Первый слайд презентации: Теории кислот и оснований. Свойства растворов электролитов. Буферные растворы
Слайд 2: Свойства растворов электролитов
Вещества, растворы и расплавы которых проводят электрический ток, называют электролитами. Свойства растворов электролитов отклоняются от законов Вант-Гоффа и Рауля и в связи с этим Вант-Гофф ввел такое понятие как изотонический коэффициент: І=1+ á ( n-1 )= Δ Т кип.эксп / Δ Т кип.теор = = Δ Т зам.эксп / Δ Т зам.теор= Р осм.эксп /Р осм.теор
Слайд 3: Теории кислот и оснований
Электролитическая теория (теория Арениуса). Протолитическая теория (Бренстеда – Лоури). Электронная теория (теория Льюиса).
Слайд 4: Электролитическая теория
Предложена шведским ученым Сванте Арениусом, который утверждал, что: при отсутствии электрического тока в растворе существует равновесие между ионами и недиссоциированными молекулами; при разбавлении растворов число молекул, которые распадаются на ионы увеличивается;
Слайд 5: Электролитическая теория
под действием электрического тока положительно заряженные ионы движутся к катоду (катионы), отрицательно заряженные – к аноду (анионы); диссоциация есть процессом обратимым. На ионы диссоциируют кислоты, основания и соли.
Слайд 6: Диссоциация кислот
Кислоты – электролиты, которые при диссоциации в водных растворах дают катионы водорода (гидроксония Н 3 О + ) и анионы кислотного остатка. Например:
Слайд 7: Диссоциация оснований
Основания – электролиты, которые при диссоциации в водных растворах образуют катион металла и анионы гидроксила. Например:
Слайд 8: Диссоциация солей
Соли – электролиты, которые при диссоциации в водных растворах дают катионы металлов, NH 4 + и анионы кислотного остатка Данная теория ограничена только кислотами и основаниями, которые содержат ионы водорода и гидроксид-анионы.
Слайд 9: Ионные уравнения реакций
Согласно с теорией электролитической диссоциации реакции в растворах электролитов проходят с участием ионов и малодиссоциированых молекул. Ионные уравнения бывают полными и сокращенными. Например для молекулярного уравнения реакции: Na 2 CO 3 +2HCl=CO 2 +2NaCl+H 2 O Полное ионное уравнение имеет вид: 2 Na + +CO 3 2- +2H + +2Cl - =CO 2 +2Na + +2Cl - +H 2 O Сокращенное ионное уравнение: CO 3 2- +2H + =CO 2 +H 2 O
Слайд 10: Протолитическая теория
Датский физико-химик Йоханнес Бренстед и английский химик Томас Лоури в 1928-1929 г. предложили протолитическую (протонную) теорию кислот и оснований, согласно которой: КИСЛОТА – это вещество (частица), способная отдавать протоны (т.е. кислоты - доноры протонов)
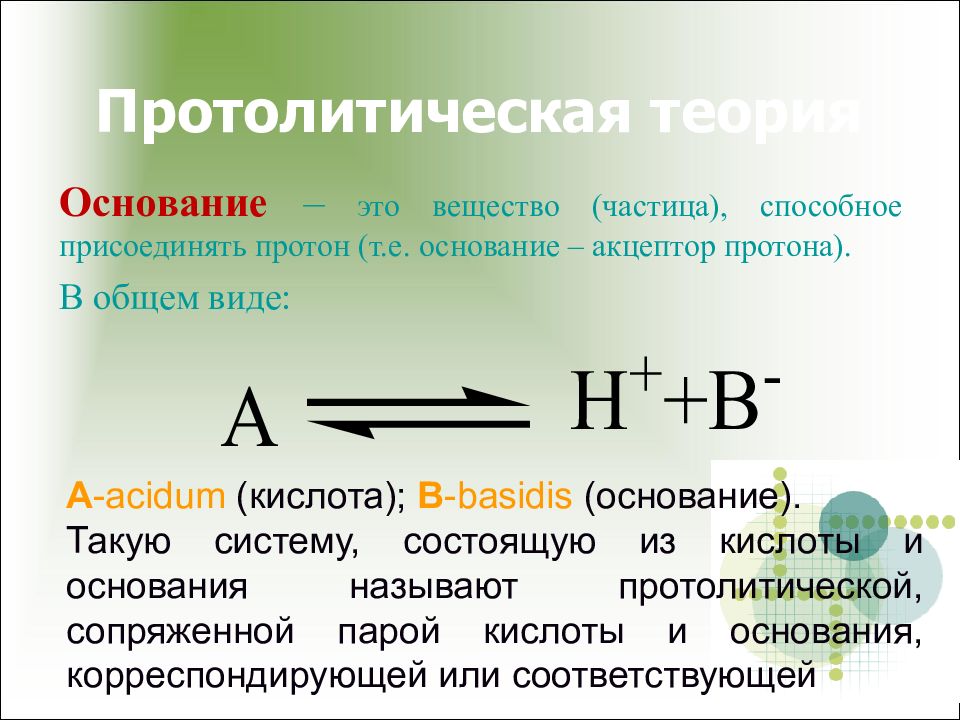
Слайд 11: Протолитическая теория
Основание – это вещество (частица), способное присоединять протон (т.е. основание – акцептор протона). В общем виде: А - acidum ( кислота ) ; B -basidis ( основание ). Такую систему, состоящую из кислоты и основания называют протолитической, сопряженной парой кислоты и основания, корреспондирующей или соответствующей
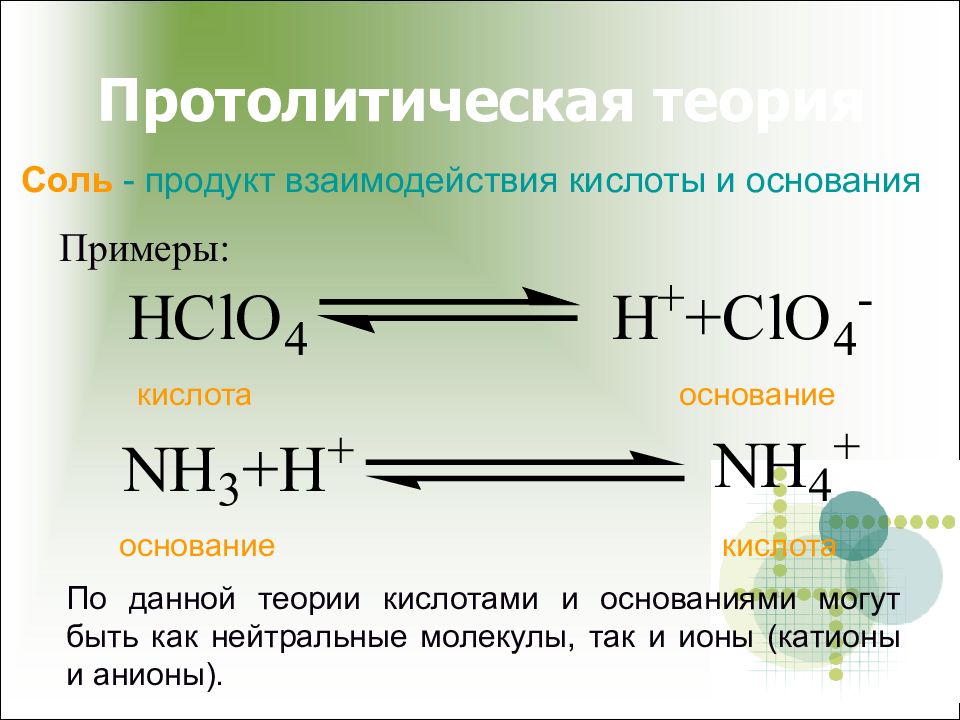
Слайд 12: Протолитическая теория
Примеры: кислота основание основание кислота По данной теории кислотами и основаниями могут быть как нейтральные молекулы, так и ионы (катионы и анионы). Соль - продукт взаимодействия кислоты и основания
Слайд 13: Электронная теория
Предложена в 1926 г. американским ученым Гилбертом Льюисом. Согласно данной теории: Кислотами называют соединения, являющиеся акцепторами электронной пары. Основаниями называют вещества, которые являются донорами электронной пары.
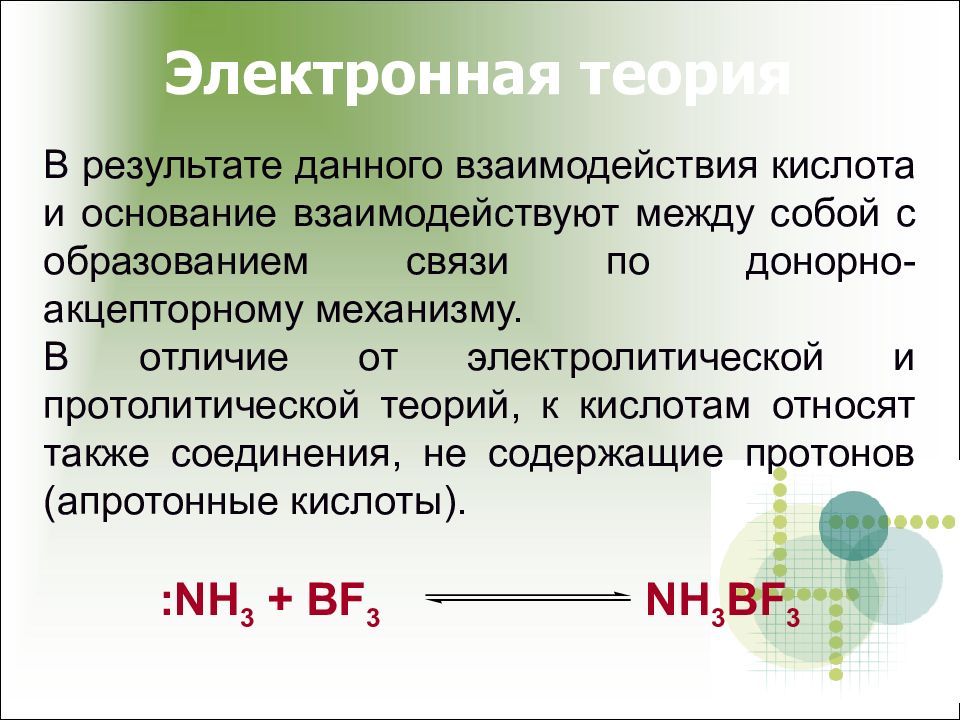
Слайд 14: Электронная теория
В результате данного взаимодействия кислота и основание взаимодействуют между собой с образованием связи по донорно-акцепторному механизму. В отличие от электролитической и протолитической теорий, к кислотам относят также соединения, не содержащие протонов (апротонные кислоты). : NH 3 + BF 3 NH 3 BF 3
Слайд 15: Степень диссоциации
Электролиты по разному диссоциируют в растворе. Количественной характеристикой распада молекул на ионы есть степень электролитической диссоциации α : n – число продисоциировавших молекул, N - общее число молекул в растворе. Величина степени диссоциации зависит от природы растворенного вещества, температуры раствора и его концентрации.
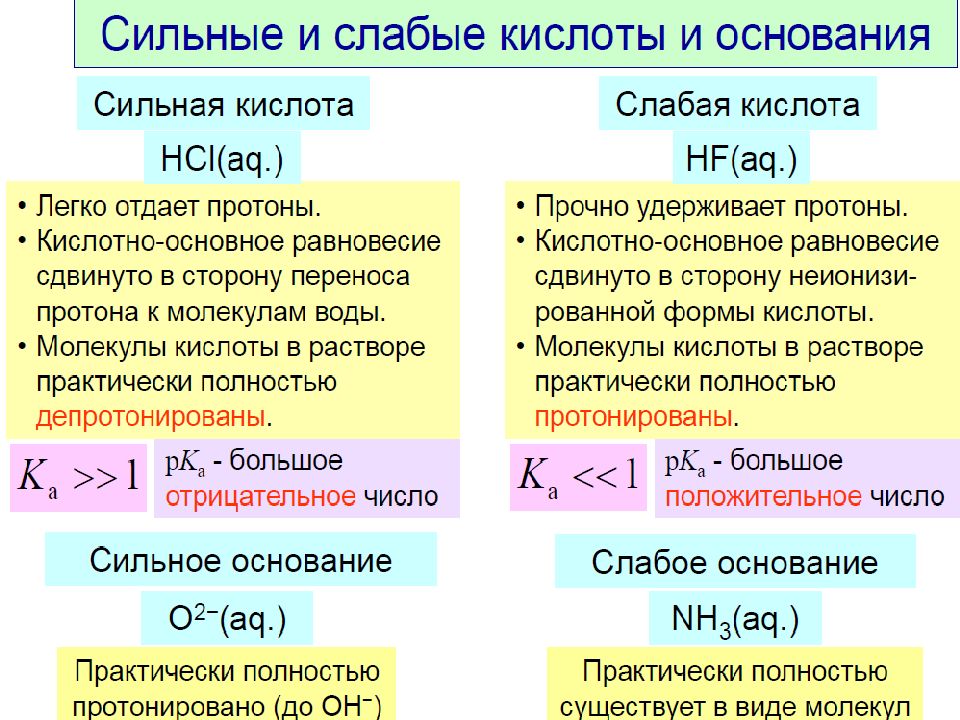
Слайд 16: Степень диссоциации
Степень диссоциации определяют экспериментально по значениям электропроводности растворов электролитов различной концентрации или по величине изотонического коэффициента В зависимости от величины степени диссоциации электролиты делят на: сильные ( α > 30% ); средней силы (30% > α > 3%); слабые ( α < 3% )
Слайд 17: Свойства растворов сильных электролитов
В растворах сильных электролитов концентрацию заменяют на активность (обозначает эффективную, условную концентрацию, согласно с которой ионы взаимодействуют в химических реакциях): Отношение активности ионов к концентрации называют коэффициентом активности ( f ). В очень разбавленных растворах f=1
Слайд 18: Коэффициент активности. Ионная сила раствора
Коэффициент активности ионов есть функцией не только концентрации ионов. Он также зависит от природы веществ и от природы электролита: Где, z - заряд иона, µ -ионная сила раствора
Слайд 19: Равновесие в растворах слабых электролитов
Для уравнения диссоциации слабого электролита КА: К 2 А 2К + +А - Выражение для константы диссоциации имеет вид: где [K + ], [A - ] равновесные концентрации катиона и аниона в растворе, [K 2 A] – равновесная концентрация недиссоциированых молекул. Кд выражается в молях/л.
Слайд 20: Закон разбавления Оствальда:
Т.к. в растворах слабых электролитов степень диссоциации очень малая величина, то 1-а=1, тогда Кд -константа диссоциации, а-степень диссоциации, См -молярная концентрация раствора. Очень часто вместо констант диссоциации пользуются их десятичными логарифмами:
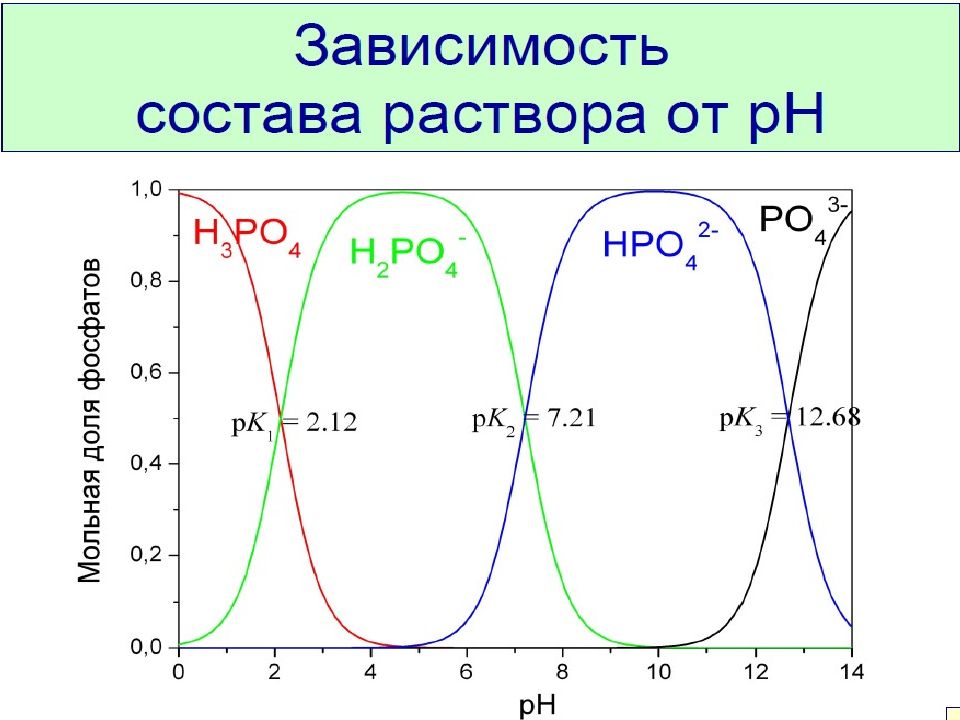
Слайд 21: Константы кислотности и основности
Константы диссоциации кислот и оснований называют соответственно константами кислотности (К А ) и основности (К В ). Произведение константы кислотности и константы основности, сопряженного с этой кислотой основания равно ионному произведению воды:
Слайд 24: Диссоциация воды. Ионное произведение воды
Экспериментально установлено, что вода проводит электрический ток: Н 2 О=Н + +ОН -, или 2Н 2 О=Н 3 О + +ОН - Кд(Н 2 О)=1,8*10 -16, [ Н 2 О ] =55,56 моль/л ; В чистой воде [H + ] = [OH - ]. При 22 о С [H + ] = [OH - ] =10 -7 моль/л
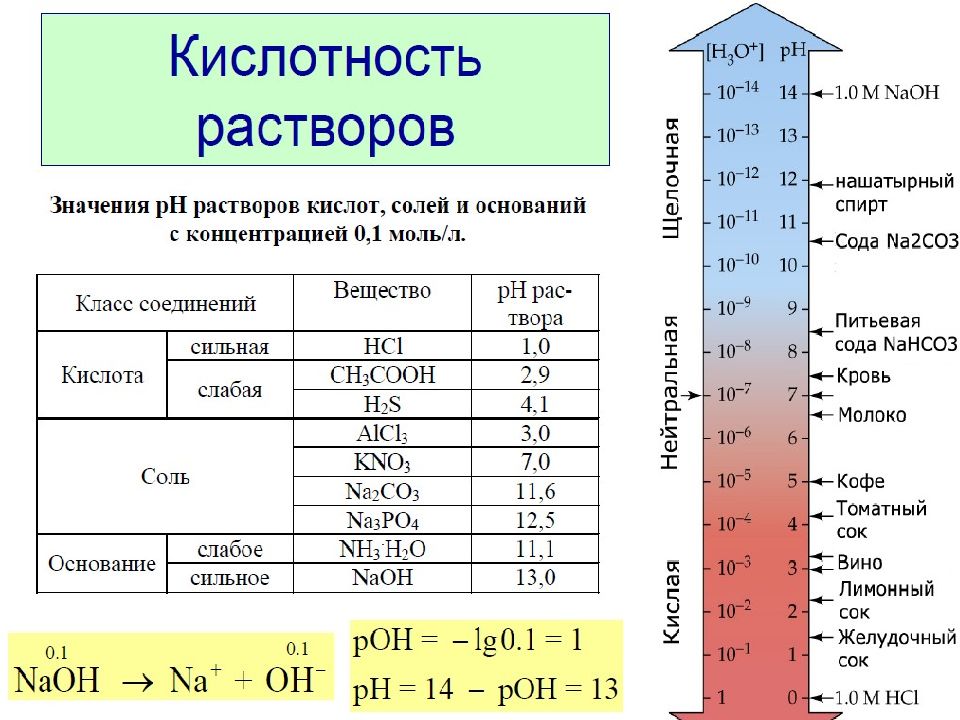
Слайд 25: Водородный показатель
Водородным показателем рН называют отрицательный десятичный логарифм концентрации ионов водорода: рН=- lg[H + ] или [H + ] =10 -рН рН+рОН=14
Слайд 28
Буферным называют раствор, содержащий смесь какой-либо слабой кислоты и ее растворимой соли. Являясь компонентами буферных систем организма, ионы определяют их свойства – способность поддерживать рН на постоянном уровне Буферные системы организма: фосфатная, состоящая из HPO 4 2- и H 2 PO 4-, поддерживает рН внутриклеточной жидкости в пределах 6,9 – 7,0. бикарбонатная буферная система, состоящая из H 2 CO 3 и HCO 3 -, поддерживающая рН на уровне 7,4.
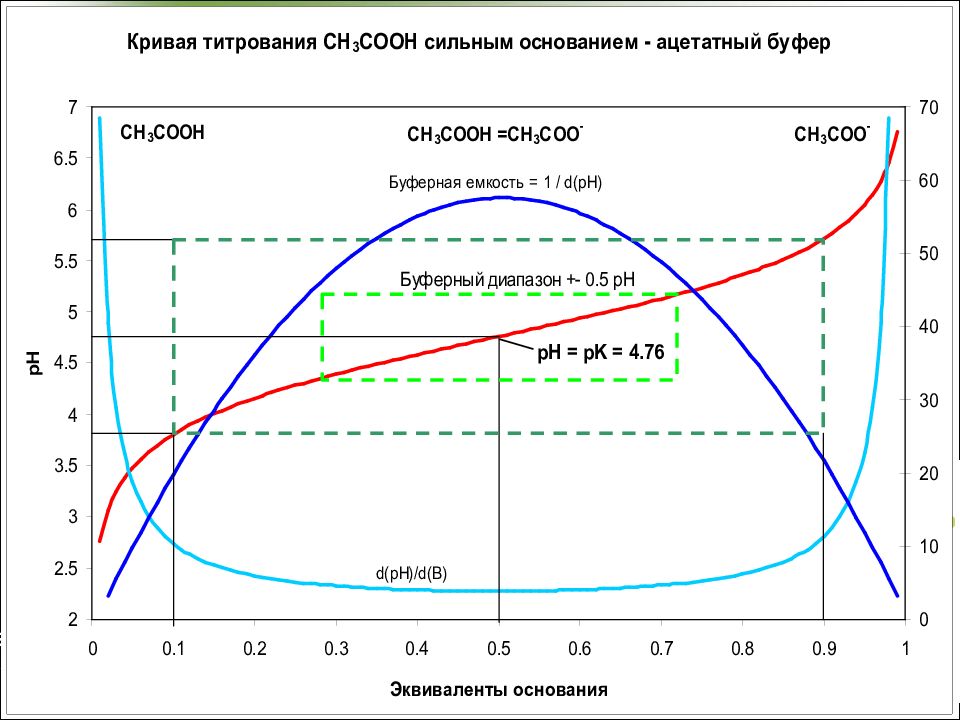
Слайд 30: Ацетатный буферный раствор (рН 3,7-5,6)
СН 3 СОО Na → СН 3 СОО - + Na + СН 3 СОО H ↔ СН 3 СОО - + H + Константа диссоциации К а = [ СН 3 СОО - ] [H + ]/[ СН 3 СОО H ] Отсюда [H + ] = К а [ СН 3 СОО H ] / [ СН 3 СОО - ] Или [H + ] = К а [ кислота ] / [ основание ] В логарифмическом виде рН = рК а – lg [ кислота ] / [ основание ] рН = рК а + lg [ основание ] / [ кислота ]
Слайд 31: Уравнение Гендерсона - Гассельбаха
рН = рК а – lg [ кислота ] [ основание ] рН = рК а + lg [ основание ] [ кислота ] Используют для расчета рН различных буферных растворов
Слайд 32: Механизм буферного действия ацетатного буфера
СН 3 СОО Na → СН 3 СОО - + Na + (полностью диссоциирует) СН 3 СОО H ↔ СН 3 СОО - + H + (частично диссоциирует) В растворе присутствуют ионы СН 3 СОО -, H +, Na + Если прибавить сильную кислоту: СН 3 СОО - + H + ↔ СН 3 СОО H (сильная кислота меняется на слабую) Если прибавить щелочь: СН 3 СОО H +ОН - → СН 3 СОО - + Н 2 О (образуется малодиссоциированая молекула воды)
Слайд 33
Буферная емкость определяется количеством эквивалентов сильной кислоты или основания, которые необходимо добавить к 1 л буферного раствора, чтобы изменить его pH на единицу.
Слайд 34: Аммиачный буфер (диапазон рН 8,4-10,3)
NH 4 OH ↔ NH 4 + + OH - NH 4 Cl → NH 4 + + Cl - Уравнение Гендерсона Гассельбаха для этого буфера рН = 14 - рК в + lg [ основание ] [ кислота ]
Слайд 35: Механизм действия аммиачного буфера
В растворе существует NH 3 и NH 4 + NH 3 +НОН ↔ NH 4 + + ОН - При добавлении кислоты: NH 3 + HCl ↔ NH 4 Cl При добавлении щелочи: NH 4 + + ОН - ↔ NH 4 OH
Слайд 36: Влияние разведения на рН буферных растворов
Из уравнения Гендерсона Гассельбаха видно, что при разведении растворов концентрации двух компонентов уменьшаются одинаково и поэтому их соотношение остается постоянным. [H + ] = К а [ кислота ] = К а 0.1 = К а 0.001 [ основание ] 0.1 0.001
Слайд 37: Буферная емкость
Буферная емкость (В) - это число молей эквивалента сильной кислоты или щелочи, которое необходимо добавить к 1 л буферного раствора, чтобы сместить его рН на единицу Вкисл= Восн= В кисл. =
Слайд 38: Буферная емкость
Буферная емкость максимальна при соотношении кислоты и соли 1:1 = > pH = pK. Хорошая – при [pK+0.5, pK-0.5] Достаточная – при [pK+ 1, pK- 1 ] Чем выше концентрация раствора, тем больше его буферная емкость. Концентрация кислоты и соли в буферных растворах обычно бывает порядка 0,05—0,20 М.
Слайд 41
Механизм действия фосфатного буфера : 1. при добавлении кислоты 2 Na + +HPO 4 2– +H + +Cl - NaH 2 PO 4 +Na + +Cl - 2. при добавлении щелочи : NaH 2 PO 4 + NaOH Na 2 HPO 4 + H 2 O Избыток однозамещённого и двузамещённого фосфата удаляется через почки. Полное восстановление отношения в буфере происходит только через 2—3 сут.
Слайд 42
Относительный вклад % буферных систем крови в поддержание в ней протолитического гомеостаза Буферные системы плазмы крови Гидрокарбонатная 35 % Белковая 7 % Гидрофосфатная 1 % ВСЕГО 43% Буферные системы эритроцитов Гемоглобиновая 35 % Гидрокарбонатная 18 % Гидрофосфатная 4 %
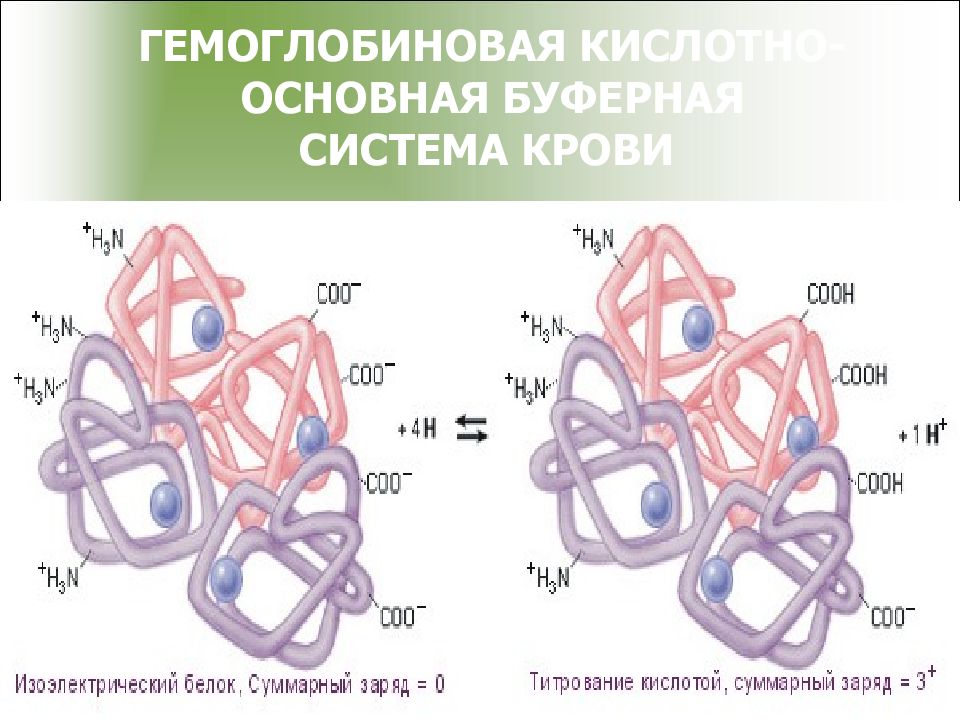
Слайд 43
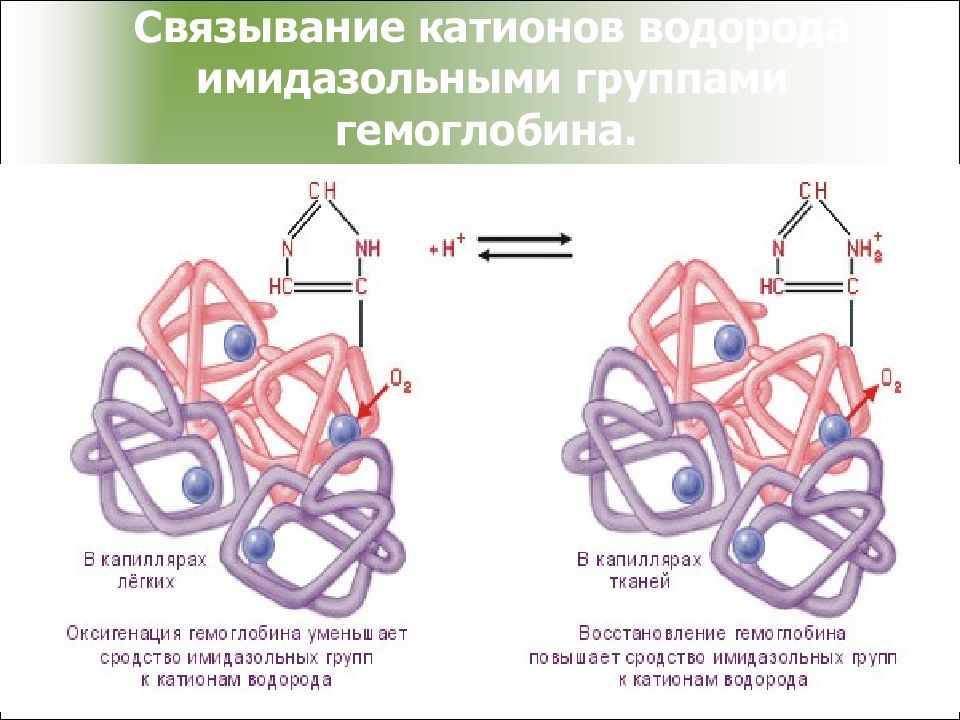
ГЕМОГЛОБИНОВЫЙ БУФЕР : где HHb — дезоксигемоглобин ; HHbO 2 — оксигемоглобин ; KHb — калиевая соль дезоксигемоглобина; KHbO 2 — калиевая соль оксигемоглобина
Слайд 44
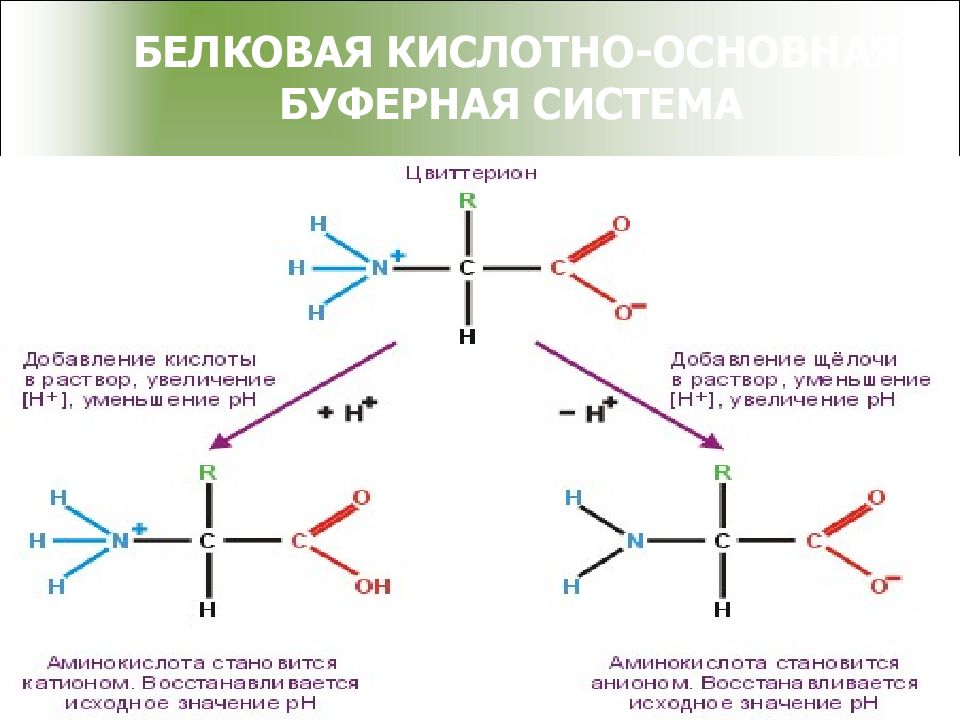
Механизм действия гемоглобинового буфера 1. Гемоглобин является белком, он амфотерен COO - COOH Pt + H + + Cl - Pt NH 3 + NH 3 +Cl COO - COONa Pt + Na + + OH - Pt NH 3 + NH 3 + OH 2. буферная система, состоящая из оксигемоглобина и калиевой соли гемоглобина, участвует в выделении углекислоты из организма, понижая рН По силе HHbO 2 > H 2 CO 3 > HHb
Слайд 48
В тканях и лёгких протекают следующие процессы: 1. В тканях : KHb + H 2 CO 3 HHb + KHCO 3 Происходит вытеснение HHb из его соли. 2. В лёгких : HHb + O 2 HHbO 2 карбоангидраза 3. В лёгких : HHbO 2 + KHCO 3 H 2 CO 3 + KHbO 2 H 2 CO 3 H 2 O + CO 2 Происходит вытеснение более слабой угольной кислоты из её соли. 4. В тканях: KHbO 2 KHb + O 2
Слайд 49
Кислотно-основное состояние организма и его нарушения Ацидоз - это уменьшение кислотной буферной емкости физиологической системы по сравнению с нормой. Алкалоз - это увеличение кислотной буферной емкости физиологической системы по сравнению с нормой . Экзогенный ацидоз возникает при употреблении пищи с избыточным содержанием кислот (лимонной, бензойной, уксусной), а также лекарственных средств, трансформация которых в организме способствует понижению рН среды. Эндогенный ацидоз или алкалоз возникает при нарушении протолитического баланса в организме вследствие нарушения соотношений скоростей синтеза и выведения тех или иных кислот или оснований
Последний слайд презентации: Теории кислот и оснований. Свойства растворов электролитов. Буферные растворы: Требования к буферным растворам
Обладать достаточной буферной емкостью в требуемом диапазоне значений рН. Обладать высокой степенью чистоты. Хорошо растворяться в воде и не проникать через биологические мембраны. Обладать устойчивостью к действию ферментов и гидролизу. рН буферных растворов должен как можно меньше зависеть от их концентрации, температуры и ионного или солевого состава среды. Не оказывать токсического или ингибирующего действия. Не поглощать свет в видимой или ультрафиолетовой областях спектра.