Первый слайд презентации: Termokimyo
1 Termokimyo Entalpiya Issiqlik sig’imi Kerxgoff qoidasi Gess qonuni
Слайд 2: Termokimyo
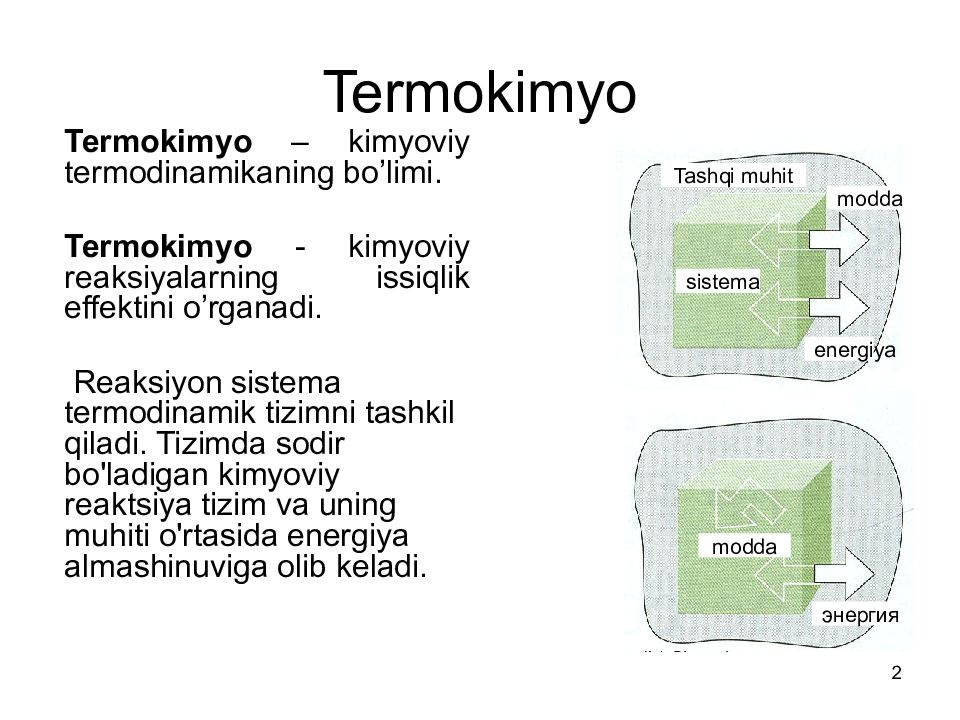
2 Termokimyo Termokimyo – kimyoviy termodinamikaning bo’limi. Termokimyo - kimyoviy reaksiyalarning issiqlik effektini o’rganadi. Reaksiy on sistema termodinamik tizimni tashkil qiladi. Tizimda sodir bo'ladigan kimyoviy reaktsiya tizim va uning muhiti o'rtasida energiya almashinuviga olib keladi. sistema modda Tashqi muhit energiya modda энергия
Слайд 3: Jarayon turlari
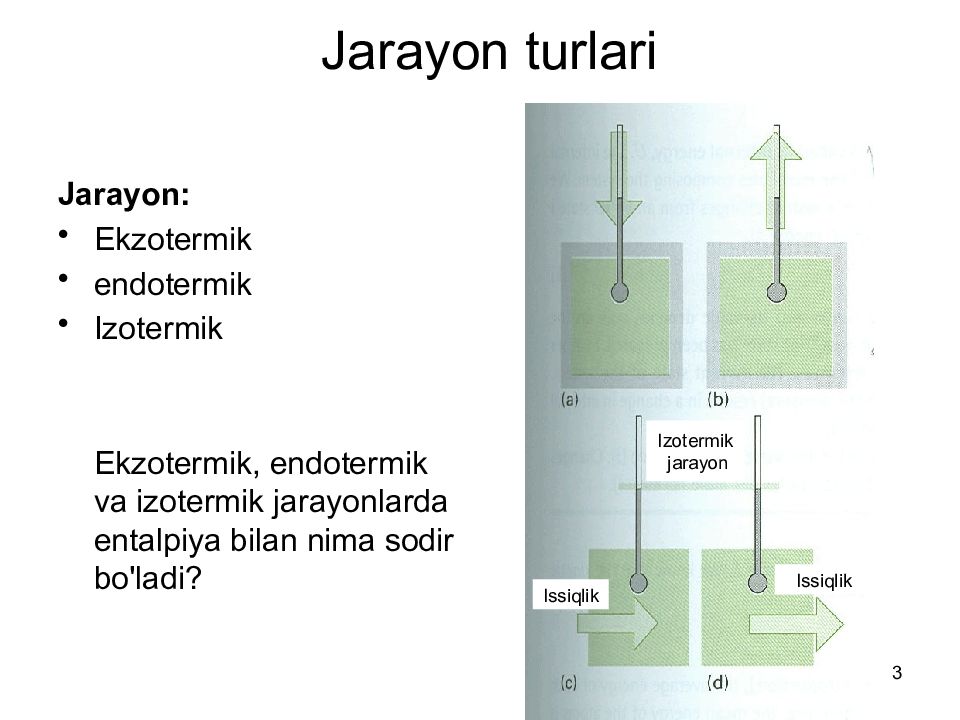
3 Jarayon turlari Jarayon: Ekzotermik endotermik Izotermik Ekzotermik, endotermik va izotermik jarayonlarda entalpiya bilan nima sodir bo'ladi? Izotermik jarayon Issiqlik Issiqlik
Слайд 4: Ekzotermik va endotermik jarayonlarda entalpiya o'zgarishi
4 Ekzotermik va endotermik jarayonlarda entalpiya o'zgarishi Reaksion sistemadan i ssiqlikning ajralib chiqishi sistema entalpiyasining kamayeshiga olib keladi (P = const). ekzotermik jarayon uchun: Δ H < 0. Reaksion sitemaga i ssiqlik yutilishi sistema entalpiyasining o rtishiga olib keladi (P = const da). Shuning uchun endotermik jarayon uchun : Δ H > 0.
Слайд 5: Kimyoviy reaksiya issiqligini o'lchash
5 Kimyoviy reaksiya issiqligini o'lchash H = U + PV Agar reaksiya uchun d U yoki d H ma'lum bo'lsa, u holda reaksiyada qancha issiqlik ajralib chiqishi yoki yutilganligini taxmin qilish mumkin. Kalorimetriya - b u kimyoviy reaktsiya paytida so'rilgan yoki chiqarilgan issiqlikni o'lchash uchun ishlatiladigan usul. Doimiy hajmda issiqlik miqdori ichki energiyaning o'zgarishiga teng bo'ladi. U = Qv (V=const) Doimiy bosimda issiqlik miqdori entalpiya o'zgarishiga teng bo'ladi H = Q P (P=const)
Слайд 6: Standart entalpiya va standart holat
6 Standart entalpiya va standart holat Standart entalpiya o'zgarishi, d H ° - bu boshlang'ich moddalar va mahsulotlar standart holatda bo'lgan jarayon uchun entalpiya o'zgarishi. Moddaning ma'lum bir haroratdagi standart holati uning standart bosimdagi holatidir. ( 1 atm, yoki 1.01325. 105 P a). Примеры : suyuq etanolning standart holati 298 K va 1 atm da suyuq etanol; Qattiq temirning standart holati 500 K va 1 atmdagi temirdir.
Слайд 7: Fizik o'zgarishla rning entalpiyasi
7 Fizik o'zgarishla rning entalpiyasi Δ f H ° modda hosil bo'lishining standart entalpiyasi - elementlardan moddaning hosil bo'lishining kimyoviy reaktsiyasining standart entalpiyasi. Δ c H ° moddaning standart yonish entalpiyasi organik moddalarning CO 2 va H 2 O ga to'liq oksidlanishining standart entalpiyasidir.
Слайд 8: Fizik jarayonlar entalpiyasi
8 Fizik jarayonlar entalpiyasi Bug’lanishning standart entalpiyasi, Δ bug’ H °, 1 atm haroratda 1 mol sof suyuqlik bug‘langanda entalpiyaning o‘zgarishi masalan : H 2 O(c) → H 2 O(g) + Δ bug’ H ° Δ bug’ H °(373 K) = +40.66 kJ / mol Erishning standart entalpiyasi Δ e H °, Bu 1 mol qattiq moddani suyuqlikka aylanganda entalpiya o'zgarishi. Пример : H 2 O(muz) → H 2 O(c) + Δ H ° Δ H °(273 K) = +6.01 kJ/mol
Слайд 9: Sublimatsiya lanishning standart entalpiyasi
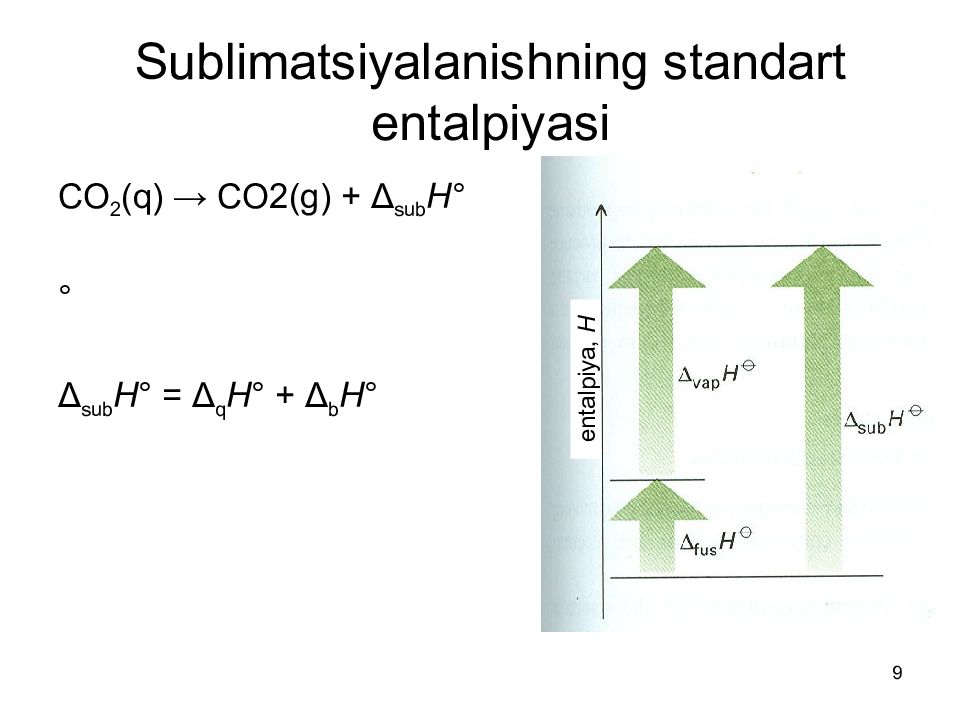
9 Sublimatsiya lanishning standart entalpiyasi CO 2 (q) → CO2(g) + Δ sub H ° ° Δ sub H ° = Δ q H ° + Δ b H ° entalpiya, Н
Слайд 10: To’gri va teskari jarayonning entalpiyasi
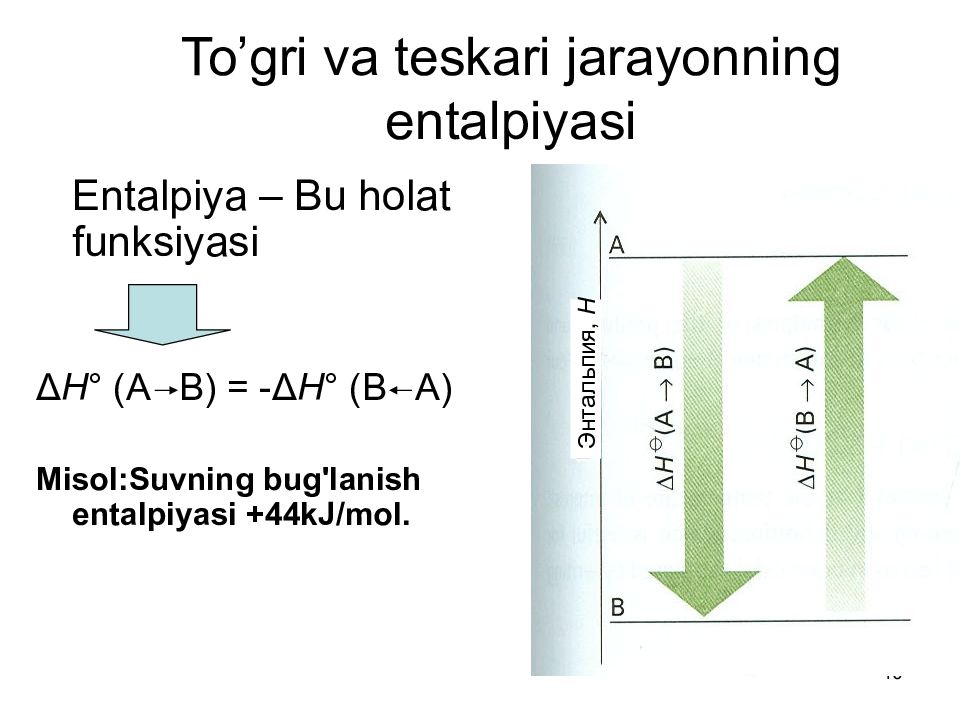
10 To’gri va teskari jarayonning entalpiyasi Entalpiya – Bu holat funksiyasi Δ H ° (A B) = -Δ H ° (B A) Misol:Suvning bug'lanish entalpiyasi +44kJ/mol. Энтальпия, Н
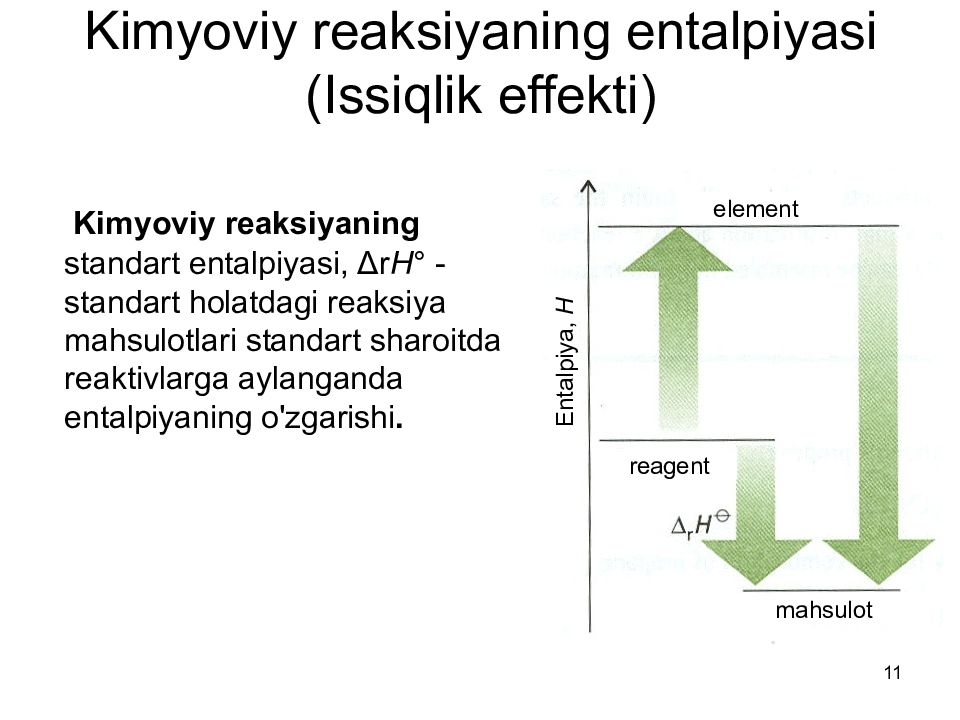
Слайд 11: Kimyoviy reaksiyaning entalpiyasi (Issiqlik effekti)
11 Kimyoviy reaksiyaning entalpiyasi (Issiqlik effekti) Kimyoviy reaksiyaning standart entalpiyasi, Δr H ° - standart holatdagi reaksiya mahsulotlari standart sharoitda reaktivlarga aylanganda entalpiyaning o'zgarishi. Entalpiya, Н reagent mahsulot element
Слайд 12: Kimyoviy reaksiyaning entalpiyasi
12 Kimyoviy reaksiyaning entalpiyasi Moddalar hosil bo'lishining standart entalpiyalaridan foydalangan holda kimyoviy reaksiya entalpiyasini hisoblash: masalan : CH 4 (g) + 2O 2 (g) → CO 2 (g) + 2H 2 O(s) + Δr H ° Δ r H = – 890 kJ/mol maxsulot reagent
Слайд 13: Kimyoviy reaksiyaning entalpiyasi
13 Kimyoviy reaksiyaning entalpiyasi Moddalarning yonishning standart entalpiyalari yordamida kimyoviy reaksiya entalpiyasini hisoblash: masalan : C 6 H 12 O 6 (q) + 6O 2 (g) = 6CO 2 ( g ) + 6H 2 O(s) Δ r H = -2808 kJ/mol mahsulot reagent
Слайд 14: Gess qonuni
14 Gess qonuni Kimyoviy reaksiyaning agar boshqa reaksiyalarning entalpiyalari ma'lum bo'lsa, aniqlanishi mumkin, ulardan umumiy reaktsiyani olish mumkin.. Gess qonuni: Reaksiyaning standart entalpiyasini berilgan reaksiyani olish mumkin bo‘lgan reaksiyalarning standart entalpiyalarining yig‘indisi sifatida aniqlash mumkin. Gess qonunining termodinamik asosi reaksiya entalpiyasini olish yo'lining mustaqilligidir..
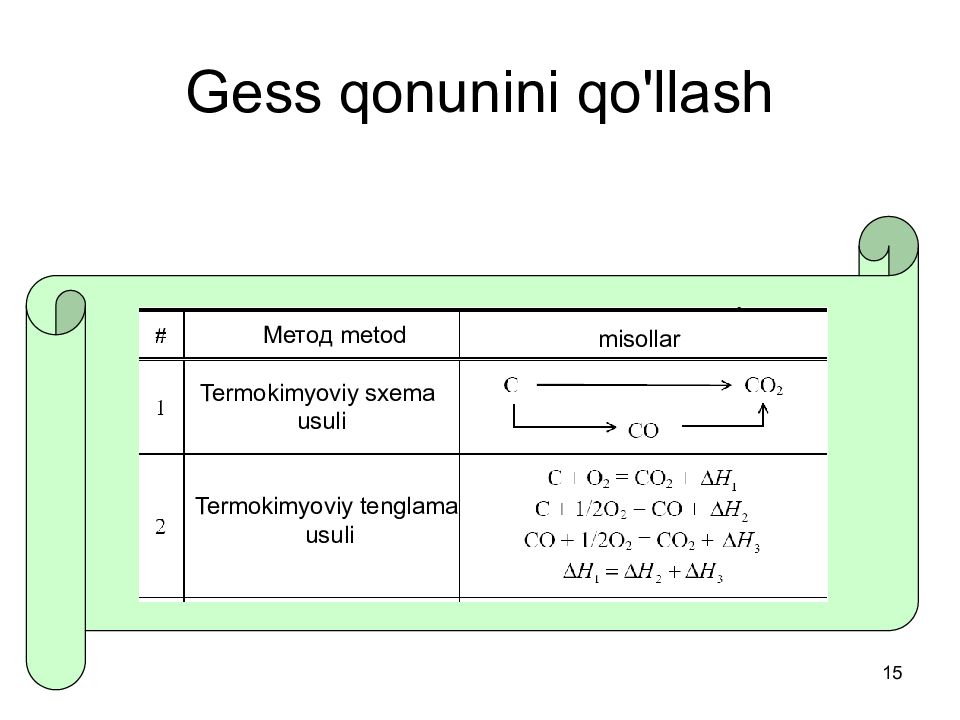
Слайд 15: Gess qonunini qo'llash
15 Gess qonunini qo'llash Termokimyoviy tenglama usuli Termokimyoviy sxema usuli Метод metod misollar
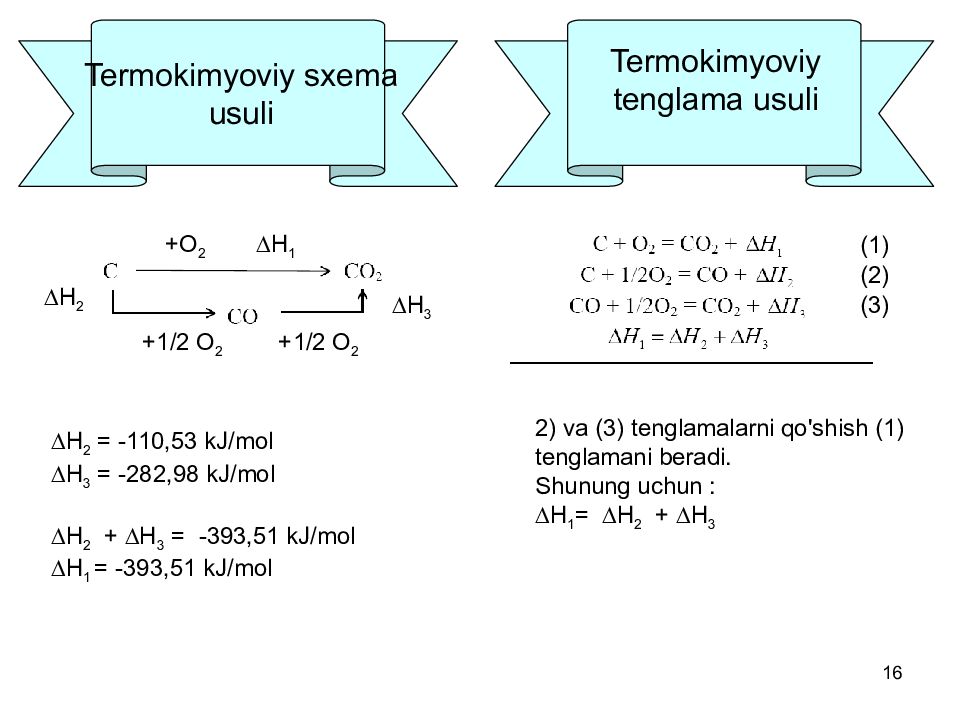
Слайд 16: Termokimyoviy sxema usuli
16 Termokimyoviy sxema usuli Н 1 Н 2 Н 3 +О 2 +1/2 О 2 +1/2 О 2 Н 2 = -110,53 kJ/mol Н 3 = -282,98 kJ/mol Н 2 + Н 3 = -393,51 kJ/mol Н 1 = -393,51 kJ/mol Termokimyoviy tenglama usuli 2) va (3) tenglamalarni qo'shish (1) tenglamani beradi. Shunung uchun : Н 1 = Н 2 + Н 3 (1) (2) (3)
Слайд 17: d U va d H aniqlash
17 d U va d H aniqlash Doimiy hajmdagi issiqlik sig'imi harorat o'zgarishi bilan ichki energiyaning o'zgarishini hisoblash uchun ishlatiladi : d U = C V d T Doimiy bosimdagi issiqlik sig'imi doimiy bosimdagi harorat o'zgarishi bilan entalpiya o'zgarishini hisoblash uchun ishlatiladi : d H = Cp d T
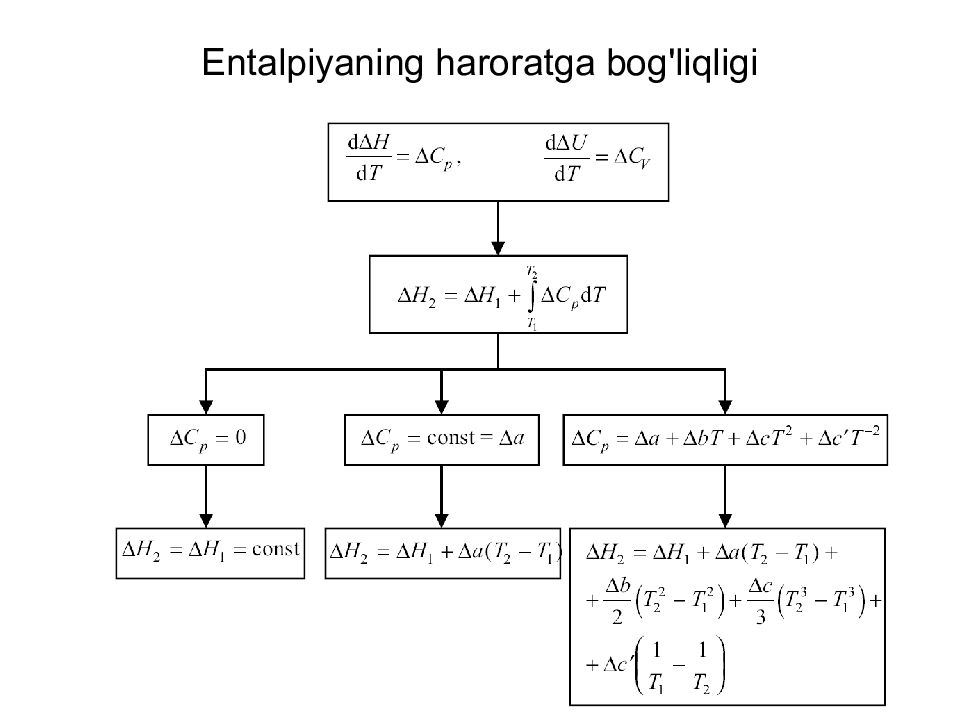
Слайд 18: Entalpiyaning haroratga bog'liqligi
18 Entalpiyaning haroratga bog'liqligi
Слайд 19: Entalpiyaning haroratga bog'liqligi
19 Entalpiyaning haroratga bog'liqligi
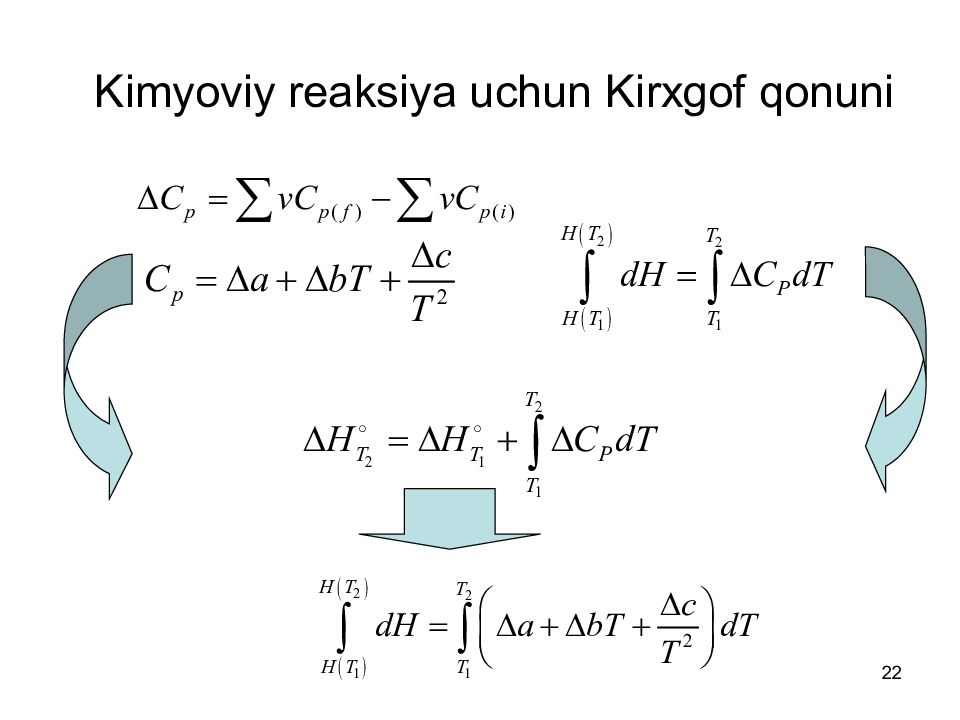
Слайд 20: Kimyoviy reaksiya uchun Kirxgof qonuni
20 Kimyoviy reaksiya uchun Kirxgof qonuni Kimyoviy reaksiya entalpiyasining haroratga bog'liqligi Kirxgof qonuni bilan ifodalanadi. Kimyoviy reaktsiya uchun : Bu ifoda reaksiyadagi har bir moddaga tegishli: продукты реагенты Энтальпия, Н Температура
Слайд 21
21 Kimyoviy reaksiyaning ichki energiyasining haroratga bog‘liqligi uchun Kirxgof tenglamasini yozish mumkin Kimyoviy reaksiya uchun: продукты реагенты Внутренняя энергия, U Температура U U
Слайд 22: Kimyoviy reaksiya uchun Kirxgof qonuni
22 Kimyoviy reaksiya uchun Kirxgof qonuni
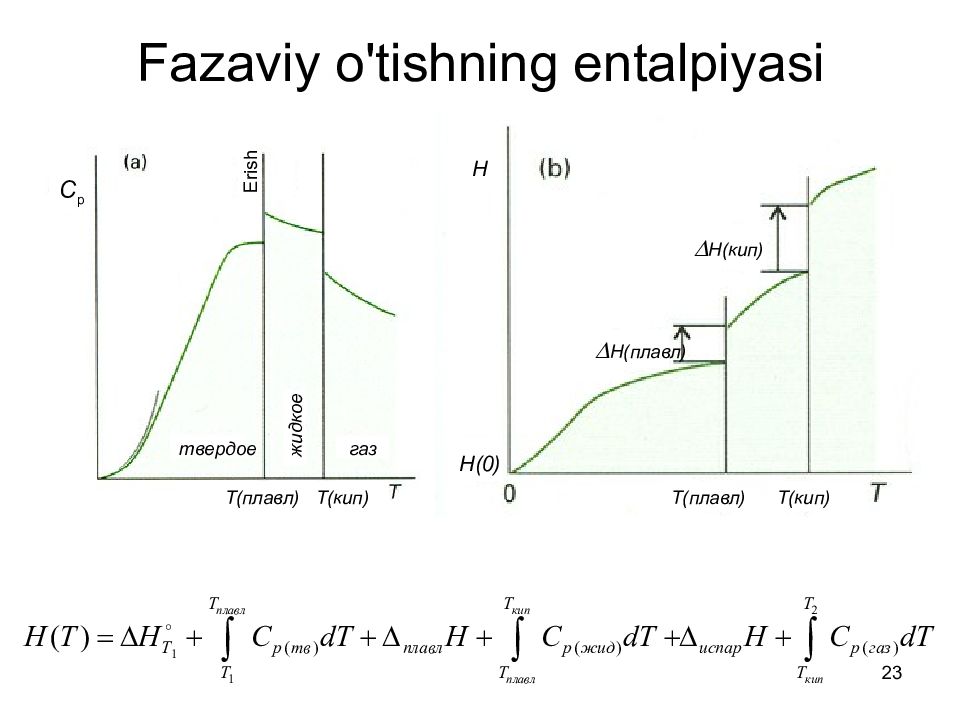
Слайд 23: Faza viy o'tishning entalpiyasi
23 Faza viy o'tishning entalpiyasi C p Erish твердое жидкое газ Т(плавл) Т(кип) Т(плавл) Т(кип) Н(плавл) Н(кип) Н Н(0)
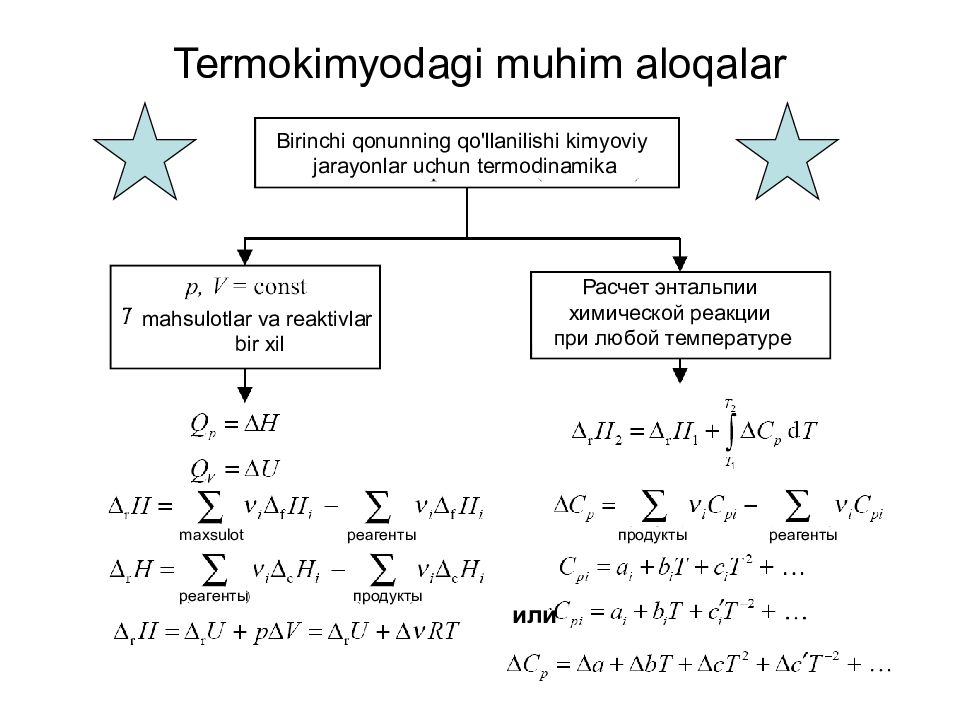
Слайд 24: Termokimyodagi muhim aloqalar
24 Termokimyodagi muhim aloqalar Birinchi qonunning qo'llanilishi kimyoviy jarayonlar uchun termodinamika mahsulotlar va reaktivlar bir xil Расчет энтальпии химической реакции при любой температуре реагенты реагенты maxsulot продукты продукты или реагенты
Слайд 25: Энтальпия образования ионов в растворе
25 Энтальпия образования ионов в растворе Тепловой эффект образования химического соединения в растворе, диссоциирующего на ионы, определяется по энтальпиям образования ионов в растворе. Пример: Теплота образования иона SO 4 2- равна энтальпии реакции: S( тв ) + 2O 2 ( г ) + H 2 O (ж) + 2e = SO 4 2- (aq) Теплота образования вещества в растворе равна сумме теплоты образования и теплоты растворения.
Слайд 26: Теплота растворения
26 Теплота растворения Теплота растворения зависит от концентрации химического соединения в растворе. Теплота, которая поглощается или выделяется при образовании раствора определенной концентрации (моляльности) – интегральная теплота растворения. Теплота растворения зависит от: Теплоты разрушения кристаллической решетки Теплоты сольватации
Слайд 27: Моляльность
27 Моляльность Моляльность – способ выражения концентрации раствора. Моляльность показывает количество молей растворенного вещества в 1000 г растворителя.
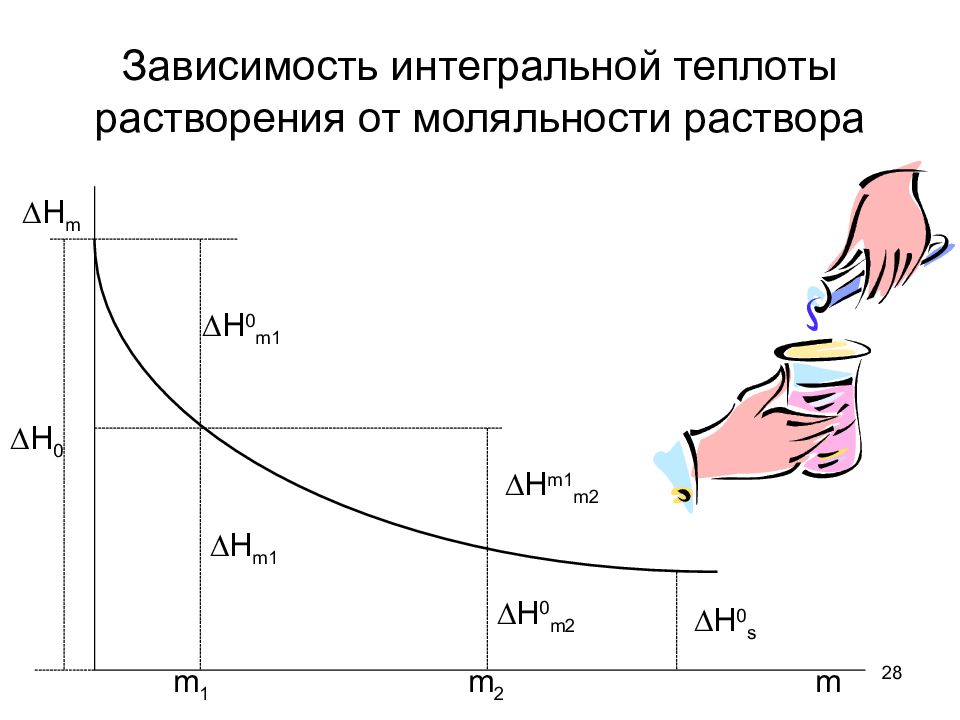
Слайд 28: Зависимость интегральной теплоты растворения от моляльности раствора
28 Зависимость интегральной теплоты растворения от моляльности раствора Н 0 Н m Н 0 m1 Н m1 Н m1 m2 Н 0 m2 Н 0 s m 1 m 2 m
Слайд 29: Интегральная теплота растворения
29 Интегральная теплота растворения ∆Н 0 – первая интегральная теплота растворения. Это тепловой эффект при растворении 1 моль вещества в бесконечно большом объеме растворителя. ∆Н s – полная интегральная теплота растворения. Это теплота растворения 1 моль вещества в таком объеме растворителя, чтобы образовался насыщенный раствор.
Слайд 30: Тепловой эффект при разведении раствора
30 Тепловой эффект при разведении раствора Прибавление воды к раствору сопровождается теплотой разведения. Интегральная теплота разведения – это тепловой эффект при разбавлении раствора, который содержит 1 моль вещества, до бесконечного разведения.
Слайд 31: Промежуточная теплота разведения
31 Промежуточная теплота разведения Промежуточная теплота разведения – это тепловой эффект разбавления раствора, содержащего 1 моль вещества от концентрации m 2 до меньшей концентрации m 1.