Слайд 2
Роль воды: В технологических процессах : растворитель твердых, жидких и газообразных веществ; среда для осуществления физических и механических процессов (флотация, транспортировка твердых материалов в виде пульпы и др.); промывная жидкость для газов; экстрагент и абсорбент различных веществ. В энергетических потоках: Теплоноситель (в виде горячей воды и пара) Хладоагент для охлаждения аппаратуры. В материальных потоках: Сырьё и реагент для производства различной химической продукции (например, водорода, ацетилена, серной и азотной кислот и др.)
Слайд 3
Схемы водооборота (в зависимости от изменений, которые претерпевает вода в процессе производства): Вода только нагревается и должна быть перед возвратом охлаждена в градирнях или бассейнах; Вода только загрязняется и должна быть перед возвратом очищена в специальных очистных сооружениях; Вода нагревается и загрязняется. Масштабы потребления воды химической промышленностью зависят от типа производства и колеблются в широких пределах. Расходные коэффициенты по воде (в м 3 на тонну продукции) составляют: для азотной кислоты 200, вискозного волокна 1200, аммиака 1500, синтетического каучука 1600, капронового волокна 2500. Источники воды Общее количество воды на Земле составляет 1,4·10 18 тонн Общие запасы пресной воды (ледники, озёра, реки…) - 2,5-3% Доступные запасы пресной воды 0,2-0,4%
Слайд 4
Классификация вод По происхождению : Атмосферные Поверхностные, в т.ч. морские Подземные По степени минерализации : Пресные < 1 г/л Солоноватые 1-3 г/л Засоленые 3-10 г/л Солёные > 10 г/л По рН : Щелочные > 11 Слабощелочные 8-10 Нейтральные 7 Слабокислые 4-6 Кислые < 4 По жёсткости : Очень мягкие < 1,5 Мягкие 1,5-3 Умеренно жёсткие 3-6 Жёсткие 6-9 Очень жёсткие >9
Слайд 5: Основные примеси
Газы ( O 2, CO 2, H 2 S ) – коррозионная активность Взвешенные вещества – невозможность питьевого и энергетического применения Органика – влияет на органолептические свойства Ионные примеси (карбонатные/гидрокарбонатные, хлоридные, сульфатные) – невозможность питьевого, технологического и энергетического применения Биологические загрязнения (гидробионты, гидрофлора, бактерии, вирусы) – невозможность питьевого, технологического и энергетического применения
Слайд 6
Показатели качества Физические Химические Бактериологические Биологические Требования к качеству определяются целью использования. Вода бывает : хозяйственно-питьевая для охлаждения для паро-силового оборудования технологическая сельско-хозяйственного назначения
Слайд 7
Методы очистки воды Выбор метода определяется требованиями к качеству и группами примесей Группы примесей: 1. Взвешенные вещества и бактерии 2. Гидрофильные/гидрофобные коллоиды, ВМС, ПАВ 3. Молекулярные растворы 4. Электролиты
Слайд 8
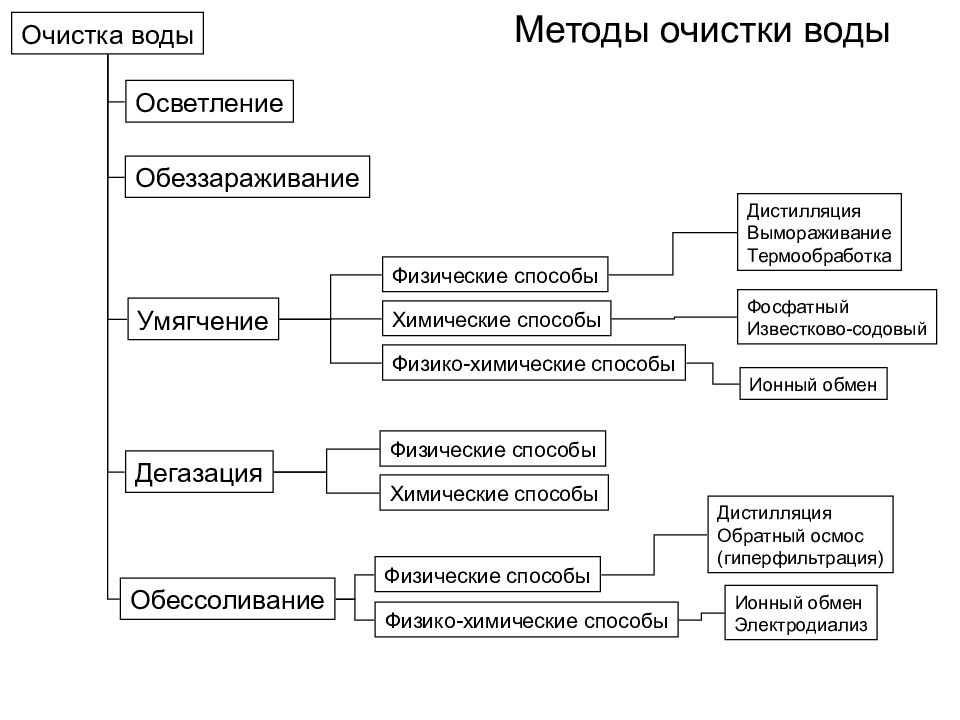
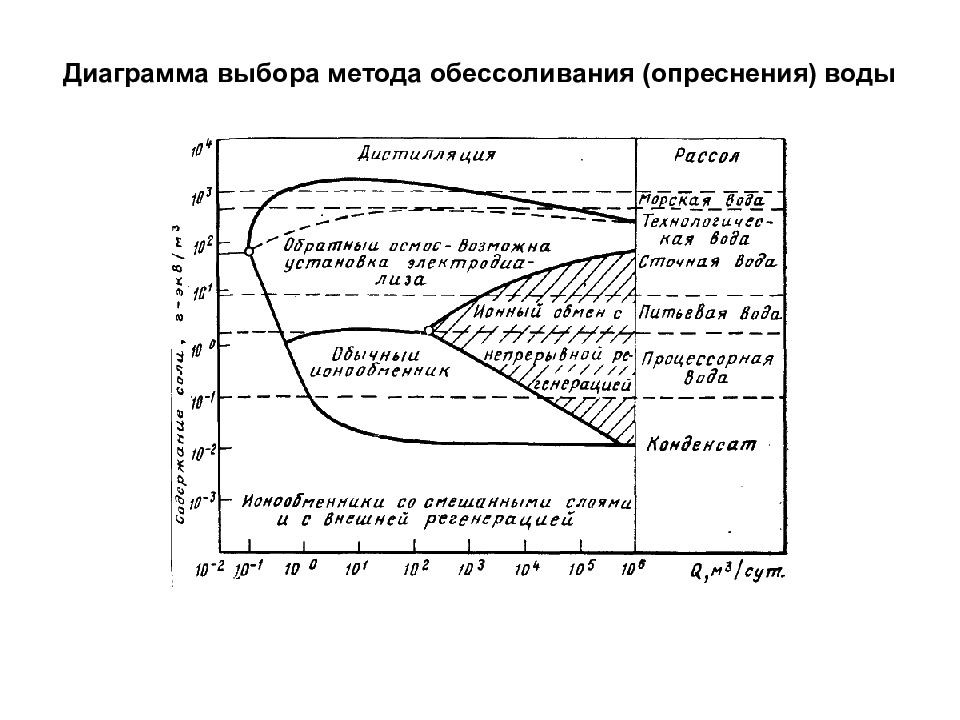
Очистка воды Осветление Обеззараживание Умягчение Дегазация Обессоливание Физические способы Химические способы Физико-химические способы Дистилляция Вымораживание Термообработка Фосфатный Известково-содовый Ионный обмен Физические способы Физико-химические способы Физические способы Химические способы Дистилляция Обратный осмос (гиперфильтрация) Ионный обмен Электродиализ Методы очистки воды
Слайд 10
Фосфатный метод : 3CaSO 4 + 2Na 3 PO 4 = 3Na 2 SO 4 + Ca 3 (PO4) 2 Известково-содовый : устранение временной жесткости Ca(HCO 3 ) 2 + Ca(OH) 2 = 2CaCO 3 + 2H 2 O устранение постоянной жесткости CaSO 4 + Na 2 CO 3 = CaCO 3 + Na 2 SO 4 Химическое умягчение воды
Слайд 11
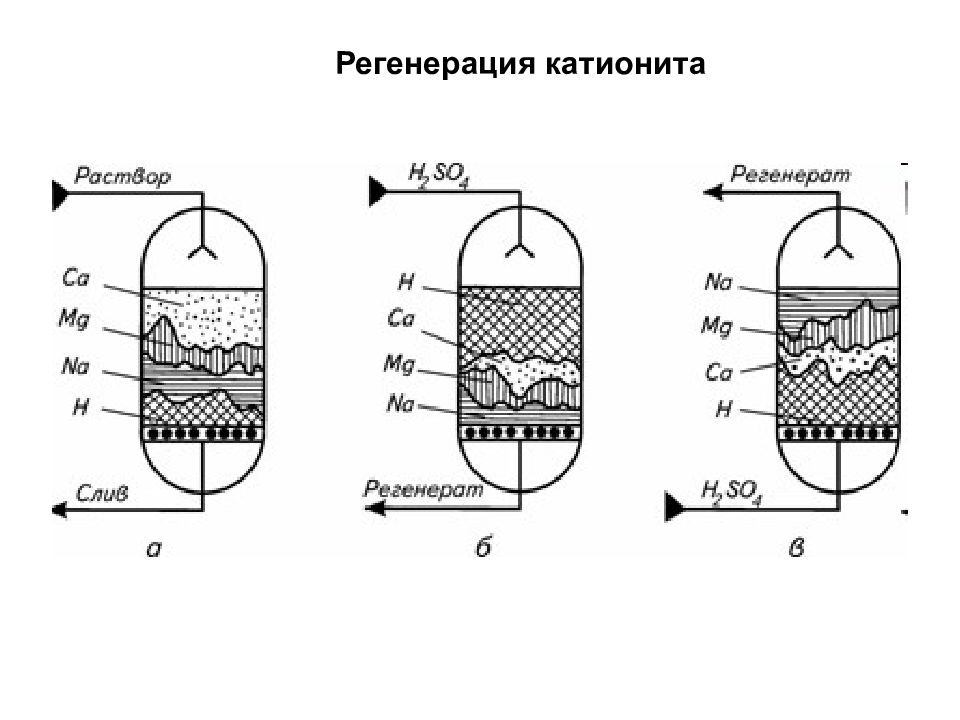
Катиониты обменивают катионы или протоны на катионы исходного раствора, для регенерации подвергают действию кислоты. Сильнокислотные - с сильно диссоциирующими кислотными группами (например, сульфогруппы, КУ ). Работают в средах с кислой, нейтральной и щелочной реакцией. Слабокислотные - со слабодиссоциирующими кислотными группами (например, карбоксильными, КБ ). Работают в средах с нейтральной и щелочной реакцией. Аниониты обменивают ОН-анионы на анионы исходного раствора, для регенерации подвергают действию щёлочи. Сильноосновные – с сильно диссоциирующими основными группами (четвертичные амониевые основания -NR 3 OH, АВ ), работают в средах с кислой, нейтральной и щелочной реакцией. Слабоосновные - с диссоциирующими основными группами (аминогруппы -NH 2, =NH, =N, АН ), работают в средах с кислой и нейтральной реакцией. Среднеосновные - содержат группы, как сильноосновных анионитов, так и слабоосновных анионитов, Levatit DW 408. Амфотерные иониты или полиамфолиты. В разных средах они могут вести себя или как катиониты, или как аниониты ( АНКБ, АВКБ ). Для регенерации амфотерные иониты промывают обессоленной водой. Ионообменное умягчение воды Иониты - твердые нерастворимые вещества, способные обменивать свои ионы на ионы из окружающего их раствора. Сильные иониты сорбируют все катионы или анионы солей. Слабые катиониты селективны по поливалентным металлам, слабые аниониты – по анионам сильных кислот. Слабые иониты имеют более высокую емкость, но меньшую химическую и механическую стойкость. Сильные иониты регенерируют достаточно концентрированными растворами кислот или щелочей, взятых с большим избытком. Слабые – разбавленными растворами практически в стехиометрическом соотношении
Слайд 12
Основными характеристиками ионитов являются : обменная емкость; селективность; механическая прочность; осмотическая стабильность; химическая стабильность; температурная устойчивость; гранулометрический (фракционный) состав.
Слайд 13
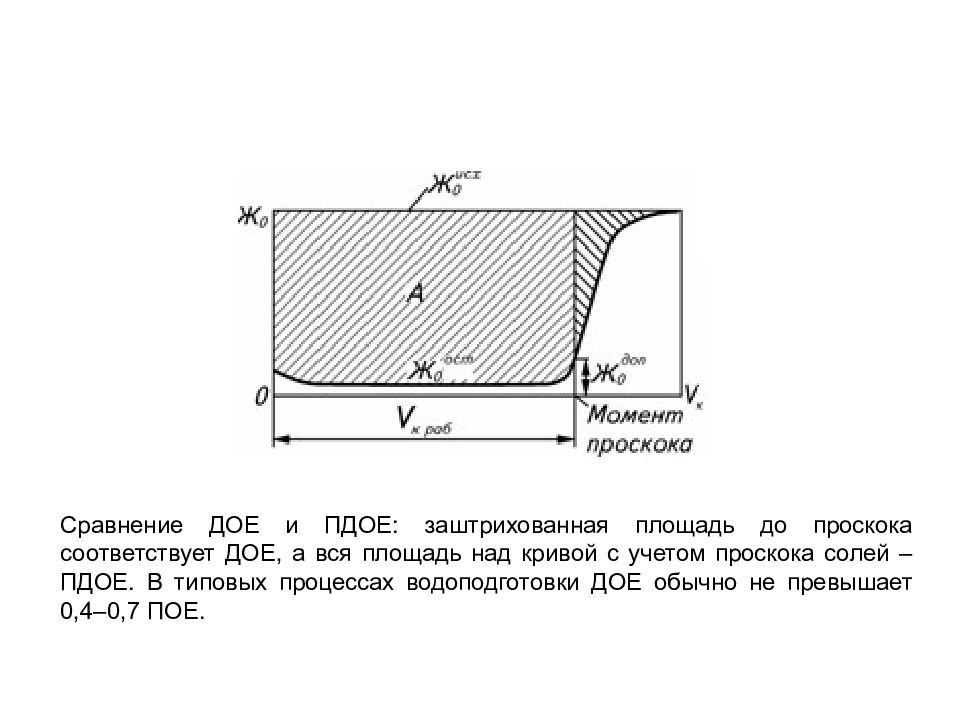
Полная обменная емкость ( ПОЕ ) определяется числом функциональных групп, способных к ионному обмену, в единице массы воздушно-сухого или набухшего ионита и выражается в мг-экв/г или мг-экв/л. Является постоянной величиной, которую указывают в паспорте ионита, и не зависит от концентрации или природы обменивающегося иона. Может уменьшаться из-за термического, химического или радиационного воздействия. В реальных условиях ПОЕ уменьшается со временем вследствие старения матрицы ионита, необратимого поглощения ионов-отравителей (органики, железа и т. п.), которые блокируют функциональные группы. Равновесная (статическая) обменная емкость зависит от концентрации ионов в воде, рН и отношения объемов ионита и раствора при измерениях. Необходима для проведения расчетов технологических процессов. Динамическая обменная емкость (ДОЕ). В реальных условиях многократного применения ионита в цикле сорбции-регенерации обменная емкость используется не полностью, а лишь частично. Степень использования определяется методом регенерации и расходом регенерирующего агента, временем контакта ионита с водой и с регенерирующим агентом, концентрацией солей, рН, конструкцией и гидродинамикой используемого аппарата. ОБМЕННАЯ ЕМКОСТЬ
Слайд 14
Сравнение ДОЕ и ПДОЕ: заштрихованная площадь до проскока соответствует ДОЕ, а вся площадь над кривой с учетом проскока солей – ПДОЕ. В типовых процессах водоподготовки ДОЕ обычно не превышает 0,4–0,7 ПОЕ.
Слайд 15
Селективность - способность избирательно сорбировать ионы из растворов сложного состава. Определяется типом ионогенных групп, числом поперечных связей матрицы ионита, размером пор и составом раствора. Для большинства ионитов селективность невелика, однако разработаны специальные образцы, имеющие высокую способность к извлечению определенных ионов. СЕЛЕКТИВНОСТЬ Ряды селективности при обмене ( к аждый последующий сорбируется более селективно, чем предыдущий ) на сильнокислотном катионите однозарядных ионов : Li + H + Na + NH 4 + K + Rb + Cs + Ag + Tl +. двухзарядных ионов : Mg 2+ Ca 2+ Sr 2+ Ba 2+ Ra 2+ на слабокислотных карбоксильных и фосфатных катионитах однозарядных ионов : Cs + Rb + K + Na + Li + на высокоосновном анионите однозарядных ионов : OH - F - HCOO - Cl - HSO 3 - Br - NO 3 - <HSO 4 - I - ClO 4 - Определяющим фактором рядов для ионов одинакового заряда служит изменение энергии гидратации, которая уменьшается с увеличением размеров ионов, избирательность ионита возрастает с увеличением их радиуса. Для разнозарядных катионов селективность растет с возрастанием заряда из-за электростатического взаимодействия с матрицей ионита, которое растет с увеличением радиуса иона
Слайд 17
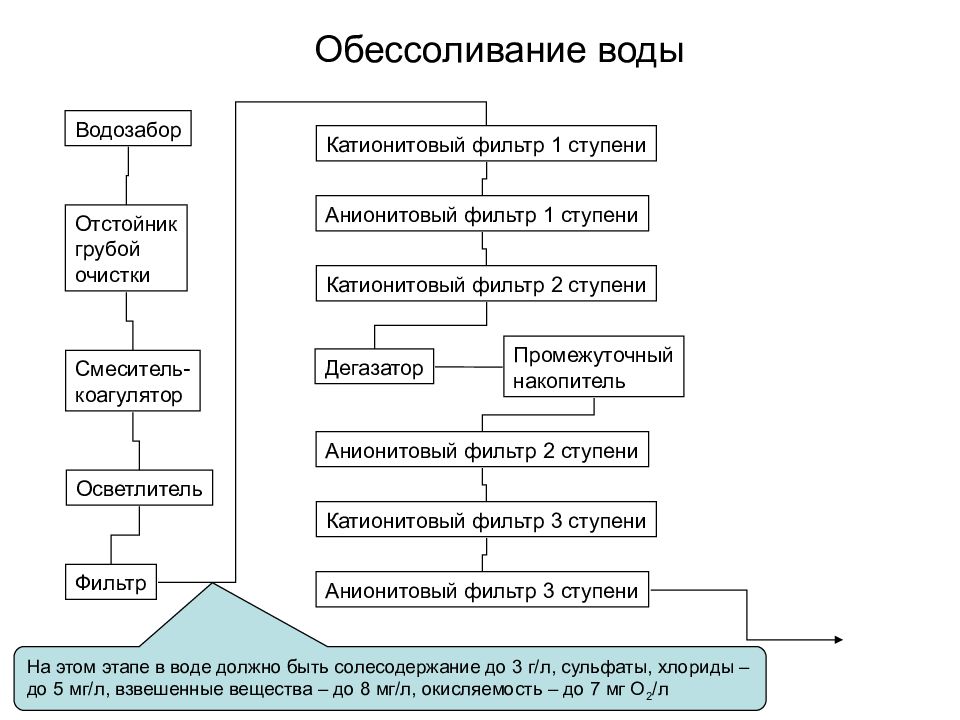
Обессоливание воды Водозабор Отстойник грубой очистки Смеситель- коагулятор Фильтр Катионитовый фильтр 1 ступени Катионитовый фильтр 2 ступени Анионитовый фильтр 1 ступени Анионитовый фильтр 2 ступени Катионитовый фильтр 3 ступени Анионитовый фильтр 3 ступени Осветлитель Дегазатор Промежуточный накопитель На этом этапе в воде должно быть солесодержание до 3 г/л, сульфаты, хлориды – до 5 мг/л, взвешенные вещества – до 8 мг/л, окисляемость – до 7 мг О 2 /л
Слайд 20
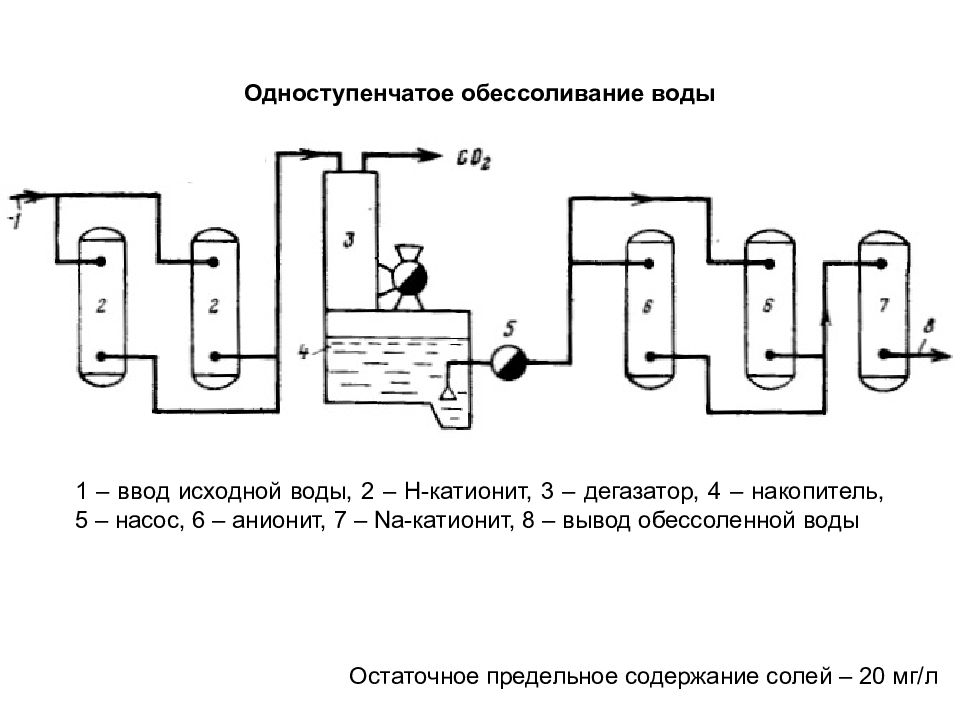
Одноступенчатое обессоливание воды Остаточное предельное содержание солей – 20 мг/л 1 – ввод исходной воды, 2 – Н-катионит, 3 – дегазатор, 4 – накопитель, 5 – насос, 6 – анионит, 7 – Na- катионит, 8 – вывод обессоленной воды
Слайд 21
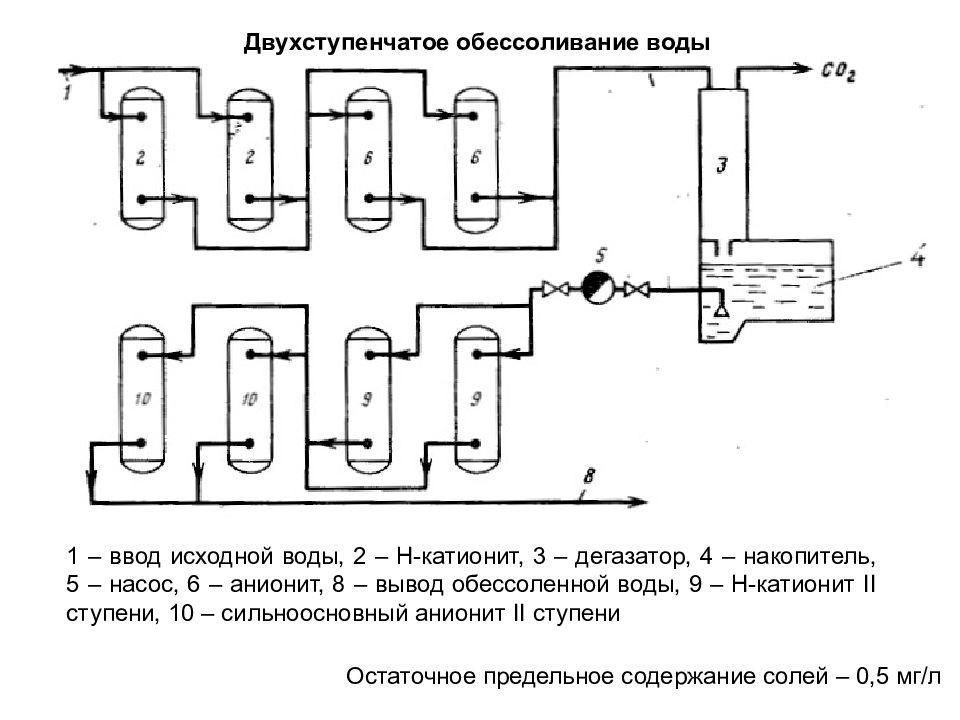
Остаточное предельное содержание солей – 0,5 мг/л 1 – ввод исходной воды, 2 – Н-катионит, 3 – дегазатор, 4 – накопитель, 5 – насос, 6 – анионит, 8 – вывод обессоленной воды, 9 – Н-катионит II ступени, 10 – сильноосновный анионит II ступени Двухступенчатое обессоливание воды
Слайд 22
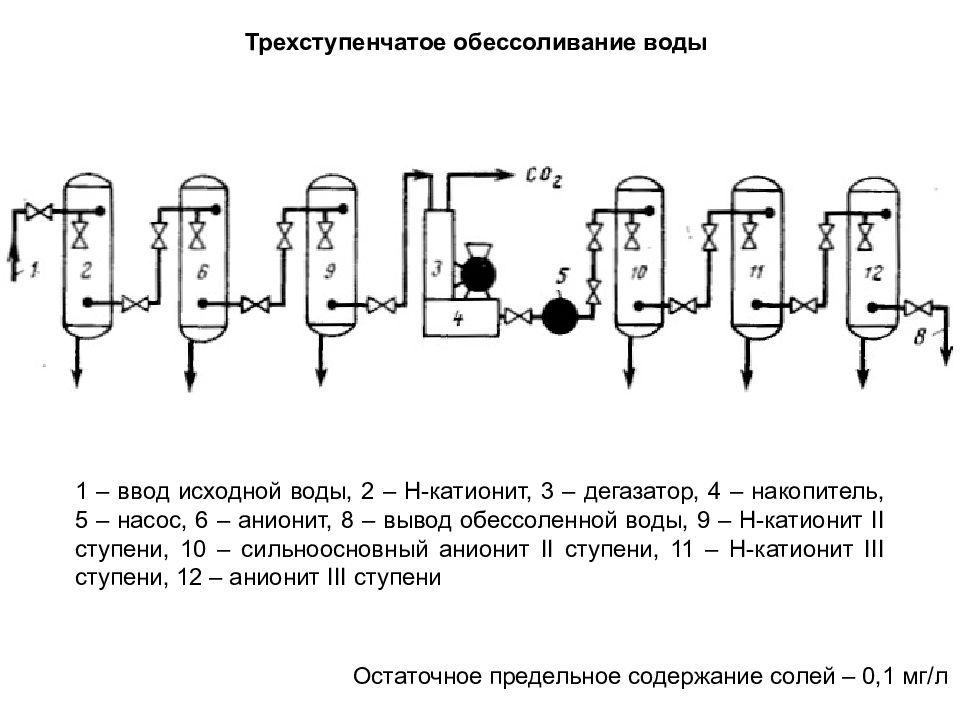
Остаточное предельное содержание солей – 0,1 мг/л 1 – ввод исходной воды, 2 – Н-катионит, 3 – дегазатор, 4 – накопитель, 5 – насос, 6 – анионит, 8 – вывод обессоленной воды, 9 – Н-катионит II ступени, 10 – сильноосновный анионит II ступени, 11 – Н-катионит III ступени, 12 – анионит III ступени Трехступенчатое обессоливание воды
Слайд 23
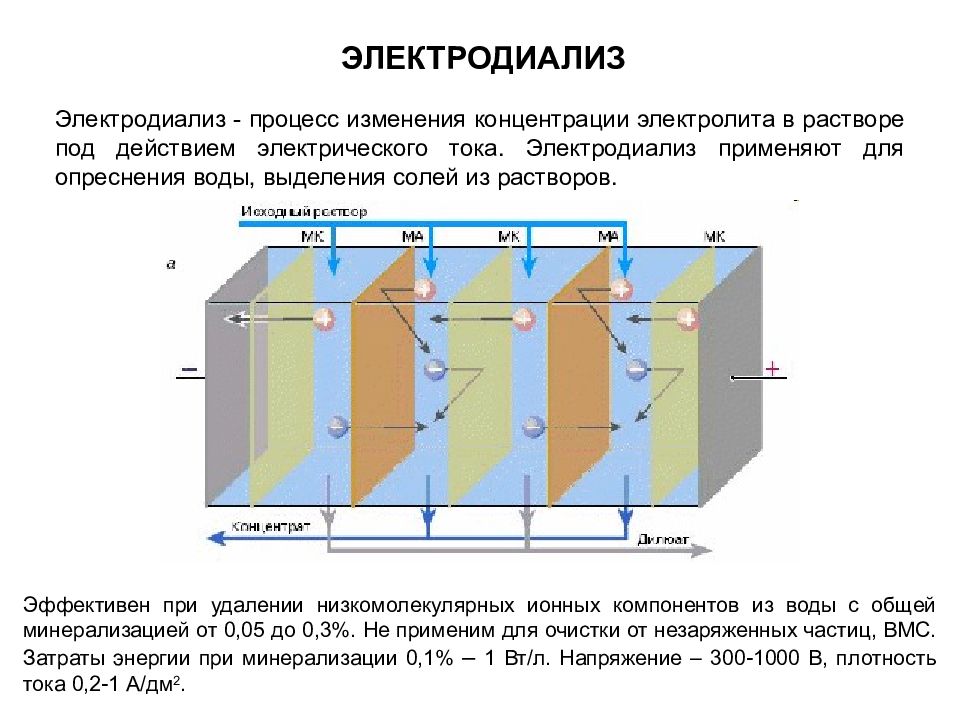
Электродиализ - процесс изменения концентрации электролита в растворе под действием электрического тока. Электродиализ применяют для опреснения воды, выделения солей из растворов. ЭЛЕКТРОДИАЛИЗ Эффективен при удалении низкомолекулярных ионных компонентов из воды с общей минерализацией от 0,05 до 0,3%. Не применим для очистки от незаряженных частиц, ВМС. Затраты энергии при минерализации 0,1% – 1 Вт/л. Напряжение – 300-1000 В, плотность тока 0,2-1 А/дм 2.