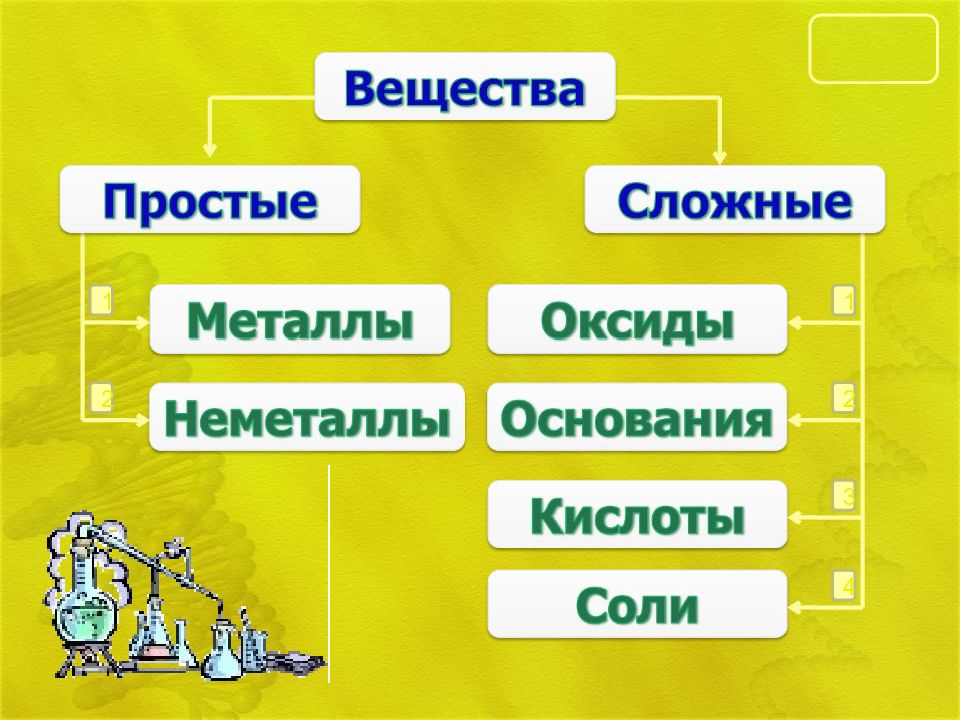
Слайд 4: Состав солей
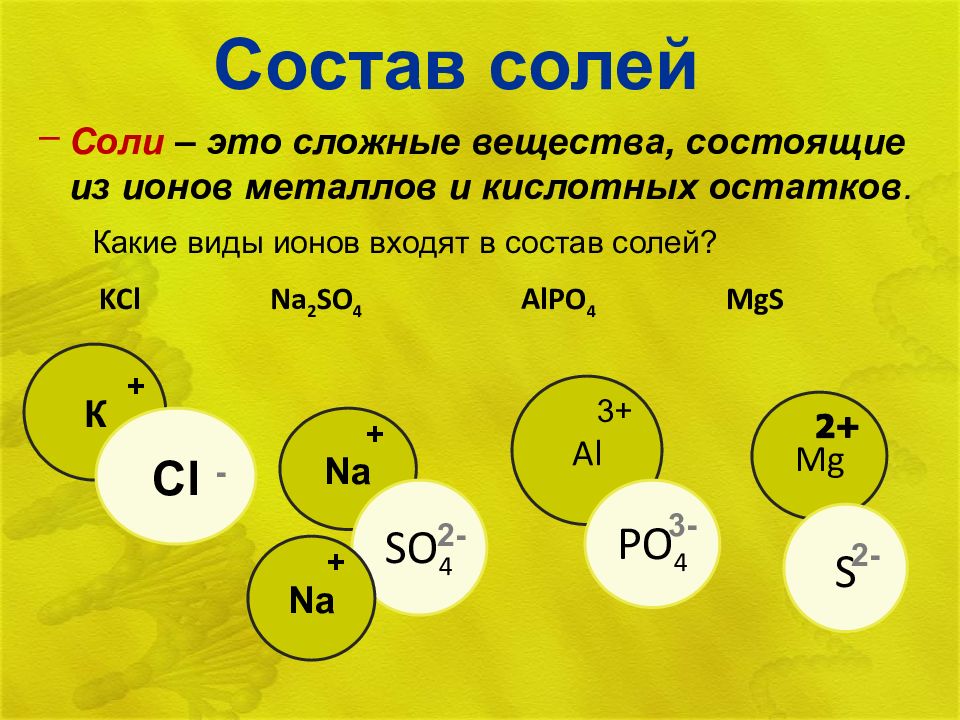
Соли – это сложные вещества, состоящие из ионов металлов и кислотных остатков. KCl Na 2 SO 4 AlPO 4 MgS Какие виды ионов входят в состав солей? К + Cl - Na + SO 4 2 - Al 3 + PO 4 3 - Mg S 2 - Na +
Слайд 5: Классификация солей
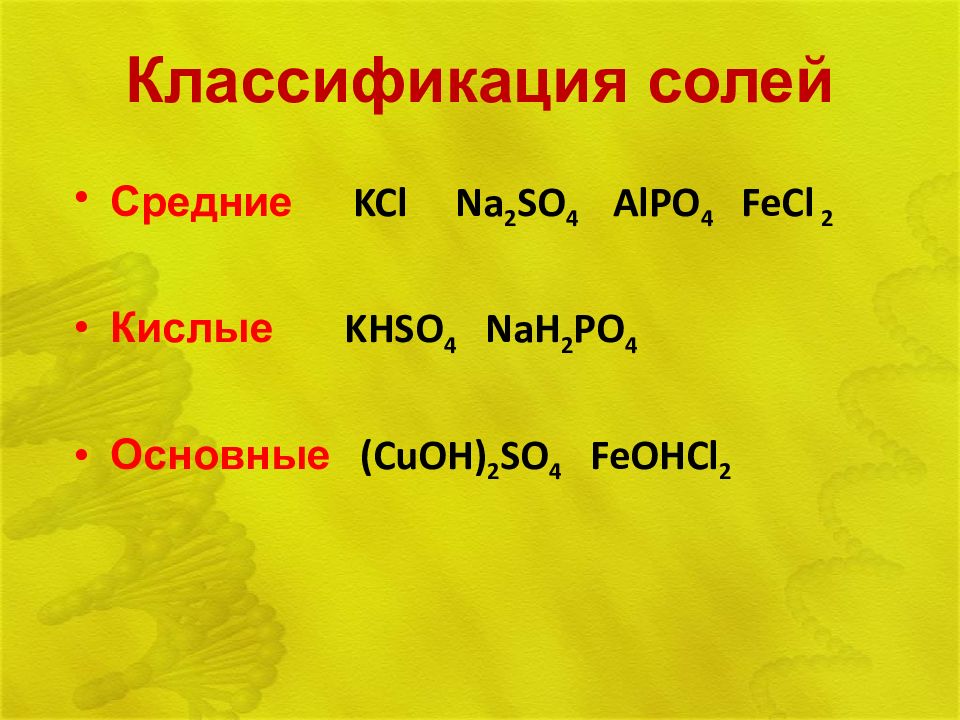
Средние KCl Na 2 SO 4 AlPO 4 FeCl 2 Кислые KHSO 4 NaH 2 PO 4 Основные (CuOH) 2 SO 4 FeOHCl 2
Слайд 6
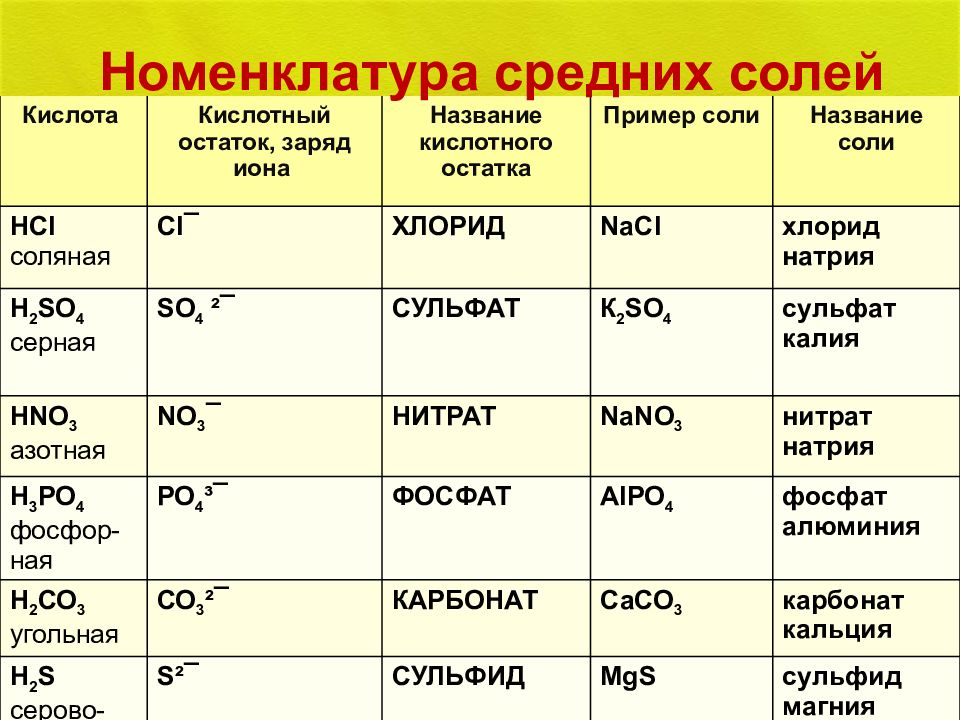
Кислота Кислотный остаток, заряд иона Название кислотного остатка Пример соли Название соли HCl соляная Cl ¯ ХЛОРИД NaCl хлорид натрия Н 2 S О 4 серная S О 4 ²¯ СУЛЬФАТ К 2 S О 4 сульфат калия Н NO 3 азотная NO 3 ¯ НИТРАТ Na NO 3 нитрат натрия Н 3 РО 4 фосфор-ная РО 4 ³¯ ФОСФАТ AlP О 4 фосфат алюминия Н 2 СО 3 угольная СО 3 ²¯ КАРБОНАТ СаСО 3 карбонат кальция Н 2 S серово-дородная S²¯ СУЛЬФИД MgS сульфид магния Номенклатура средних солей
Слайд 7: Номенклатура кислых и основных солей
У кислых солей приставка ГИДРО добавляется к названию аниона. KHSO 4 гидро сульфат калия NaH 2 PO 4 ди гидро сульфат натрия У основных солей приставка ГИДРОКСО добавляется к названию аниона. (CuOH) 2 SO 4 гидроксо сульфат меди ( II ) FeOHCl 2 гидроксо хлорид железа ( III )
Слайд 8: Сделай сам!
Даны формулы солей. Раздели их на 3 группы, назови каждую соль. KHCO 3 K 2 SO 4 NaH 2 PO 4 (CuOH) 2 CO 3 CaS
Слайд 9: Алгоритм составления формулы соли по названию
1. Записать ионы металла и кислотного остатка, указать заряды ионов. 2. Найти наименьшее общее кратное и поочередно разделить на заряды ионов. 3. Полученные числа записать как индексы у соответствующего иона.
Слайд 10: Сделай сам!
Составь формулы солей: а) сульфат лития б) гидросульфат лития в) дигидрофосфат лития
Слайд 12: Представители класса «Соли»
CuSO 4 MgSO 4 CaCO 3 (мел ) KNO 3 KCl (сильвин) FeTiO 3 (ильменит ) KMnO 4 FeCl 3 CuSO 4 MgSO 4 CaCO 3 (мел ) KNO 3 KCl (сильвин) FeTiO 3 (ильменит ) KMnO 4 FeCl 3
Слайд 13: Что это за вещество?
Вещество, без которого невозможна жизнь растений, животных и человека. Это химическое соединение необходимо для существования в крови эритроцитов, сокращения мышц, переваривания пищи в желудке. В год каждый человек потребляет от 3 до 5 кг. этого вещества. Это вещество- символ гостеприимства и радушия русской нации. Говорят, чтобы узнать человека, надо с ним пуд этого вещества съесть.
Слайд 14: Среди всех природных минеральных солей, самая главная та, которую мы называем просто “соль” А.Е.Ферсман
Слайд 16: Знаете ли вы, что…
Толщина пласта соли в Соль- Илецке превышает 1,5 км. Поваренной солью, извлеченной только из морской воды, можно было бы засыпать всю сушу Земного шара слоем 130 м. А для территории Европы этого количества хватило бы для слоя толщиной около 5 км.
Слайд 19: Минералы карбоната кальция находятся в горных породах:
Известняк Мел Мрамор Травертин
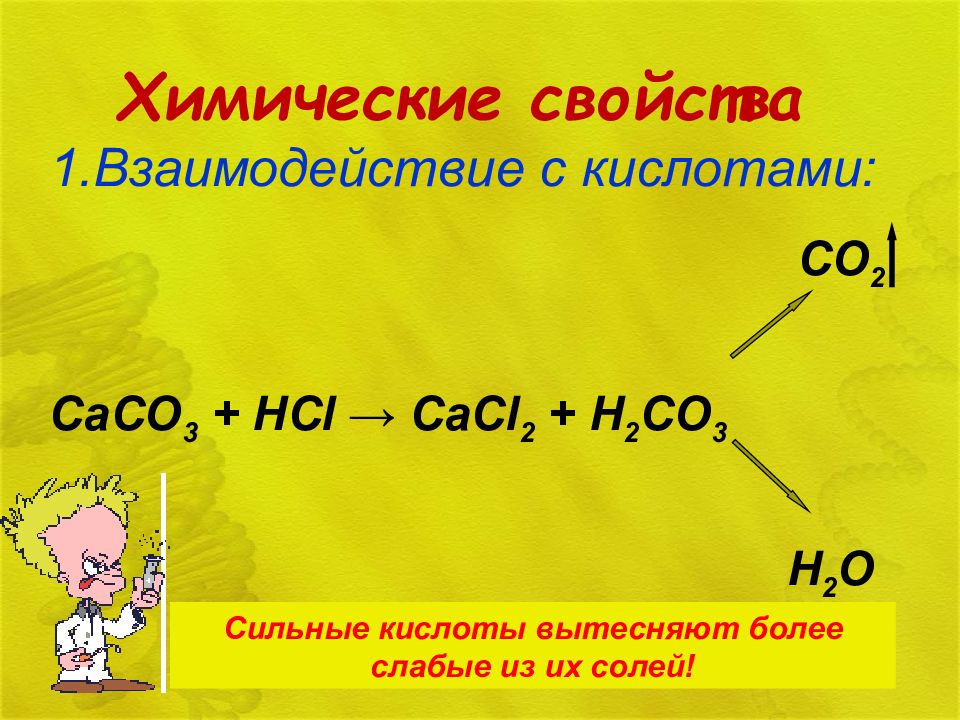
Слайд 20: Химические свойства
1.Взаимодействие с кислотами: Сильные кислоты вытесняют более слабые из их солей! CO 2 CaCO 3 + HCl → CaCl 2 + H 2 CO 3 H 2 O
Слайд 21: Химические свойства
2. Взаимодействие со щелочами: 3Na ОН + FeCl 3 → Fe(OH) 3 + 3NaCl
Слайд 22: Химические свойства
3. Взаимодействие с металлами: CuSO 4 + Fe FeSO 4 + Cu
Слайд 23: Химические свойства
4. Взаимодействие солей между собой Na 2 S + Cu(NO 3 ) 2 → CuS + 2NaNO 3
Слайд 26
1. На уроке было над чем подумать 2. Я понял новую тему 3. На все возникшие у меня вопросы я получил ответы 4. На уроке я поработал добросовестно 5. Оцените свою работу на уроке по пятибалльной системе. Ответьте на утверждение знаком «+» или «-»: