Первый слайд презентации: Жоспар: I.Кіріспе II.Негізгі бөлім 1)Катализ құбылысы,өзіне тән ерекшеліктері.Маңызы 2)Катализдің түрлері 3)Гомогенді катализ.Механизмі.Ферментативті катализ 4)Гетерогенді катализ 5)Ингибитор.Таңдаушы,иондық,электронды,автокатализ 6)Катализдің қолданылуы мен маңызы III.Қорытынды IV.Пайдаланылған әдебиеттер тізімі
Слайд 2
Көптеген химиялық реакциялардың жылдамдығын реакцияға бөгде бір заттарды қатыстыру арқылы өзгертуге болады.Бөгде заттардың аз ғана мөлшері әсерінен реакция жылдамдығы кенеттен өседі,не азаяды,ал бөгде зат реакция аяғында таза күйінде бөлініп шығады.Бұл құбылысты «катализ» деп,ал реакция жылдамдығын өзгертетін бөгде затты «катализатор «деп атайды. К атализ құбылысы ерте заманнан белгілі,бірақ оны ғылыми түрде зерттеу өткен ғасырдың басында басталған.Катализ дейтін терминді ғылымға 1836 жылы Берцелиус енгізген. Катализдік реакциялар табиғатта кең таралған,олардың химиялық технологияда және өмірде де маңызы өте зор.Катализатор қолдану арқылы қажетті бағытта жүргізе аламыз. Химиялық өнеркәсіптің өте маңызды үдерістері – күкірт қышқылын алу,аммиакты синтездеу,азот қышқылын алу көптеген реакциялар катализатор қатысында жүреді.Кейбір катализаторсыз өтеді дейтін реакциялардың өзінде ыдыс қабырғасы,реакция жүретін орта (су) немесе реакция өнімі катализдік қасиет көрсетіп реакция жылдамдығын өзгертеді.
Слайд 3
°C Катализаторсыз жер бетінде тіршілік те мүмкін емес деуге болады.Тірі жасушаларда белоктың,майдың,көмірсулардың және басқа күрделі молекулалары синтезі мен олардың ыдырау үдерістері жүреді. Бұл үдерістер биологиялық катализатордың,яғни ферменттердің қатысында өтеді.Ферменттердің катализдік активтігі химиялық катализаторлың активтігінен әлдеқайда жоғары. Мысалы,ферменттің 1 молі бөлме температурасында 1 секундта 720 моль спирті сірке альдегидіне айналдырады,өндірісте қолданатын катализатордың 1 молі(мысалы,мыстың 1 моль атомы) 200 °C температурада спирттің 0,1-1 молін ғана сірке альдегидіне айналдырады н / е 3 моль фермент 0 °C -де 1 с.ішінде сутек асқын оксидінің 200000 молін ыдыратады.
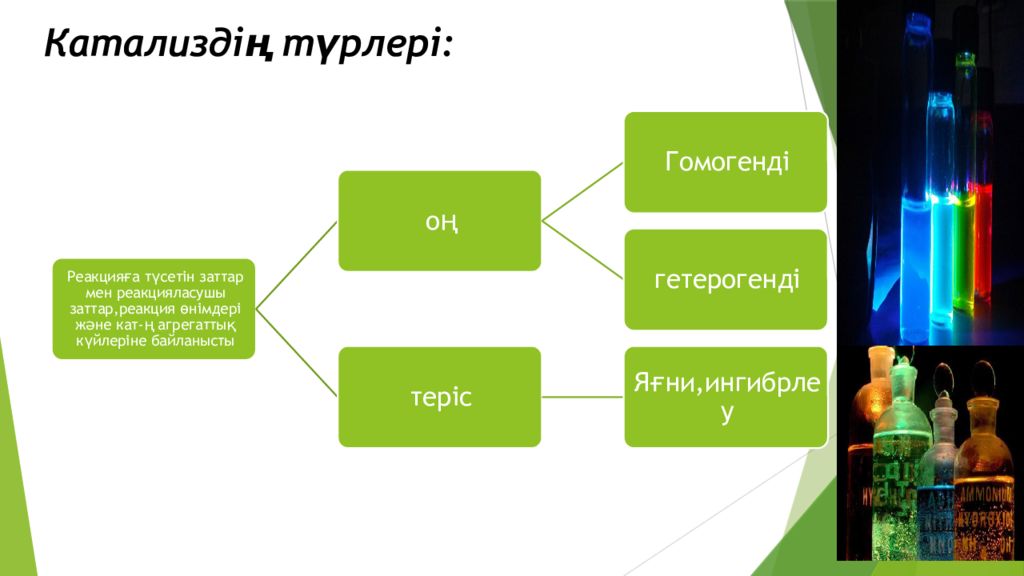
Слайд 4: Катализаторлар құбылысының өзіне тән бірнеше ерекшеліктері бар:
Талғағыштық –кат.әсері талғамалы. Оствальдтың айтуынша: «Әр құлыптың өз кілті болатындай,әр реакцияның өзіне тән катализаторы болады» Мысалы: Селективтілік -( кат.реакцияны белгілі бір бағытта жүргізе алатын қасиеті ). Мысалы: Реакция аяғында таза күйінде алынуы – кат.реакцияласатын затпен ешқандай стехиометриялық қатынаста болмайды. Реакцияның тепе- теңдік констанатсын өзгерте алмайды,тек реакцияның тепе- теңдік қалыпқа тез жетуін қамтамасыз етеді. ( K с = k 1 /k 2) *Катализатор әсерінен тура және кері реакция жылдамдықтары бірдей өсетінін көреміз,яғни Кс өзгермейді.
Слайд 7: Гомогенді катализ Реакцияласушы заттар,реакция өнімдері және катализатор барлығы да бір фазада болатын үдеріс.Көбінесе,сұйық не газды ортада өтеді
Кемшілігі: гетерогенді катализге қарағанда аз тараған; Артықшылығы: реакция жүргенде катализатордың әрекеттесуші реагенттердің бірі-бірімен аса тұрақсыз аралық қосылыс түзуі, сосын оның келесімен тез әрекеттесіп қатализатордың қайта қалпына келетіні ; Ерекшелігі: кинетикасы жағынан ерекшеленеді гетерогенді катализден.
Слайд 9: Катализатор әсері немен байланысты ?
Гомогенді реакцияның катализатор қатысындағы активтену энергиясы катализаторсыз жүрген кездегі активтену энергиясынан төмен болатынын көреміз ( E a.cat< Е a.) Катализатор акт.эн.төмендетіп,жылдамдықты жоғарылатады; Термодинамикалық мүмкін болатын реакцияның энергиялық тиімді жолмен жүруін қамтамасыз етеді.
Слайд 10: Гетерогенді катализ
Гетерогенді катализ- реакцияласушы заттар,реакция өнімдері,катализатор әр түрлі фазада болатын үдерісті айтады.Гет.кат.түрлері: Артықшылығы: микрогетерогендік катализ коллоид бөлшектердің қатысуымен сұйық фазада өтеді; Ферментік катализ үлкен маңызға ие,өсімдік және жануарлар жасушаларында жүреді,мұнда коллоидты түрде еріген белоктік бөлшектер-ферменттер тірі табиғаттағы күрдеі органикалық процесстердің жүруін тездетеді.
Слайд 11: Гетерогенді катализ Кемшілігі:
Еа төмендеуі аралық катализатордың реагентпен адсорбциялану нәтижесіне жетеді, бұл деген химиялық байланыстардың әлсіреуіне әкеледі. Мысалы : көмірқышқыл оксидін жандырғанда бөлінетін оттегі газдарында платиналық катализатордың беттік бөлігінде адсорбция жүреді. Молекула адсорбциялық газдардың реакциясы әлсіз молекулаішілік байланыстардың бөлінуі активтендіру энергиясы аз болады, аналогиялық реакциялардың газды ортада жүргеніне қарағанда. Одан кейін түзілген молекулалардың десорбциясы катализатор бетінде орындалады.
Слайд 12: Маңызды гетерогенді каталитикалық процестер
Фишер-Бош процесі : N2 + 3 H2 2 NH3 Fe / Ru катализаторлары, жоғары қысымы мен температурасы Тыңайтқыштар мен азот қышқылын өндіру үшін Фишер-Троп химиясы n CO + 2n H2→ (CH2) n + n H2O, сұйық отынды синтездеу Fe / Co катализаторлары Екінші дүниежүзілік соғыстағы ось үшін отын көзі. Сұйықталған каталитикалық крекинг Жоғары МВт мұнай → төмен МВт отыны, мыалға бензин. Цеолит катализаторлары
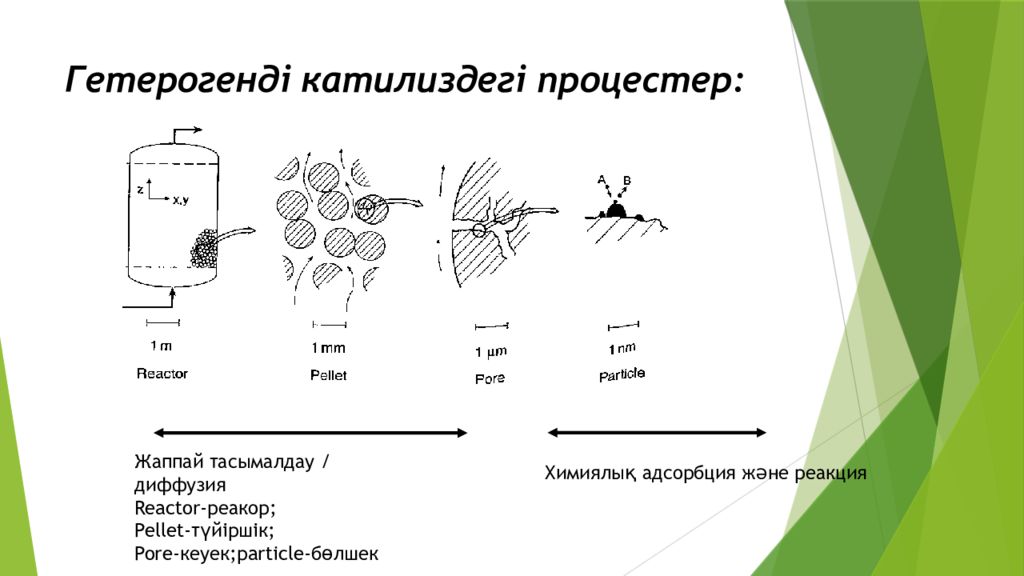
Слайд 13: Гетерогенді катилиздегі процестер:
Жаппай тасымалдау / диффузия Reactor- реакор; Pellet- түйіршік; Pore- кеуек; particle- бөлшек Химиялық адсорбция және реакция
Слайд 14: Ингибитор
Ингибиторлар ( латынша і nh і beo – тоқтату, тежеу ) – зиянды химиялық реакцияларды ( металдардың коррозияға ұшырауын, жағар май, тамақ өнімдерінің тотығуын ), тірі организмдегі ферменттер активтігін, өсімдіктердің өсуін тежейтін табиғи және синтетикалық заттар. Басқаша : Реакция жылдамдығын төмендететін заттарды ингибиторлар деп атайды. Олар реакция жолын өзгертеді бастапқы заттар интермедиат. Жүйенің активтендіру энергиясы аралық байланыстан соңғы өнім нәтижесі аса үлкен және мұндай процесс болуы мүмкін емес. Нәтижесінде интермедиат бастапқы заттардың түзілуімен айырылады.
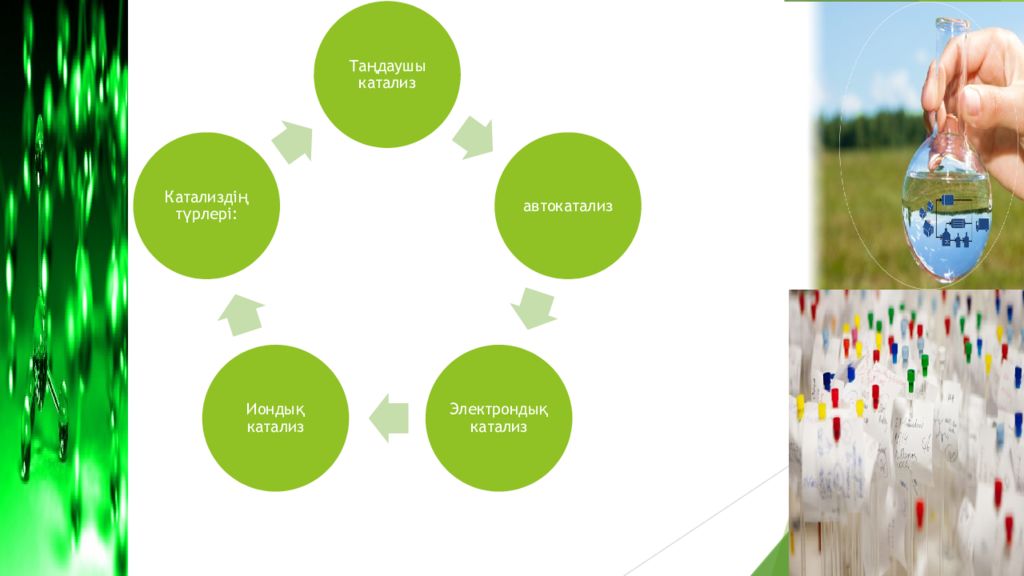
Слайд 15: Таңдаушы катализ
Қатар жүретін бірнеше реакциялардың ішінен керекті тек біреуінің ғана жылдамдығын өсіруші катализді айтады. 4NH3 + 5O2 = 4NO + 6H2O
Слайд 16: Автокатализ.Электрондық катализ
Бұл реакция кезіндегі аралық н / е соңғы өнімнің біреуі катализатор қызметін артқаратын реакция болып табылады.Тізбекті реакцияларда автокатализатор қызметін бос радикалдар атқарады. Автокатализ реакциялар қатарына қопарылғыш заттардың кейбір бөлінгіш реакциялары,жану,полимерлеу. Автокатализге тән нәрсе бастапқы кезде реакцияның жай жүруі индукция мерзімі деп аталаы. Электрондық катализ –гомогенді тотығу-тотықсыздануда,реакцияларға ерітінділердегі ауыспалы тотыққыш металлдардан мыс,марганец,темір( III ) иондары арқылы жеделдейтін тотығу-тотықсыздану реакциялары жатады.Мысалы, SO 2 газы бар ауаны темір сульфаты ерітіндісі арқылы өткізгенде SO2 газы SO 3-ке гомогенді түрде тотығады,нәтижесінде күкірт қышқылы пайда болады.Темір( III) ионының жеделдету әсері орын алады.
Слайд 17: Иондық катализ
Қышқыл-негіздік катализде катализатор есебінде қатты қышқылдар мен негіздер қызмет атқарады,бұл заттар тек иондық өткізгіштер болып табылады.Мысалы,көп қуысты тасушыларға жағылған ұшпайтын қышқылдар,қышқыл тұздар,анион бере алатын қатты бейорганикалық заттар жатады.
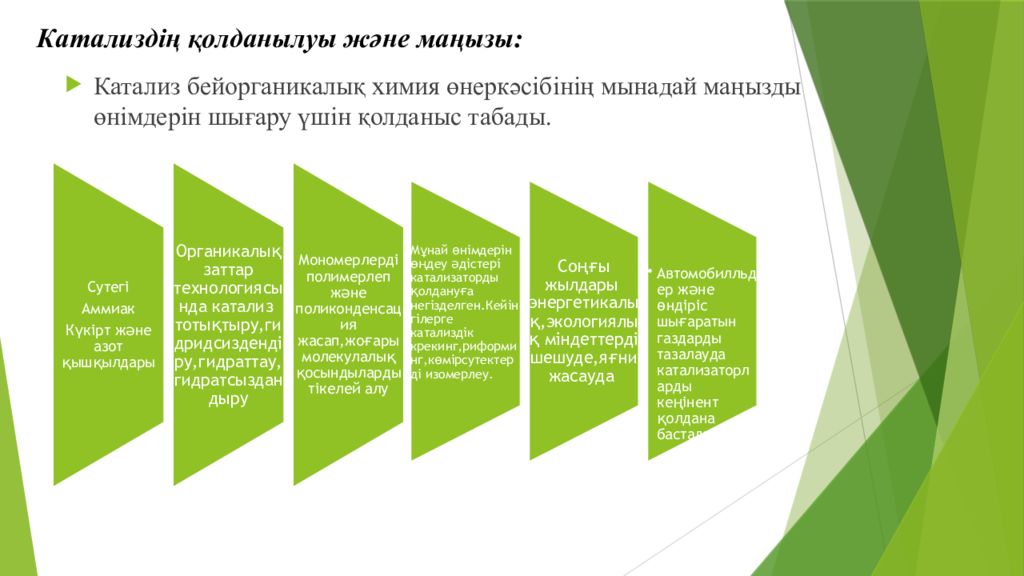
Слайд 18: Катализдің қолданылуы және маңызы:
Катализ бейорганикалық химия өнеркәсібінің мынадай маңызды өнімдерін шығару үшін қолданыс табады.
Слайд 19: Қорытынды:
Катализ – энергетикалық тосқауылды жеңілдетуде,химиялық өзгерістердің жолын реттуде үлкен рөл атқарады. Катализатор бастапқы әрекеттесуші заттармен әрекеттесіп және тікелей активтелген комплекстің түзілуіне қатысады,энергетикалық тосқауылдың шамасын төмендетіп химиялық реакцияның жылдамдығын арттырады.
Слайд 20: Пайдаланылған әдебиеттер тізімі:
1. «Жалпы химиялық технология», Қ.Ж.Керімқұлов,Ш.Ш.Нұрсейітов,Астана-2013,103-112 б. 2. «Химиялық кинетика және электрохимия»,Ә.Қ.Оспанова,Г.А.Сейілханова, II басылым,Алматы-2010,36-56 б. 3. «Физкалық химия»,Х.Қ.Оспанов,Д.Х.Қамысбаев,Е.Х.Абланова,Г.Х.Шәбікова,Алматы- 2 014.352-382 б. 4.Суреттер: интернет желісінен( https://www.google.com, http://tutmet.ru ) 5. «Жалпы химиялық технология» Ж.Қ.Қайырбеков,Е.А.Әубәкіров,Ж.К.Мылтықбаева,Алматы-2009,94-125 б.