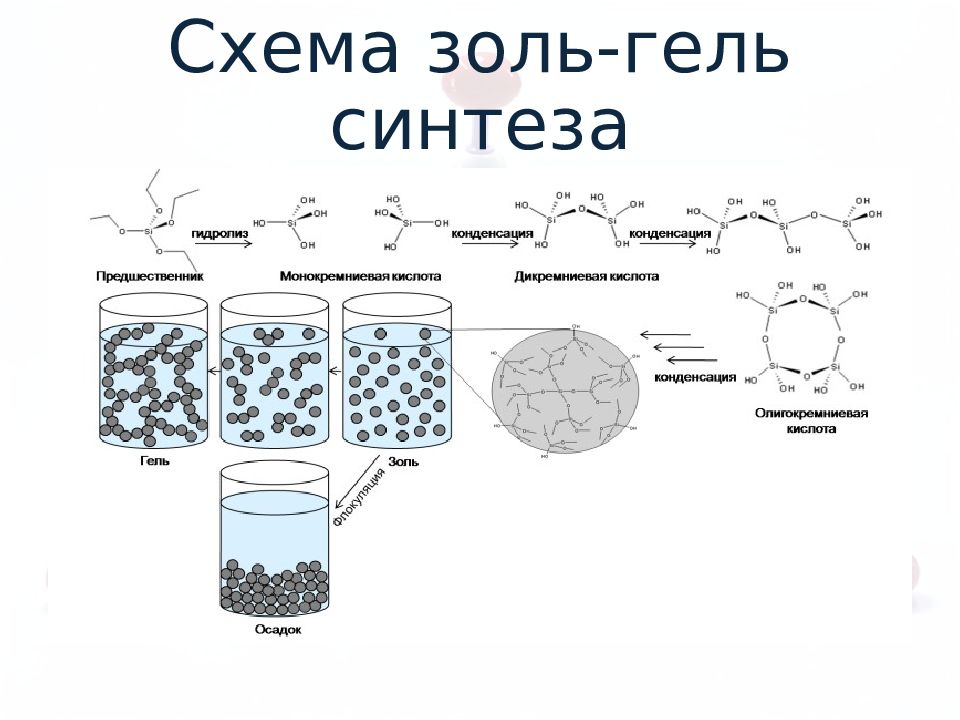
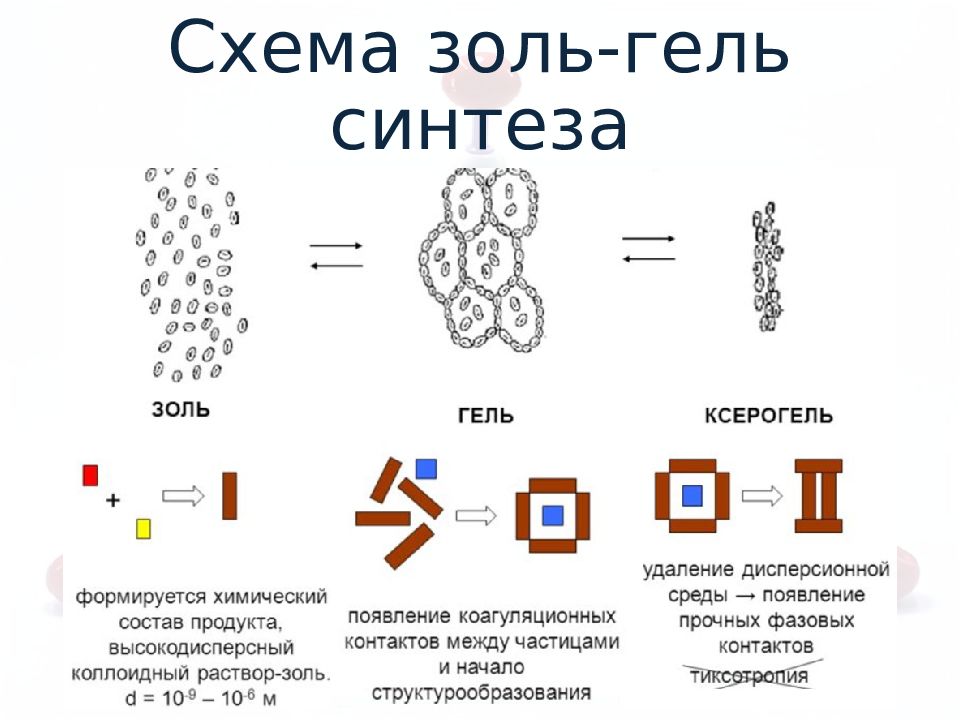
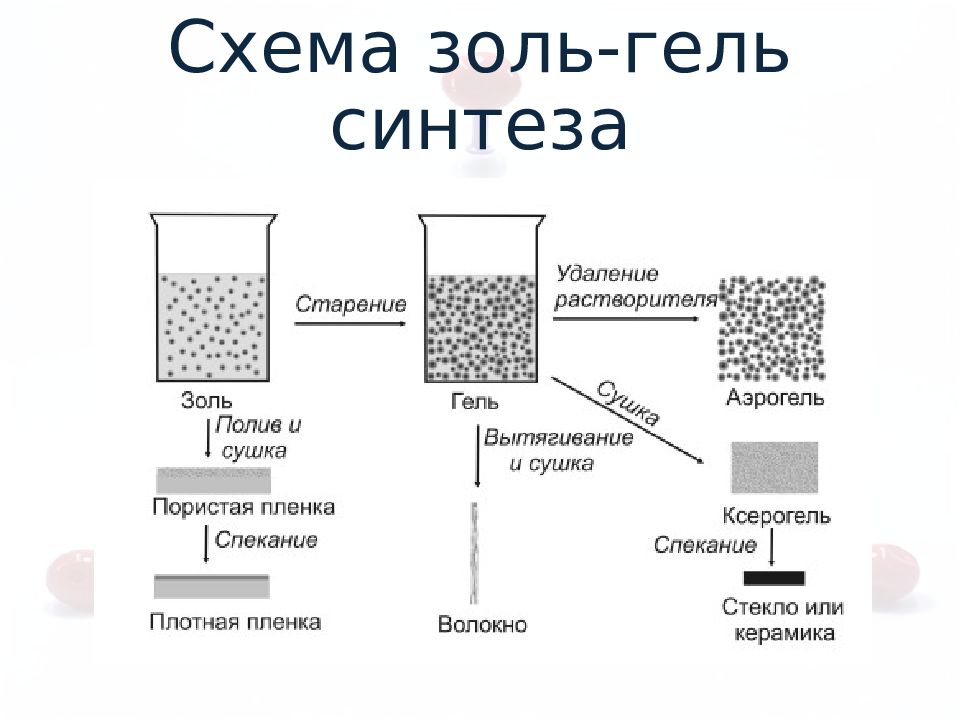
Слайд 7
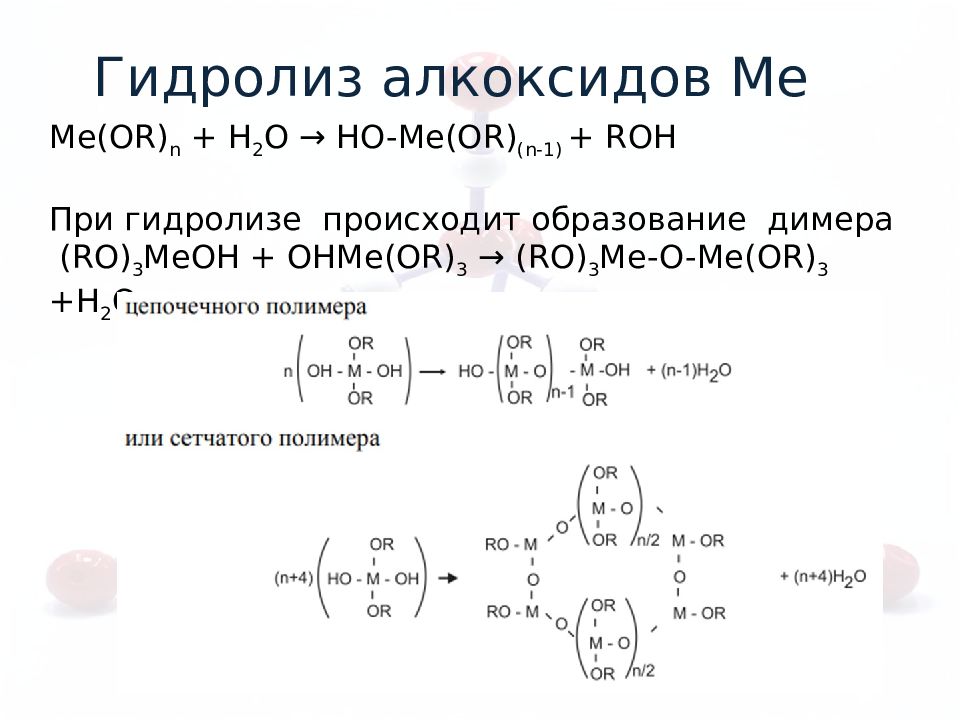
Me (OR) n + H 2 O → HO- Me (OR) (n-1) + ROH При гидролизе происходит образование димера (RO) 3 Me OH + OH Me (OR) 3 → (RO) 3 Me -O- Me (OR) 3 +Н 2 О Гидролиз алкоксидов Ме
Слайд 8
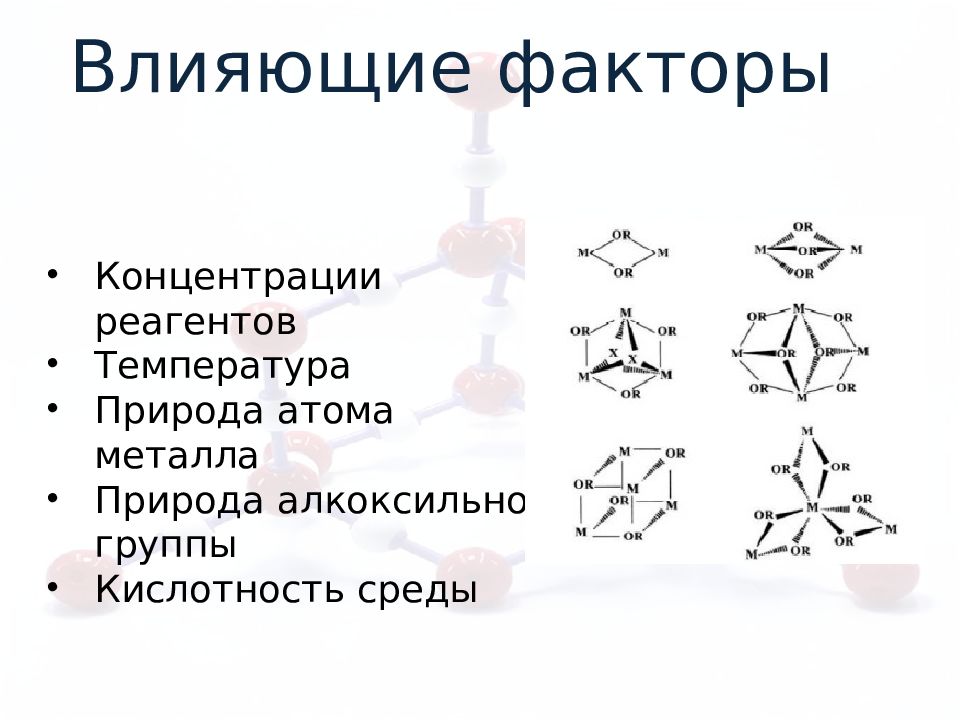
Концентрации реагентов Температура Природа атома металла Природа алкоксильной группы Кислотность среды Влияющие факторы
Слайд 9
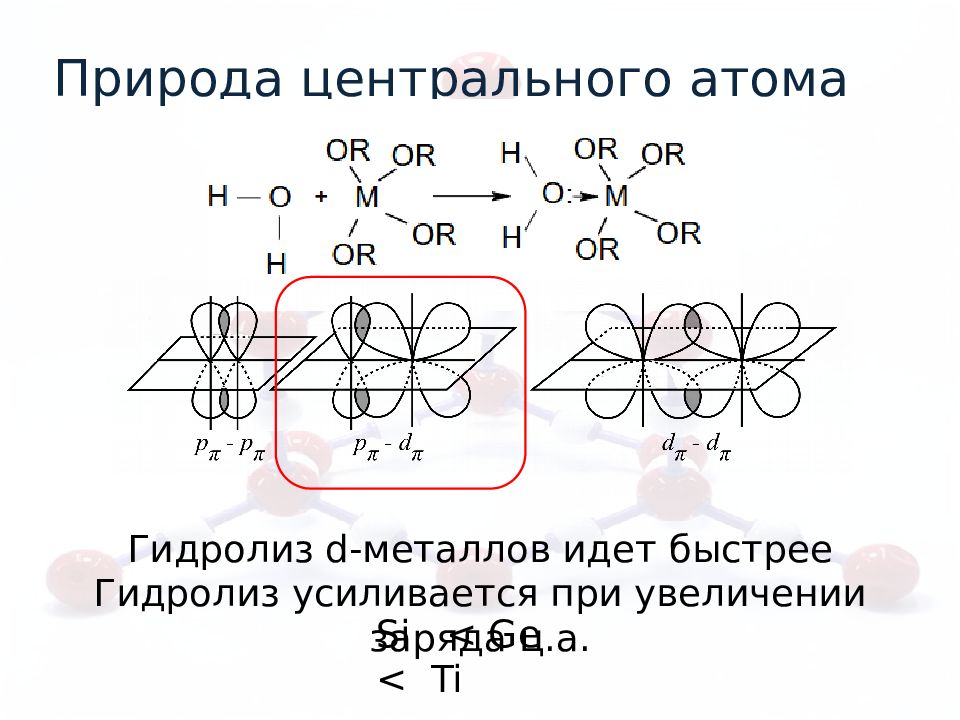
Природа центрального атома Si < Ge < Ti Гидролиз d- металлов идет быстрее Гидролиз усиливается при увеличении заряда ц.а.
Слайд 10
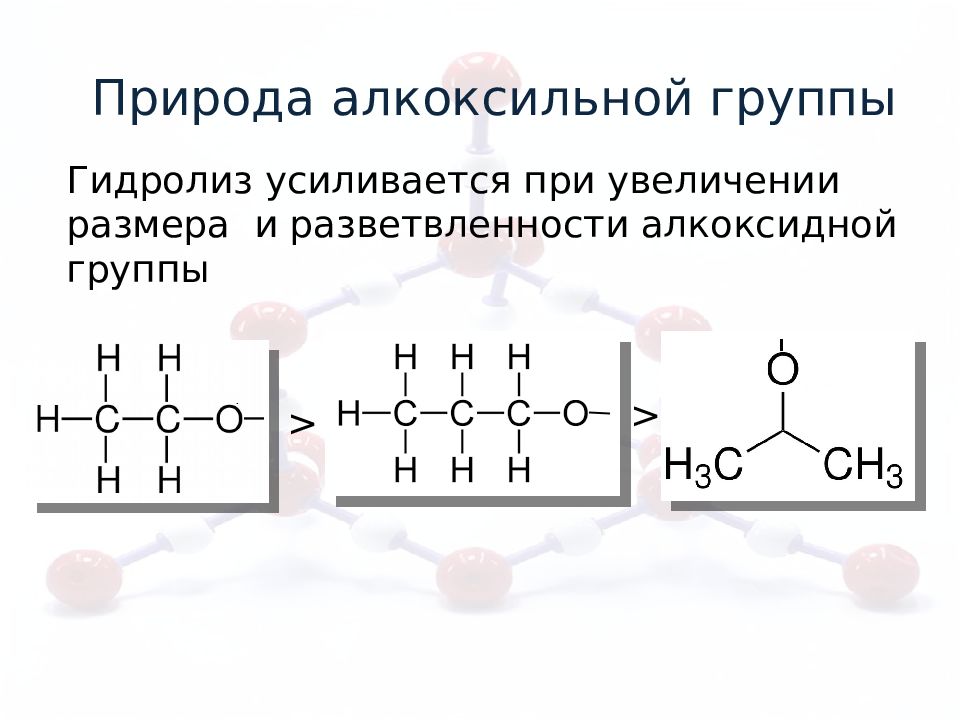
Природа алкоксильной группы Гидролиз усиливается при увеличении размера и разветвленности алкоксидной группы > >
Слайд 11
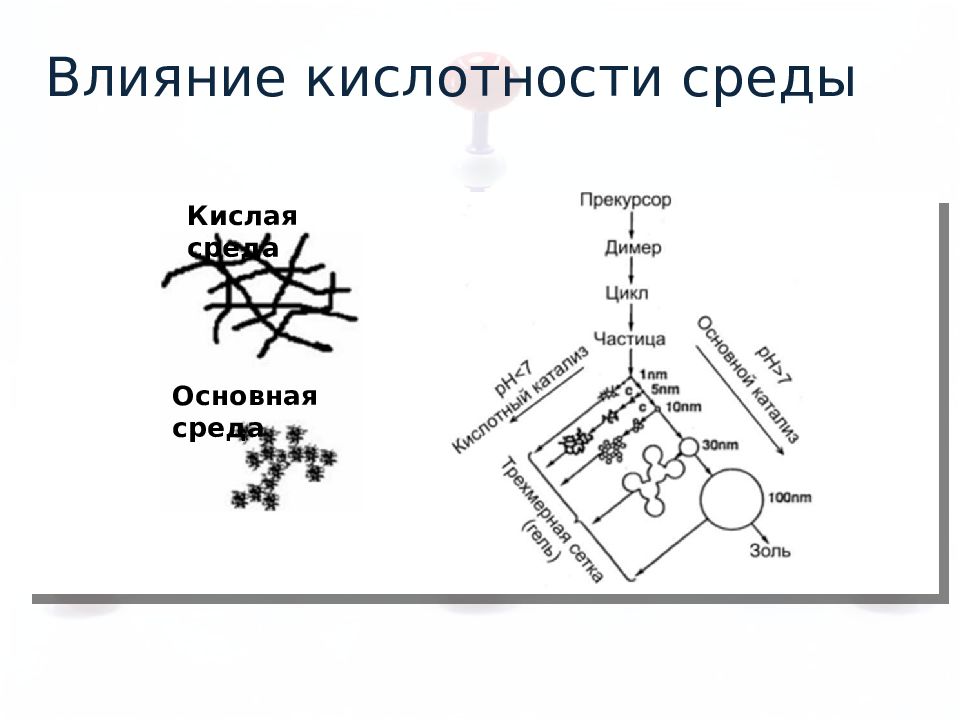
Чем более отрицательный заряд на кислороде, тем быстрее реакция При кислотном катализе увеличивается длина цепи, а не разветвленность Кислотный катализ D>>A>C>>B
Слайд 12
Чем более положительный заряд на металле, тем быстрее реакция Основный катализ При основном катализе увеличивается разветвленность цепи, а не длина B>>C>A>D
Слайд 14
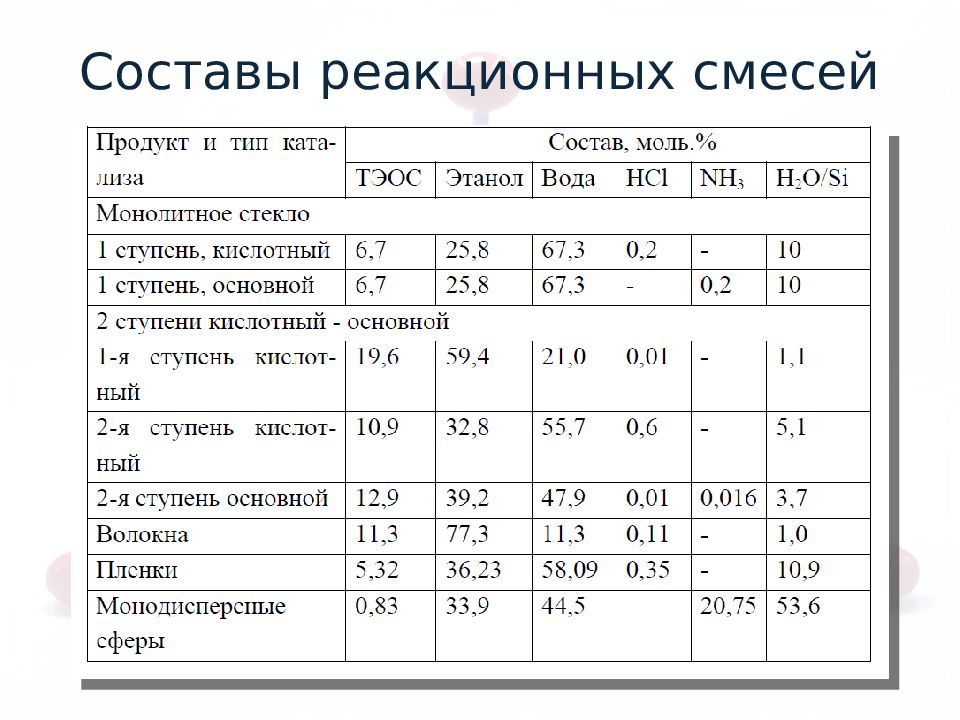
Молярное соотношение H 2 O/(C 2 H 5 O) 4 Si от 1:50 до 1:0,01. Влияние растворителя
Слайд 16
Получение ксерогеля Δ Р – капиллярное давление D – диаметр пор Θ – краевой угол смачивания γ – поверхностная энергия
Слайд 17
Золь-гель из солей металлов Готовят растворы: (1) тетрабутоксид титана в пропаноле-2 и (2) ацетат свинца в ледяной уксусной кислоте. Растворы сливают, тщательно перемешивают и для инициирования гидролиза добавляют водный раствор изопропанола-2. Добавляют порошок титаната свинца, который играет роль центров роста геля. Гель высушивается и после прокаливания при 400 о С в течение 20 часов получается полностью кристаллическая фаза.
Слайд 18
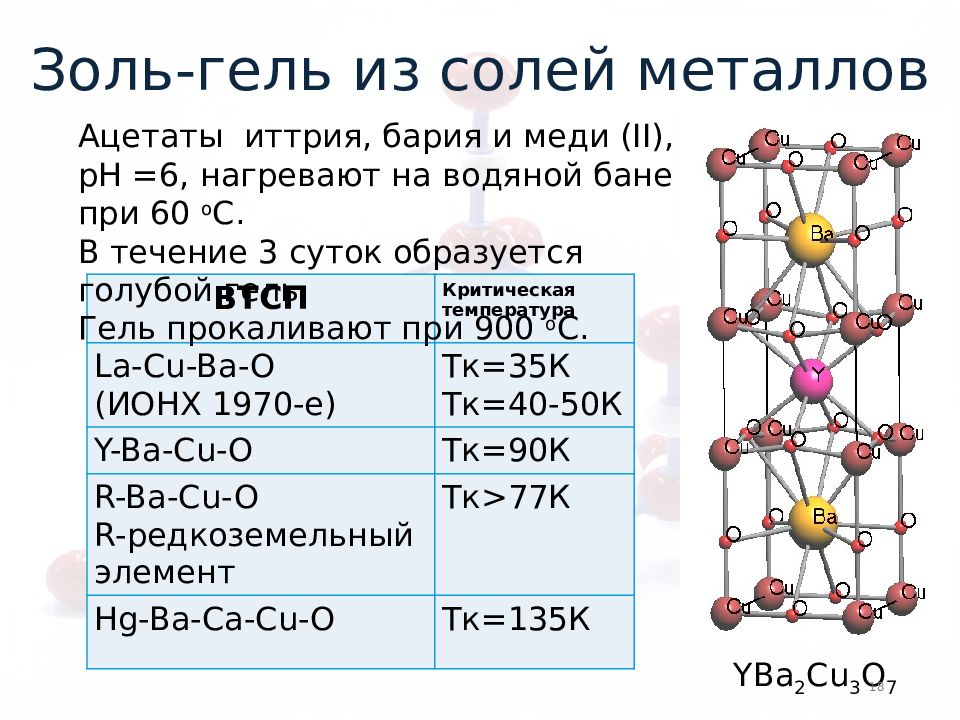
ВТСП Критическая температура La-Cu-Ba-O (ИОНХ 1970-е) T к=35К T к= 40-50 К Y-Ba-Cu-O T к= 90 К R-Ba-Cu-O R- редкоземельный элемент T к >77 К Hg-Ba-Ca-Cu-O Тк =135К YBa 2 Cu 3 O 7 18 Ацетаты иттрия, бария и меди (II), рН =6, нагревают на водяной бане при 60 о С. В течение 3 суток образуется голубой гель. Гель прокаливают при 900 о С. Золь-гель из солей металлов
Слайд 19
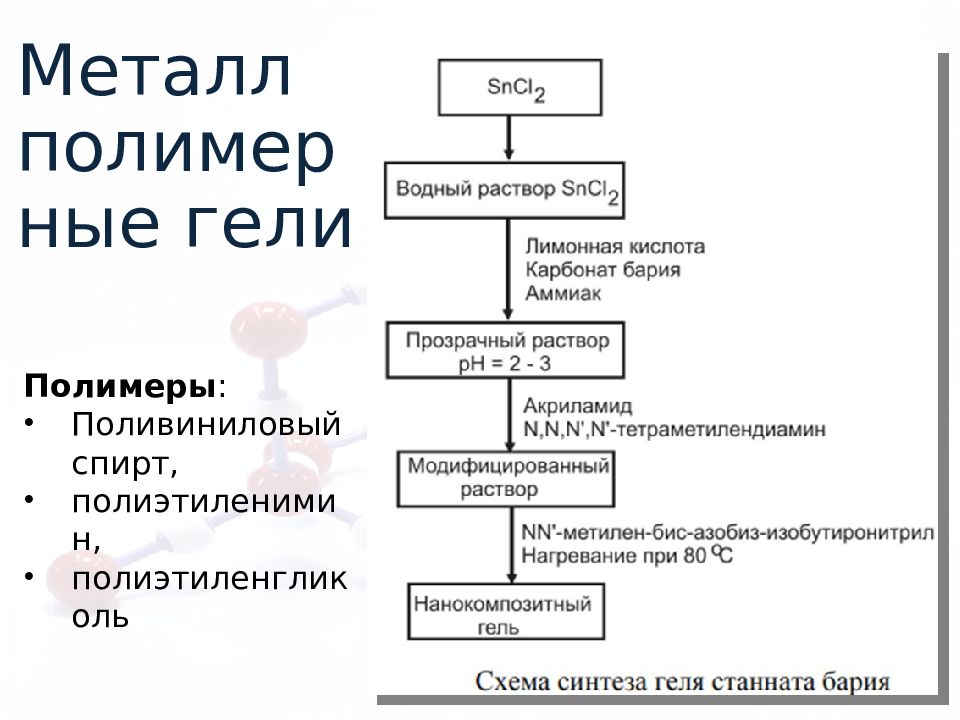
Металл полимерные гели Полимеры : Поливиниловый спирт, полиэтиленимин, полиэтиленгликоль
Слайд 21
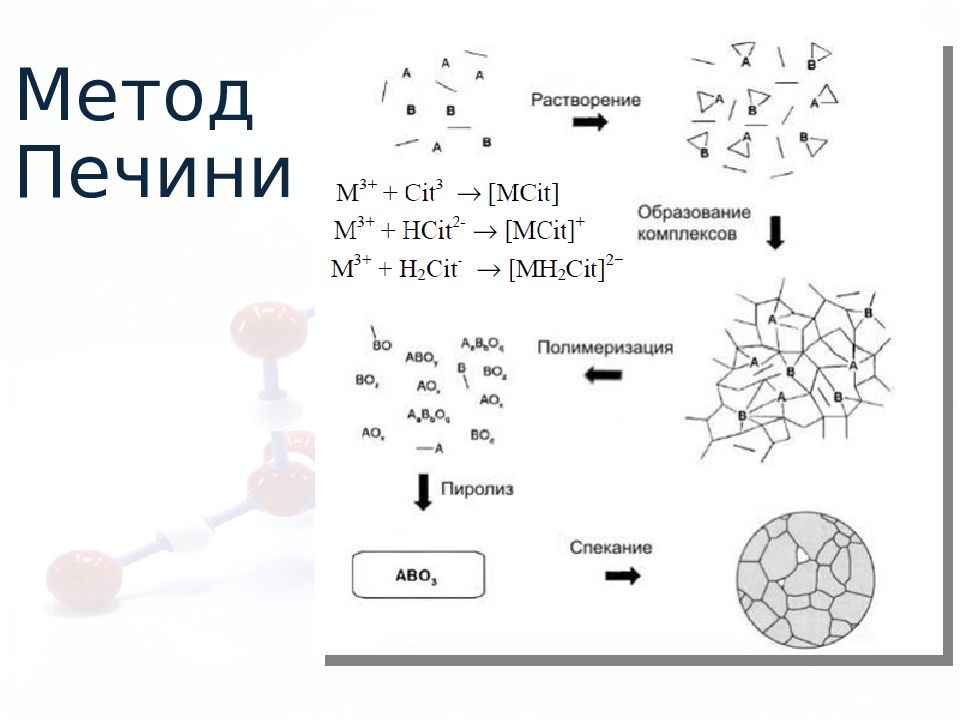
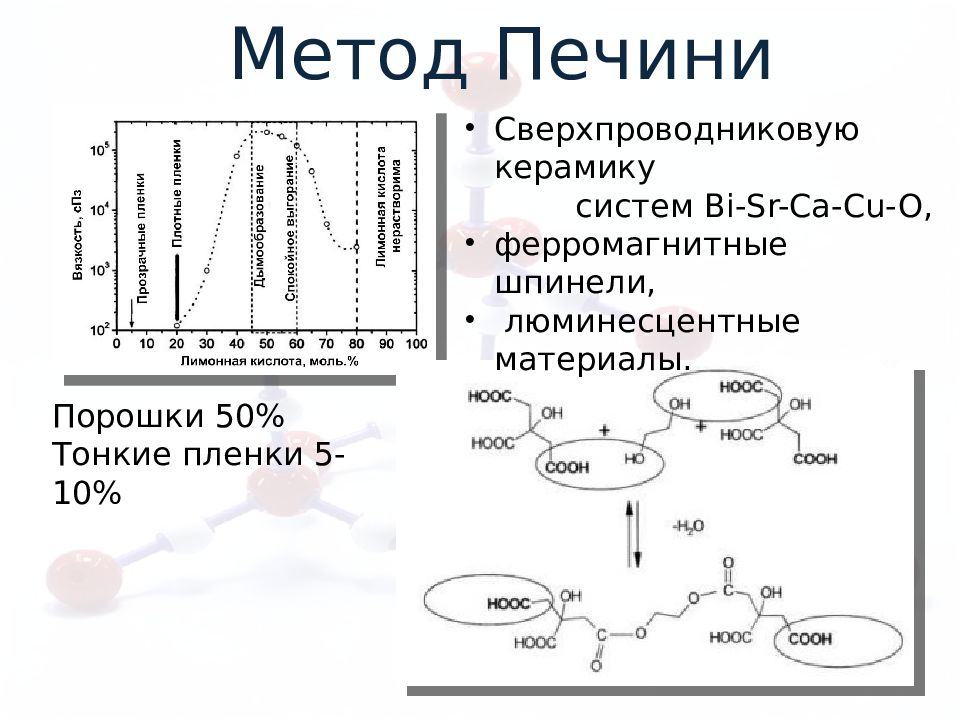
Метод Печини Порошки 50% Тонкие пленки 5-10% Сверхпроводниковую керамику систем Bi - Sr - Ca - Cu -O, ферромагнитные шпинели, люминесцентные материалы.
Слайд 23
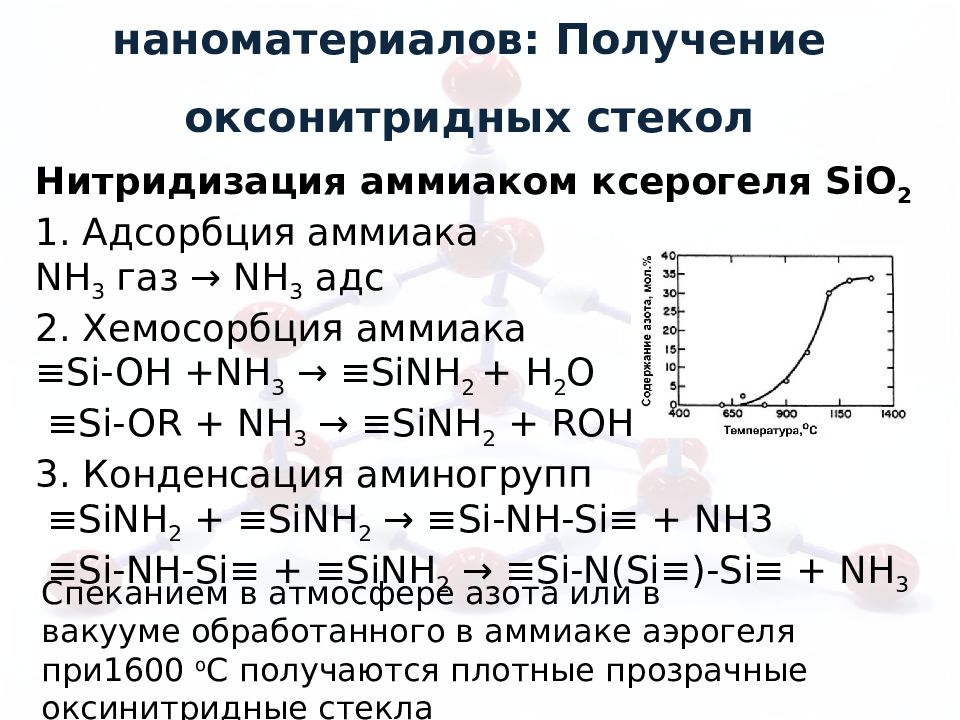
Синтез неоксидных наноматериалов: Получение оксонитридных стекол Нитридизация аммиаком ксерогеля SiO 2 1. Адсорбция аммиака NH 3 газ → NH 3 адс 2. Хемосорбция аммиака ≡ Si-OH +NH 3 → ≡SiNH 2 + H 2 O ≡Si-OR + NH 3 → ≡SiNH 2 + ROH 3. Конденсация аминогрупп ≡ SiNH 2 + ≡SiNH 2 → ≡Si-NH-Si≡ + NH3 ≡Si-NH-Si≡ + ≡SiNH 2 → ≡Si-N(Si≡)-Si≡ + NH 3 Спеканием в атмосфере азота или в вакууме обработанного в аммиаке аэрогеля при1600 о С получаются плотные прозрачные оксинитридные стекла
Слайд 24
Получение нитридов титана: NH 3 ↔ 1/2N 2 +3/2H 2 2TiO 2 + H 2 → Ti 2 O 3 + H 2 O Ti 2 O 3 + 2NH 3 → 2TiN + 3H 2 O Нитриды Al, Nb, W Получение нитридного волокна в качестве наполнителя композитных материалов Синтез неоксидных наноматериалов: Синтез нитридов
Слайд 26
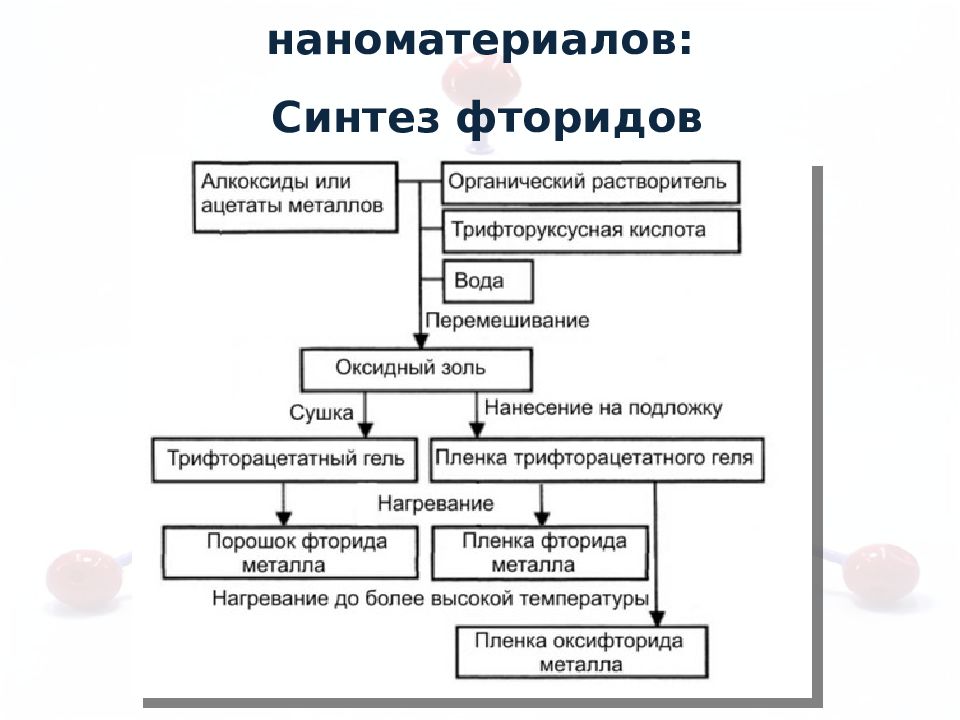
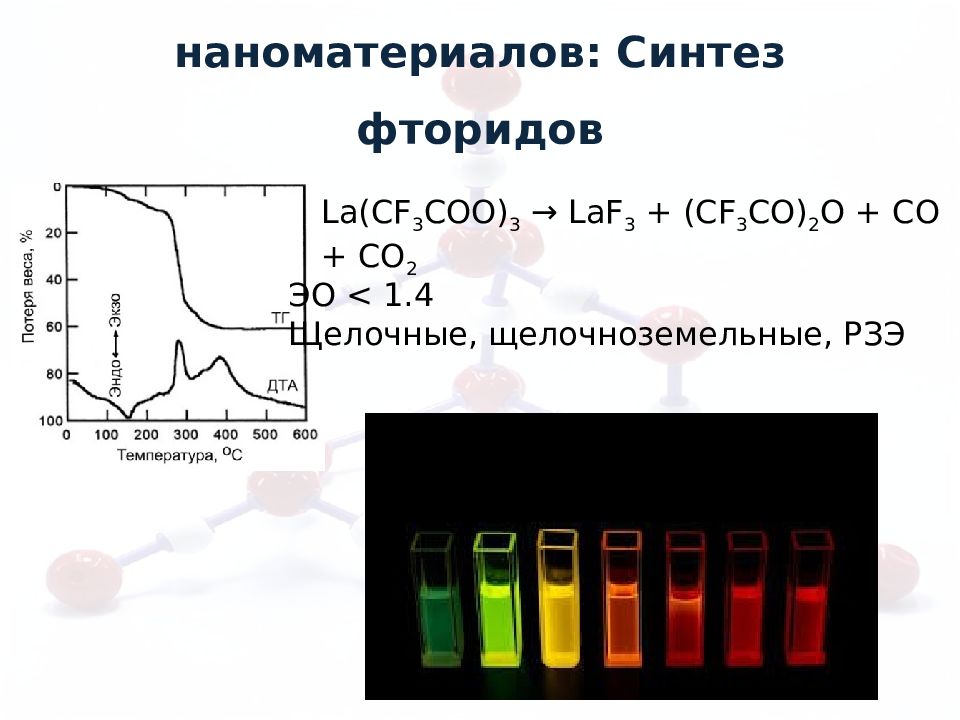
La(CF 3 COO) 3 → LaF 3 + (CF 3 CO) 2 O + CO + CO 2 ЭО < 1.4 Щелочные, щелочноземельные, РЗЭ Синтез неоксидных наноматериалов: Синтез фторидов
Слайд 27
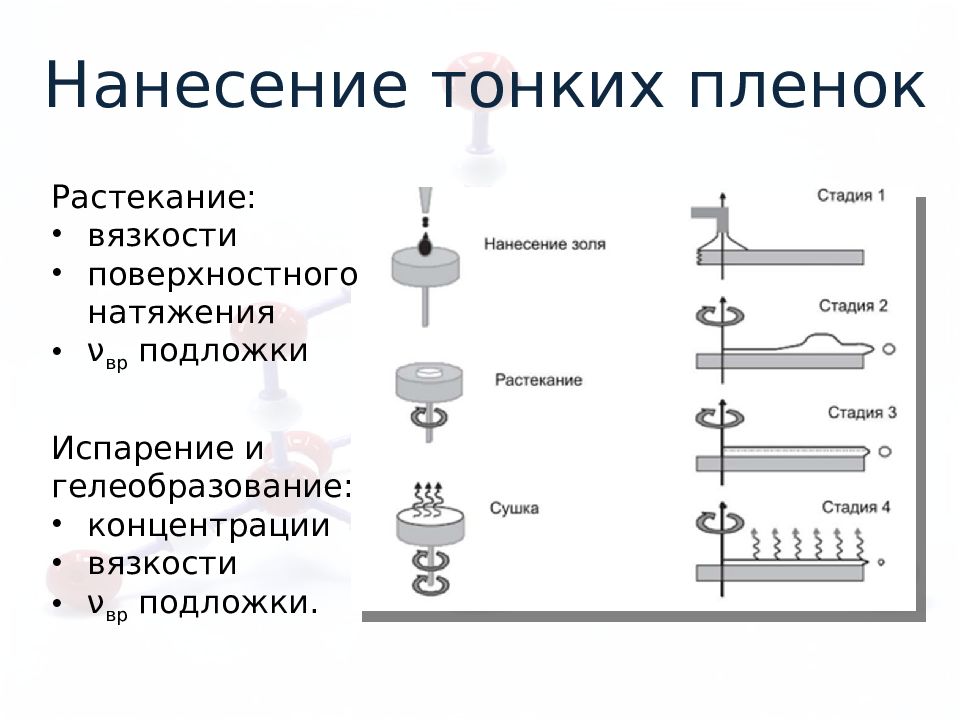
Нанесение тонких пленок Растекание: вязкости поверхностного натяжения ν вр подложки Испарение и гелеобразование: концентрации вязкости ν вр подложки.
Слайд 28
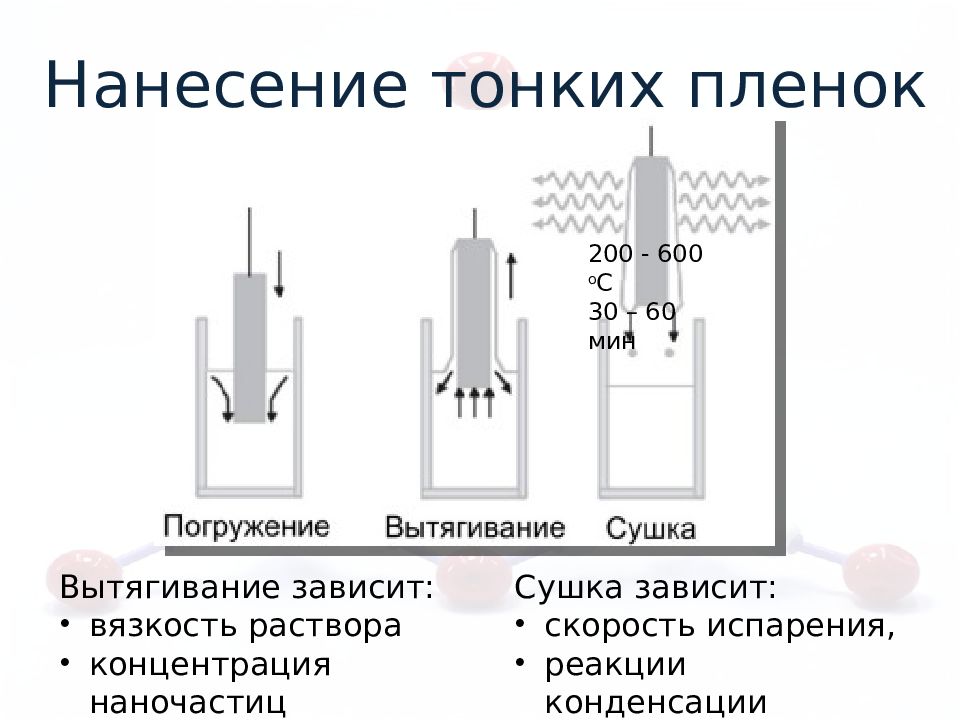
Нанесение тонких пленок Вытягивание зависит: вязкость раствора концентрация наночастиц Сушка зависит: скорость испарения, реакции конденсации 200 - 600 о С 30 – 60 мин
Слайд 29
Нанесение тонких пленок Плотные и пористые пленки для просветляющих покрытий, защитных и изолирующих слоев, газовых сенсоров, биосовместимых покрытий
Слайд 30
Толщина пленки BaTiO 3 от соотношения PVP/(i-C 3 H 7 O) 4 Ti 700 о С. Добавки к гелю, уменьшающие скорость конденсации: диэтаноламин, диолы, поливинилпирролидон ( PVP). Нанесение тонких пленок Трещины из-за изменения V при нагревании, реакциях конденсации, испарения растворителя