Первый слайд презентации
1 Лекция 7 Мицеллярные растворы ПАВ Солюбилизация Микроэмульсии Автор: Задымова Н.М.
Слайд 2
2 Мицеллярные растворы ПАВ как термодинамически устойчивые самоорганизованные системы
Слайд 3
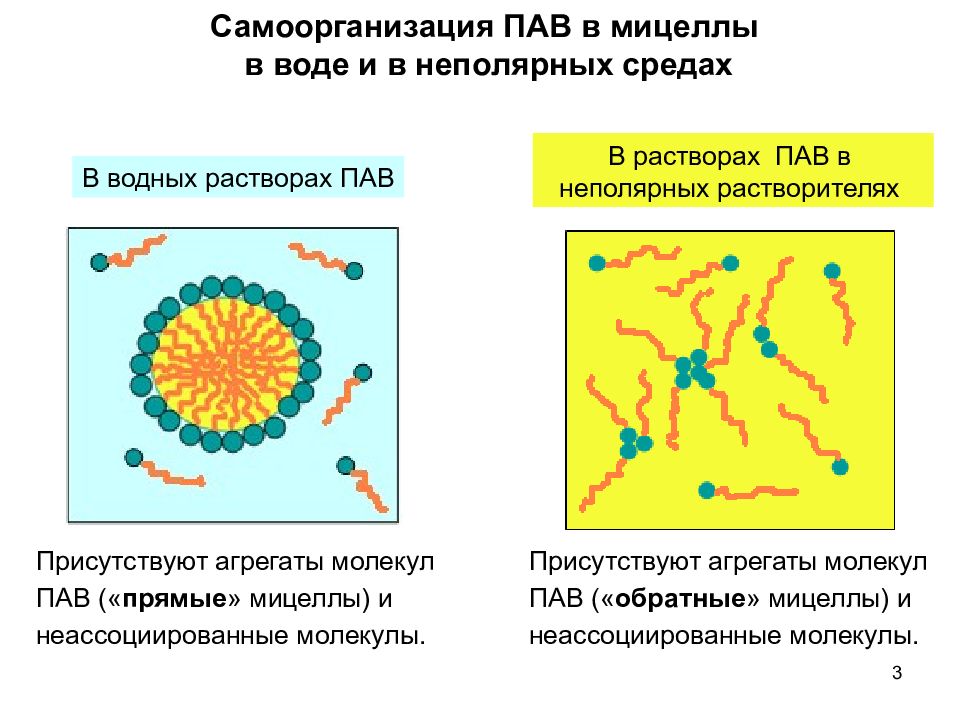
3 Самоорганизация ПАВ в мицеллы в воде и в неполярных средах В водных растворах ПАВ Присутствуют агрегаты молекул ПАВ (« прямые » мицеллы) и неассоциированные молекулы. В растворах ПАВ в неполярных растворителях Присутствуют агрегаты молекул ПАВ (« обратные » мицеллы) и неассоциированные молекулы.
Слайд 4
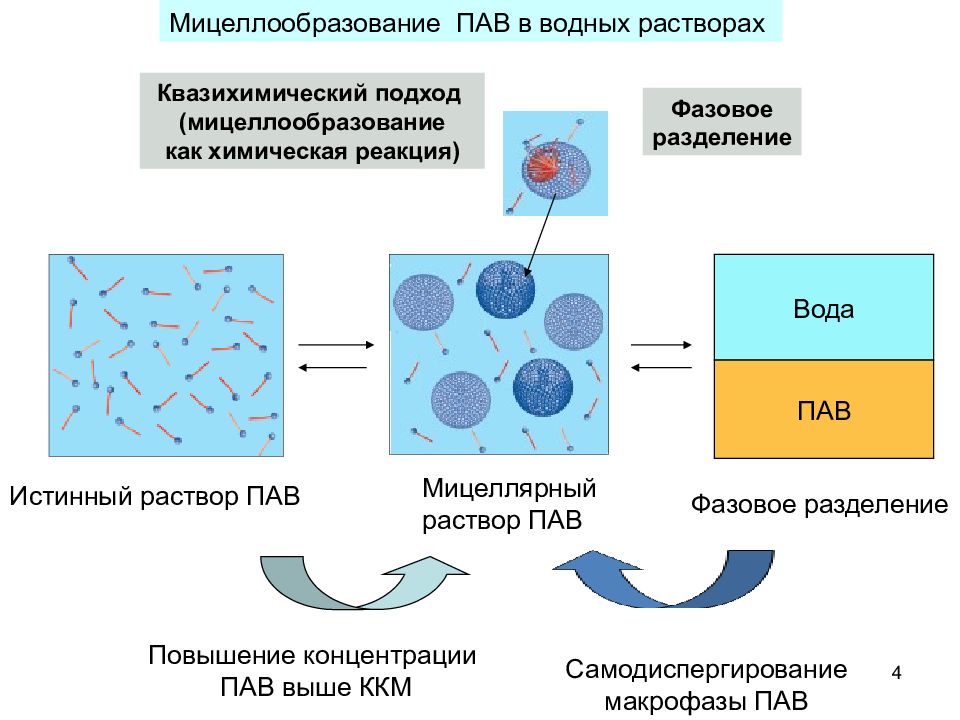
4 Вода ПАВ Истинный раствор ПАВ Мицеллярный раствор ПАВ Фазовое разделение Повышение концентрации ПАВ выше ККМ Самодиспергирование макрофазы ПАВ Квазихимический подход (мицеллообразование как химическая реакция) Фазовое разделение Мицеллообразование ПАВ в водных растворах
Слайд 5
5 Мицеллообразующие в водной среде ПАВ (ГЛБ 12 13) Углеводородная цепь ( R ) содержит от 8 до 18 атомов углерода Неионогенные ПАВ Анионные ПАВ Катионные ПАВ где OE – (OCH 2 CH 2 ) ; k, m варьируются от единиц до сотен R (O E ) k OH R (O E ) k NH 2 RС 6 H 4 O( OE ) k H R СOO( OE ) k H ( OE ) k ( CH 2 CHO ) m (OE) k CH 3 R COO – X + R OSO 3 – X + R SO 3 – X + RС 6 H 4 O SO 3 – X + RС 6 H 4 SO 3 – X + где Х + – Na +, K +, NH 4 + R NH 3 + X - R 2 NH 2 + X - R 3 NH + X - R N(CH 3 ) 3 + X - RC 5 H 4 N + X - где Х - Cl -, Br - ??
Слайд 6
6 Зависимости концентрации ПАВ в молекулярной ( С 1 ) и в мицеллярной ( С миц ф ) формах от общей концентрации ПАВ в растворе.
Слайд 7
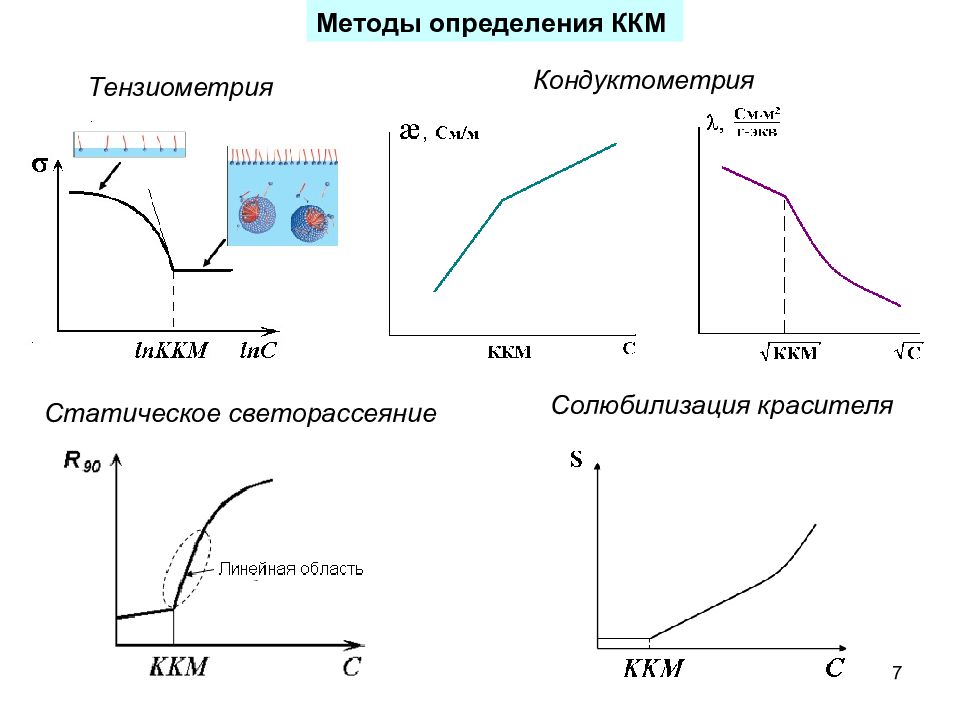
7 Методы определения ККМ Тензиометрия Кондуктометрия Статическое светорассеяние Солюбилизация красителя
Слайд 8
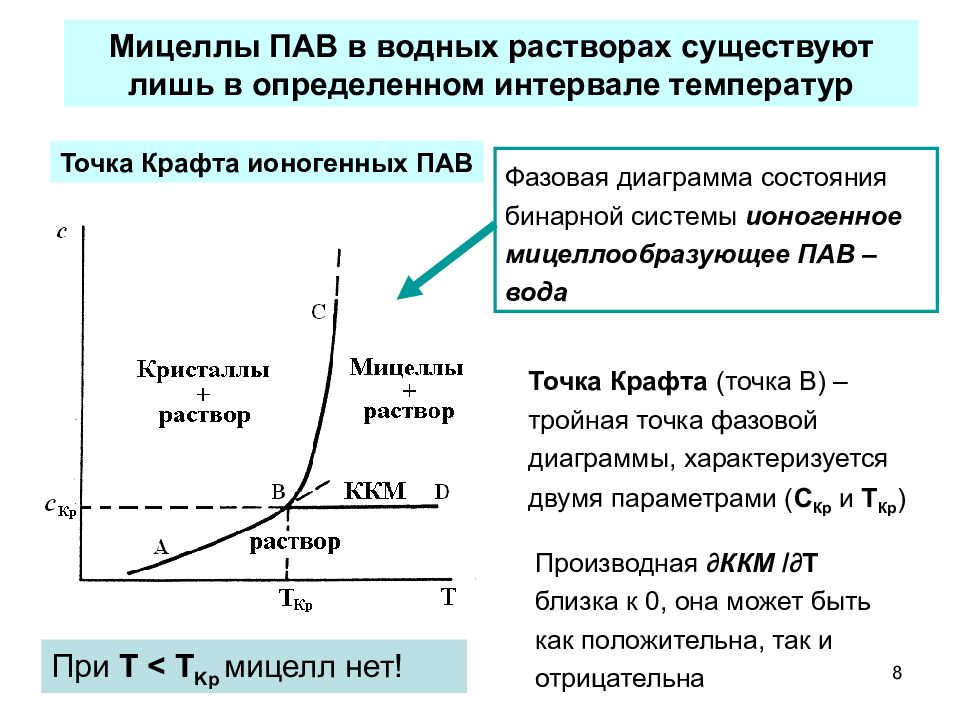
8 Производная ∂ ККМ /∂ T близка к 0, она может быть как положительна, так и отрицательна Мицеллы ПАВ в водных растворах существуют лишь в определенном интервале температур Точка Крафта (точка В) – тройная точка фазовой диаграммы, характеризуется двумя параметрами ( С Кр и Т Кр ) При Т < T Kp мицелл нет! Точка Крафта ионогенных ПАВ Фазовая диаграмма состояния бинарной системы ионогенное мицеллообразующее ПАВ – вода
Слайд 9
9 Для неионогенных полиоксиэтилированных ПАВ температурная область существования мицеллярных водных растворов ограничена сверху температурой помутнения ( Т П ), выше которой происходит фазовое разделение. Это следствие уменьшения растворимости НПАВ в воде из-за дегидратации оксиэтилированных звеньев дифильных молекул при повышении температуры, В качестве Т П принята температура помутнения 1 мас. % раствора неионогенных ПАВ. Т П растет с увеличением степени оксиэтилирования молекулы НПАВ. Температура помутнения
Слайд 10
10 Термодинамика мицеллообразования неионогенных ПАВ в водных растворах Рассмотрим мицеллообразование неионогенного ПАВ (НПАВ) с позиций квазихимического подхода, в котором мицеллы являются продуктом обратимой химической реакции: где М 1 – молекула НПАВ; М n – мицелла n – число молекул НПАВ в мицелле (число агрегации ) При условии равенства единице коэффициентов активности компонентов, константа равновесия данной реакции запишется так: где с m и с 1 – соответственно концентрация мицелл и концентрация неассоциированного НПАВ в растворе. (1) (2)
Слайд 11
11 В изобарно–изотермических условиях стандартная энергия Гиббса для данной реакции в расчете на 1 мицеллу : где k – константа Больцмана. Энергия Гиббса мицеллообразования в расчете на 1 моль ПАВ, находящегося в мицеллярной форме, с учетом того, что в 1 моле ассоциированного ПАВ содержится N A / n мицелл, можно выразить: можно пренебречь (3) (4)
Слайд 12
12 Таким образом: где ККМ и KKM c – соответственно критическая концентрация мицеллообразования, выраженная в мольных долях и в моль/л ; k 0 – коэффициент пересчета от мольных долей к молярной концентрации ПАВ. Поскольку концентрация ПАВ в растворе пренебрежимо мала по сравнению с концентрацией растворителя, поэтому k 0 можно считать равным молярной концентрации воды при данной температуре ( например, при 20ºС k 0 = w [ г/л ] / M w [ г/моль ] = 55,46 моль/л ). Важно : Уравнение (5) справедливо не только для водных растворов неионогенных ПАВ, но и для ионогенных ПАВ в присутствии избытка неорганического электролита, подавляющего диссоциацию. ( 5 ) 12
Слайд 13
13 Термодинамика мицеллообразования ионогенных ПАВ в водных растворах Как правило, мицеллообразующие ионогенные ПАВ являются 1:1 валентными электролитами.
Слайд 14
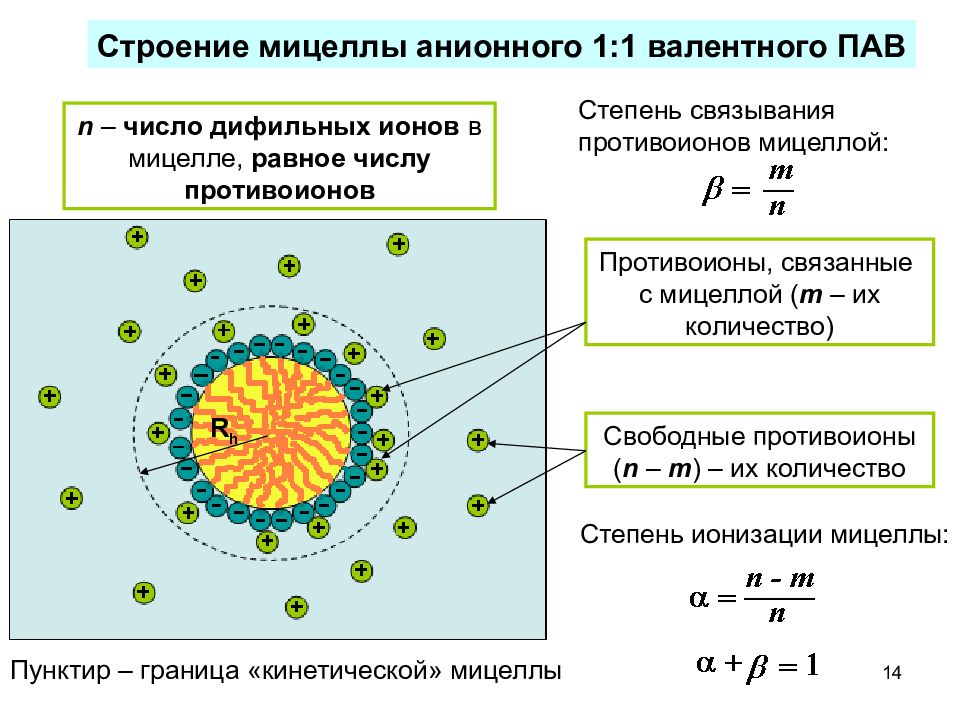
14 Противоионы, связанные с мицеллой ( m – их количество) Свободные противоионы ( n – m ) – их количество n – число дифильных ионов в мицелле, равное числу противоионов Строение мицеллы анионного 1:1 валентного ПАВ Степень ионизации мицеллы: Степень связывания противоионов мицеллой: Пунктир – граница «кинетической» мицеллы R h
Слайд 15
15 В рамках квазихимического подхода образование «кинетической мицеллы» может быть выражено следующей обратимой химической реакцией: где M – ион ПАВ; X – противоион. Константа равновесия этой обратимой реакции : где с m, с 1 и с 2 – соответственно концентрации мицелл, неассоциированных ионов ПАВ и неассоциированных противоионов; n – число дифильных ионов в мицелле; m – противоионы, связанные с мицеллой (6) ( 7 )
Слайд 16
16 Стандартная энергия Гиббса в расчете на 1 мицеллу запишется: В расчете на 1 моль мицеллярного ПАВ: можно пренебречь ( 8 ) ( 9 )
Слайд 17
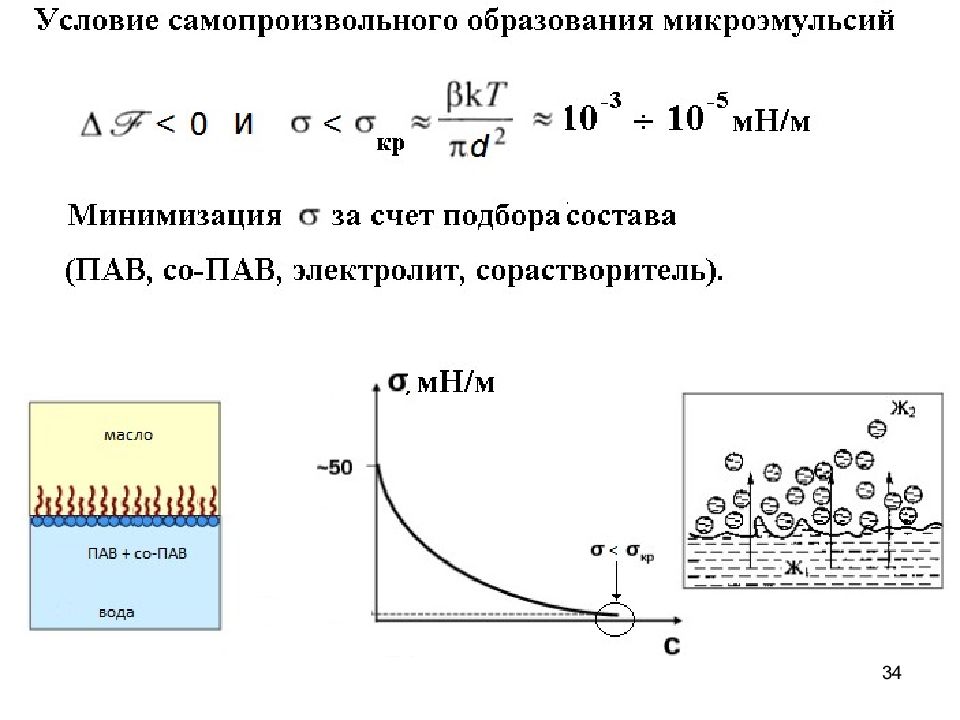
17 Важно : Для оценки G необходимо определить ККМ и (или ) Для широкого круга ионогенных ПАВ по данным кондуктометрии и статического рассеяния света при температуре 20–25ºС значения степени ионизации мицелл ( ) находятся в диапазоне 0,2 0,3. В итоге: ( 10 )
Слайд 18
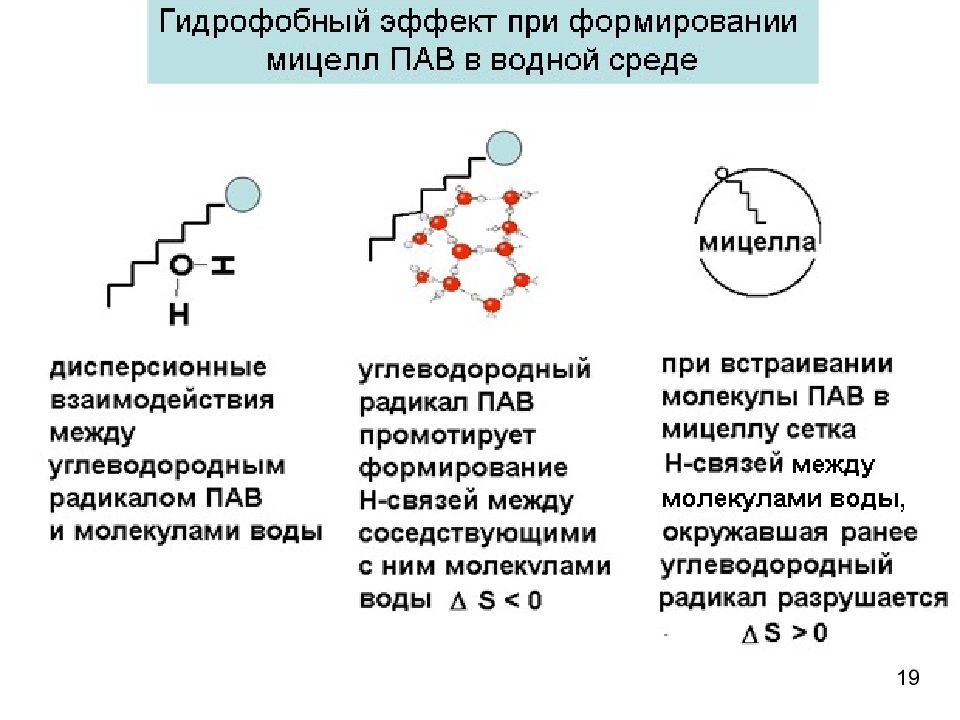
18 Причины самоорганизации ПАВ в мицеллы в водной среде Процесс самопроизвольный : Энтропийный характер процесса самоорганизации: Энтропия системы возрастает при мицеллообразовании вследствие гидрофобного эффекта, связанного с особенностями влияния гидрофобных частей молекул (ионов) ПАВ на структуру воды Аналогия с адсорбцией ПАВ из водных растворов
Слайд 20
20 Факторы, влияющие на мицеллообразование ПАВ в водных растворах Длина гидрофобной части молекулы ПАВ Природа полярной группы: Температура Неорганические электролиты Органические добавки, модифицирующие структуру воды
Слайд 23
23 Влияние длины цепи ионогенных ПАВ на ККМ Эксперимент : для 1-1 валентных ПАВ ККМ уменьшается примерно в 2 раза при переходе к более диннноцепочечному гомологу:
Слайд 24
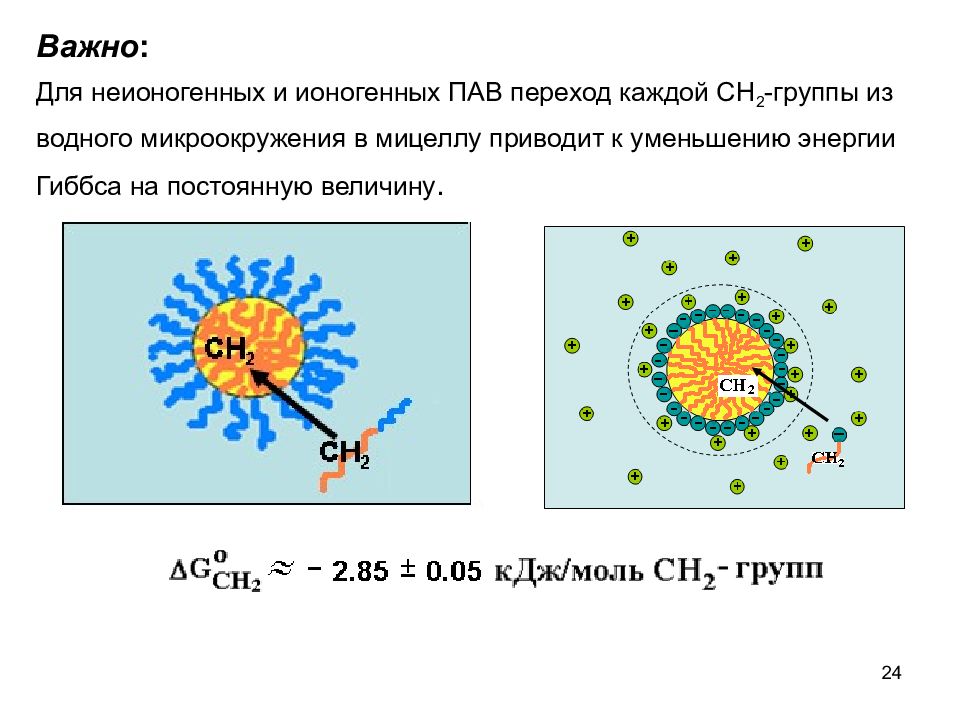
24 Важно : Для неионогенных и ионогенных ПАВ переход каждой СН 2 -группы из водного микроокружения в мицеллу приводит к уменьшению энергии Гиббса на постоянную величину.
Слайд 25
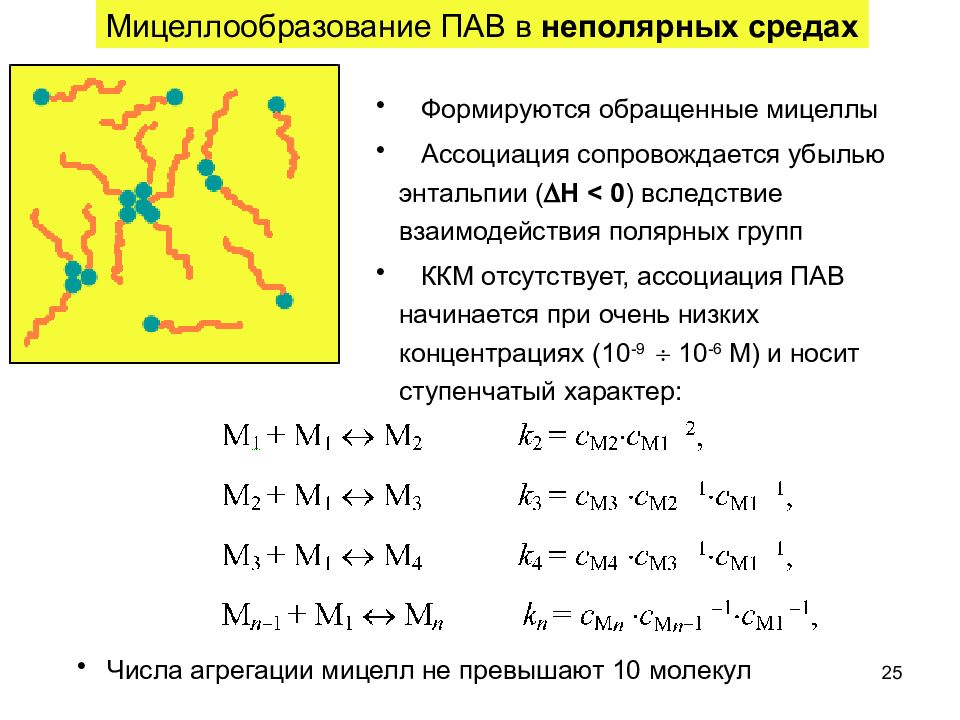
25 Мицеллообразование ПАВ в неполярных средах Формируются обращенные мицеллы Ассоциация сопровождается убылью энтальпии ( Н < 0 ) вследствие взаимодействия полярных групп ККМ отсутствует, ассоциация ПАВ начинается при очень низких концентрациях (10 -9 10 -6 М) и носит ступенчатый характер: Числа агрегации мицелл не превышают 10 молекул
Слайд 26
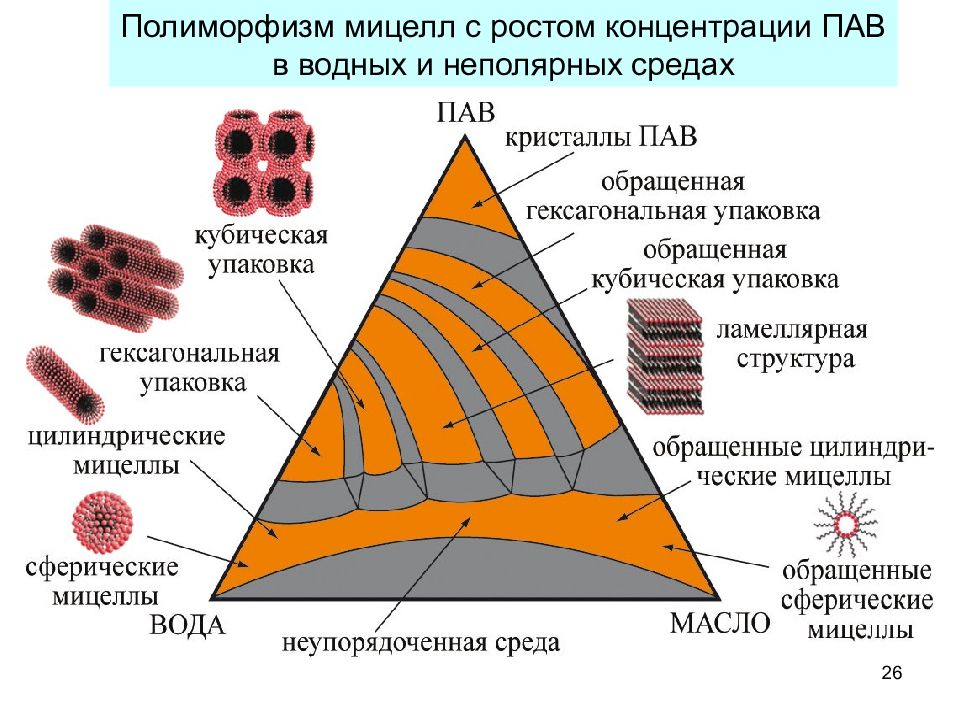
26 Полиморфизм мицелл с ростом концентрации ПАВ в водных и неполярных средах
Слайд 27
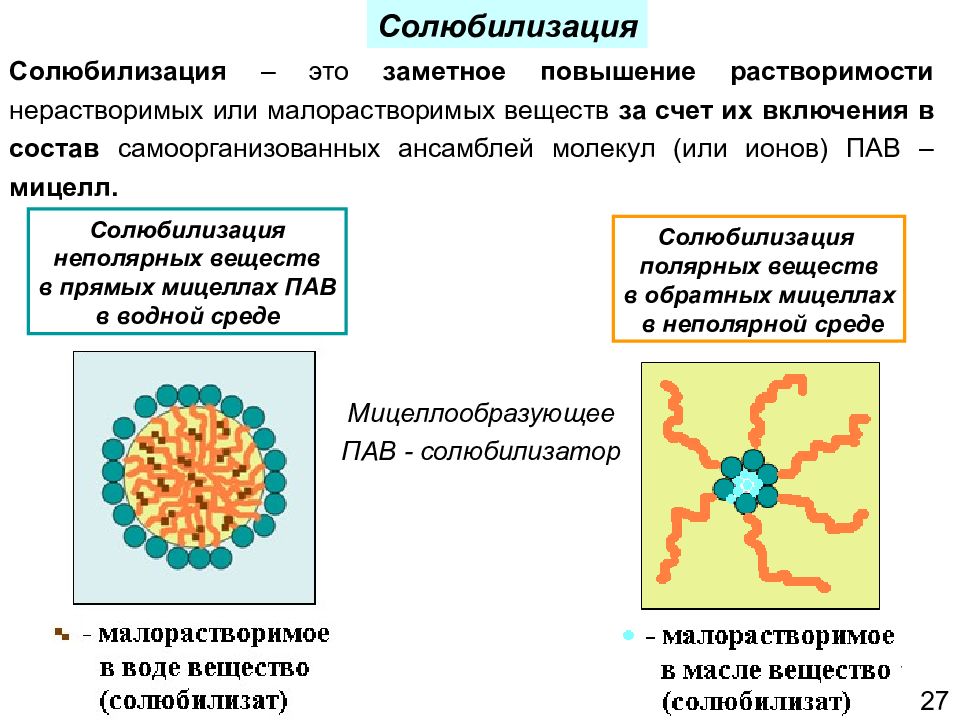
27 Солюбилизация – это заметное повышение растворимости нерастворимых или малорастворимых веществ за счет их включения в состав самоорганизованных ансамблей молекул (или ионов) ПАВ – мицелл. Солюбилизация неполярных веществ в прямых мицеллах ПАВ в водной среде Солюбилизация полярных веществ в обратных мицеллах в неполярной среде Мицеллообразующее ПАВ - солюбилизатор Солюбилизация 27
Слайд 28
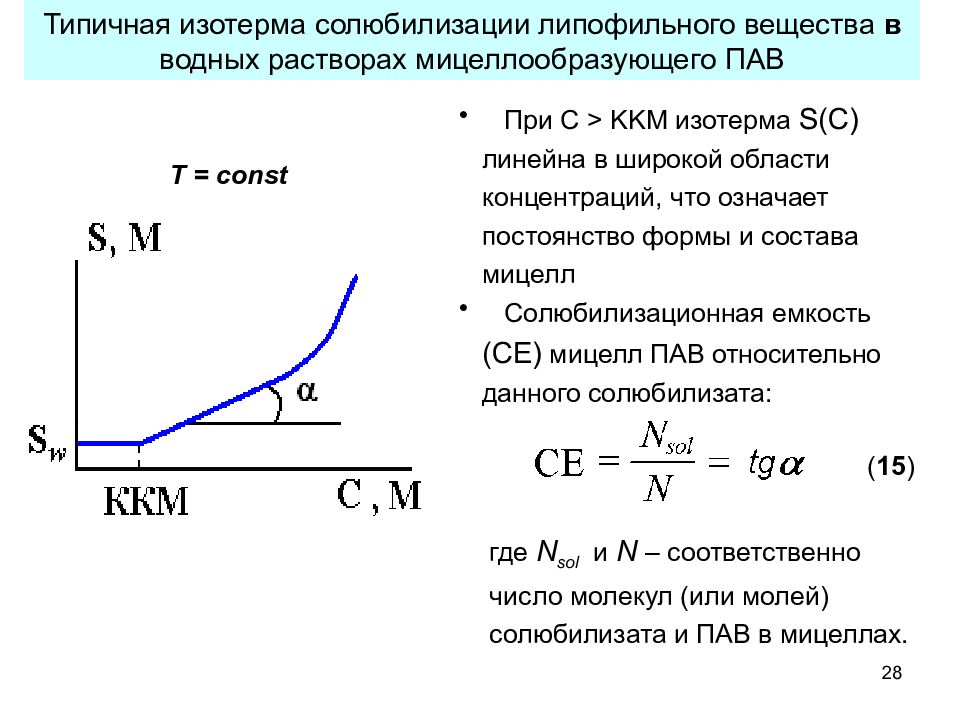
28 Типичная изотерма солюбилизации липофильного вещества в водных растворах мицеллообразующего ПАВ Т = const При С > KKM изотерма S(C ) линейна в широкой области концентраций, что означает постоянство формы и состава мицелл Солюбилизационная емкость (СЕ) мицелл ПАВ относительно данного солюбилизата: где N sol и N – соответственно число молекул (или молей) солюбилизата и ПАВ в мицеллах. ( 15 )
Слайд 29
29 Используется «фазовый» подход: мицеллы рассматриваются как высокодисперсная фаза (т.е. как «псевдофаза») Стандартной энергия Гиббса солюбилизации : Термодинамика солюбилизации олеофильных веществ в мицеллах ПАВ в водной среде где К sol - константа распределения солюбилизата между мицеллярной «псевдофазой» и водной средой (т.е. водным раствором неассоциированного ПАВ, имеющим концентрацию порядка ККМ): где Х m sol и X w sol соответственно мольные доли солюбилизата в мицеллах и в водной среде. (16) (17)
Слайд 30
30 Мольная доля солюбилизата в мицелле: В домицеллярной области растворимость солюбилизата слабо зависит от концентрации ПАВ и примерно равна его растворимости в воде ( S w, моль/л ), значение X w sol определяется из соотношения: k 0 – коэффициент пересчета, равный количеству молей воды в 1 л (55.4 моль/л при 25 С). (18) (19) Стандартная энергия Гиббса солюбилизации с учетом уравнений 16 19 выражается следующим образом: (20)
Слайд 31
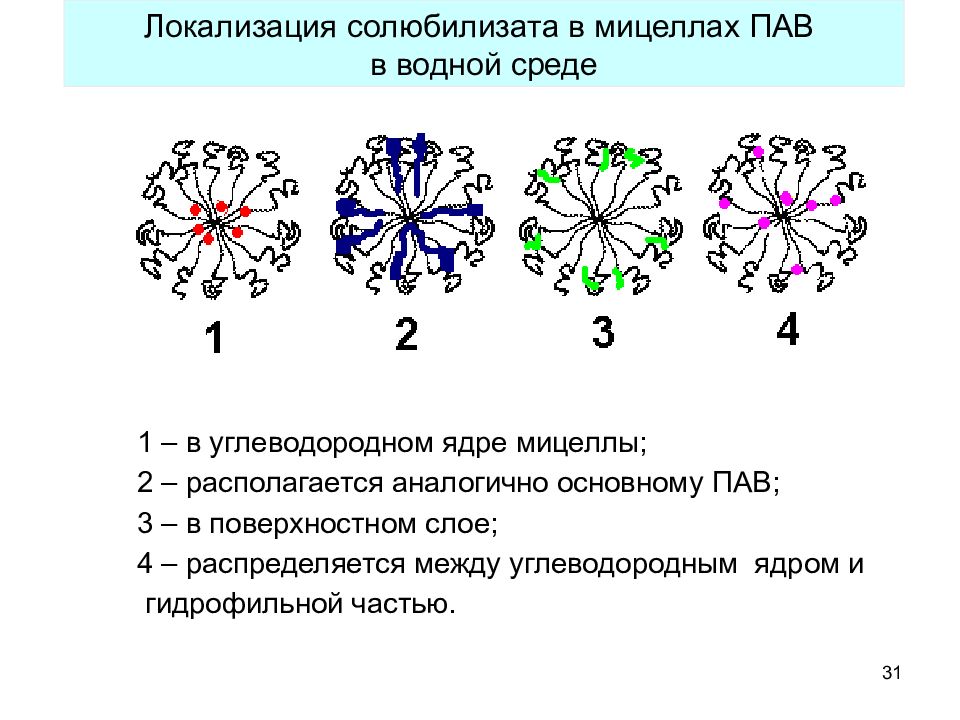
31 1 – в углеводородном ядре мицеллы; 2 – располагается аналогично основному ПАВ; 3 – в поверхностном слое; 4 – распределяется между углеводородным ядром и гидрофильной частью. Локализация солюбилизата в мицеллах ПАВ в водной среде
Слайд 32
32 Важно: солюбилизация в водных растворах ПАВ в основном имеет энтропийный характер, обусловленный гидрофобным эффектом. В ряде случаев, когда солюбилизат локализован в полярной части мицеллы вследствие специфических взаимодействий, вклад энтальпии также может быть существенным. В присутствии солюбилизата величина ККМ ПАВ может уменьшаться.
Слайд 33
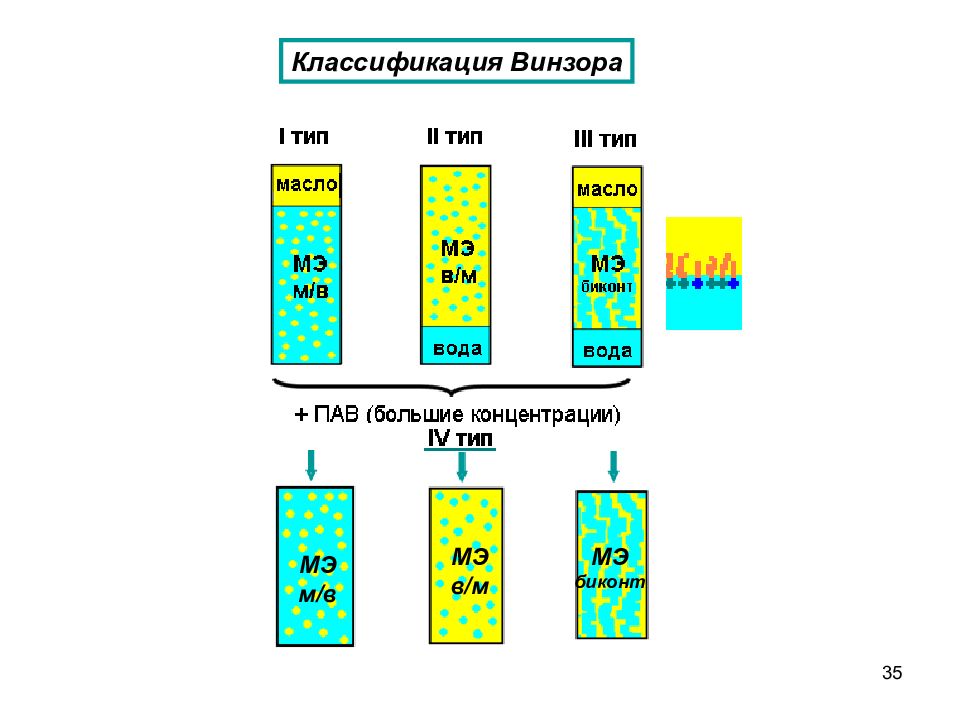
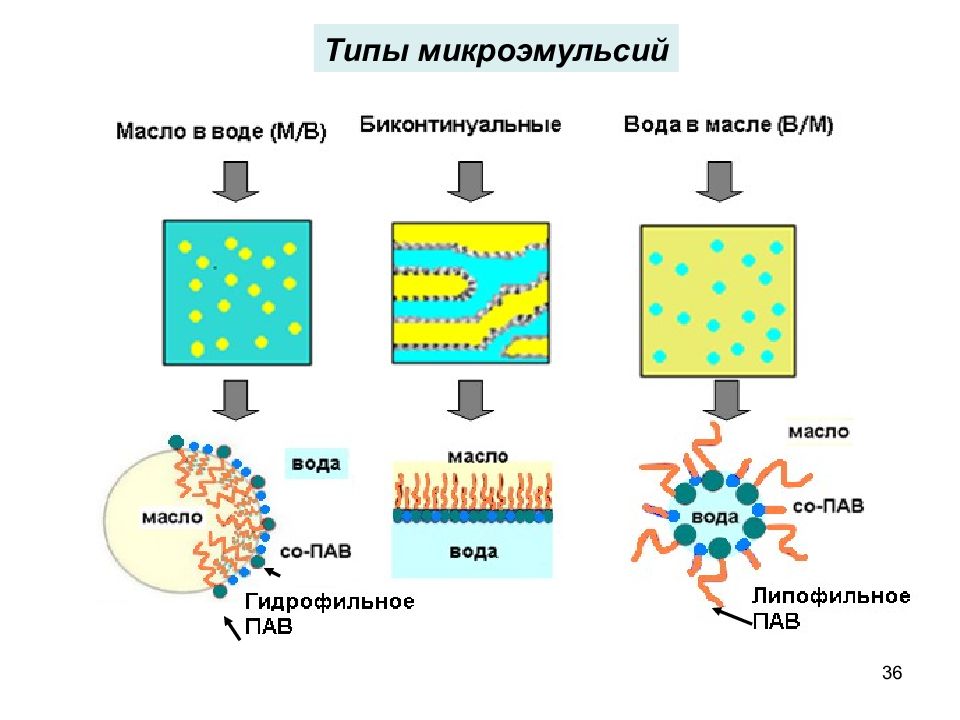
33 Микроэмульсии – термодинамически устойчивые оптически прозрачные (или слегка опалесцирующие) многокомпонентные дисперсные системы на основе жидкостей с ограниченной взаимной растворимостью (масла и воды) и стабилизированные ПАВ и со-ПАВ Диаметр капель микроэмульсии находится в диапазоне 10 100 нм Микроэмульсии характеризуются ультранизкими значениями межфазного натяжения на границе раздела дисперсная фаза/дисперсионная среда, большой площадью удельной поверхности ( до нескольких сотен м 2 /г) и высокой солюбилизационной емкостью относительно полярных и неполярных веществ Микроэмульсии как термодинамически устойчивые дисперсные системы
Слайд 37
37 Структура микроэмульсий и размер частиц Просвечивающая электронная микроскопия Капельный тип МЭ Биконтинуальный тип МЭ Сканирующая электронная микроскопия
Слайд 38
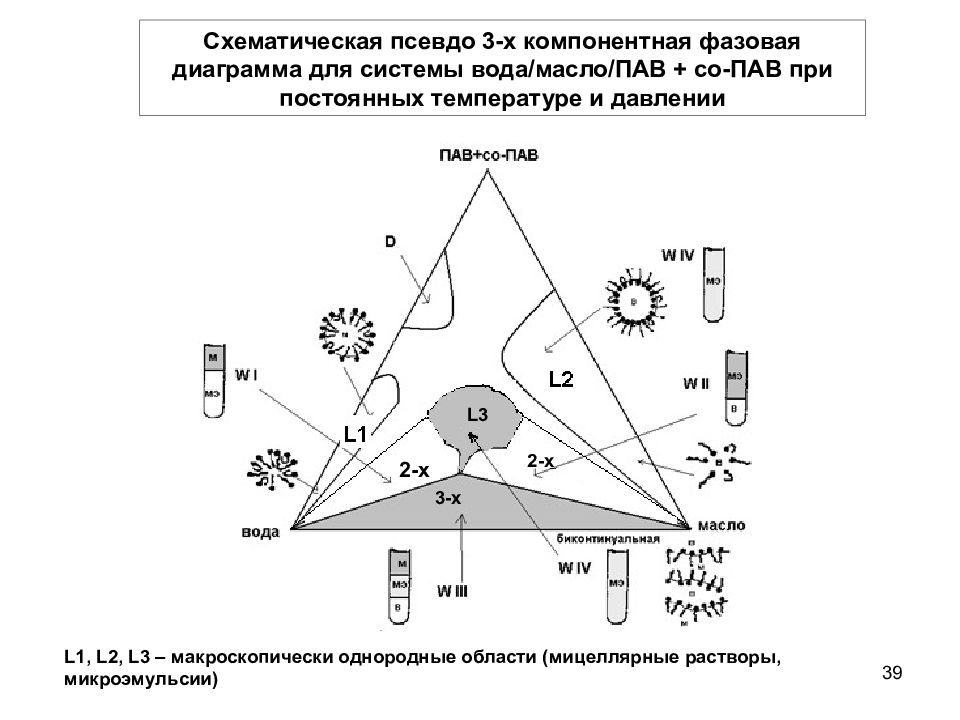
38 Фазовое состояние микроэмульсионных систем В основе описания фазового состояния – равносторонний треугольник, каждая вершина которого соответствует индивидуальному компоненту 3-х компонентной системы Для микроэмульсий, содержащих более 3-х компонентов, строят псевдо-трехкомпонентные фазовые диаграммы, считая одним компонентом смесь двух компонентов определенного состава, например: ПАВ + со-ПАВ, вода + электролит, масло + со-ПАВ или масло + со-растворитель и т.д.
Слайд 39
39 L3 2-x 2-x 3-x L1, L2, L3 – макроскопически однородные области (мицеллярные растворы, микроэмульсии) Схематическая псевдо 3-х компонентная фазовая диаграмма для системы вода/масло/ПАВ + со-ПАВ при постоянных температуре и давлении
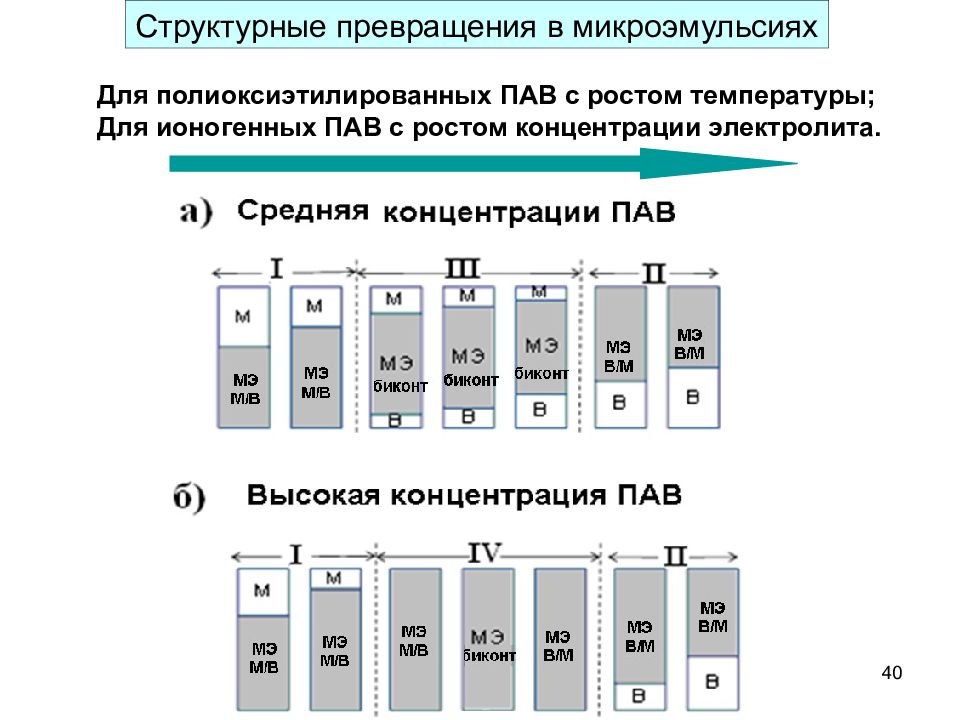
Слайд 40
40 Структурные превращения в микроэмульсиях Для полиоксиэтилированных ПАВ с ростом температуры; Для ионогенных ПАВ с ростом концентрации электролита.
Слайд 41
41 Рекомендованная литература: Практикум по коллоидной химии: Учебное пособие для вузов / Под ред. В.Г. Куличихина. М.: Вузовский учебник: ИНФРА-М, 2012 или 2014. Глава 6, стр. 141-172. Коллоидная химия. Е.Д. Щукин, А.В. Перцов, Е.А. Амелина. М.: Высш. шк., неоднократно переиздан, глава 6, параграфы 2 и 3. Со следующей недели чтение курса лекций по коллоидной химии продолжит профессор Зоя Николаевна Скворцова