Первый слайд презентации: АЛКАНЫ (предельные углеводороды ряда метана, парафины)
Презентация к уроку химии в 10 классе. Учитель химии МБОУ СОШ № 3 г. Светлого Калининградской обл. Ракович Лариса Викторовна
Слайд 2: НАХОЖДЕНИЕ АЛКАНОВ В ПРИРОДЕ
Слайд 3: НАХОЖДЕНИЕ В КОСМОСЕ
В небольших количествах алканы содержатся в атмосфере планет Солнечной системы: на Юпитере — 0,1% метана, 0,0002% этана, на Сатурне метана 0,2%, а этана — 0,0005%, метана и этана, на Уране — соответственно 1,99% и 0,00025%, на Нептуне же — 1,5% и 1,5·10 -10 %. На спутнике Сатурна Титане метан (1,6%) содержится в жидком виде, причем, подобно воде, находящейся на Земле. Кроме того, метан найден в хвосте кометы Хиякутаке и в метеоритах. Предполагается также, что метановые и этановые кометные льды образовались в межзвёздном пространстве. Комета Хиякутаке Сатурн Юпитер Уран 3
Слайд 4: НАХОЖДЕНИЕ НА ЗЕМЛЕ
В земной атмосфере метан присутствует в очень небольших количествах (около 0,0001%), он производится некоторыми архебактериями, в частности, находящимися в кишечном тракте крупного рогатого скота. Промышленное значение имеют месторождения низших алканов в форме природного газа, нефти и, вероятно, в будущем — газовых гидратов (найдены в областях вечной мерзлоты и под океанами). Также метан содержится в биогазе. 4 Добыча газа Добыча нефти
Слайд 5: НАХОЖДЕНИЕ НА ЗЕМЛЕ
Высшие алканы содержатся в кутикуле растений, предохраняя их от высыхания, паразитных грибков и мелких растительноядных тварей. Это обыкновенно цепи с нечётным числом атомов углерода. Среди животных алканы встречаются в качестве феромонов у насекомых, в частности у мухи цеце. Некоторые орхидеи при помощи алканов-феромонов привлекают опылителей. 5
Слайд 7
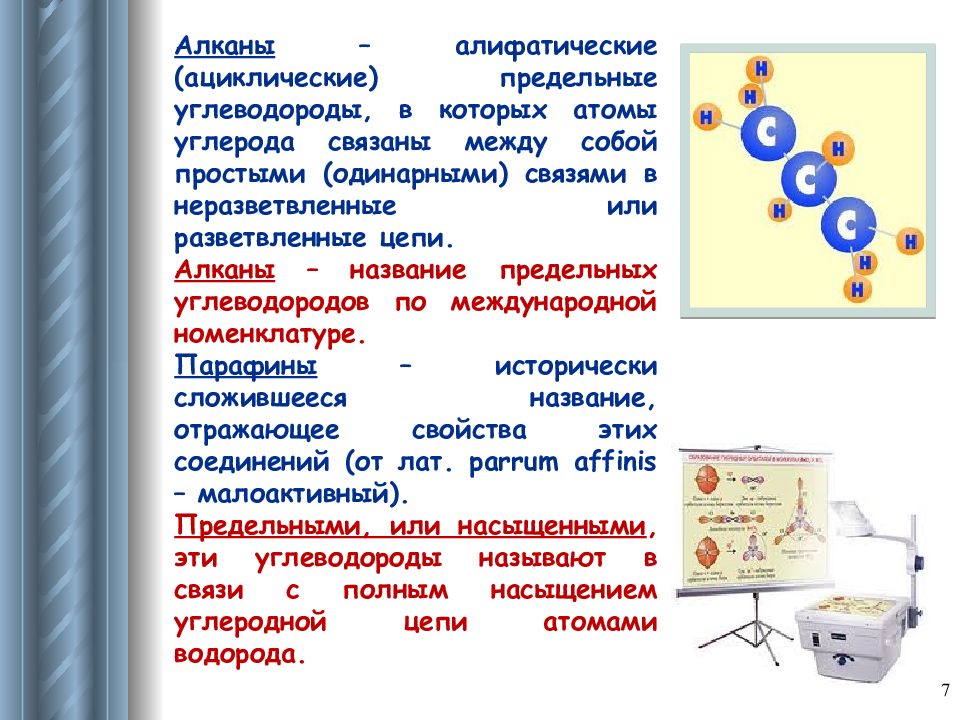
Алканы – алифатические (ациклические) предельные углеводороды, в которых атомы углерода связаны между собой простыми (одинарными) связями в неразветвленные или разветвленные цепи. Алканы – название предельных углеводородов по международной номенклатуре. Парафины – исторически сложившееся название, отражающее свойства этих соединений (от лат. parrum affinis – малоактивный). Предельными, или насыщенными, эти углеводороды называют в связи с полным насыщением углеродной цепи атомами водорода. 7
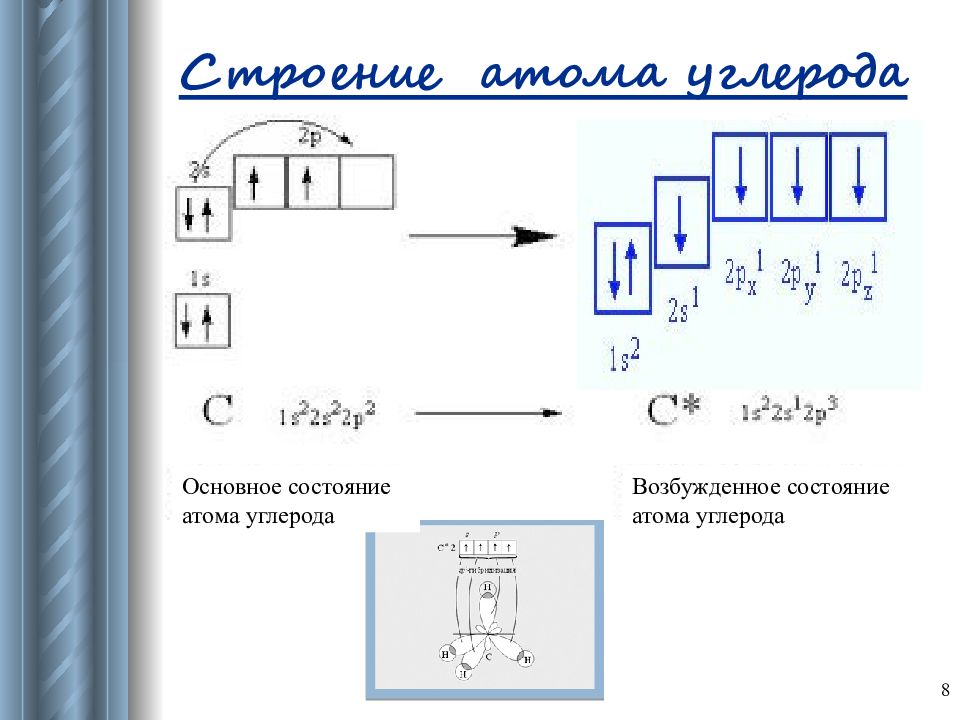
Слайд 8: Строение атома углерода
8 Возбужденное состояние атома углерода Основное состояние атома углерода
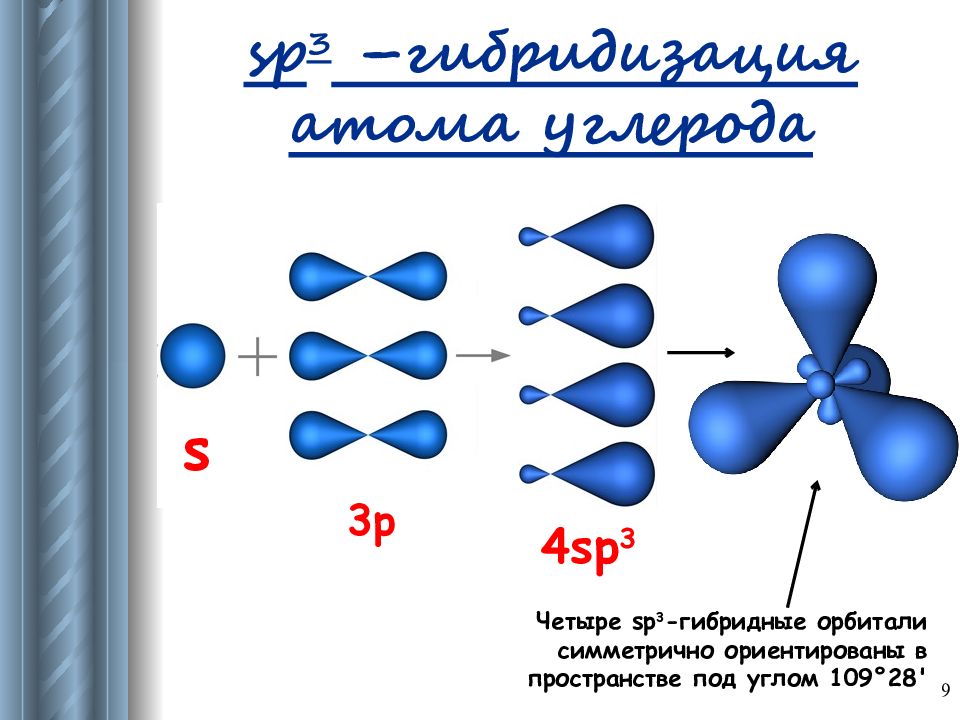
Слайд 9: sp 3 – гибридизация атома углерода
s 3p 4sp 3 Четыре sp 3 -гибридные орбитали симметрично ориентированы в пространстве под углом 109°28' 9
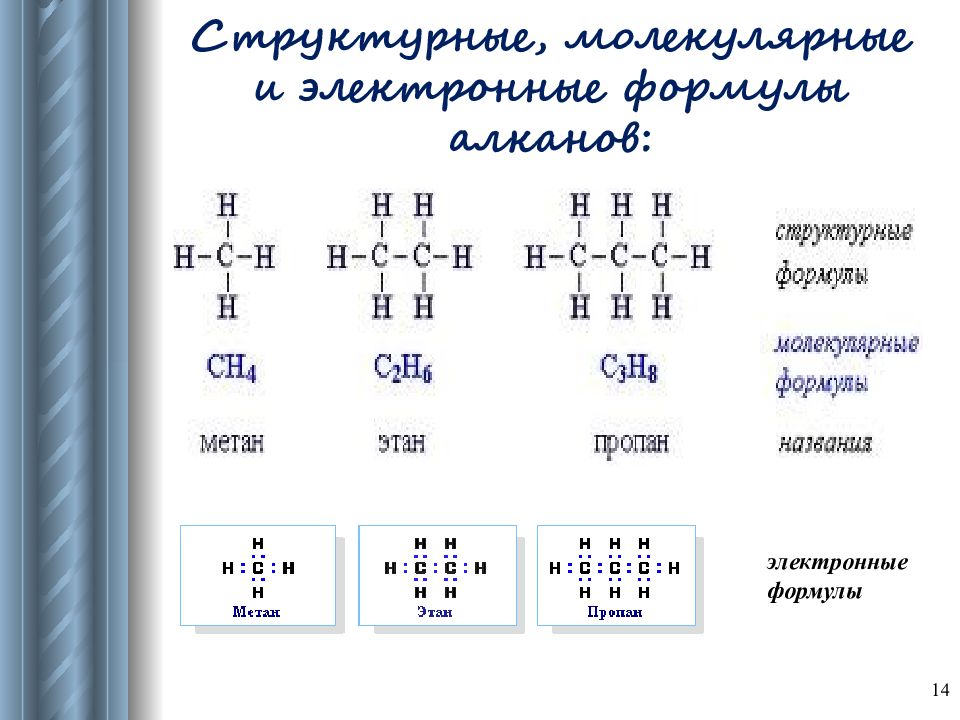
Слайд 14: Структурные, молекулярные и электронные формулы алканов :
электронные формулы Структурные, молекулярные и электронные формулы алканов : 14
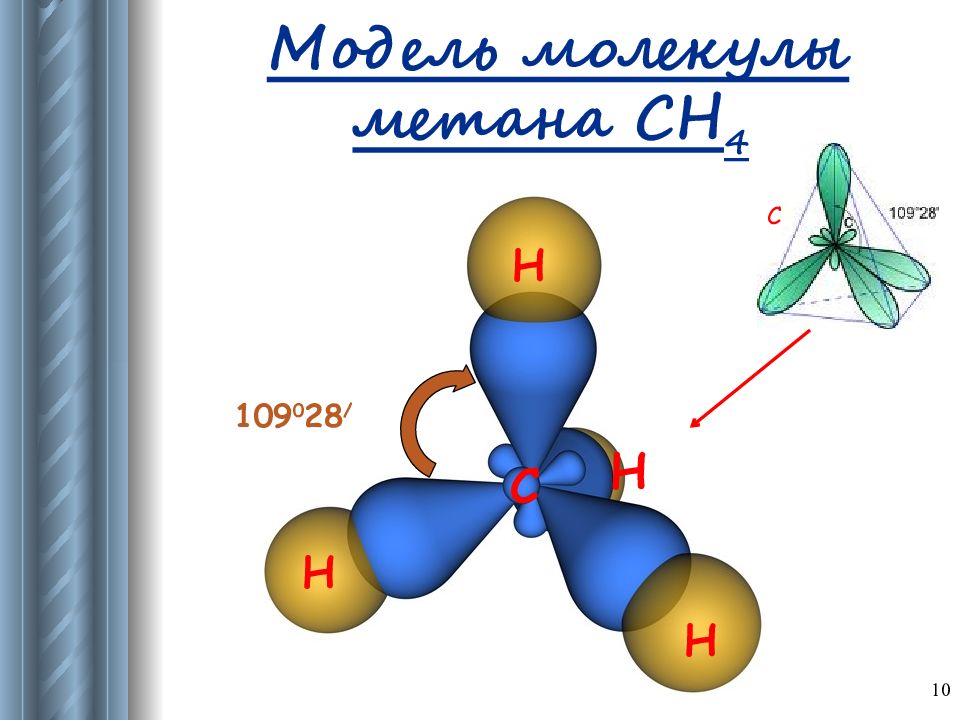
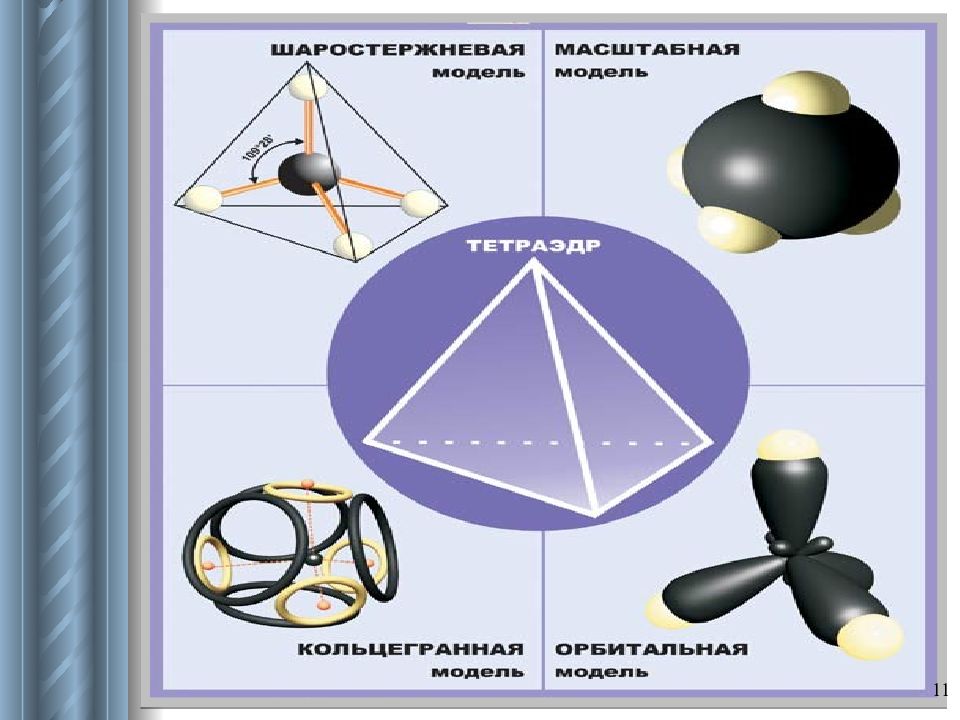
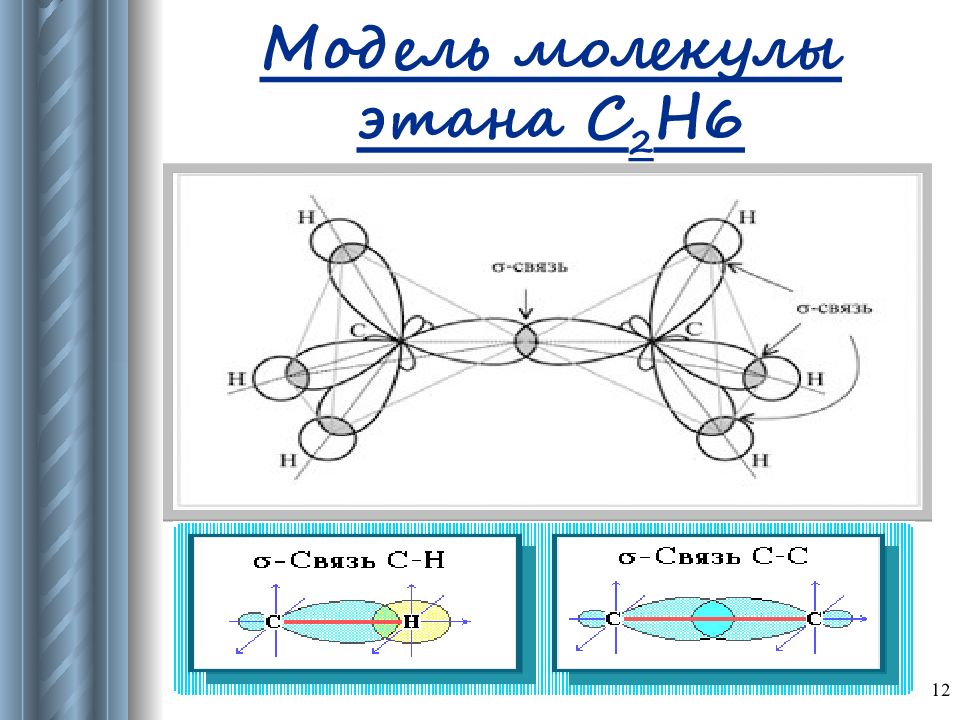
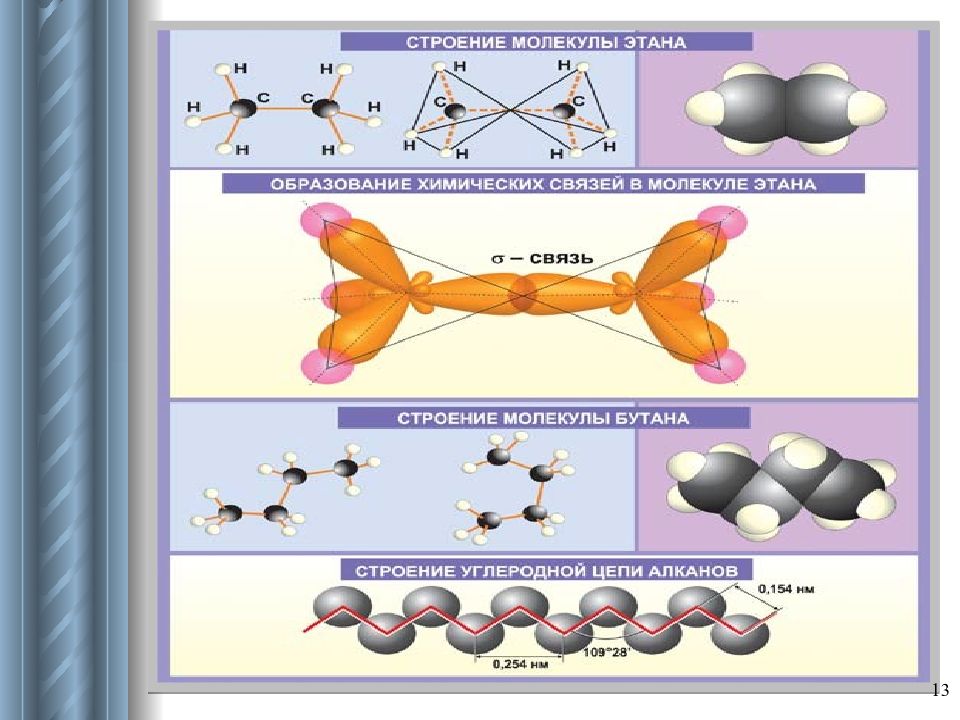
Слайд 15: Характеристика строения алканов
15 Тетраэдрическое строение молекул Валентный угол : α = 109 0 28 ʹ Длина связи: λ с-с = 0,154 нм Связи и их особенности: σ -связи прочные, трудно поляризуемые; возможно свободное вращение вокруг σ -связи. Пространственное строение: могут образовывать пространственные формы.
Слайд 17
17 Существуют углеродистые соединения выполняющие те же химические отправления, следующие тем же законам метаморфоз и содержащие тоже количество элементов: водорода, кислорода, хлора, азота и т.д. увеличенных или уменьшенных на СН 2. Я называю их гомологическими телами. Шарль Жерар
Слайд 18: Основные определения
18 Ряд соединений, в котором каждый последующий член отличается от предыдущего на одну и ту же величину, группу СН 2, называется гомологическим рядом. Каждый член гомологического ряда по отношению к предыдущим или последующим членам будет являться гомологом. Сама группа СН 2 называется гомологической разницей.
Слайд 19
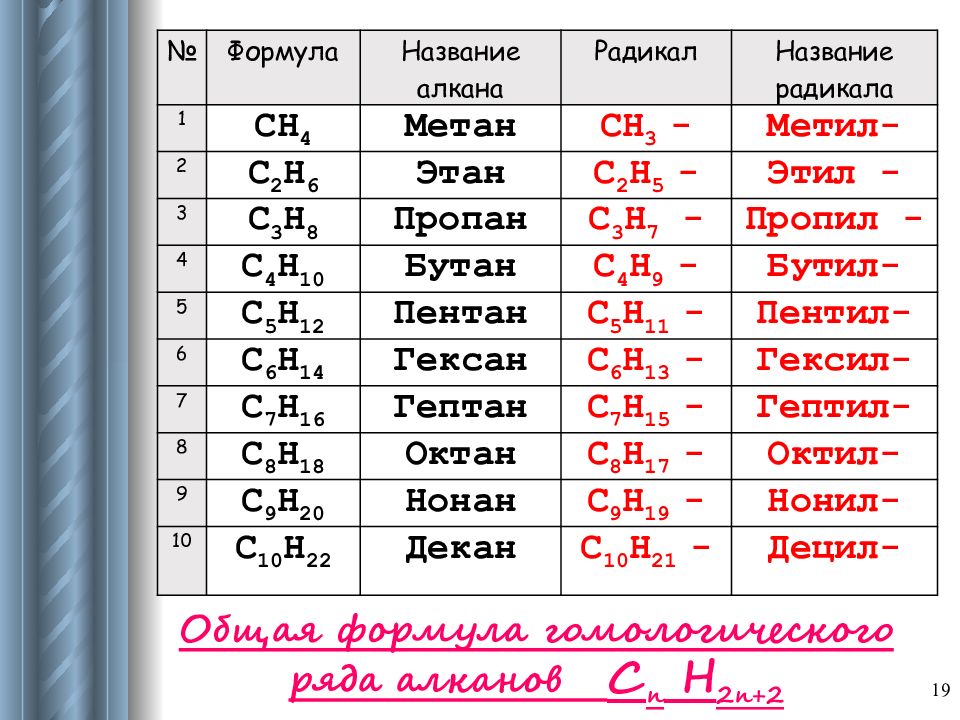
№ Формула Название алкана Радикал Название радикала 1 CH 4 Метан CH 3 - Метил- 2 C 2 H 6 Этан C 2 H 5 - Этил - 3 C 3 H 8 Пропан C 3 H 7 - Пропил - 4 C 4 H 10 Бутан C 4 H 9 - Бутил- 5 C 5 H 12 Пентан C 5 H 11 - Пентил- 6 C 6 H 14 Гексан C 6 H 13 - Гексил- 7 C 7 H 16 Гептан C 7 H 15 - Гептил- 8 C 8 H 18 Октан C 8 H 17 - Октил- 9 C 9 H 20 Нонан C 9 H 19 - Нонил- 10 C 10 H 22 Декан C 10 H 2 1 - Децил - Общая формула гомологического ряда алканов С n H 2n+2 19
Слайд 21: ПОВТОРИМ!
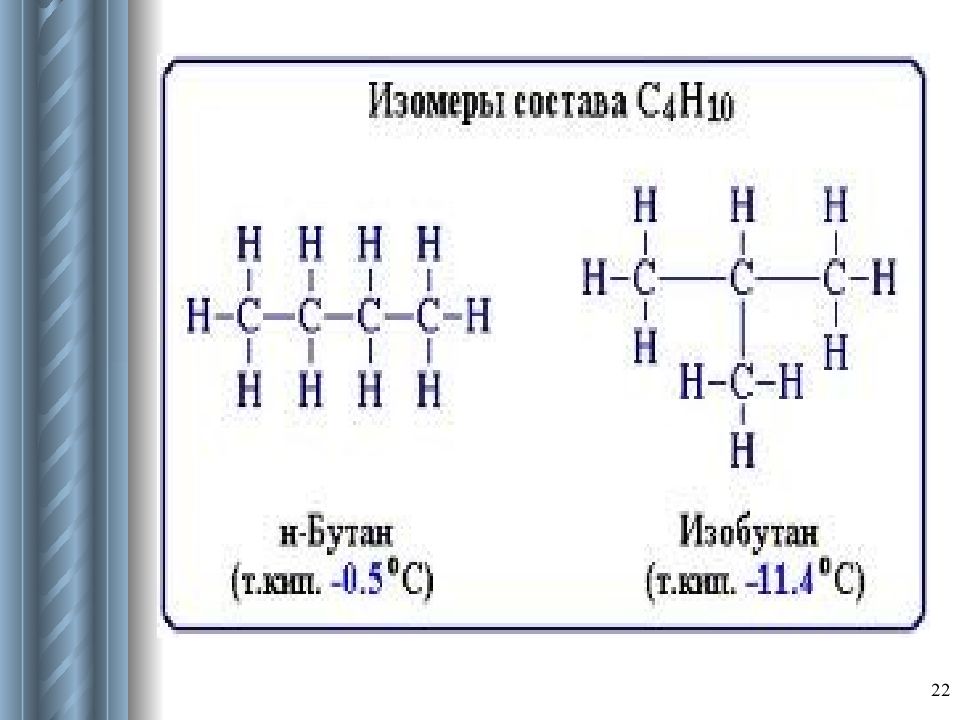
Изомерия – явление существования соединений, которые имеют одинаковый состав (одинаковую молекулярную формулу), но разное строение и свойства. Такие соединения называются изомерами. 21
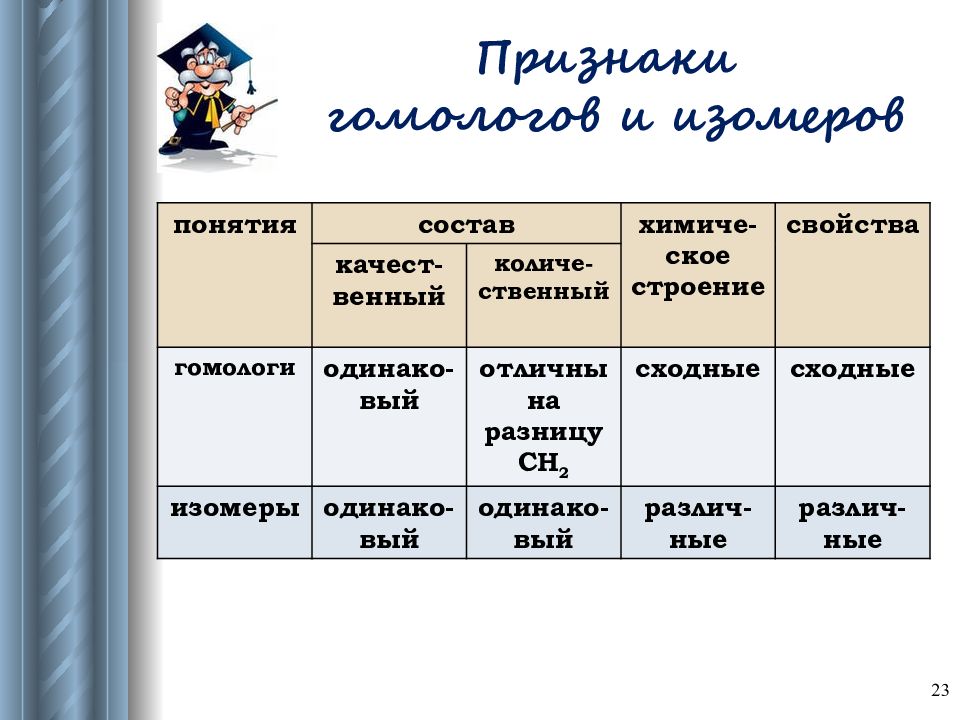
Слайд 23: Признаки гомологов и изомеров
23 понятия состав химиче-ское строение свойства качест-венный количе-ственный гомологи одинако-вый отличны на разницу СН 2 сходные сходные изомеры одинако-вый одинако-вый различ-ные различ-ные
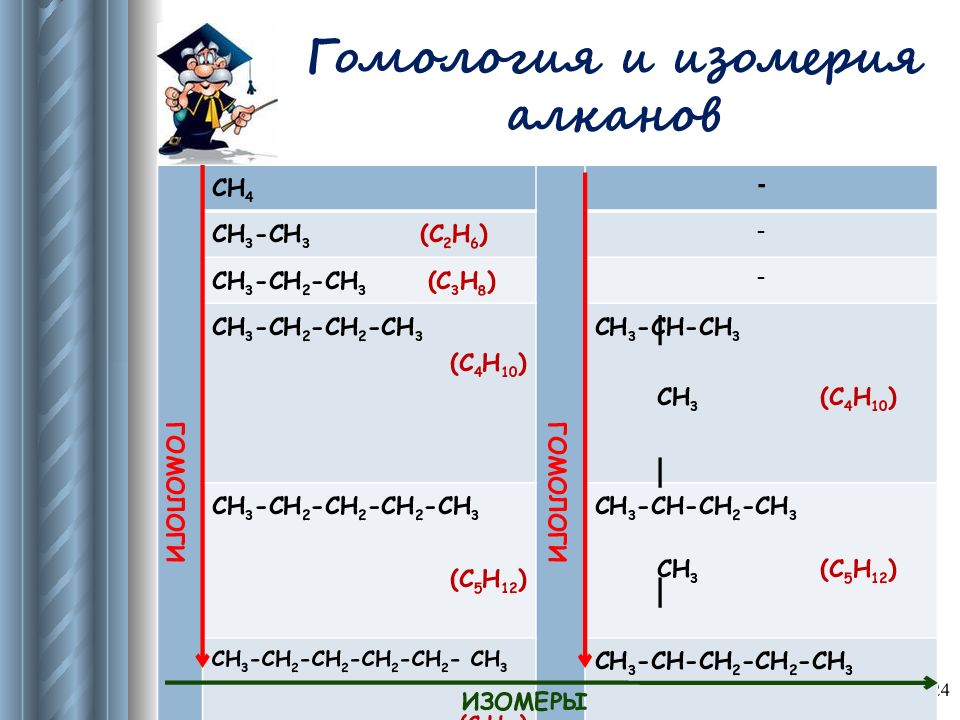
Слайд 24: Гомология и изомерия алканов
24 ГОМОЛОГИ СН 4 ГОМОЛОГИ - СН 3 -СН 3 (С 2 Н 6 ) - СН 3 -СН 2 -СН 3 (С 3 Н 8 ) - СН 3 -СН 2 -СН 2 -СН 3 (С 4 Н 10 ) СН 3 -СН-СН 3 СН 3 (С 4 Н 10 ) СН 3 -СН 2 -СН 2 -СН 2 -СН 3 (С 5 Н 12 ) СН 3 -СН-СН 2 -СН 3 СН 3 (С 5 Н 12 ) СН 3 -СН 2 -СН 2 -СН 2 -СН 2 - СН 3 (С 6 Н 14 ) СН 3 -СН-СН 2 -СН 2 -СН 3 СН 3 (С 6 Н 14 ) ИЗОМЕРЫ
Слайд 26
26 В обычных условиях (при 25 °С и атмосферном давлении) первые четыре члена гомологического ряда алканов (С 1 -С 4 )-газы. Нормальные алканы от пентана до гептадекана (С 5 -С 17 ) - жидкости, начиная с С 18 и выше - твердые вещества. По мере увеличения числа атомов углерода в цепи, т.е. с ростом относительной молекулярной массы, возрастают температуры кипения и плавления алканов. При одинаковом числе атомов углерода в молекуле алканы с разветвленным строением имеют более низкие температуры кипения, чем нормальные алканы. Алканы практически не растворимы в воде, так как их молекулы малополярны и не взаимодействуют с молекулами воды. Жидкие алканы легко смешиваются друг с другом. Они хорошо растворяются в неполярных органических растворителях, таких как бензол, тетрахлорметан (четыреххлористый углерод), диэтиловый эфир и др.
Слайд 28
28 Предельные углеводороды характеризуются малой реактивной способностью. Их называют инерционными, химически стойкими, парафинами (от латинского parum affinis – “мало сродства”).
Слайд 29: 1. Реакции окисления
29 При поджигании (t = 600 o С) алканы вступают в реакцию с кислородом, при этом происходит их окисление до углекислого газа и воды. С n Н 2n+2 + O 2 → CO 2 + H 2 O + Q например: СН 4 + 2O 2 → CO 2 + 2H 2 O + Q Смесь метана с кислородом или воздухом при поджигании может взрываться. Наиболее сильный взрыв получается при объёмных отношениях 1 : 2 (с кислородом) или 1 : 10 (с воздухом), т.к. метан и кислород вступают в реакцию полностью. Подобные смеси опасны в каменноугольных шахтах. Чтобы обеспечить безопасность работы в шахтах, там устанавливают анализаторы, сигнализирующие о появлении газа, и мощные вентиляционные устройства. С 3 Н 8 + 5O 2 → 3CO 2 + 4H 2 O + Q
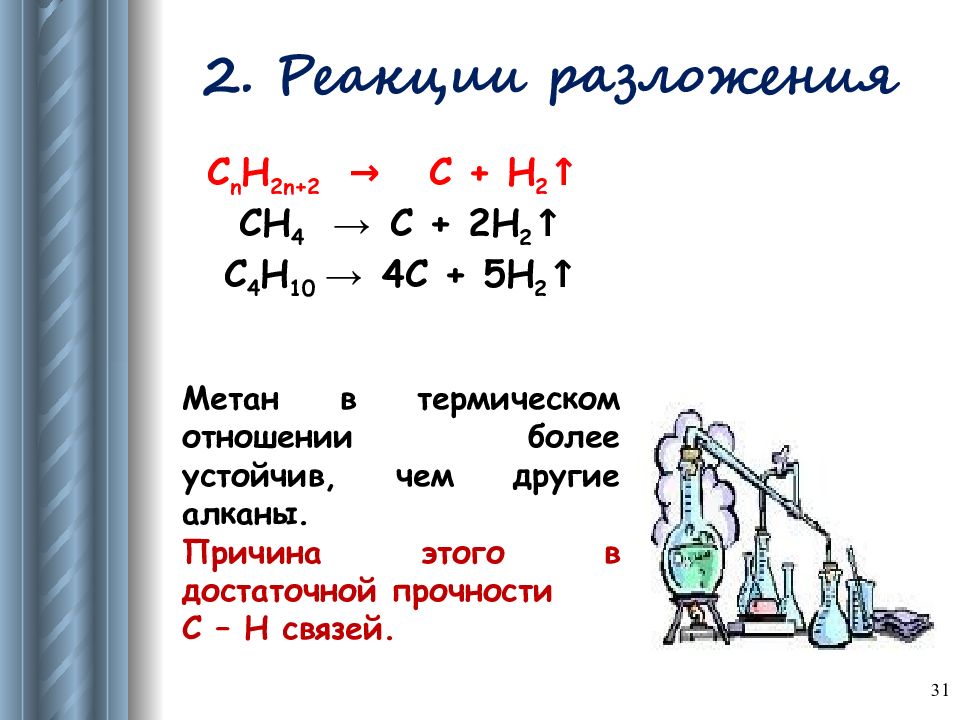
Слайд 31: 2. Реакции разложения
31 С n Н 2n+2 → C + H 2 ↑ СН 4 → C + 2H 2 ↑ С 4 Н 10 → 4C + 5H 2 ↑ Метан в термическом отношении более устойчив, чем другие алканы. Причина этого в достаточной прочности С – Н связей.
Слайд 32: 3. Реакции замещения
32 Протекают с галогенами и другими окислителями при определённых условиях: свет, температура: СН 4 + Cl 2 → CH 3 Cl + HCl СН 3 Cl + Cl 2 → CH 2 Cl 2 + HCl СН 2 Cl 2 + Cl 2 → CHCl 3 + HCl СН Cl 3 + Cl 2 → CCl 4 + HCl Механизм цепных реакций достаточно сложен, объяснение ему было дано русским учёным Н.Н. Семёновым, за что он в 1956 г. был удостоен Нобелевской премии. Н.Н. Семёнов (1896 -25.09.1986 г.г.)
Слайд 33: 4. Реакции изомеризации
33 Характерны не для всех алканов. Возможны превращения одних изомеров в другие при наличии катализаторов. С 4 Н 10 → C 4 H 10 Уравнение вызывает недоумение, т.к. вы не встречались с реакциями, при которых состав молекул не изменялся. Значит, химические реакции могут сопровождаться не только изменением состава веществ, но и изменением их строения, что часто встречается в органической химии. Чтобы выразить такое превращение, надо пользоваться структурными формулами. Структурно это выглядит следующим образом: СН 3 – СН 2 – СН 2 – СН 3 AlCl з СН 3 – СН – СН 3 СН 3 н-бутан изобутан (2-метилпропан)
Слайд 36: ИСТОЧНИКИ ИНФОРМАЦИИ
36 http://ru.wikipedia.org/wiki/ Алканы http://hybridation.ru/sp3.htm http://www.chem.asu.ru/org/ochem_bio/ALKANY/fisic.htm