Слайд 2: Алкены
Алкенами или олефинами, или этиленовыми углеводородами называются углеводороды, содержащие в молекуле одну двойную связь и имеющие общую формулу C n H 2 n.
Слайд 3
Углерод четырехвалентен всегда В органических соединениях Независимо от формулы вещества И его строения.
Слайд 4: Основное содержание лекции
Понятие о непредельных углеводородах. Характеристика двойной связи. Изомерия и номенклатура алкенов. Получение алкенов. Свойства алкенов.
Слайд 5: Решите задачу
Найдите молекулярную формулу углеводорода, массовая доля углерода в котором составляет 85,7 %. Относительная плотность этого углеводорода по азоту равна 2. При сжигании углеводорода массой 0,7 г образовались оксида углерода (IV) и вода количеством вещества по 0,05 моль каждое. Относительная плотность паров этого вещества по азоту равна 2,5. Найдите молекулярную формулу алкена. При сжигании углеводорода массой 11,2 г получили 35,2 г оксида углерода (IV) и 14,4 г воды. Относительная плотность углеводорода по воздуху 1,93. Найдите молекулярную формулу вещества.
Слайд 6: Проверь
М(С х Н Y ) =56 г/моль m (С х Н Y ) =56 г m (С)=48 г m (Н)=8 г x : y = = 4 : 8 Ответ: С 4 Н 8 М(С х Н Y ) =70 г/моль n (Н)= 0,1 моль n (С)= 0,05 моль x : y = 0,05 : 0,1 = 1 : 2 Простейшая формула СН 2 Истинная – С 5 Н 10 Ответ: С 5 Н 10 М(С х Н Y ) =56 г/моль m (С х Н Y ) =11,2 г n (СО 2 )= 0,8 моль n (Н 2 О)=0,8 моль n (С)= 0,8 моль n (Н)=1,6 моль x : y = 0,8 : 1,6 = 1 : 2 Простейшая формула СН 2 Истинная – С 4 Н 8 Ответ: С 4 Н 8 Задача 2 Задача 3 Задача 1
Слайд 7: Понятие об алкенах
Алкены – углеводороды, содержащие в молекуле одну двойную связь между атомами углерода, а качественный и количественный состав выражается общей формулой С n Н 2n, где n ≥ 2. Алкены относятся к непредельным углеводородам, так как их молекулы содержат меньшее число атомов водорода, чем насыщенные.
Слайд 8: Характеристика двойной связи (С ═ С)
Вид гибридизации – Валентный угол – Длина связи С = С – Строение ─ Вид связи – По типу перекрывания – sp 2 120 º 0,134 нм плоскостное ковалентная неполярная σ и π
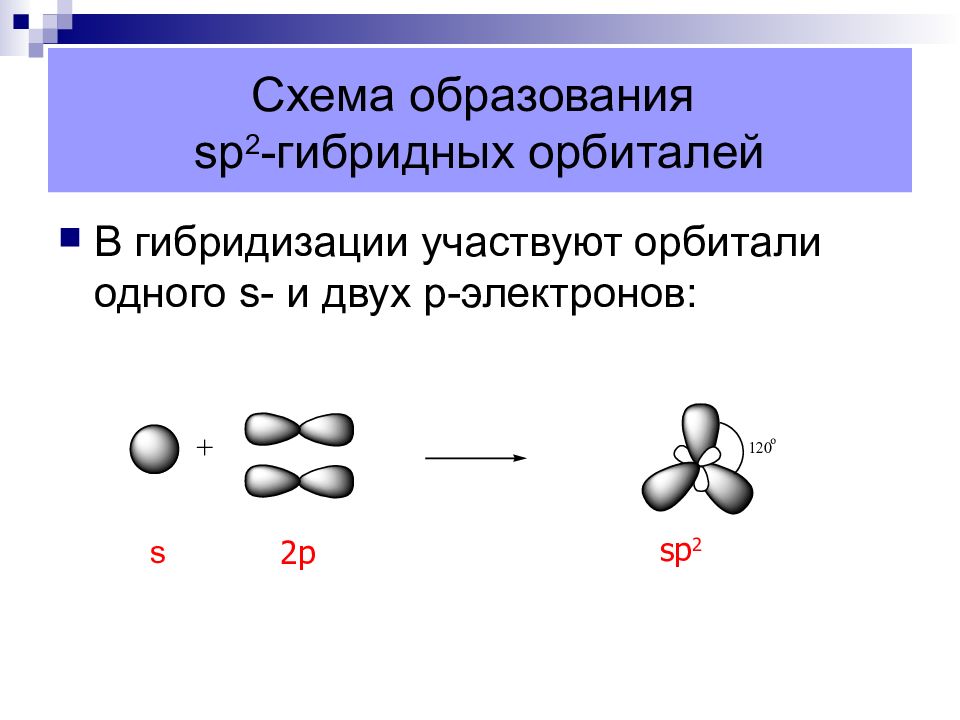
Слайд 9: Схема образования sp 2 -гибридных орбиталей
В гибридизации участвуют орбитали одного s - и двух p -электронов: s 2p sp 2
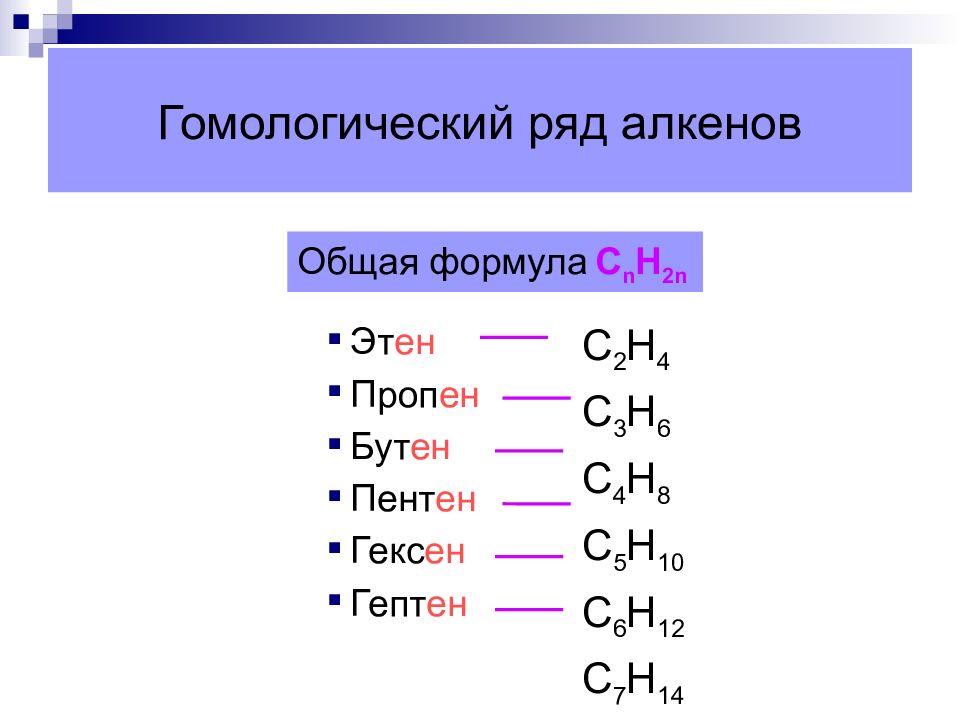
Слайд 11: Гомологический ряд алкенов
Эт ен Проп ен Бут ен Пент ен Гекс ен Гепт ен C 2 H 4 C 3 H 6 C 4 H 8 C 5 H 10 C 6 H 12 C 7 H 14 Общая формула С n Н 2n
Слайд 12: Изомерия алкенов
Для алкенов возможны два типа изомерии: 1-ый тип – структурная изомерия : углеродного скелета положения двойной связи Межклассовая 2-ой тип – пространственная изомерия : геометрическая
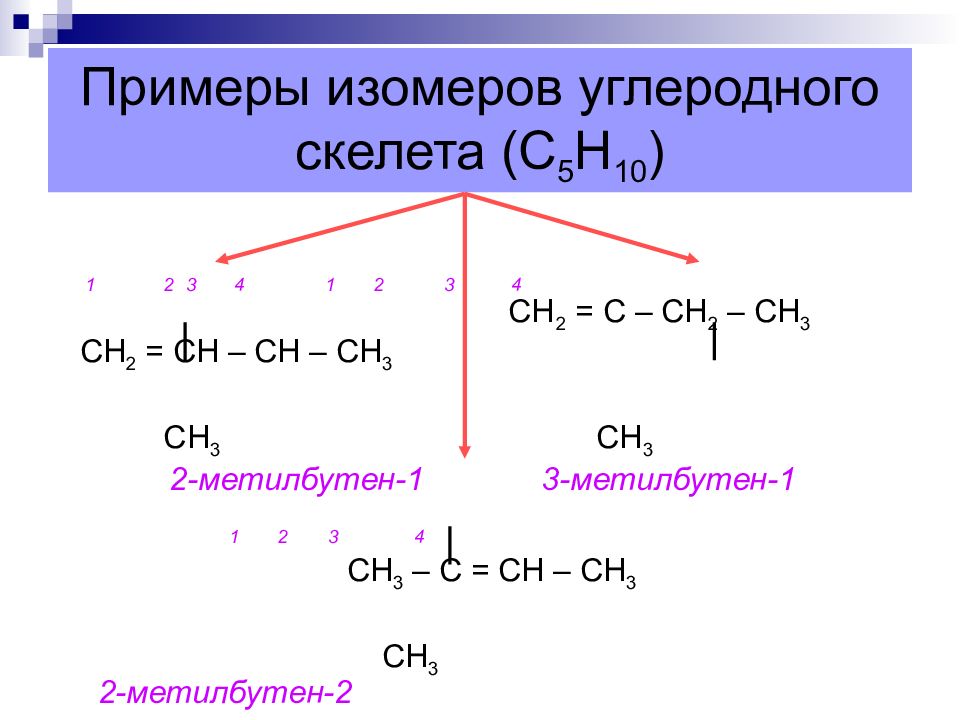
Слайд 13: Примеры изомеров углеродного скелета (С 5 Н 10 )
1 2 3 4 1 2 3 4 СН 2 = С – СН 2 – СН 3 СН 2 = СН – СН – СН 3 СН 3 СН 3 2-метилбутен-1 3-метилбутен-1 1 2 3 4 СН 3 – С = СН – СН 3 СН 3 2-метилбутен-2
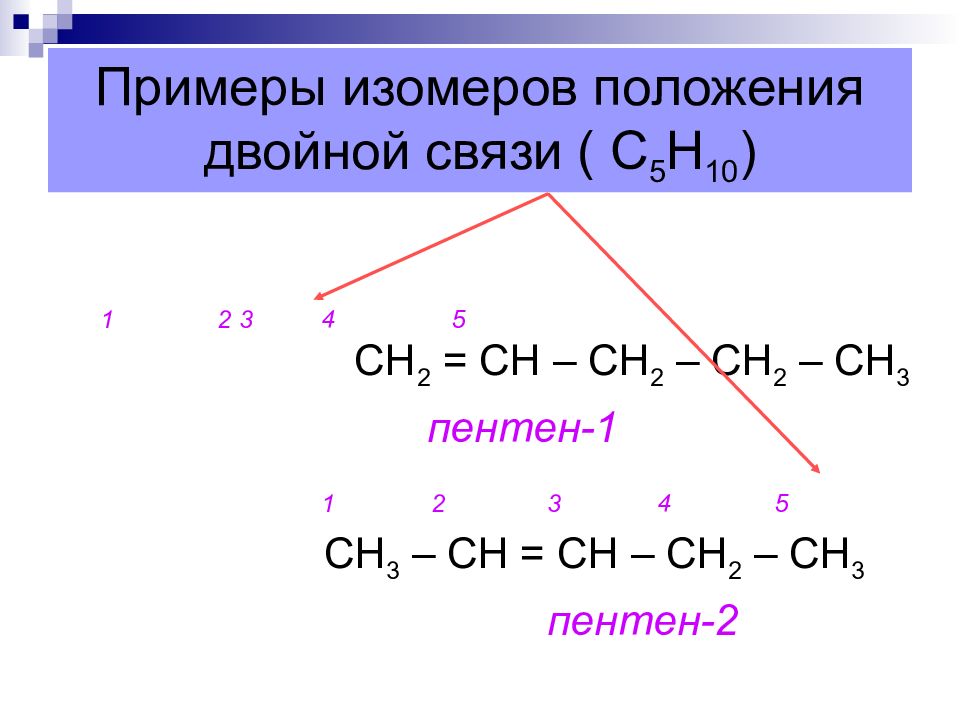
Слайд 14: Примеры изомеров положения двойной связи ( С 5 Н 10 )
1 2 3 4 5 СН 2 = СН – СН 2 – СН 2 – СН 3 пентен-1 1 2 3 4 5 СН 3 – СН = СН – СН 2 – СН 3 пентен-2
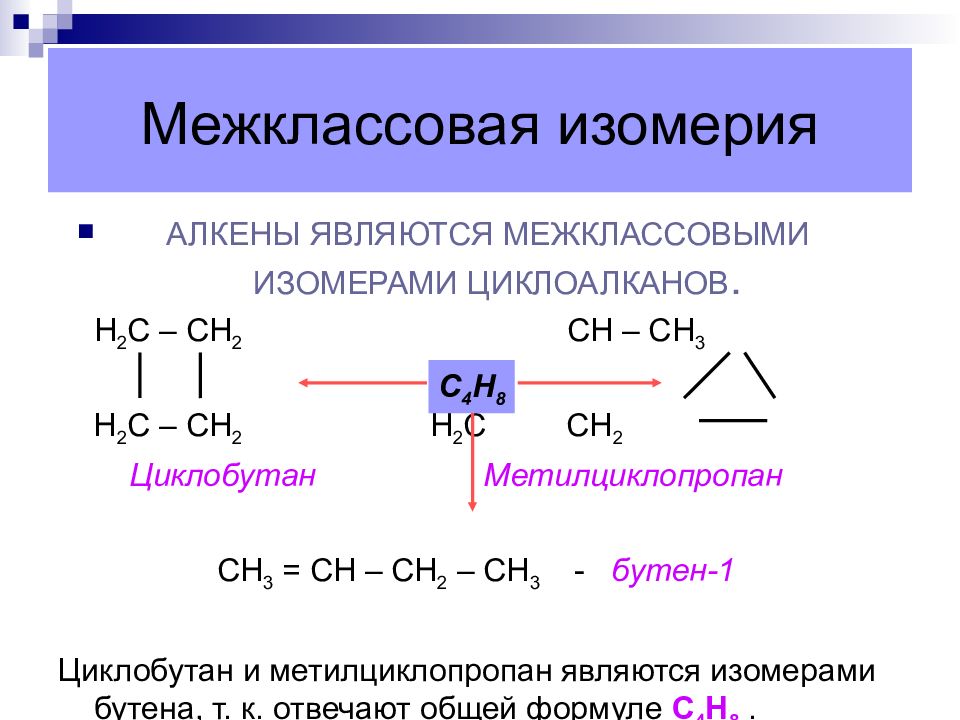
Слайд 15: Межклассовая изомерия
АЛКЕНЫ ЯВЛЯЮТСЯ МЕЖКЛАССОВЫМИ ИЗОМЕРАМИ ЦИКЛОАЛКАНОВ. Н 2 С – СН 2 СН – СН 3 Н 2 С – СН 2 Н 2 С СН 2 Циклобутан Метилциклопропан СН 3 = СН – СН 2 – СН 3 - бутен-1 Циклобутан и метилциклопропан являются изомерами бутена, т. к. отвечают общей формуле С 4 Н 8. С 4 Н 8
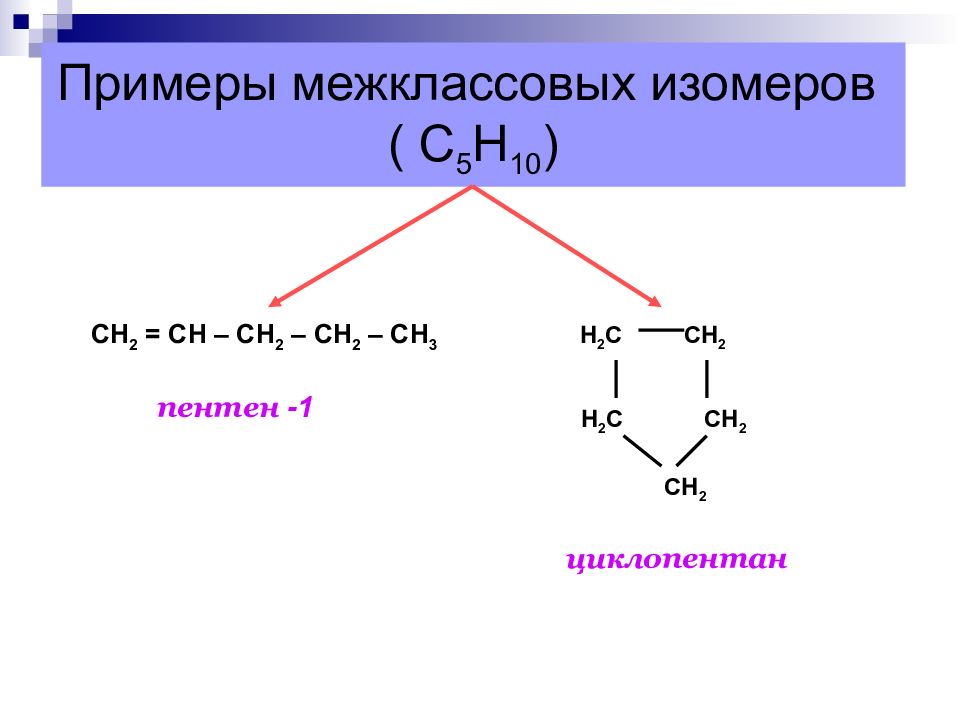
Слайд 16: Примеры межклассовых изомеров ( С 5 Н 10 )
СН 2 = СН – СН 2 – СН 2 – СН 3 Н 2 С СН 2 Н 2 С СН 2 СН 2 пентен -1 циклопентан
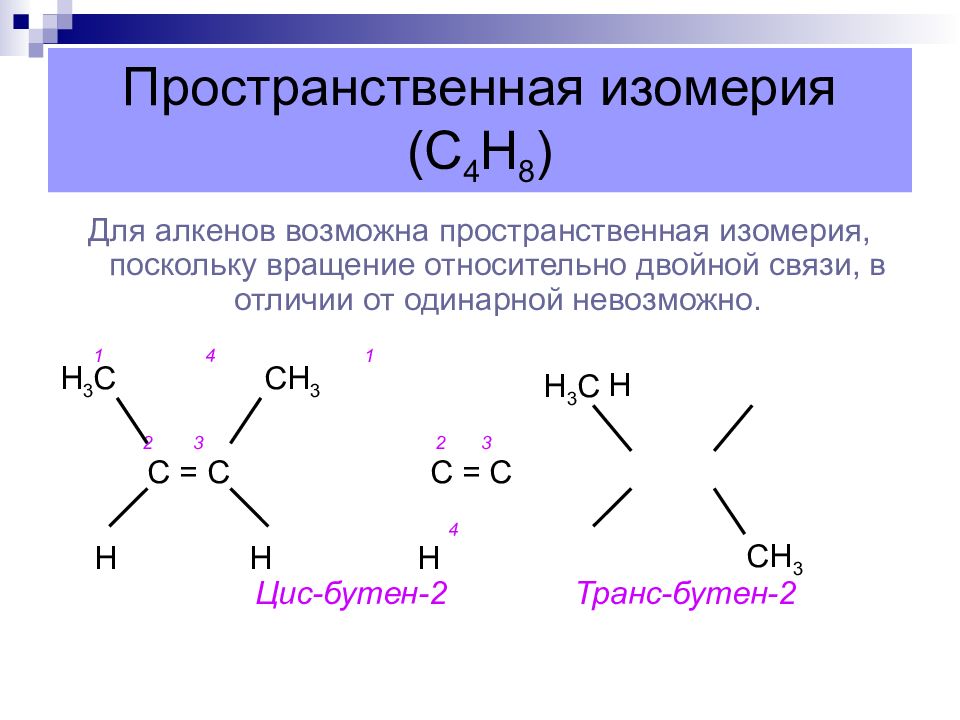
Слайд 17: Пространственная изомерия (С 4 Н 8 )
Для алкенов возможна пространственная изомерия, поскольку вращение относительно двойной связи, в отличии от одинарной невозможно. 1 4 1 Н 2 3 2 3 С = С С = С 4 Н Н Н Цис-бутен-2 Транс-бутен-2 Н 3 С СН 3 Н 3 С СН 3
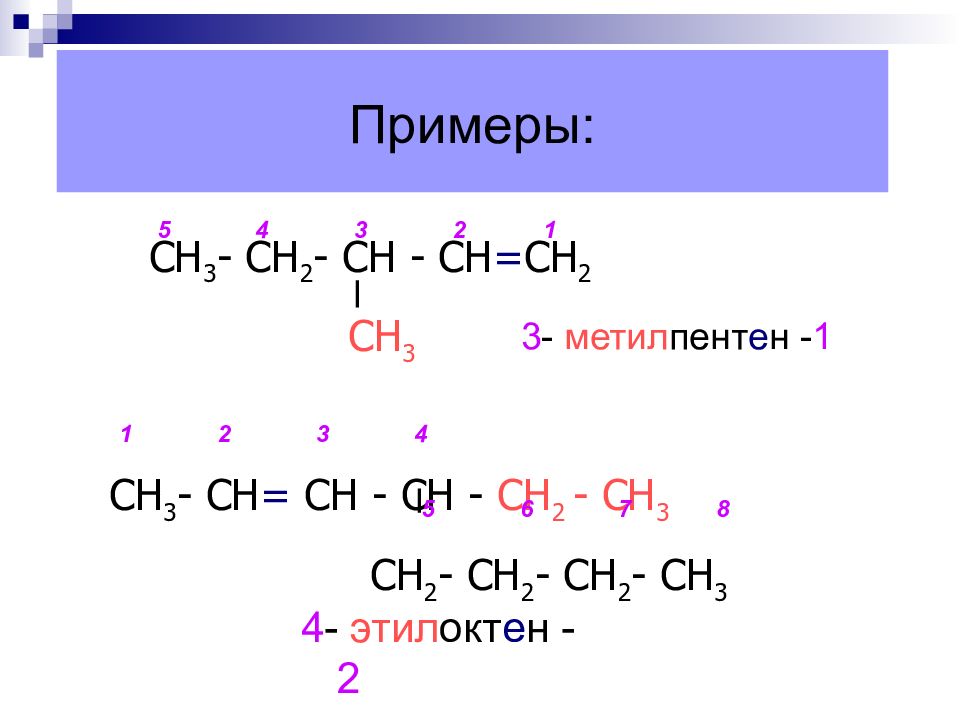
Слайд 19: Примеры:
4 - этил окт е н - 2 СН 3 - СН 2 - СН - СН = СН 2 СН 3 СН 3 - СН = СН - СН - СН 2 - СН 3 СН 2 - СН 2 - СН 2 - СН 3 1 2 3 4 5 6 7 8 1 2 3 4 5 3 - метил пент е н - 1
Слайд 20: Физические свойства алкенов
Алкены плохо растворимы в воде, но хорошо растворяются в органических растворителях. С 2 – С 4 - газы С 5 – С 16 - жидкости С 17 … - твёрдые вещества С увеличением молекулярной массы алкенов, в гомологическом ряду, повышаются температуры кипения и плавления, увеличивается плотность веществ.
Слайд 21: Химические свойства алкенов
По химическим свойствам алкены резко отличаются от алканов. Алкены химически более активные вещества, что обусловлено наличием двойной связи, состоящей из σ - и π -связей. Алкены способны присоединять два одновалентных атома или радикала за счёт разрыва π -связи, как менее прочной.
Слайд 22: Типы химических реакций, которые характерны для алкенов
Реакции присоединения. Реакции окисления. Реакции полимеризации. Реакции -водорода
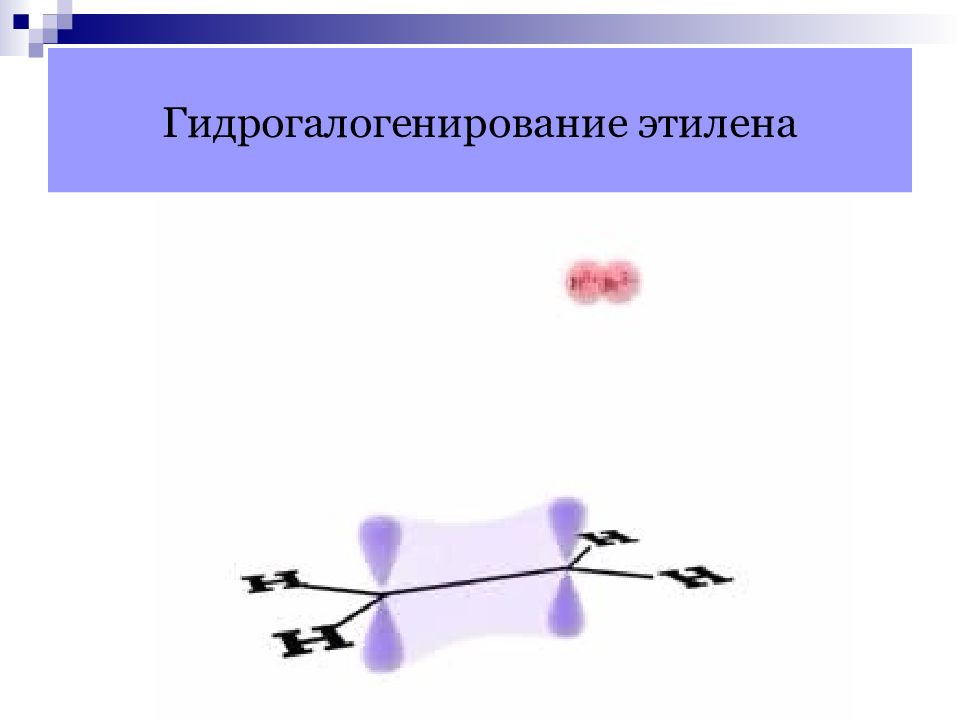
Слайд 23: Механизм реакций присоединения алкенов
π -связь является донором электронов, поэтому она легко реагирует с электрофильными реагентами. Электрофильное присоединение : разрыв π -связи протекает по гетеролитическому механизму, если атакующая частица является электрофилом. Свободно-радикальное присоединение : разрыв связи протекает по гомолитическому механизму, если атакующая частица является радикалом.
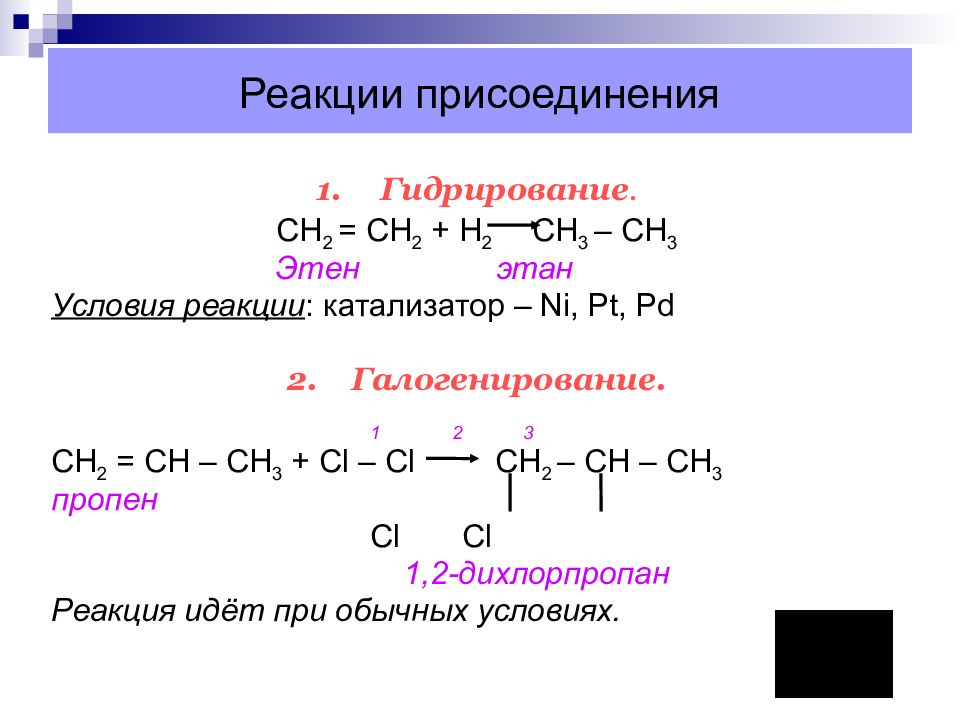
Слайд 25: Реакции присоединения
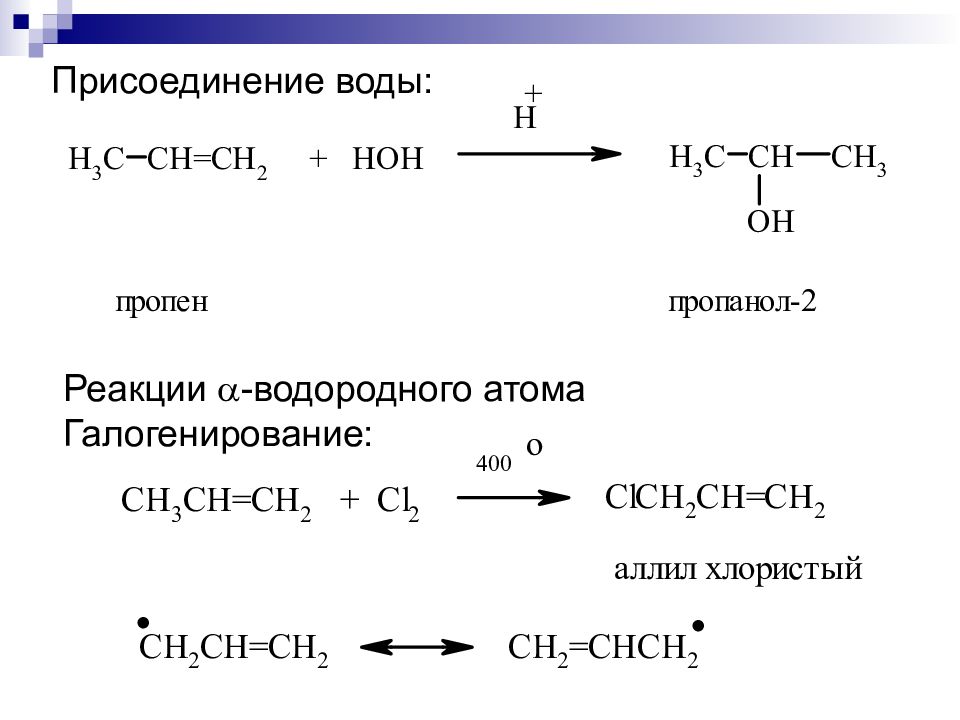
1. Гидрирование. C Н 2 = СН 2 + Н 2 СН 3 – СН 3 Этен этан Условия реакции : катализатор – Ni, Pt, Pd 2. Галогенирование. 1 2 3 C Н 2 = СН – СН 3 + С l – С l СН 2 – СН – СН 3 пропен Cl Cl 1,2-дихлорпропан Реакция идёт при обычных условиях.
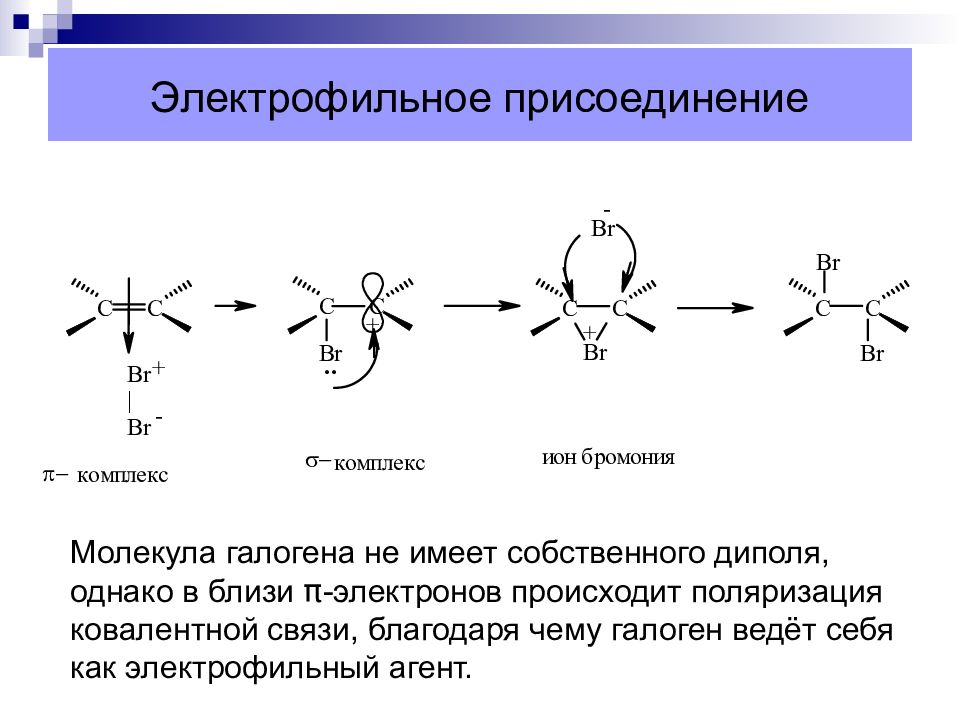
Слайд 26: Электрофильное присоединение
Молекула галогена не имеет собственного диполя, однако в близи π -электронов происходит поляризация ковалентной связи, благодаря чему галоген ведёт себя как электрофильный агент.
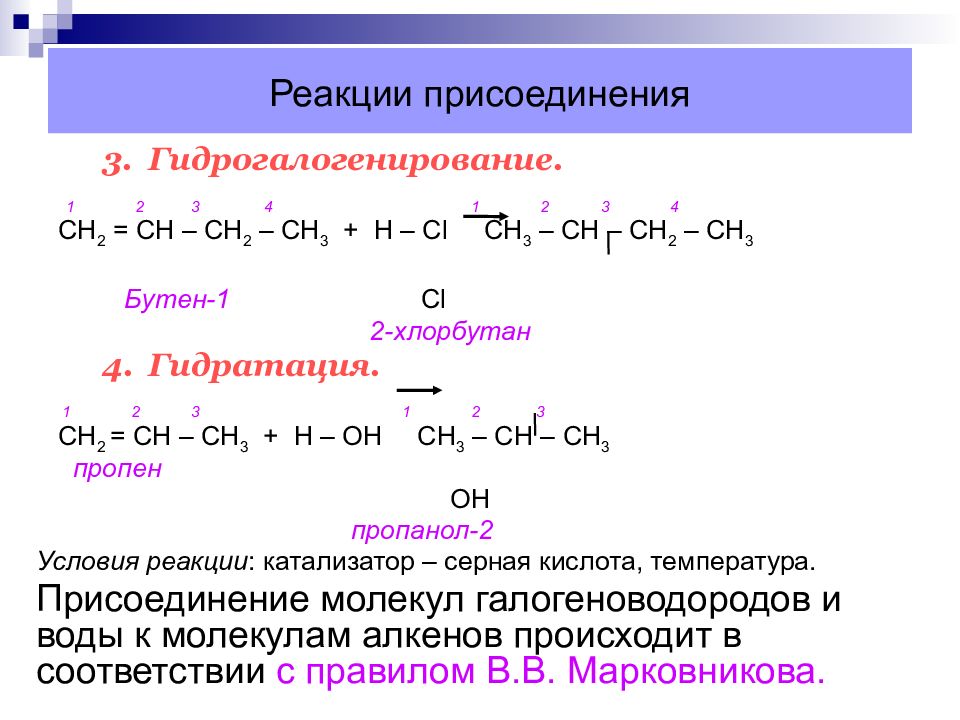
Слайд 27: Реакции присоединения
3. Гидрогалогенирование. 1 2 3 4 1 2 3 4 СН 2 = СН – СН 2 – СН 3 + Н – С l C Н 3 – СН – СН 2 – СН 3 Бутен-1 Cl 2-хлорбутан 4. Гидратация. 1 2 3 1 2 3 C Н 2 = СН – СН 3 + Н – ОН СН 3 – СН – СН 3 пропен ОН пропанол-2 Условия реакции : катализатор – серная кислота, температура. Присоединение молекул галогеноводородов и воды к молекулам алкенов происходит в соответствии с правилом В.В. Марковникова.
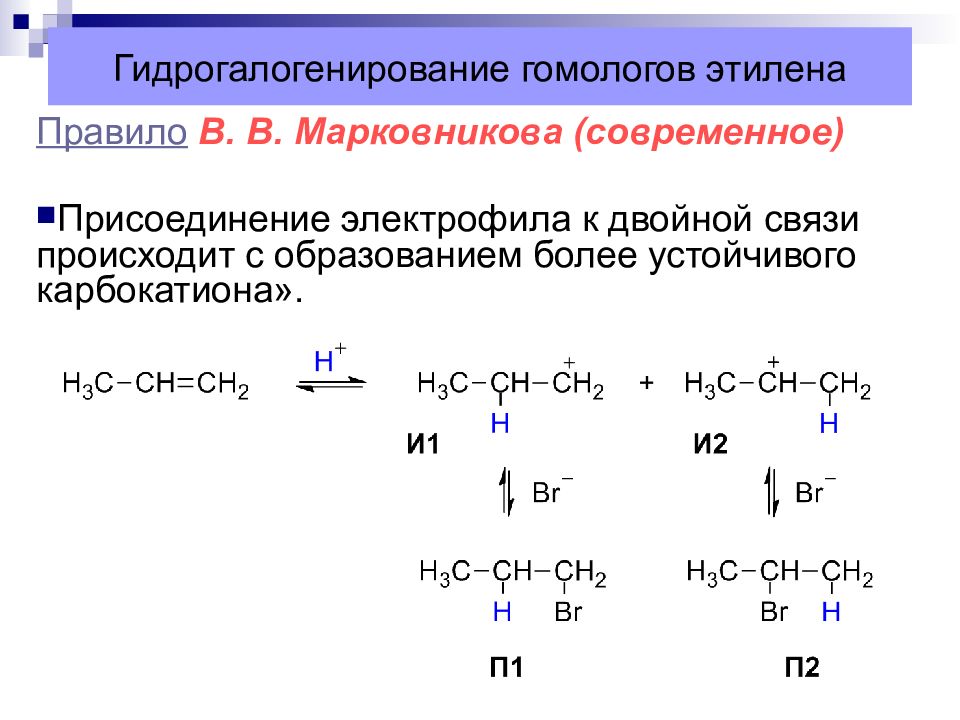
Слайд 28: Гидрогалогенирование гомологов этилена
Правило В. В. Марковникова Атом водорода присоединяется к более гидрогенизированному атому углерода при двойной связи, а атом галогена или гидроксогруппа – к менее гидр огениз ированному.
Слайд 29
Впервые правило было предложено русским химиком В. В. Марковниковым в 1869 году. Правило Марковникова как таковое установилось лишь в 1924 году благодаря работе О. Маасса (англ. O. Maass), который растворял безводные галогеноводороды и алкены в гексане и наблюдал образование продуктов, предсказанных Марковниковым. В частности, он первым провёл классический иллюстративный эксперимент — присоединение бромоводорода к пропену, в котором достоверно образовался 2-бромпропан.
Слайд 30: Гидрогалогенирование гомологов этилена
Правило В. В. Марковникова (современное) Присоединение электрофила к двойной связи происходит с образованием более устойчивого карбокатиона ».
Слайд 31
Правила В. В. Марковникова и А. М. Зайцева (мнемоническое) Найдешь ли справедливость тут, Где действуют двойные связи: Где много – так еще дадут, Где мало – так отнимут сразу! Правило Зайцева —эмпирическое правило, используемое в органической химии для предсказания преобладающего продукта в реакциях отщепления воды или галогеноводородов от спиртов и галогенидов соответственно. Правило формулируется следующим образом: при дегидратации вторичных и третичных спиртов и при дегидрогалогенировании вторичных и третичных галогенидов водород отщепляется преимущественно от наименее гидрогенизированного атома углерода. Правило предложено русским химиком А. М. Зайцевым в 1875 году.
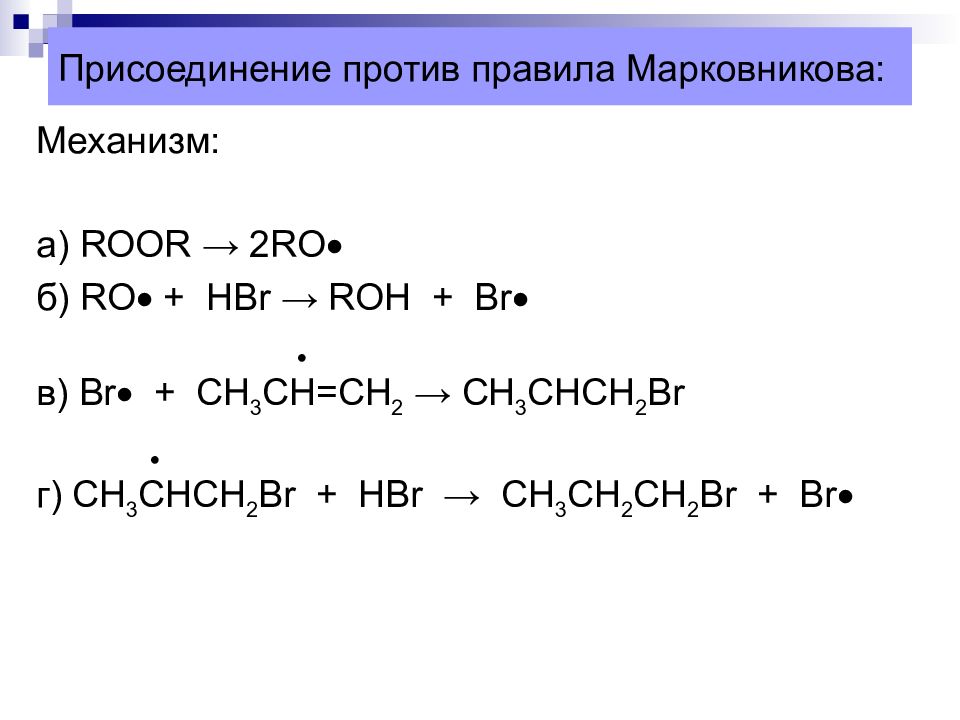
Слайд 33: Присоединение против правила Марковникова:
Механизм: а) ROOR → 2RO б) RO + HBr → ROH + Br в) Br + CH 3 CH=CH 2 → CH 3 CHCH 2 Br г) С H 3 CHCH 2 Br + HBr → CH 3 CH 2 CH 2 Br + Br
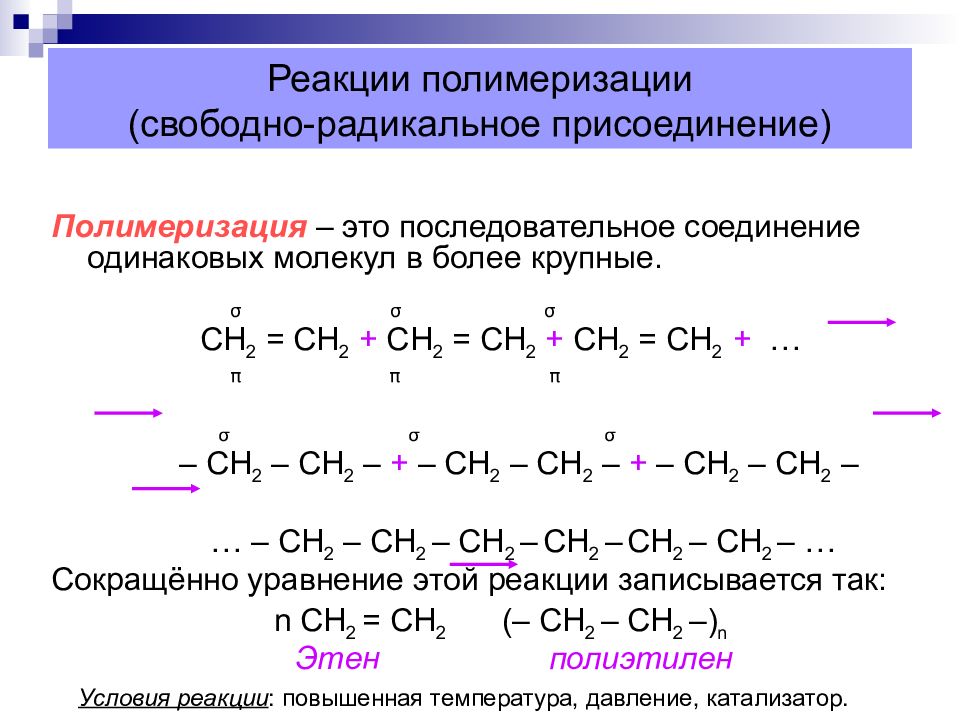
Слайд 34: Реакции полимеризации (свободно-радикальное присоединение)
Полимеризация – это последовательное соединение одинаковых молекул в более крупные. σ σ σ СН 2 = СН 2 + СН 2 = СН 2 + СН 2 = СН 2 + … π π π σ σ σ – СН 2 – СН 2 – + – СН 2 – СН 2 – + – СН 2 – СН 2 – … – СН 2 – СН 2 – СН 2 – СН 2 – СН 2 – СН 2 – … Сокращённо уравнение этой реакции записывается так: n СН 2 = СН 2 (– СН 2 – СН 2 –) n Этен полиэтилен Условия реакции : повышенная температура, давление, катализатор.
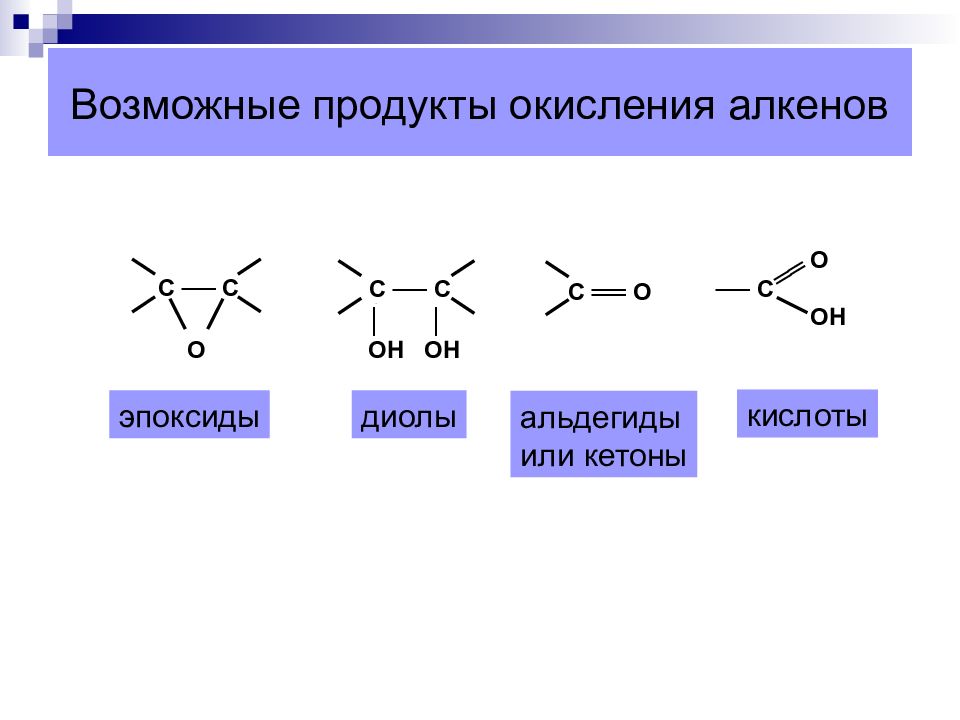
Слайд 35: Возможные продукты окисления алкенов
С ── С О С ── С │ │ ОН ОН С ══ О О ── С ОН ══ эпоксиды диолы альдегиды или кетоны кислоты
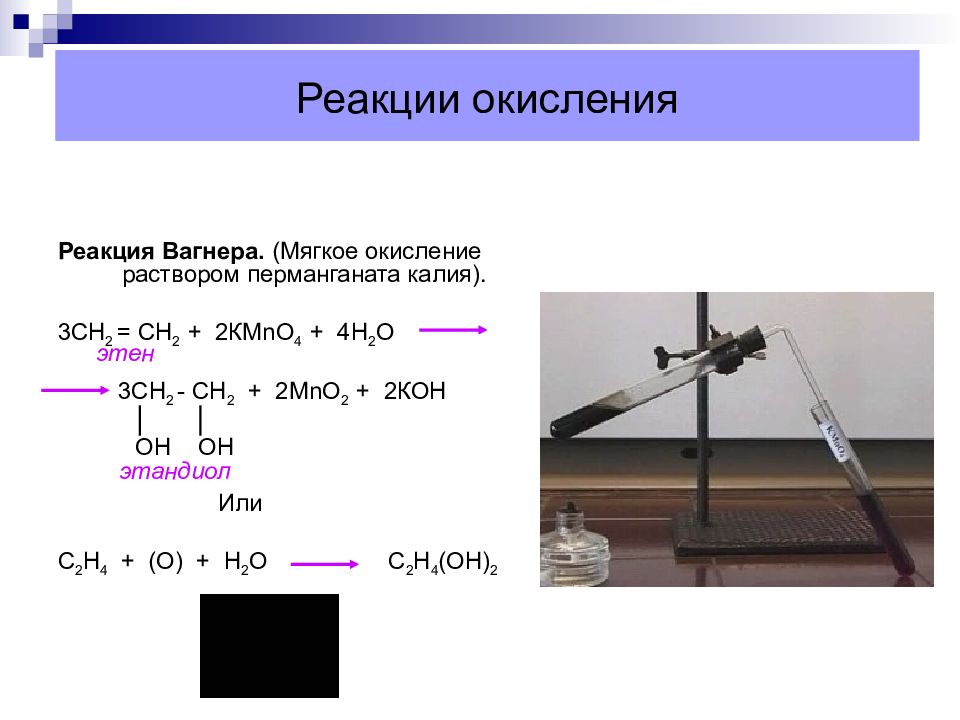
Слайд 36: Реакции окисления
Реакция Вагнера. (Мягкое окисление раствором перманганата калия). 3СН 2 = СН 2 + 2КМ n О 4 + 4Н 2 О 3СН 2 - СН 2 + 2М n О 2 + 2КОН ОН ОН Или С 2 Н 4 + (О) + Н 2 О С 2 Н 4 (ОН) 2 этандиол этен
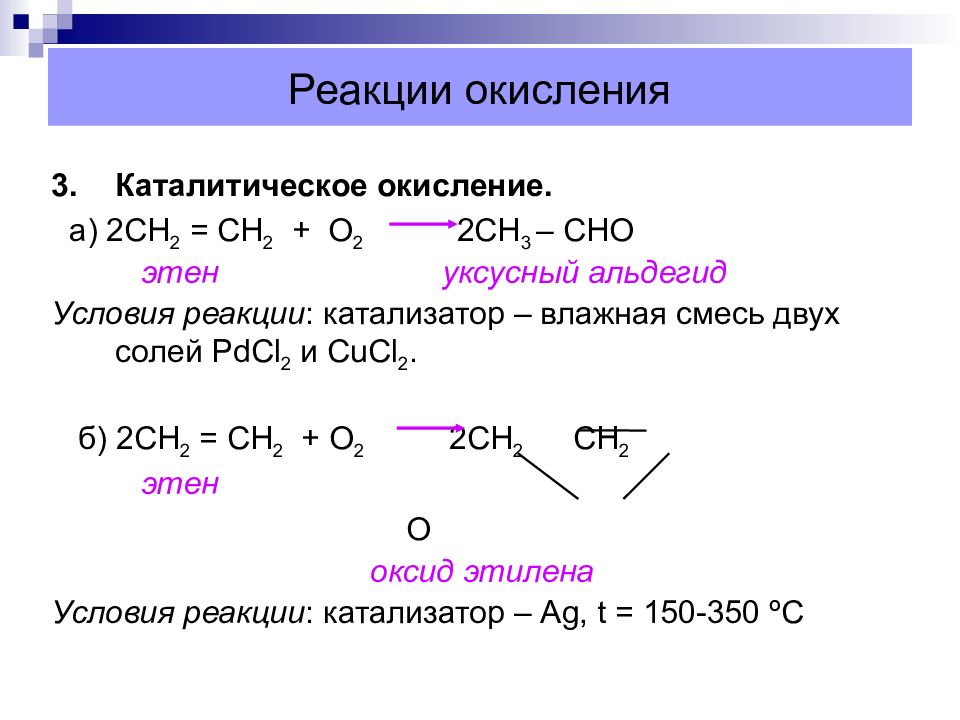
Слайд 37: Реакции окисления
3. Каталитическое окисление. а) 2СН 2 = СН 2 + О 2 2СН 3 – CH О этен уксусный альдегид Условия реакции : катализатор – влажная смесь двух солей PdCl 2 и CuCl 2. б) 2СН 2 = СН 2 + О 2 2СН 2 СН 2 этен О оксид этилена Условия реакции : катализатор – Ag, t = 150-350 º С
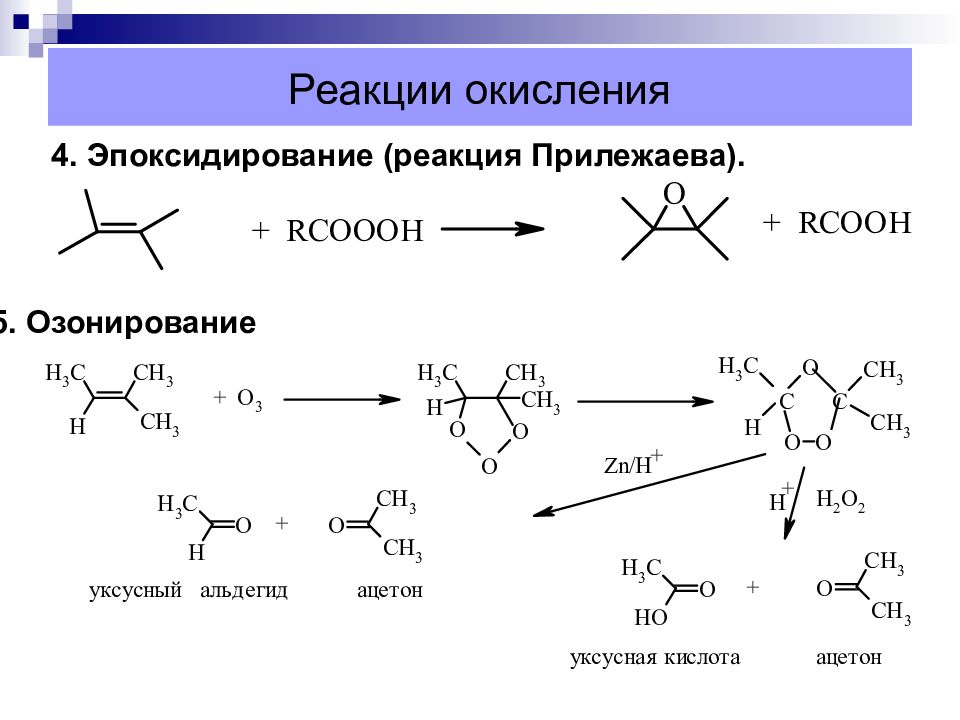
Слайд 38: Реакции окисления
4. Эпоксидирование (реакция Прилежаева). 5. Озонирование
Слайд 39: Горение алкенов
Алкены горят красноватым светящимся пламенем, в то время как пламя предельных углеводородов голубое. Массовая доля углерода в алкенах несколько выше, чем в алканах с тем же числом атомов углерода. С 4 Н 8 + 8О 2 4СО 2 + 4Н 2 О бутен При недостатке кислорода С 4 Н 8 + 6О 2 4СО + 4Н 2 О бутен
Слайд 41: Лабораторные способы получения алкенов
При получении алкенов необходимо учитывать правило А.М. Зайцева: при отщеплении галогеноводорода или воды от вторичных и третичных галогеналканов или спиртов атом водорода отщепляется от наименее гидрированного атома углерода. Дегидрогалогенирование галогеналкенов. Н 3 С ─ СН 2 ─ СН С l ─ СН 3 + КОН Н 3 С ─ СН ═ СН ─ СН 3 + КС l + Н 2 О 2-хлорбутан бутен-2 Условия реакции : нагревание. Дегидратация спиртов. Н 3 С ─ СН 2 ─ ОН Н 2 С ═ СН 2 + Н 2 О этанол этен Условия реакции: катализатор – Н 2 SO 4 (конц.), t = 180 º С. Дегалогенирование дигалогеналканов. Н 3 С ─ СН Cl ─ СН 2 С l + М g Н 3 С ─ СН ═ СН 2 + MgCl 2 1,2-дихлорпрпан пропен
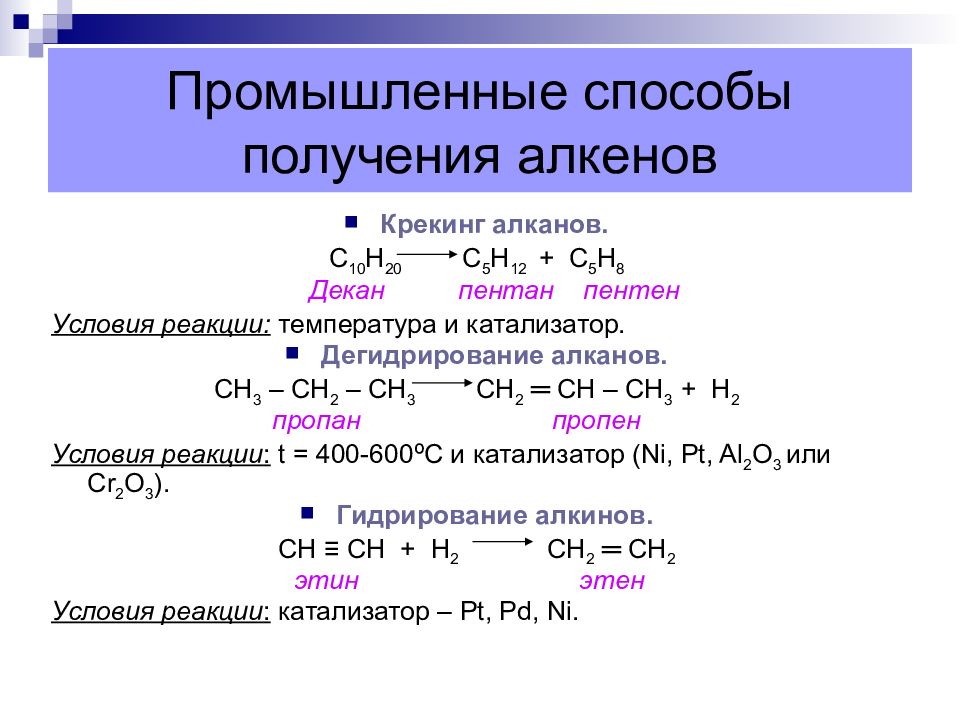
Слайд 42: Промышленные способы получения алкенов
Крекинг алканов. С 10 Н 20 С 5 Н 12 + С 5 Н 8 Декан пентан пентен Условия реакции: температура и катализатор. Дегидрирование алканов. СН 3 – СН 2 – СН 3 СН 2 ═ СН – СН 3 + Н 2 пропан пропен Условия реакции : t = 400-600 º С и катализатор ( Ni, Pt, Al 2 O 3 или Cr 2 O 3 ). Гидрирование алкинов. C Н ≡ СН + Н 2 СН 2 ═ СН 2 этин этен Условия реакции : катализатор – Pt, Pd, Ni.
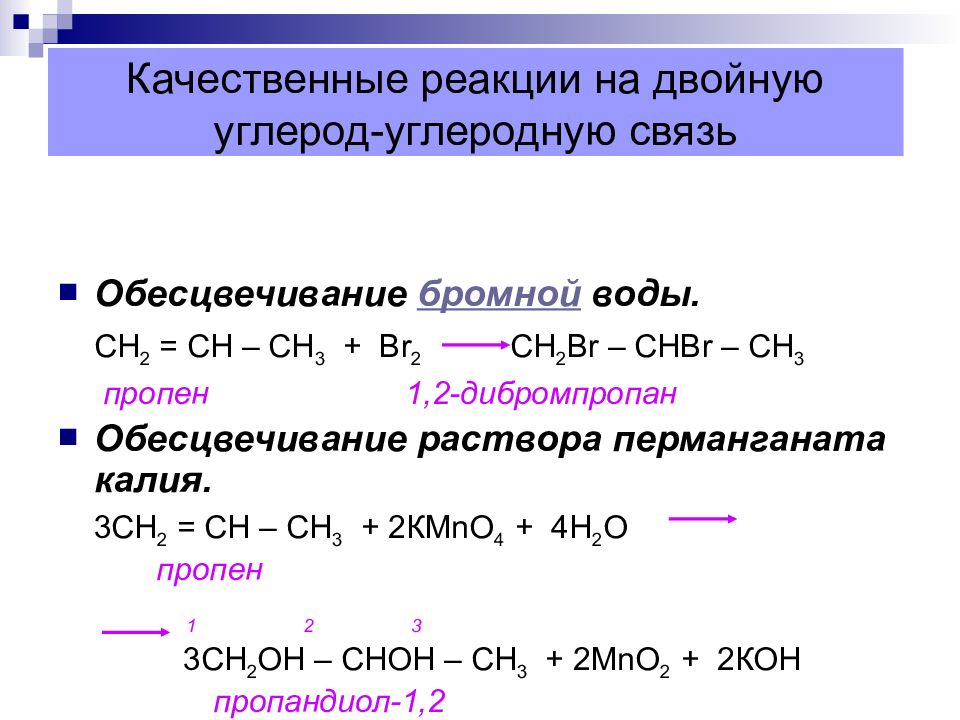
Слайд 43: Качественные реакции на двойную углерод-углеродную связь
Обесцвечивание бромной воды. СН 2 = СН – СН 3 + В r 2 CH 2 Br – CHBr – CH 3 пропен 1,2-дибромпропан Обесцвечивание раствора перманганата калия. 3СН 2 = СН – СН 3 + 2КМ n О 4 + 4Н 2 О пропен 1 2 3 3СН 2 ОН – СНОН – СН 3 + 2М n О 2 + 2КОН пропандиол-1,2
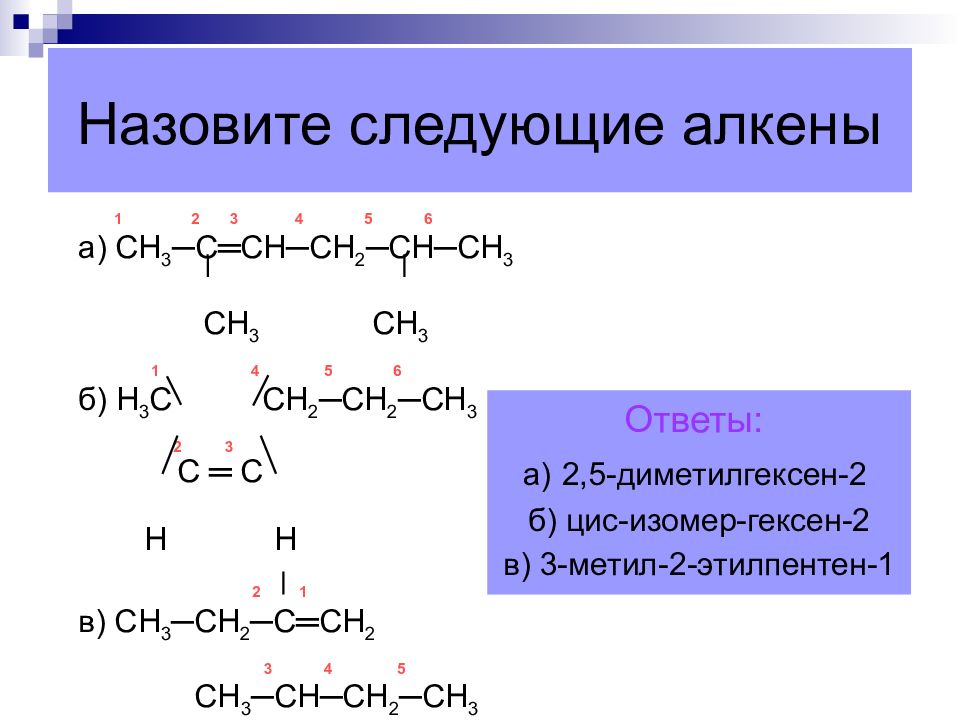
Слайд 44: Назовите следующие алкены
1 2 3 4 5 6 а) СН 3 ─ С ═ СН ─ СН 2 ─ СН ─ СН 3 СН 3 СН 3 1 4 5 6 б) Н 3 С СН 2 ─ СН 2 ─ СН 3 2 3 С ═ С Н Н 2 1 в) СН 3 ─ СН 2 ─ С ═ СН 2 3 4 5 СН 3 ─ СН ─ СН 2 ─ СН 3 Ответы: а) 2,5-диметилгексен-2 б) цис-изомер-гексен-2 в) 3-метил-2-этилпентен-1 Назовите следующие алкены
Слайд 45
Проверьте правильность написаний уравнений реакций СН 3 -(СН 2 ) 2 -СН 2 Br + КОН СН 3 -СН 2 -СН=СН 2 + К Br + Н 2 О СН 3 -СН 2 -СН=СН 2 + Н Br СН 3 -СН 2 -СН-СН 3 Br
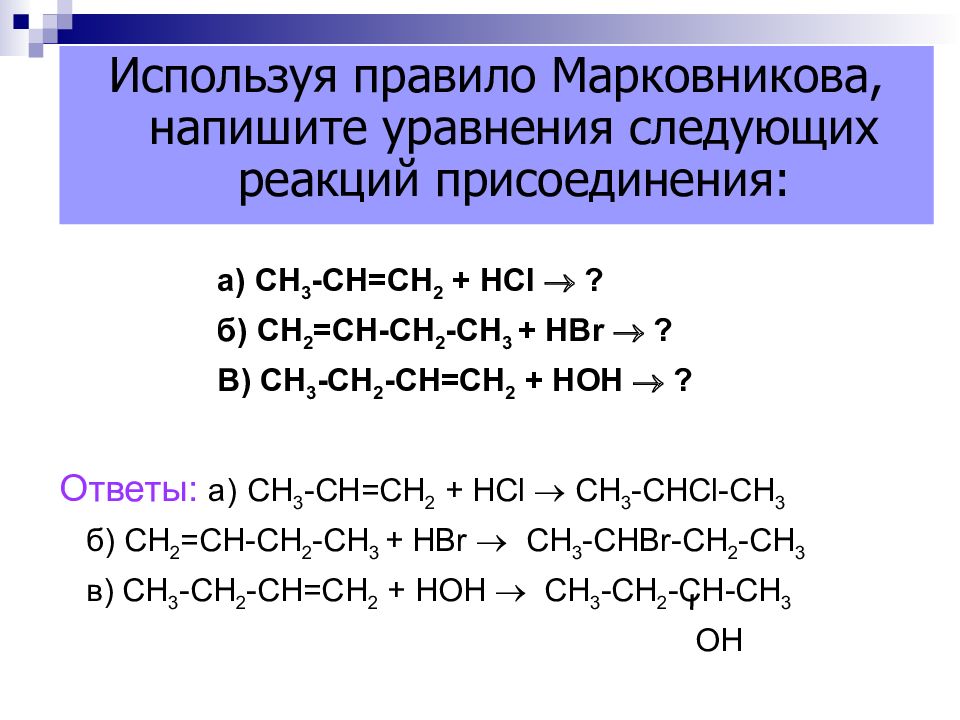
Слайд 46
а) СН 3 -СН=СН 2 + НС l ? б) СН 2 =СН-СН 2 -СН 3 + Н Br ? В) СН 3 -СН 2 -СН=СН 2 + НОН ? Ответы: а) СН 3 -СН=СН 2 + НС l СН 3 -СН Cl- СН 3 б) СН 2 =СН-СН 2 -СН 3 + Н Br СН 3 -СН Br -СН 2 -СН 3 в) СН 3 -СН 2 -СН=СН 2 + НОН СН 3 -СН 2 -СН-СН 3 ОН Используя правило Марковникова, напишите уравнения следующих реакций присоединения: