Первый слайд презентации: Гетерофункциональные соединения
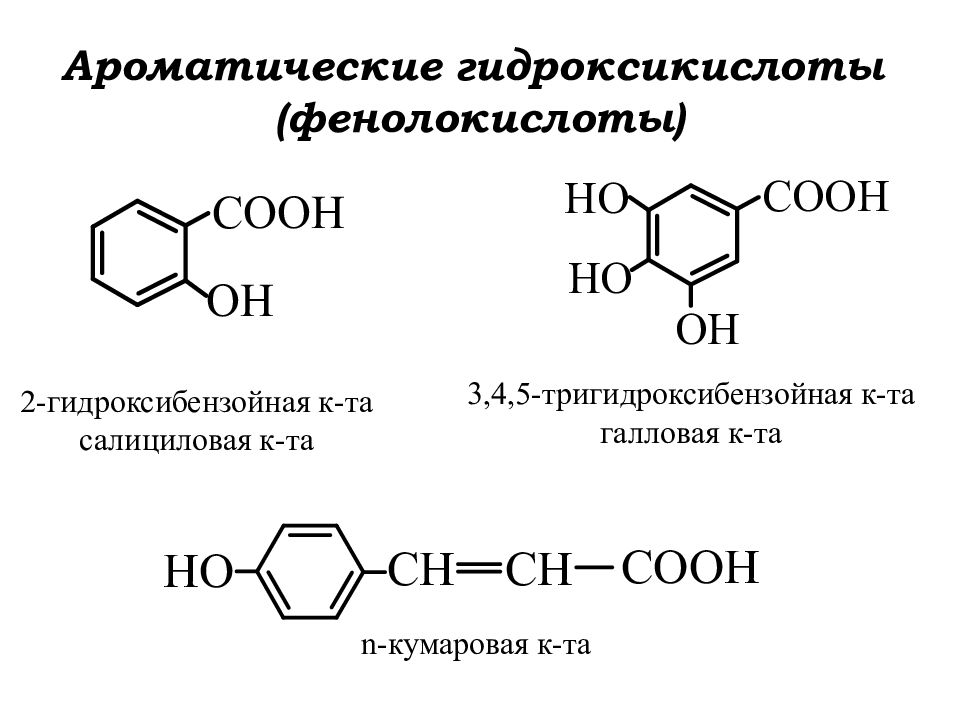
Слайд 2: Ароматические гидроксикислоты (фенолокислоты)
2-гидроксибензойная к-та салициловая к-та 3,4,5-тригидроксибензойная к-та галловая к-та n- кумаровая к-та
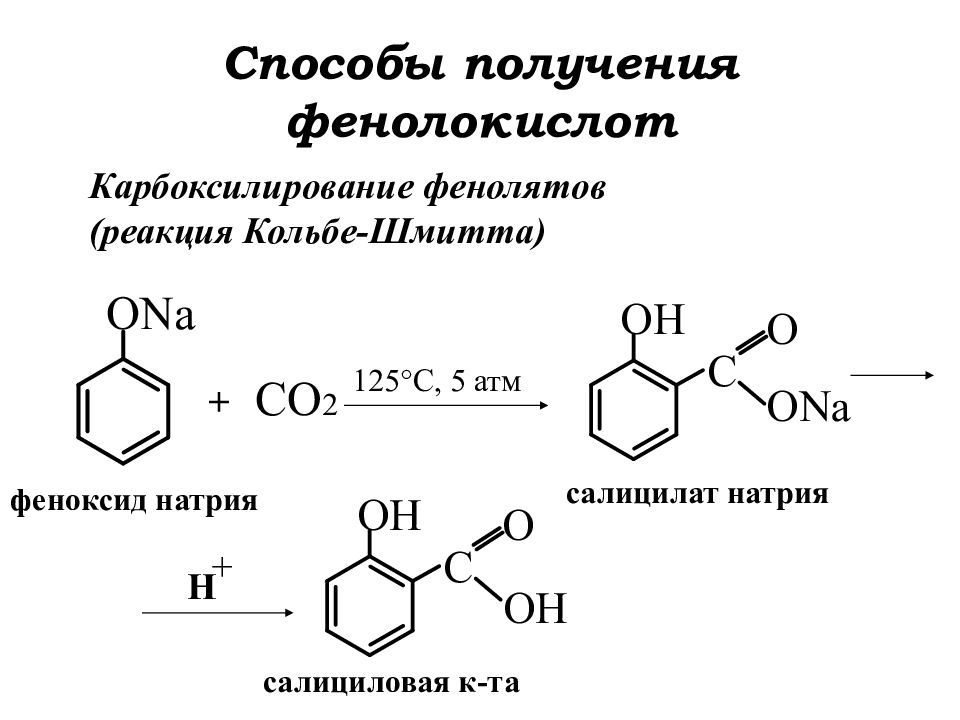
Слайд 3: Способы получения фенолокислот
Карбоксилирование фенолятов (реакция Кольбе-Шмитта) + СО 2 125 °C, 5 атм H + феноксид натрия салицилат натрия салициловая к-та
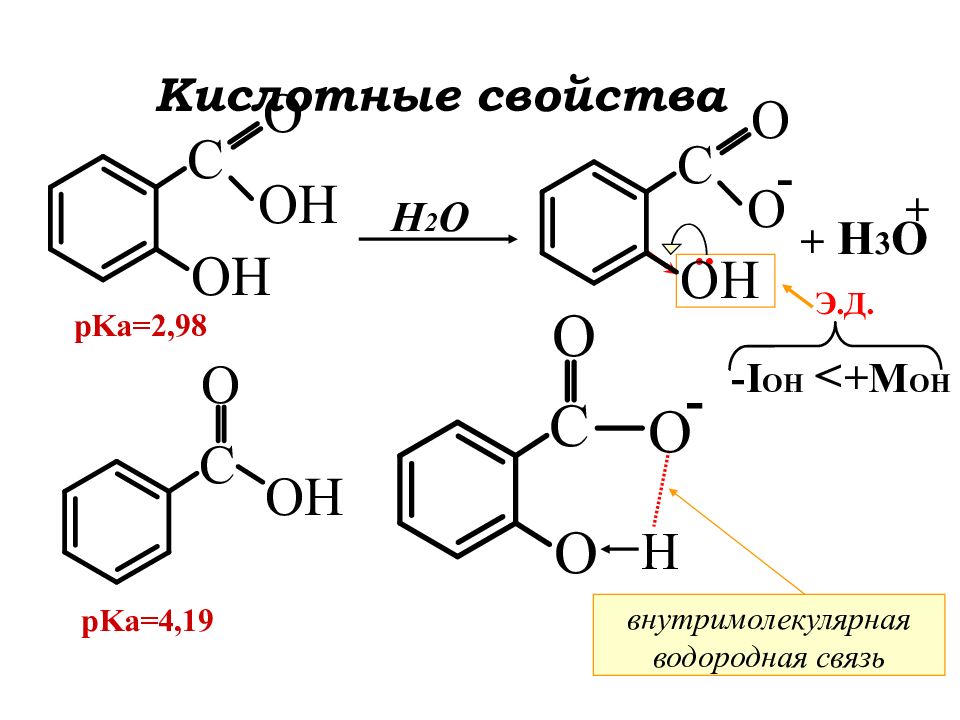
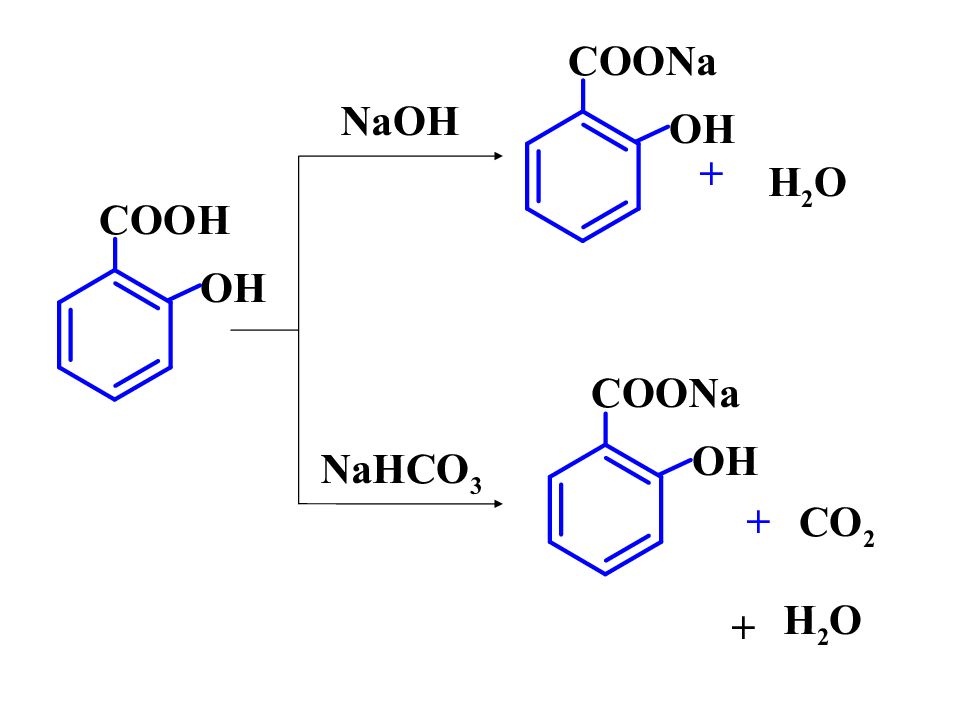
Слайд 4
- H 2 O H 3 O + + - H pKa=2,98 pKa=4,19 внутримолекулярная водородная связь .. - I OH +M OH > Э.Д. Кислотные свойства
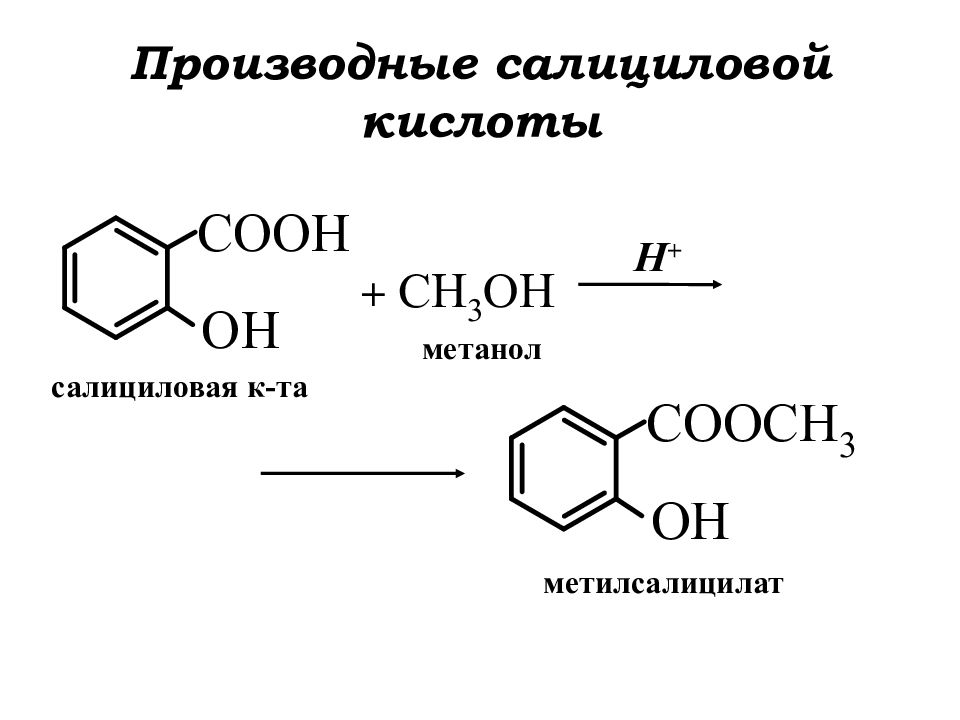
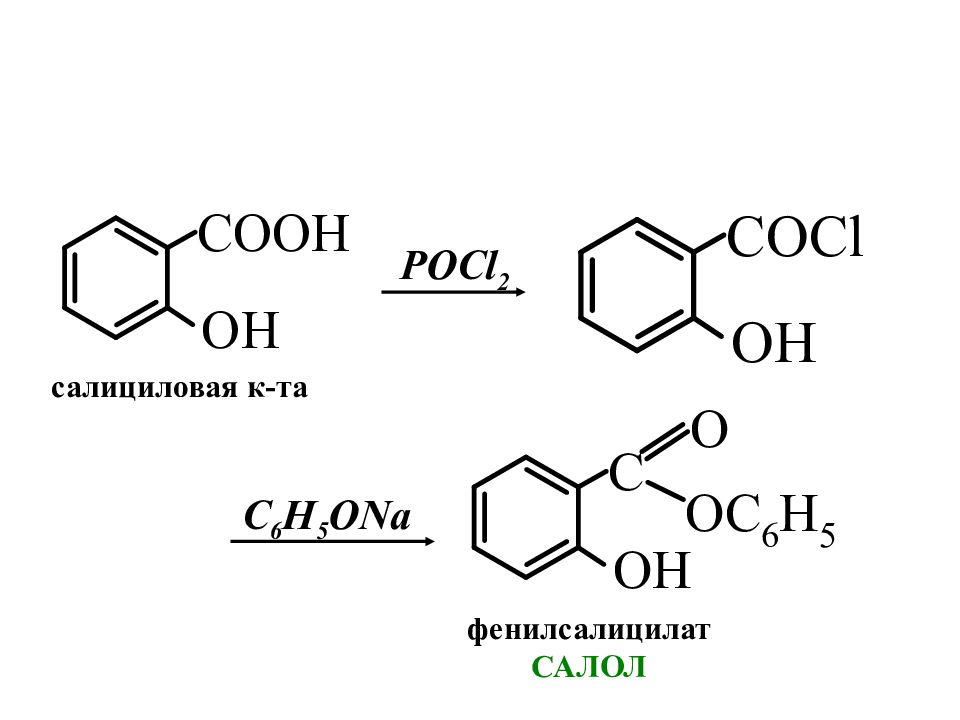
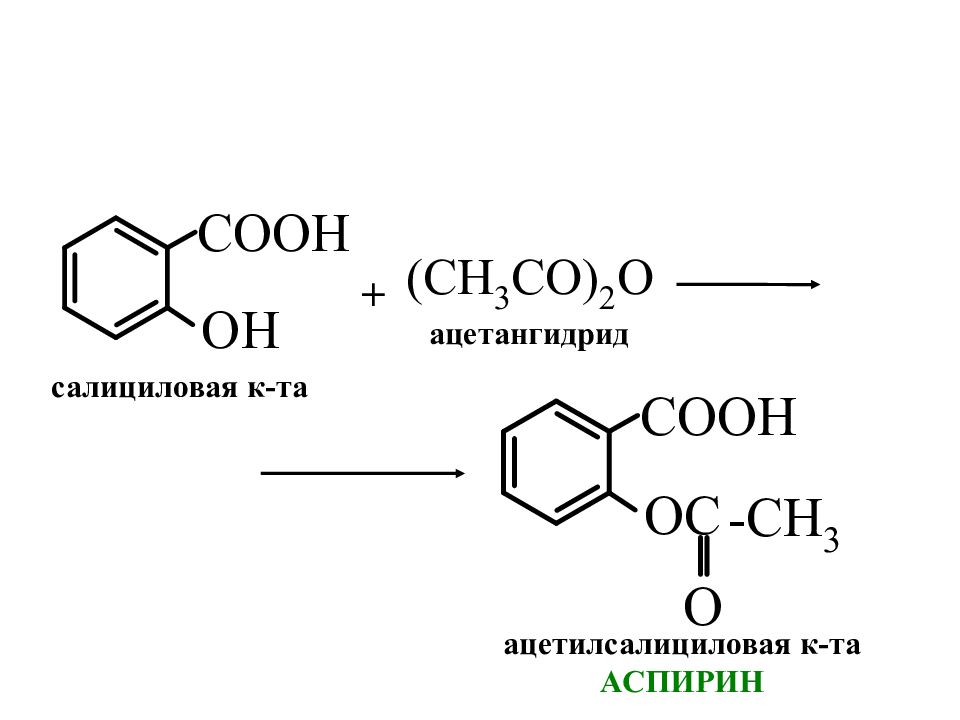
Слайд 6: Производные салициловой кислоты
+ H + салициловая к-та метанол метилсалицилат
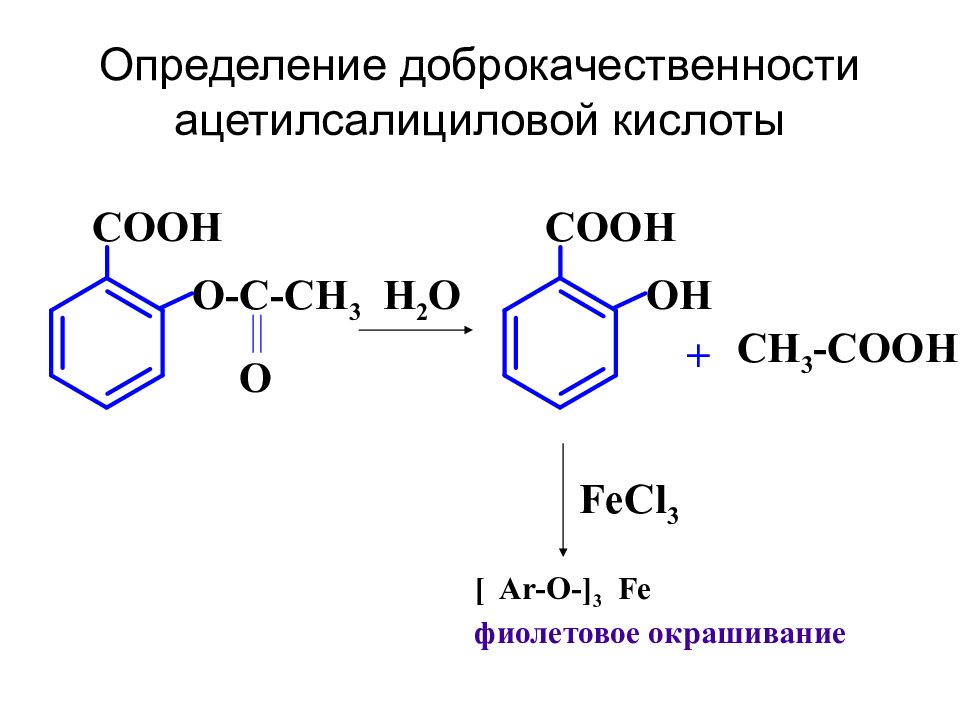
Слайд 9: Определение доброкачественности ацетилсалициловой кислоты
COOH O-C-CH 3 O H 2 O COOH OH + CH 3 -COOH FeCl 3 [ Ar-O-] 3 Fe фиолетовое окрашивание
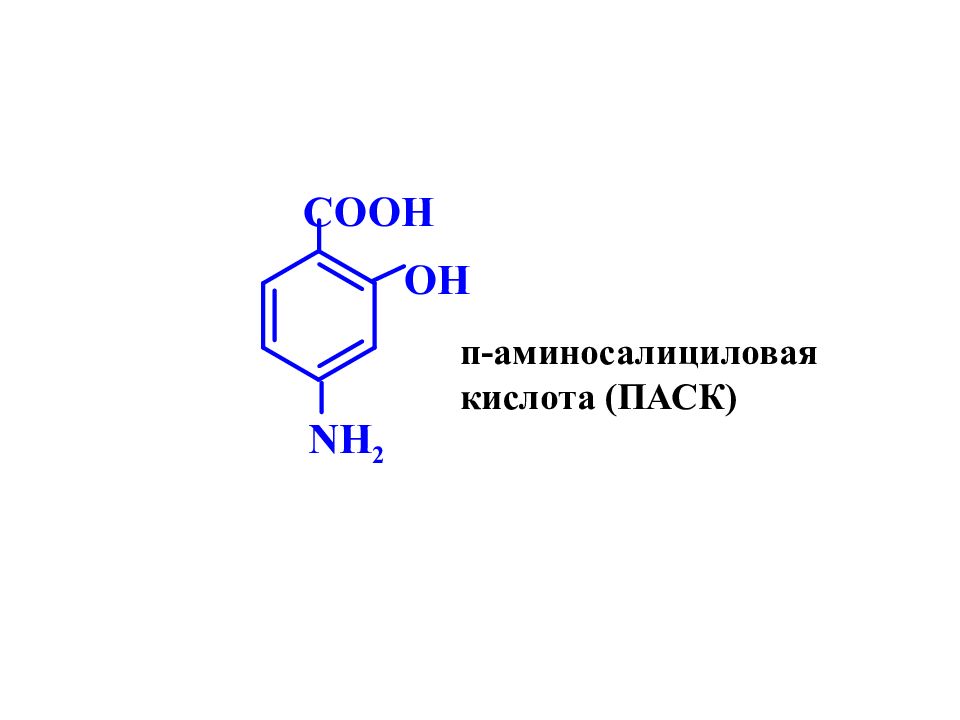
Слайд 11
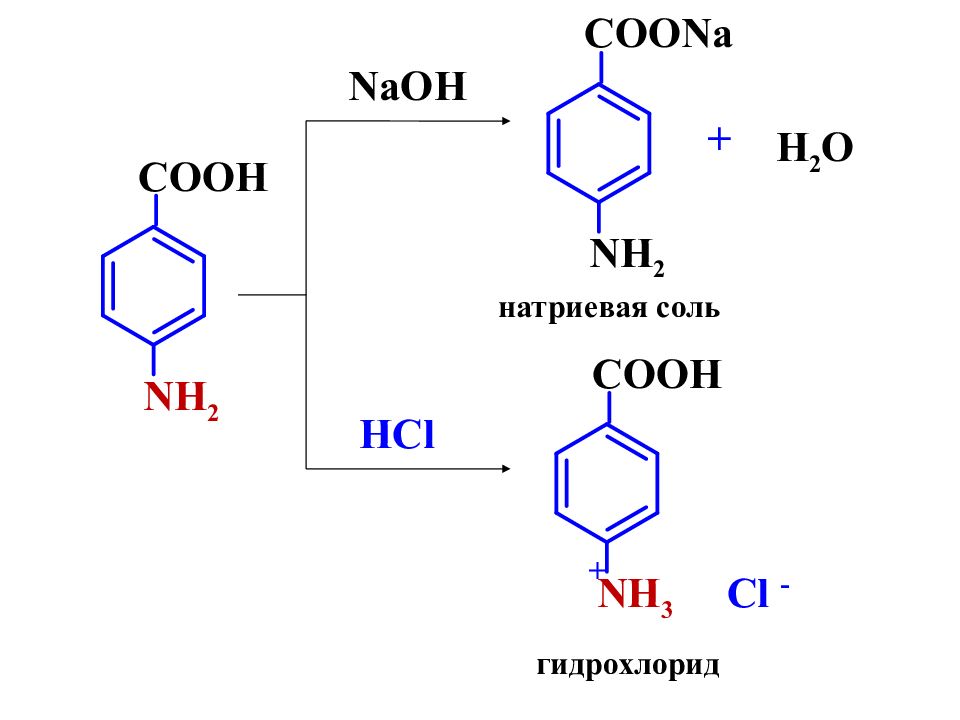
COOH NH 2 NaOH COONa NH 2 натриевая соль + H 2 O HCl COOH NH 3 Cl - + гидрохлорид
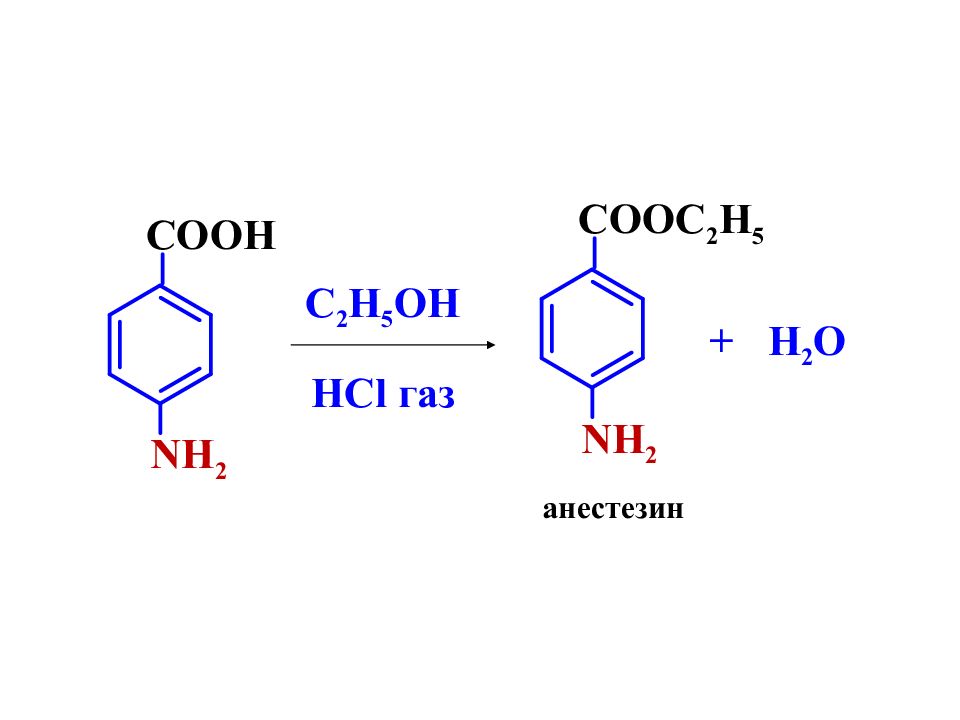
Слайд 13
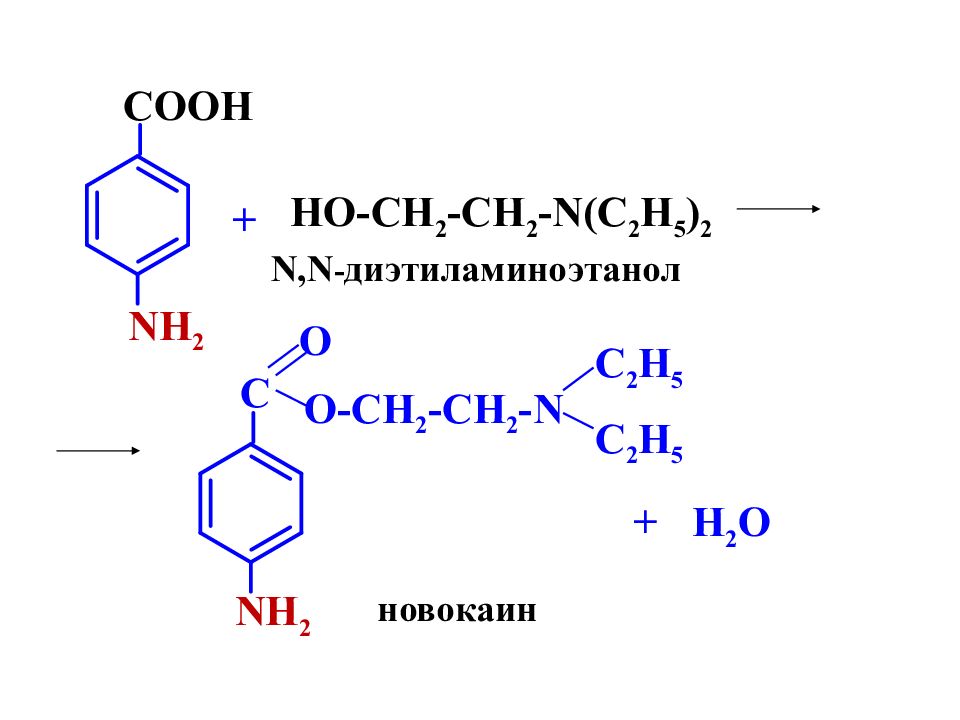
COOH NH 2 HO-CH 2 -CH 2 -N(C 2 H 5 ) 2 + N,N - диэтиламиноэтанол C NH 2 O O-CH 2 -CH 2 -N C 2 H 5 C 2 H 5 + H 2 O новокаин
Слайд 14
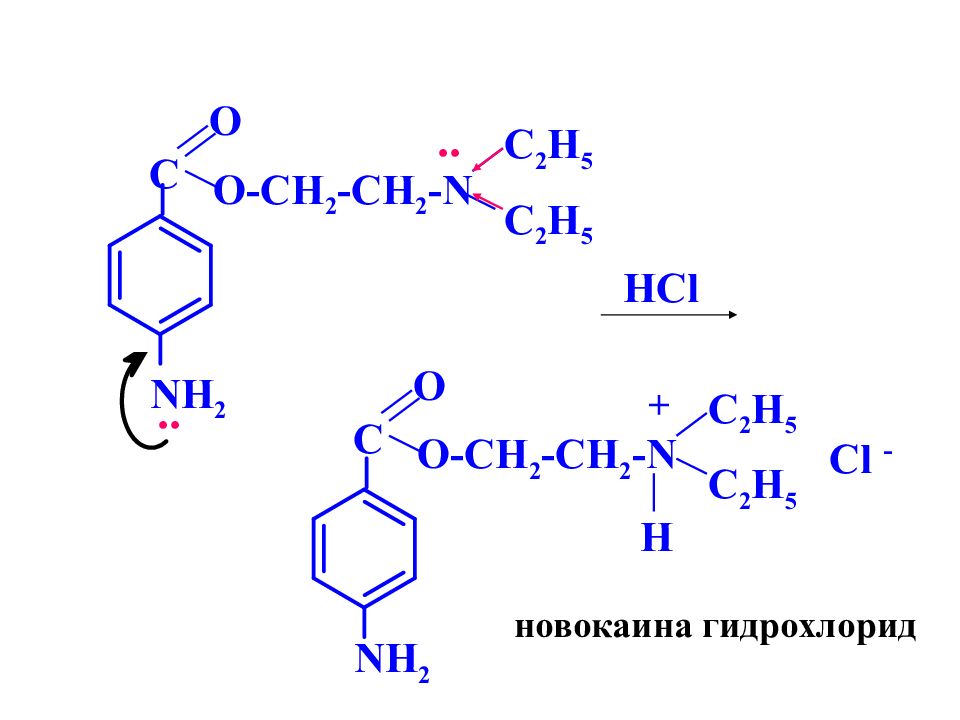
C NH 2 O O-CH 2 -CH 2 -N C 2 H 5 C 2 H 5 HCl .. .. C NH 2 O O-CH 2 -CH 2 -N C 2 H 5 C 2 H 5 H + Cl - новокаина гидрохлорид
Слайд 15
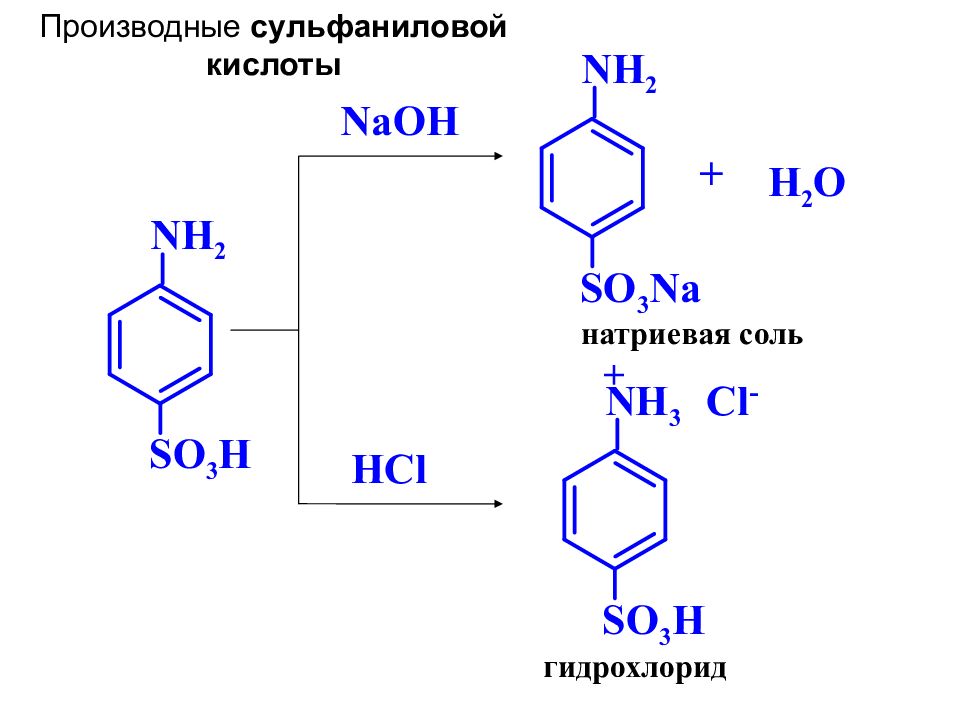
NH 2 SO 3 H NaOH натриевая соль + H 2 O HCl гидрохлорид NH 2 SO 3 Na NH 3 Cl - SO 3 H + Производные сульфаниловой кислоты
Слайд 16
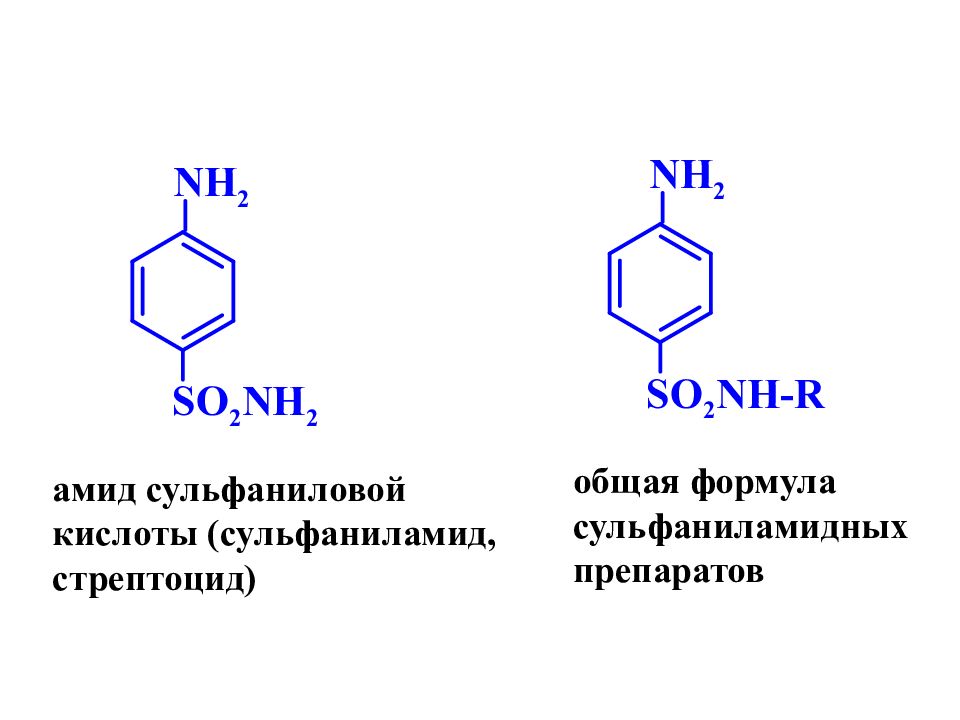
NH 2 SO 2 NH 2 NH 2 SO 2 NH-R амид сульфаниловой кислоты (сульфаниламид, стрептоцид) общая формула сульфаниламидных препаратов
Слайд 18
Гетероциклические соединения Гетероциклическими называют соединения, в циклах которых помимо атомов углерода содержатся и другие атомы (т.н. гетероатомы ), чаще всего N, O, S
Слайд 19
Классификация гетероциклов Основные признаки классификации: природа гетероатома (пиррол и тиол ); число гетероатомов (пиррол и имидазол); размер цикла (пиррол и пиридин); степень насыщенности ( фуран, ТГФ)
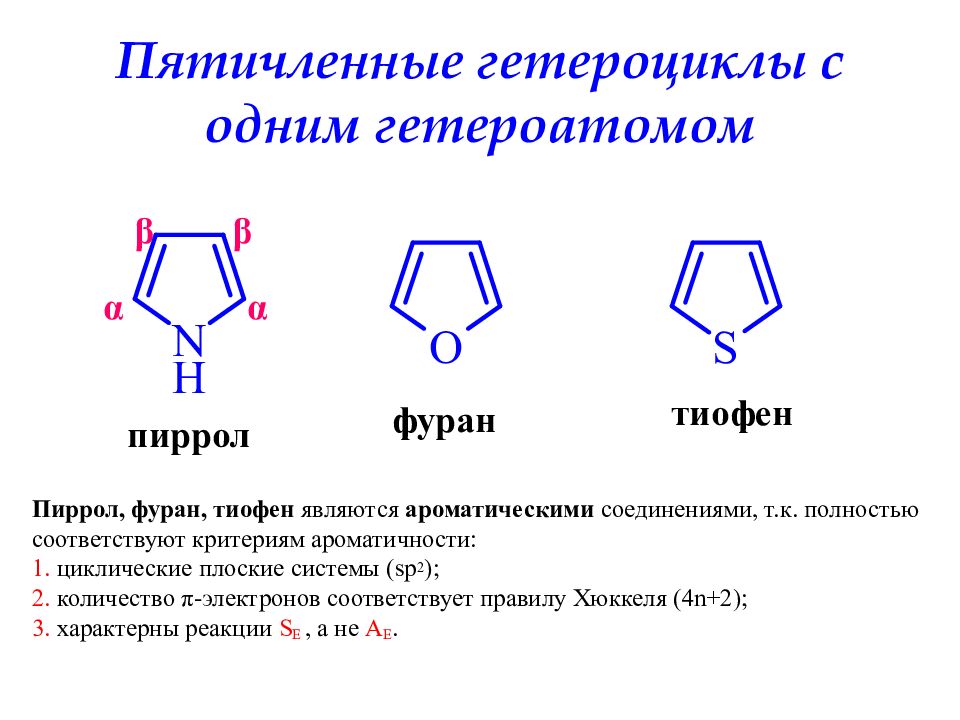
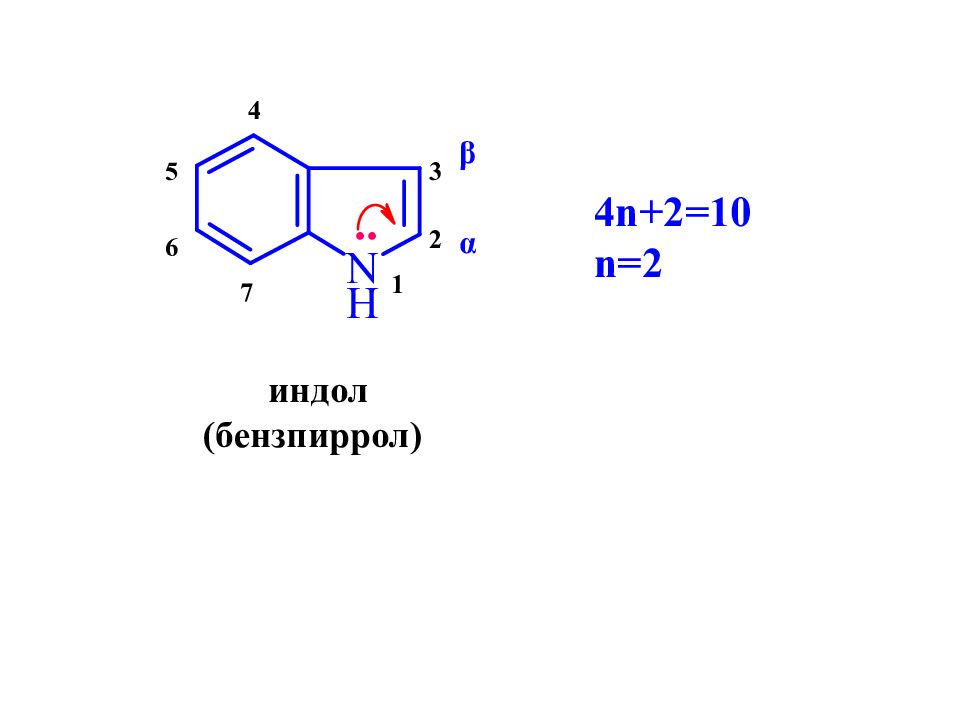
Слайд 20: Пятичленные гетероциклы с одним гетероатомом
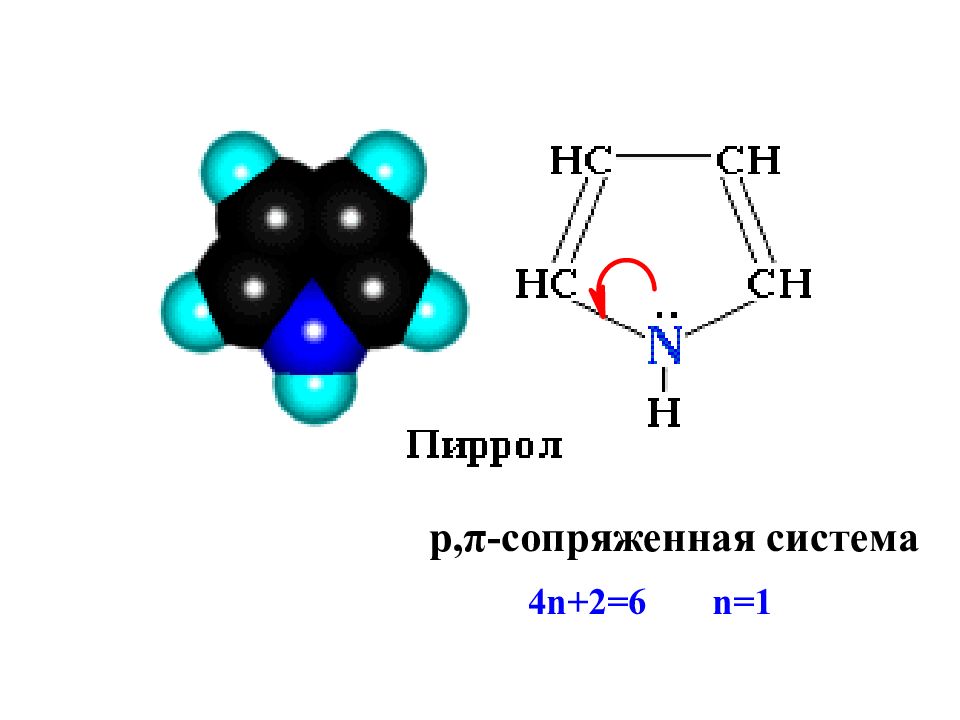
пиррол фуран тиофен α α β β Пиррол, фуран, тиофен являются ароматическими соединениями, т.к. полностью соответствуют критериям ароматичности: 1. циклические плоские системы ( sp 2 ); 2. количество π -электронов соответствует правилу Хюккеля (4 n+2); 3. характерны реакции S E, а не А Е.
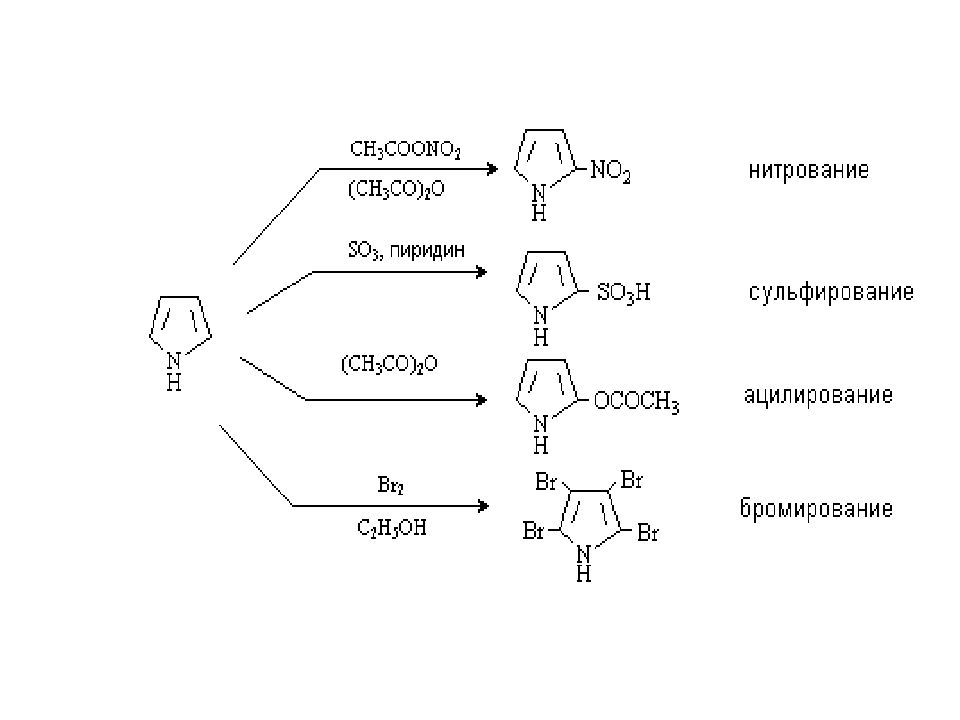
Слайд 22
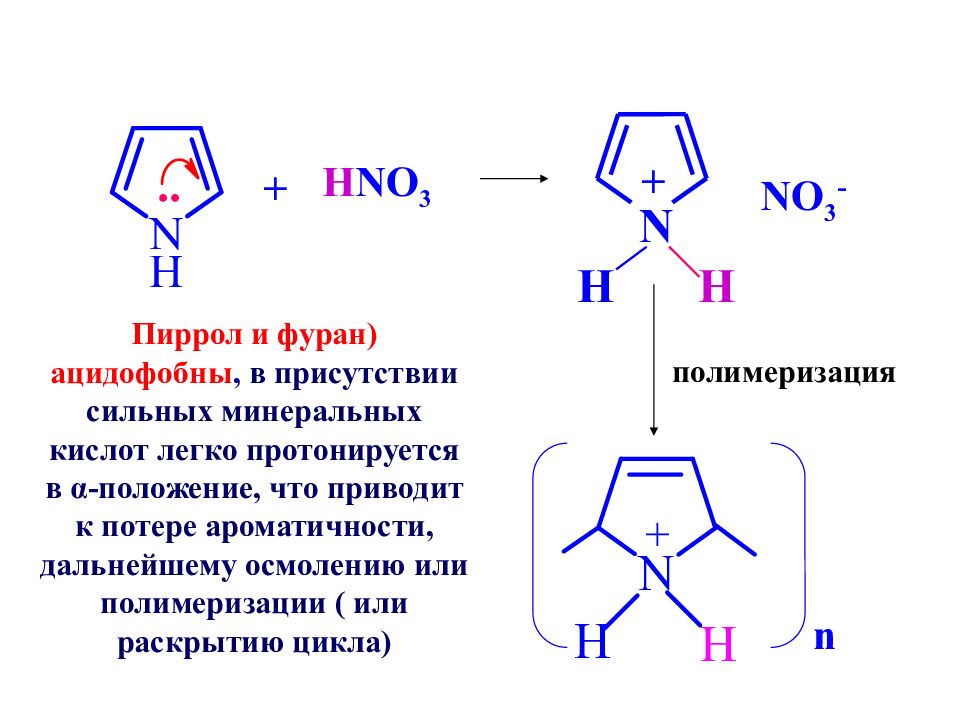
.. + H NO 3 N H H + NO 3 - полимеризация n Пиррол и фуран) ацидофобны, в присутствии сильных минеральных кислот легко протонируется в α-положение, что приводит к потере ароматичности, дальнейшему осмолению или полимеризации ( или раскрытию цикла)
Слайд 23
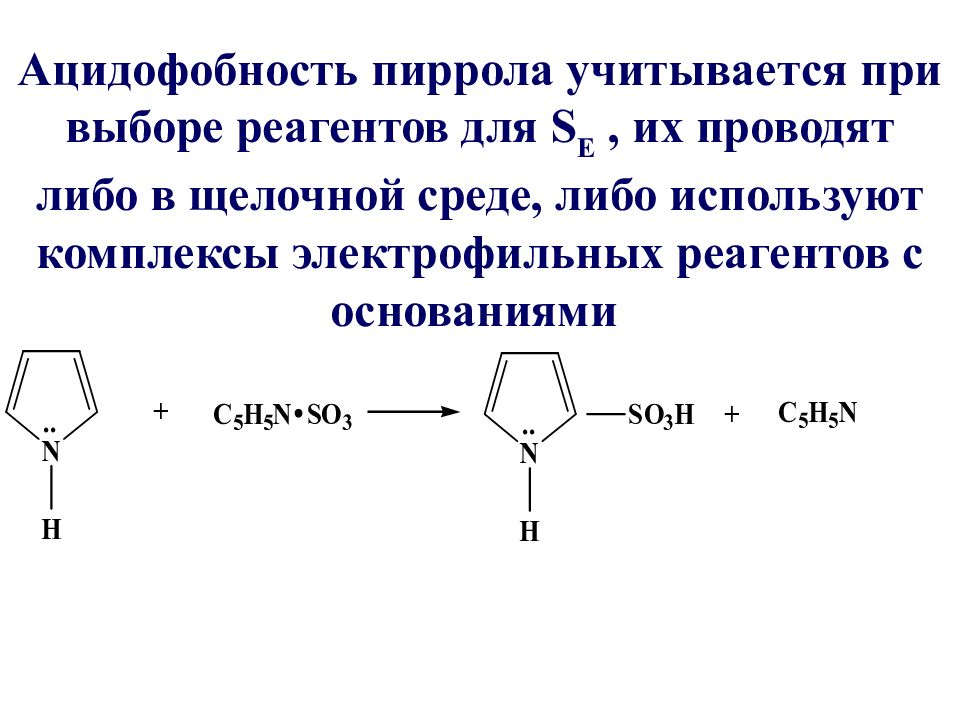
Ацидофобность пиррола учитывается при выборе реагентов для S Е, их проводят либо в щелочной среде, либо используют комплексы электрофильных реагентов с основаниями
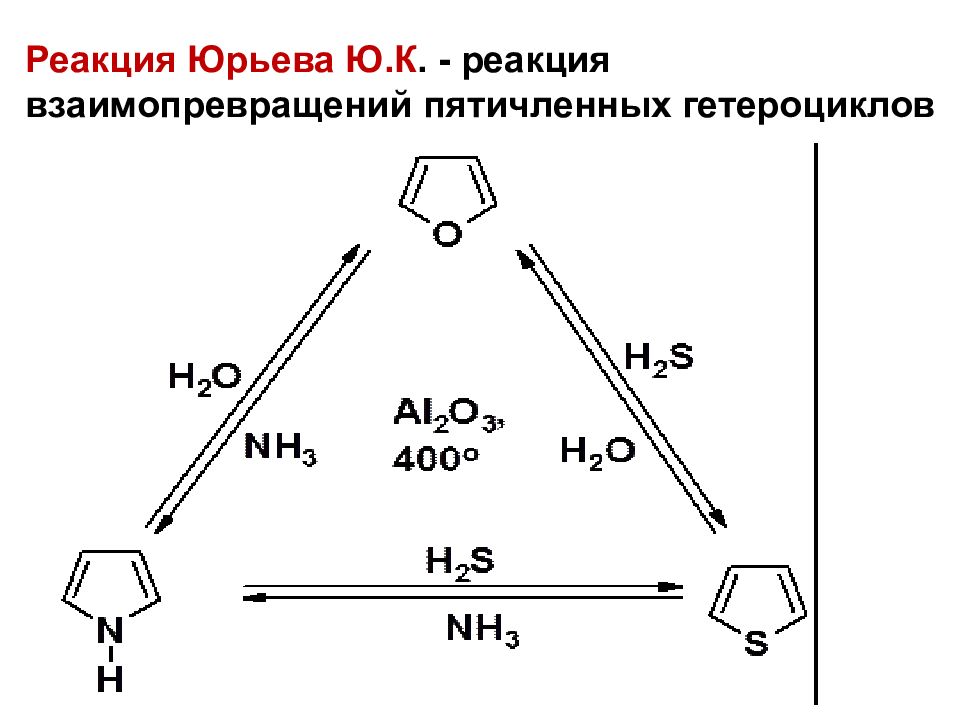
Слайд 25
Реакция Юрьева Ю.К. - реакция взаимопревращений пятичленных гетероциклов
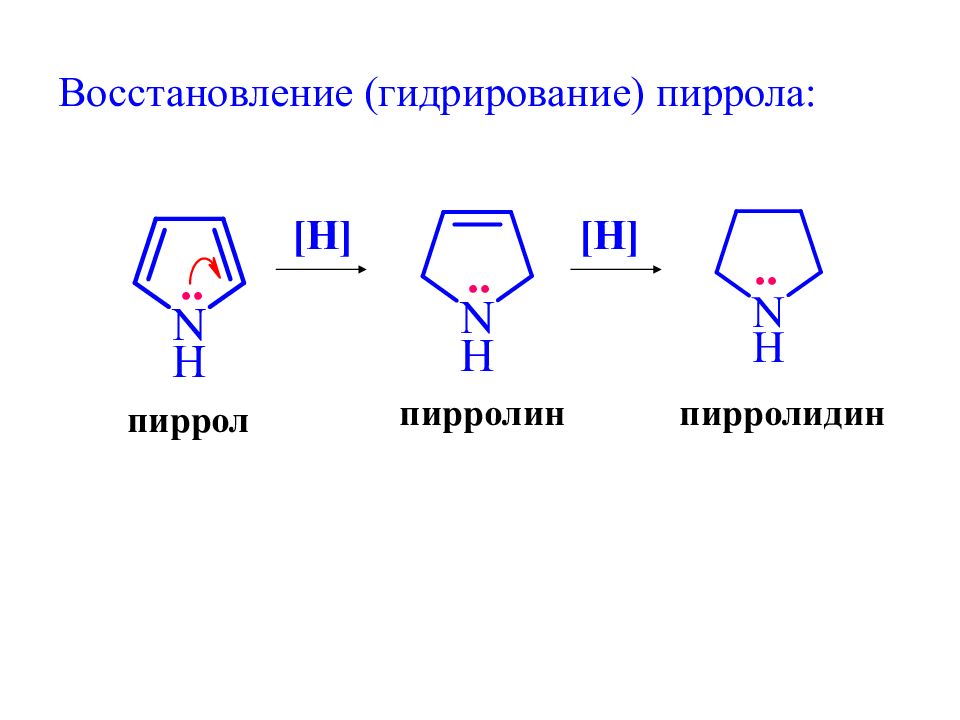
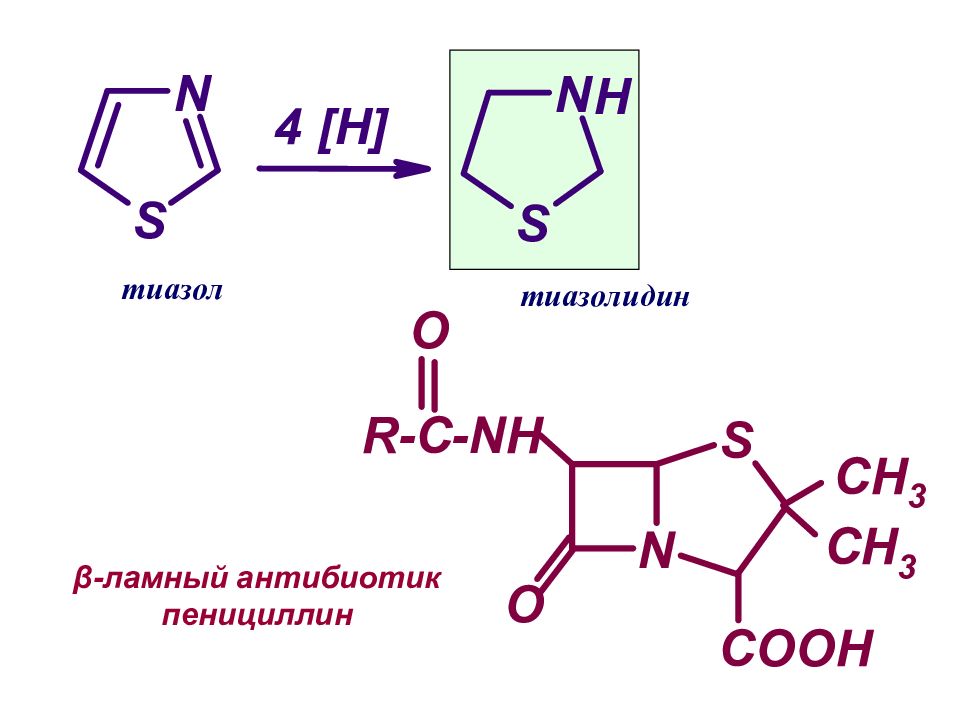
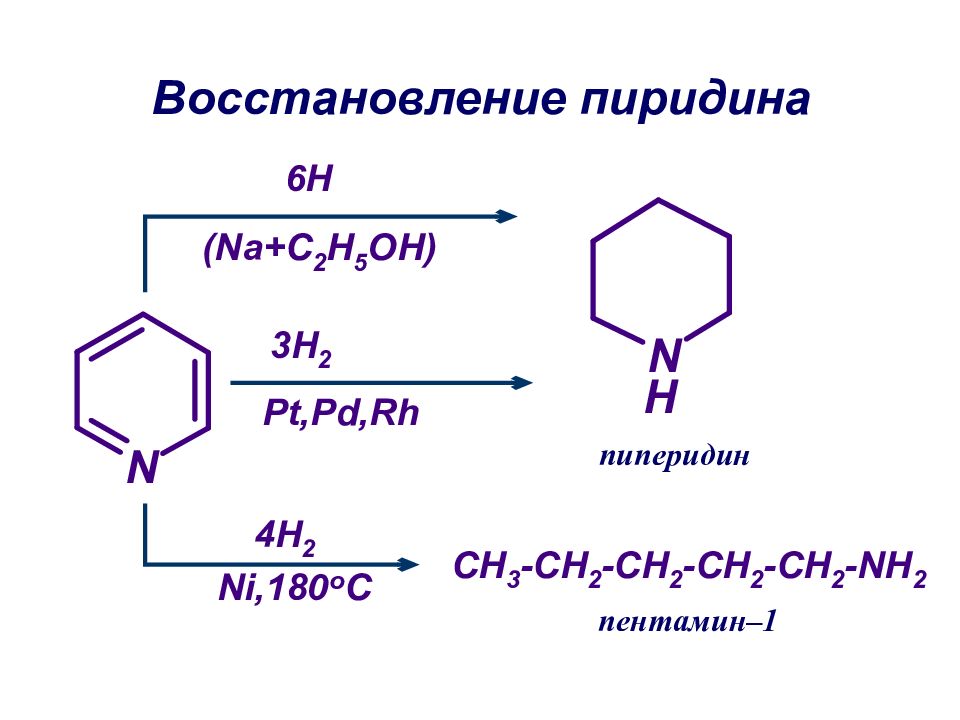
Слайд 26: Восстановление (гидрирование) пиррола:
[H] пиррол пирролин [H] пирролидин .. .. ..
Слайд 28
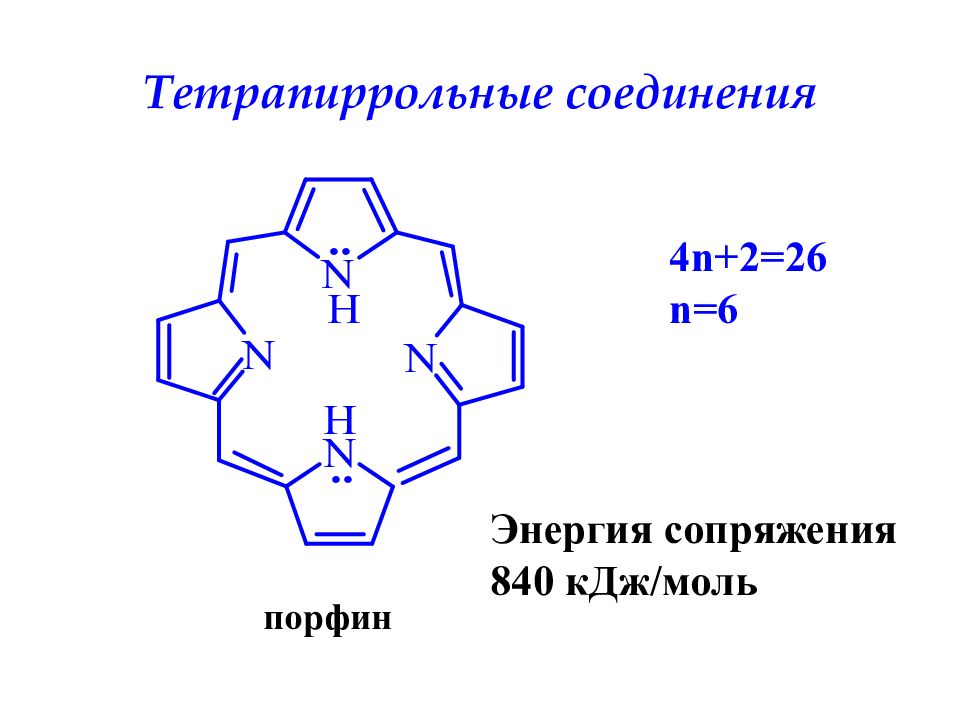
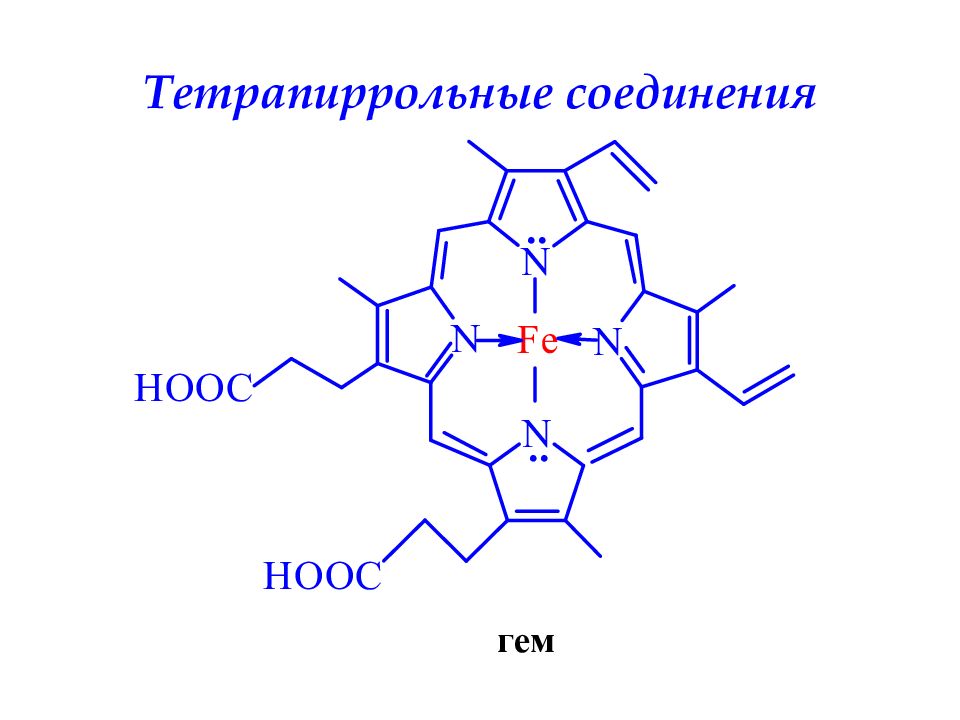
4 пиррольных кольца образуют циклическую сопряженную систему порфин, которая входит в состав хлорофилла, гемоглобина и цитохромов. Порфиновое кольцо обладает высокой термодинамической устойчивостью, его энергия сопряжения ≈ 840 кДж/моль. Порфиновый цикл может содержать различные заместители
Слайд 29: Тетрапиррольные соединения
порфин Тетрапиррольные соединения 4n+2=26 n=6 Энергия сопряжения 840 кДж/моль
Слайд 32
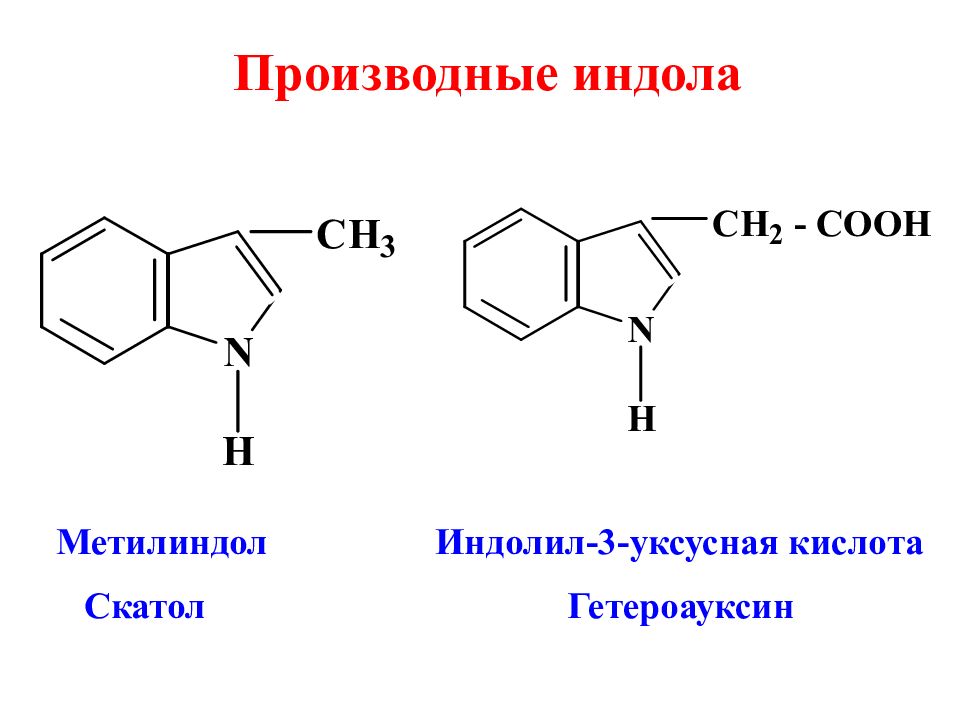
Производные индола Метилиндол Индолил-3-уксусная кислота Скатол Гетероауксин
Слайд 33
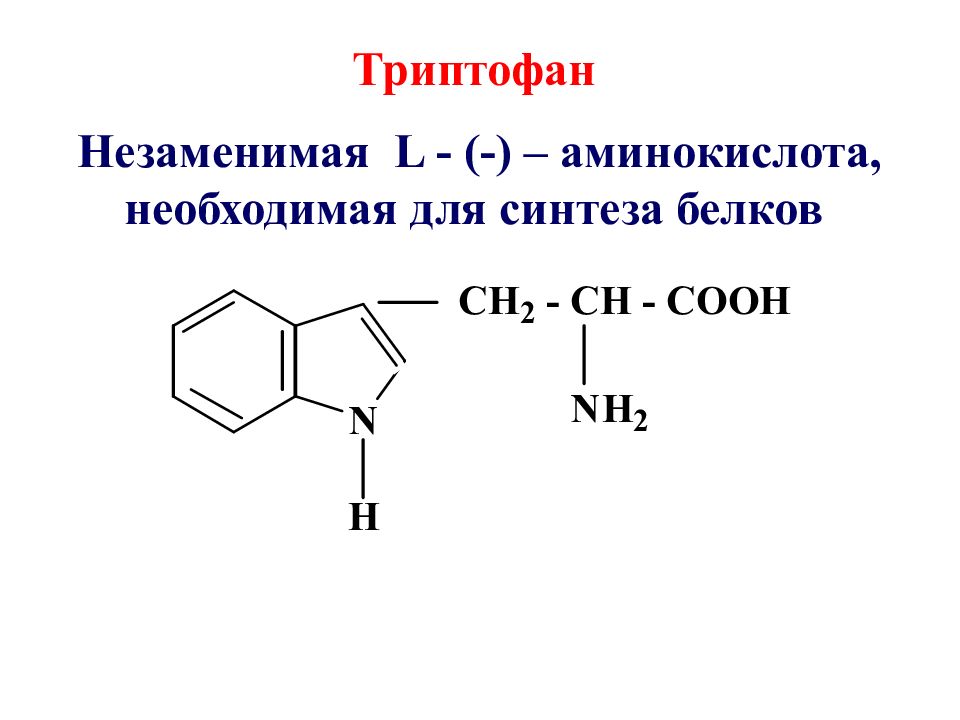
Триптофан Незаменимая L - (-) – аминокислота, необходимая для синтеза белков
Слайд 34
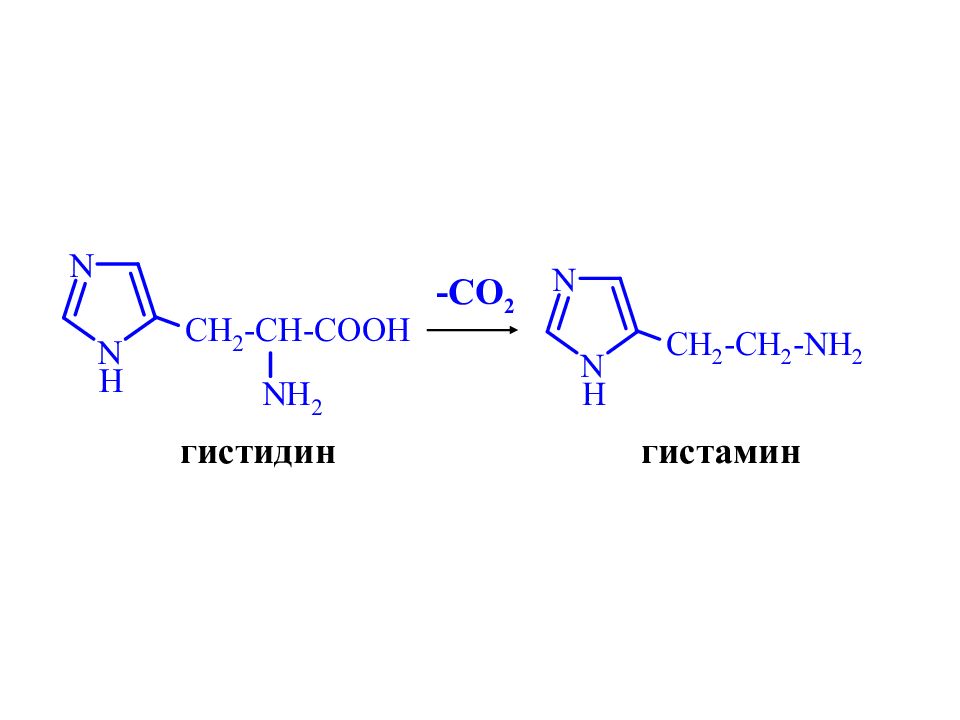
Продукт ы биологического расщепления триптофана : скатол, гетероауксин, триптамин – биогенный амин, серотонин – нейромедиатор головного мозга, нарушение его обмена приводит к шизофрении и другим психическим заболеваниям
Слайд 35
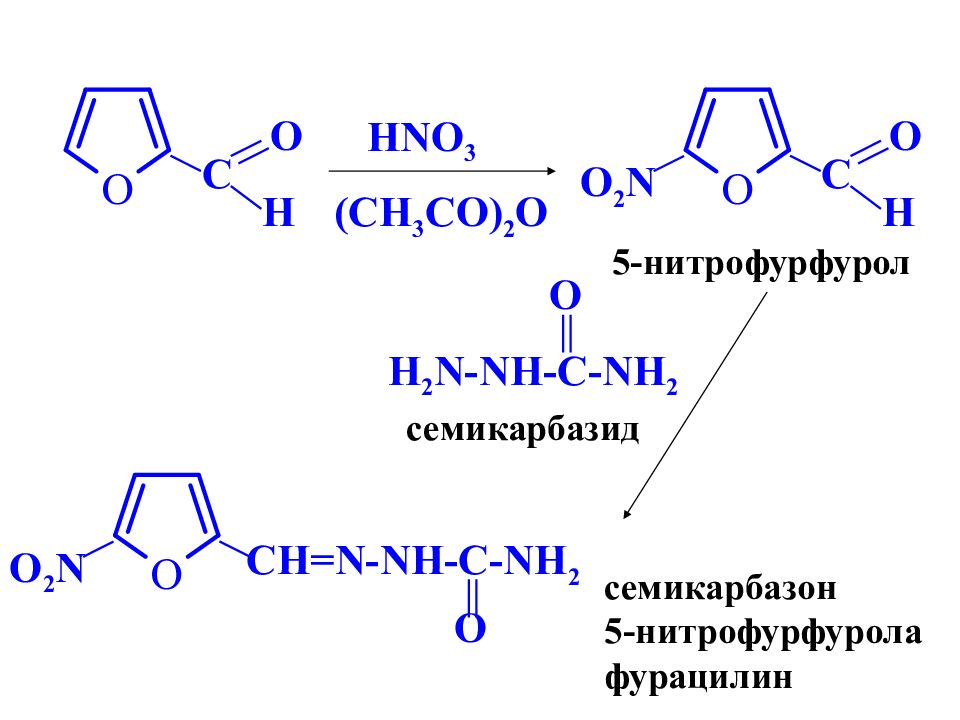
C O H HNO 3 (CH 3 CO) 2 O C O H O 2 N 5-нитрофурфурол H 2 N-NH-C-NH 2 O семикарбазид CH=N-NH-C-NH 2 O O 2 N семикарбазон 5-нитрофурфурола фурацилин
Слайд 37
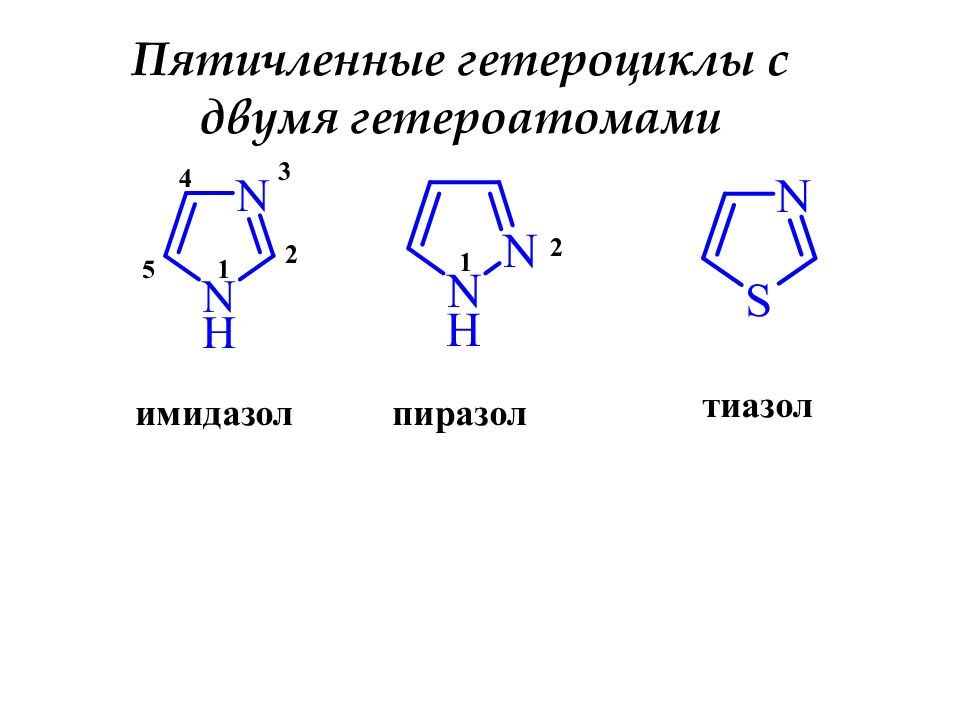
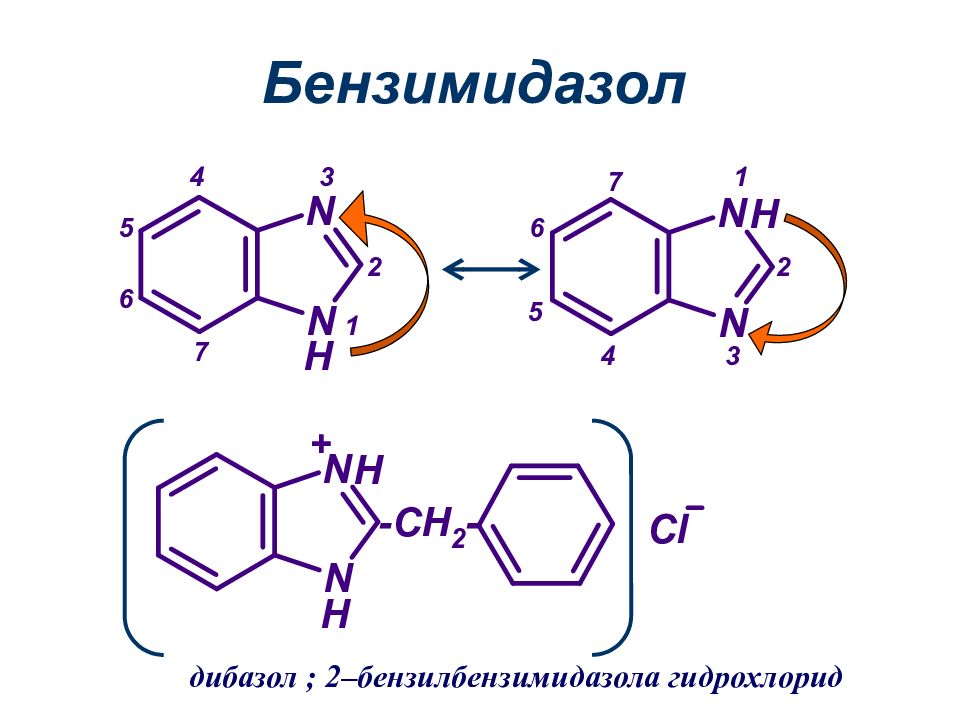
имидазол 5 4 3 2 1 пиразол 1 2 тиазол Пятичленные гетероциклы с двумя гетероатомами
Слайд 38
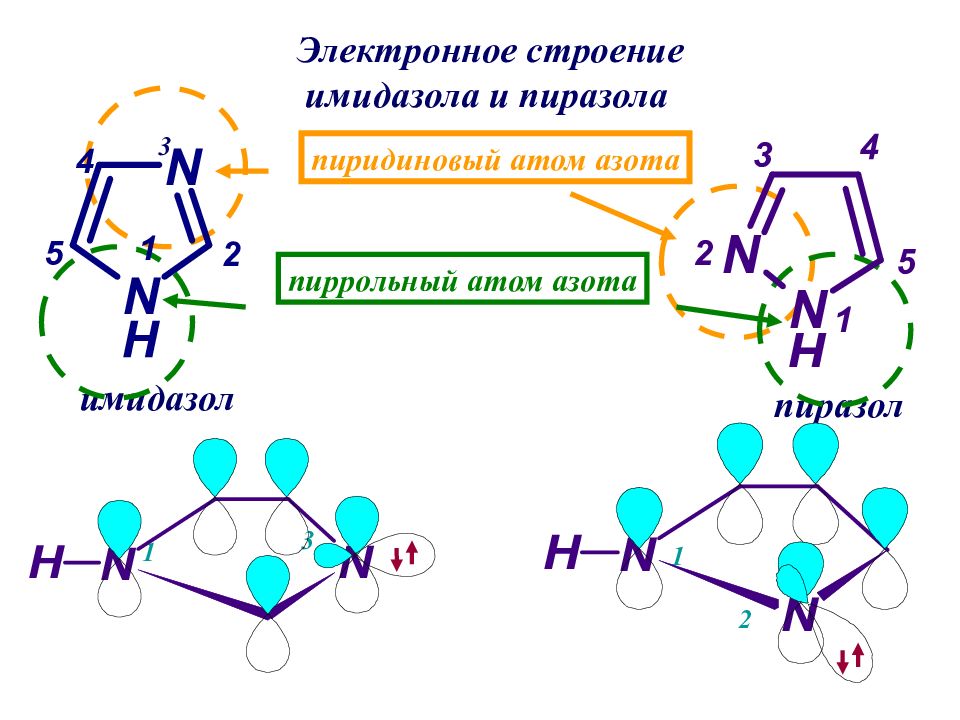
имидазол пиразол Электронное строение имидазола и пиразола пиррольный атом азота пиридиновый атом азота 3 1 1 2 3
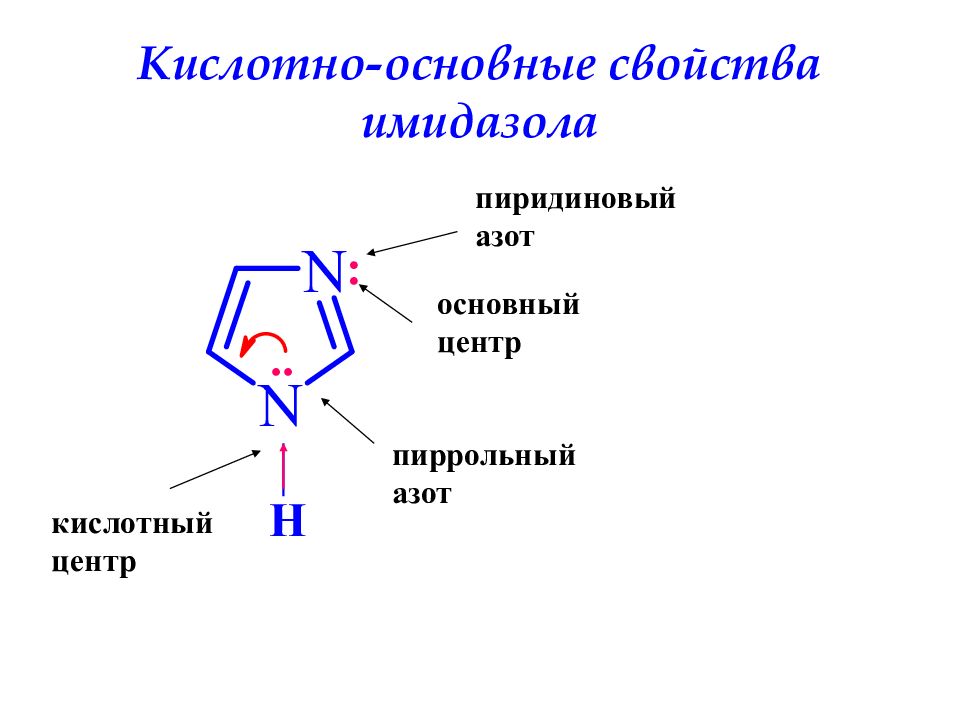
Слайд 39: Кислотно-основные свойства имидазола
H .. пиррольный азот пиридиновый азот : кислотный центр основный центр
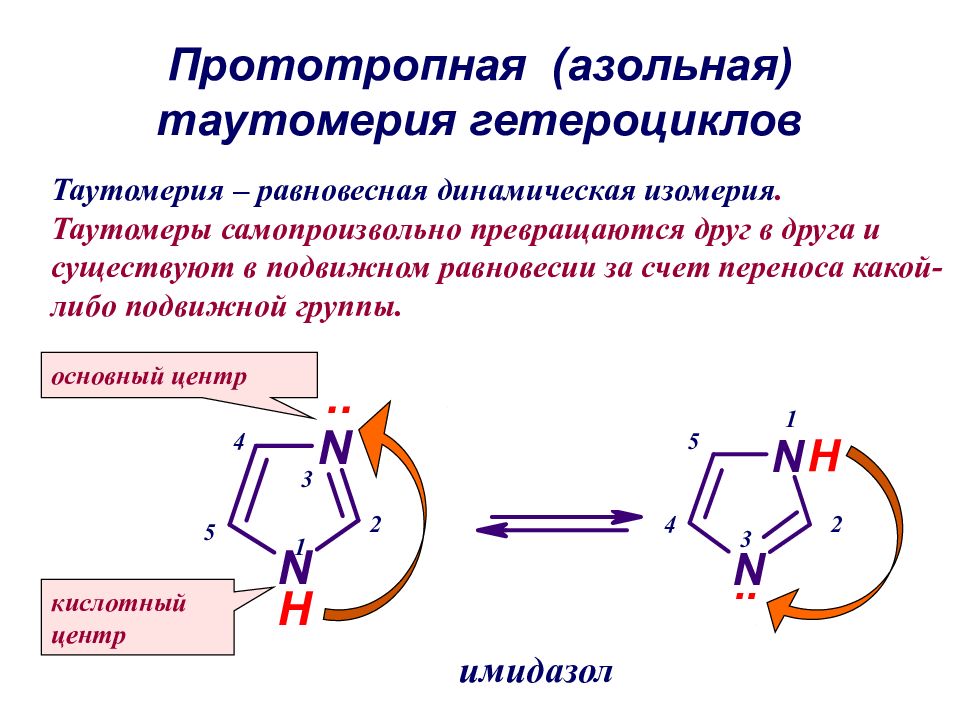
Слайд 40: Прототропная (азольная) таутомерия гетероциклов
основный центр кислотный центр 5 1 2 3 4 1 2 3 4 5 имидазол Таутомерия – равновесная динамическая изомерия. Таутомеры самопроизвольно превращаются друг в друга и существуют в подвижном равновесии за счет переноса какой-либо подвижной группы.
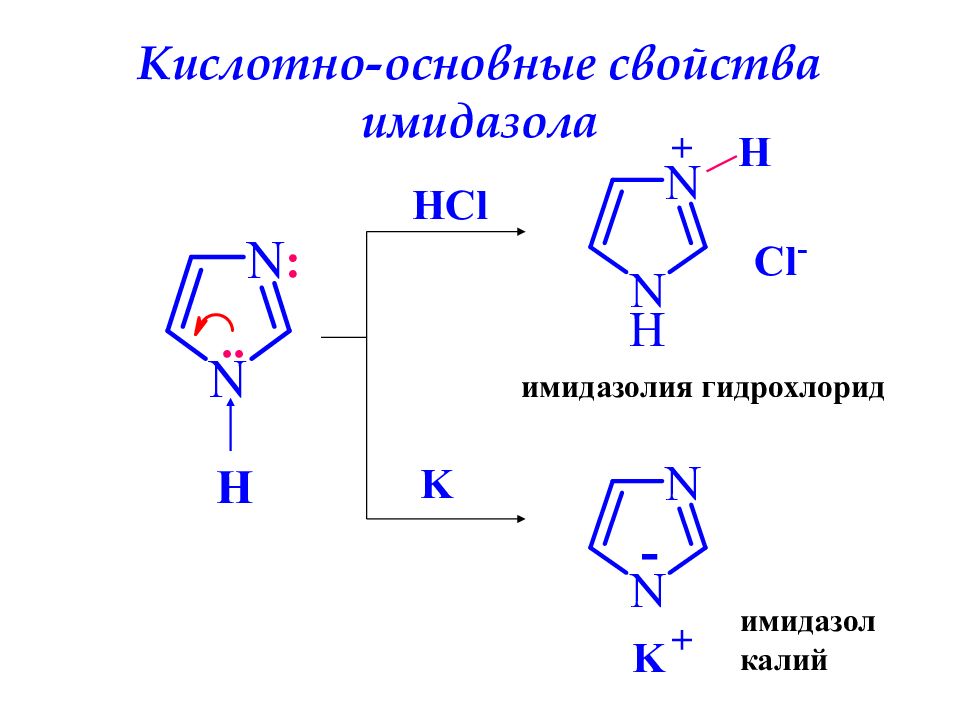
Слайд 41: Кислотно-основные свойства имидазола
H .. : HCl H + Cl - имидазолия гидрохлорид K + K - имидазол калий
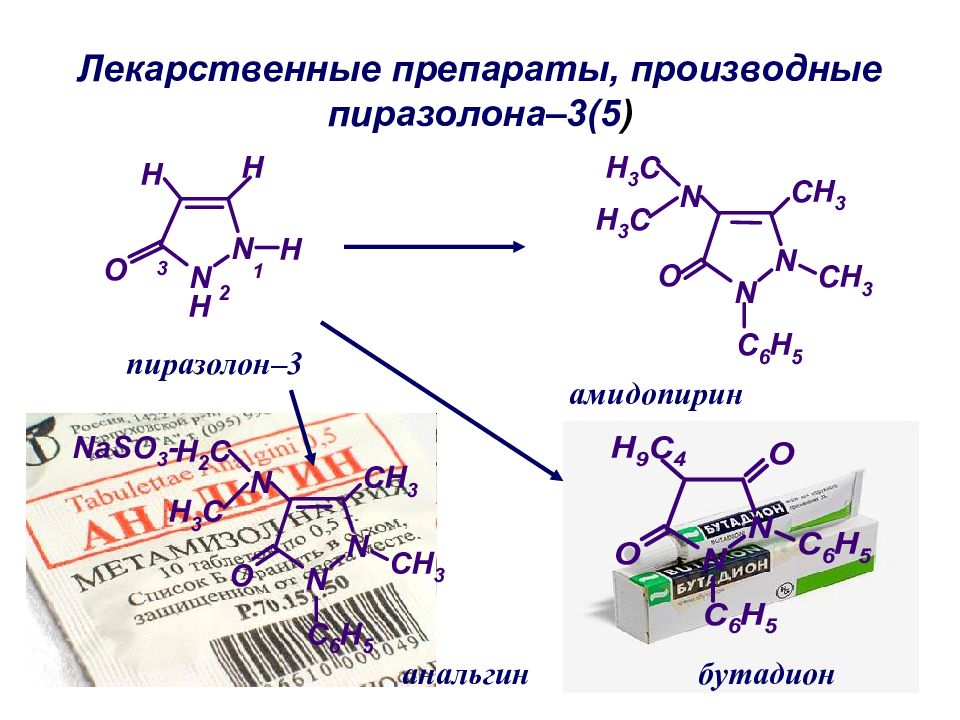
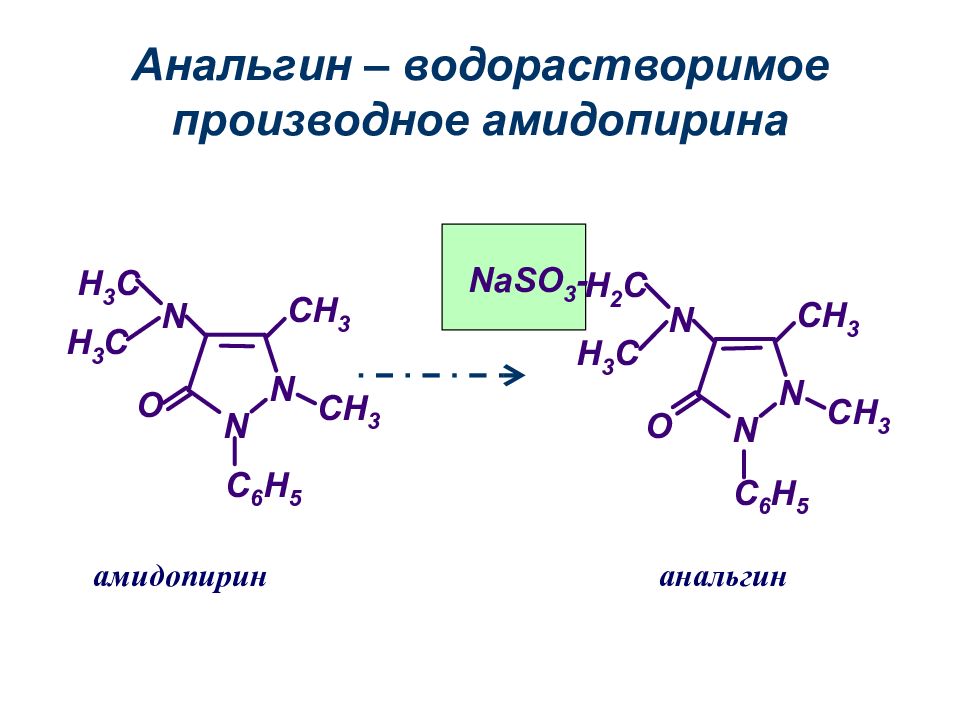
Слайд 44: Лекарственные препараты, производные пиразолона–3(5 )
пиразолон–3 анальгин бутадион амидопирин
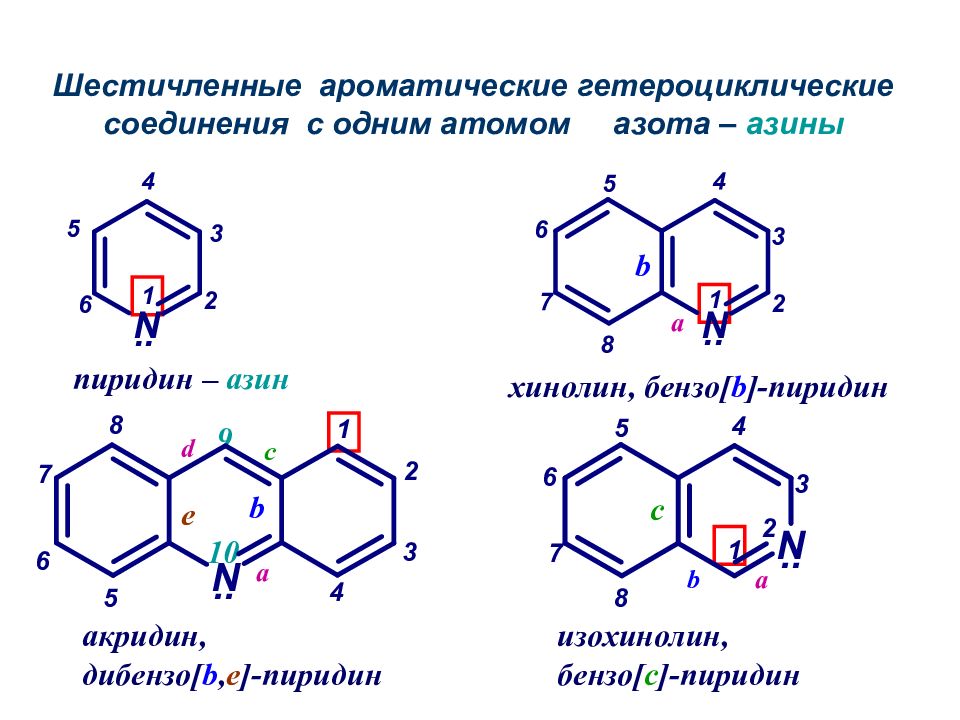
пиридин – азин хинолин, бензо [ b ]- пиридин изохинолин, бензо [ с ]- пиридин акридин, дибензо [ b, e ]- пиридин 9 10 a a a b b b c c d e
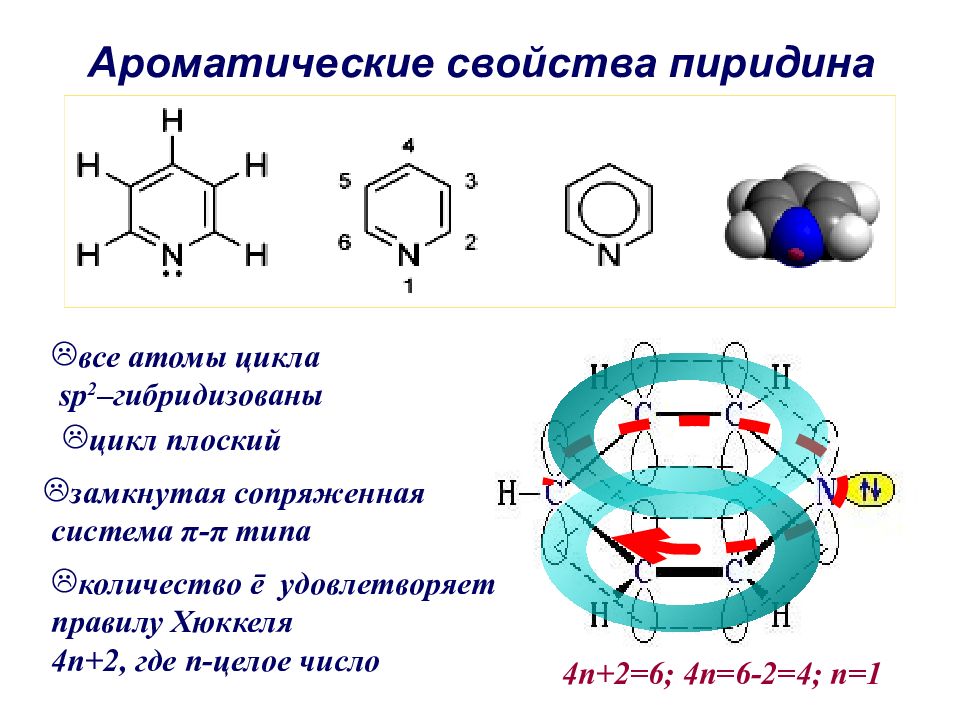
Слайд 48: Ароматические свойства пиридина
все атомы цикла sp 2 –гибридизованы цикл плоский замкнутая сопряженная система π - π типа количество ē удовлетворяет правилу Хюккеля 4 n+2, где n- целое число 4 n+2=6; 4n=6-2=4; n=1
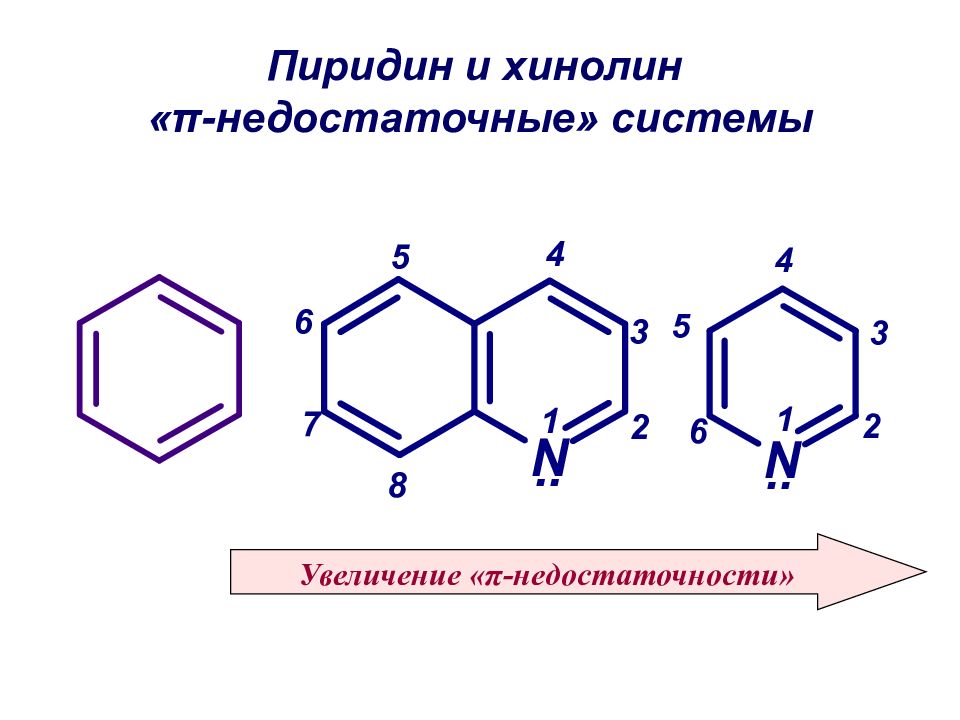
Слайд 49: Пиридин и хинолин « π -недостаточные» системы
Увеличение « π -недостаточности»
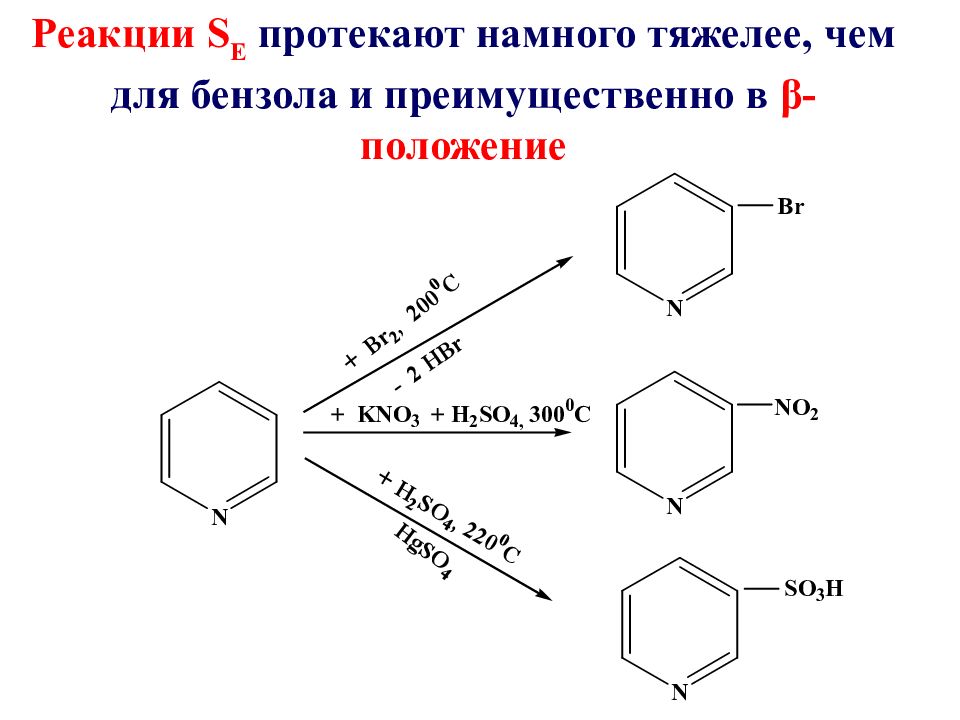
Слайд 50
Реакции S Е протекают намного тяжелее, чем для бензола и преимущественно в β-положение
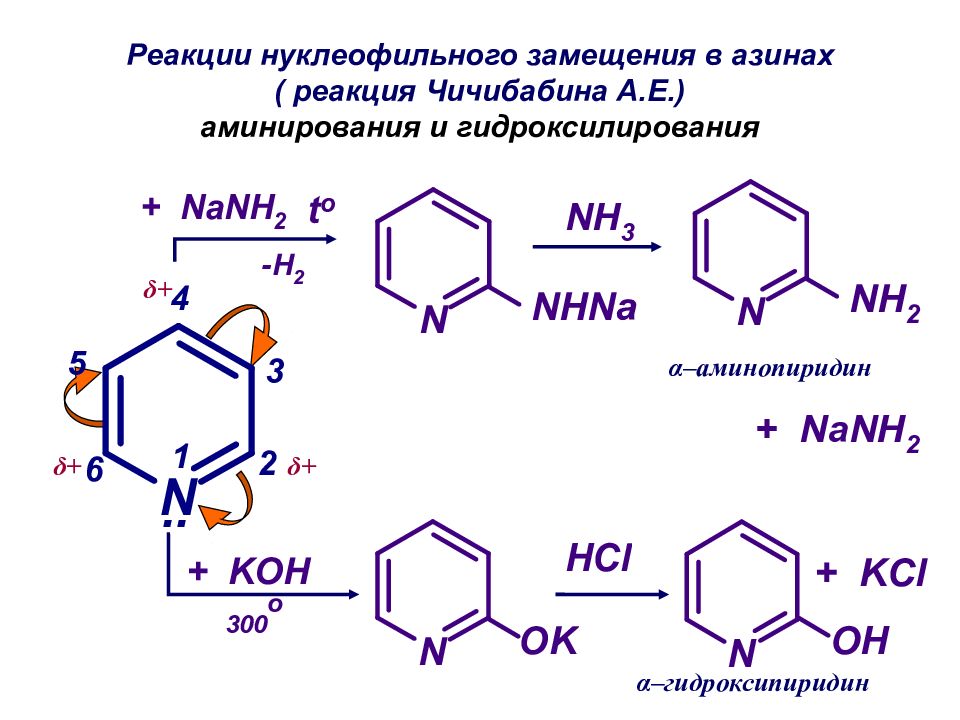
Слайд 51: Реакции нуклеофильного замещения в азинах ( реакция Чичибабина А.Е.) аминирования и гидроксилирования
δ+ δ+ δ+ α–аминопиридин α–гидроксипиридин
Слайд 53
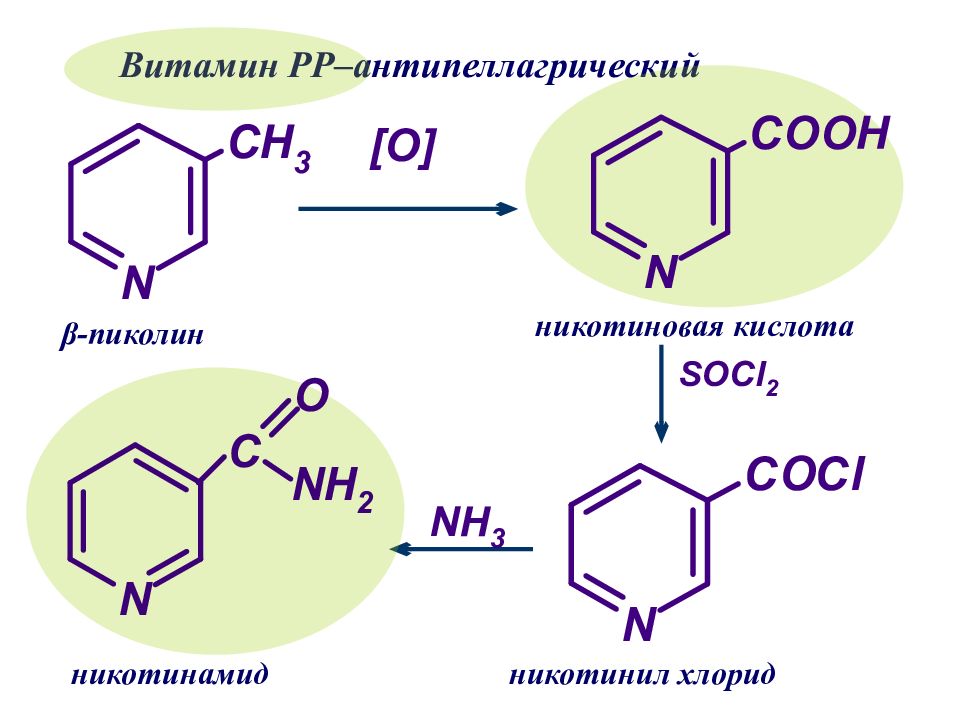
β -пиколин никотиновая кислота никотинил хлорид никотинамид Витамин РР–антипеллагрический
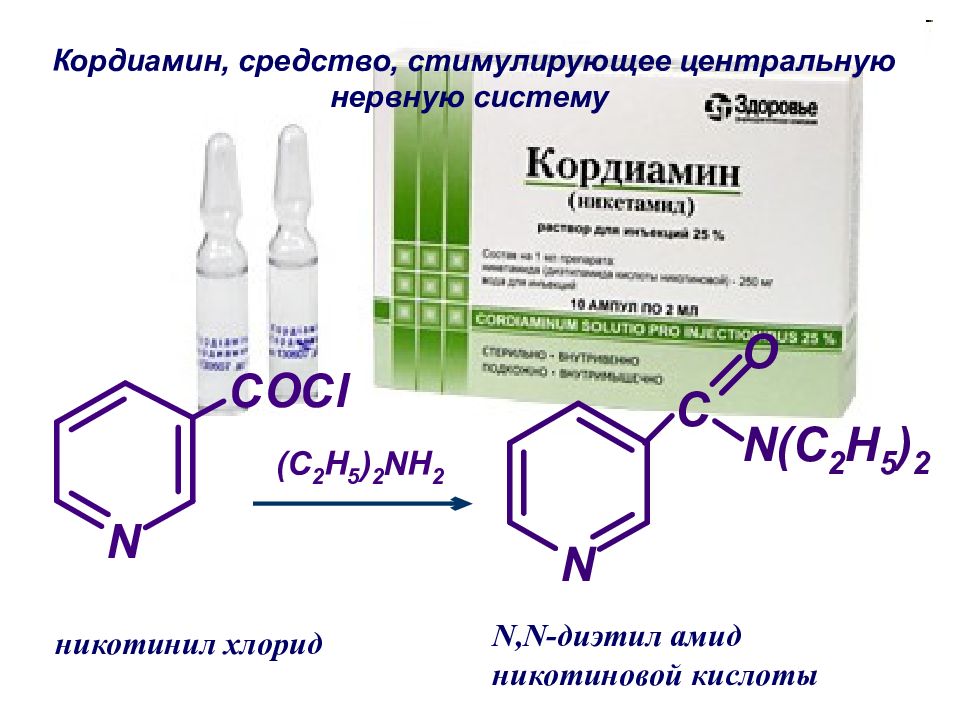
Слайд 54: Кордиамин, средство, стимулирующее центральную нервную систему
никотинил хлорид N,N- диэтил амид никотиновой кислоты
Слайд 55
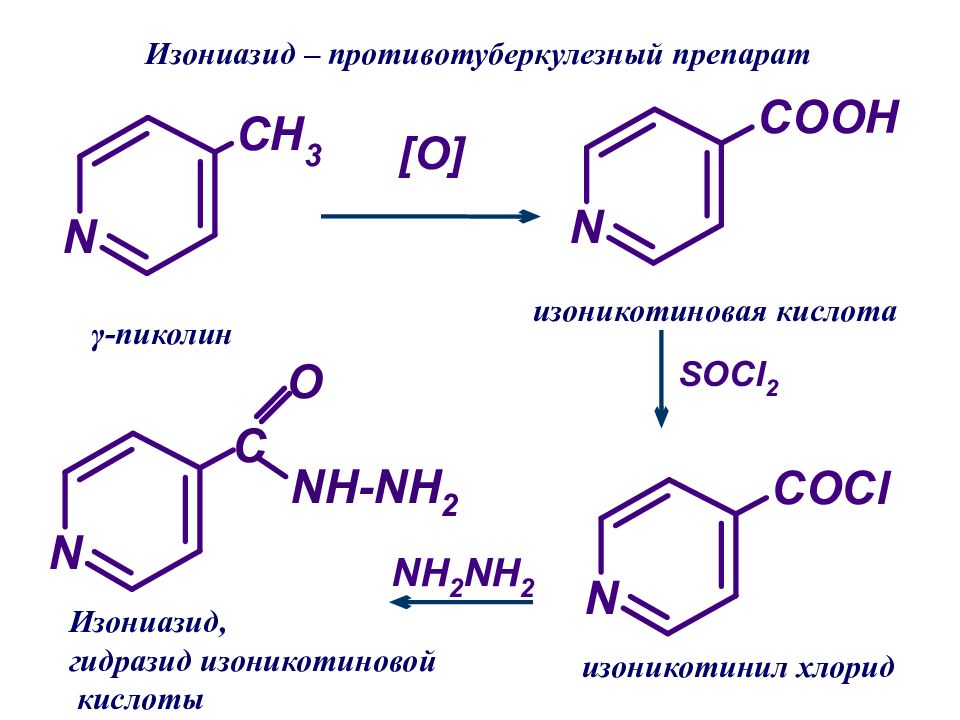
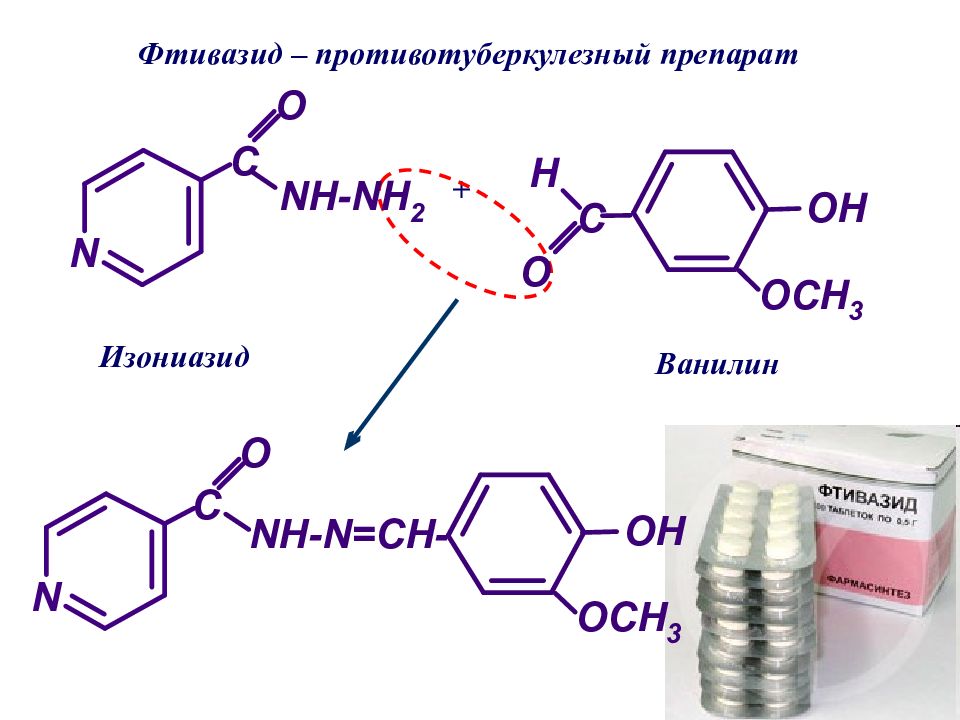
изоникотиновая кислота изоникотинил хлорид Изониазид – противотуберкулезный препарат Изониазид, гидразид изоникотиновой кислоты γ -пиколин
Слайд 57
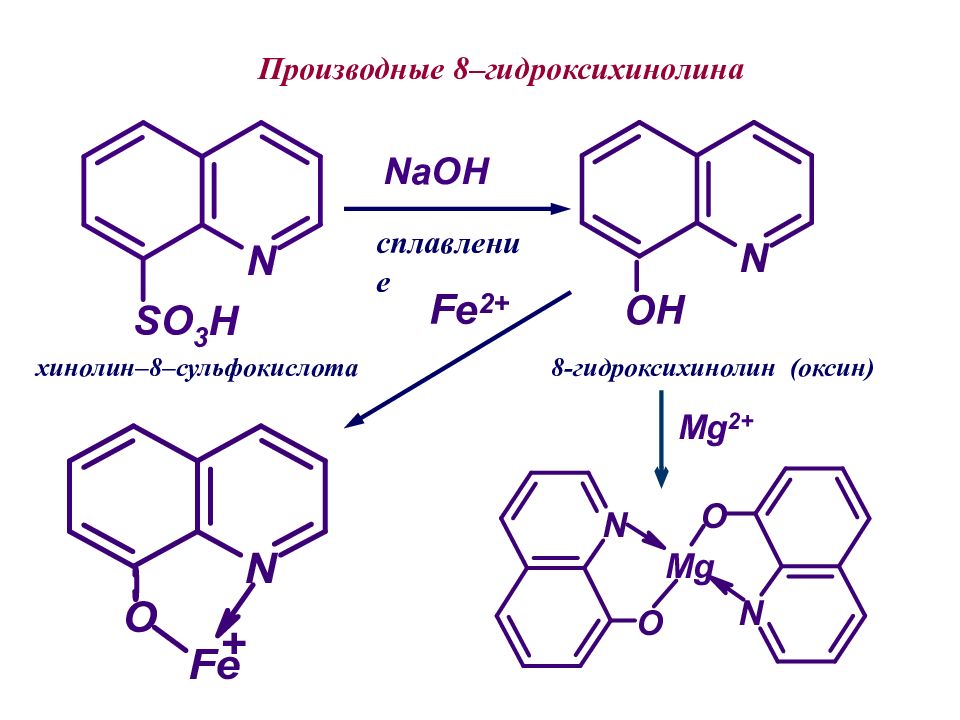
8-гидроксихинолин (оксин) Производные 8–гидроксихинолина хинолин–8–сульфокислота сплавление