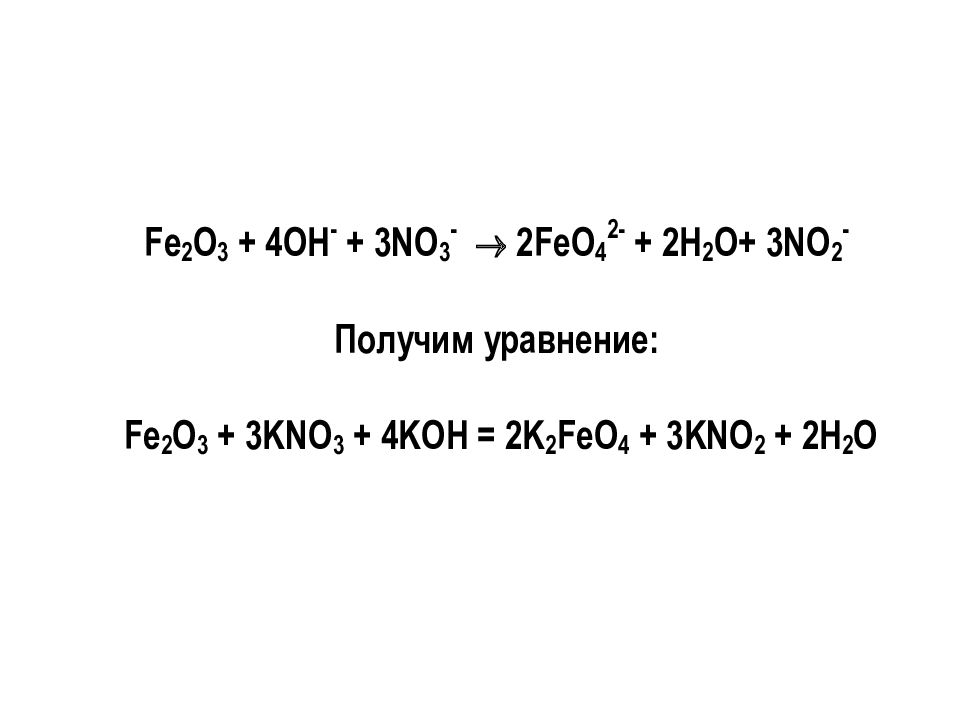Слайд 2
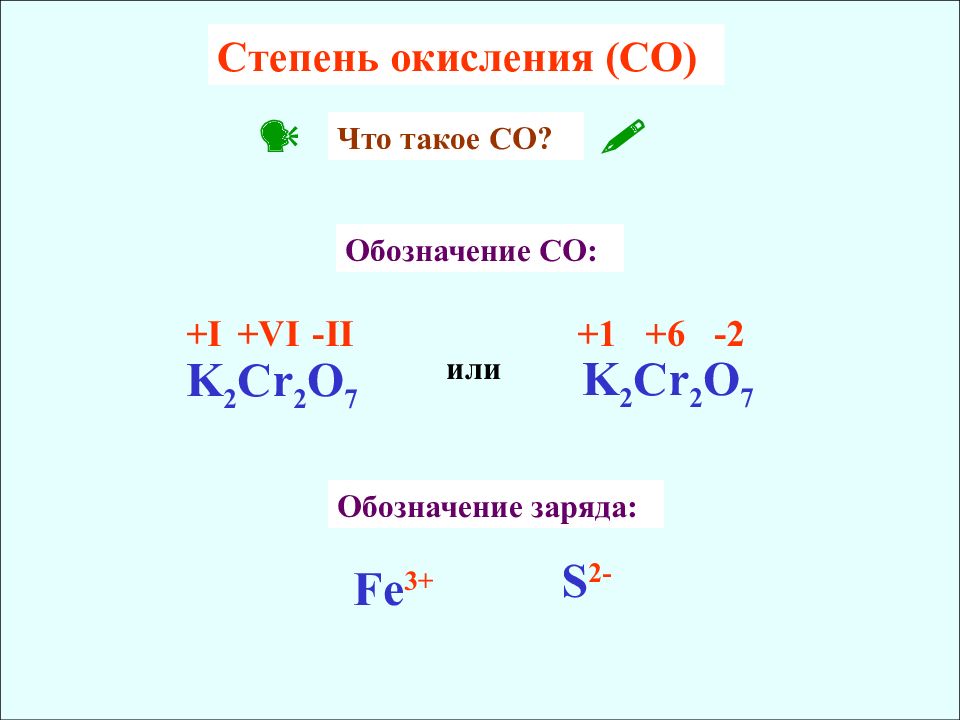
Cтепень окисления (CO) K 2 Cr 2 O 7 +I +VI -II K 2 Cr 2 O 7 +1 +6 -2 или Обозначение CO : Что такое C О ? Обозначение заряда : Fe 3+ S 2-
Слайд 3
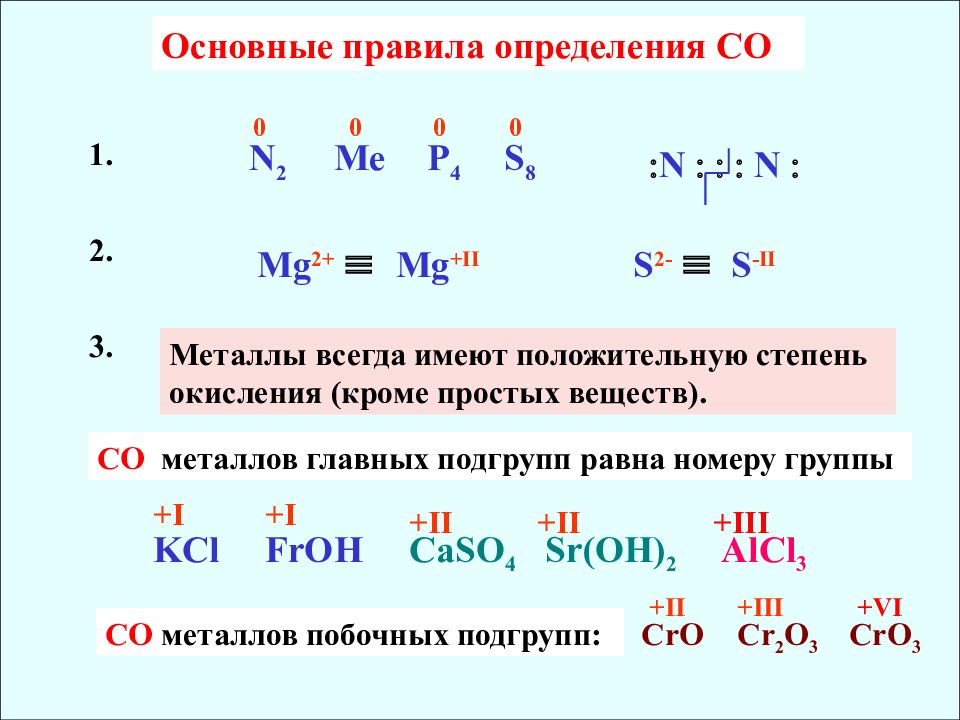
Основные правила определения CO Mg 2+ Mg +II S 2- S -II N 2 0 Me 0 P 4 0 S 8 0 N N 1. 2. Металлы всегда имеют положительную степень окисления (кроме простых веществ). 3. СO металлов главных подгрупп равна номеру группы + I KCl FrOH +I CaSO 4 Sr(OH) 2 +II +II AlCl 3 +III СО металлов побочных подгрупп : CrO Cr 2 O 3 CrO 3 +II +III +VI
Слайд 4
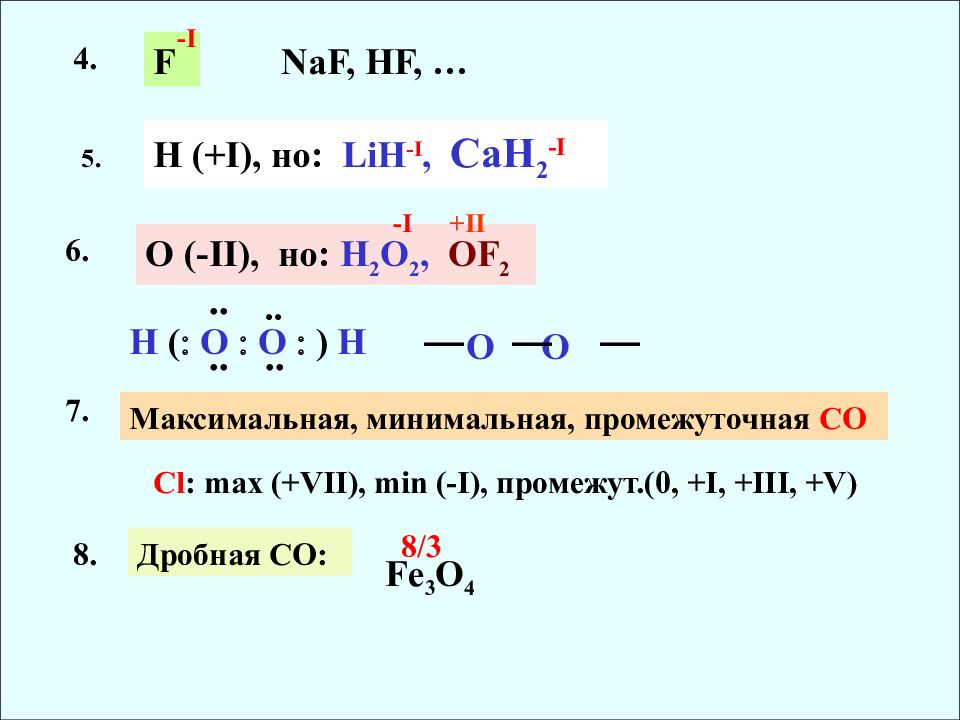
O (-II), но : H 2 O 2, OF 2 O O H ( O O ) H •• •• •• •• -I +II F 4. -I NaF, HF, … H (+I), но : LiH -I, CaH 2 -I 5. 6. 7. Максимальная, минимальная, промежуточная СО С l : max (+VII), min (-I), промежут.(0, +I, +III, +V) 8. Дробная СО : Fe 3 O 4 8/3
Слайд 5
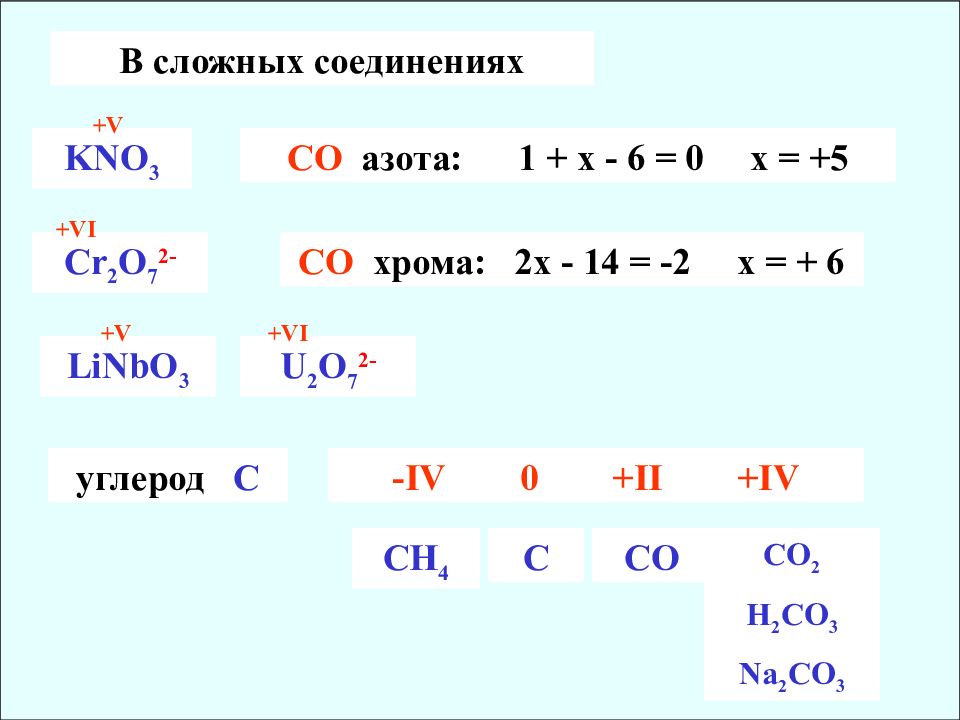
В сложных соединениях KNO 3 CO азота : 1 + х - 6 = 0 х = +5 +V С r 2 O 7 2- CO хрома : 2х - 14 = -2 х = + 6 + VI LiNbO 3 + V U 2 O 7 2- +VI углерод С -IV 0 +II +IV CH 4 C CO CO 2 H 2 CO 3 Na 2 CO 3
Слайд 6
Что такое ОВР ? K 2 SO 3 + H 2 O KHSO 3 + KOH K 2 SO 3 + H 2 O 2 = K 2 SO 4 + H 2 O IV -I VI -II Об окислителях и восстановителях Процессы окисления и восстановления На окислителе идет процесс восстановления Cl 2 + 2 е = 2С l - Fe 3+ + 1 e = Fe 2+ На восстановителе идет процесс окисления Fe 2+ - 1 e = Fe 3+ 2Cl - - 2 e = Cl 2
Слайд 7
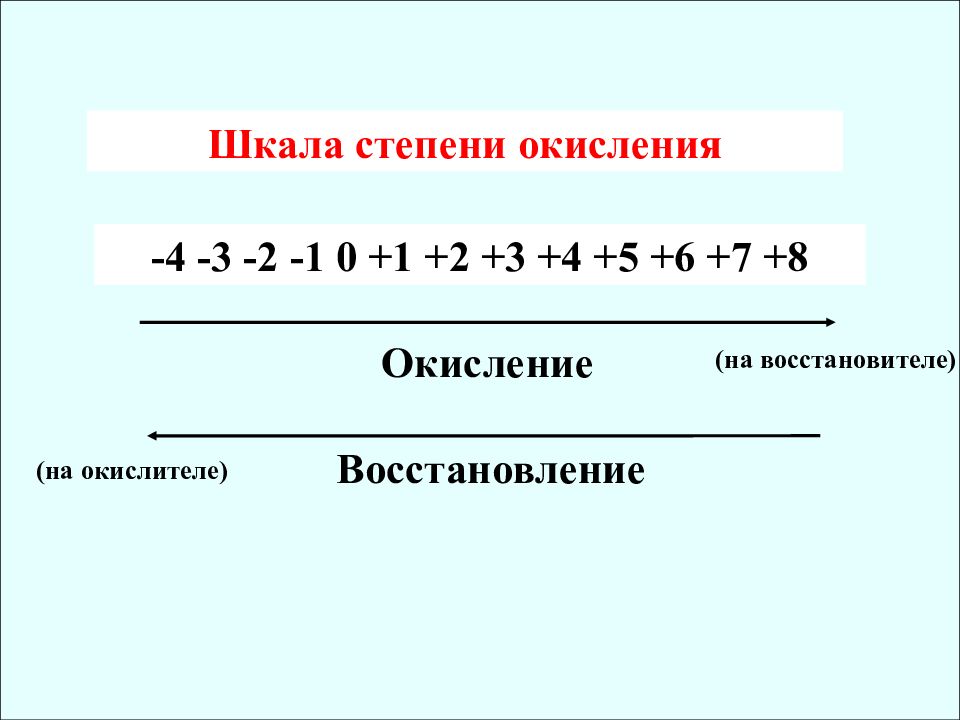
Шкала степени окисления -4 -3 -2 -1 0 +1 +2 +3 +4 +5 +6 +7 +8 Окисление Восстановление (на восстановителе) (на окислителе)
Слайд 8
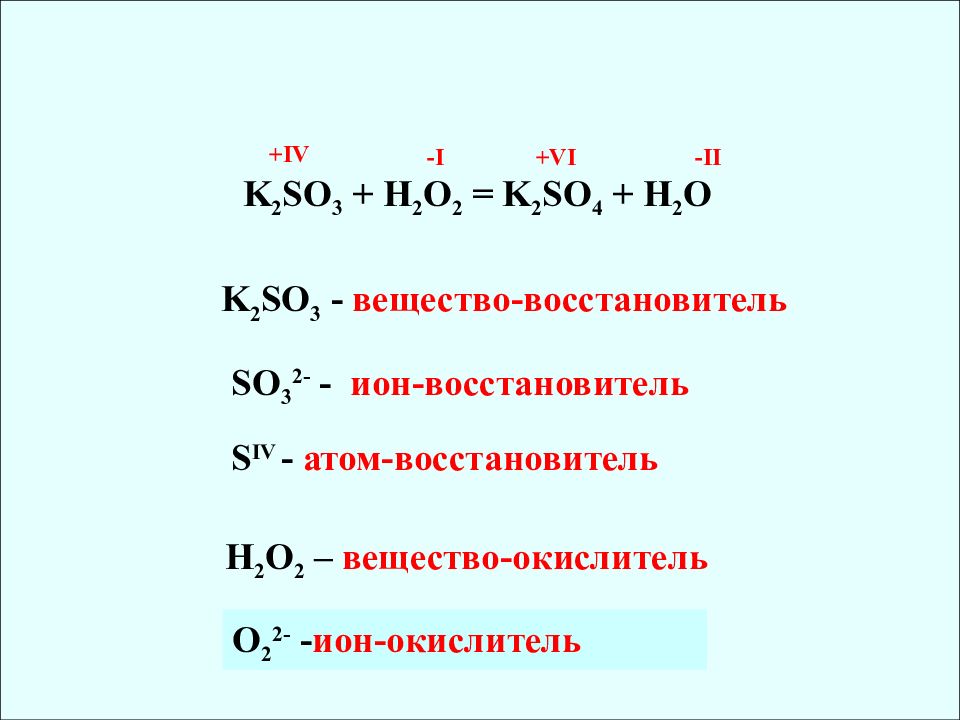
+IV +VI -I -II K 2 SO 3 - вещество-восстановитель SO 3 2- - ион-восстановитель S IV - атом-восстановитель K 2 SO 3 + H 2 O 2 = K 2 SO 4 + H 2 O H 2 O 2 – вещество-окислитель О 2 2- - ион-окислитель
Слайд 9
Важнейшие окислители и восстановители Окислители : F 2, Cl 2, Br 2, О 2 ( при повышенных т - рах ) KMnO 4, K 2 Cr 2 O 7, PbO 2, HNO 3, + VII + VI + IV + V Катионы металлов более высокой CO : Fe 3+, Au 3+, Sn 4+ Восстановители : Na, Ca, Zn, Al, H 2, C, Na 2 S, KI, SnCl 2, Fe(NO 3 ) 2, NH 3, … -II -I -I + II + II -III Вещества с двойственной природой : H 2 O 2, SO 2, KNO 2, -I + IV + III H 2 O 2 + K I + H 2 SO 4 = H 2 O + I 2 + K 2 SO 4 -I -II окислитель H 2 O 2 + KMnO 4 + H 2 SO 4 = O 2 + MnSO 4 + K 2 SO 4 + H 2 O восстановитель -I 0
Слайд 10
Составление уравнений ОВР Метод электронного баланса PbS + O 2 = PbO + SO 2 ( T ~ 1000 C) Главное в металлургии : M +z M 0 +z e -II 0 -II IV -II O 2 0 + 4 e = 2 O -II 3 S -II - 6 e = S IV 2 3O 2 0 + 2S -II =6O -II +2 S IV 2PbS + 3O 2 = 2PbO + 2SO 2
Слайд 11
Метод полуреакций K 2 Cr 2 O 7 + K 2 SO 3 + H 2 SO 4 = Cr 2 (SO 4 ) 3 + K 2 SO 4 + H 2 O VI IV III VI Cr 2 O 7 2- + 14 H + + 6 е 2Cr 3+ + 7H 2 O 1 SO 3 2- + H 2 O - 2 е SO 4 2- + 2H + 3 Cr 2 O 7 2- + 14H + + 3SO 3 2- + 3H 2 O 2Cr 3+ + 7H 2 O + 3SO 4 2- + 6H + Cr 2 O 7 2- + 8H + + 3SO 3 2- 2Cr 3+ + 4H 2 O + 3SO 4 2- K 2 Cr 2 O 7 + 3K 2 SO 3 + 4H 2 SO 4 = Cr 2 (SO 4 ) 3 + 4K 2 SO 4 + 4H 2 O
Слайд 12
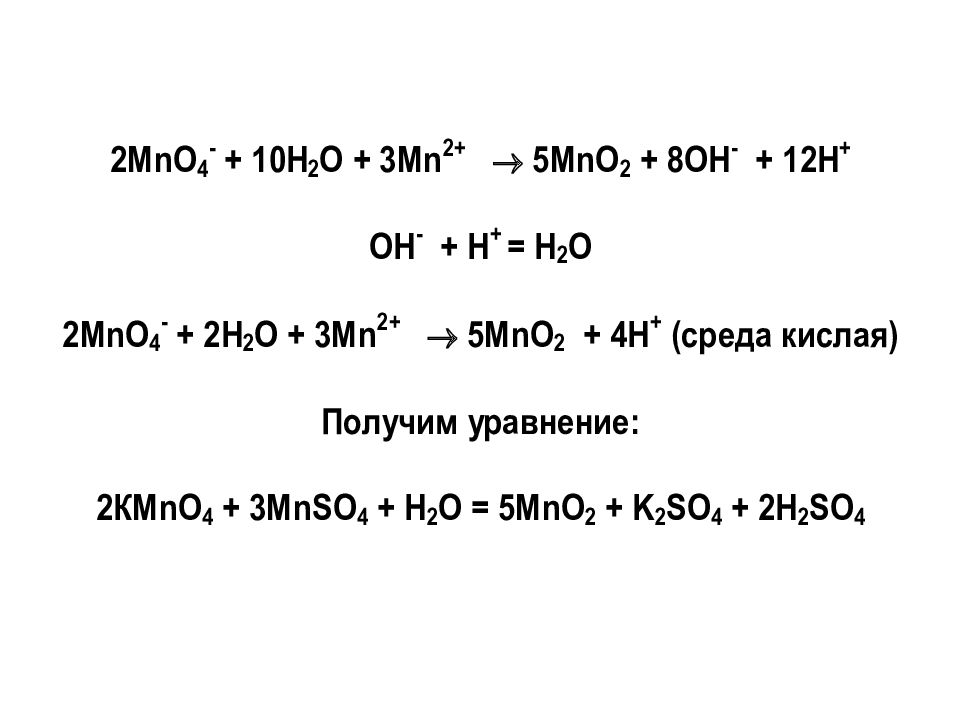
О том, как составляются полуреакции для уравнивания ОВР в щелочной и нейтральной средах, смотрите на сайте кафедры «Дополнительные материалы» Лекции № 8 «ОВР»
Слайд 18
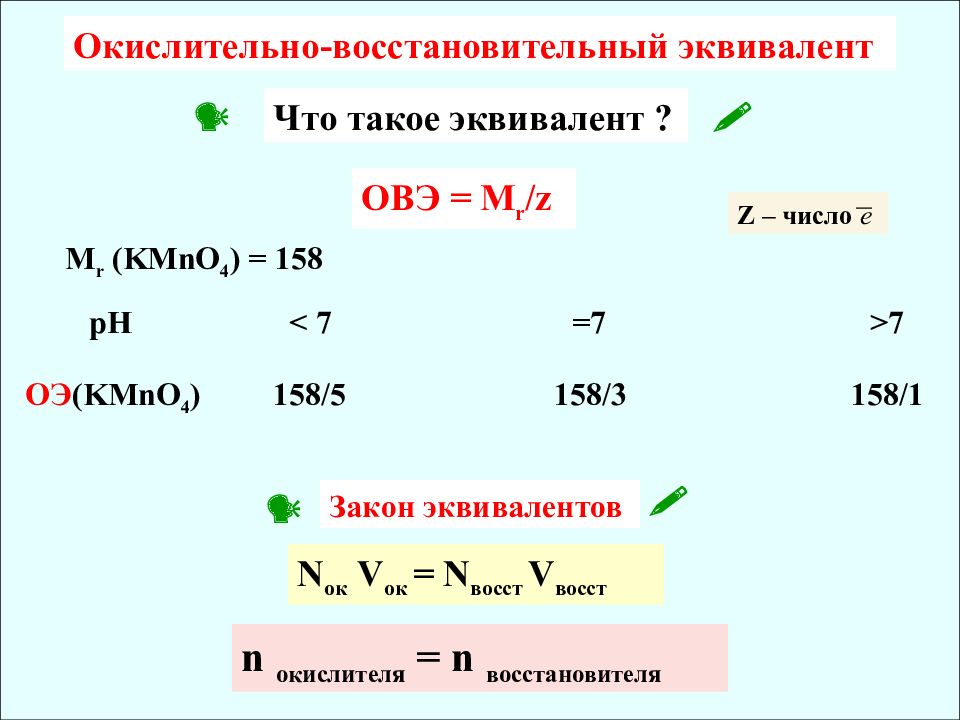
Что такое эквивалент ? Окислительно-восстановительный эквивалент ОВЭ = М r /z M r (KMnO 4 ) = 158 pH < 7 = 7 > 7 O Э ( KMnO 4 ) 158/5 158/3 158/1 Z – число e Закон эквивалентов N ок V ок = N восст V восст n окислителя = n восстановителя
Слайд 19
Дополнительные материалы Лекции № 8 Составление полуреакций для уравнивания ОВР в щелочной и нейтральной средах «ОВР»
Слайд 25
Электрохимический ряд напряжений металлов Металлы расположены в порядке возрастания их стандартных электродных потенциалов Li, Rb, K, Ba, Sr, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Cd, Co, Ni, Sn, Pb, H, Sb, Bi, Cu, Hg, Ag, Pd, Pt, Au
Слайд 26
Ряд напряжений характеризует химические свойства металлов : 1. Чем более отрицателен электродный потенциал металла, тем больше его восстановительная способность Например : железо ( φ ° = - 0,44 ) более сильный восстановитель, чем медь ( φ ° = + 0,34 ) Но, катионы Cu 2+ в водном растворе более сильный окислитель, чем Fe 2+
Слайд 27
2. Каждый металл способен вытеснять (восстанавливать) из растворов солей те металлы, которые стоят в ряду напряжений металлов после него Fe + CuSO 4 → FeSO 4 + Cu ↓ Cu + 2AgNO 3 → Cu(NO 3 ) 2 + 2Ag ↓ Исключение – щелочные и щелочно-земельные металлы 3. Все металлы, имеющие отрицательный электродный потенциал, т. е. находящиеся в ряду напряжений металлов левее водорода, способны вытеснять его из растворов кислот ( HCl, HBr, HI, H 3 PO 4, разбавленная H 2 SO 4 ) Fe + H 2 SO 4 → FeSO 4 + H 2 ↑; φ ° Fe = -0,44
Последний слайд презентации: Лекция № 8 Окислительно-восстановительные реакции
Li Cs Ca Na Mg Al Zn Fe Ni Pb H 2 Cu Ag Hg Au Усиление восстановительной способности атомов Усиление окислительной способности ионов Li + Ca 2+ Na + Mg 2+ Al 3+ Zn 2+ Fe 2+ Ni 2+ Pb 2+ H + Cu 2+ Ag + Hg 2+ Au 3+ 4. Окислительно-восстановительные свойства металлов и их ионов в ряду напряжения металлов