Слайд 2: Типы химических реакций
Реакции протекающие с изменением степени окисления элементов в реагирующих веществах(см. лекцию ОВР) Реакции, протекающие без изменения степени окисления элементов в реагирующих веществах.
2 Mg + O 2 2 MgO CaO + CO 2 CaCO 3
Слайд 4: Реакции разложения – реакции в результате которых из одного вещества образуются два и более веществ
( NH 4 ) 2 Cr 2 O 7 N 2 + Cr 2 O 3 + 4 H 2 O Cu ( OH ) 2 CuO + H 2 O Условия: нагревание, тепловой или световой импульс, реже самопроизвольно
Слайд 5: Реакции замещения – р еакции, в результате которых атомы простого вещества замещают атомы одного из элементов в сложном веществе (всегда ОВР)
Zn + 2 HCl ZnCl 2 + H 2 2Al + 3CuSO 4 Al 2 (SO 4 ) 3 + 3Cu
Слайд 6: Реакции обмена – реакции в результате которых молекулы 2-х соединений обмениваются своими составными частями (без изменения с.о.)
CuSO 4 + 2 NaOH Cu ( OH ) 2 + Na 2 SO 4
Слайд 7: Эти реакции протекают необратимо если:
Образуется осадок Выделяется газ Образуется слабый электролит (вода и др.)
Слайд 8: По тепловому эффекту
Экзотермические - протекают с выделением тепла Ca ( OH ) 2 +2 HCl CaCl 2 +2 H 2 O + Q Эндотермические - протекают с поглощением тепла CaCO 3 CaO + CO 2 – Q
Слайд 9: Необратимые реакции – реакции, которые при данных условиях протекают практически только в одном направлении
Обратимые реакции – реакции, которые при данных условиях протекает впрямом и обратном направлениях 2NO N 2 O 4
Слайд 10: определние
Окислительно-восстановительные реакции (ОВР) – реакции, протекающие с изменением степени окисления атомов, входящих в состав реагирующих веществ. определние
Слайд 11: Окисление, восстановитель
Окисление – процесс отдачи электронов атомом, молекулой или ионом. Восстановитель – атом, молекула или ион, отдающий электроны. Окисление, восстановитель
Слайд 12: Примеры записи процесса окисления
Примеры: Al – 3e Al 3+ H 2 0 – 2e 2H + 2Cl - -2e Cl 2 Восстановитель окисляется. При этом его степень окисления повышается Примеры записи процесса окисления
Слайд 13: Восстановление, окислитель
Восстановление – процесс присоединения электронов атомом, молекулой или ионом. Окислитель – атом, молекула или ион, присоединяющий электроны. Восстановление, окислитель
Слайд 14: Примеры записи восстановления
Примеры: S 0 +2e S 2 Cl 2 +2e 2Cl Окислитель восстанавливается. Его степень окисления понижается Примеры записи восстановления
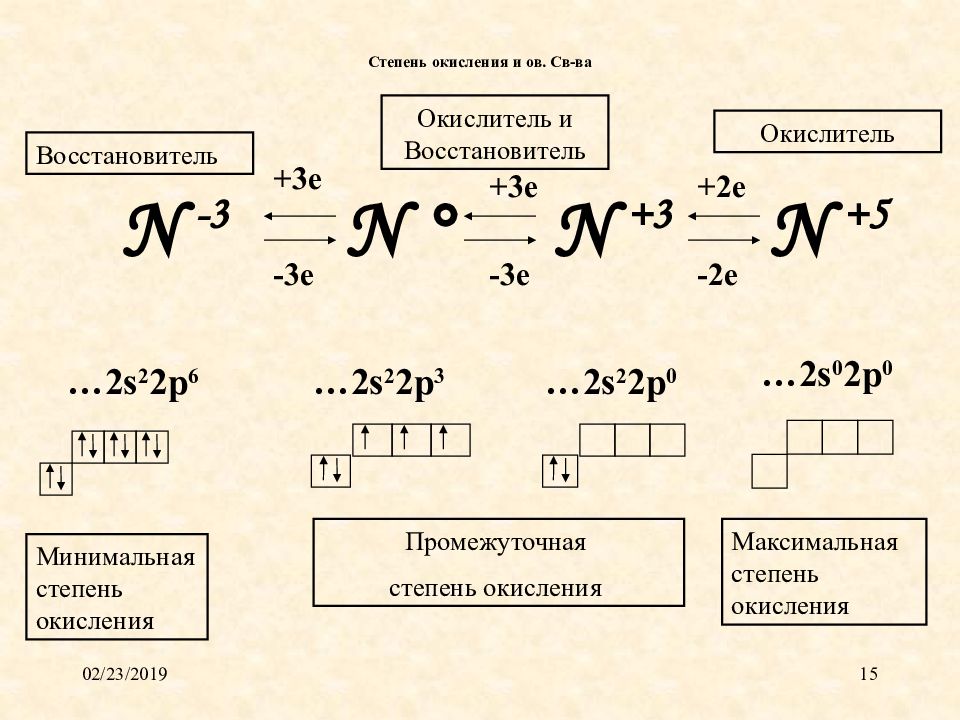
Слайд 15: Степень окисления и ов. Св-ва
16.02.2019 15 N ° N +3 N +5 N -3 -3 e +3 e +3 e -3 e +2 e -2 e … 2 s 2 2p 6 …2s 2 2p 3 …2s 2 2p 0 …2s 0 2p 0 Степень окисления и ов. Св-ва Минимальная степень окисления Промежуточная степень окисления Максимальная степень окисления Восстановитель Окислитель Окислитель и Восстановитель
Слайд 16: Восстановители
простые вещества металлы, Н 2, С, Si, Р ионы в минимальной степени окисления ( S 2-, I -, Br -, Cl -, N 3- ) некоторые ионы металлов в меньшей из возможных с.о. ( Fe 2+, Sn 2+, Cu + ) органические вещества: спирты, альдегиды, глюкоза
Слайд 17: Окислители
Простые вещества: О 2, О 3, галогены ( F 2, Cl 2, Br 2, I 2 ) Ионы неметаллов и металлов в высшей с.о. ( S +6, N +5,Mn +7, Cr +6 ) Оксиды металлов ( CuO, PbO 2, Ag 2 O, CrO 3, MnO 2 )
Слайд 18: Окислительно-восстановительная двойственность
Элементы в промежуточной степени окисления могут проявлять как свойства восстановителя, так и свойства окислителя, так как могут и повышать степень окисления (отдают электроны, окисляются), так и понижать (принимают электроны, восстанавливаются).
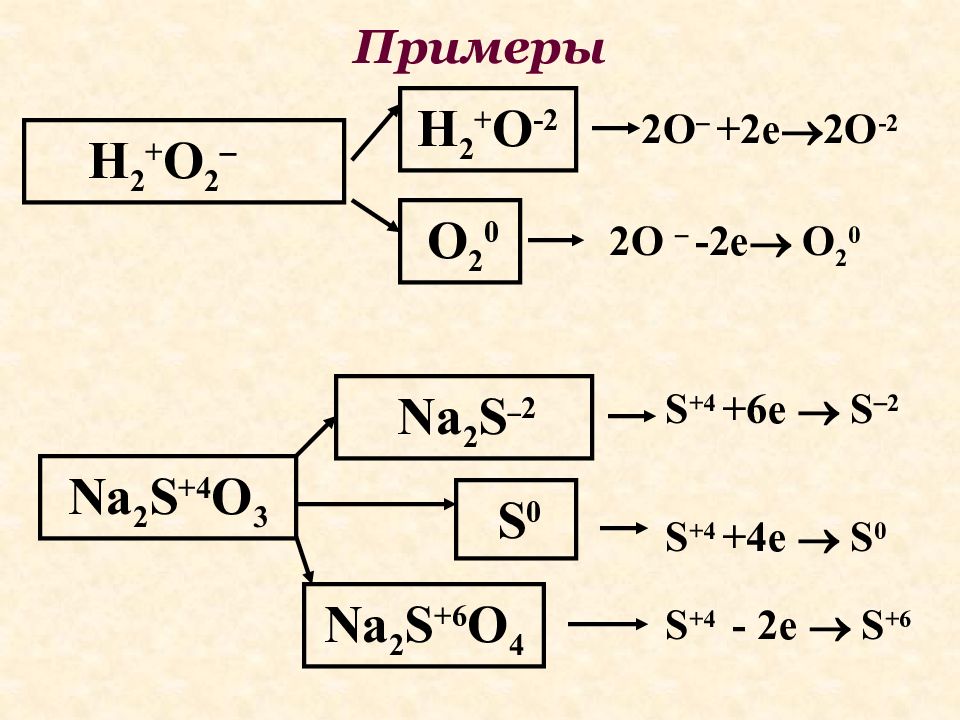
Слайд 19: Примеры
H 2 + O 2 Na 2 S +4 O 3 S 0 H 2 + O -2 2О +2е 2О -2 2О -2е О 2 0 Na 2 S 2 О 2 0 Na 2 S +6 O 4 S +4 +6e S 2 S +4 +4e S 0 S +4 - 2e S +6
Слайд 21: Радиус атома
(радиус Слейтера) – расстояние от ядра атома до максимума электронной плотности его валентных электронов Обозначение r. Размерность пм (пикометр – 10 -12 м) или нм (нанометр – 10 -9 м) Радиус атома r ан >r ат > r кат
Слайд 22: Энергия ионизации [ кДж/моль ]
Определяет восстановительную способность атомов элементов Энергия, необходимая для превращения 1моль атомов в газовой фазе в 1 моль катионов в газовой фазе. Первая энергия ионизации характеризует способность атома отдавать 1 электрон Энергия ионизации [ кДж/моль ]
Слайд 23: Энергия сродства к электрону
Характеризует окислительную способность атомов элементов Энергия, которая выделяется при присоединении 1 моль электронов к 1 моль атомов в газовой фазе
Слайд 24
Также об о-в св-вах можно судить по величине ОЭО и по положению атома элемента в ПС. Чем выше ОЭО и меньше радиус атома, тем более сильным окислителем является элемент.
Слайд 25
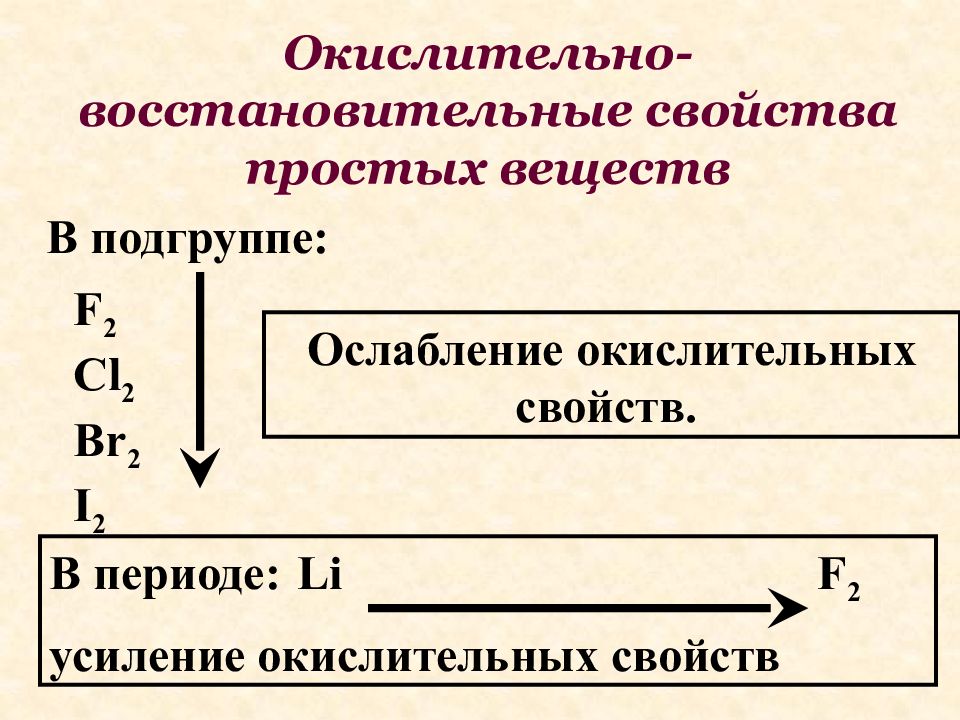
Окислительно-восстановительные свойства простых веществ В подгруппе: В периоде: усиление окислительных свойств F 2 Cl 2 Br 2 I 2 Ослабление окислительных свойств. F 2 Li
Слайд 26: Окислительно-восстановительная активность ионов
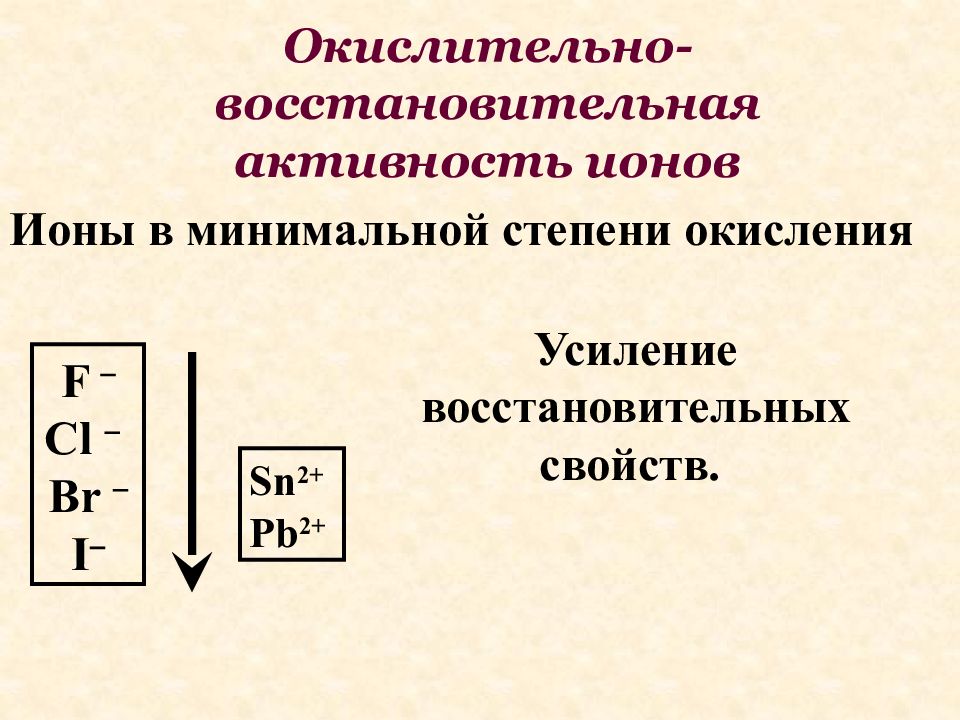
Ионы в минимальной степени окисления F Cl Br I Усиление восстановительных свойств. Sn 2+ Pb 2+
Слайд 27: Окислительные свойства ионов в максимальной степени окисления
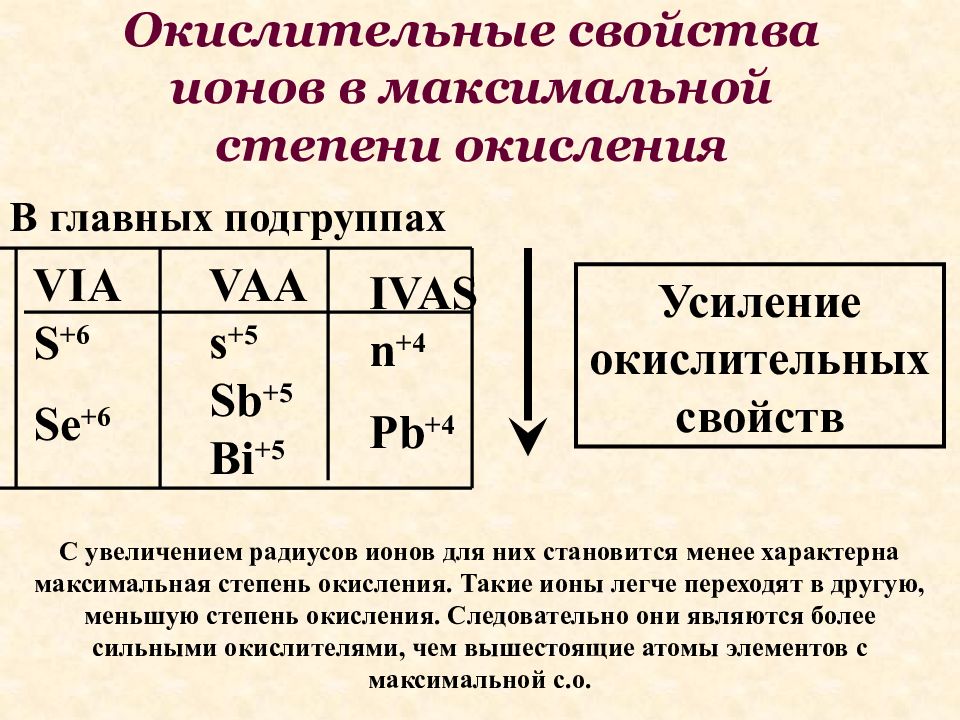
С увеличением радиусов ионов для них становится менее характерна максимальная степень окисления. Такие ионы легче переходят в другую, меньшую степень окисления. Следовательно они являются более сильными окислителями, чем вышестоящие атомы элементов с максимальной с.о. VIAS +6 Se +6 VAAs +5 Sb +5 Bi +5 IVASn +4 Pb +4 В главных подгруппах Усиление окислительных свойств
Слайд 28: Типы ОВР
Межмолекулярные ОВР – реакции, в которых окислитель и восстановитель содержатся в молекулах разных веществ. С u 0 + O 2 0 2 Cu 2+ O 2- 2 3H 2 S 2 +H 2 S +6 O 4 4 S 0 + 4H 2 O 6K I + 4H 2 S +6 O 4 3 I 2 0 + S 0 +3K 2 SO 4 +4H 2 O
Слайд 29: Внутримолекулярные ОВР
Реакции, которые идут с изменением степени окисления разных атомов элементов, содержащихся в одной молекуле. Молекула вещества содержит окислитель и восстановитель ( N -3 H 4 ) 2 Cr 2 +6 O 7 (t 0 ) N 2 0 + Cr 2 +3 O 3 + 4H 2 O 2Na N +5 O 3 -2 2Na N +3 O 2 + O 2 0 K Cl +5 O 3 2 2K Cl + 3 O 2 0
Слайд 30: Реакции диспропорционирования (самоокисления-самовосстановления)
Это реакции, идущие с изменением степени окисления одного атома элемента в молекуле одного и того же вещества. Атом элемента в промежуточной степени окисления. Он может и понижать и повышать степень окисления. 4K Cl +5 O 3 K Cl +3K Cl +7 O 4 Cl 2 0 + 2KOH K Cl +K Cl +1 O +H 2 O 4Na 2 S +4 O 3 Na 2 S 2 + 3Na 2 S +6 O 4
Слайд 31: Правила составления ОВР
Записать схему ОВР. 2. Определить степени окисления элементов в реагирующих веществах. 3. Подчеркнуть символы элементов, изменяющих степени окисления. 4. Составить уравнения электронного баланса, указать окислитель и восстановитель, процессы окисления и восстановления.
Слайд 32: Продолжение
5. Уравнять число отданных и принятых электронов. 6. Расставить коэффициенты при восстановителе и окислителе и проверить количество атомов каждого элемента. Если нужно, уравнять количество атомов других элементов 7. Правильность подбора коэффициентов проверить по водороду и кислороду.
Слайд 33: Примеры
Mg + H 2 SO 4 (к) MgSO 4 +H 2 S + H 2 O Mg 0 -2е - Mg +2 S +6 +8е - S -2 0 +6 +2 -2 Восстановитель Окисление Окислитель Восстановление 8 2 4 1 4 4 5 4 4 Mg 0 + S +6 4 Mg +2 + S -2
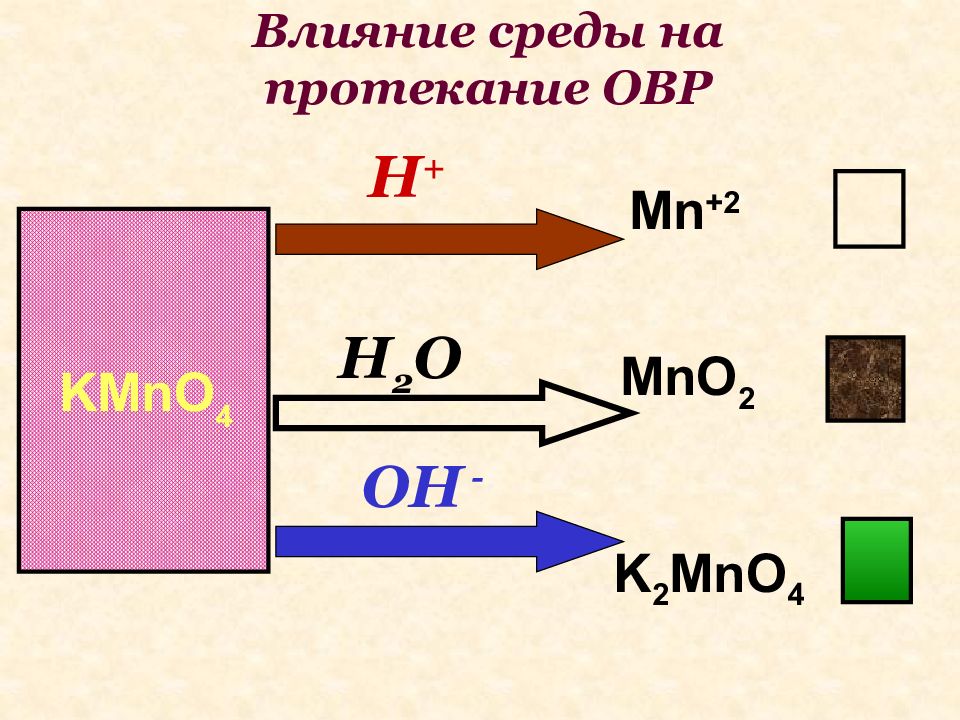
Слайд 34: Влияние среды на протекание ОВР
Mn +2 Mn O 2 K 2 MnO 4 H + H 2 O OH - KMnO 4
Слайд 35: Перманганат в кислой среде
KMnO 4 + Na 2 SO 3 + H 2 SO 4 = Mn SO 4 + Na 2 SO 4 + K 2 SO 4 + H 2 O 2 5 3 2 5 Mn +7 +5e - Mn +2 S +4 -2e - S +6 Окислитель Восстановитель 2 5 Окисление + +7 -2 + +4 –2 + +6 –2 +2 +6 –2 + +6 –2 + +6 –2 + - 2 3 Восстановление Перманганат в кислой среде 2 Mn +7 + 5 S +4 2 Mn +2 + 5 S +6
Слайд 36: Перманганат в нейтральной и щелочной среде
KMnO 4 + Na 2 SO 3 + H 2 O = Mn O 2 + Na 2 SO 4 + KOH KMnO 4 + Na 2 SO 3 + К O H = K 2 Mn O 4 + Na 2 SO 4 + H 2 O Перманганат в нейтральной и щелочной среде
Слайд 37: Электродные потенциалы. Электрохимические процессы в растворах
Возможность и полноту протекания ОВР определяет величина электродного потенциала данной полуреакции. Значение электродных потециалов различных полуреакций при стандартных условиях приводятся в справочных таблицах.
Слайд 38: Условие протекания ОВР
Обозначение 0. Размерность – В. Условие протекания ОВР 0 окислителя > 0 восстановителя Условие протекания ОВР
Слайд 40: Решение
Составим уравнения электронного баланса и запишем табличные значения потенциалов для каждой полуреакции окислитель Cl e 1/2 Cl 2 в 0 =1,36В Fe 3+ +e Fe 2+ Восстанови-тель ок 0 = 0,77В Условие протекания ОВР не выполняется, т.к. в 0 > ок 0. 2Na C l + Fe 2 (SO 4 ) 3 2 Fe SO 4 + C l 2 + Na 2 SO 4
Слайд 41: Продолжение
2Na I + Fe 2 (SO 4 ) 3 2 Fe SO 4 + I 2 + Na 2 SO 4 Продолжение окислитель I e 1/2I 2 0 в 0 =0,54В Fe 3+ +e Fe 2+ Восстанови-тель ок 0 = 0,77В Условие протекания ОВР выполняется, т.к. ок 0 > в 0. Вывод: при стандартных условиях сульфат железа ( III) можно восстановить до сульфата железа ( II) иодидом натрия. Аналогично для второй реакции
Слайд 42: Электродные потенциалы металлов
Электродный потенциал металла– это разность потенциалов между металлом и раствором, в который он погружен. Рассмотрим процессы происходящие при погружении металлической пластины в воду. Электродные потенциалы металлов
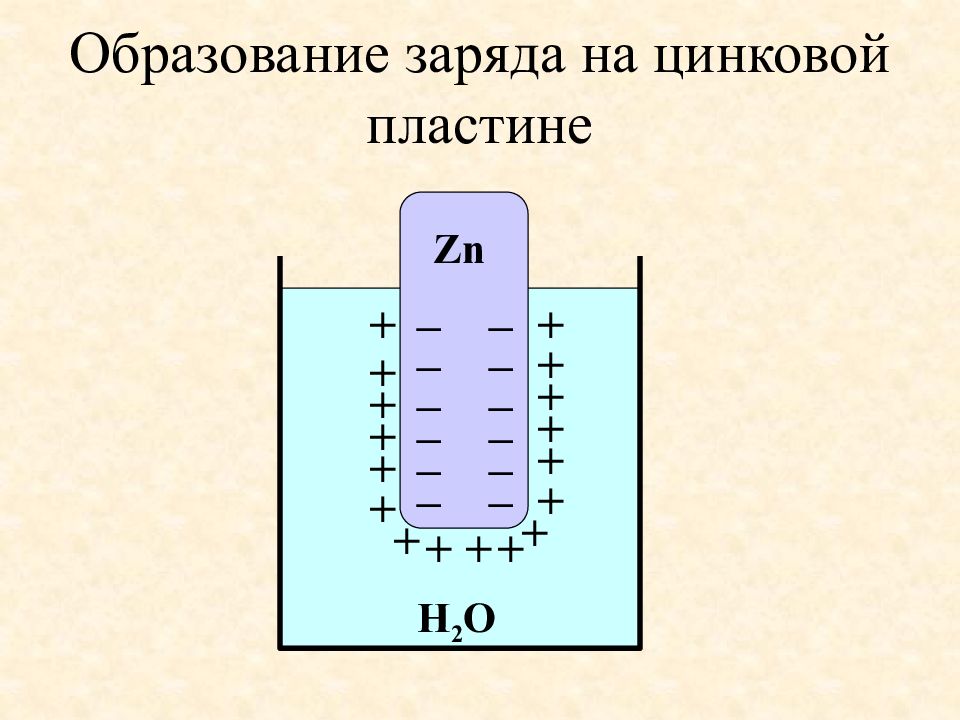
Слайд 43: Образование заряда на цинковой пластине
Н 2 О Zn + + + + + + + + + + + + + + + + + – – – – – – – – – – – –
Слайд 44: Продолжение
При погружении металла в воду, полярные молекулы воды гидратируют ионы металла. Ионы металла переходят в раствор, а его поверхность заряжается отрицательно. Слой воды около поверхности металла заряжается положительно. Устанавливается равновесие: Me + mH 2 O Me(H 2 O) n+ + ne пластинка раствор пластинка Продолжение
Слайд 45: Стандартный электродный потенциал
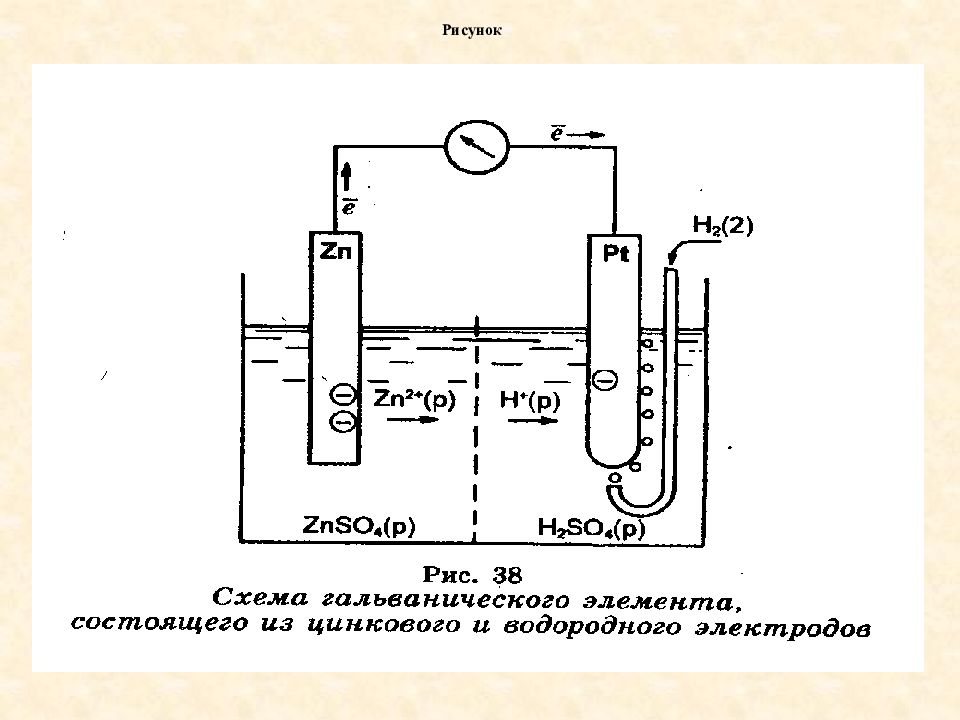
Абсолютное значение электродного потенциала определить невозможно. Поэтому измеряют относительную величину потенциала в стандартных условиях. Стандартный электродный потенциал металла – потенциал металла измеренный относительно водородного электрода при стандартных условиях ( Р=101,3кПа, Т=298К, содержание соли в растворе 1 моль/л)
Слайд 46: Водородный электрод
состоит из рыхлой платиновой пластинки, опущенной в раствор серной кислоты с активной концентрацией ионов водорда 1 моль/л, через который пропускают газообразный водород при Р=101,3 кПа, Т=298К (25 0 С) Водородный электрод
Слайд 48: Ряд напряжений
0 характеризует восстановительную способность металла. Для неактивных металлов 0 > 0, для активных 0 < 0. По величине стандартных электродных металлы образуют электрохимичесий ряд напряжений металлов. По ряду напряжений можно определить какие металлы вытесняют водород из растворов кислот, вытесняют другие металлы из растворов их солей. Ряд напряжений
Слайд 49: Продолжение
Каждый левостоящий металл вытесняет правостоящий из раствора его соли. Металлы, стоящие в ряду напряжений до водорода вытесняют его из растворов кислот (кроме азотной и серной концентрированной). Продолжение Пример. Будут ли реагировать: цинк и раствор сульфата меди; медь и раствор хлорида магния; железо и нитрат серебра.
Слайд 50: Гальванический элемент
– это устройство, в котром энергия химической реакции превращается в электрическую. Простейший гальванический элемент – элемент Даниэля-Якоби Гальванический элемент Анод – электрод на котором происходит окисление (более активный металл) Катод – электрод на котором происходит восстановление (менее активный металл)
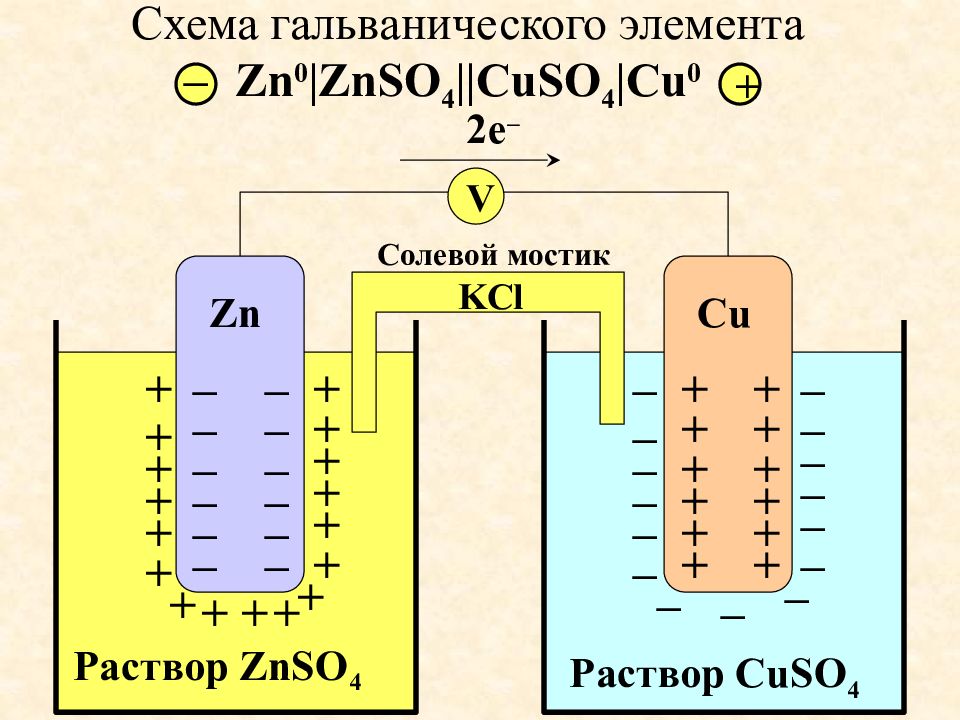
Слайд 51: Схема гальванического элемента Zn 0 |ZnSO 4 ||CuSO 4 |Cu 0
Раствор ZnSO 4 Zn + + + + + + + + + + + + + + + + + – – – – – – – – – – – – Раствор CuSO 4 Cu – – – – – – – – – – – – – – – + + + + + + + + + + + + V 2 e – Солевой мостик KCl + –
Слайд 52: Процессы на аноде и катоде
Zn 0 |ZnSO 4 ||CuSO 4 |Cu 0 А: Zn 0 – 2e Zn 2+ 0 = 0,76 K: Cu 2+ + 2e Cu 0 0 = +0,34 Zn 0 + Cu 2+ Zn 2+ + Cu 0 Анод заряжен отрицательно, катод положительно - + окисление восстан-ие
Слайд 53: ЭДС
Эффективность работы гальванического элемента оценивается величиной электродвижущей силы гальванического элемента. Электродвижущая сила – максимальное напряжение, возникающее при работе гальванического элемента. Обозначение - Е 0. Размерность - В Е 0 = 0 К - 0 А Е 0 Cu-Zn = 0,34 – (-0,76)=1,1 В
Слайд 54: Характеристика элемента по его положению в периодической системе
Положение в п.с. (порядковый номер, период, подгруппа). Характеристика элемента по его положению в периодической системе.
Слайд 55: ПРОДОЛЖЕНИЕ
2. Характеристика атома элемента: Заряд ядра Z, число протонов N р, число нейтронов N n, число электронов N e. Полная электронная формула. Графическая электронная конфигурация валентных уровней в нормальном и возбужденном состояниях.
Слайд 56
3. Электронное семейство к которому относится элемент, металл или неметалл, формула и характер высшего оксида (основной, амфотерный, кислотный) и соответствующего ему гидрата. Реакции подтверждающие свойства оксида и гидрата.
Слайд 57: Примеры
Дайте характеристику элемента № 56 по положению в п.с. Элемент №56 – барий 56 Ва. Ва находится в 6 периоде во второй группе главной подгруппы (IIA).
Слайд 58: продолжение
2) Z =+56, A =137 N ( 1 1 p)=56, N (e)=56, N ( 1 0 n)= A-N ( 1 1 p)=137-56=81 Электронная формула: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6 s 2
Слайд 59
Основное состояние: … 6 s 2 6р 0 Возбужденное состояние … 6 s 1 6р 1 В(Ва)=0 В(Ва*)=2
Слайд 60: продолжение
3. Ва – s - элемент, металл, ОЭО=0,9. Высший оксид ВаО – основной. Гидрат – Ва(ОН) 2 -основание ВаО+Н 2 О=Ва(ОН) 2 ; ВаО+СО2= ВаСО 3 ; ВаО+ 2HCl=BaCl 2 + Н 2 О ;



















![Лекция 11 Энергия ионизации [ кДж/моль ]](https://s0.showslide.ru/s_slide/cdb1b5b868edb5d7e162e51e272d5b97/f8ecc531-62a4-47c6-99a0-1ce5a60fd5ff.jpeg)