Слайд 2
1. Органическая химия: Учебник для вузов в 2 кн.(Под ред. Н.А. Тюкавкиной) - М.: Дрофа, 2002 или более поздние издания. 2. Грандберг И. И. Органическая химия. - М.: Дрофа, 2001 (или Грандберг И. Л. Органическая химия.- М.: Высшая школа, 1987.) 3. Терней А.. Современная органическая химия в 2 т. Пер. с англ. - М., Мир, 1981 4. Райлс А., Смит К., Уорд Р. Основы органической химии. Пер. с англ. - М.: Мир, 1982. Литература основная :
Слайд 3
ДОПОЛНИТЕЛЬНАЯ ЛИТЕРАТУРА : 1. Ельницкий А. П. Номенклатура органических соединений. Сборник упражнений. - Минск: «Сэр-Вит», 2003 2. Ельницкий А. П., Ильина Н. А, Козырьков Ю. Ю., Матюшенков Е. А., Бубель О. Н, Шевчук Т. А., Асташко Д. А., Райман М. В. Задачи и упражнения по органической химии. ч.1. - Минск: БГУ, 2007. 3. Тюкавкина Н.А., Бауков Ю. И. Биоорганическая химия. - М.: Медицина. 1991 4. Тейлор Г. Основы органической химии. Пер. с англ. - М.: Мир, 1989 5. Моррисон Р., Бойд Р. Органическая химия. Пер. с англ. - М.: Мир, 1974.
Слайд 4
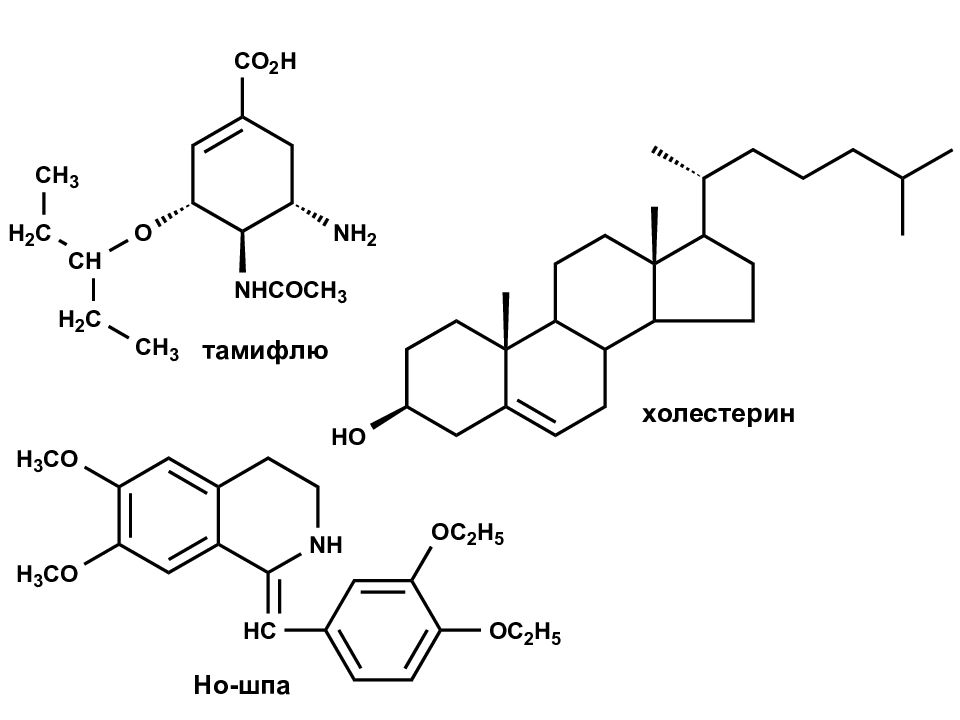
I. ВВЕДЕНИЕ. ОБЩИЕ ПРЕДСТАВЛЕНИЯ. 1.1. Предмет органической химии. Соединения называются органическими, если в их состав входят атомы углерода. Помимо атомов углерода, в состав органических соединений могут входить другие химические соединения. Чаще всего ими оказываются H, N, O, S, P. Уксусная кислота Стеариновая кислота
Слайд 7
Органические молекулы лежат в основе всех живых организмов: ДНК, РНК, АТФ, белки, ферменты, рецепторы, углеводы, жиры, нейромедиаторы и др. ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ В ПРИРОДЕ
Слайд 8
Основные источники органических веществ – это нефть, уголь, газ, древесина. Множество синтетических органических соединений производится промышленностью для использования в самых разных отраслях человеческой деятельности: горючее для различных двигателей полимерные материалы (каучуки, пластмассы, волокна, пленки, лаки, клеи и т.д.) поверхностно-активные вещества красители средства защиты растений лекарственные препараты ароматизаторы, красители, стабилизаторы для пищевой и косметической продукции парфюмерные вещества и т.п.
Слайд 9
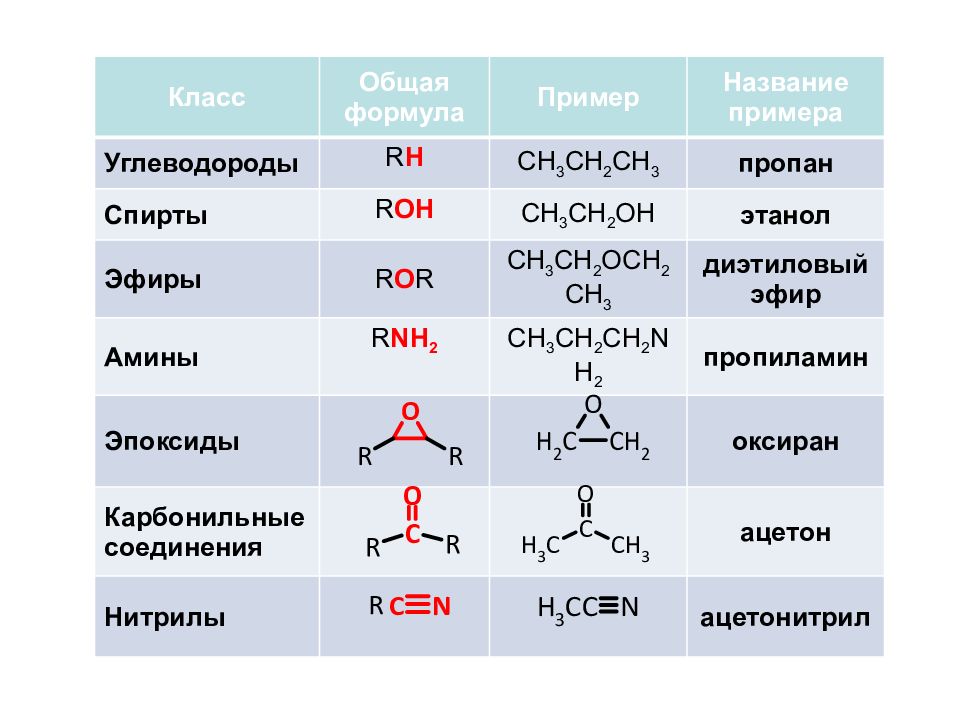
Класс Общая формула Пример Название примера Углеводороды R H CH 3 CH 2 CH 3 пропан Спирты R OH CH 3 CH 2 OH этанол Эфиры R O R CH 3 CH 2 OCH 2 CH 3 диэтиловый эфир Амины R NH 2 CH 3 CH 2 CH 2 NH 2 пропиламин Эпоксиды оксиран Карбонильные соединения ацетон Нитрилы ацетонитрил
Слайд 10
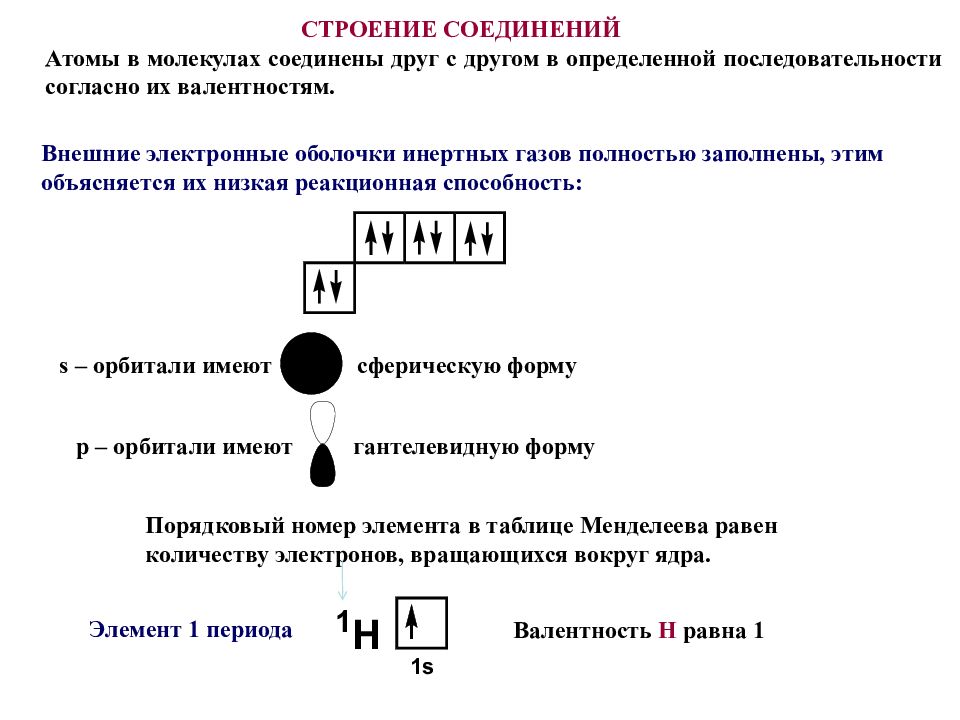
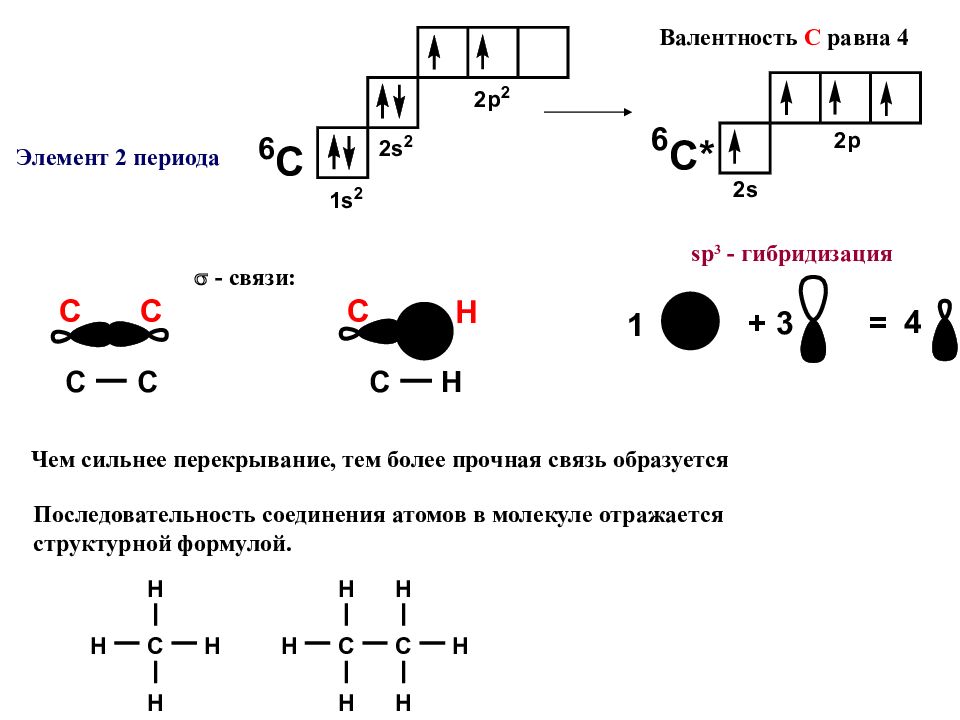
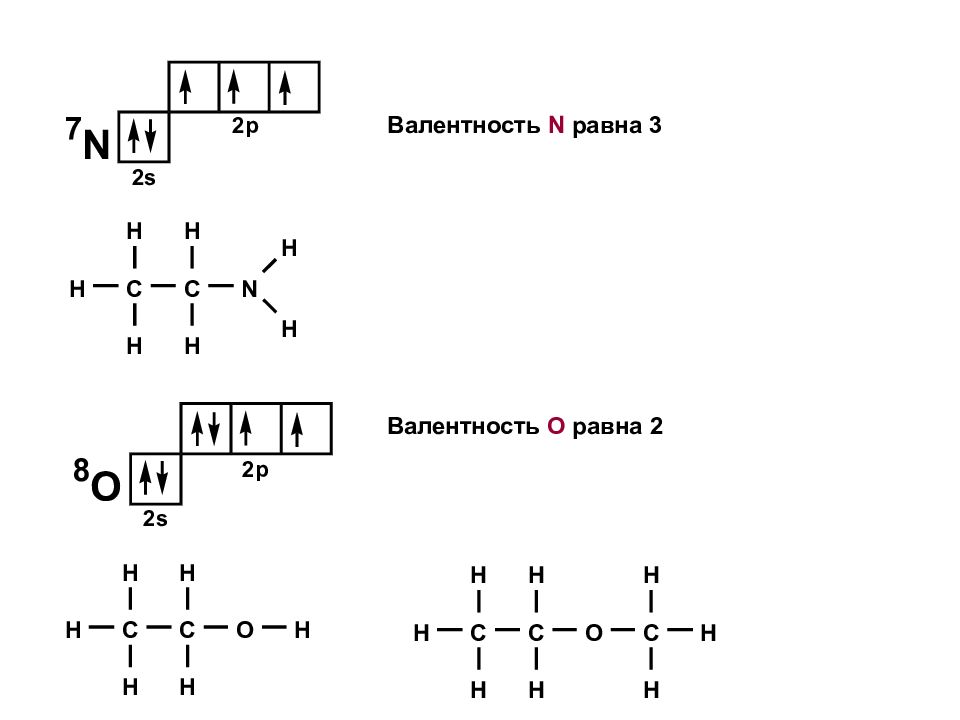
Атомы в молекулах соединены друг с другом в определенной последовательности согласно их валентностям. Порядковый номер элемента в таблице Менделеева равен количеству электронов, вращающихся вокруг ядра. Валентность H равна 1 Внешние электронные оболочки инертных газов полностью заполнены, этим объясняется их низкая реакционная способность : СТРОЕНИЕ СОЕДИНЕНИЙ Элемент 1 периода s – орбитали имеют сферическую форму p – орбитали имеют гантелевидную форму
Слайд 11
Элемент 2 периода sp 3 - гибридизация Валентность С равна 4 - связи: Последовательность соединения атомов в молекуле отражается структурной формулой. Чем сильнее перекрывание, тем более прочная связь образуется
Слайд 13
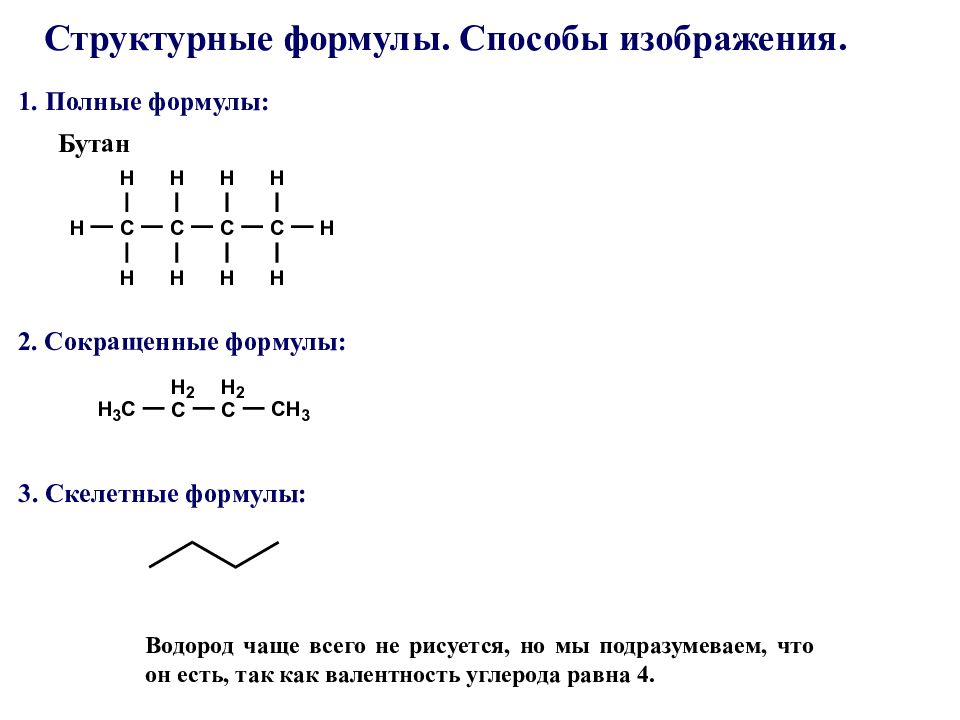
Бутан Структурные формулы. Способы изображения. Водород чаще всего не рисуется, но мы подразумеваем, что он есть, так как валентность углерода равна 4. 3. Скелетные формулы : 1. Полные формулы : 2. Сокращенные формулы :
Слайд 14
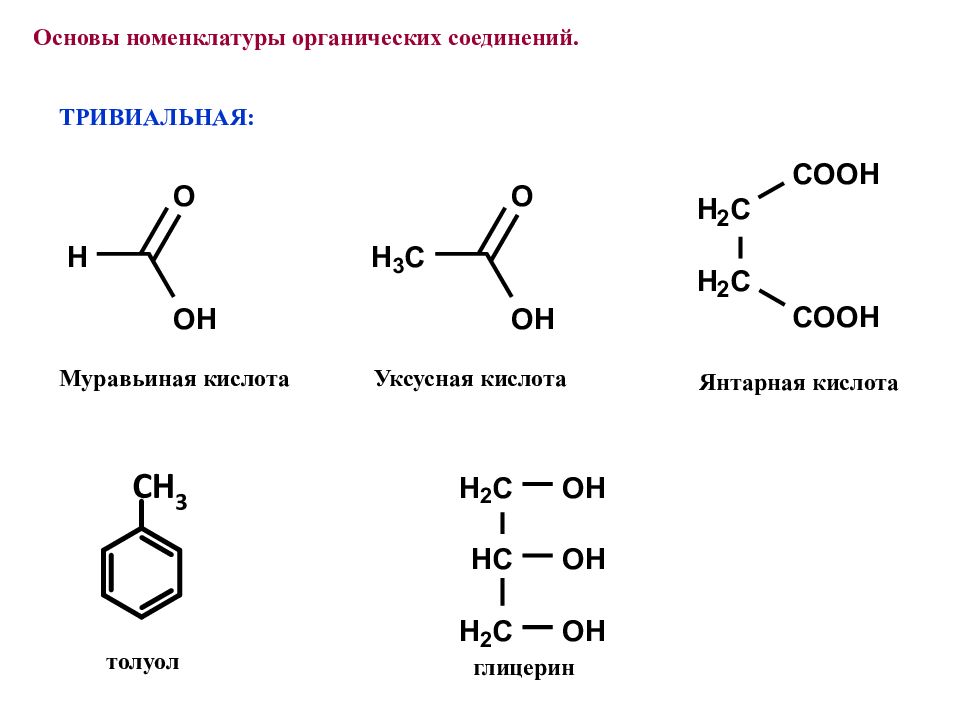
ТРИВИАЛЬНАЯ: Муравьиная кислота Основы номенклатуры органических соединений. Янтарная кислота толуол Уксусная кислота глицерин
Слайд 15
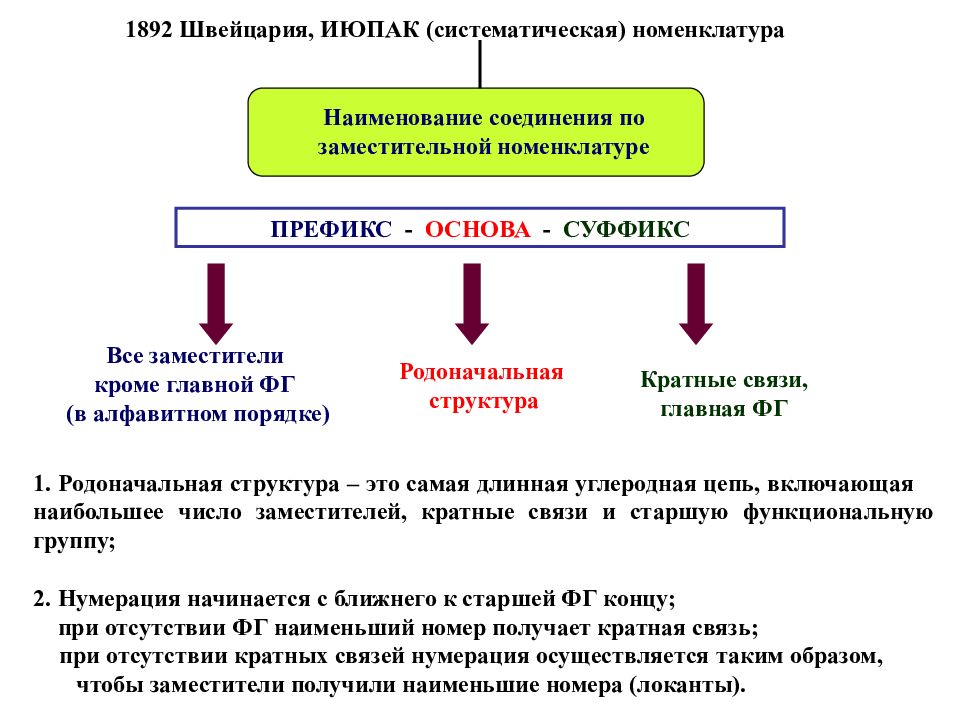
Наименование соединения по заместительной номенклатуре ПРЕФИКС - ОСНОВА - СУФФИКС Все заместители кроме главной ФГ (в алфавитном порядке) Родоначальная структура Кратные связи, главная ФГ 1. Родоначальная структура – это самая длинная углеродная цепь, включающая наибольшее число заместителей, кратные связи и старшую функциональную группу ; 2. Нумерация начинается с ближнего к старшей ФГ концу ; при отсутствии ФГ наименьший номер получает кратная связь ; при отсутствии кратных связей нумерация осуществляется таким образом, чтобы заместители получили наименьшие номера (локанты). 1892 Швейцария, ИЮПАК (систематическая) номенклатура
Слайд 16
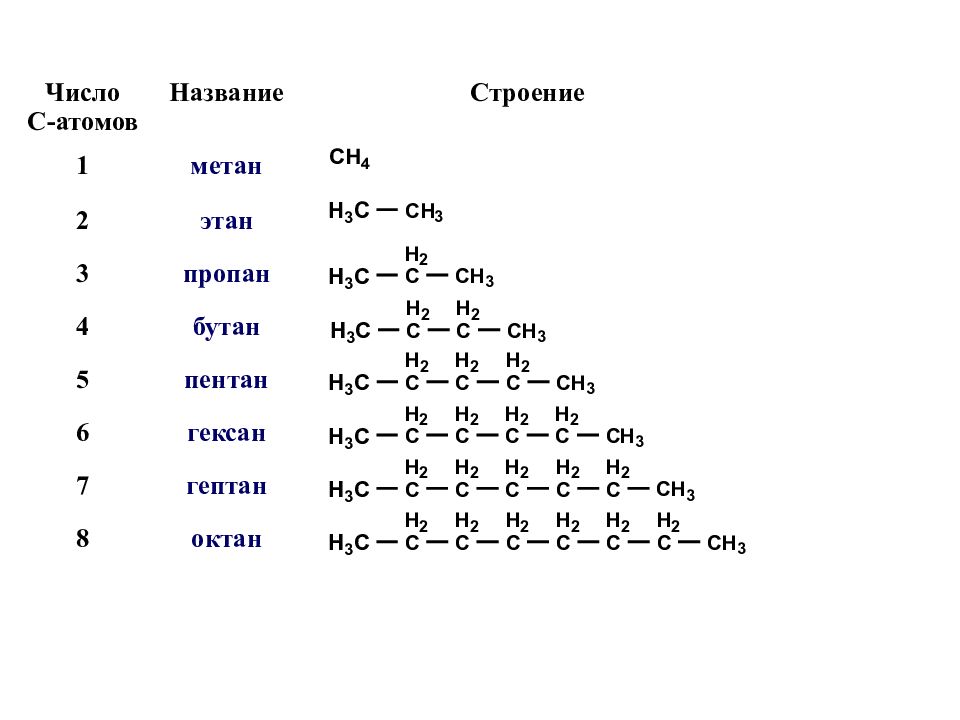
Число С-атомов Название Строение 1 метан 2 этан 3 пропан 4 бутан 5 пентан 6 гексан 7 гептан 8 октан
Слайд 17
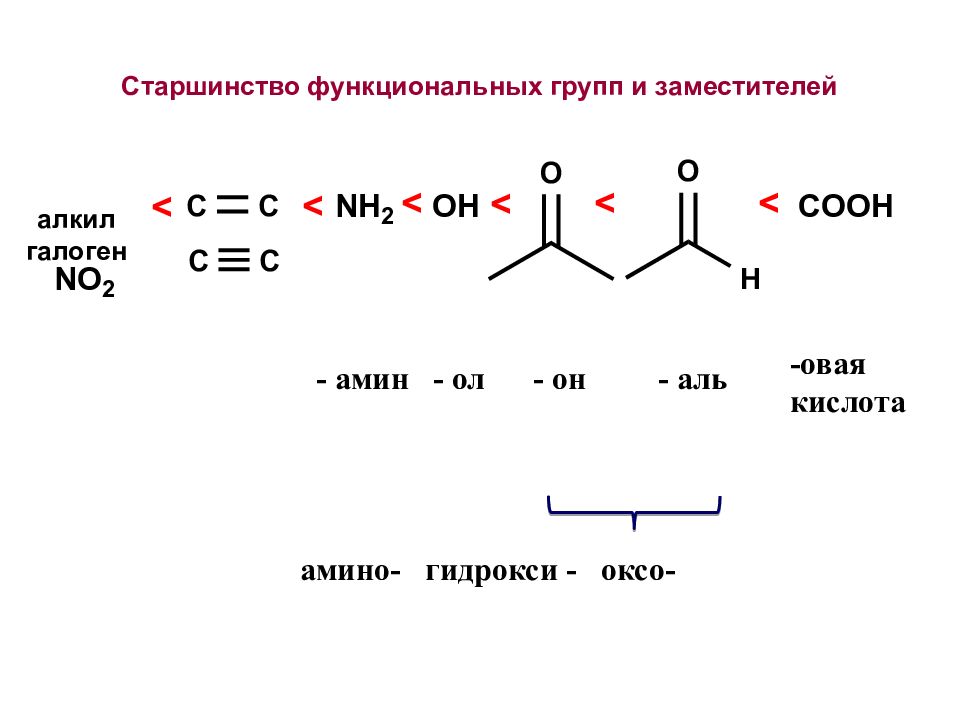
-овая кислота - амин - ол - он - аль амино- гидрокси - оксо- алкил галоген Старшинство функциональных групп и заместителей
Слайд 18
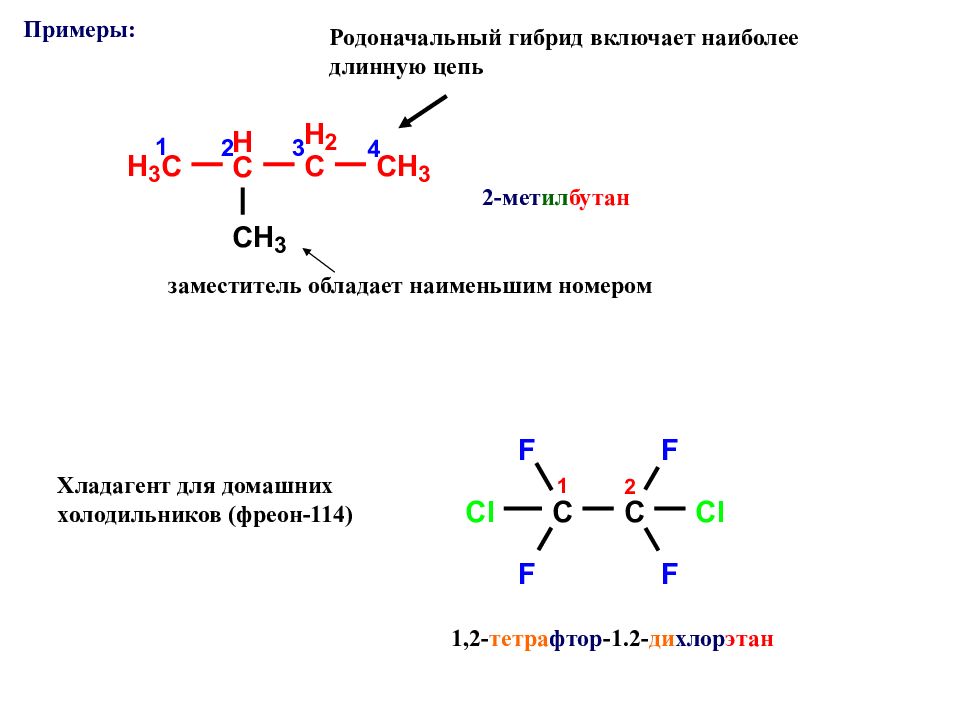
Родоначальный гибрид включает наиболее длинную цепь заместитель обладает наименьшим номером 2-мет ил бутан Примеры : 1,2- тетра фтор -1.2- ди хлор этан Хладагент для домашних холодильников (фреон-114)
Слайд 19
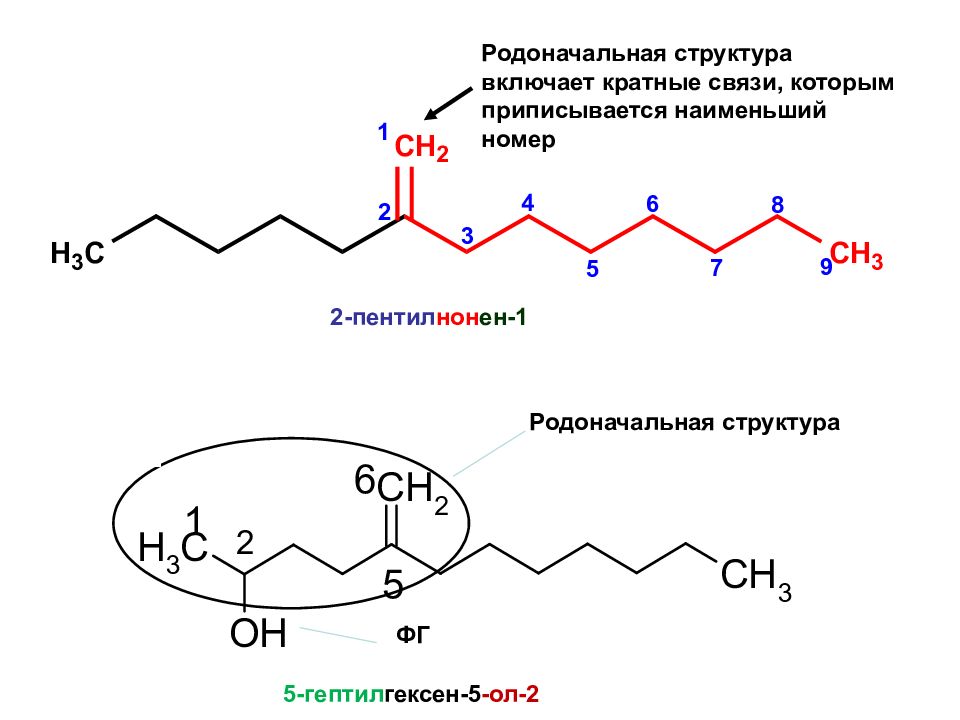
2-пентил нон ен -1 Родоначальная структура включает кратные связи, которым приписывается наименьший номер 5-гептил гексен-5 -ол-2 ФГ Родоначальная структура
Слайд 20
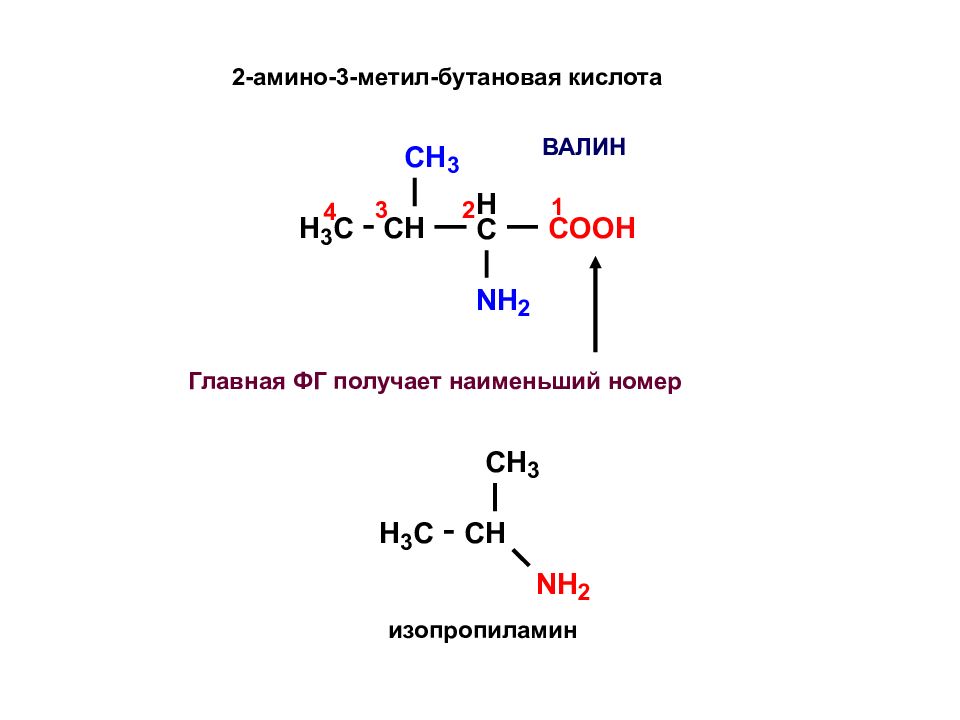
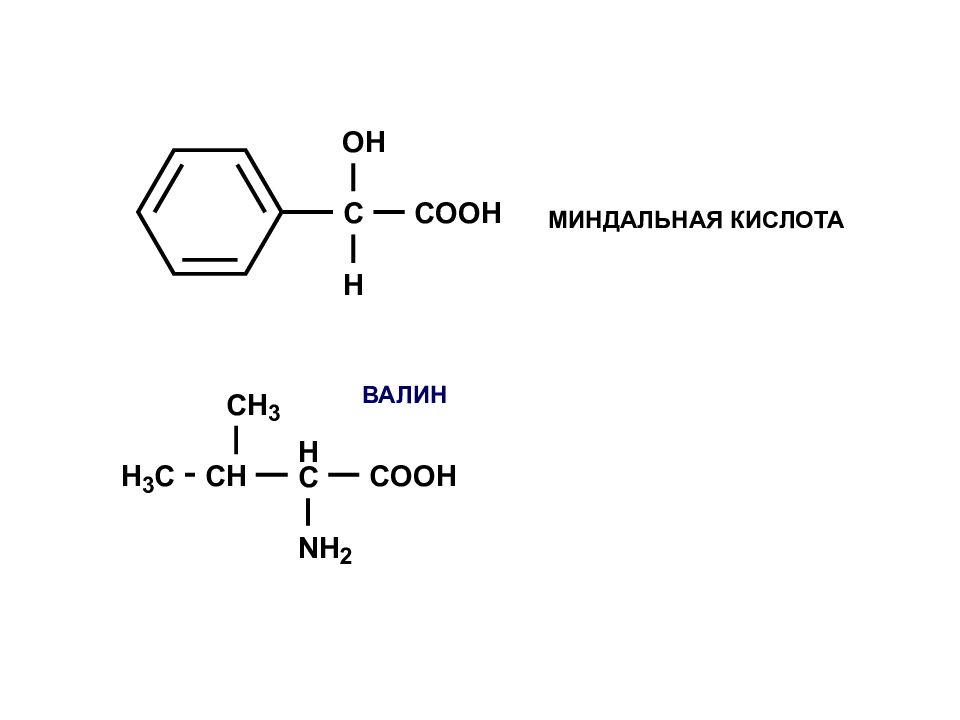
Главная ФГ получает наименьший номер ВАЛИН 2-амино-3-метил-бутановая кислота изопропиламин
Слайд 21
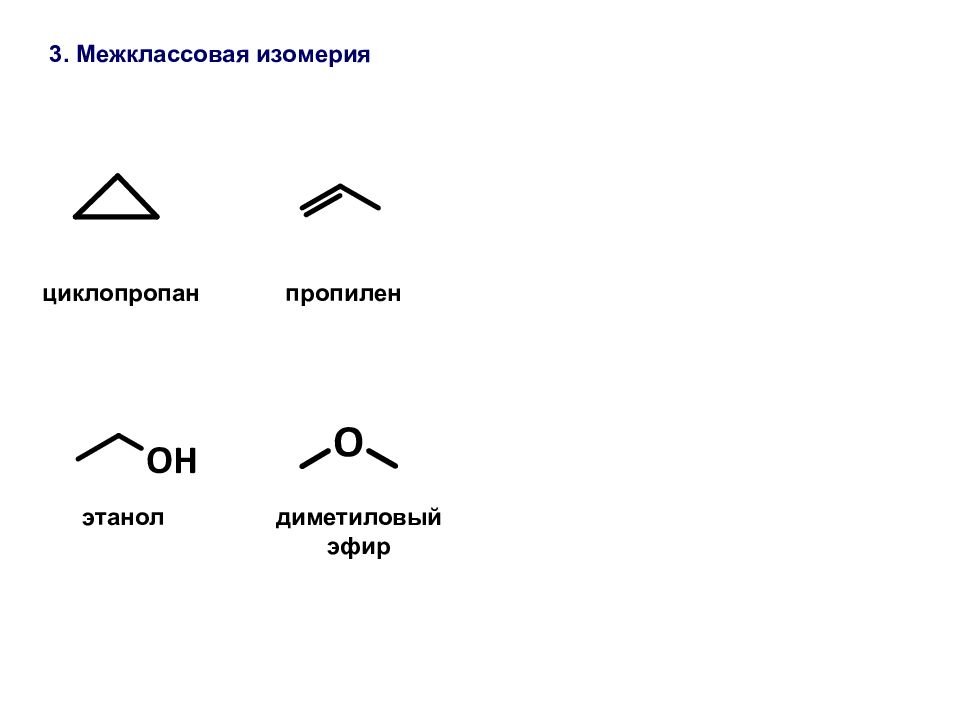
Типы изомерии в органической химии : структурная пространственная (стереоизомерия) ИЗОМЕРИЯ – явление, заключающееся в существовании химических соединений (изомеров), одинаковых по составу и молекулярной массе, но различающихся по строению или расположению атомов в пространстве и, вследствие этого, по свойствам. Изомерия органических соединений. Структурные изомеры – соединения одинакового качественного и количественного состава, отличающиеся порядком соединения атомов между собой, т.е химическим строением. Структурные изомеры различаются физическими свойствами, реакционной способностью. СТРУКТУРНАЯ ИЗОМЕРИЯ:
Слайд 22
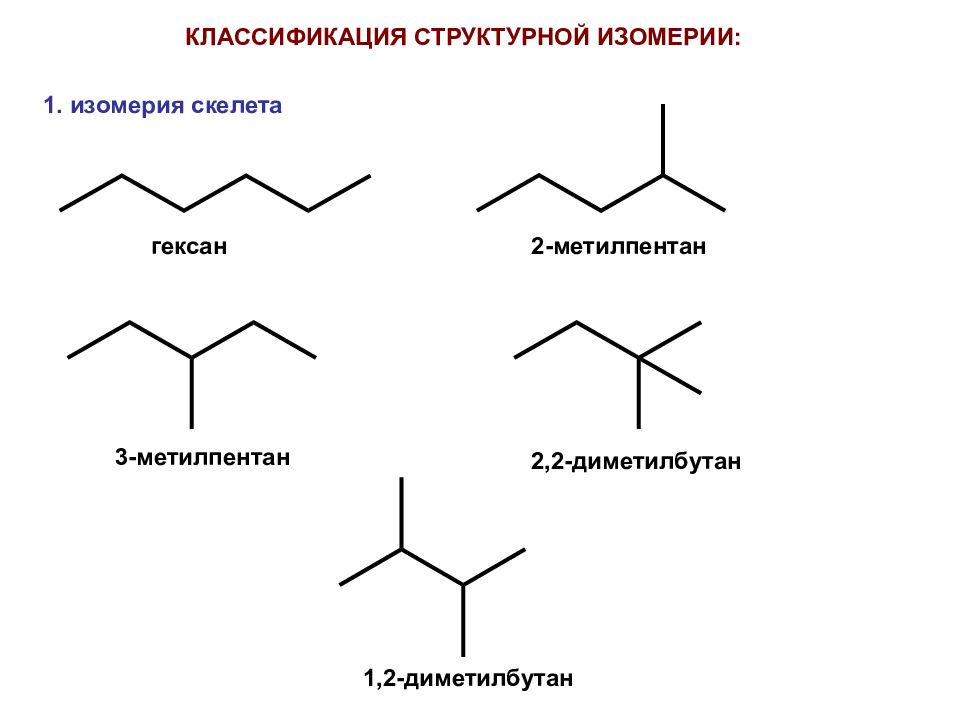
КЛАССИФИКАЦИЯ СТРУКТУРНОЙ ИЗОМЕРИИ: гексан 2-метилпентан 3-метилпентан 2,2-диметилбутан 1,2-диметилбутан 1. изомерия скелета
Слайд 23
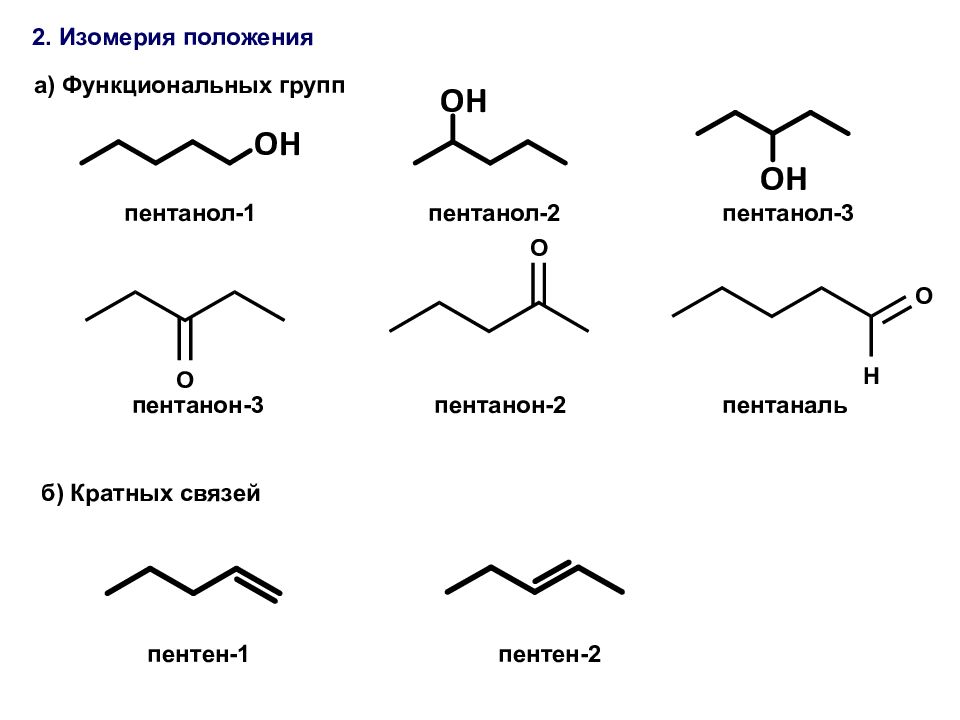
2. Изомерия положения пентанол-1 пентанол-2 пентанол-3 a) Функциональных групп б ) Кратных связей пентанон-3 пентанон-2 пентаналь пентен-1 пентен-2
Слайд 25
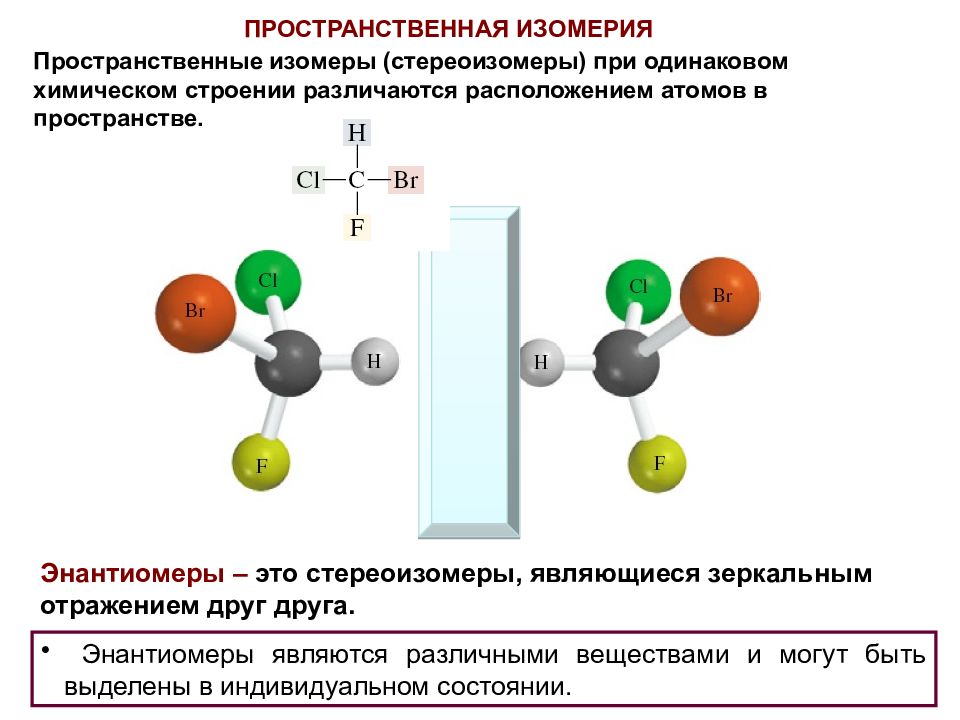
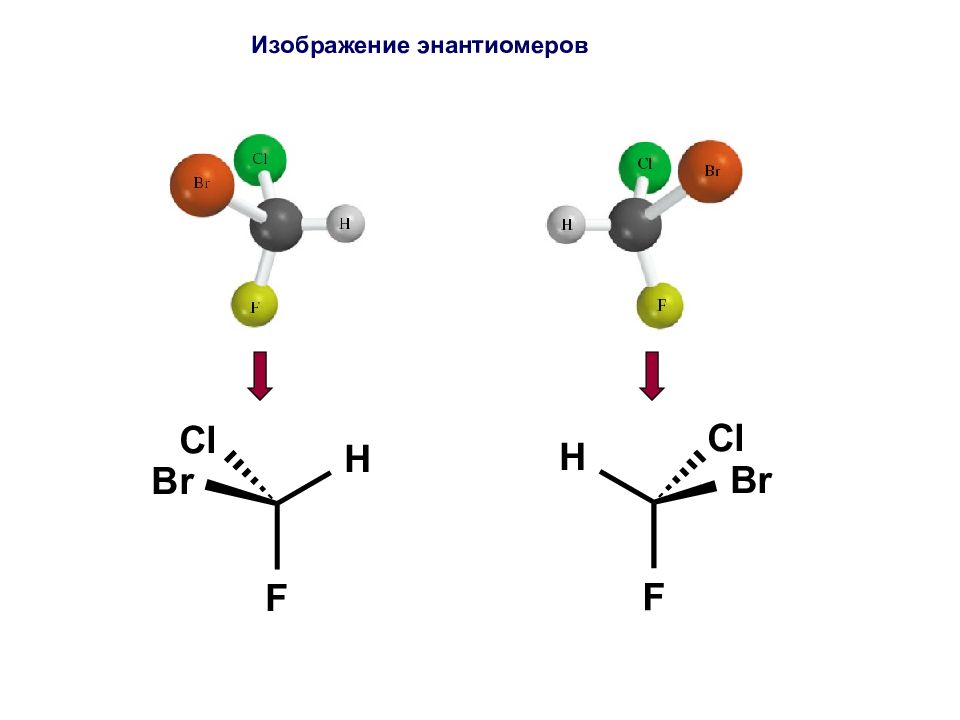
Пространственные изомеры (стереоизомеры) при одинаковом химическом строении различаются расположением атомов в пространстве. ПРОСТРАНСТВЕННАЯ ИЗОМЕРИЯ Энантиомеры являются различными веществами и могут быть выделены в индивидуальном состоянии. Энантиомеры – это стереоизомеры, являющиеся зеркальным отражением друг друга.
Слайд 26
Молекула хиральна, если она не идентична своему зеркальному отражению. CHEIR (греч.) – рука С hiral – хиральный Chirality - хиральность
Слайд 27
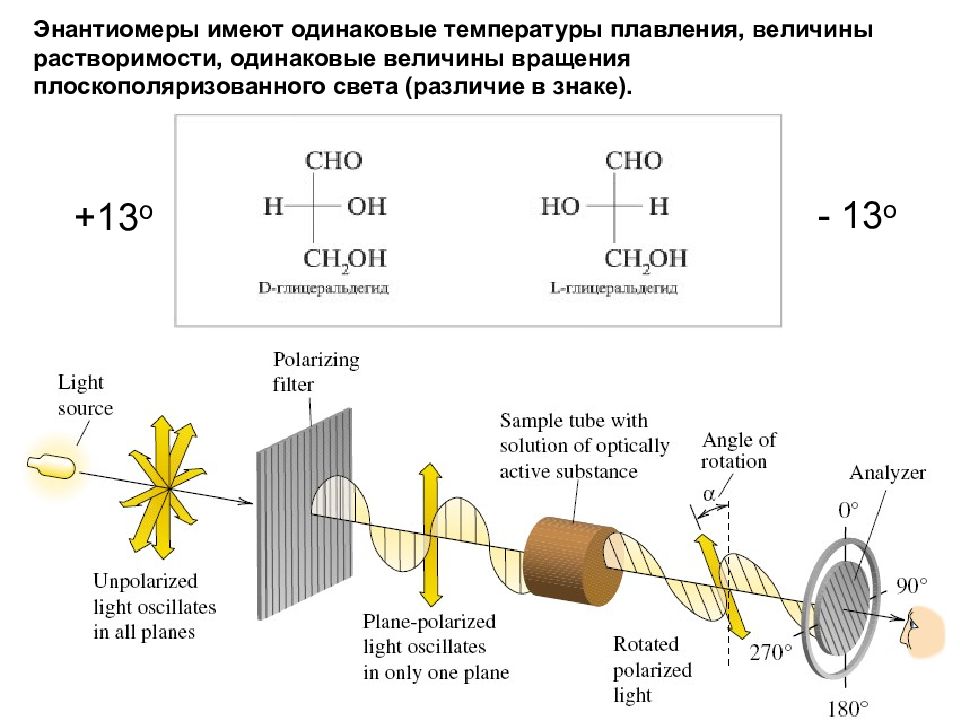
Энантиомеры имеют одинаковые температуры плавления, величины растворимости, одинаковые величины вращения плоскополяризованного света (различие в знаке).
Слайд 28
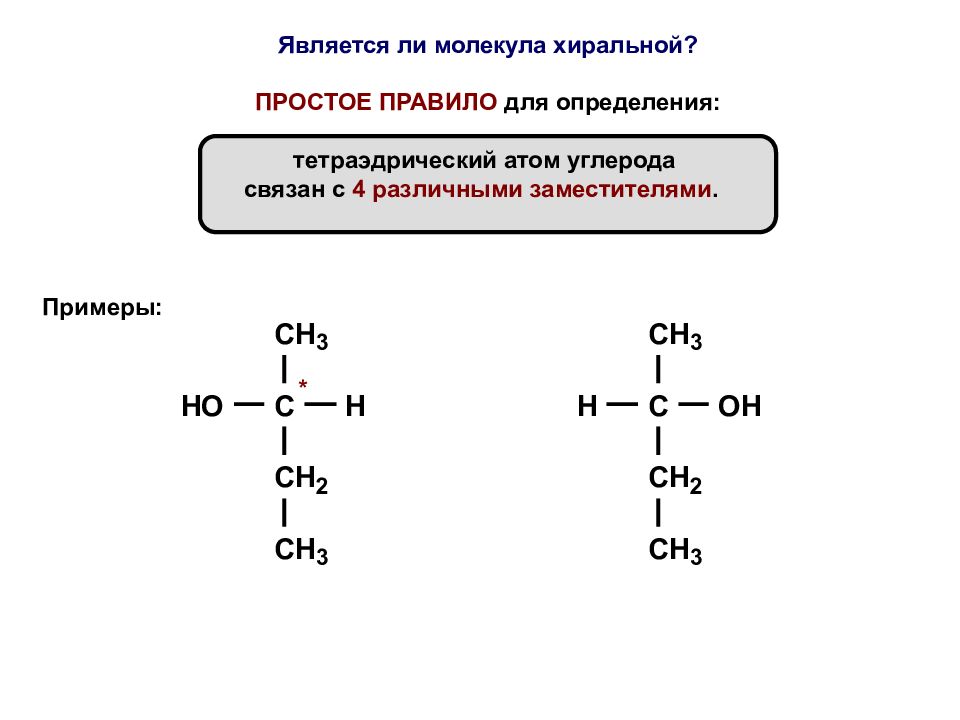
Является ли молекула хиральной? ПРОСТОЕ ПРАВИЛО для определения: тетраэдрический атом углерода связан с 4 различными заместителями. Примеры: *
Слайд 31
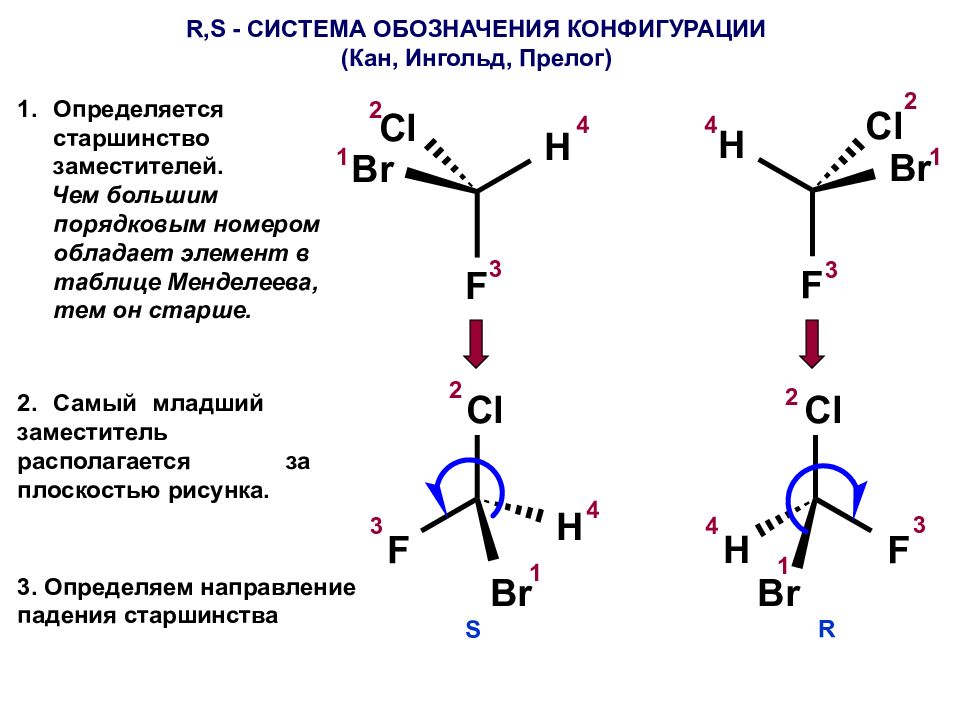
R,S - СИСТЕМА ОБОЗНАЧЕНИЯ КОНФИГУРАЦИИ (Кан, Ингольд, Прелог) Определяется старшинство заместителей. Чем большим порядковым номером обладает элемент в таблице Менделеева, тем он старше. 1 2 3 1 2 3 4 4 2. Самый младший заместитель располагается за плоскостью рисунка. 2 2 1 1 3 3 4 4 S R 3. Определяем направление падения старшинства
Слайд 32
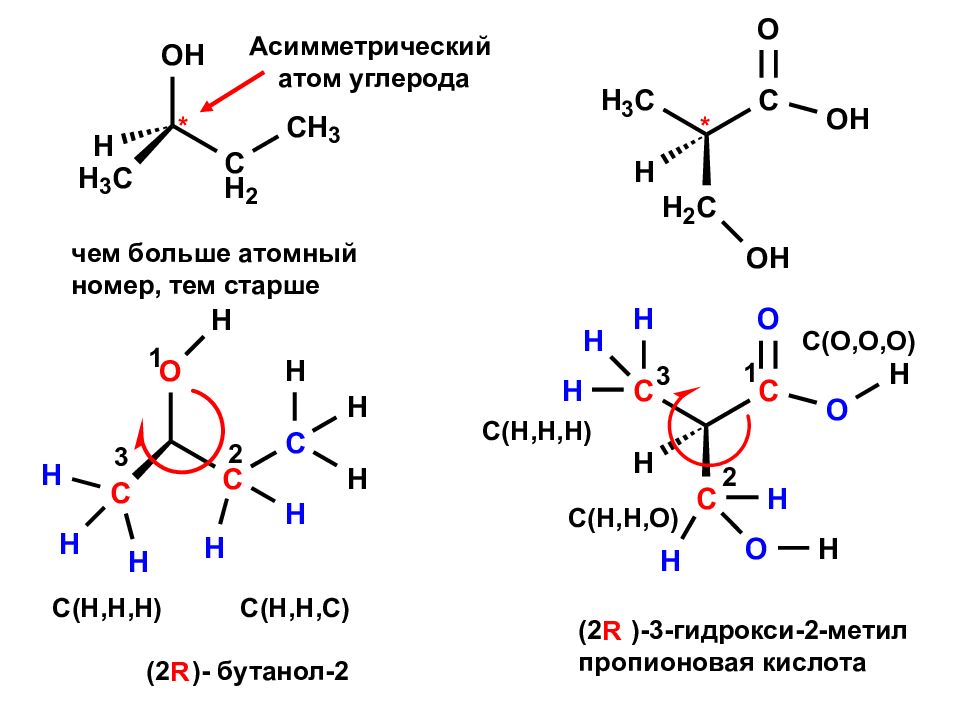
чем больше атомный номер, тем старше 3 С( H,H,H) C(H,H,C) 2 1 R * Асимметрический атом углерода (2 )- бутанол-2 * С( H,H,H) C(H,H,O) C(O,O,O) 1 2 3 R (2 )-3- гидрокси-2-метил пропионовая кислота
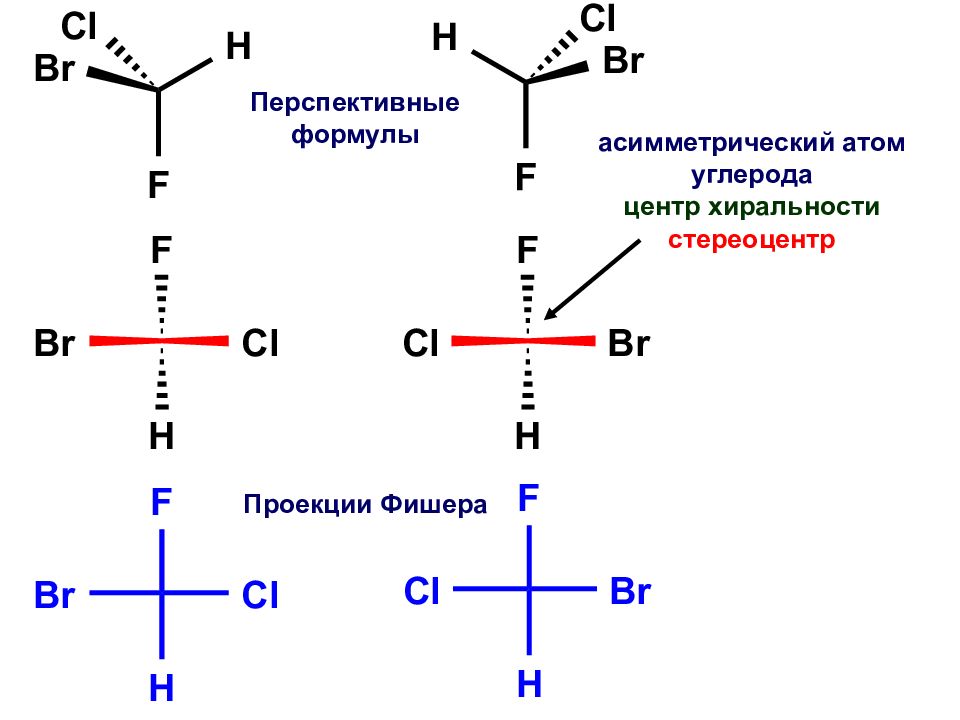
Слайд 33
Проекции Фишера Перспективные формулы асимметрический атом углерода центр хиральности стереоцентр
Слайд 34
ОПРЕДЕЛЕНИЕ R/S КОНФИГУРАЦИИ НА ПРОЕКЦИИ ФИШЕРА Операции, не изменяющие конфигурацию стереоцентра: Поворот на 180 о. Четное число перестановок заместителей. Операции, изменяющие конфигурацию стереоцентра на противоположную: Поворот на 90 о. Нечетное число перестановок заместителей.
Слайд 35
Молекулы с 1 стереоцентром 2 возможных энантиомера ( R и S ) Молекулы с n стереоцентрами 2 n - стереоизомеров Все возможные комбинации R и S изомеров
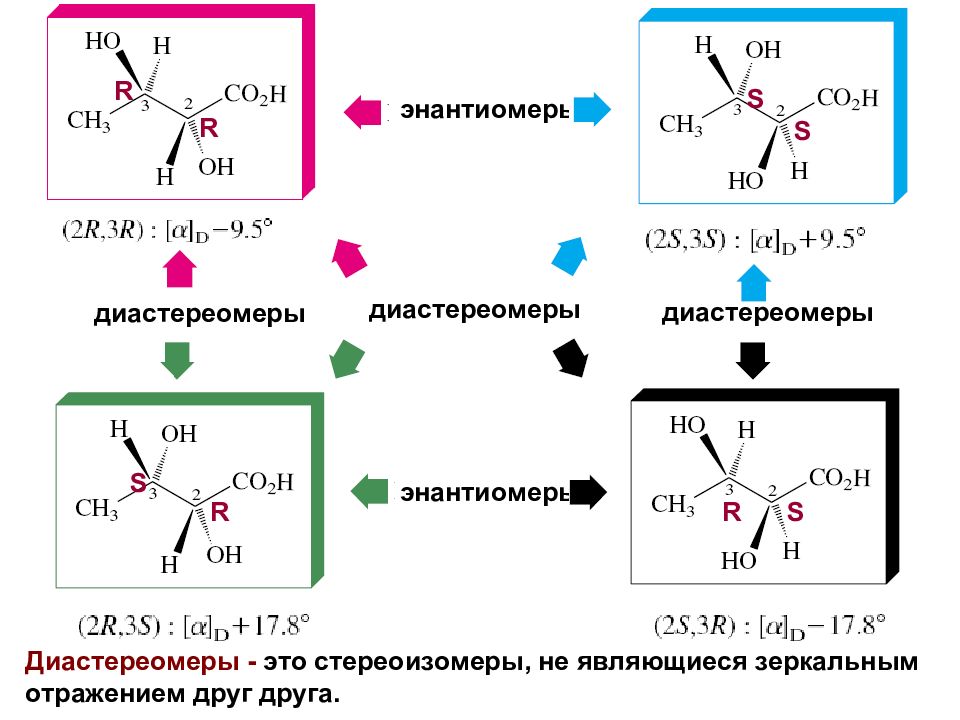
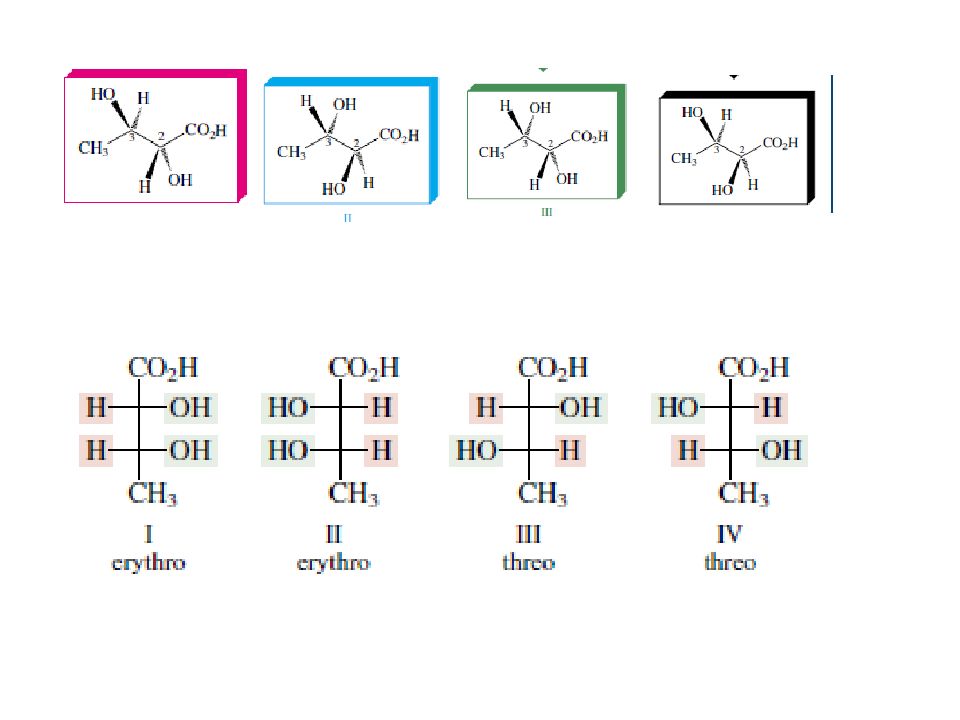
Слайд 36
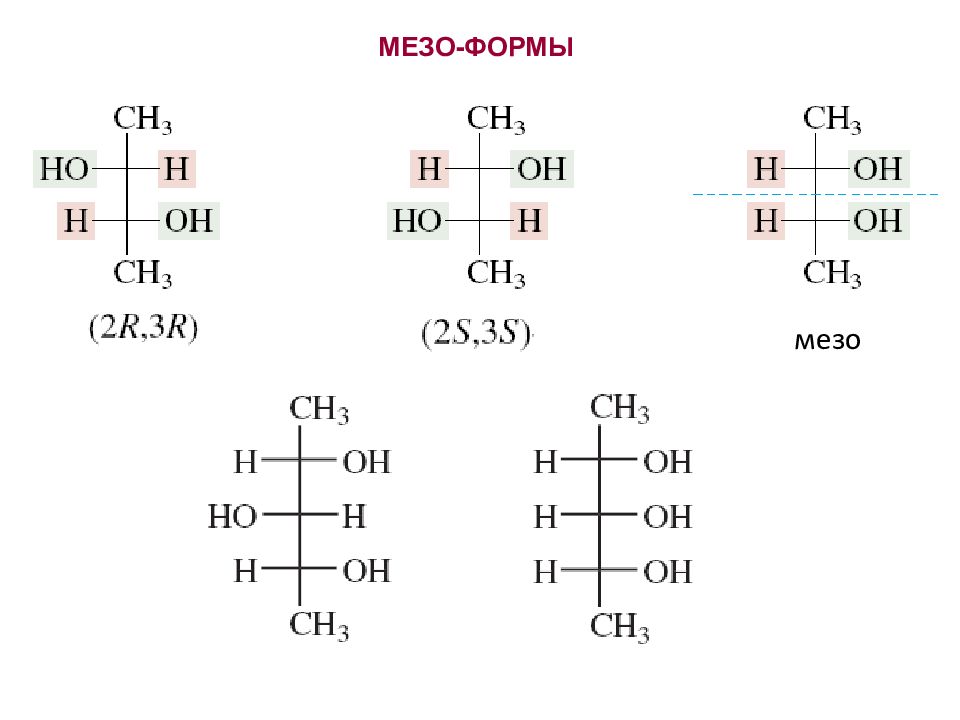
энантиомеры энантиомеры диастереомеры диастереомеры диастереомеры R R R S S S S R Диастереомеры - это стереоизомеры, не являющиеся зеркальным отражением друг друга.
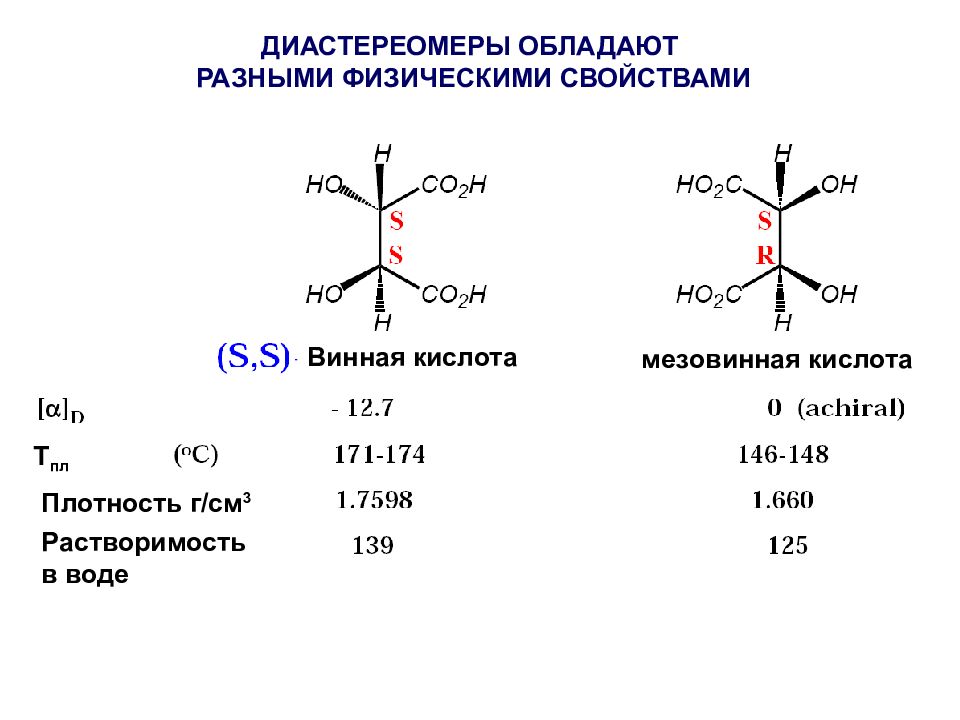
Слайд 37
Т пл Плотность г / см 3 Растворимость в воде Винная кислота мезовинная кислота ДИАСТЕРЕОМЕРЫ ОБЛАДАЮТ РАЗНЫМИ ФИЗИЧЕСКИМИ СВОЙСТВАМИ