Первый слайд презентации: Лекция 1 Предмет органической химии. Особенности органических веществ. Основные классы органических соединений
Балакин Константин Валерьевич, д.х.н. зав. кафедрой общей химии на основе слайдов доцента Т.М. Васильевой (каф. общ. хим.)
Слайд 2: Информация о лекторе К.В. Балакин
Образование 1993 – Московский институт тонкой химической технологии, специальности – биотехнология, тонкий органический синтез; 1993-1996 – обучение в аспирантуре в ИБХ РАН; 1998 – степень кандидата химических наук, специальность биоорганическая химия 2005 – степень доктора химических наук, специальность органическая химия (ИГХТУ, Иваново). Профессиональная деятельность 2000-2008 – руководитель отдела компьютерной и медицинской химии, ЦВТ ХимРар. 2008 по н.в. – зав. лабораторией в ИФАВ РАН (Черноголовка). 2008 по н.в. – директор некоммерческого партнерства институтов РАН «Орхимед» (Москва). 2012 по н.в. – зав. кафедрой общей химии МФТИ (ГУ) (Долгопрудный). Специализация Органическая, биоорганическая, медицинская и компьютерная химия, разработка лекарственных препаратов, химическая информатика, химическая технология
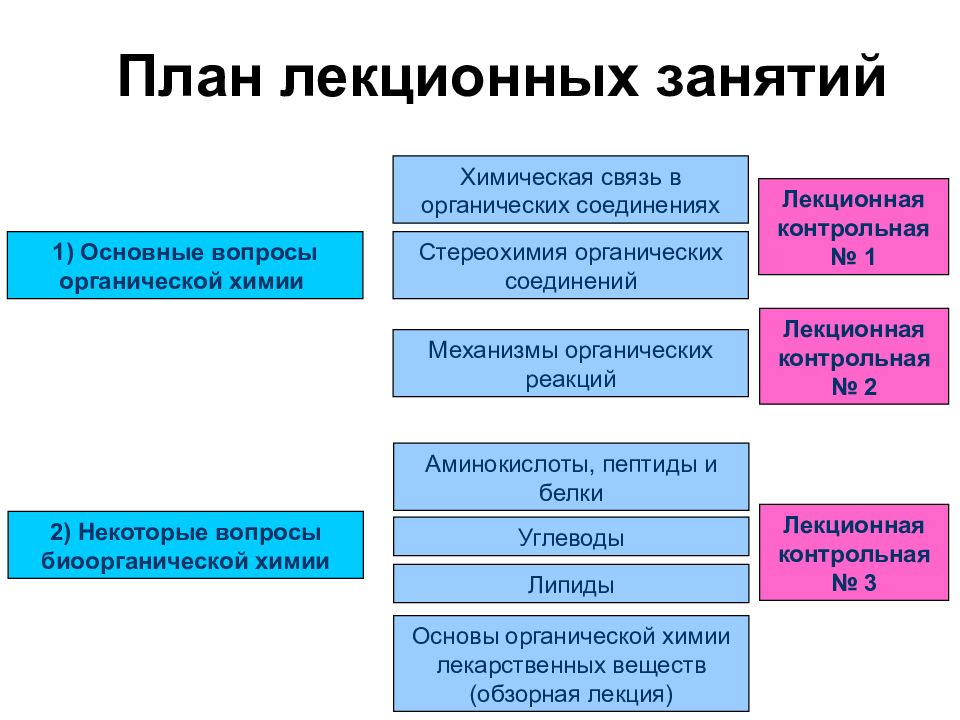
Слайд 3: План лекционных занятий
Лекционная контрольная № 3 2) Некоторые вопросы биоорганической химии Основы органической химии лекарственных веществ (обзорная лекция) Углеводы Липиды Аминокислоты, пептиды и белки 1) Основные вопросы органической химии Химическая связь в органических соединениях Стереохимия органических соединений Механизмы органических реакций Лекционная контрольная № 1 Лекционная контрольная № 2
Слайд 4
Современная органическая химия: некоторые особенности Теоретико-эмпирическая наука, занимающая промежуточное место между строгими и гуманитарными науками. Источники – философия, физика, математика, биология. Критическая роль эксперимента. Приложения – от создания новых материалов до разработки лекарств, систем искусственного интеллекта и пр. В современной органической химии – очень высокая роль информационной составляющей, а также физико-математической и технической проблематики в целом. Связь с загадками живой природы.
Слайд 7: Предмет органической химии
Органическая химия – научная дисциплина, всесторонне изучающая органические соединения: Строение Физические и химические свойства Способы получения, синтез Способы практического использования
Слайд 8: Что такое органические соединения?
Органические соединения – это соединения углерода с другими элементами (водородом, кислородом, азотом, серой, фосфор, галогены), которые содержат в своем составе С-С и С-Н связи. Причем наличие последних обязательно. Оксиды углерода СО, СО 2 Карбиды CaC 2, Al 4 C 3, SiC, B 4 C, Fe 3 C Органические соединения – это углеводороды и их производные. Неорганические соединения
Слайд 9: Особенности органических соединений
Многообразие органических соединений. Сложность молекул органических веществ, содержащих до 10 тысяч атомов (например, природные биополимеры - белки, углеводы). Специфичность свойств органических соединений по сравнению с неорганическими (неустойчивостью при сравнительно невысоких температурах, низкой – до 300°С – температурой плавления, горючестью). Медленно идущие реакции между органическими веществами по сравнению с реакциями, характерными для неорганических веществ, образование побочных продуктов, специфика выделения получающихся веществ и технологическое оборудование. Огромное практическое значение органических соединений. Они - наша пища и одежда, топливо, разнообразные лекарственные препараты, многочисленные полимерные материалы и т.д.
Слайд 10: Источники органических веществ
1) Сырьевые источники - нефть (крекинг, дегидрирование, гидрирование, полимеризация, окисление) - смолы - каучуки - пластмассы - природный газ - бурый и каменный угли - горючие сланцы - торф - древесина - другие природные продукты - алкалоиды растений (хинин, атропин, стрихнин) - антибиотики (стрептомицин, пенициллин) - стероиды и изопреониды - пигменты (каротиноиды, порфирины)
Слайд 11: Источники органических веществ
2) Синтез - лекарственные соединения - витамины - гормоны - регуляторы роста - пестициды 3) Биотехнология, генная инженерия - рекомбинантная ДНК - рекомбинантные белки - клеточные культуры Источники органических веществ Изучение возможности использования живых организмов, их систем или продуктов их жизнедеятельности для решения технологических задач, а также возможности создания живых организмов с необходимыми свойствами
Слайд 13: Неорганические vs. органические
Соединения Неорганические Органические Более 10 млн. соединений Почему существует такое большое число органических веществ, устойчивых к физико-химическим условиям нашей планеты? ~ 700 тыс
Слайд 14
Разнообразие органических соединений: комбинаторный взрыв Пример: пептиды
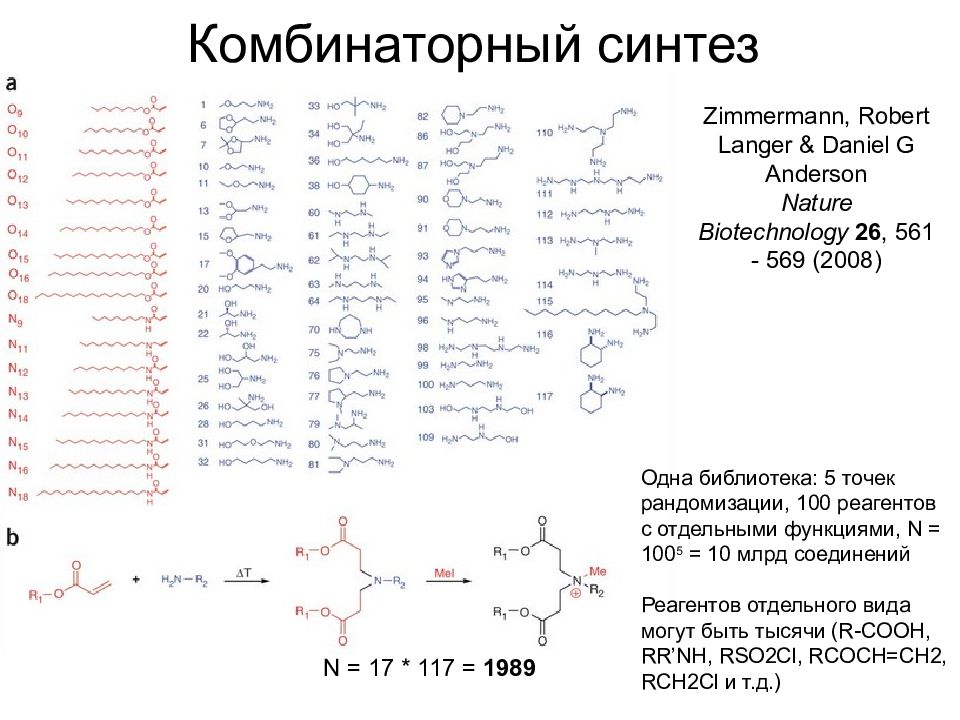
Слайд 15: Комбинаторный синтез
N = 17 * 117 = 1989 Zimmermann, Robert Langer & Daniel G Anderson Nature Biotechnology 26, 561 - 569 (2008) Одна библиотека: 5 точек рандомизации, 100 реагентов с отдельными функциями, N = 100 5 = 1 0 млрд соединений Реагентов отдельного вида могут быть тысячи ( R-COOH, RR’NH, RSO2Cl, RCOCH=CH2, RCH2Cl и т.д.)
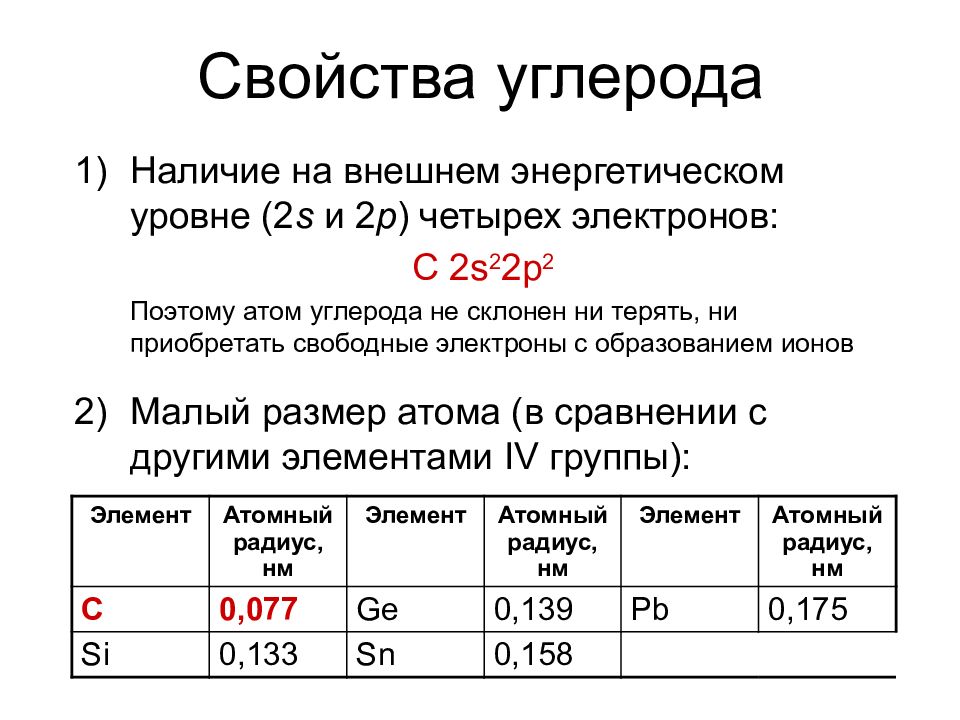
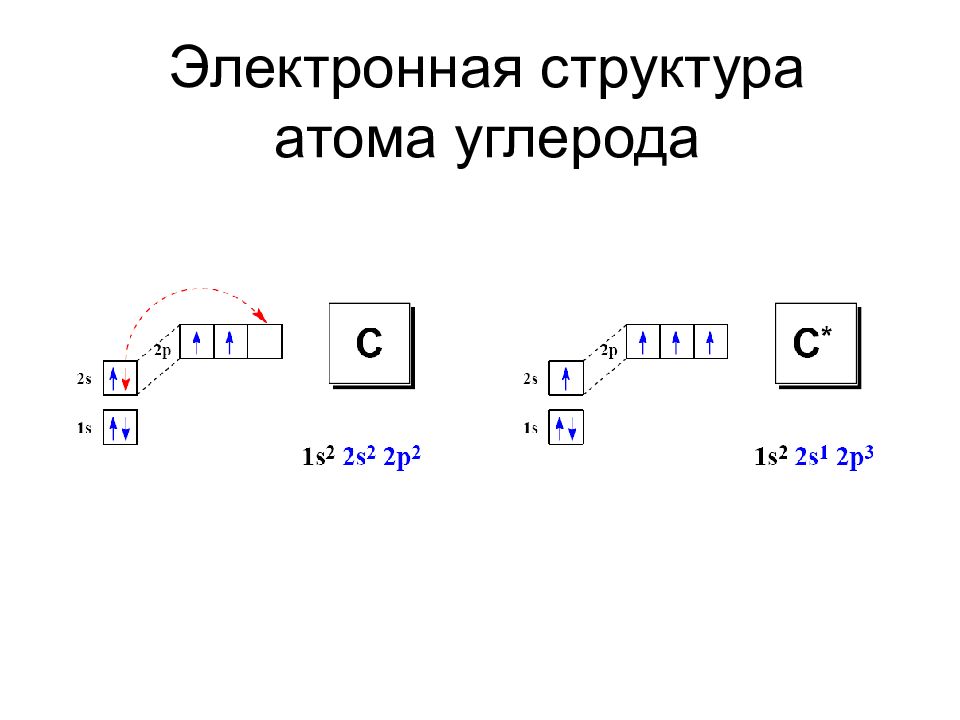
Слайд 16: Свойства углерода
Наличие на внешнем энергетическом уровне (2 s и 2 p ) четырех электронов: С 2 s 2 2p 2 Поэтому атом углерода не склонен ни терять, ни приобретать свободные электроны с образованием ионов Малый размер атома (в сравнении с другими элементами IV группы) : Элемент Атомный радиус, нм Элемент Атомный радиус, нм Элемент Атомный радиус, нм С 0,077 Ge 0,139 Pb 0,175 Si 0,133 Sn 0,158
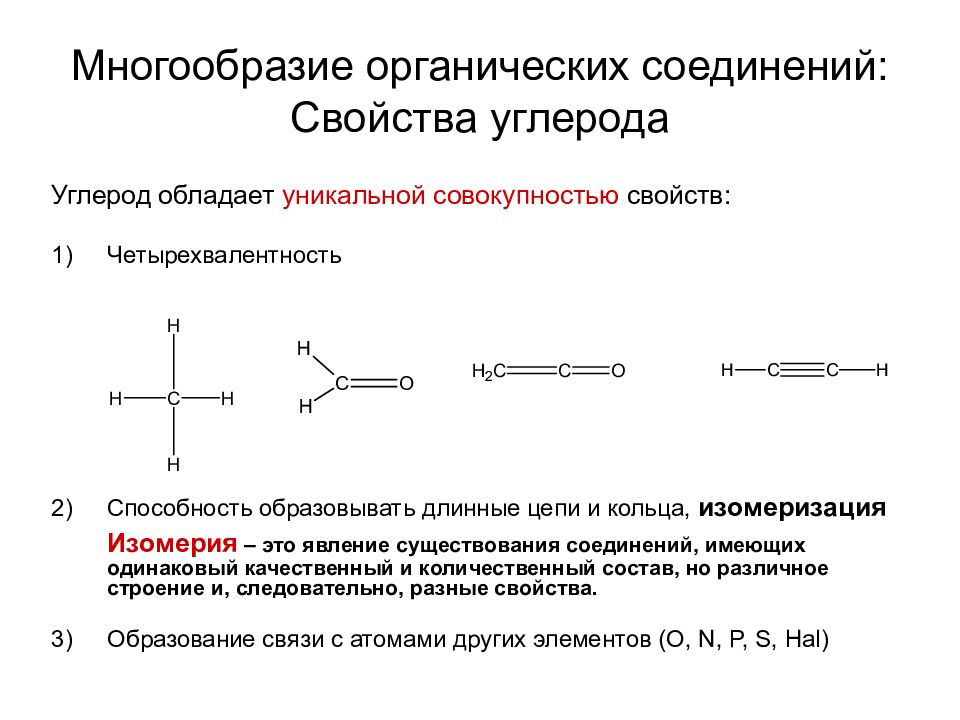
Слайд 18: Многообразие органических соединений: Свойства углерода
Углерод обладает уникальной совокупностью свойств: Четырехвалентность Способность образовывать длинные цепи и кольца, изомеризация Изомерия – это явление существования соединений, имеющих одинаковый качественный и количественный состав, но различное строение и, следовательно, разные свойства. Образование связи с атомами других элементов (O, N, P, S, Hal )
Слайд 19: Многообразие органических соединений: продолжение
4) Элементы обнаруживают присущую им валентность, и также не изменяется их способность образовывать кратную связь. 5) N, O, S и другие элементы, способные образовывать более чем одну одинарную связь, все еще сохраняют свою способность связываться с другими элементами помимо углерода. 6) В состав органических молекул может входить группа, которая в других случаях была бы слишком неустойчивой, чтобы существовать Диазогруппа бенздиазонийхлорид
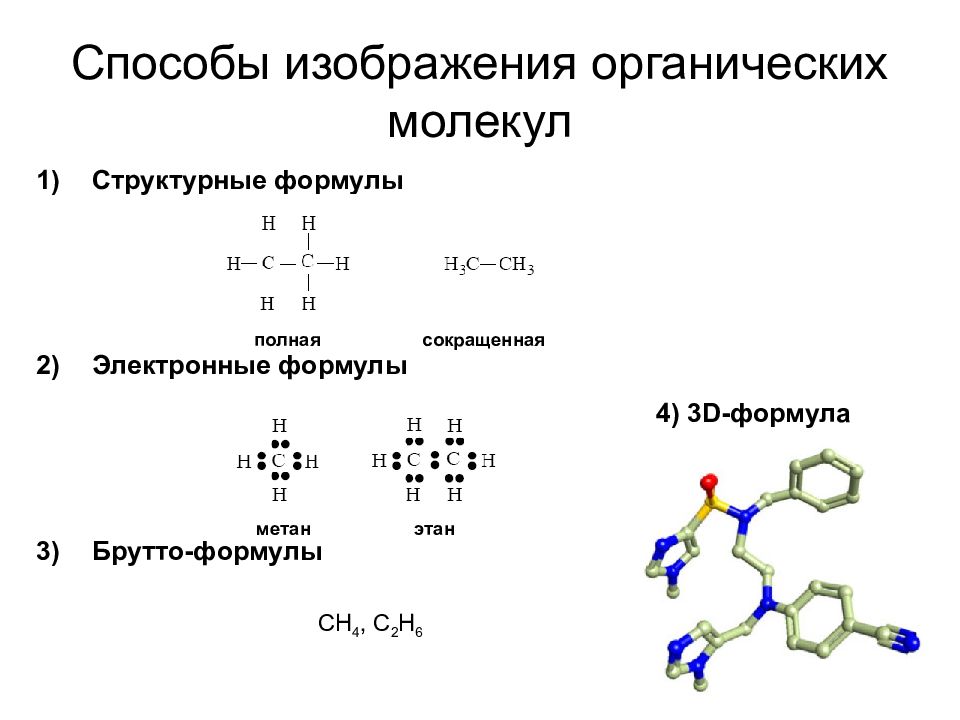
Слайд 20: Способы изображения органических молекул
Структурные формулы Электронные формулы Брутто-формулы полная сокращенная метан этан CH 4, C 2 H 6 4) 3D- формула
Слайд 21: Теории органических соединений
1) Теория витализма (Й.Я. Берцелиус) Органические вещества образуются лишь в живых организмах под влиянием особой «жизненной силы» (« vis vitalis » – жизненная сила (лат.)) Возражения: Синтез мочевины (Ф. Велер 1828 г.) Синтез уксусной кислоты (А. Кольбе 1847 г.) Синтез природных аналогов жиров (М. Бертло 1853-1854 гг.) Синтез метана (М. Бертло 1856 г.)
Слайд 22: Теории органических соединений
2) Теория радикалов (Ж.Дюма, Ю.Либих, Й.Берцелиус ) П ревращения органических соединений протекают так, что некоторые группы атомов (радикалы), не изменяясь, переходят из одного органического соединения в другое. 3) Теория типов ( О.Лоран, Ш.Жерар, Ж.Дюма) К лассифи кация органически х веществ по типам превращений : тип водорода – углеводороды ; тип хлороводорода – галогенопроизводные ; тип воды – спирты, эфиры, кислоты и их ангидриды ; тип аммиака – амины.
Слайд 23: Теория А.М. Бутлерова (1861 г.)
«Всякое органическое соединение имеет единственную (!) химическую формулу, отражающую порядок связывания атомов в молекуле и определяющую его свойства (!!) » Основные положения: Атомы в молекулах соединены друг с другом в определённой последовательности. Изменение этой последовательности приводит к образованию нового вещества с новыми свойствами. Соединение атомов происходит в соответствии с их валентностью. Свойства веществ зависят не только от их состава, но и от химического строения, то есть от порядка соединения атомов в молекулах и характера их взаимного влияния. Наиболее сильно влияют друг на друга атомы, непосредственно связанные между собой.
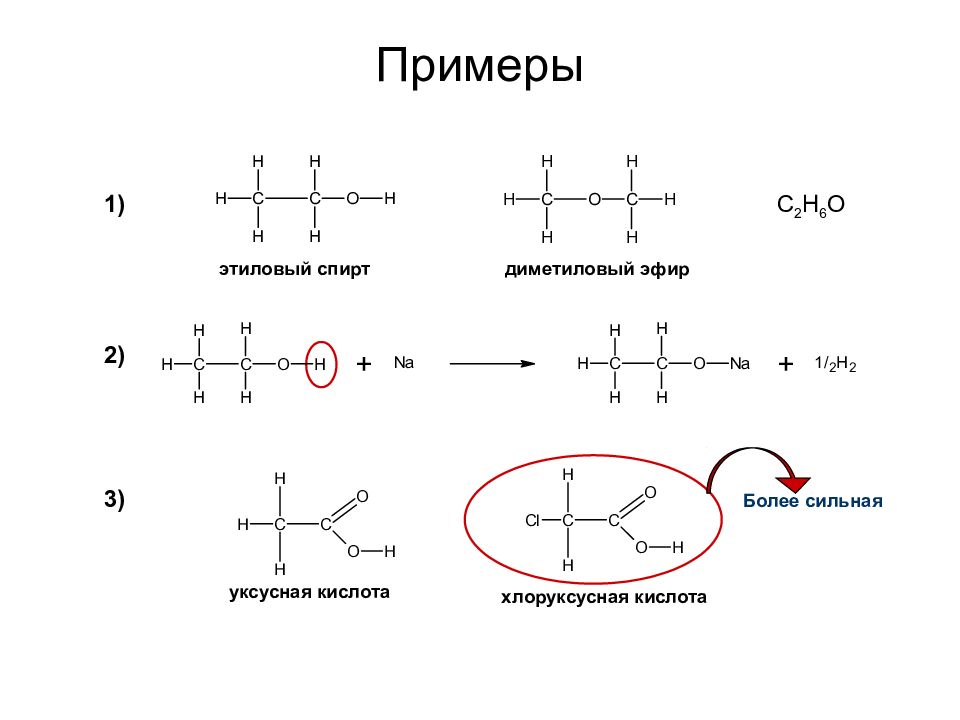
Слайд 24: Примеры
Более сильная Примеры этиловый спирт диметиловый эфир 1) 2) 3) уксусная кислота хлоруксусная кислота C 2 H 6 O
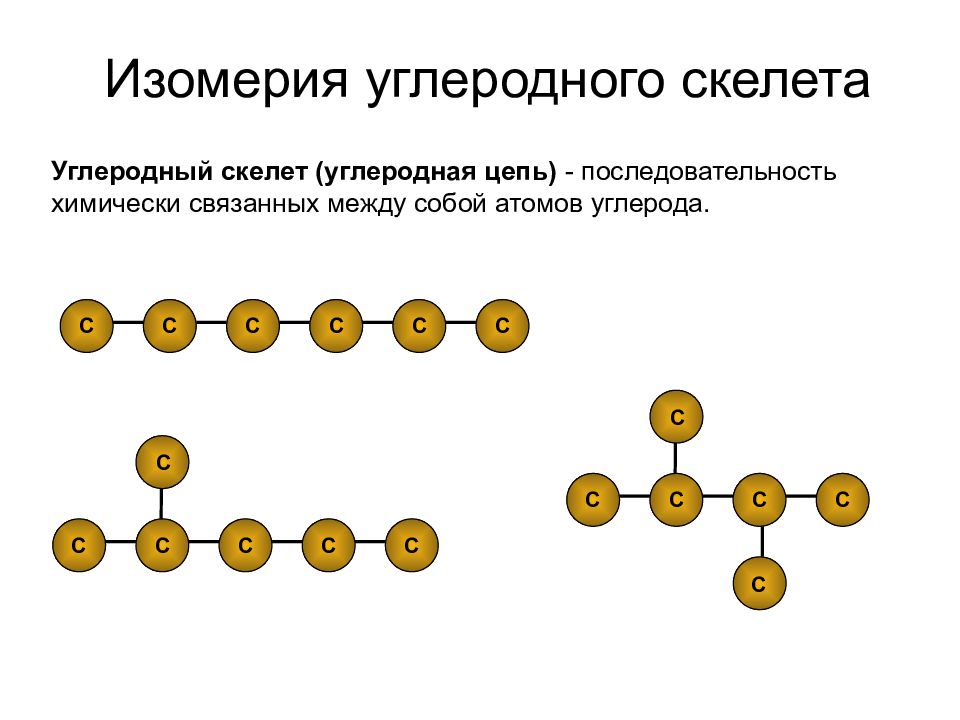
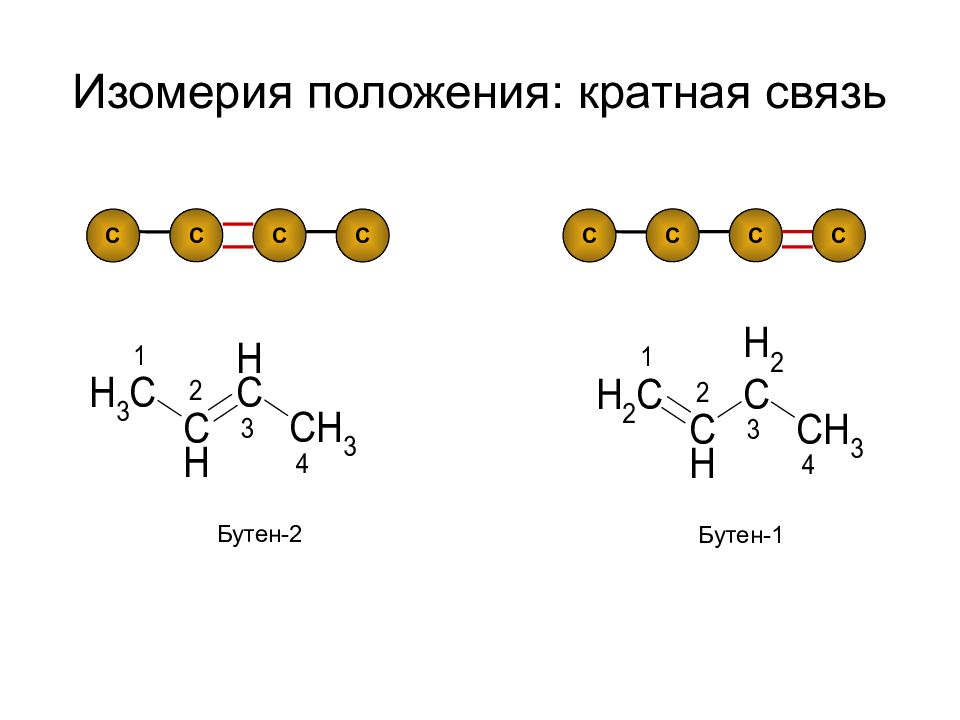
Слайд 25: Изомерия углеродного скелета
С С С С С С С С С С С С С С С С С С Углеродный скелет (углеродная цепь) - последовательность химически связанных между собой атомов углерода.
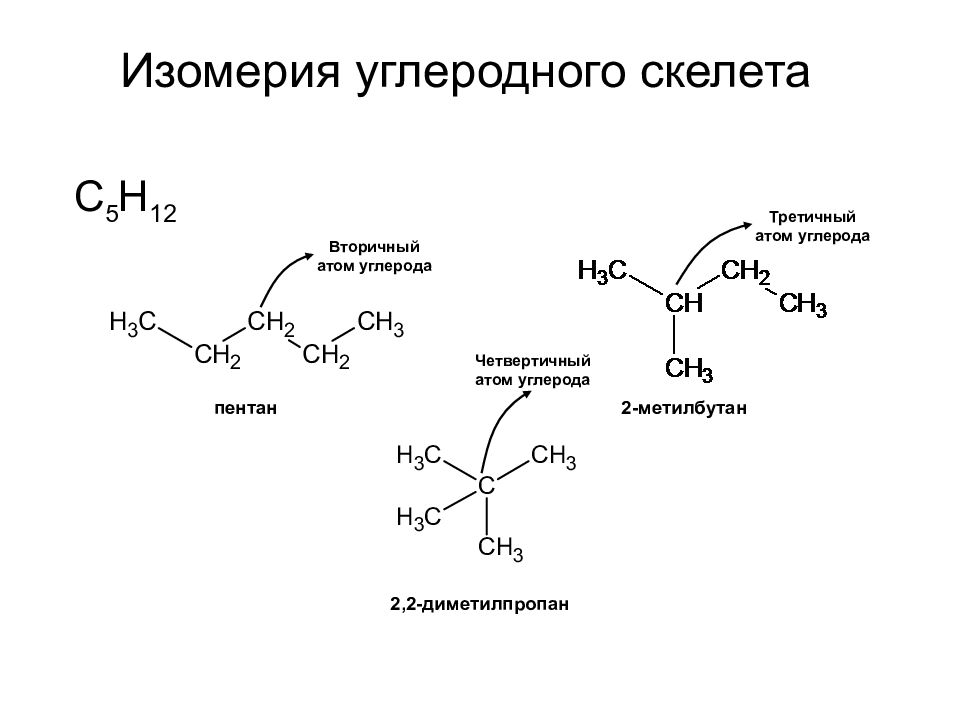
Слайд 26: Изомерия углеродного скелета
С 5 Н 12 Изомерия углеродного скелета пентан 2-метилбутан 2,2-диметилпропан Вторичный атом углерода Третичный атом углерода Четвертичный атом углерода
Слайд 28: Изомерия положения: функциональная группа
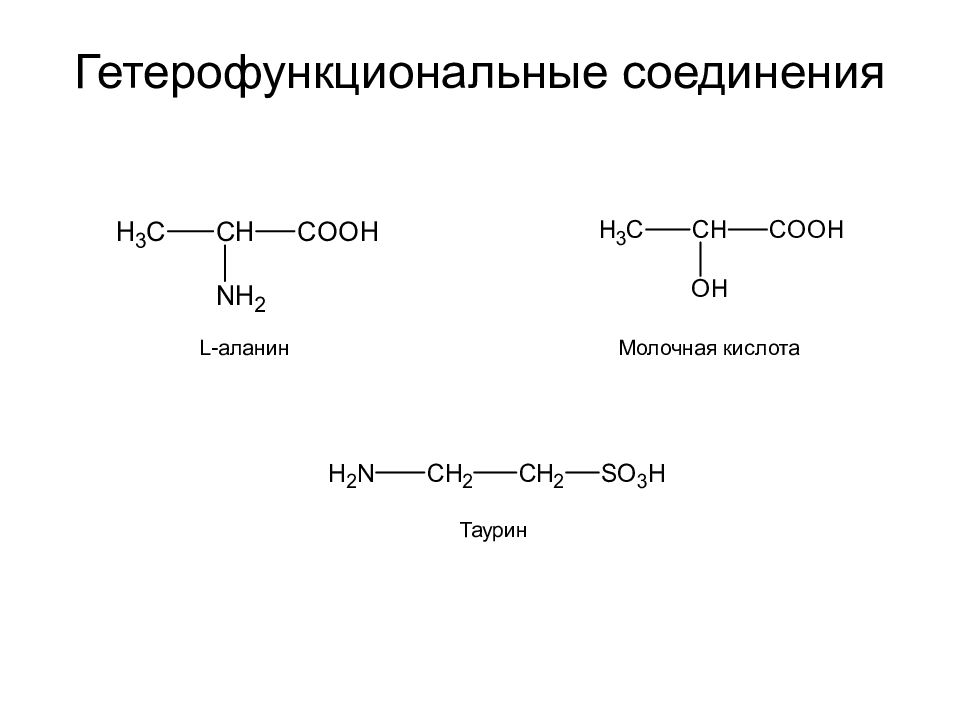
С С С ОН С С С ОН Пропанол 2-Пропанол (изопропиловый спирт) Функциональная группа - атом или группа атомов, определяющие принадлежность соединения к определенному классу и ответственные за его химические свойства.
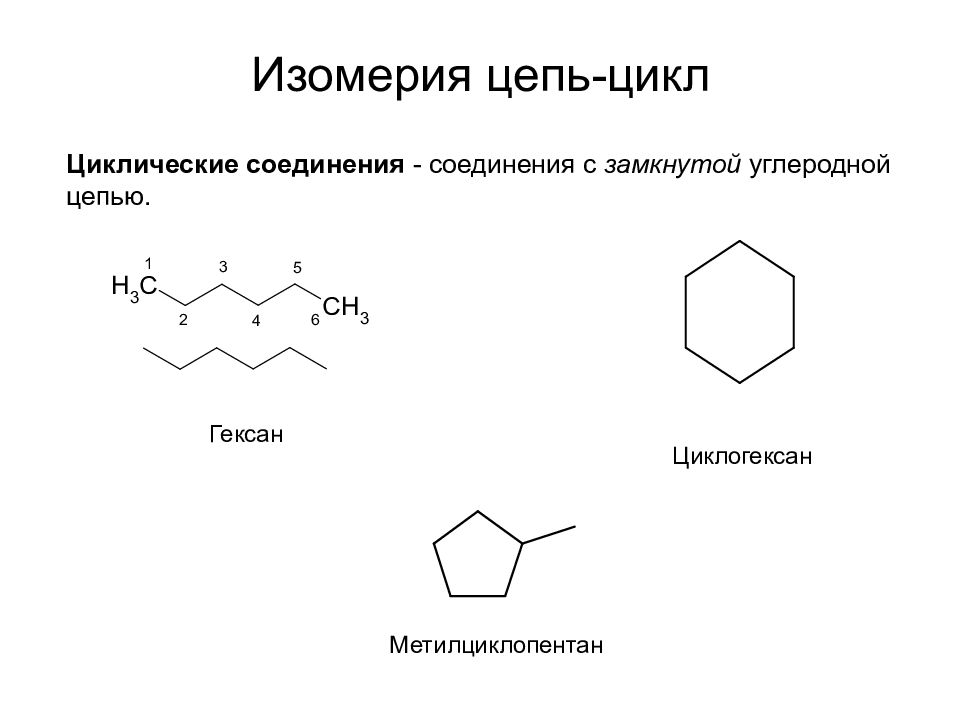
Слайд 29: Изомерия цепь-цикл
Гексан Циклогексан Метилциклопентан Циклические соединения - соединения с замкнутой углеродной цепью.
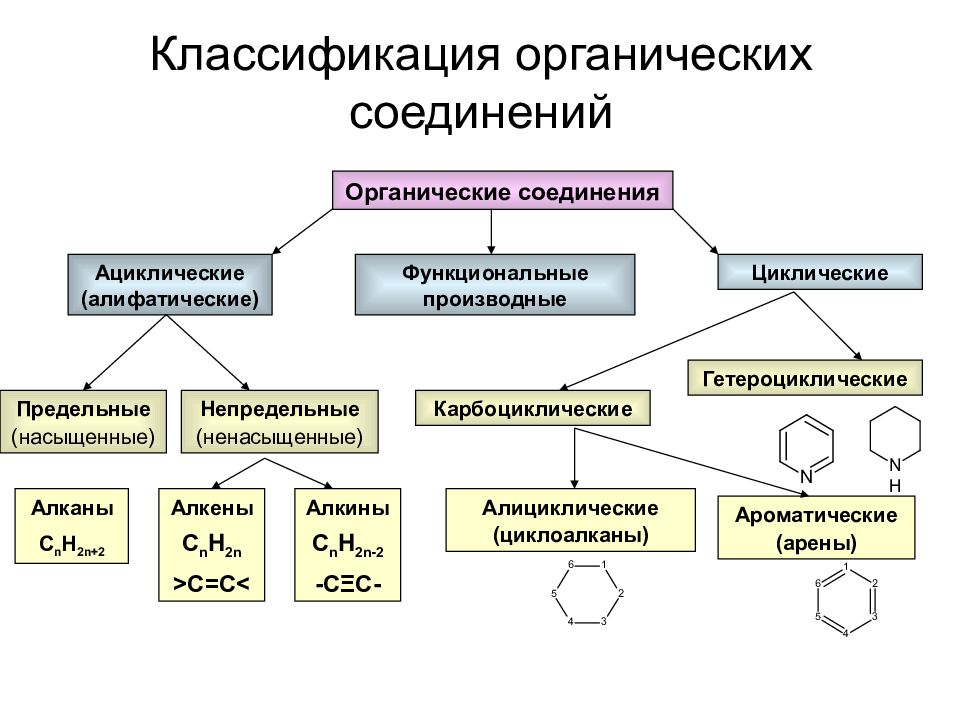
Слайд 30: Классификация органических соединений
Органические соединения Ациклические (алифатические) Циклические Функциональные производные Предельные (насыщенные) Непредельные (ненасыщенные) Карбоциклические Гетероциклические Алканы С n H 2n+2 Алкены С n H 2n > C=C < Алкины С n H 2n-2 -C Ξ C- Алициклические (циклоалканы) Ароматические ( арены)
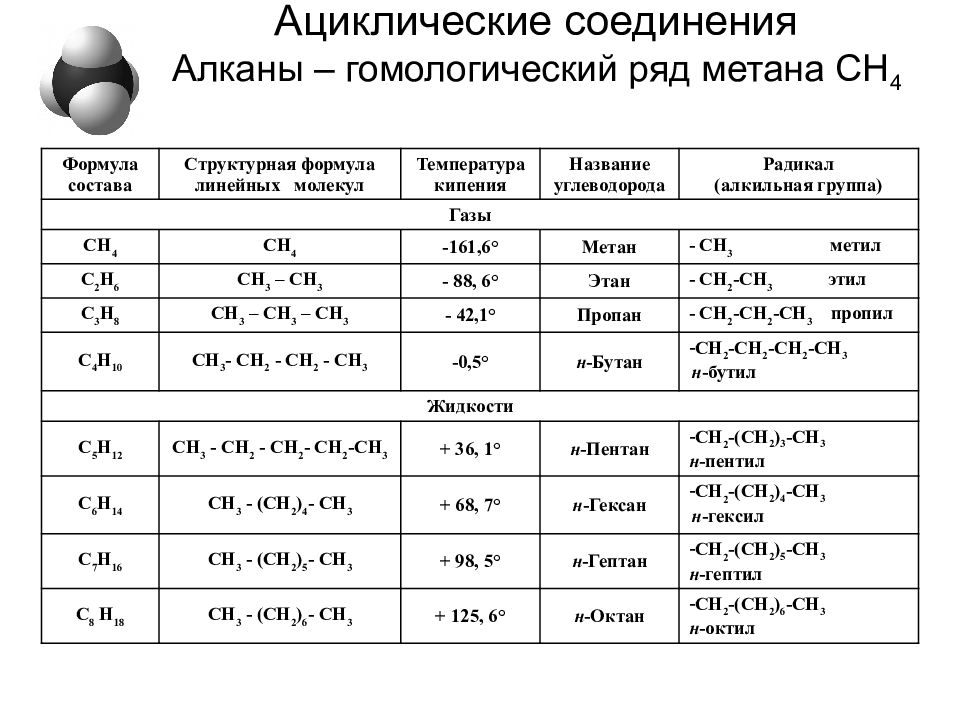
Слайд 31: Ациклические соединения Алканы – гомологический ряд метана СН 4
Формула состава Структурная формула линейных молекул Температура кипения Название углеводорода Радикал (алкильная группа) Газы СН 4 СН 4 -161,6° Метан - СН 3 метил С 2 Н 6 СН 3 – СН 3 - 88, 6° Этан - СН 2 -СН 3 этил С 3 Н 8 СН 3 – СН 3 – СН 3 - 42,1° Пропан - СН 2 -СН 2 -СН 3 пропил С 4 Н 10 СН 3 - СН 2 - СН 2 - СН 3 -0,5° н -Бутан СН 2 -СН 2 -СН 2 -СН 3 н -бутил Жидкости С 5 Н 12 СН 3 - СН 2 - СН 2 - СН 2 -СН 3 + 36, 1° н -Пентан СН 2 -(СН 2 ) 3 -СН 3 н -пентил С 6 Н 14 СН 3 - (СН 2 ) 4 - СН 3 + 68, 7° н -Гексан СН 2 -(СН 2 ) 4 -СН 3 н -гексил С 7 H 16 СН 3 - (СН 2 ) 5 - СН 3 + 98, 5° н -Гептан СН 2 -(СН 2 ) 5 -СН 3 н -гептил C 8 H 18 СН 3 - (СН 2 ) 6 - СН 3 + 125, 6° н -Октан СН 2 -(СН 2 ) 6 -СН 3 н -октил
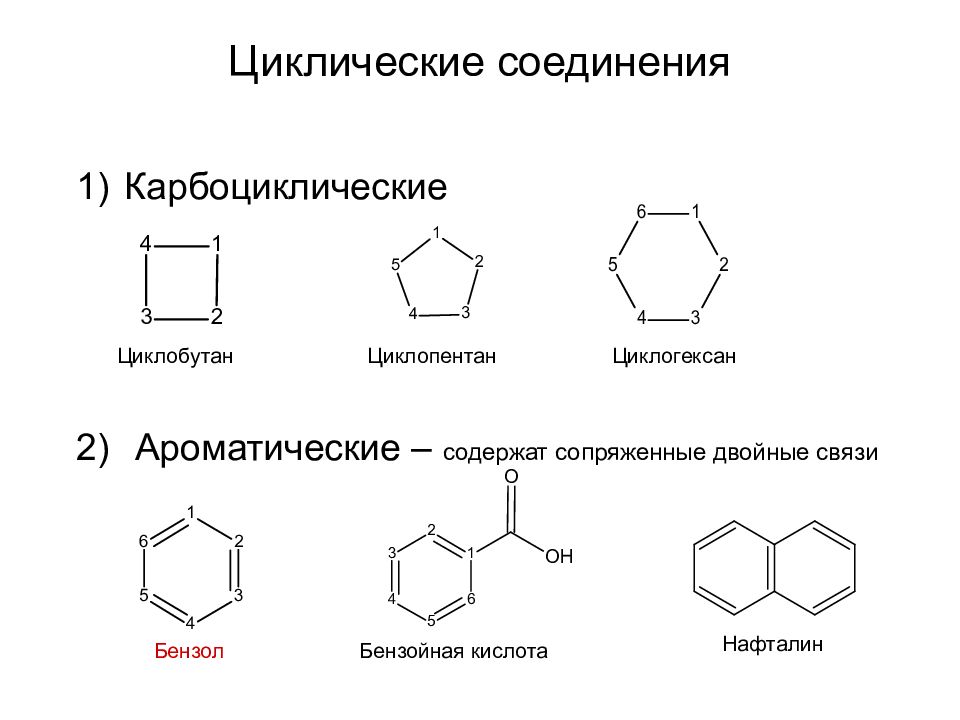
Слайд 32: Циклические соединения
Карбоциклические Ароматические – содержат сопряженные двойные связи Циклобутан Циклопентан Циклогексан Бензол Бензойная кислота Нафталин
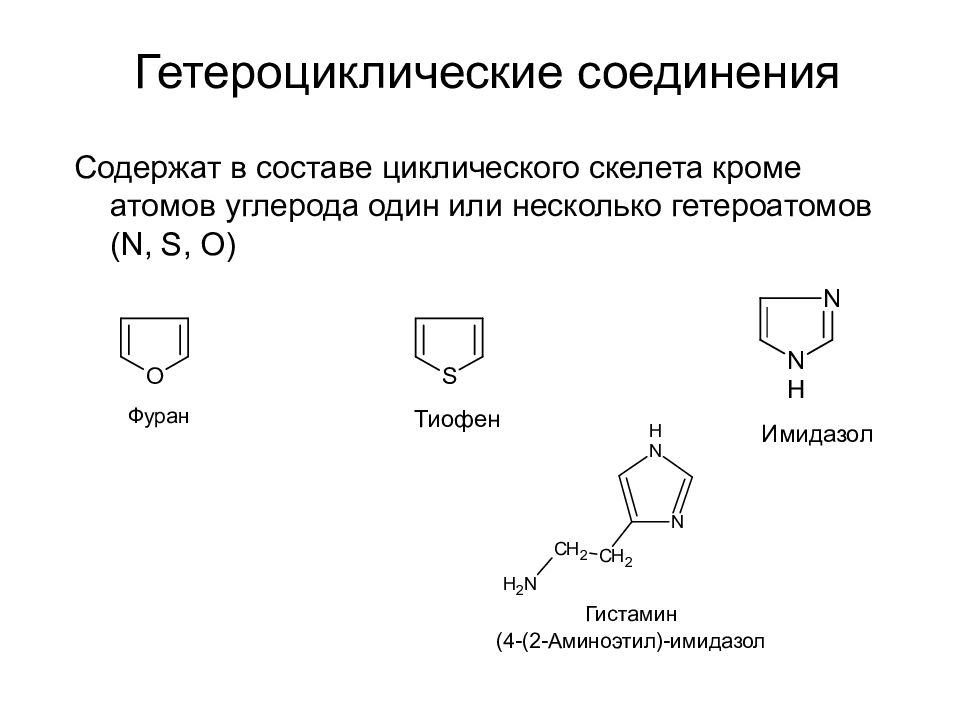
Слайд 33: Гетероциклические соединения
Содержат в составе циклического скелета кроме атомов углерода один или несколько гетероатомов ( N, S, O ) Фуран Тиофен Имидазол Гистамин (4-(2-Аминоэтил)-имидазол
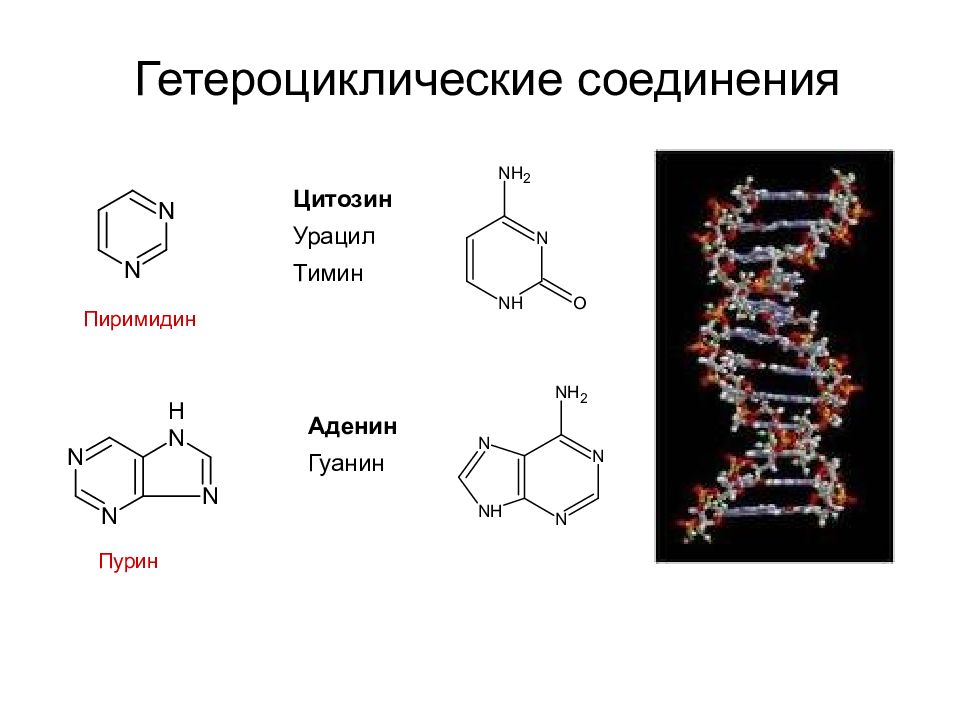
Слайд 34: Гетероциклические соединения
Пурин Пиримидин Цитозин Урацил Тимин Аденин Гуанин
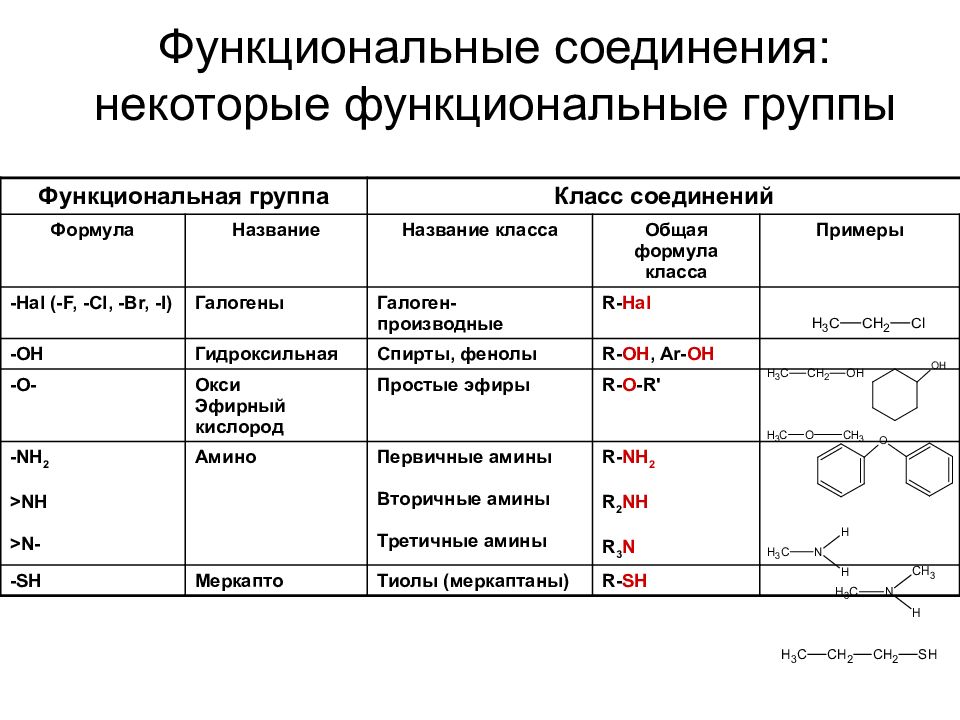
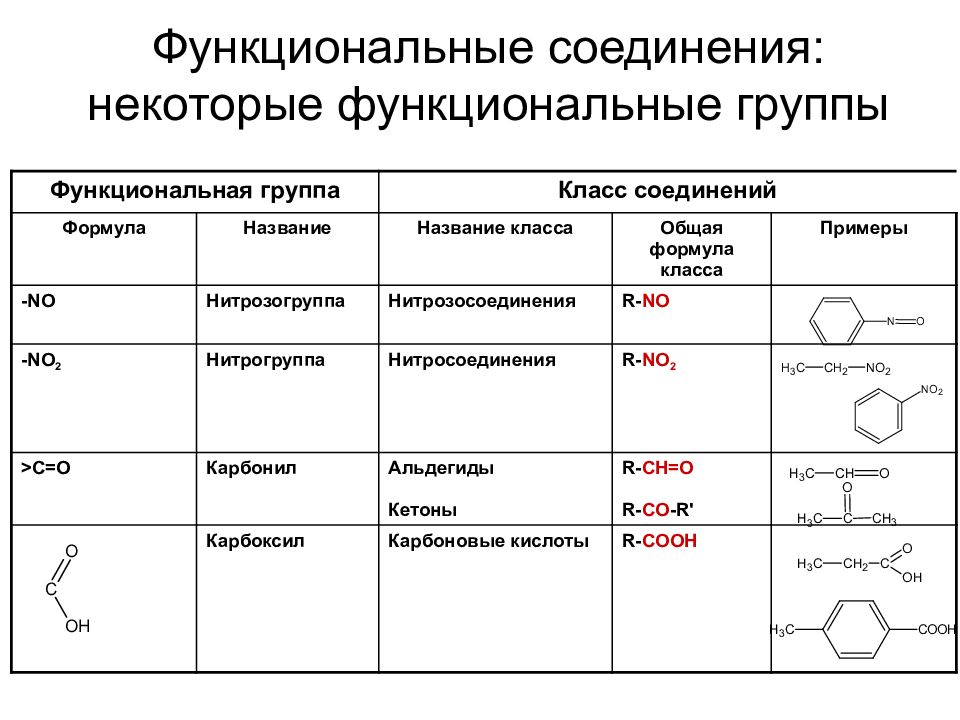
Слайд 35: Функциональные соединения: некоторые функциональные группы
Функциональная группа Класс соединений Формула Название Название класса Общая формула класса Примеры -Hal (-F, -Cl, -Br, -I) Галогены Галоген - производные R- Hal -OH Гидроксильная Спирты, фенолы R- OH, Ar- OH -O- Окси Эфирный кислород Простые эфиры R- O -R' -NH 2 >NH >N- Амино Первичные амины Вторичные амины Третичные амины R- NH 2 R 2 NH R 3 N - SH Меркапто Тиолы (меркаптаны) R- SH
Слайд 36: Функциональные соединения: некоторые функциональные группы
Функциональная группа Класс соединений Формула Название Название класса Общая формула класса Примеры -NO Нитрозогруппа Нитрозосоединения R- NO - NO 2 Нитрогруппа Нитросоединения R- NO 2 > С=О Карбонил Альдегиды Кетоны R- CH=O R- CO -R' Карбоксил Карбоновые кислоты R- COOH
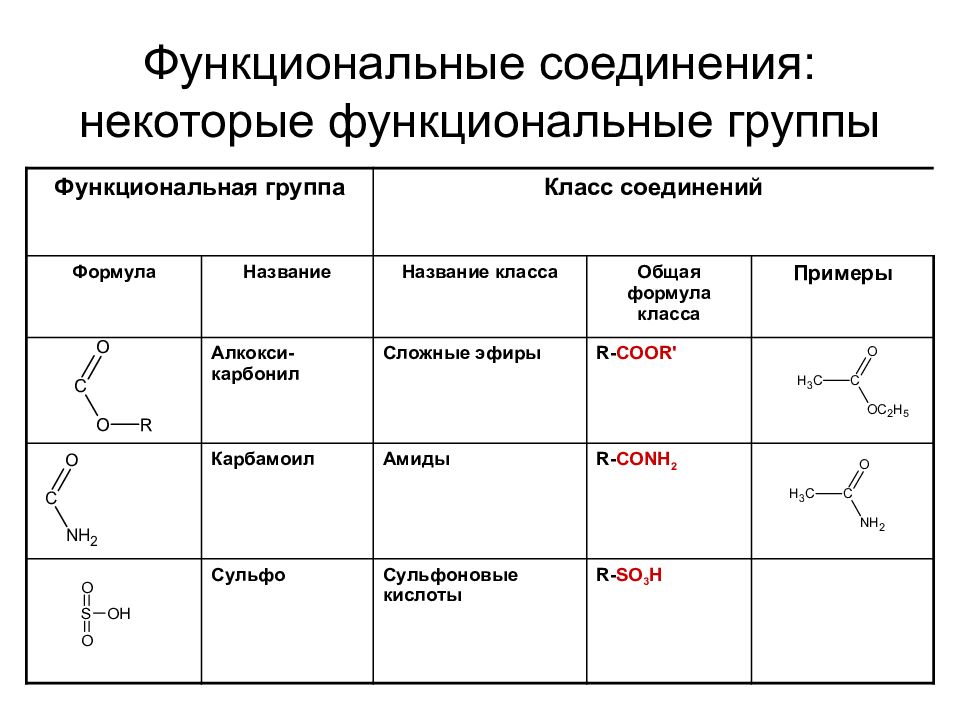
Слайд 37: Функциональные соединения: некоторые функциональные группы
Функциональная группа Класс соединений Формула Название Название класса Общая формула класса Примеры Алкокси - карбонил Сложные эфиры R- COOR' Карбамоил Амиды R- CONH 2 Сульфо Сульфоновые кислоты R- SO 3 H
Слайд 39: Номенклатура органических соединений
Номенклатура – это система терминов, обозначающих строение веществ и пространственное расположение атомов в их молекулах Рациональная : сложное вещество рассматривается как производное более простого, получаемого путем замены водорода на другие атомы или атомные группы Заместительная ( IUPAC *, женевская ) : название соединения строится как сложное слово, состоящее из корня (родоначальное название), префиксов и суффикса, характеризующих число и характер заместителей, степень насыщенности; при необходимости указываются локанты * International Union of Pure and Applied Chemistry, Женева 1892 г.
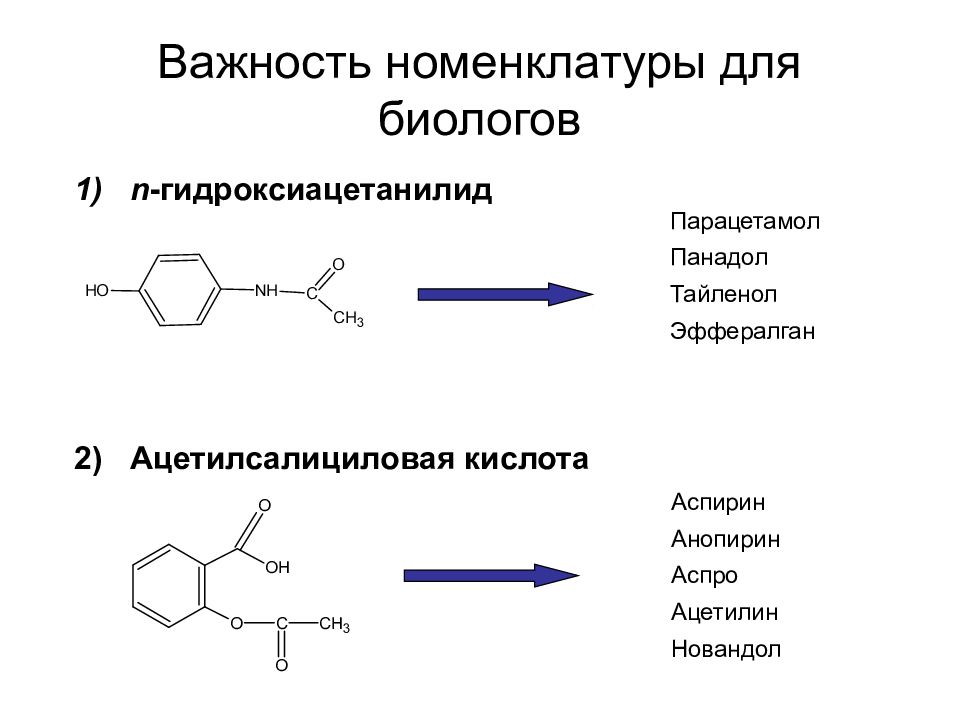
Слайд 40: Важность номенклатуры для биологов
n - гидроксиацетанилид Ацетилсалициловая кислота Парацетамол Панадол Тайленол Эффералган Аспирин Анопирин Аспро Ацетилин Новандол
Слайд 41: Аналитические методы
Элементный анализ: определение брутто-формулы Методы аналитической химии: определение функциональных групп ИК-спектроскопия: определение функциональных групп УФ-спектроскопия: характеристика конъюгированных π -систем Электронная спектроскопия: определение ароматических групп, кратных связей, исследование таутомерии Масс-спектроскопия: определение молекулярного веса вещества, определение функциональных групп Ядерный магнитный резонанс (ЯМР): исследование формы углеродного скелета молекулы, определение положения атомов C, H, F, P. Изучение пространственного строения молекул, их динамики Рентгеноструктурный анализ: характеристика взаимного расположения центров атомов и углов между связями
Слайд 42: Литература
В.Л. Белобородов, С.Э. Зурабян, А.П. Лузин, Н.А. Тюкавкина Органическая химия: учеб. для вузов. В 2 кн. М.: Дрофа, 2008 В.Л. Флорентьев Геном человека. Органическая химия (часть 1) 1990 3) Дж. Робертс, М. Касерио Основы органической химии М.: Мир, 1978 4) А. Терней Современная органическая химия В 2 кн. М.: Мир, 1981 5) М.А. Юровская, А.В. Куркин Основы органической химии М.: БИНОМ. Лаборатория знаний, 2010 6) И.И. Грандберг Органическая химия М.: Дрофа, 2001 7) Ф. Кери, Р. Сандберг Углубленный курс органической химии. В 2 кн. М.: Химия, 1981