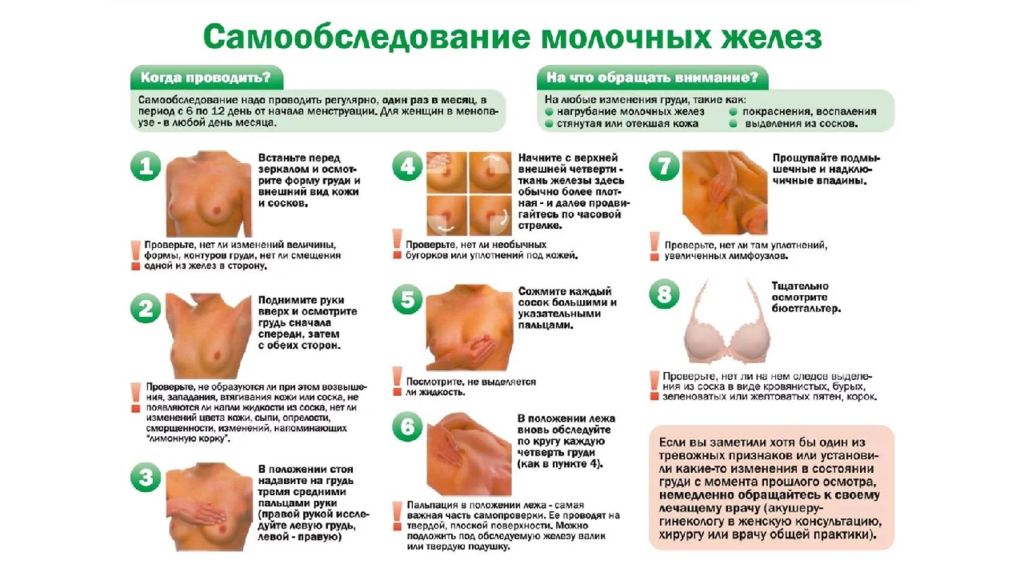
Первый слайд презентации: Рак молочной железы
– злокачественная опухоль, исходящая из эпителия ткани молочной железы.
Слайд 2: Этиология и эпидемиология
У 3-10% больных РМЖ развитие заболевания связано с наличием мутаций в генах BRCA1, BRCA2, CHEK, NBS1, tP53. У остальных пациентов РМЖ имеет спорадический характер. В структуре смертности женского населения РМЖ находится на первом месте, составляя 17,0%.
Слайд 3: Международная гистологическая классификация (2012)
Эпителиальные опухоли Инвазивный рак молочной железы Эпителиально-миоэпителиальный опухоли Предраковые очаги Внутрипротоковые пролиферативные очаги Папиллярные очаги Доброкачественная эпителиальная пролиферация
Слайд 4: Международная гистологическая классификация (2012 ). Продолжение
Фиброэпителиальные опухоли Опухоли соска Злокачественная лимфома Метастатические опухоли (лечение зависит от локализации первичной опухоли) Опухоли грудной железы у мужчин (лечение аналогично таковому у женщин)
Слайд 6: Стадирование по системе TNM
Т – первичная опухоль; N – регионарные лимфатические узлы; М – отдаленные метастазы.
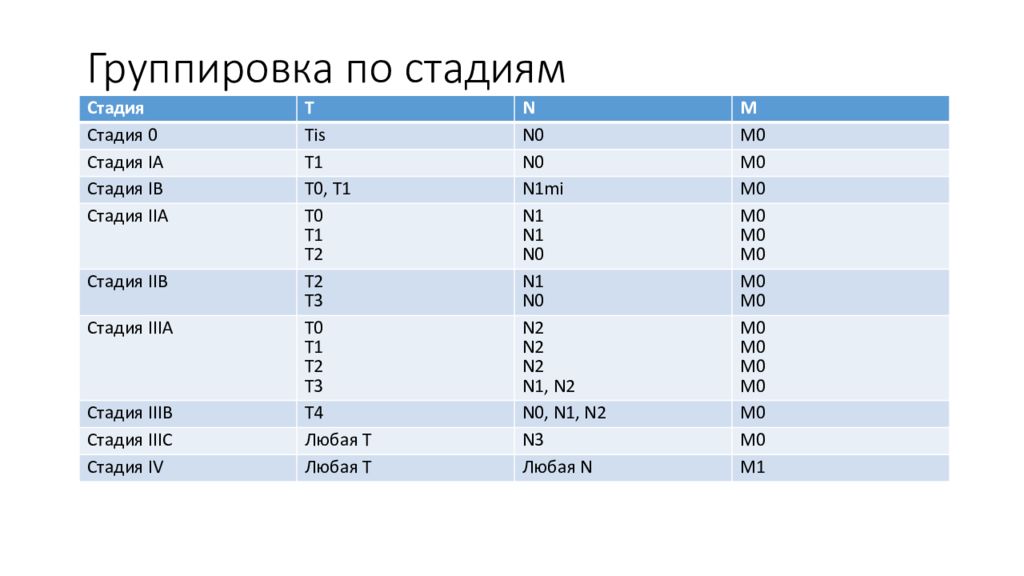
Слайд 7: Группировка по стадиям
Стадия T N M C тадия 0 Tis N0 M0 Стадия I А T1 N0 M0 Стадия I В Т0, Т 1 N1mi M0 Стадия II А T0 T1 T2 N1 N1 N0 M0 M0 M0 Стадия II В T2 T3 N1 N0 M0 M0 Стадия III А T0 T 1 T2 T3 N 2 N 2 N 2 N 1, N 2 M0 M0 M0 M0 C тадия III В Т4 N0, N 1, N 2 M0 C тадия III С Любая Т N3 M0 Стадия IV Любая Т Любая N M1
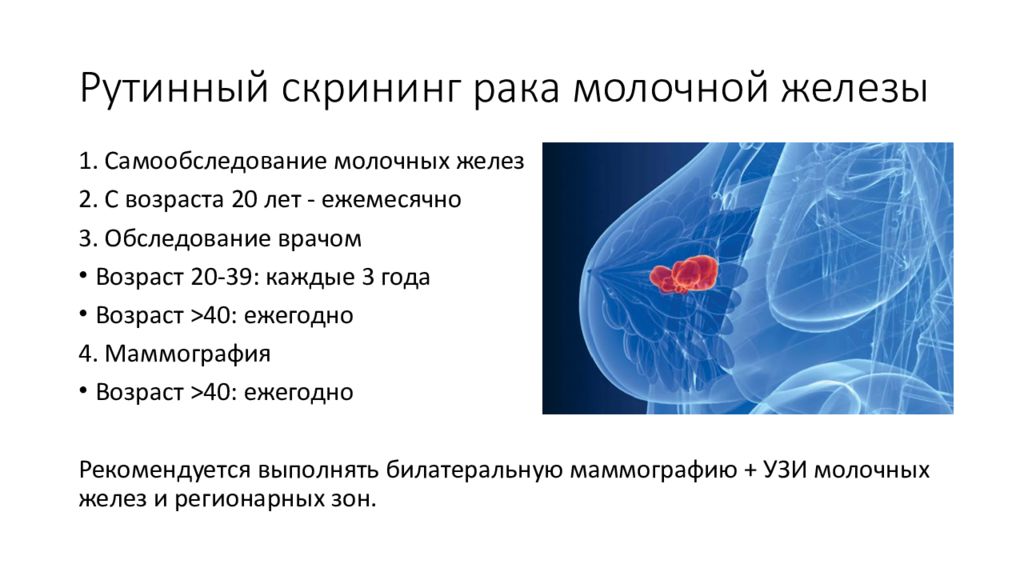
Слайд 9: Р утинный скрининг рака молочной железы
1. Самообследование молочных желез 2. С возраста 20 лет - ежемесячно 3. Обследование врачом Возраст 20-39: каждые 3 года Возраст >40: ежегодно 4. Маммография Возраст >40: ежегодно Рекомендуется выполнять билатеральную маммографию + УЗИ молочных желез и регионарных зон.
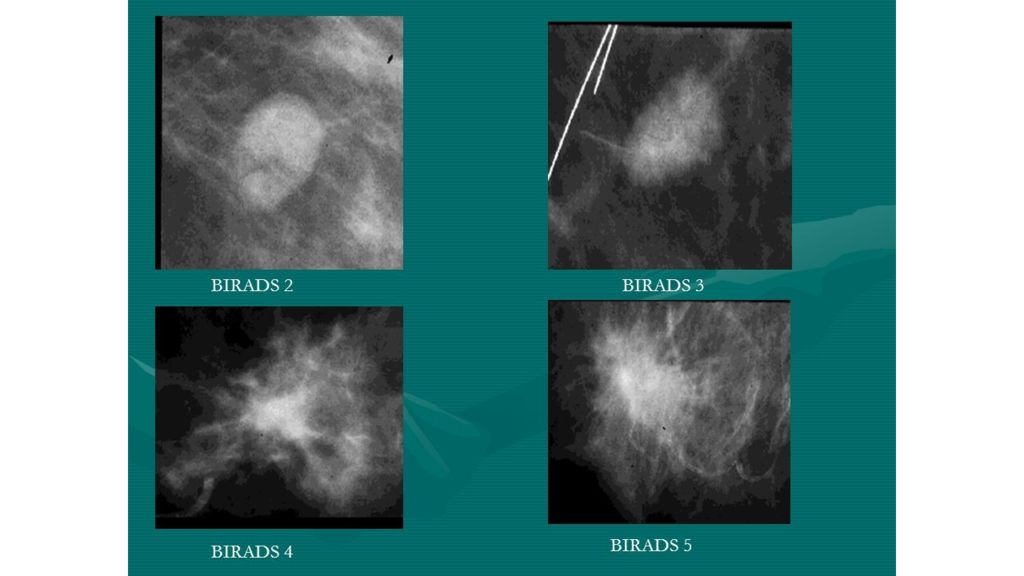
Слайд 10: Классификация BIRADS
Аббревиа тура BIRADS в переводе означает « система интерпретации и протоколирования визуализации молочных желез », является широко распространенным инструментом оценки рисков и обеспечения качества и стандартизации описания маммографии, УЗИ или МРТ. Прогноз риск рака молочной железы: BIRADS III: ~2% BIRADS IV: ~30% BIRADS V: 95%
Слайд 11: Классификация BIRADS
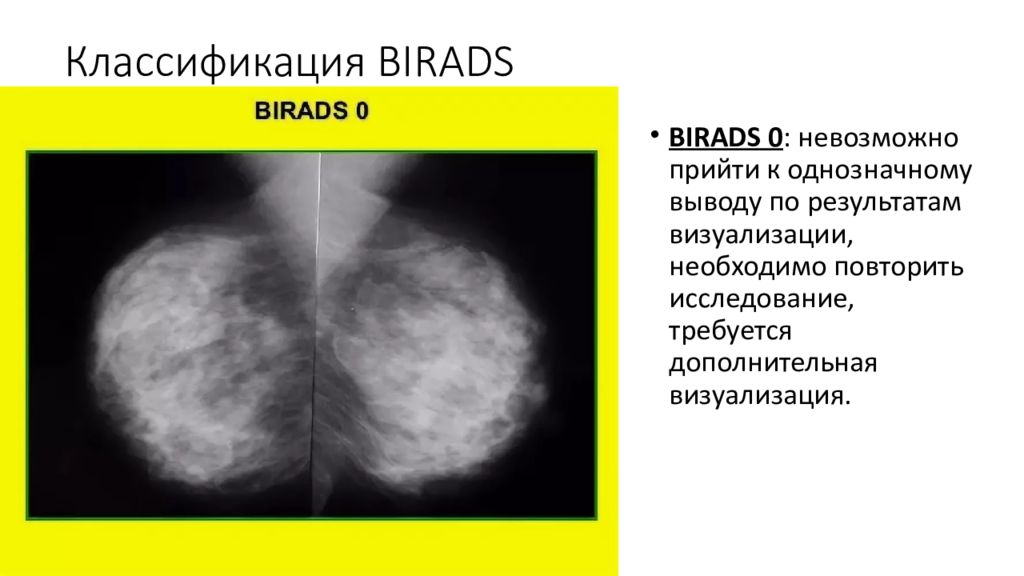
BIRADS 0 : невозможно прийти к однозначному выводу по результатам визуализации, необходимо повторить исследование, требуется дополнительная визуализация.
Слайд 12
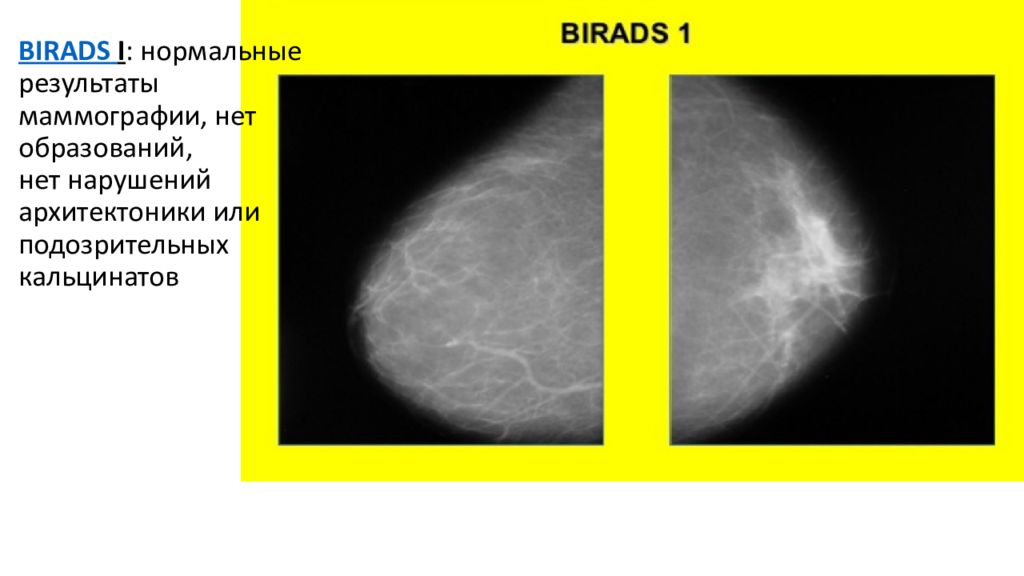
BIRADS I : нормальные результаты маммографии, нет образований, нет нарушений архитектоники или подозрительных кальцинатов
Слайд 13
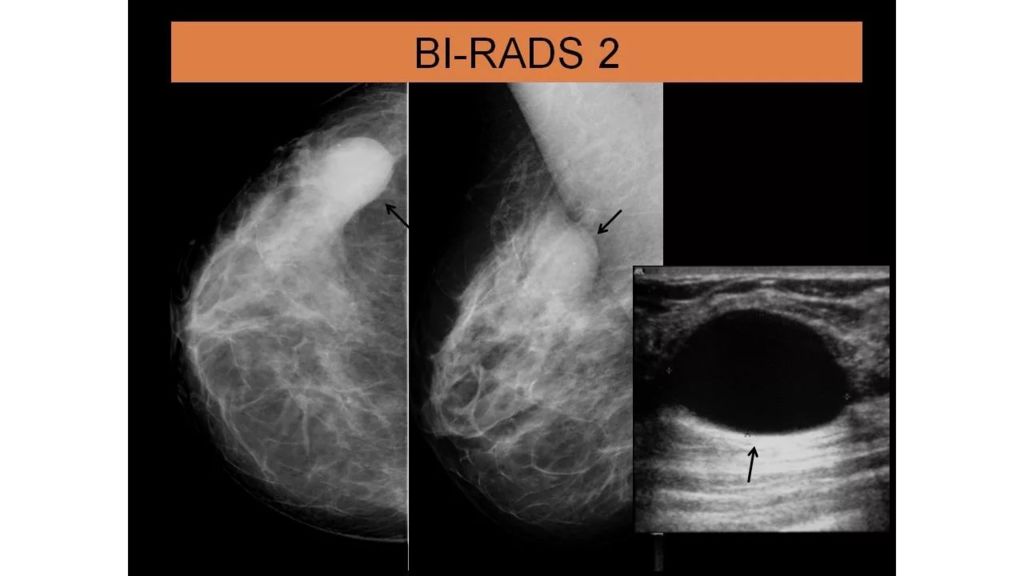
BIRADS II : доброкачественные изменения: кальцинированные фиброаденомы множественные секреторные кальцификаты жиросодеражащие образования: масляная киста липоматоз молочной железы фиброаденолипома или гамартома смешанной плотности галактоцелле простые кисты молочной железы все вышеперечисленные находки должны иметь характерные данные визуализации, а следовательно могут быть указанны с уверенностью; диагност может описать внутригрудные лимфатические узлы, имплантаты и т. д., при этом в заключении необходимо указать, что нет маммографических данных, указывающих на злокачественность
Слайд 15
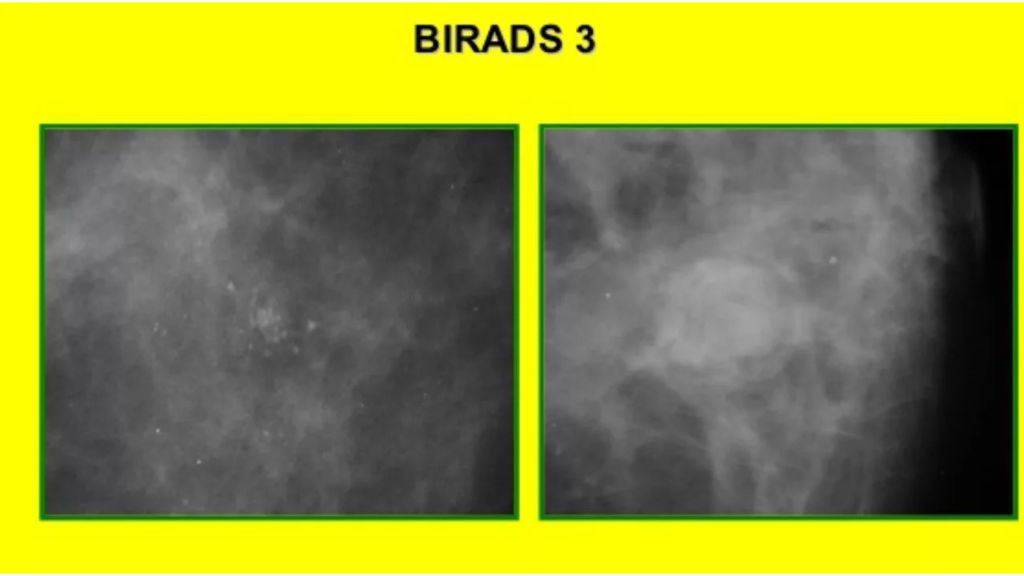
BIRADS III : наиболее вероятно доброкачественное образование до 98% за то, что есть доброкачественный процесс контрольная визуализации через 3-6 месяцев, после которой пациентка должна перейти во 2 или 4 группу по BIRADS. В 3 категории пациенты могут находиться не более 6 месяцев.
Слайд 17
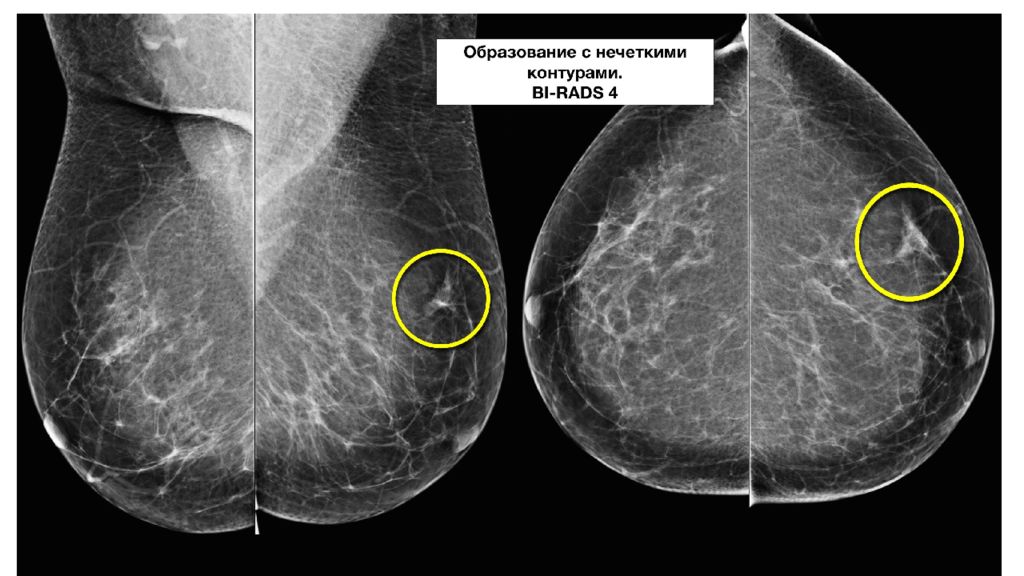
BIRADS IV : образование подозрительное на злокачественный процесс. Тактика ведения пациенток при 4 категории: показана морфологическая верификация диагноза путем выполнения биопсии. 4A. Низкая вероятность злокачественности. После отрицательных или сомнительных результатов биопсии рекомендуется повторное исследование через 3-6 месяцев. 4B. Средняя вероятность злокачественности. При получении сомнительных или доброкачественных результатов биопсии решение о кратности наблюдения принимают индивидуально. 4C. Высокая вероятность злокачественности. При получении сомнительных или доброкачественных результатов биопсии решение о кратности наблюдения принимают индивидуально.
Слайд 19
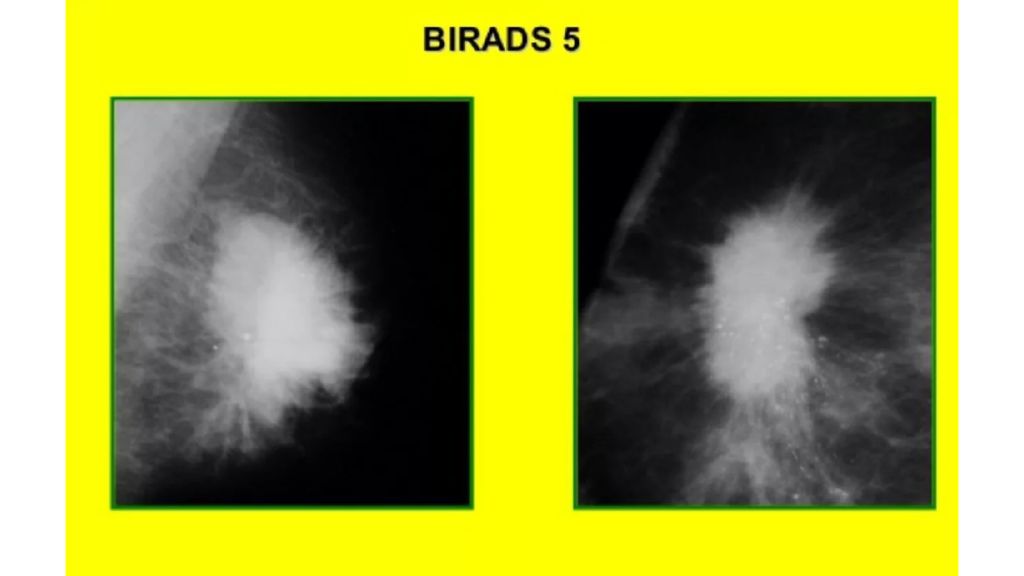
BIRADS V : все признаки указывают на наличие рака молочной железы. Тактика при 5 категории: должны быть приняты соответствующие меры, показана морфологическая верификация диагноза для определения гистологических и иммуногистологических особенностей опухоли. При получении доброкачественных или сомнительных результатов биопсии, образование относят к категории 4. BIRADS VI : под эту категорию попадают пациентки с уже верифицированным диагнозом злокачественного процесса молочной железы
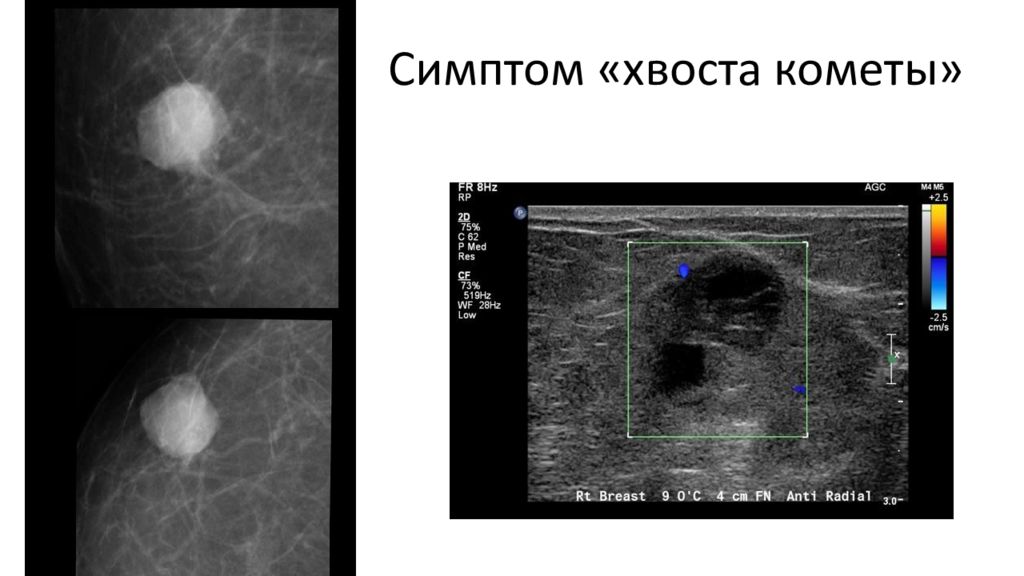
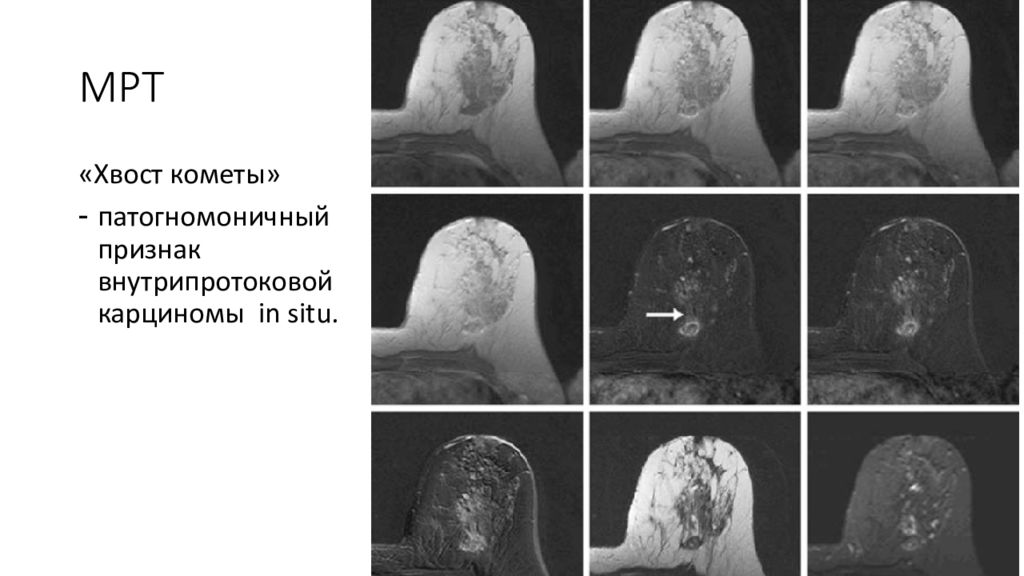
Слайд 23: МРТ
«Хвост кометы» патогномоничный признак внутрипротоковой карциномы in situ.
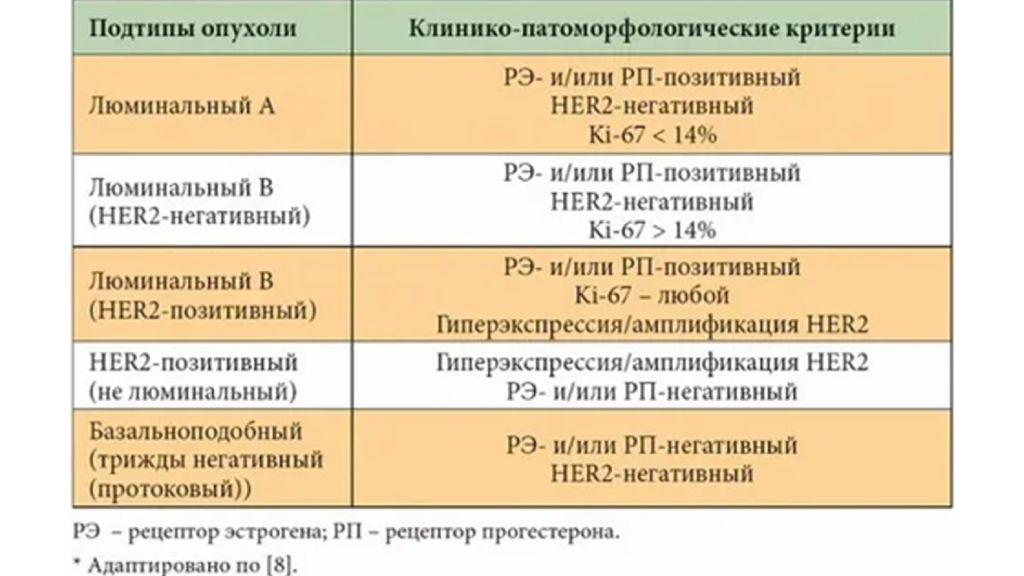
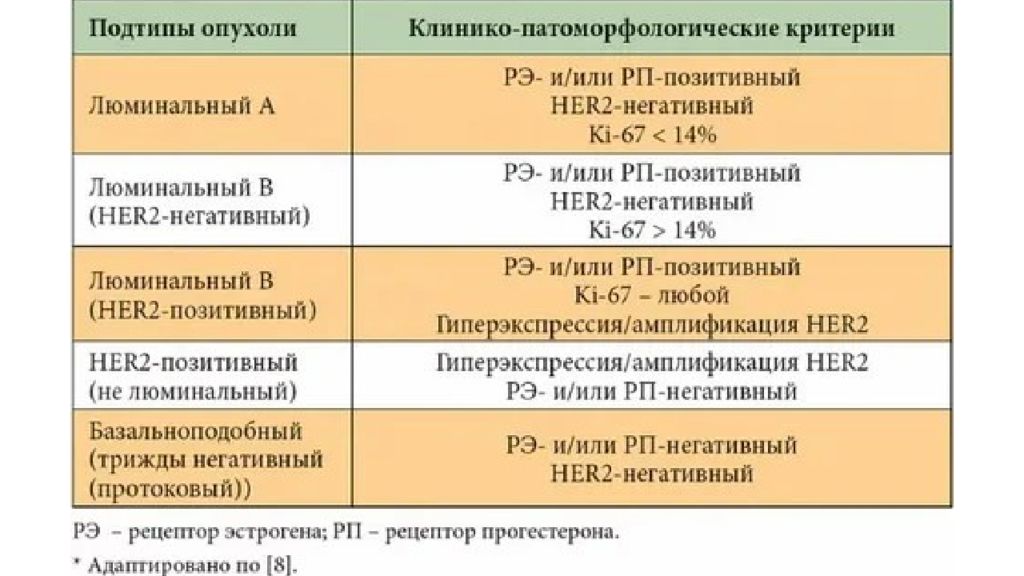
Слайд 24: Люминальный рак молочной железы
— гормонозависимый вид, представленный тремя разными подтипами. По новой лечебно-профилактической классификации такой вариант заболевания называют «гормон-рецептор-позитивный», и подтипы уже не «А» и «В», а с прибавкой « HER2-негативный» и « HER2-позитивный» к основному названию. « позитивный по гормональному статусу»
Слайд 25
Люминальный тип карциномы развивается вследствие гормональной разбалансировки. Вне зависимости от гормонального фона все женщины старше 39 лет считаются группой риска и каждые 24 месяца нуждаются в маммологическом обследовании. Высока вероятность развития РМЖ у женщин из семей, где уже были карциномы органов репродуктивной системы и толстой кишки, поэтому им необходимо пройти генетическое обследование на гены BRCA. Клинические проявления люминального рака ничем не отличаются от симптомов, сопровождающих другие биологические типы РМЖ: такие же внешние признаки опухоли, те же лимфатические коллекторы и зоны метастазирования.
Слайд 26: Люминальный тип А рака молочной железы
Главная особенность — в высокой чувствительности рака к гормональным препаратам, потому что в наличии оба вида гормональных рецепторов и нет гена лекарственной устойчивости HER2, позволяющего клеткам не реагировать на лекарства или быстро формировать защиту от них. Высокий уровень прогестиновых рецепторов — больше 20% обещает хороший результат лечения, если сочетается со значительной концентрацией эстрогенных рецепторов. На хороший прогноз при люминальной А форме влияет распространенность карциномы на начало лечения и возможность хирургического лечения. После радикальной операции такой молекулярный вид рака подлежит исключительно гормональной терапии: менструирующая женщина получает тамоксифен ; при противопоказаниях к тамоксифену молодая женщина должна пройти кастрацию, по выбору хирургическую, лучевую или лекарственную, чтобы начать прием ингибитора ароматазы ; пережившие менопаузу пациенты лечатся ингибитором ароматазы.
Слайд 27: Люминальный тип В рака молочной железы
Эта форма карциномы отличается от подтипа А наличием двух вариантов — с геном НЕR2 и без него. Клетки отрицательные по HER2 могут иметь высокий уровень Ki67 или мало ПР, что в любом случае неблагоприятно, поэтому при любой стадии прооперированной пациентке с таким генотипом перед профилактическим гормональным лечением будет обязательно предложена химиотерапия, если новообразования больше полсантиметра. При наличии в клетках гена HER2 уже не важно, сколько в них Ki67 и ПР, прогностически это неблагоприятный в сравнении с двумя другими люминальными вариантами процесс.
Слайд 29: Ген brca 1
Ген BRCA1 ( Gen breast cancer 1, в переводе с английского ген рака молочной железы 1) расположен на длинном плече 17-ой хромосомы (17q21.31) и кодирует синтез белка, играющего ключевую роль в процессе репарации (восстановления) ДНК после повреждений, регуляции клеточного деления и поддержания стабильности генома. Описано более 500 мутаций гена, которые наследуются аутосомно-доминантно с неполной пенетрантностью и ассоциированы с высоким риском развития рака молочной железы и/или яичников у женщин и рака грудной или предстательной железы у мужчин. У носительниц мутаций в гене BRCA1 риск рака молочной железы составляет 50-85%, рака яичников — 15-45%. Кроме того, мутации в этом гене ассоциированы с повышенным риском развития некоторых форм рака желудочно-кишечного тракта (рак поджелудочной железы) и других форм злокачественных образований. Одной из наиболее частых мутаций в гене BRCA1 среди жителей России является инсерция цитозина (5382insC), приводящая к сдвигу рамки считывания и образованию укороченного белка BRCA1, который не может выполнять полноценно свою функцию.
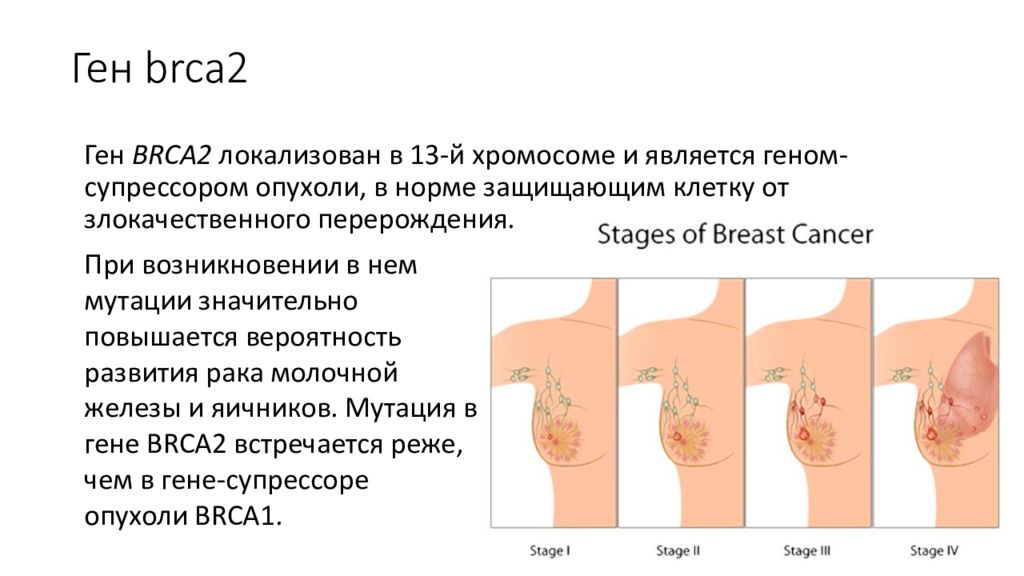
Слайд 30: Ген brca 2
Ген BRCA2 локализован в 13-й хромосоме и является геном- супрессором опухоли, в норме защищающим клетку от злокачественного перерождения. При возникновении в нем мутации значительно повышается вероятность развития рака молочной железы и яичников. Мутация в гене BRCA2 встречается реже, чем в гене- супрессоре опухоли BRCA1.
Слайд 31: Кому рекомендовано генетическое тестирование?
Генетическое тестирование рекомендуется в следующих случаях: – при отягощенном наследственном анамнезе – наличии РМЖ у 2 и более близких родственников; – у женщин моложе 50 лет, страдающих РМЖ; – при первично-множественном РМЖ; – при тройном негативном фенотипе опухоли; – при РМЖ у мужчин
Слайд 32
Мама и бабушка Анджелины Джоли скончались от рака молочной железы. Первой было 56 лет, второй – 40. В 2013 году Джоли перенесла двойную мастэктомию, а позже удалила яичники и фаллопиевы трубы. «…я несу в себе «бракованный» ген BRCA, который существенно увеличивает риск появления у меня рака груди и яичника. … Когда я узнала, что меня может ждать, я решила действовать на упреждение и по мере возможности свести риск к минимуму. Я начала с груди, поскольку риск появления рака груди у меня гораздо выше, чем риск заболевания раком яичника, и потому что эта операция более сложная.»
Слайд 33: Заподозрить семейную форму рака можно при:
наличии двух или более родственниц, имеющих рак молочной железы; выявлении рака молочной железы в возрасте до 35 лет; наличии двустороннего или мультифокального рака молочной железы; раке яичников; наличии даже одного родственника с раком яичников или раком молочной железы, который был диагностирован до 40-летнего возраста; раке грудной железы у родственника-мужчины; раке молочной железы у матери, сестры или дочери; если у многих поколений в семье был рак молочной железы или яичников; наличии родственницы, страдающей раком молочной железы в относительно молодом возрасте (моложе 50 лет); наличии родственницы, страдающей раком обеих молочных желез.
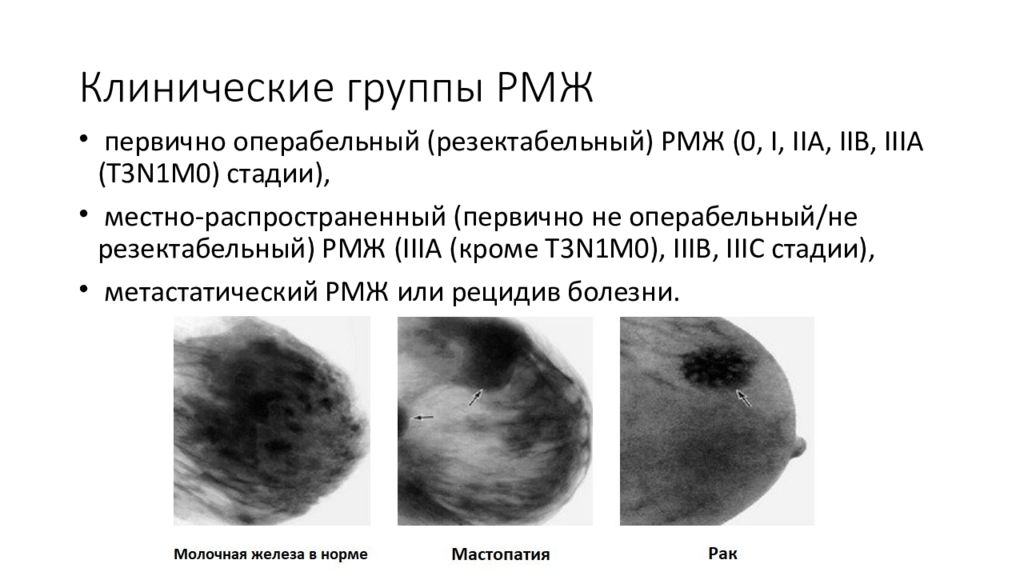
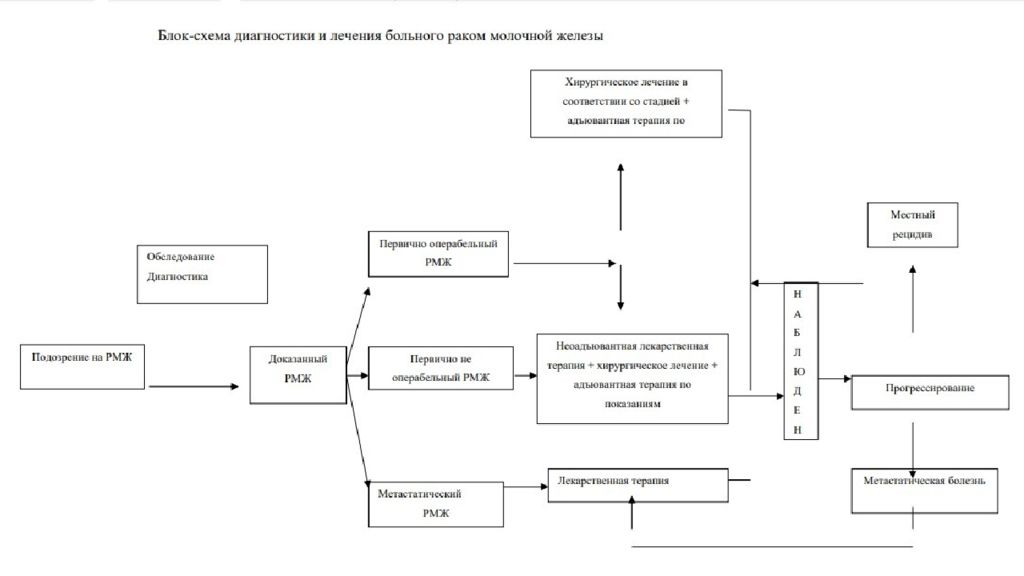
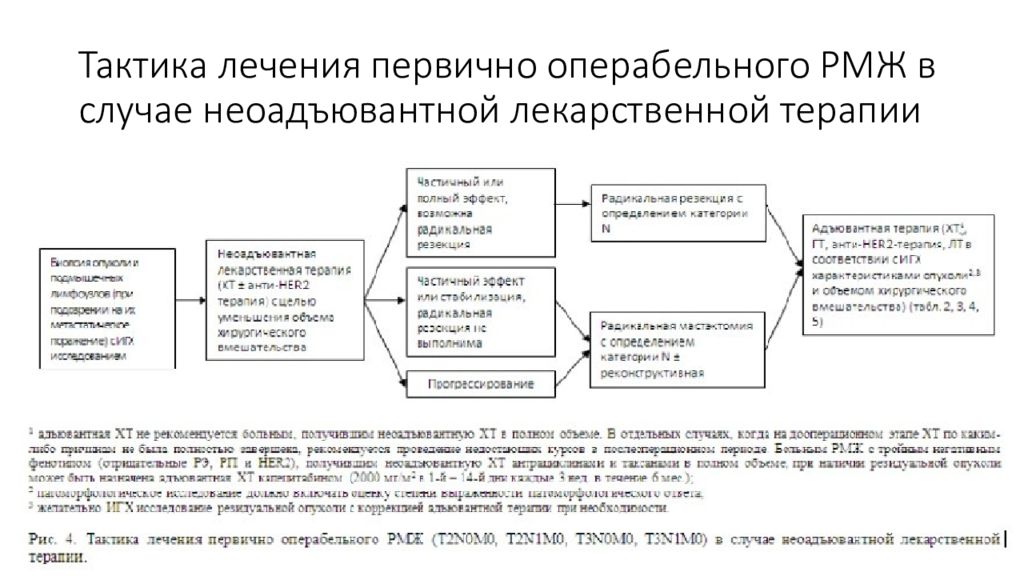
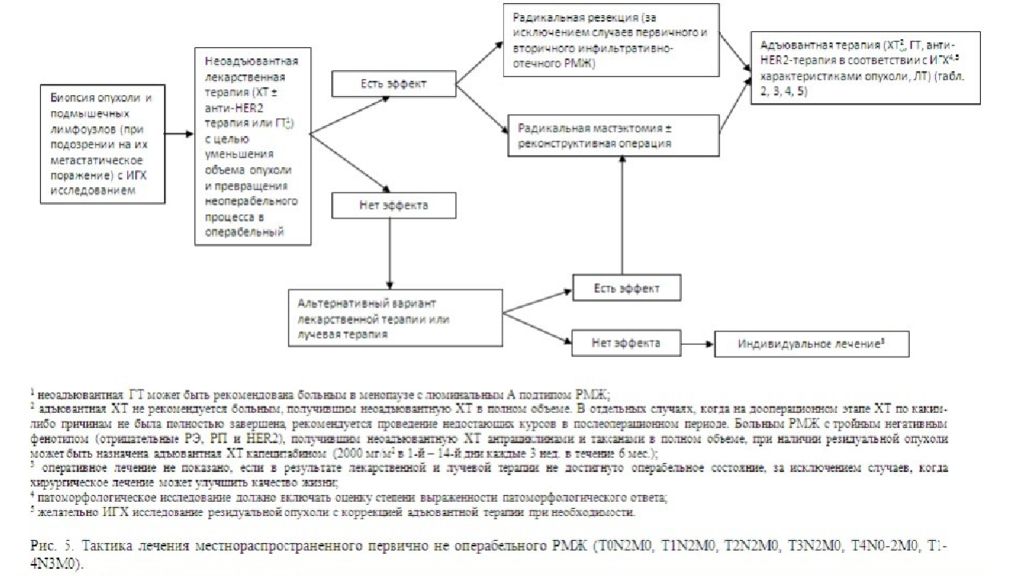
Слайд 34: Клинические группы РМЖ
первично операбельный ( резектабельный ) РМЖ (0, I, IIA, IIB, IIIA (T3N1M0) стадии ), местно-распространенный (первично не операбельный/не резектабельный ) РМЖ (IIIA (кроме T3N1M0), IIIВ, IIIС стадии), метастатический РМЖ или рецидив болезни.
Слайд 35: Лечение
Локализованные стадии I, II, IIIa Отсутствие отдаленных метастазов, возможность проведения локального лечения на первом этапе Подход к лечению – комплексный с обязательным включением локальной терапии Цель терапии – излечение или достижение значительного времени без проявлений болезни Прогноз – зависит от размеров первичной опухоли, поражения лимфатических узлов и биологических характеристик опухоли
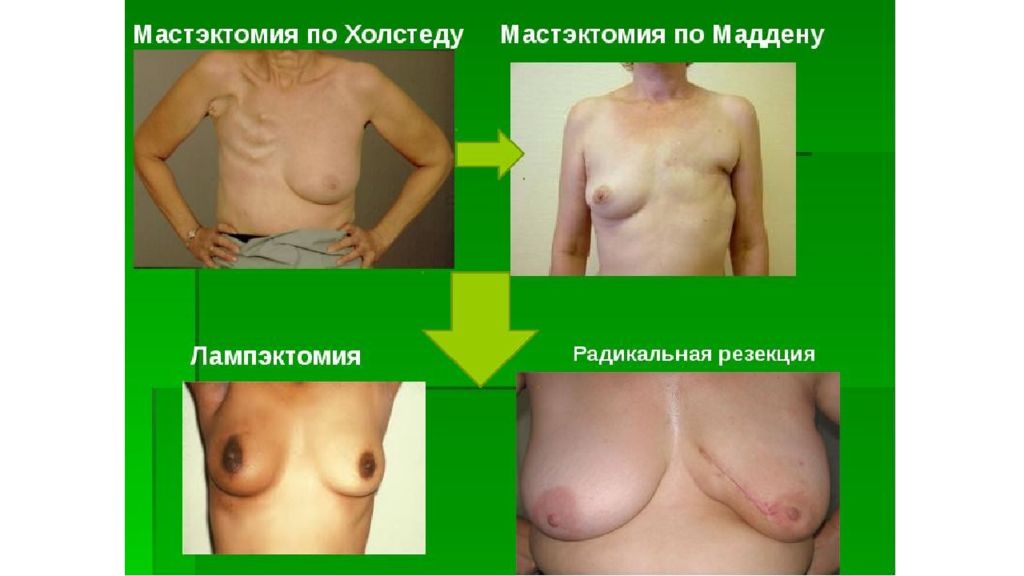
Слайд 36
Основа лечения - локальная терапия Радикальная операция – удаление первичной опухоли и регионарных лимфатических узлов Радикальная мастэктомия (полное удаление молочной железы, несущей опухоль) По Холстеду – с большой и малой грудной мышцами По Пейти – с малой грудной мышцей По Маддену – без грудных мышц Органосохраняющие операции Радикальная резекция – удаление части молочной железы, несущей опухоль Лампэктомия – удаление опухоли с небольшим отступом в окружающие ткани (обычно, менее 1 см)
Слайд 38: Адъювантная терапия
– терапия, проводимая дополнительно к радикальному локальному лечению, с целью эрадикации (уничтожения) или торможения роста микрометастазов Лучевая – профилактика местных рецидивов (возврат опухоли в послеоперационной зоне) Лекарственная (системная) – подавление отдаленных микрометастазов и профилактика местных рецидивов
Слайд 39: Ключевые моменты при выборе тактики адъювантного лечения
Клинико-морфологические Размер опухоли Степень злокачественности Количество пораженных лимфоузлов Гистологический подтип Молекулярно-биологические Наличие рецепторов эстрогенов и/или прогестерона в опухоли HER-2 статус Ki-67 Генетические
Слайд 40: Химиотерапия
Адьювантно используется практически у всех больных ранним РМЖ (за исключением очень маленьких опухолей <0,5-1 см) Абсолютная величина выигрыша зависит от характеристик опухоли (чем хуже прогноз – тем больше выигрыш от химиотерапии) Более токсична и менее специфична, чем другие виды терапии Длительность адьювантной химиотерапии ~ 5-6 месяцев (4 – 6 циклов лечения)
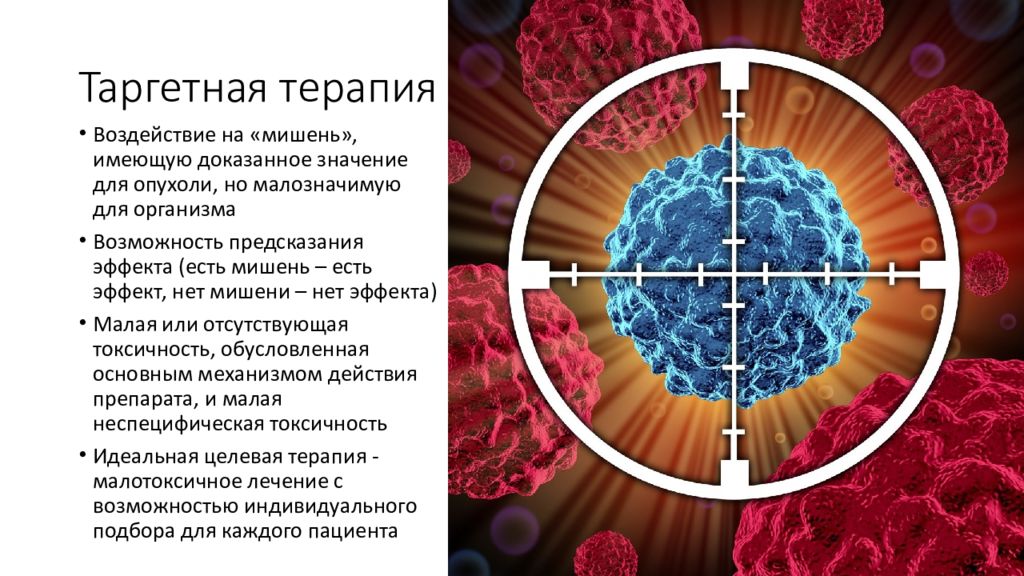
Слайд 41: Таргетная терапия
Воздействие на «мишень», имеющую доказанное значение для опухоли, но малозначимую для организма Возможность предсказания эффекта (есть мишень – есть эффект, нет мишени – нет эффекта) Малая или отсутствующая токсичность, обусловленная основным механизмом действия препарата, и малая неспецифическая токсичность Идеальная целевая терапия - малотоксичное лечение с возможностью индивидуального подбора для каждого пациента
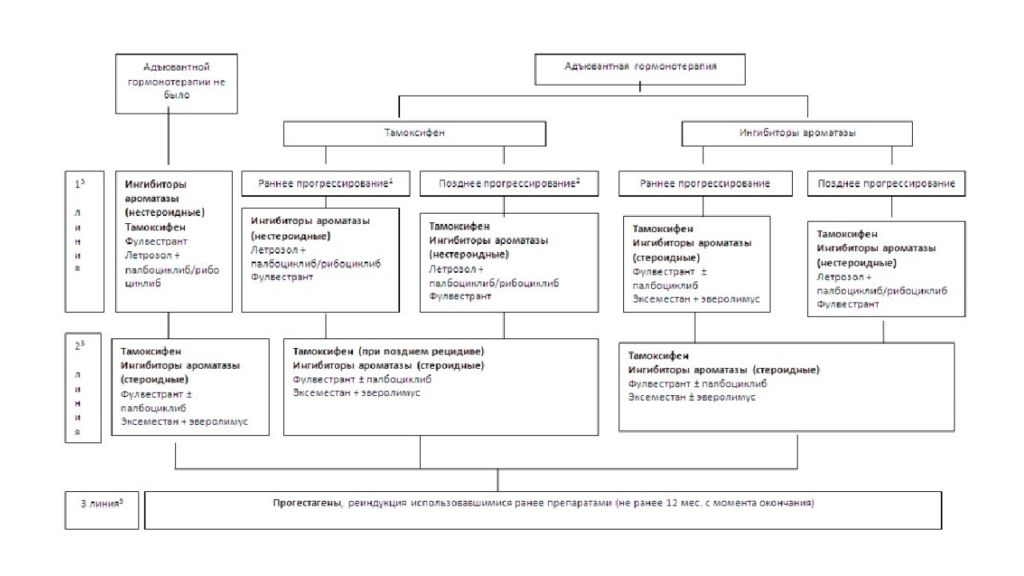
Слайд 43: Эндокринотерапия
В адъювантном режиме применяется самостоятельно (при благоприятном прогнозе) или после завершения химиотерапии Используется у пациенток, опухоли которых сохранили чувствительность к стимуляции эстрогенами (несут рецепторы эстрогенов и/или прогестерона ) Продолжительность адъювантной эндокринотерапии 5 лет и более Блокада рецепторов эстрогенов Блокада выработки эстрогенов яичниками (или удаление яичников) Блокада выработки эстрогенов надпочечниками (в менопаузе)
Слайд 44: Доступные варианты эндокринотерапии
Антиэстрогены ( тамоксифен, фулвестрант ) – блокада рецепторов эстрогенов Ингибиторы ароматазы ( анастразол, экземестан, летрозол ) – блокируют синтез эстрогенов в надпочечниках (в постменопаузе) Кастрация – выключение функции яичников (хирургическое, лучевое, лекарственное ) Эндокринотерапия является истинной первой линией лечения у больных с рецептор-позитивными опухолями, т.к. при меньшей токсичности позволяет добиться отдаленных результатов, сопоставимых с химиотерапией