Первый слайд презентации: РЕГУЛЯЦИЯ МЕТАБОЛИЗМА БАКТЕРИЙ. МИКРОБИОЛОГИЧЕСКИЕ АСПЕКТЫ БИОТЕХНОЛОГИИ
1. Основные принципы регуляции метаболизма и скорости роста микроорганизмов 2. Регуляция на уровне биосинтеза белка 3. Регуляция активности ферментов 4. Регуляция интегральных мембранных процессов и клеточного деления у микроорганизмов 5. Промышленное использование микроорганизмов
Регуляция метаболизма – управление скоростью биохимических процессов путем обратимого изменения количества белковых посредников, участвующих в этих процессах, или их активности. В большинстве биохимических процессов белковые посредники - катализаторы химических реакций – ферменты. Однако некоторые процессы (транспорт многих субстратов через биологические мембраны) осуществляются белками, которые не катализируют каких-либо химических превращений, а обусловливают «узнавание» и транслокацию субстратов.
Слайд 3: УРОВНИ РЕГУЛЯЦИИ МЕТАБОЛИЗМА
Существует 2 основных уровня регуляции: 1) уровень регуляции биосинтеза белков-ферментов, 2) уровень регуляции их активности в процессе функционирования. Этапы регуляции биосинтеза белковых посредников: подготовительные стадии: репликация генома и его транскрипция, т. е. биосинтез иРНК; завершающая стадия – трансляция – сборка молекул белков ферментов, конечных акцепторов генетической информации клетки.
Слайд 4: РЕГУЛЯЦИЯ НА УРОВНЕ БИОСИНТЕЗА БЕЛКА
РЕГУЛЯЦИЯ РЕПЛИКАЦИИ ДНК (полуконсервативный механизм), состоящей из инициации, элонгации, терминации. Характеризуется мультиферментным характером (участие 2х ДНК-полимераз, ДНК-лигазы, релаксирующих белков – хеликазы и топоизомераз ). У бактерий одновременно протекают репликации нескольких типов : 1) редупликация генома; 2) репарационный синтез ДНК; 3) рекомбинационный синтез ДНК; 4) репликация внехромосомных генетических детерминант – плазмид. Репликация ДНК находится под «+» (накопление активатора активирует репликацию согласованно с удвоением массы клетки) и «–» контролем белков-регуляторов.
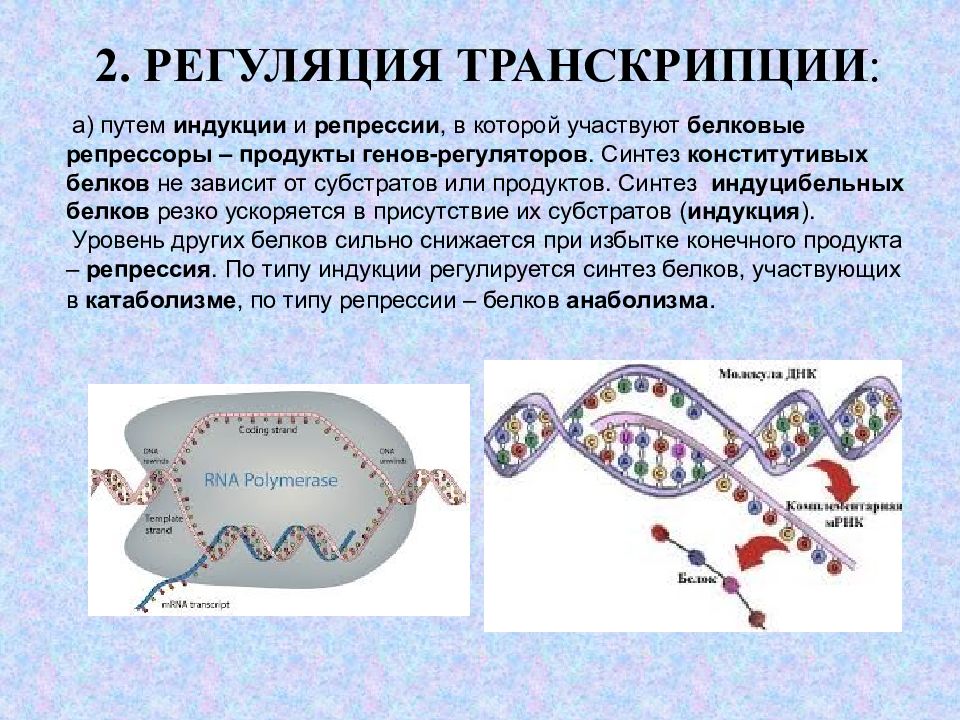
Слайд 5: 2. РЕГУЛЯЦИЯ ТРАНСКРИПЦИИ :
а) путем индукции и репрессии, в которой участвуют белковые репрессоры – продукты генов-регуляторов. Синтез конститутивых белков не зависит от субстратов или продуктов. Синтез индуцибельных белков резко ускоряется в присутствие их субстратов ( индукция ). Уровень других белков сильно снижается при избытке конечного продукта – репрессия. По типу индукции регулируется синтез белков, участвующих в катаболизме, по типу репрессии – белков анаболизма.
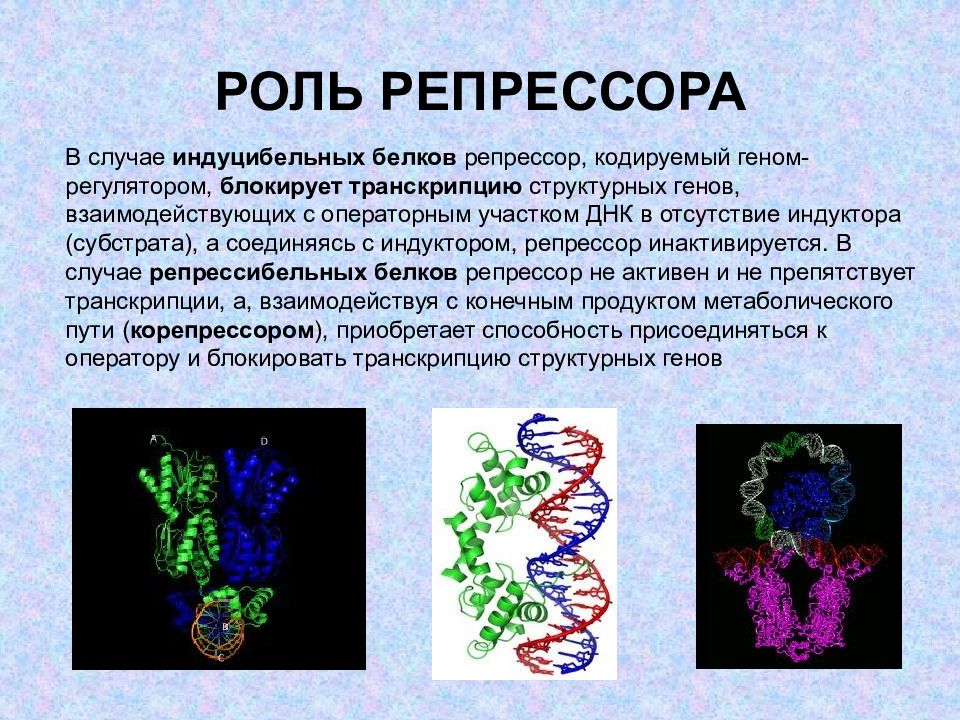
Слайд 6: РОЛЬ РЕПРЕССОРА
В случае индуцибельных белков репрессор, кодируемый геном-регулятором, блокирует транскрипцию структурных генов, взаимодействующих с операторным участком ДНК в отсутствие индуктора (субстрата), а соединяясь с индуктором, репрессор инактивируется. В случае репрессибельных белков репрессор не активен и не препятствует транскрипции, а, взаимодействуя с конечным продуктом метаболического пути ( корепрессором ), приобретает способность присоединяться к оператору и блокировать транскрипцию структурных генов
Слайд 7: 2. РЕГУЛЯЦИЯ ТРАНСКРИПЦИИ :
б) катаболическая репрессия – регуляция активности оперонов, транскрипция которых нуждается в наличии активатора – комплекса специального белка с АМФ. в) регуляция на уровне функционирования РНК-полимеразы. г) регуляция путем изменения конформации или структуры ДНК ( топоизомеразы – белковые катализаторы, изменяющие степень суперспирализации ДНК: релаксирующие белки снижают, а ДНК-гираза повышает ее ).
Слайд 8
3. Регуляция трансляции: а) регуляция на уровне биосинтеза и сборки компонентов аппарата трансляции: аминоацетил-тРНК-синтетазы ; тРНК, рРНК, мРНК, рибосомных белков и белковых факторов трансляции. б) регуляция функционирования аппарата трансляции ( селективность рибосом в отношении мРНК ). 4. Регуляция биосинтеза белков путем посттрансляционной модификации ( стадия «созревания» или процессинга белков; ферментативное присоединение коферментов – биотина, флавина ; формирование третичной и четвертичной структур молекул ). 5. Регуляция круговорота белков путем избирательного протеолиза.
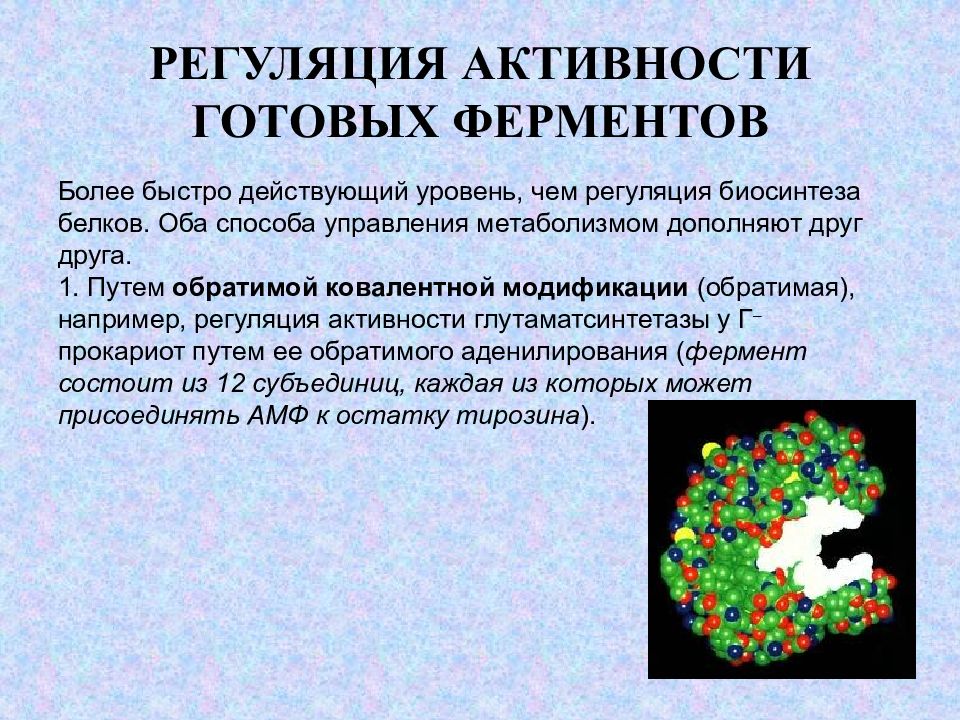
Слайд 9: РЕГУЛЯЦИЯ АКТИВНОСТИ ГОТОВЫХ ФЕРМЕНТОВ
Более быстро действующий уровень, чем регуляция биосинтеза белков. Оба способа управления метаболизмом дополняют друг друга. Путем обратимой ковалентной модификации (обратимая), например, регуляция активности глутаматсинтетазы у Г – прокариот путем ее обратимого аденилирования ( фермент состоит из 12 субъединиц, каждая из которых может присоединять АМФ к остатку тирозина ).
Слайд 10: РЕГУЛЯЦИЯ АКТИВНОСТИ ГОТОВЫХ ФЕРМЕНТОВ
2. Путем взаимодействия с субстратом (гомотропная кооперативность ): фермент имеет несколько активных центров одинаковой природы, взаимодействующих с молекулами субстрата, причем присоединение первой молекулы субстрата облегчает присоединение последующих молекул (НАД+-зависимая глицеральдегид-3-фосфат-дегидрогеназа из дрожжей).
Слайд 11: РЕГУЛЯЦИЯ АКТИВНОСТИ ГОТОВЫХ ФЕРМЕНТОВ
3. Путем взаимодействия с продуктом (гетеротропная кооперативность) : фермент обладает раздельными активными центрами: каталитический связывает субстрат и регуляторный, связывающий продукт или другой эффектор; обычно эти центры размещены на разных субъединицах фермента. Связывание эффектора с регуляторным центром влияет на конформацию каталитического центра и снижает его сродство к субстрату (например, активность треониндегидратазы у E. coli подавляется конечным продуктом метаболической цепи – изолейцином). Этот тип регуляции характерен для конструктивных (анаболических) путей метаболизма: конечный продукт метаболического пути, накапливающийся до определенного уровня, подавляет свой биосинтез, ингибируя активность первого фермента данного пути, что обеспечивает экономию конструктивного материала и энергии.
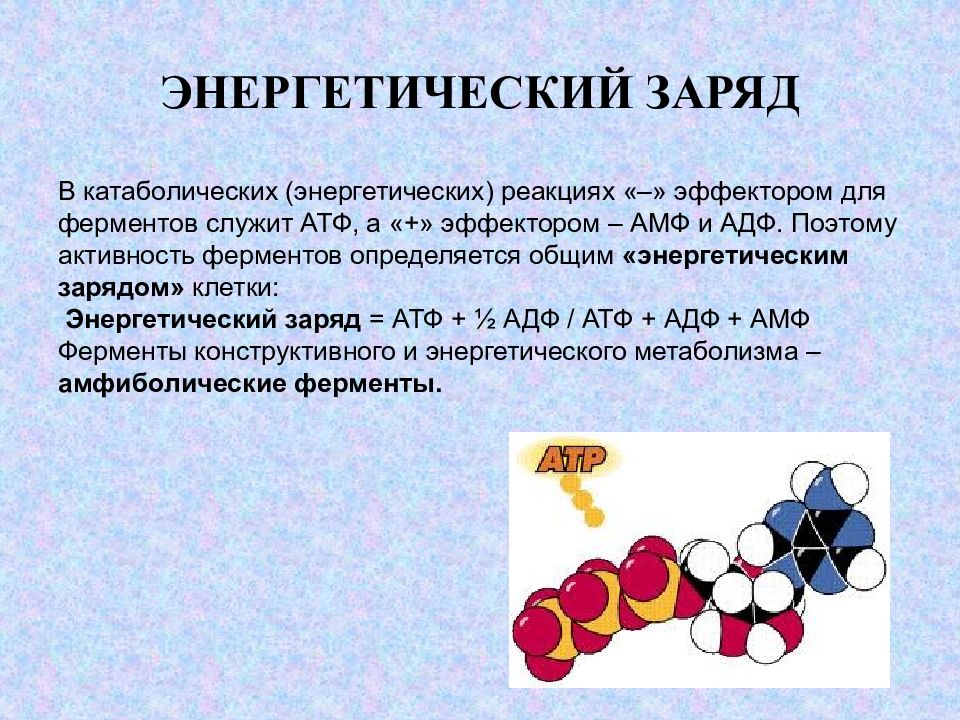
Слайд 12: ЭНЕРГЕТИЧЕСКИЙ ЗАРЯД
В катаболических (энергетических) реакциях «–» эффектором для ферментов служит АТФ, а «+» эффектором – АМФ и АДФ. Поэтому активность ферментов определяется общим «энергетическим зарядом» клетки: Энергетический заряд = АТФ + ½ АДФ / АТФ + АДФ + АМФ Ферменты конструктивного и энергетического метаболизма – амфиболические ферменты.
Слайд 13: РЕГУЛЯЦИЯ АКТИВНОСТИ ГОТОВЫХ ФЕРМЕНТОВ
4. Путем пространственного разобщения и взаимодействия с мембранами : (у Г– бактерий некоторые гидролазы локализованы в периплазме → активность фермента регулируется путем управления скоростью проникновения или его выхода – компартментация). Многие ферменты могут обратимо взаимодействовать с клеточной мембраной, что изменяет их физико-химические свойства и активность – аллотопия. Ферменты, катализирующие серию последовательных реакций, образуют ансамбли, локализованные в ЦПме ( дегидрогеназы α-кетокислот ) или в клеточной мембране ( дыхательные ферменты ).
Слайд 14: РЕГУЛЯЦИЯ ИНТЕГРАЛЬНЫХ МЕМБРАННЫХ ПРОЦЕССОВ У МИКРООРГАНИЗМОВ
Организация и регуляция транспортных процессов Основную роль в транспорте веществ из окружающей среды в клетки большинства микроорганизмов выполняют компоненты аппарата, локализованного в ЦПМ е. Клетки Г – микроорганизмов окружены наружной мембраной – барьером для проникновения большинства гидрофильных (и некоторых гидрофобных) веществ. Избирательная проницаемость наружно мембраны обеспечивается образованием гидрофильных «каналов», или «пор», с помощью специальных структурных белков (поринов), а Также специфическими транспортными системами.
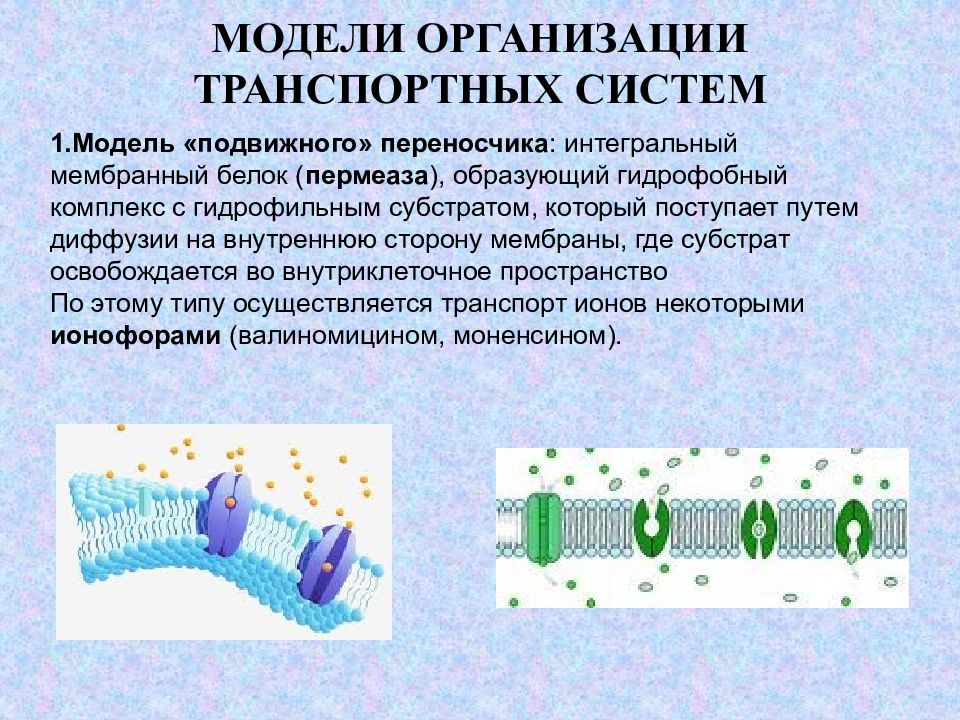
Слайд 15: МОДЕЛИ ОРГАНИЗАЦИИ ТРАНСПОРТНЫХ СИСТЕМ
Модель «подвижного» переносчика : интегральный мембранный белок ( пермеаза ), образующий гидрофобный комплекс с гидрофильным субстратом, который поступает путем диффузии на внутреннюю сторону мембраны, где субстрат освобождается во внутриклеточное пространство По этому типу осуществляется транспорт ионов некоторыми ионофорами (валиномицином, моненсином).
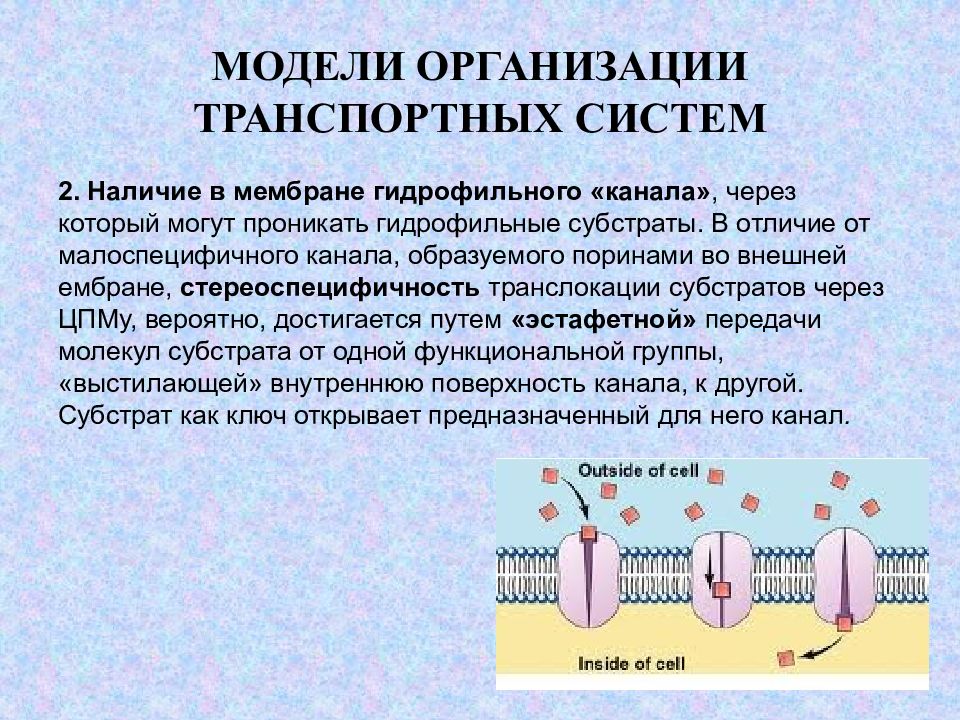
Слайд 16: МОДЕЛИ ОРГАНИЗАЦИИ ТРАНСПОРТНЫХ СИСТЕМ
2. Наличие в мембране гидрофильного «канала», через который могут проникать гидрофильные субстраты. В отличие от малоспецифичного канала, образуемого поринами во внешней ембране, стереоспецифичность транслокации субстратов через ЦПМу, вероятно, достигается путем «эстафетной» передачи молекул субстрата от одной функциональной группы, «выстилающей» внутреннюю поверхность канала, к другой. Субстрат как ключ открывает предназначенный для него канал.
Слайд 17: МОДЕЛИ ОРГАНИЗАЦИИ ТРАНСПОРТНЫХ СИСТЕМ
3. Комбинация первых 2х моделей : позволяет использовать их «+» стороны: предполагается наличие гидрофобного мембранного переносчика, который путем конформационных изменений, вызываемых субстратом, «протаскивает» последний с внешней стороны мембраны на ее внутреннюю сторону. Упрощенный вариант модели - представление о переносчике как о трансмембранном «колесе», вращающемся в мембране и захватывающем субстрат на ее внешней стороне. Образующийся гидрофобный комплекс распадается на внутренней стороне мембраны.
Слайд 18: МЕМБРАННЫЕ ТРАНСПОРТНЫЕ СИСТЕМЫ
В состав мембранных транспортных систем входит более одного белкового посредника, между ними существует разделение функций. Сами переносчики организованы в виде мультимеров (димеров). Связывающие белки не могут выполнять функции переносчиков, т.к. они являются гидрофильными периферическими белками, а не интегральными компонентами мембраны. Их роль: «узнавание» субстрата, концентрирование его на внешней поверхности мембраны и последующая передача компоненту, осуществляющему транслокацию субстрата через мембрану. Связывающие белки участвуют в хемотаксисе.
Слайд 19: ТИПЫ ТРАНСПОРТНЫХ СИСТЕМ
2 основных типа транспортных систем: 1) 2-3 белковых посредника, из которых один – истинный транслокатор (переносчик), а другие, располагаясь на внешней и внутренней поверхности мембраны, определяют специфичность транспорта и способы его регуляции. лишь один белковый посредник, обязательное его свойство – сложность четвертичной структуры ( мультимерность ), приводящее к появлению аллостерических свойств, определяющих взаимодействия с субстратом и эффекторами. Такие системы осуществляют симпорт, т.е. одновременную транслокацию субстрата и эффекторов, в качестве которых выступают одновалентные неорганические катионы (Н + или N а + ). Системы 1-го типа используют АТФ (или близкие к нему интермедиаты), энергизация транспортных систем 2-го типа - за счет трансмембранного электрохимического потенциала.
Слайд 20: Регуляция транспортных процессов
Осуществляется на двух уровнях: на уровне биосинтеза белковых переносчиков и на уровне функционирования готовых посредников. У микроорганизмов для одного и того же субстрата часто используется несколько транспортных систем. Часть систем обладает узкой специфичностью и предназначена для группы субстратов (иногда для единственного субстрата), близких по химическому строению, а часть систем обладает более широкой субстратной специфичностью. У Е. со li существует 12 типов транспортных систем аминокислот, причем узкоспецифичные транспортные системы часто обладают более высоким сродством к субстрату, чем системы с широкой специфичностью.
Слайд 21: КЛЕТОЧНОЕ ДЕЛЕНИЕ И РОСТ
Процесс клеточного роста и деления включает: накопление «критической» клеточной массы (объема), индуцирующей деление; 2) репликация ДНК генома; 3) построение новой клеточной оболочки (клеточной стенки и ЦПМы), обеспечивающее рост клетки; 4) построение клеточной перегородки — собственно деление; расхождение дочерних клеток. Некоторые из этих событий протекают одновременно, другие совершаются последовательно ; некоторые из них могут отсутствовать у данного микроорганизма. Например, деление клеток может осуществляться без участия клеточной стенки (у порядка М ycoplasmatales, L -форм некоторых бактерий; может отсутствовать этап расхождения дочерних клеток ( Streptococcales, Sarcina ).
Слайд 22: РЕГУЛЯЦИЯ КЛЕТОЧНОГО ДЕЛЕНИЯ
Осуществляется на 2х уровнях: путем регуляции каждого из перечисленных процессов, путем организации их взаимодействия. Накопление критической клеточной массы и репликация ДНК. Это подготовительный этап к процессу собственно деления клетки. В различных условиях размер клеток (и пороговая биомасса) у данного организма может варьировать, но в стандартных условиях этот признак стабилен и даже имеет определенное таксономическое значение. Построение новой клеточной оболочки. Различают пролиферацию данных клеточных структур (динамику накопления в них нового материала на протяжении клеточного цикла), и сегрегацию поверхностных структур (способ включения нового материала в предсуществующие структуры).
Слайд 23: ПОДГОТОВКА К КЛЕТОЧНОМУ ДЕЛЕНИЮ
В период подготовки к клеточно му делени ю происходит запасание предобразованных белков в цитоплазме и быстрая их мобилизация в процессе деления. В период деления возрастает активность некоторых литических ферментов (в частности, муреингидролаз), участвующих в образовании брешей в предсуществующем каркасе клеточной стенки, необходимых для включения новых ее фрагментов.
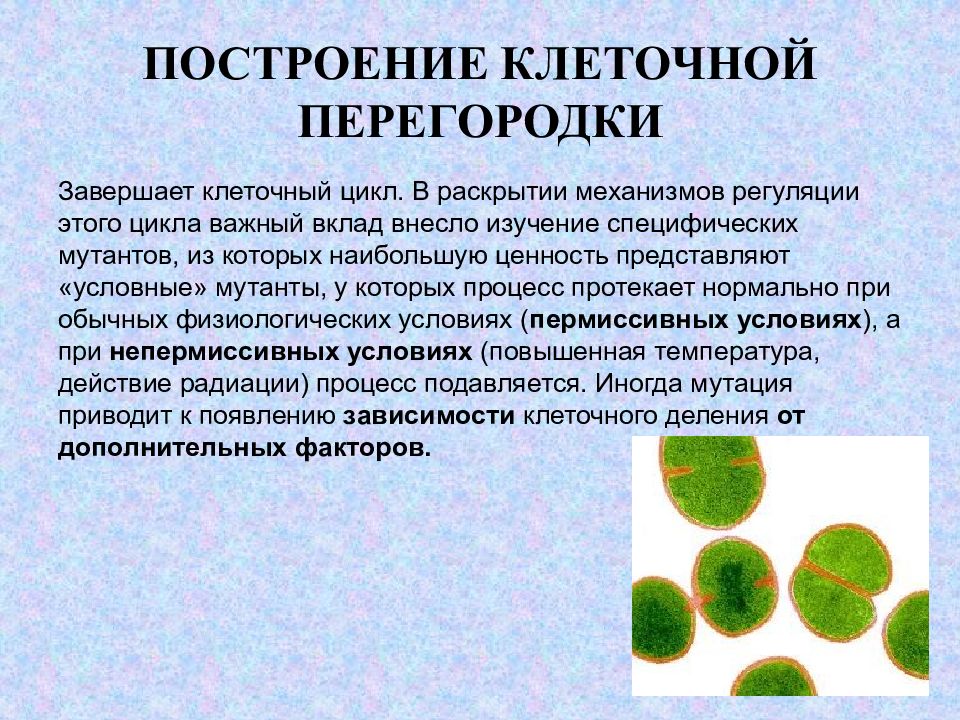
Слайд 24: ПОСТРОЕНИЕ КЛЕТОЧНОЙ ПЕРЕГОРОДКИ
Завершает клеточный цикл. В раскрытии механизмов регуляции этого цикла важный вклад внесло изучение специфических мутантов, из которых наибольшую ценность представляют «условные» мутанты, у которых процесс протекает нормально при обычных физиологических условиях ( пермиссивных условиях ), а при непермиссивных условиях (повышенная температура, действие радиации) процесс подавляется. Иногда мутация приводит к появлению зависимости клеточного деления от дополнительных факторов.
Слайд 25: Взаимосвязь процессов накопления критической массы, репликации ДНК и сборки клеточной перегородки
В норме репликация ДНК должна завершаться до построения клеточной перегородки, чтобы каждая из дочерних клеток получила полный набор генетических детерминант. Поэтому в процессе эволюции выработались определенные сигналы для запуска ( инициации ) ключевых процессов. Между рассматриваемыми процессами не существует облигатно-реципрокной связи, при которой подавление одного из процессов тормозило бы другой, и наоборот. Сайты, ответственные за построение перегородки, строго локализованы в поверхностных структурах клетки, а количество перегородок пропорционально количеству удвоений клеточной массы. Сигналом для инициации сборки клеточной перегородки в норме служит удвоение клеточной массы (объема).
Слайд 26: Промышленное использование микроорганизмов
Промышленная микробиология основывается на применении микроорганизмов в промышленности для получения коммерчески ценных продуктов и лекарств: антибиотики, ферменты, ингибиторы ферментов, витамины, ароматизаторы, добавки для пищевой промышленности. Гибкость метаболизма и высокая способность микробов к адаптации, простота культивирования, изученность генетики, разработанные методы направленного создания штаммов с заданными свойствами – преимущества, делающие микробную биотехнологию одним из перспектив ных направлений промышленности.
Слайд 27: Целесообразность микробиологического производства
Определяется такими факторами, как высокий выход продукта (образование больших количеств и исходного материала), низка стоимость производства и доступность сырья. В настоящее время разработаны способы получения более 1000 Наименований продуктов, полученных биотехнологическими способами. В США совокупная стоимость этих продуктов в 2000 г. оценивается в десятки миллиардов $. Все отрасли, в которых может быть использована биотехнология, перечислить невозможно.
Слайд 28: Оптимизация микробиологических процессов в биотехнологии
управляемое культивирование (изменение состава питательной среды, целевые добавки, регуляция скорости перемешивания, аэрации, модификация температурного режима); генетические манипуляции, которые подразделяют на традиционные методы (селекция штаммов) и методы генной инженерии (технология рекомбинантных ДНК). Микробиологическим путём получают микробную биомассу, первичные и вторичные продукты метаболизма. Первичные продукты (продукты 1-ой фазы) — метаболиты, синтез которых необходим для выживания данного микроорганизма. Синтез вторичных продуктов (продукты 2-ой фазы) не относится к жизненно необходимым для микроорганизма-продуцента.
Слайд 29: Генная инженерия
Производство продуктов микробного синтеза – одно из самых развитых направлений современной промышленности. Многие проблемы медицины, пищевой промышленности, сельского хозяйства решаются с применением организмов с модифи цированным геномом. С 1982 г. ряд фирм Европы, США и Японии производят инсулин человека, выделяемый из культуральной жидкости кишечной палочки. Из 1000 бактериальной культуры получают около 200 г человеческого инсулина. Такое количество ранее получали из 1600 кг тканей поджелудочной железы животных. Новый продукт позволяет избежать развития аллергических реакций на животный инсулин. В 2000 г. стоимость продукции, выпускаемой в США на основе генно - инженерных методов, достигла 50 млрд. $. Инсулин
Слайд 30: Области использования биотехнологии:
1. Медицина, здравоохранение, фармакология: антибиотики, ферменты, аминокислоты, кровезаменители, алкалоиды, нукпеотиды, иммунорегуляторы, противораковые и противовирусные препараты, новые вакцины, гормональные препараты (инсулин, гормон роста), моноклональные AT для диагностики и лечения, пробы ДНК для диагностики и генотерапии, продукты диетического питания.
Слайд 31: Области использования биотехнологии:
2. Получение химических веществ: этилен, пропилен, бутилен, окисленные углеводороды, органические кислоты, терпены, фенолы, акрилаты, полимеры, ферменты, продукты тонкого органического синтеза, полисахариды.
Слайд 32: Области использования биотехнологии:
3. Животноводство: усовершенствование кормовых рационов (производство белка, аминокислот, витаминов, кормовых антибиотиков, ферментов, заквасок для силосования), ветеринарных препаратов (антибиотики, вакцины), гормонов роста, манипуляции с чужеродными генам.
Слайд 33: Области использования биотехнологии:
4. Растениеводство: биорациональные пестициды, бактериальные удобрения, гибберелины, производство безвирусного посадочного материала, создание введение генов устойчивости к болезням.
Слайд 34: Области использования биотехнологии:
5. Рыбное хозяйство: кормовой белок, ферменты, антибиотики.
Слайд 35: Области использования биотехнологии:
6. Пищевая промышленность: белок, аминокислоты, заменители сахара (аспартам, глюкозофрукто вый сироп), полисахариды, органические кислоты, нуклеотиды, липи ды, переработка пищевых продуктов.
Слайд 36: Области использования биотехнологии:
7. Энергетика и добыча полезных ископаемых: спирты, биогаз, жирные кислоты, алифатические углеводороды, водород, интенсификация добычи нефти, газа, искусственный фотосинтез, биометаллургия, добыча серы.
Слайд 37: Области использования биотехнологии:
8. Тяжёлая промышленность: улучшение технических характеристик каучука, моторных топлив; антикоррозийные присадки, смазки для проката чёрных и цветных металлов, технический белок, липиды.
Слайд 38: Области использования биотехнологии:
9. Лёгкая промышленность: улучшение технологии переработки кож, производства текстильного сырья, шерсти, бумаги, парфюмерно-косметических изделий, получение биополимеров, искусственных кожи и шерсти и т.д.
Слайд 39: Области использования биотехнологии:
10. Биозлектроника : биосенсоры, биочипы
Слайд 40: Области использования биотехнологии:
11. Космонавтика : создание замкнутых систем жизнеобеспечения в космосе.
Слайд 41: Области использования биотехнологии:
12. Экология: утилизация сельскохозяйственных, промышленных и бытовых отходов, биодеградация трудноразлагаемых и токсических веществ ( пестици дов, гербицидов, нефти), создание замкнутых технологических циклов, производство безвредных пестицидов, легкоразрушаемых полимеров.
Последний слайд презентации: РЕГУЛЯЦИЯ МЕТАБОЛИЗМА БАКТЕРИЙ. МИКРОБИОЛОГИЧЕСКИЕ АСПЕКТЫ БИОТЕХНОЛОГИИ: Области использования биотехнологии:
13. Научные исследования: генно-инженерные и молекулярно-биологические исследования ( ферменты рестрикции ДНК, ДНК- и РНК-полимеразы, ДНК- и РНК-лигазы, нуклеиновые кислоты, нуклеотиды), медицинские исследования (средства диагностики, реактивы), химия (реактивы, сенсоры).