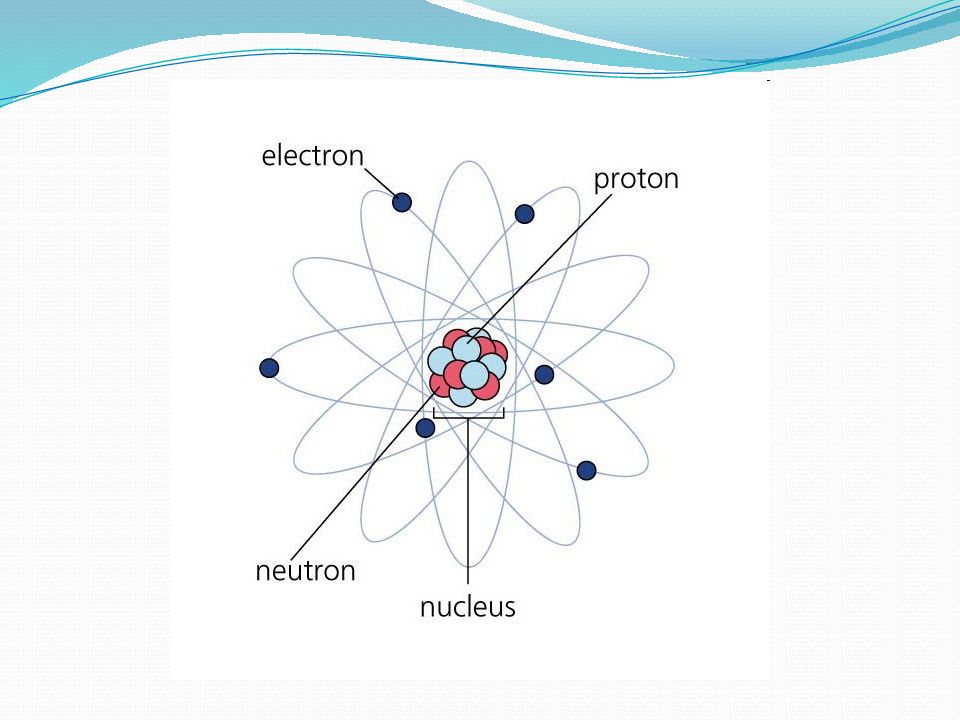
Слайд 2: Вспомним, что такое атом?
Атом (от др.-греч. ἄτομος — неделимый) — наименьшая, химически неделимая часть химического элемента, являющаяся носителем его свойств
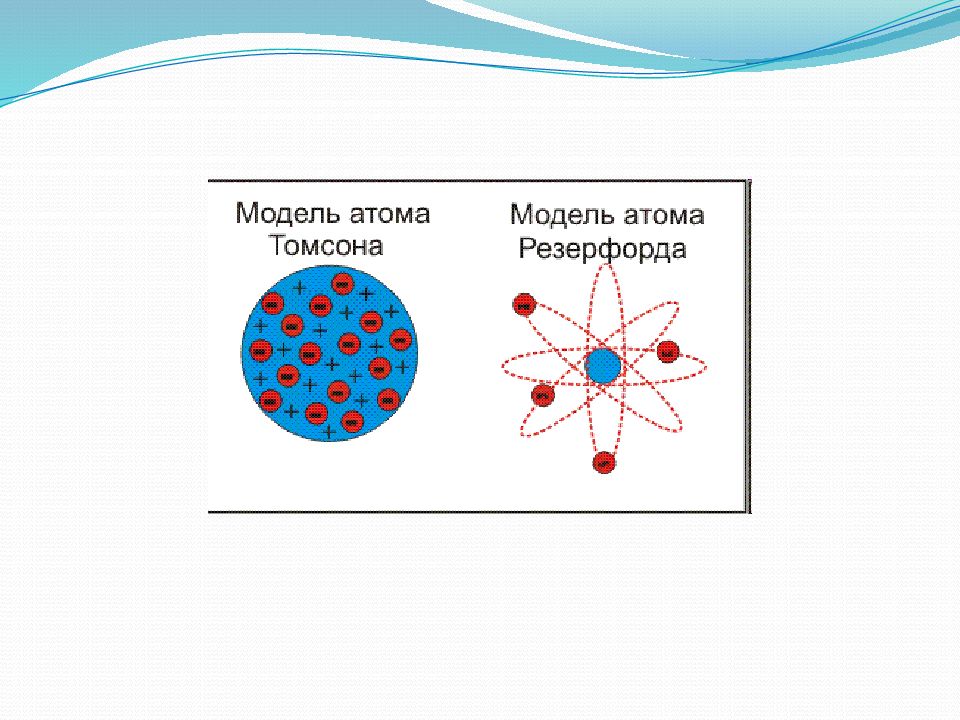
Слайд 4: Модели атомов
Модель атома Томсона (модель «Пудинг с изюмом»). Дж. Дж. Томсон предложил рассматривать атом как некоторое положительно заряженное тело с заключёнными внутри него электронами. Была окончательно опровергнута Резерфордом после проведённого им знаменитого опыта по рассеиванию альфа-частиц.
Слайд 5: Планетарная модель атома Бора-Резерфорда
Описание атома вошло в противоречие с классической электродинамикой. Дело в том, что, согласно классической электродинамике, электрон при движении с центростремительным ускорением должен излучать электромагнитные волны, а, следовательно, терять энергию. Дальнейшее изучение излучения атома привело к созданию квантовой механики, которая позволила объяснить подавляющее большинство наблюдаемых фактов.
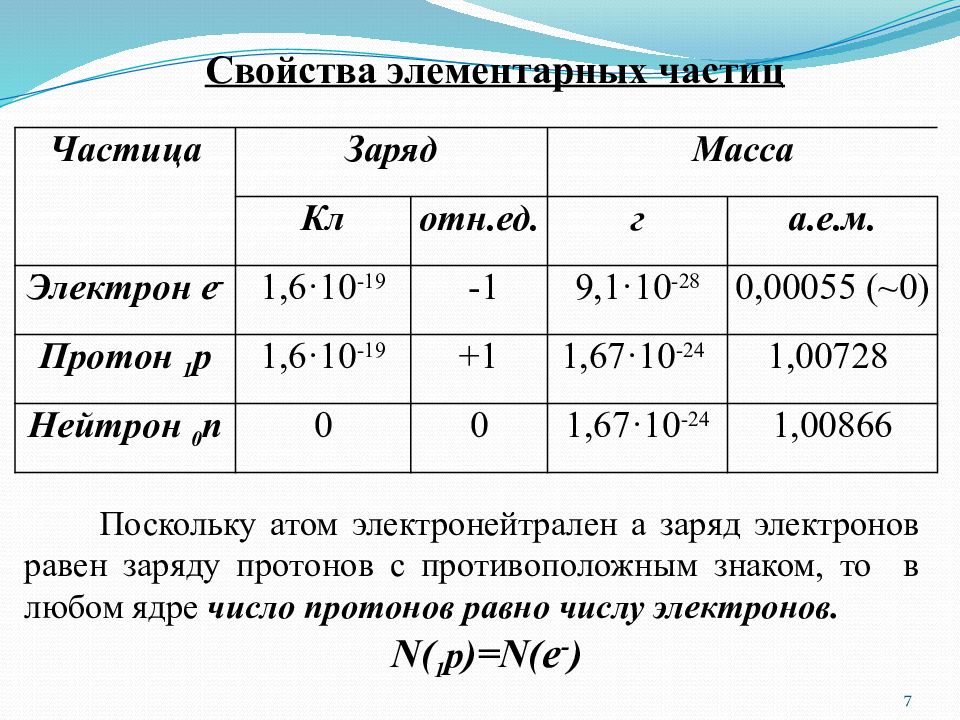
Слайд 7
Частица Заряд Масса Кл отн.ед. г а.е.м. Электрон e - 1,6·10 -19 -1 9,1·10 -28 0,00055 (~0) Протон 1 p 1,6·10 -19 +1 1,67·10 -24 1,00728 Нейтрон 0 n 0 0 1,67·10 -24 1,00866 Свойства элементарных частиц Поскольку атом электронейтрален а заряд электронов равен заряду протонов с противоположным знаком, то в любом ядре число протонов равно числу электронов. N( 1 p )=N( e - ) 7
Слайд 8
А – массовое число. Z – заряд ядра (порядковый номер элемента). N( 1 p ) – число протонов. N( 0 n) – число нейтронов. N( e - ) – число электронов. A = N( 1 p ) + N( 0 n) Z = N( 1 p ) = N( e - ) N( 0 n) = A - Z 8
Слайд 9
Изотопы – атомы одного и того же химического элемента, отличающиеся числом нейтронов, а, следовательно, и массой. Z 1 =Z 1, N 1 ≠ N 2, A 1 ≠A 2 16 8 O, 17 8 O, 18 8 O Изобары – нуклиды разных элементов с одинаковой атомной массой, но с различным числом протонов и нейтронов. Z 1 ≠ Z 1, A 1 =A 2 40 Ar, 40 Ca, 40 K Изотоны – нуклиды разных элементов с одинаковым числом нейтронов, но с различным числом протонов и атомной массой. Z 1 ≠ Z 1, N 1 = N 2, A 1 ≠ A 2 15 7 N, 14 6 C Виды нуклидов 9
Слайд 10: Постулаты Бора
Атом может находиться только в особенных стационарных, или квантовых, состояниях, каждому из которых отвечает определенная энергия. В стационарном состоянии атом не излучает электромагнитных волн. При переходе электрона с орбиты (энергетический уровень) на орбиту излучается или поглощается квант энергии. При переходе с верхнего уровня на нижний энергия излучается, при переходе с нижнего на верхний — поглощается.
Слайд 12: Квантовые числа
Квантовые числа – распределение электронов в атоме. Это своеобразный паспорт каждого электрона в атоме.
Слайд 13: 1. Главное квантовое число n
– показывает общий запас энергии электрона, а значит его удаленность от ядра: чем выше энергия электрона, тем дальше он расположен от ядра; n принимает целое значение n = [1;7] и соответствует номеру уровня, на котором находится электрон.
Слайд 14: 2. побочное (орбитальное) квантовое число l
– отражает разное энергетическое состояние электрона в пределах уровня и соответствует подуровню ( s -, p -, d -, f -), принимает значение от 0 до n -1. Например, при n=3, l=0, 1, 2.
Слайд 15: 3. магнитное квантовое число m
m – характеризует ориентацию орбиталей в пространстве; принимает значения – l …0…+ l. Например, если l=2, m принимает значения -2 ;-1;0;+1;+2.
Слайд 16: 4. спиновое квантовое число s
– собственный момент импульса электрона, не связанный с движением в пространстве. Это свойство электрона, не имеющее аналога в макромире. Для всех электронов спиновое квантовое число
Слайд 17: 5. магнитное спиновое число ms
– проекция спина на ось Oz. Всегда равно
Слайд 18
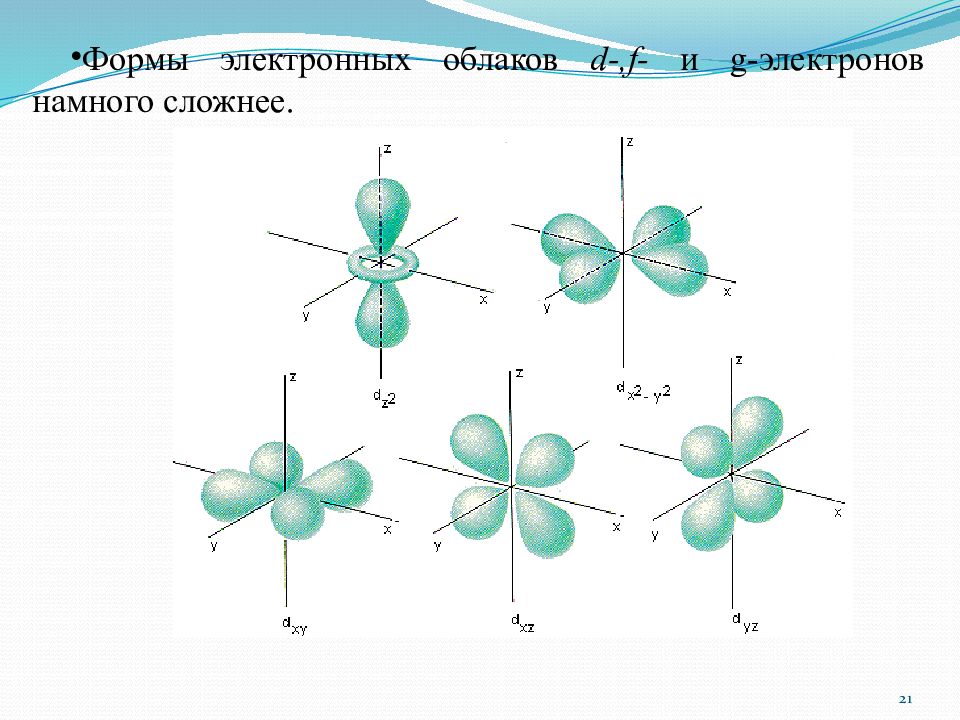
1. Главное квантовое число п определяет общую энергию электрона на данной орбитали, а, значит, его удаленность от ядра : чем выше энергия электрона, тем дальше он расположен от ядра; n принимает целые значение от 1 до 7 ( n = [1;7]) и соответствует номеру уровня, на котором находится электрон. 2. Побочное (орбитальное) квантовое число l. Определяет форму (симметрию) атомной орбитали и характеризует различный запас энергии электрона в пределах данного энергетического уровня или его подуровень. Может принимать целочисленные значения от 0 до n -1 ( l = 0, 1,..., п - 1) Значение l 0 1 2 3 4 Буквенное обозначение s p d f g Квантовые числа электронов 18
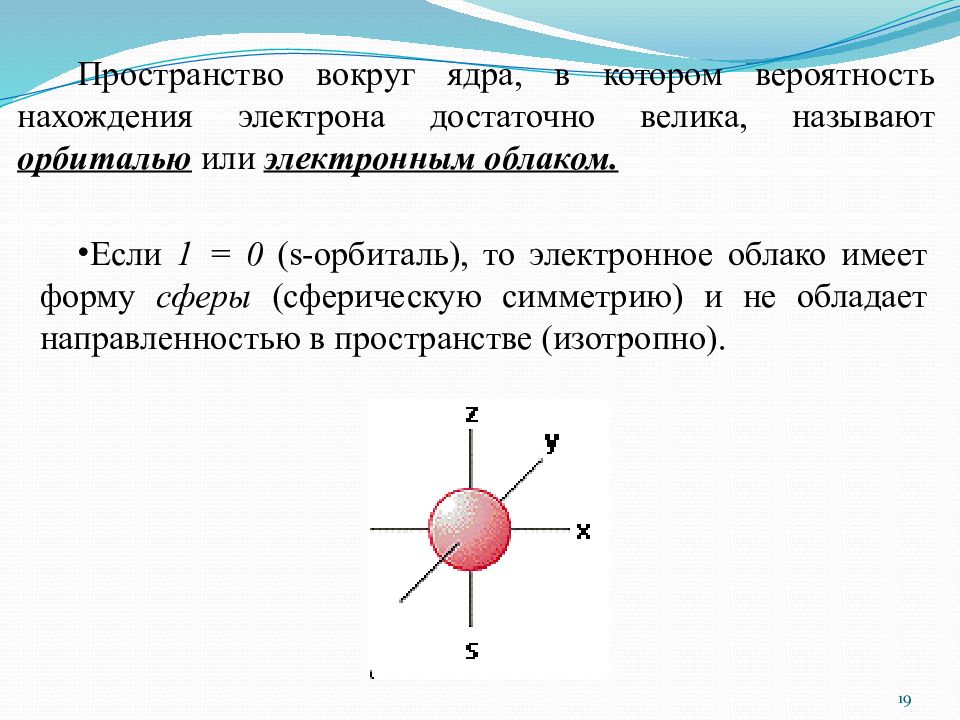
Слайд 19
E сли 1 = 0 ( s - орбиталь ), то электронное облако имеет форму сферы (сферическую симметрию) и не обладает направленностью в пространстве (изотропно). Пространство вокруг ядра, в котором вероятность нахождения электрона достаточно велика, называют орбиталью или электронным облаком. 19
Слайд 20
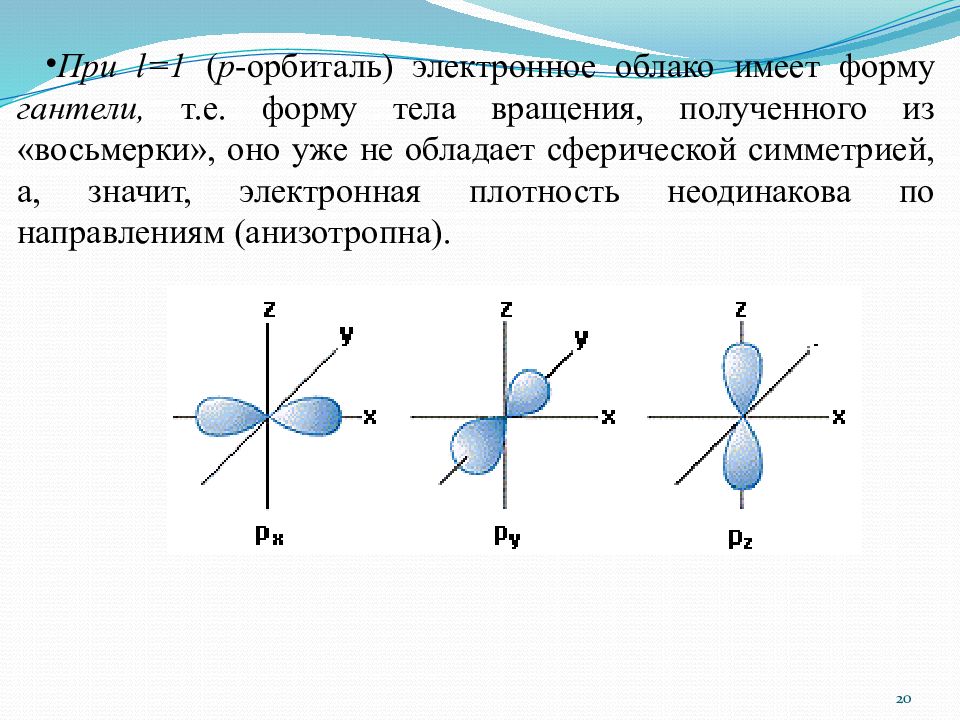
При l =1 ( р -орбиталь ) электронное облако имеет форму гантели, т.е. форму тела вращения, полученного из «восьмерки», оно уже не обладает сферической симметрией, а, значит, электронная плотность неодинакова по направлениям ( анизотропна ). 20
Слайд 22
3. Магнитное орбитальное квантовое число m l. Определяет ориентацию электронного облака в пространстве. Общее число возможных значений m l равно (2 l +1) и показывает, сколькими способами можно расположить орбитали данного подуровня в пространстве, т.е. общее число орбиталей на подуровне l. m l [ – l ; l ], включая 0 22
Слайд 23
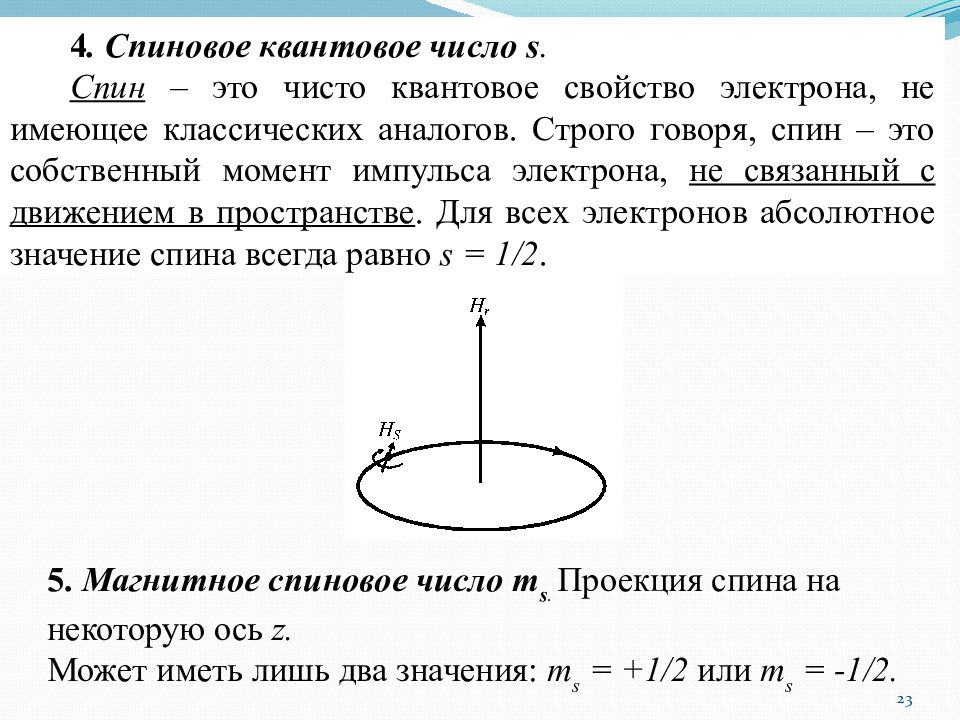
4. Спиновое квантовое число s. C пин – это чисто квантовое свойство электрона, не имеющее классических аналогов. Строго говоря, спин – это собственный момент импульса электрона, не связанный с движением в пространстве. Для всех электронов абсолютное значение спина всегда равно s = 1/2. 5. Магнитное спиновое число m s. Проекция спина на некоторую ось z. Может иметь лишь два значения: m s = +1/2 или m s = -1/2. 23
Слайд 24
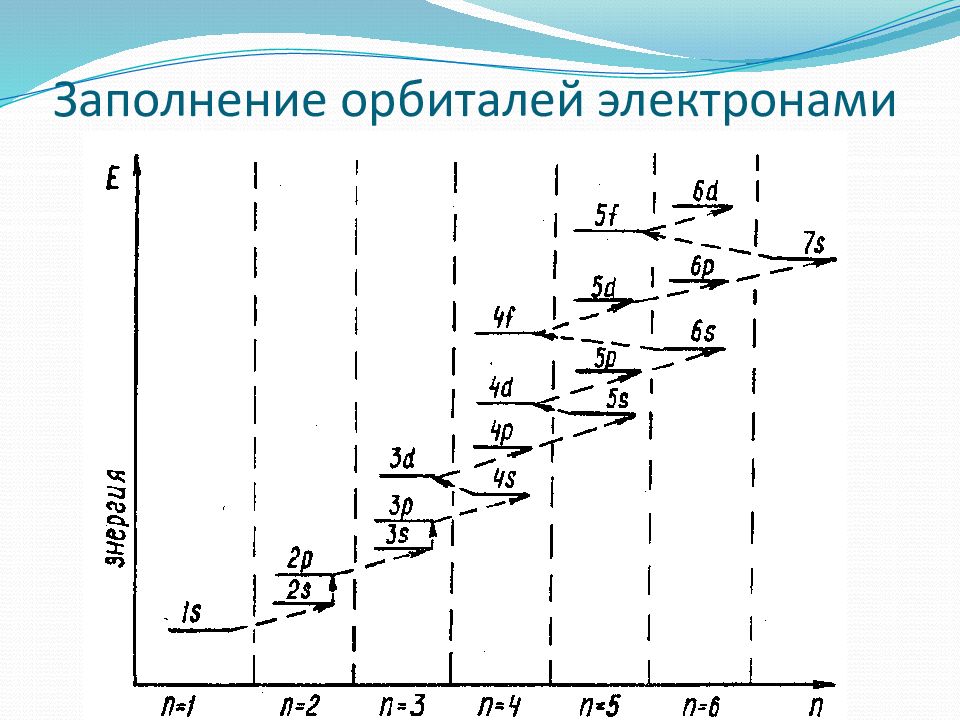
Электронные конфигурации атомов Распределение электронов по уровням и подуровням подчиняется определенным закономерностям. 2. Правило Клечковского. Энергия электрона определяется главным квантовым числом n и побочным квантовым числом l, поэтому электрон занимает в основном состоянии уровень не с минимально возможным значением n, а с наименьшим значением суммы ( n + l ). 1. Принцип наименьшей энергии. Если электрон находится в основном (невозбужденном) состоянии, он располагается в атоме так, чтобы его энергия была минимальной. Значит, в уровни будут заполняться по возрастанию главного квантового числа. Число электронов на n - ом уровне ( N n ) рассчитывается по формуле: 24
Слайд 25
Например, энергия электрона на подуровне 4s меньше, чем на подуровне 3d, так как в первом случае n+l=4+0=4, а во втором n+l=3+2=5, поэтому сначала заполняется 4s, а потом 3d подуровень. На подуровне 5s ( n+l=5+0=5 ) энергия меньше, чем на 4d ( n+l=4+2=6 ), поэтому сначала заполняется 5 s, а потом 4d подуровень; на ( n+l=5+1=6 ) энергия меньше, чем на ( n+l=4+3=7 ), значит, заполнение подуровней происходит в порядке 5р, 4f и т. д. Однако, как только электроны заполнят квантовые ячейки, энергия подуровней станет строго пропорциональна величине n, так что при ионизации электроны будут уходить всегда с внешнего слоя с большим значением n. Согласно сказанному, конфигурация внешнего слоя атома Fe имеет вид 3d 6 4s 2, а конфигурация внешнего слоя иона Fe 3+ выглядит так: 3d 5 4s 0. 25
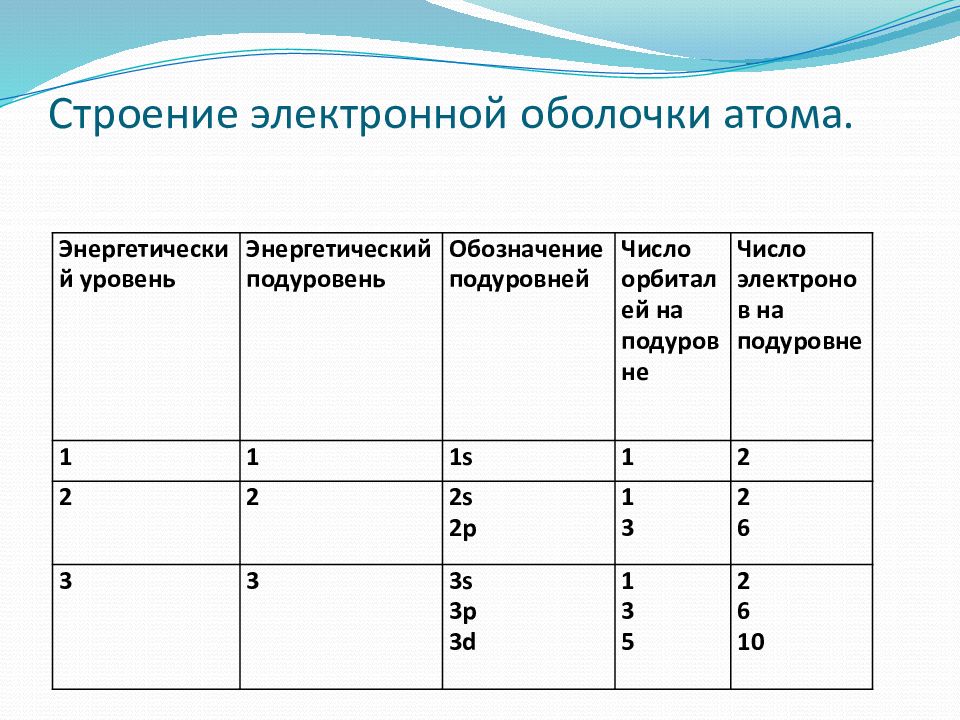
Слайд 26: Строение электронной оболочки атома
Энергетический уровень Число энергетических уровней в атоме равно номеру периода, в котором находится элемент!!!
Слайд 27: Строение электронной оболочки атома
Энергетический подуровень Число подуровней на каждом энергетическом уровне равно номеру уровня!!!
Слайд 29: Строение электронной оболочки атома
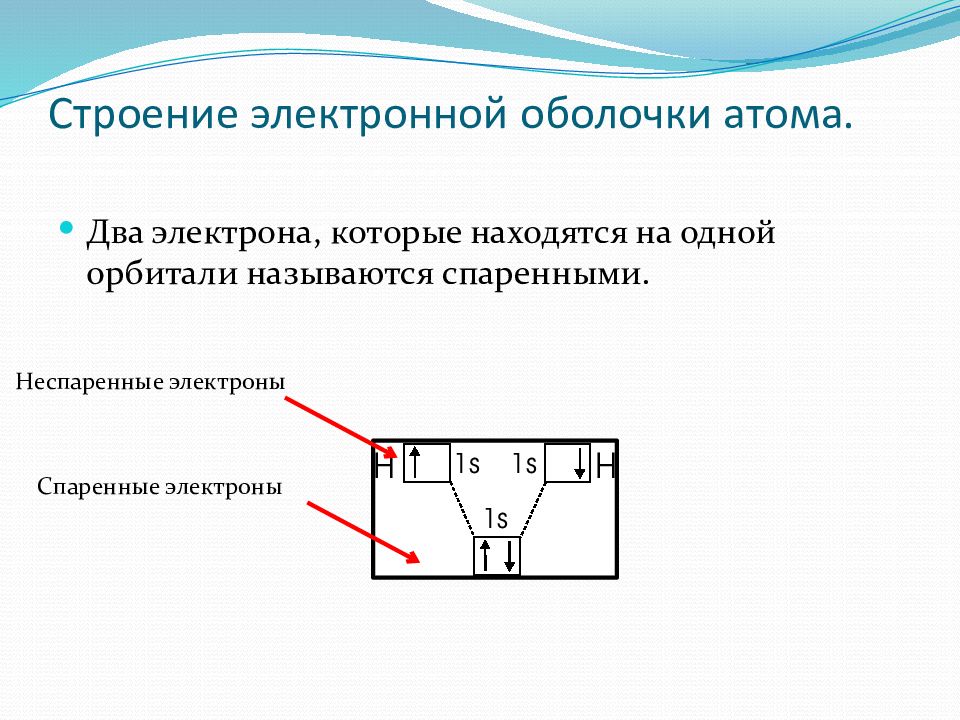
Два электрона, которые находятся на одной орбитали называются спаренными. Спаренные электроны Неспаренные электроны
Слайд 30: Строение электронной оболочки атома
Энергетический уровень Энергетический подуровень Обозначение подуровней Число орбиталей на подуровне Число электронов на подуровне 1 1 1 s 1 2 2 2 2s 2p 1 3 2 6 3 3 3s 3p 3d 1 3 5 2 6 10
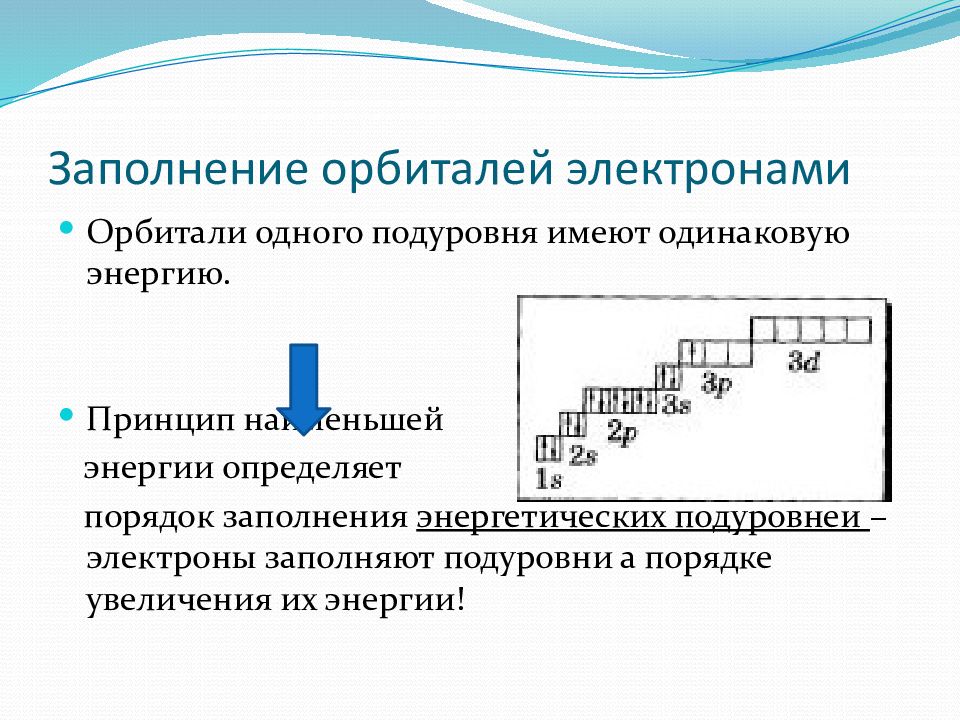
Слайд 31: Заполнение орбиталей электронами
Порядок заполнения электронами атомных орбиталей определяет принцип наименьшей энергии.
Слайд 32: Заполнение орбиталей электронами
Орбитали одного подуровня имеют одинаковую энергию. Принцип наименьшей энергии определяет порядок заполнения энергетических подуровней – электроны заполняют подуровни а порядке увеличения их энергии!
Слайд 34: Электронные конфигурации атомов
Чтобы правильно изображать электронные конфигурации атомов, нужно знать: Число электронов в атоме (равно порядковому номеру). Максимальное число электронов на уровнях и подуровнях. Порядок заполнения подуровней и орбиталей.
Слайд 35
В том случае, когда для двух подуровней суммы значений n и l равны, сначала идет заполнение подуровня с меньшим значением n. Например, на подуровнях 3 d, 4р, 5s сумма значений n и l равна 5. В этом случае происходит сначала заполнение подуровней с меньшими значениями n, то есть 3 d, 4р, 5s и т. д. 1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 5d >4f < 6p Заполнение подуровней 35
Слайд 37
s- элементы – последним заполняется s- подуровень p- элементы – последним заполняется p- подуровень d- элементы – последним заполняется d- подуровень f- элементы – последним заполняется f- подуровень Семейства элементов Элементы делятся на семейства, в зависимости от того, какой подуровень у них заполняется последним. s -, p -, d -, f -элементы 37
Слайд 38
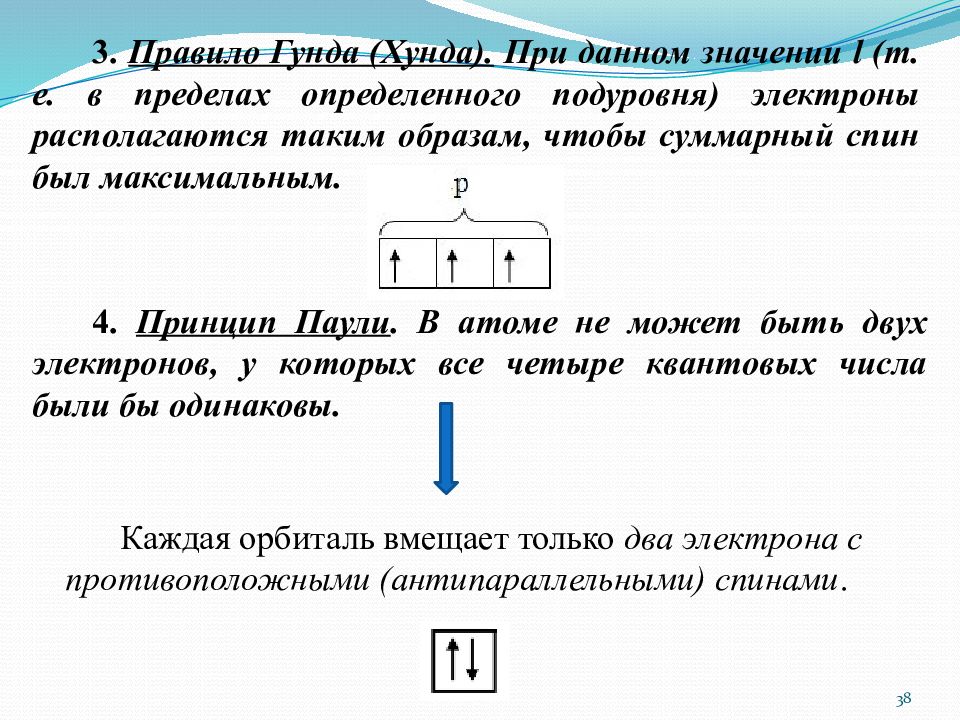
3. Правило Гунда ( Хунда ). При данном значении l (т. е. в пределах определенного подуровня) электроны располагаются таким образам, чтобы суммарный спин был максимальным. 4. Принцип Паули. В атоме не может быть двух электронов, у которых все четыре квантовых числа были бы одинаковы. Каждая орбиталь вмещает только два электрона с противоположными ( антипараллельными ) спинами. 38
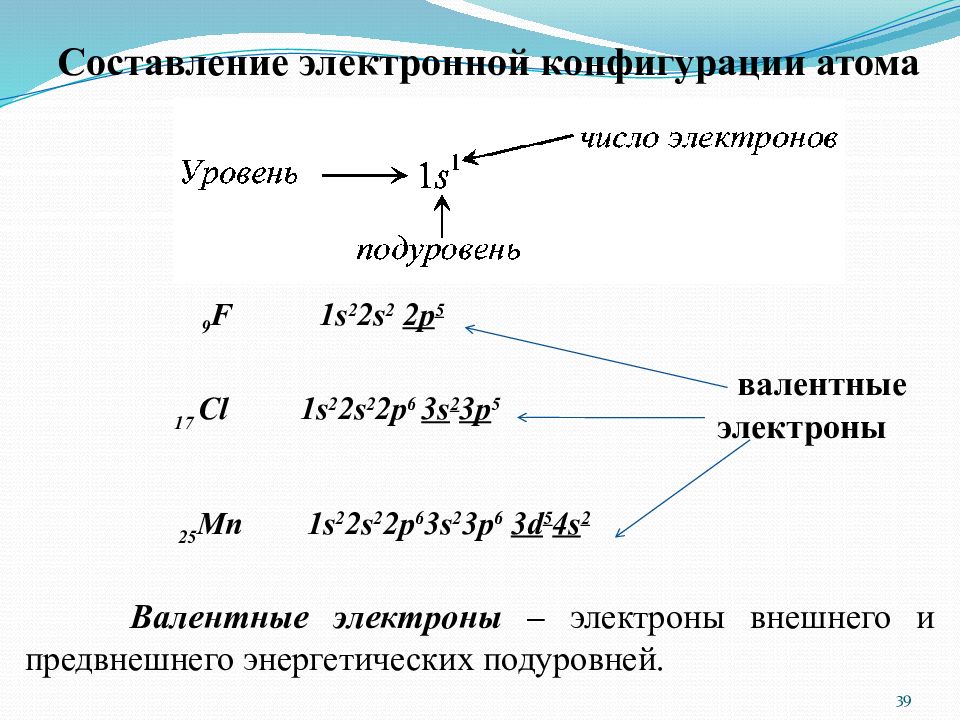
Слайд 39
25 Mn 1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 2 Составление электронной конфигурации атома 9 F 1 s 2 2 s 2 2 p 5 17 Cl 1 s 2 2 s 2 2 p 6 3 s 2 3 p 5 валентные электроны В алентные электроны – электроны внешнего и предвнешнего энергетических подуровней. 39
Слайд 40
«Проскок» электрона Внешние оболочки с конфигурациями d 4 и d 9 нестабильны и стремятся перейти в устойчивые заполненные d 5 - и d 10 -конфигурации. 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 3 d 5 4 s 1 Cr «Проскок» электрона имеет место у Cr, Cu, Ag, Tl, Mo, Nb, Tc, Ru, Rh, Pt, и Au 40
Слайд 41
Периодический закон Д.И. Менделеева 1869 г, Д.И. Менделеев Свойства химических элементов, а также формы и свойства их соединений находятся в периодической зависимости от их атомного веса. Современная формулировка периодического закона С войства химических элементов, а также формы и свойства их соединений находятся в периодической зависимости от заряда ядра их атомов. Физический смысл периодического закона : свойства химических элементов периодически повторяются, потому что происходит периодическое изменение электронных конфигураций атомов. Периодичность – это повторяемость свойств химических и некоторых физических свойств у простых веществ и их соединений. 41
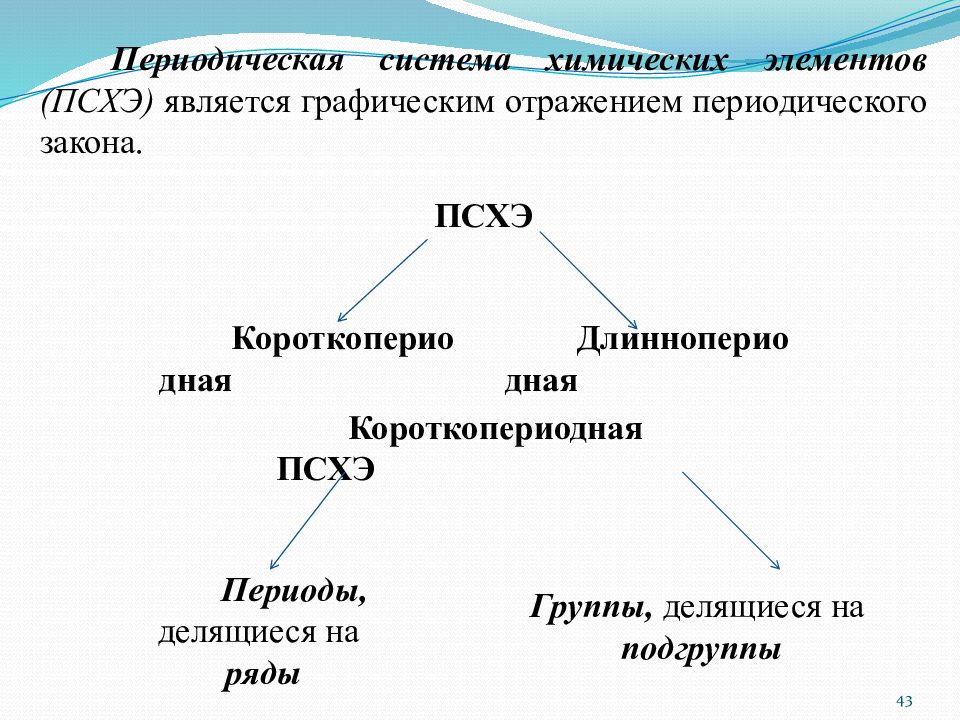
Слайд 43
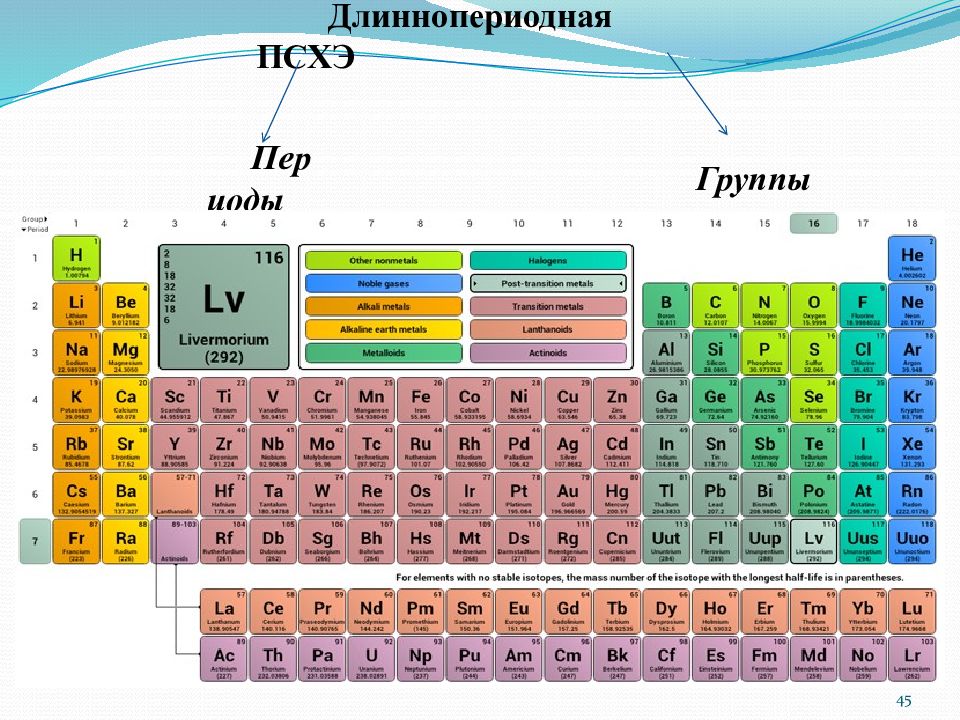
Периодическая система химических элементов (ПСХЭ) является графическим отражением периодического закона. ПСХЭ Короткопериодная Длиннопериодная Короткопериодная ПСХЭ Периоды, делящиеся на ряды Группы, делящиеся на подгруппы 43
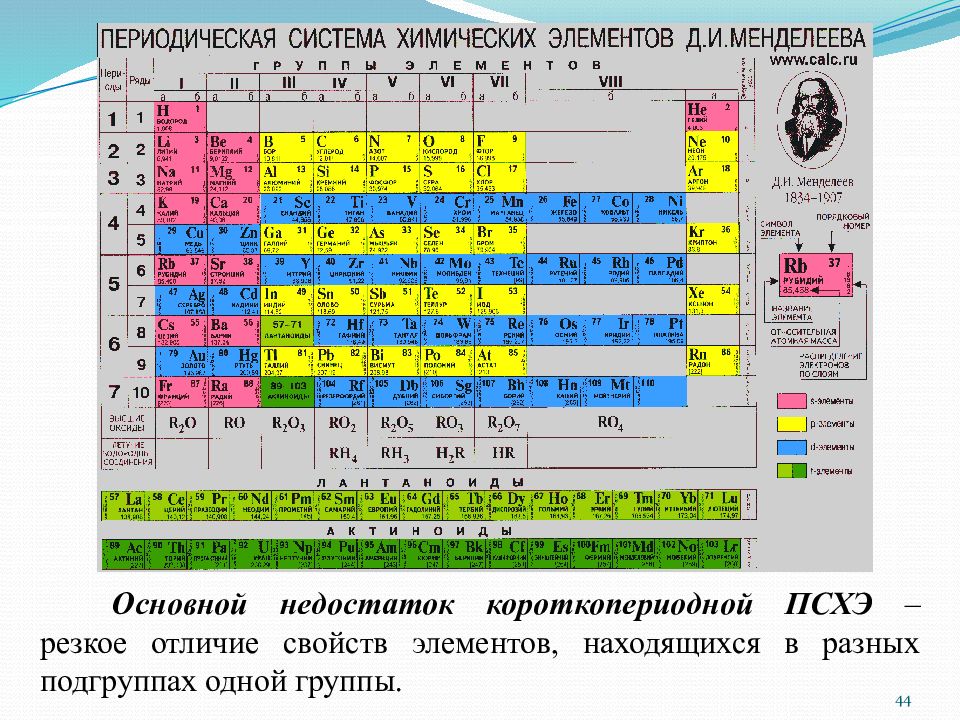
Слайд 44
Основной недостаток короткопериодной ПСХЭ – резкое отличие свойств элементов, находящихся в разных подгруппах одной группы. 44
Слайд 46
Периоды делятся на малые и большие. Периоды Физический смысл номера периода : номер периода указывает на число энергетических уровней атома и равен главному квантовому числу. Малые периоды – состоят из одного ряда и включают до 8 элементов ( I, II, III периоды ). Большие периоды – состоят из двух рядов и включают 18 и более элементов ( IV, V, VI, VII периоды ). Горизонтальная периодичность заключается в появлении максимальных и минимальных значений свойств простых веществ и соединений в пределах каждого периода. Период – горизонтальный ряд химических элементов, расположенных в порядке возрастания их порядкового номера, начиная со щелочного металла и заканчивая инертным газом. 46
Слайд 47
Группы Группа – вертикальный ряд элементов в ПСХЭ. Группа состоит из двух п одгрупп – главной (обозначается А ) и побочной (обозначается В ) Вертикальная периодичность заключается в повторяемости свойств простых веществ и соединений в группах. Физический смысл номера группы : номер группы указывает на число электронов, находящихся на внешнем и предвнешнем энергетических подуровнях. Для длиннопериодной системы : если № группы ≥13, то число валентных электронов равно № группы минус 10 Для короткопериодной системы: для элементов 1, 2 и 8 групп побочных подгрупп число валентных электронов нужно считать по таблице. Диагональная периодичность – повторяемость свойств простых веществ и соединений по диагоналям ПСХЭ. 47
Слайд 48
Свойства атомов Металличность – способность атомов отдавать электроны. Потенциал ионизации ( I ) – энергия, необходимая для отрыва наиболее слабо связанного с ядром электрона от атома. Неметалличность – способность атомов присоединять электроны. Сродство к электрону – энергия, которая выделяется при присоединении электрона к атому, молекуле или радикалу. [ I ] = эВ [ A ср ] = эВ Способность к отдаче электронов количественно определяется потенциалом ионизации. Способность к принятию электронов количественно определяется сродством к электрону. 48
Слайд 49
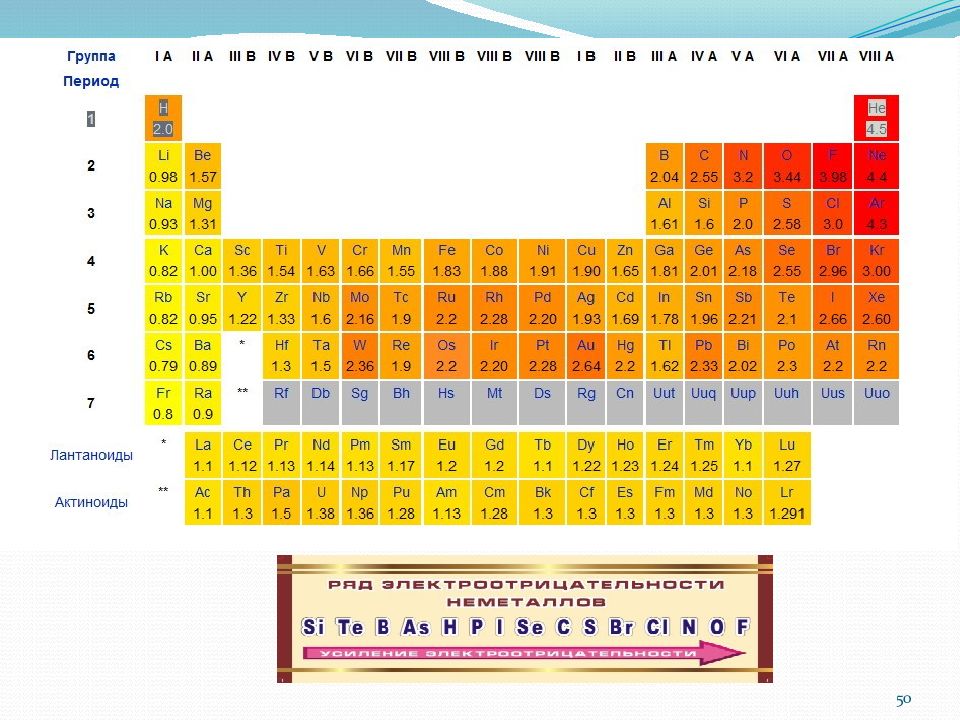
Электроотрицательность (ЭО) – способность атомов перетягивать на себя электронную плотность (валентные электроны и электронные пары). Упрощение – относим все значения к электроотрицательности лития Получаем 49
Слайд 51
Валентность Понятие валентность можно определить как свойство атомов и как величину. Как свойство атома валентность – это способность атомов химических элементов образовывать строго определенное число связей. К ак величина валентность атома равна числу неспаренных электронов атома в основном или возбужденном состоянии, участвующих в образовании общих электронных пар с электронами других атомов. Ч исло связей, образованных атомом в данном соединении, может быть больше, чем его валентность 51
Слайд 52
Правила определения валентности элементов I. Элементы с постоянной валентностью. 1. Элементы I, II, III групп длиннопериодной ( I - A и II - A, III - A групп короткопериодной) ПСХЭ. Их валентность определяется номером группы, в которой они располагаются. w = № группы 2. Водород всегда проявляет валентность I w ( H ) = I 3. Фтор в соединениях всегда проявляет валентность I. w ( F ) = I 4. Цинк всегда проявляет валентность II. w ( Zn ) = II 5. Валентность кислорода всегда равна II (кроме перекиси водорода Н 2 О 2 и некоторых других веществ). w (О) = II 52
Слайд 53
1. Для короткопериодной системы: максимальная валентность элемента совпадает с номером его группы. w max = № группы II. Элементы с переменной валентностью. Все остальные элементы, не вошедшие в пункт I, способны проявлять различную валентность. Но наивысшую (максимальную) валентность большинства элементов можно определить с помощью таблицы Менделеева: Исключения: фтор, азот, кислород, элементы 1, 2, 8 групп побочных подгрупп, благородные газы. w max ( F, O, N, эл - тов 1,2,8-Б-групп,благородных газов) ≠ № группы 53
Слайд 54
Степень окисления Степень окисления – условный заряд атома в молекуле, вычисленный в предположении, что все связи имеют ионный характер. В предположении, что разделение зарядов происходит на 100 %, степень окисления определяется целыми значениями: Cs + 1 F -1 Разделение зарядов в самом полярном соединении – фториде цезия – осуществляется только на 8 9 %. Cs +0,89 F -0,8 9 54
Слайд 55
Правила определения степени окисления элементов 1. Сумма, степеней окисления атомов в любой частице равна ее электрическому заряду. Следовательно, степень окисления элемента в его простом веществе равна нулю. СТ.ОК (элемента в простом веществе) = 0 2. С вязь между одинаковыми атомами не дает вклада в степень окисления. 3. Степень окисления элементов ( I - A и II - A, III - A групп короткопериодной) ПСХЭ постоянная и равна + w. СТ.ОК (элементов I, II, III групп) = + w 4. Цинк всегда проявляет степень окисления +2 СТОК( Zn ) = +2 5. Степень окисления водорода равна (+1) в соединениях с неметаллами и (-1) в соединениях с металлами ( K Н, СаН 2 ). СТОК( H ) = +1, -1 55
Слайд 56
7. В соединениях фтор всегда проявляет степень окисления минус 1. СТ.ОК( F ) = -1 6. Степень окисления кислорода в соединениях обычно равна минус 2 (кроме фторида кислорода O +2 F 2 и перекиси водорода Н 2 О -1 2 и некоторых других веществ). СТ.ОК(О) = -2 Все остальные элементы, способны проявлять различную степень окисления. Для ее определения существуют следующие правила: 8. Металлы никогда не проявляют отрицательную степень окисления. СТ.ОК(любого металла) ≥ 0 Исключения: висмут, теллур 56
Слайд 57
Минимальную степень окисления проявляют элементы, записывающиеся справа в бинарных соединениях. 10. Минимальная степень окисления (максимальная отрицательная СТ.ОК) элемента равна максимальной положительной степени окисления минус восемь. СТ.ОК min (почти всех элементов) = СТ.ОК max - 8 9. Максимальная положительная степень окисления элемента равна максимальной валентности. СТ.ОК max = + w max 57
Слайд 58
Периодическое изменение свойств атомов и их соединений по периодам и группам По группе сверху вниз : Радиус атома увеличивается. Прочность связи электронов с ядром уменьшается. Потенциал ионизации уменьшается. Сродство к электрону уменьшается. ЭО уменьшается. Металличность увеличивается. Неметалличность уменьшается. Восстановительные свойства увеличиваются. Окислительные свойства уменьшаются. 58
Слайд 59
По периоду слева направо: Окислительные свойства увеличиваются. Радиус атома уменьшается. Прочность связи электронов с ядром увеличивается. Потенциал ионизации увеличивается. Сродство к электрону увеличивается ЭО увеличивается. Металличность уменьшается. Неметалличность увеличивается Восстановительные свойства уменьшаются. 59