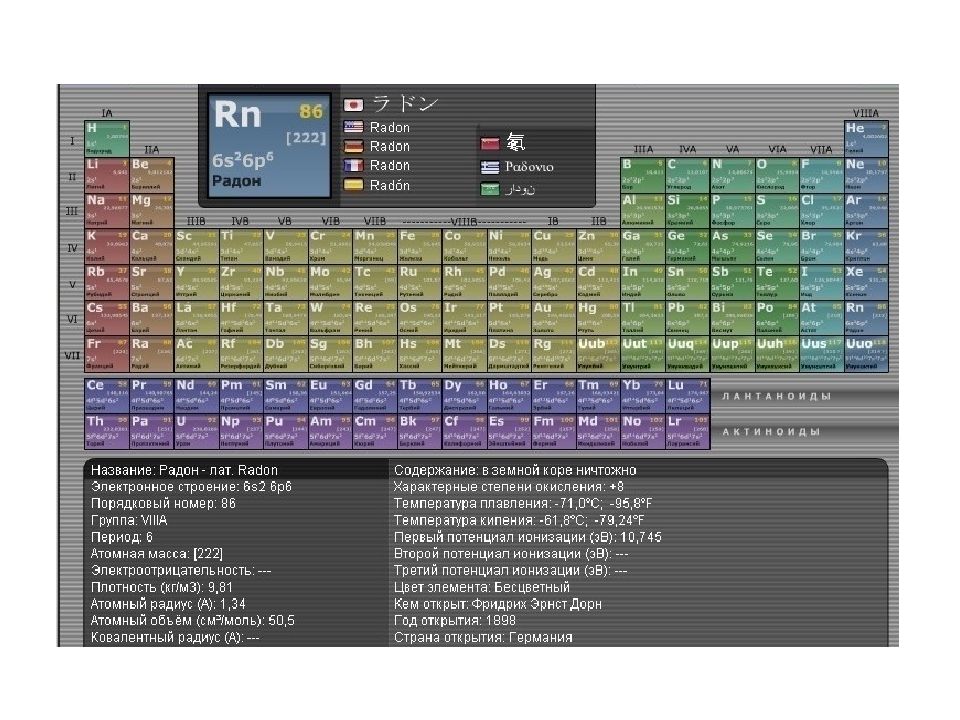
Слайд 3: Строение атома
Слайд 4: Основные понятия
Атом – сложная микросистема находящихся в движении элементарных частиц. Он состоит из положительно заряженного я д р а и отрицательно заряженных э л е к т р о н о в. В ядре атомов всех элементов, за исключением ядра легкого изотопа водорода, входят протоны и н е й т р о н ы. Химический элемент – вид атомов, характеризующихся определенным зарядом ядра.
Слайд 5: Введение
Долгое время в науке господствовало мнение, что атомы неделимы, т.е. не содержат более простых составных частей и ни при каких условиях атом одного элемента не может превращаться в атом другого. Однако ряд открытий сделанных на рубеже lXX -XX в.в. свидетельствует о сложном строении атома.
Слайд 6: Важнейшие открытия
Доказательства сложности строения атома 1.Открытие рентгеновских лучей(1895г., К.Рентген) 2.Открытие катодных лучей(1897г. Дж. Томсон) 3. Открытие радиоактивности(1896г., А. Беккерель) и ее изучение (1897-1903г.г., супруги М. Склодовская-Кюри и П. Кюри) 4. Открытие фотоэффекта (1888-1890гг. А.Г. Столетов) 5. Открытие – электрона (1897г., Томпсон)
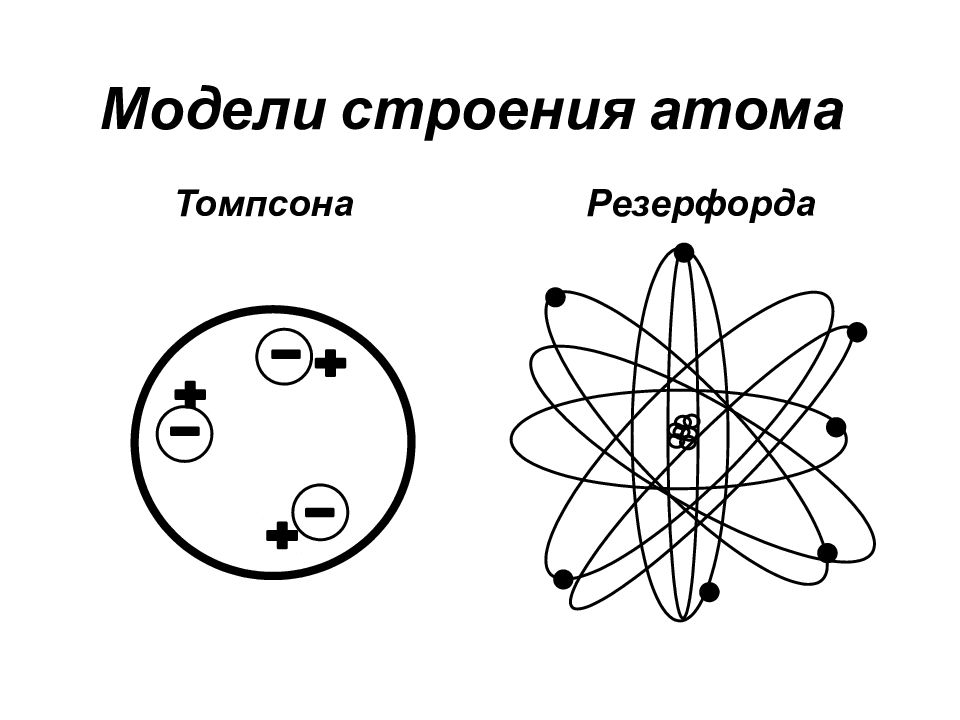
Слайд 7: Модели строения атома
Модель пудинга(1902-1904 г.г., В Кельвин, Дж. Томпсон) Планетарная модель (1907 г., Э.Резерфорд) Модель Р.Бора (1913 г.)
Слайд 9: Планетарная модель
1911 г. Э.Резерфорд ( планетарная модель строения атома) Достоинства: доступность, наглядность Суть: в центре атома – положительно заряженное ядро и вращающиеся вокруг него отрицательно заряженные электроны. ē +
Слайд 10: Теория Резерфорда
В 1911 г. Э.Резерфорд предложил первую научную теорию строения атома. Сущность теории: Атом состоит из + заряженного ядра, в котором сосредоточена основная часть массы атома и вращающихся вокруг него электронов. + заряд ядра нейтрализуется суммарным – зарядом электронов. В целом атом электронейтрален. Возникающая вследствие вращения ē центробежная сила уравновешивается электростатической силой притяжения ē к + ядру. Заряд ядра численно равен порядковому номеру № элемента. (Из электронейтральности атома следует, что число ē = № элемента). Достоинства теории – доступность, наглядность. Недостатки – 1 ) при движении излучается энергия, что привело бы к потере энергии и падению на ядро, чего в действительности не происходит, 2 ) при движении должен бы излучаться сплошной спектр, а в действительности спектр линейчатый.
Слайд 11: Сведения о некоторых элементарных частицах
Частица Символ Масса покоя кг Масса покоя относительная Заряд, Кл Протон p⁺ 1,673 · 10 ⁻²⁷ 1,007276 1,602 · 10 ⁻¹⁹ Нейтрон n⁰ 1,675 · 10 ⁻²⁷ 1,008665 0 Электрон ē 9,109 · 10 ⁻³¹ 0,000549 1,602 · 10 ⁻¹⁹
Слайд 12: Строение ядра а тома
Ядро р ⁺ 1836,12 (нуклоны) n⁰ 1838,65 Электрон (е):элементарный электрический заряд – 1,602∙10- ¹ ⁹Кл.; масса электрона- 9,110∙10¯³¹кг. Диаметр ядра – 10¯¹⁵-10¯¹⁴м А= Z+N Атомная единица массы( а.е.м.) равна 1,6606∙10¯²⁷ кг.
Слайд 13: Изотопы, изобары, изотоны ( определения )
Изотопы Изобары Изотоны Атомы элементов, имеющие одинаковое количество протонов, но разное количество нейтронов.( Атомы одного и того же элемента.) Атомы элементов, имеющие одинаковую атомную массу, но разное количество протонов. ( Атомы разных элементов.) Атомы элементов, имеющие одинаковое количество нейтронов.( Атомы разных элементов.)
Слайд 14: Изотопы, изобары, изотоны ( Примеры )
Изотопы 20 ⁴⁰ Са 20 ⁴ ²Са 20 ⁴³ Ca ( 20р 20 n ) ( 20p 22n ) ( 20p 23n ) Изобары 18 ⁴⁰А r 19 ⁴⁰K 20 ⁴⁰ Ca ( 18p 22n ) ( 19p 21n ) ( 20p 20n ) Изотоны 54 ¹³ ⁶ Xe 56 ¹³⁸ Ba 57 ¹³⁹ La ( 54p 82n ) ( 56p 82n ) ( 57p 82n )
Слайд 15
В дальнейшем изучение строения атома основывалось на квантовой теории света Планка. В 1900 г. М.Планк показал, что способность нагретого тела к лучеиспусканию можно количественно описать, предположив, что лучистая энергия испускается телами не непрерывно, а дискретно,т.е. отдельными порциями – квантами. При этом энергия Е каждой порции связана с ν частотой излучения соотношением, получившим название уравнения Планка. Е = h ν h – коэффициент пропорциональности(постоянная Планка = 6,626 ∙10⁻³⁴ Дж∙с)
Слайд 16: Уравнение Планка
1900 г. Е = h∙ ν Е – энергия кванта h – коэффициент пропорциональности (постоянная Планка) =6,626∙10-³⁴ Дж∙с ν – частота излучения Это уравнение выражает корпускулярные свойства фотона
Слайд 17
В 1924 г. Де Бройль предположил, что корпускулярно – волновой дуализм присущ не только фотонам, но и ē λ = h / m ν, Что значит, частице с массой m и движущейся со скоростью V – присуща длина волны = λ ē движется быстро и его движение описывается как движение волны (смысл дуализма). Через несколько лет после предположения де Бройля волновые свойства ē были подтверждены опытами (интерференция, дифракция).
Слайд 18: Уравнение де Бройля
1924 г. λ = h/m∙v Это означает, частице с массой ( m ) движущейся со скоростью ( v ), присуща длина волны равная ( λ ) ē (частица) движется быстро и его движение описывается как движение волны -( смысл дуализма)
Слайд 19: Уравнение Эйнштейна
Фотон обладает массой (А. Эйнштейн) Е= m с² Из двух последних уравнений следует mc²= ( h∙c ) / λ откуда λ =h/mc С – скорость света(3∙10⁸ м / с) h - универсальная постоянная Планка(6,63∙10¯³⁴ Дж∙с)
Слайд 20: Принцип неопределенности Гейзенберга
1925-27 г.г. ∆ X ∆ Px ≥ h X,У, Z -координата частицы ∆ У ∆ Р у ≥ h P=m ∙v ( скорость или импульс) ∆ Z ∆ P z ≥ h Отсюда следует, что при точном определении координаты Х микрочастицы исчезает информация об ее импульсе, ∆ Рх так как при Х=0 величина ∆ Рх → ∞ ∆ q ∆V ≥ h/m
Слайд 21: Квантовая механика
Создание квантовой (волновой) механики произошло на пути обобщения представления о корпускулярно – волновой двойственности фотона на все обьекты микромира и, прежде всего, на ē. Корпускулярные свойства фотона выражаются уравнением Планка Е = h ν Волновые же свойства фотона выражены λν =с, где λ – длина волны, ν – частота колебаний, с – скорость распространения.
Слайд 22: Постулаты Бора
1913 г. Н.Бор, основываясь на модели Резерфорда и исследованиях М.Планка предложил свою теорию в виде трех постулатов: Электрон может вращаться вокруг ядра не по любым, а строго определенным круговым орбитам, которые называются стационарными. Двигаясь по стационарной орбите, электрон энергии не излучает. Излучение происходит при скачкообразном переходе электрона с одной стационарной орбиты на другую. При этом испускается или поглощается квант электромагнитного излучения. Е=Ев – Есв. Принимая во внимание постулат Планка Е= h ν Получим h ν = Ев – Есв ν = (Ев – Есв) / h
Слайд 23: Достоинства и противоречия теории Н.Бора
Достоинства – теория Бора не только объяснила физическую природу атомных спектров, как результата перехода атомных электронов с одних стационарных орбит на другие, но и впервые позволила рассчитывать спектры. Противоречия – постулаты Бора находились в резком противоречии с положениями классической физики. С точки зрения классической механики ē может вращаться по любым орбитам, а классическая электродинамика не допускает движения заряженной частицы по круговой орбите без излучения. Оставался неясным вопрос, где находится ē в процессе перехода с одной орбиты на другую?
Слайд 24: Достоинства и противоречия теории Н.Бора (продолжение)
Из теории относительности следует, что ни один физический процесс не может распространяться со скоростью, превышающей скорость света, поэтому переход электрона на новую орбиту, отделенную некоторым расстоянием от исходной, не совершается мгновенно, а длится некоторое время. В течение этого времени ē должен находиться где-то между орбитами. Но как раз такие промежуточные состояния запрещены теорией. Эта теория не могла объяснить и причину различной интенсивности линий в атомном спектре атома водорода.
Слайд 25: Значение теории Бора
Все же теория Бора была важным этапом в развитии представлений о строении атома. Она показала, что нельзя автоматически переносить законы природы справедливые для больших объектов макромира, на ничтожно малые объекты микромира (атомы, электроны, фотоны), поэтому и возникла задача разработки новой теории для описания свойств и поведения объектов микромира. Эта задача была решена в 20-х годах ХХ- века, после возникновения и развития новой отрасли теоретической физики – квантовой или волновой механики.
Слайд 26
Дальнейшее изучение строения атома происходит на основе изучения видимой части спектра атома водорода
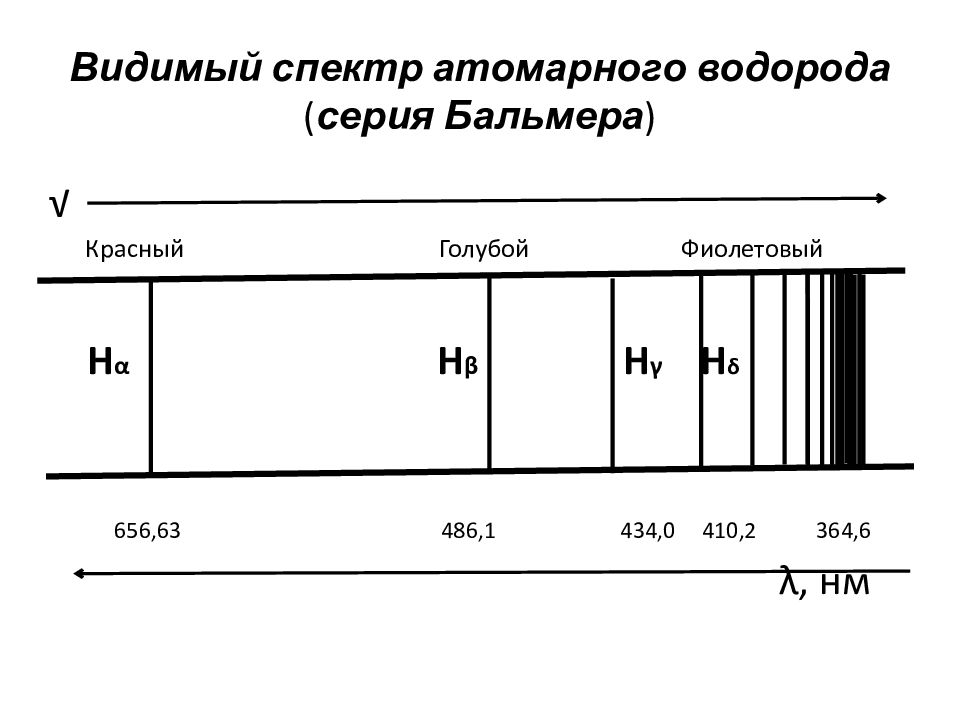
Слайд 27: Видимый спектр атомарного водорода ( серия Бальмера )
√ Красный Голубой Фиолетовый H α H β H γ H δ 656,63 486,1 434,0 410,2 364,6 λ, нм
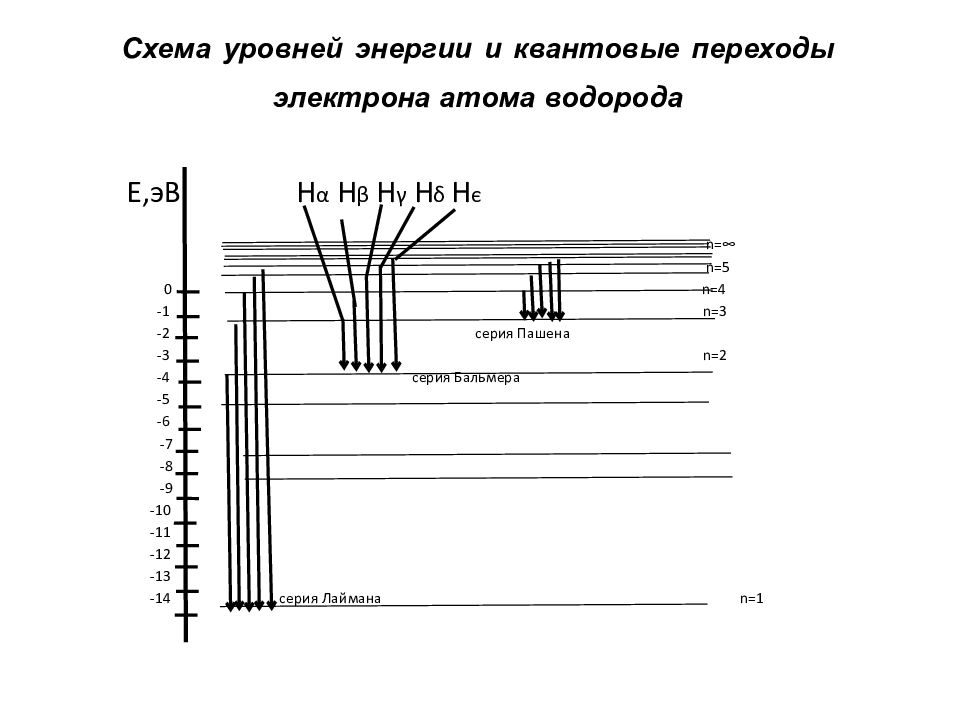
Слайд 28: Схема уровней энергии и квантовые переходы электрона атома водорода
Е,эВ Н α Н β Н γ Н δ Н є n=∞ n=5 0 n=4 -1 n=3 -2 серия Пашена -3 n=2 -4 серия Бальмера -5 -6 -7 -8 -9 -10 -11 -12 -13 -14 серия Лаймана n=1
Слайд 29: Формула Бальмера-Ритца
1885 г. ν = R∞(1/2²-1/n²), где ν - волновое число = 1/ λ ( λ -длина волны) R ∞-постоянная Ридберга(109737 см⁻¹) n- целое число >2 ν = R∞(1/n₁²-1/n₂²), где n =1 ультрафиолетовая часть c пектра n =2 видимая часть спектра n =3 инфракрасная часть спектра
Слайд 30: Атомная (электронная) орбиталь
Орбиталь – это область наиболее вероятного нахождения электрона
Слайд 32: Электронное облако ( Орбиталь )
Электронная орбиталь – область наиболее вероятного нахождения электрона. Орбиталь (АО) – обладает четырьмя степенями свободы (характеристиками): размером, формой, ориентацией в пространстве
Слайд 33: Главное квантовое число
1.Главное к.ч. ( n ) Энергетический уровень. (размер орбитали ) ē в атоме может находиться лишь в определенных квантовых состояниях: Е=-2 π ² m е⁴/ n ² h ² или Е= -13,6·1/ n² эВ, где n – любое целое число от1 до ∞ n= 1, 2, 3, 4 …,∞ Е₁ - основное состояние Е₂, Е₃, Е₄…- возбужденные состояния Квант – 1.89 эВ ( с Е₂ на Е₃)
Слайд 34: Энергетический уровень
Согласно условиям квантования электрон в атоме может находиться лишь в определенных квантовых состояниях, соответствующих определенным значениям его энергии связи с ядром. E= (2 π² me⁴)/(n²h²) ИЛИ E= - 13,6· 1/n²· э B где m –масса электрона; e – его заряд; h – постоянная Планка; n – любое целое число от 1 до ∞, называемое главным квантовым числом; n =1,2,3,…∞
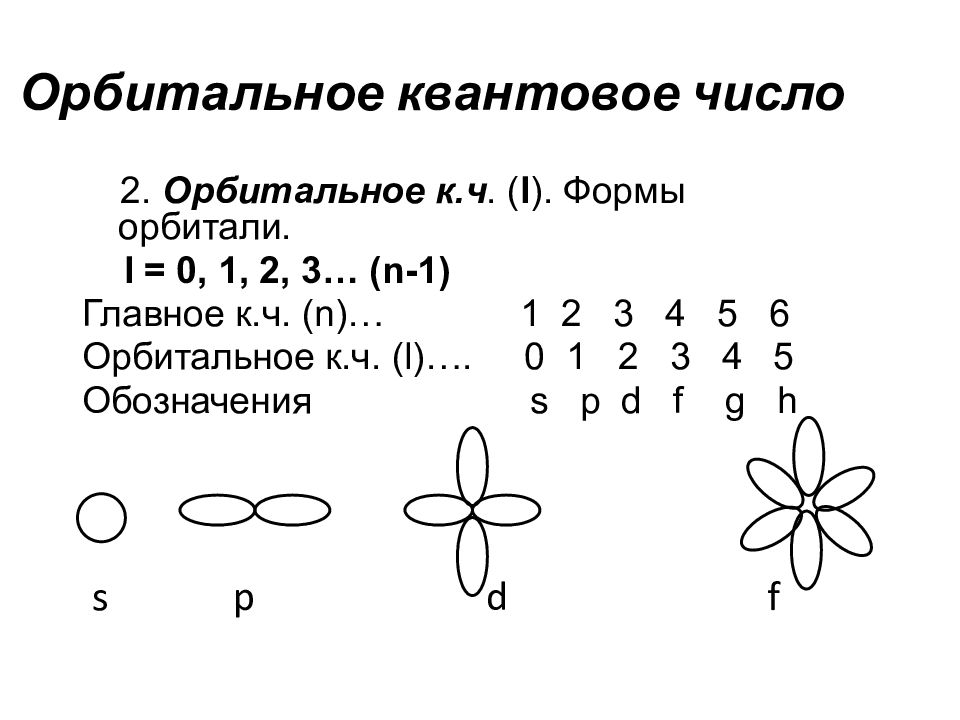
Слайд 35: Орбитальное квантовое число
2. Орбитальное к.ч. ( l ). Формы орбитали. l = 0, 1, 2, 3… ( n-1 ) Главное к.ч. ( n )… 1 2 3 4 5 6 Орбитальное к.ч. (l) …. 0 1 2 3 4 5 Обозначения s p d f g h s p d f
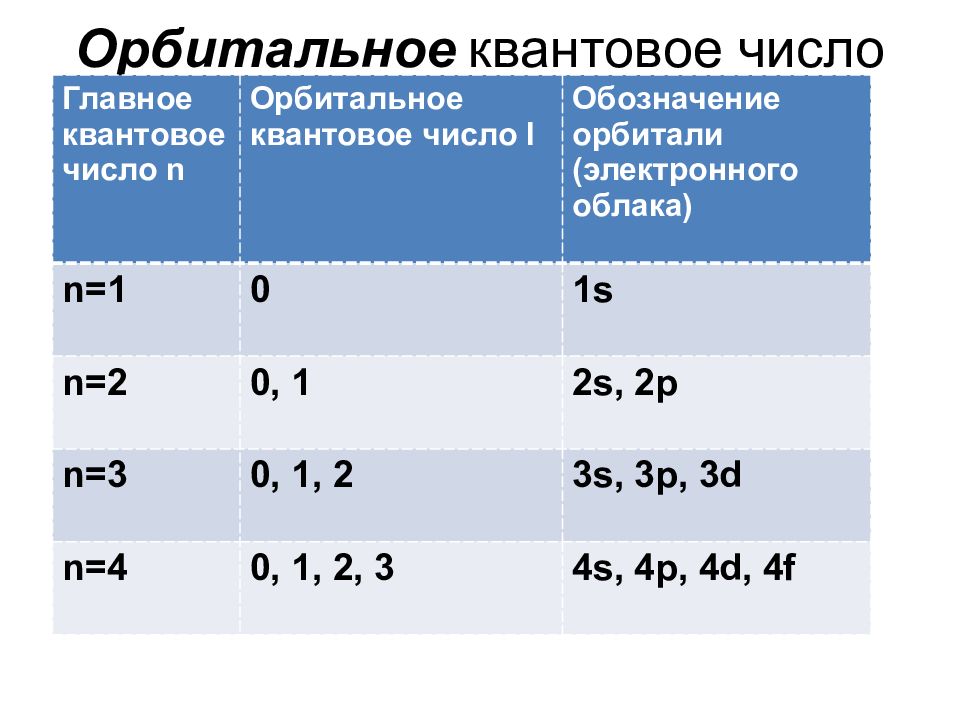
Слайд 36: Орбитальное квантовое число
Главное квантовое число n Орбитальное квантовое число l Обозначение орбитали (электронного облака) n=1 0 1s n=2 0, 1 2s, 2p n=3 0, 1, 2 3s, 3p, 3d n=4 0, 1, 2, 3 4s, 4p, 4d, 4f
Слайд 37: Магнитное квантовое число
3.Магнитное к.ч. ( m ı ) Пространственная ориентация орбитали. Значения: 0,±1,±2,±3…± l Число значений m l = (2l+1) электронная ячейка (АО) (1,2,3 квантовые числа)
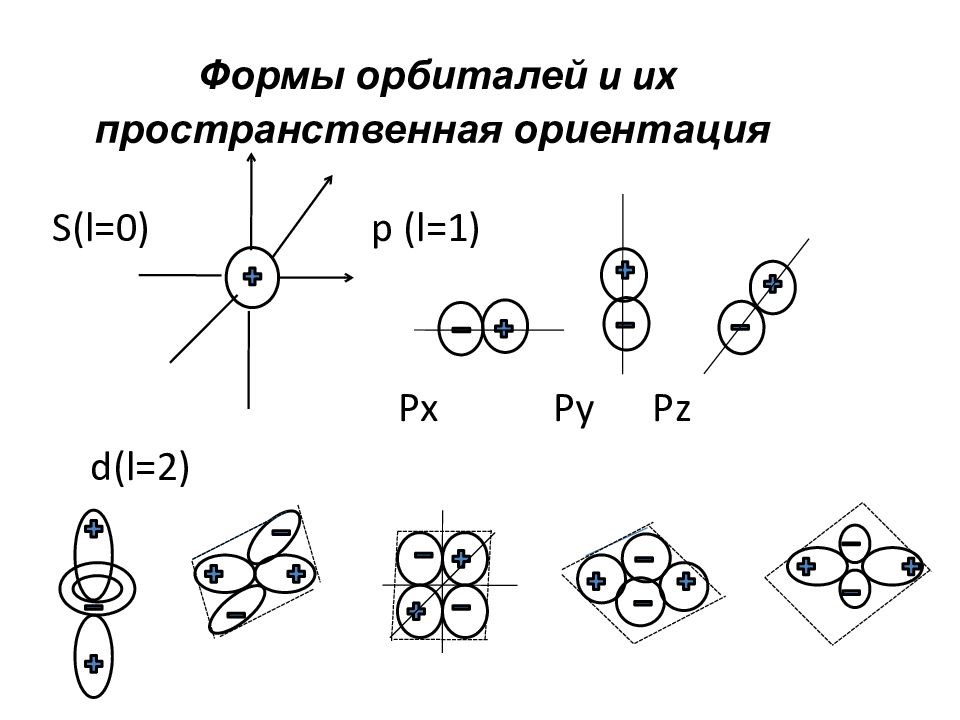
Слайд 38: Формы орбиталей и их пространственная ориентация
S(l=0) p (l=1) Px Py Pz d(l= 2)
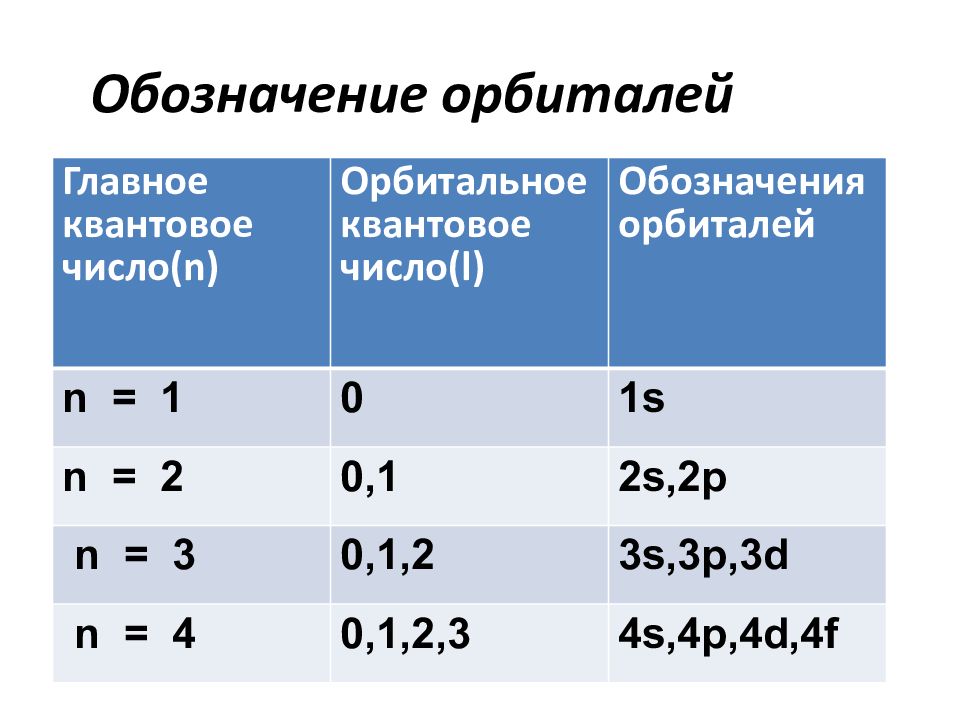
Слайд 39: Обозначение орбиталей
Главное квантовое число( n ) Орбитальное квантовое число( l ) Обозначения орбиталей n = 1 0 1s n = 2 0,1 2s,2p n = 3 0,1,2 3s,3p,3d n = 4 0,1,2,3 4s,4p,4d,4f
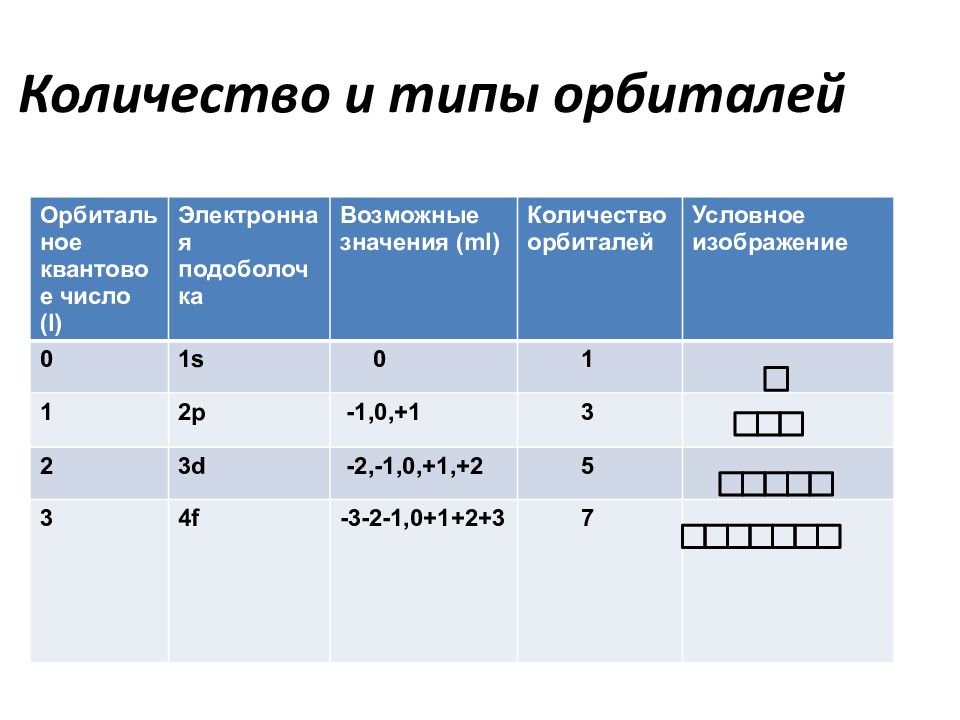
Слайд 40: Количество и типы орбиталей
Орбитальное квантовое число ( l ) Электронная подоболочка Возможные значения (ml) Количество орбиталей Условное изображение 0 1s 0 1 1 2p -1,0,+1 3 2 3d -2,-1,0,+1,+2 5 3 4f -3-2-1,0+1+2+3 7
Слайд 41: Спин ( спиновое квантовое число )
4. Спиновое к.ч. Спин ( mș ) Принимает значения ± ½ + ½ - ½ АО
Слайд 42: Принцип минимальной энергии
Принцип наименьшей энергии отражает стремление любого атома находиться в основном (невозбужденном ) состоянии. В связи с этим электрон в атоме всегда старается занять наиболее низкий уровень, т.е. подуровень с наименьшим значением энергии. Поэтому заполнение электронами подуровней внутри данного энергетического уровня происходит в следующей последовательности: ns¹ ¯ ² → np¹ ¯⁶ → nd ¹ ¯ ¹ ⁰ → nf ¹ ¯ ¹ ⁴
Слайд 43: Принцип Паули
1925 г. В атоме не может быть двух электронов, имеющих одинаковый набор всех четырех квантовых чисел. Следствия: 1.На одной орбитали только 2 ē +1/2 и -1/2 S – 2ē, p- 6ē, d-10ē, f- 14ē 2.Число орбиталей уровня = n², то емкость уровня составляет 2 n ² 2( n =1) 8( n =2) 18( n =3) 32( n =4) и т.д.
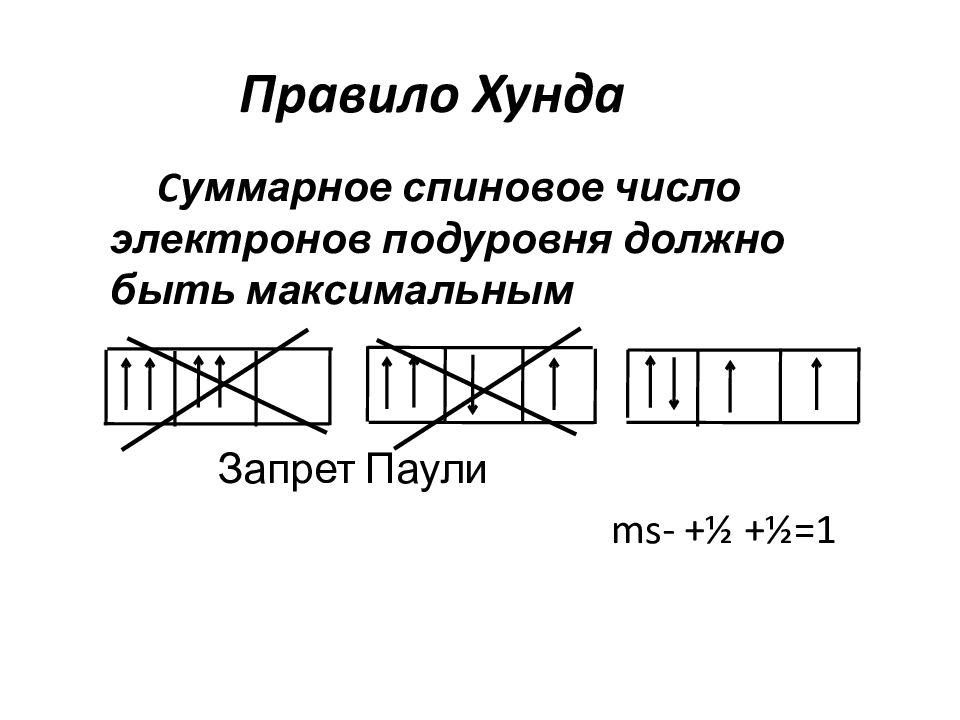
Слайд 44: Правило Хунда
C уммарное спиновое число электронов подуровня должно быть максимальным Запрет Паули ms- +½ +½=1
Слайд 45: Правило Клечковского
Заполнение энергетических подуровней происходит в порядке возрастания суммы ( n+l ); при равенстве значений суммы( n+l ) вначале заполняется подуровень с меньшим значением главного квантового числа( n ) 3d 4s 3d 4p 5s n+l 3+2=5 4+0=4 3+2=5 4+1=5 5+0=5 4 s 3 d 3 d 4 p 5 s
Слайд 46: Ряд Клечковского
1s²<2s²<2p⁶<3s²<3p⁶<4s²≈3d¹⁰<4p⁶<5s²≈4d¹⁰< <5p⁶<6s²≈5d¹≈4f¹⁴≈5d⁹<6p⁶<7s²≈6d¹≈5f¹⁴≈6d …
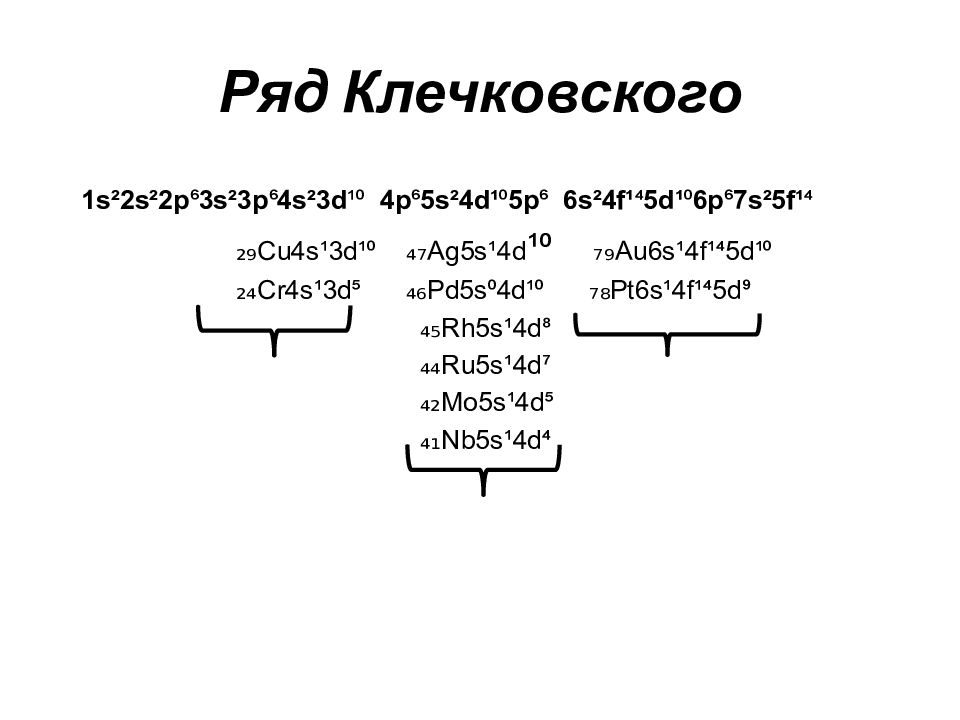
Слайд 47: Ряд Клечковского
1s²2s²2p ⁶ 3s²3p ⁶ 4s²3d ¹⁰ 4p ⁶ 5s²4d¹ ⁰ 5p ⁶ 6s²4f¹ ⁴ 5d¹ ⁰ 6p ⁶ 7s²5f¹ ⁴ ₂₉Cu4s¹3d¹⁰ ₄₇Ag5s¹4d ¹⁰ ₇₉ Au6s¹4f¹⁴5d¹⁰ ₂₄Cr4s¹3d⁵ ₄₆Pd5s⁰4d¹⁰ ₇₈Pt6s¹4f¹⁴5d⁹ ₄₅Rh5s¹4d⁸ ₄₄Ru5s¹4d⁷ ₄₂Mo5s¹4d⁵ ₄₁Nb5s¹4d⁴
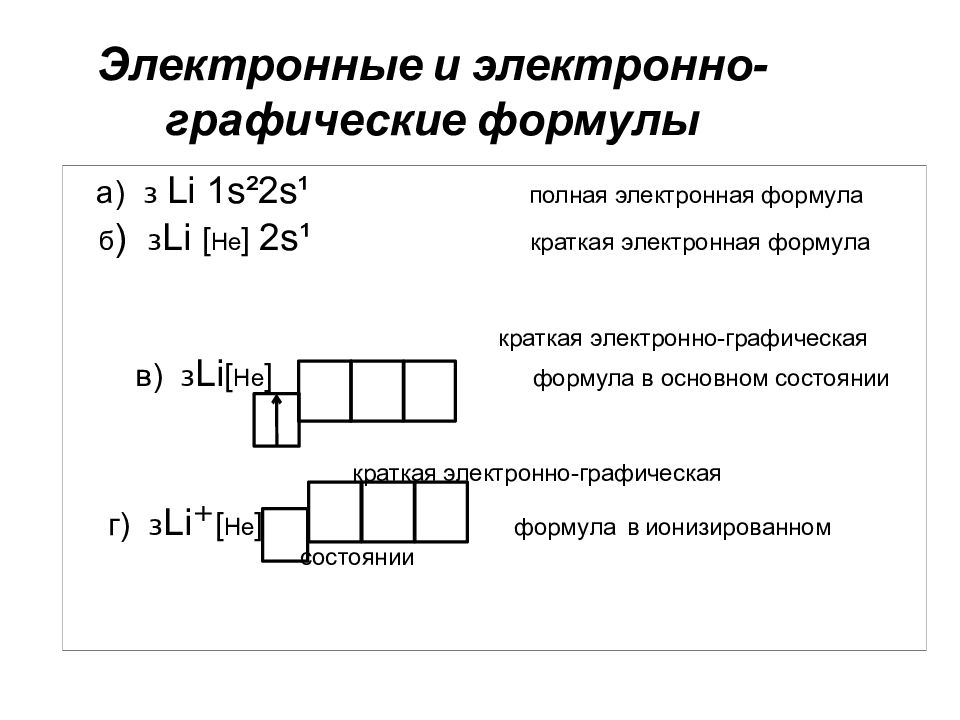
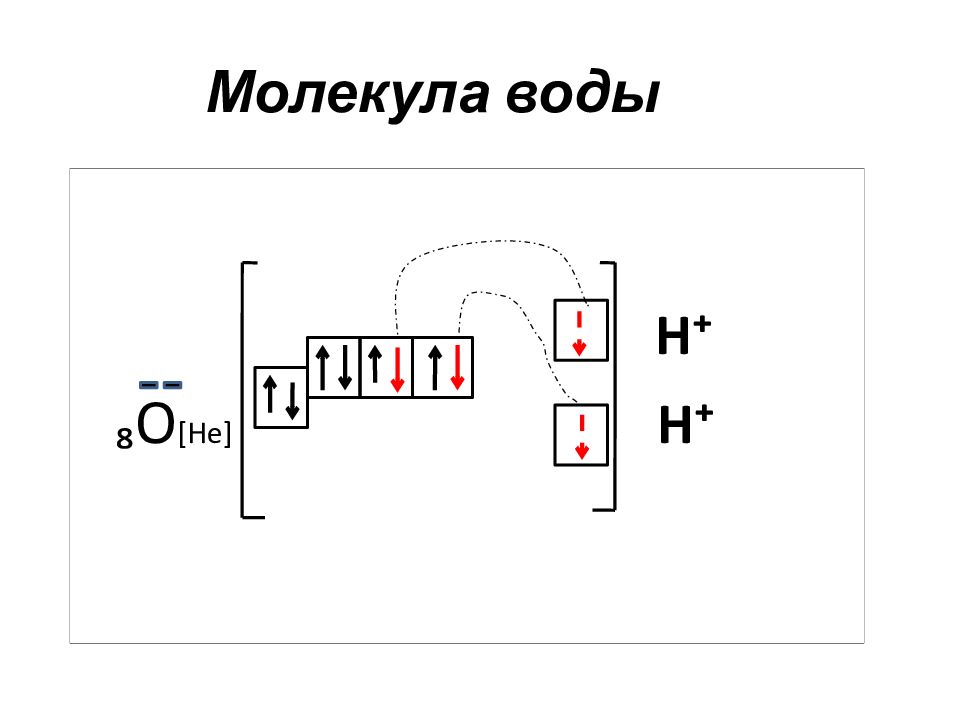
Слайд 48: Электронные и электронно-графические формулы
а) ₃ Li 1s²2s¹ полная электронная формула б ) ₃Li [ He ] 2s¹ краткая электронная формула краткая электронно-графическая в) ₃Li [ He ] формула в основном состоянии краткая электронно-графическая г) ₃Li ⁺ [ He ] формула в ионизированном состоянии
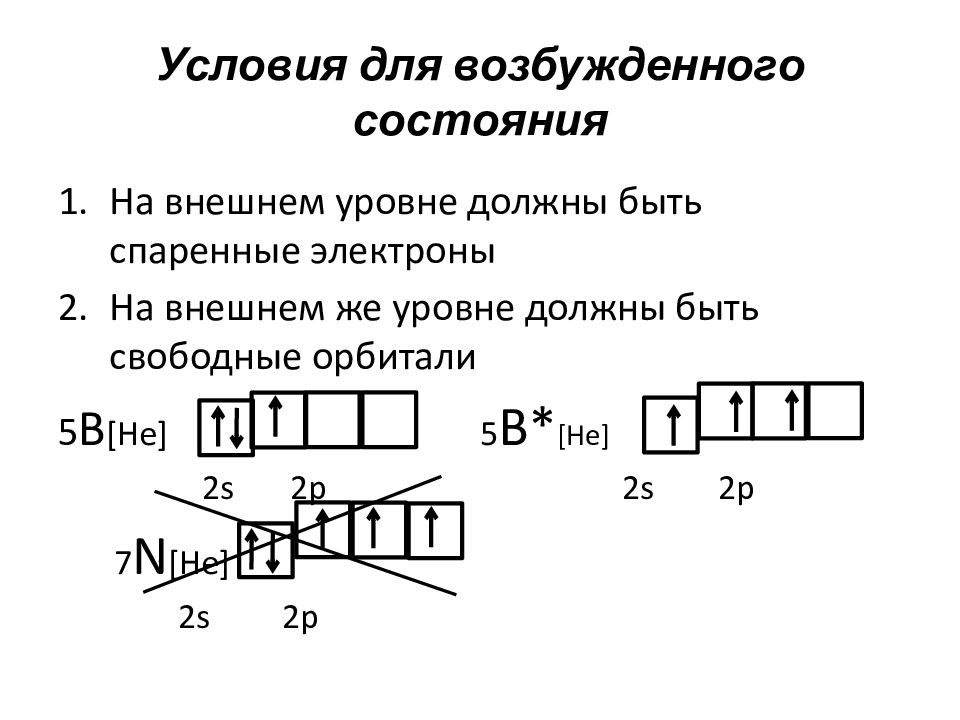
Слайд 49: Условия для возбужденного состояния
На внешнем уровне должны быть спаренные электроны На внешнем же уровне должны быть свободные орбитали 5 В [He] 5 B* [He] 2s 2p 2s 2p 7 N [He] 2s 2p
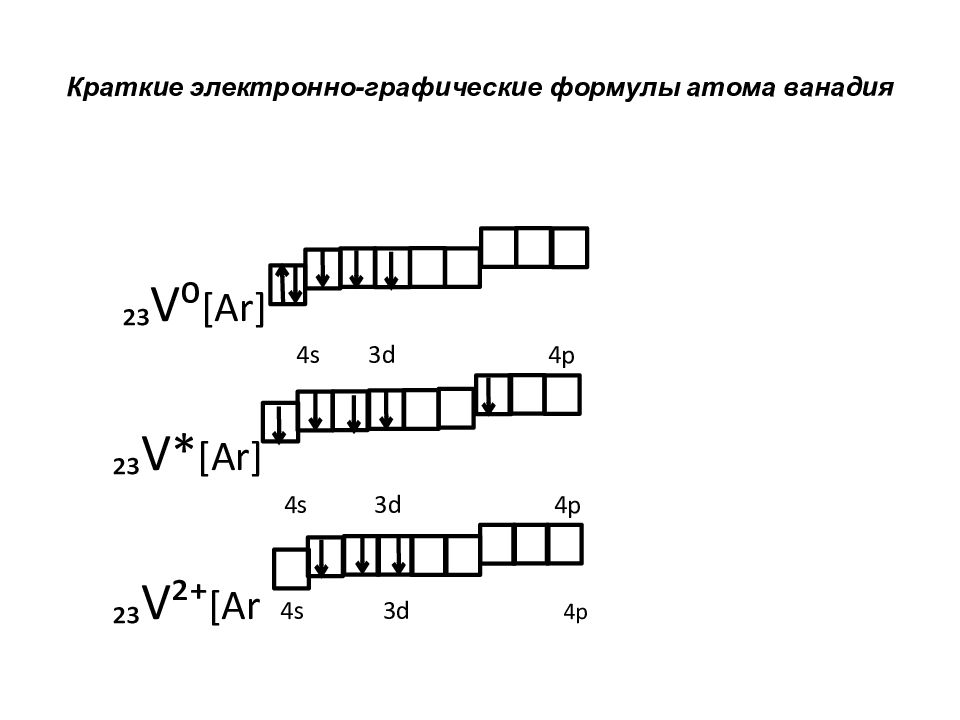
Слайд 51: Краткие электронно-графические формулы атома ванадия
₂₃ V⁰ [Ar] 4s 3d 4p ₂₃ V* [Ar] 4s 3d 4p ₂₃ V²⁺ [Ar 4s 3d 4p
Слайд 53: Периодический закон
Это была самая первая формулировка всемирно известного Периодического закона, окончательная редакция которого вышла в 1869-1870 годах. 6 марта 1869 года на заседании Русского физико-химического общества профессор Н. А. Меншуткин прочитал доклад Менделеева "Опыт системы элементов, основанной на их атомном весе и химическом сродстве".
Слайд 54: Периодический закон
Март 1869 г. Свойства простых тел, также формы и свойства соединений элементов находятся в периодической зависимости от атомных весов элементов. Свойства элементов и их соединений находятся в периодической зависимости от заряда ядра атома или порядкового номера элемента.
Слайд 55
Периодический закон Д.И. Менделеева в настоящее время формулируется так: Свойства химических элементов, а также формы и свойства их соединений находятся в периодической зависимости от заряда ядер атомов этих элементов. Периодические изменения свойств химических элементов обусловлены правильным повторением электронной конфигурации внешнего энергетического уровня (валентных электронов) их атомов с увеличением заряда ядра. Графическим изображением периодического закона является периодическая таблица.
Слайд 56: Закон Мозли
В 1913 г. Г.Мозли подтвердил опыты Э.Резерфорда, установив связь между длинами волн определенных линий рентгеновского спектра элемента и его порядковым номером.
Слайд 57: Закон Мозли
Корень квадратный из волнового числа определенной линии характеристического рентгеновского спектра элемента есть линейная функция заряда ядра, или, что то же, порядкового номера элемента. γ = А( Z-b ), где γ - волновое число А – коэффициент пропорциональности Z – порядковый номер элемента b - константа, зависящая от серии линий спектра.
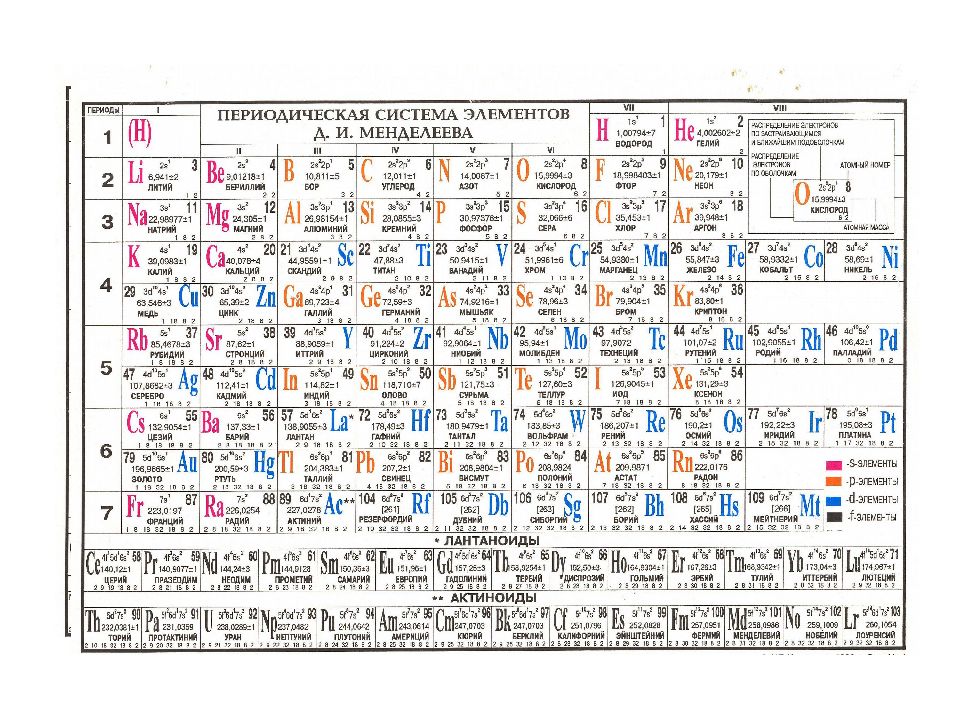
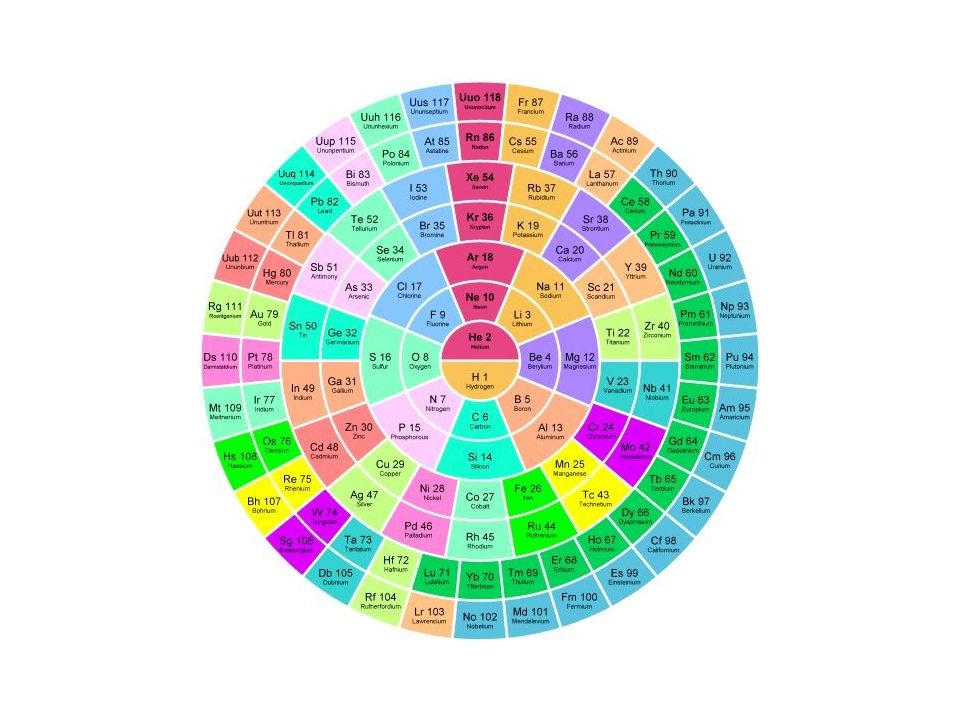
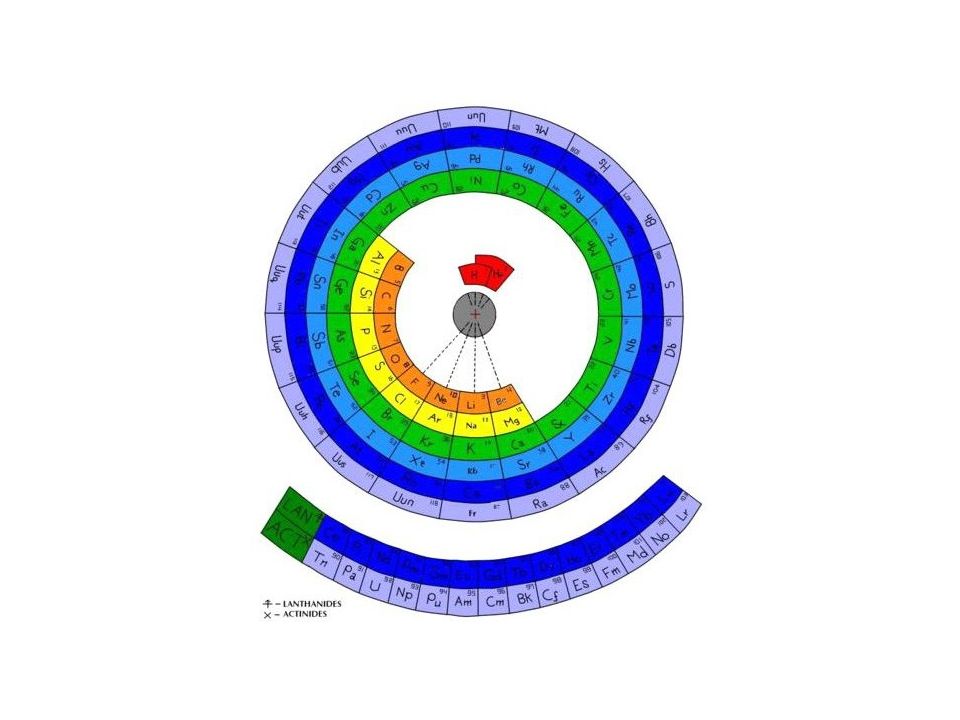
Слайд 58: Периодическая система
Графическим отображением периодического закона является периодическая система элементов Существует около 400 вариантов периодической системы, наиболее распространены клеточные варианты, а из них восьми-, восемнадцати- и тридцатидвухклеточные, соответствующие емкости слоев.
Слайд 68: Структура таблицы
Таблица имеет 7 периодов (горизонтальные ряды) расположение элементов в порядке возрастания заряда ядра. № периода = главному квантовому числу ( n ). № периода указывает: На количество электронных уровней; На количество подуровней во внешнем уровне.
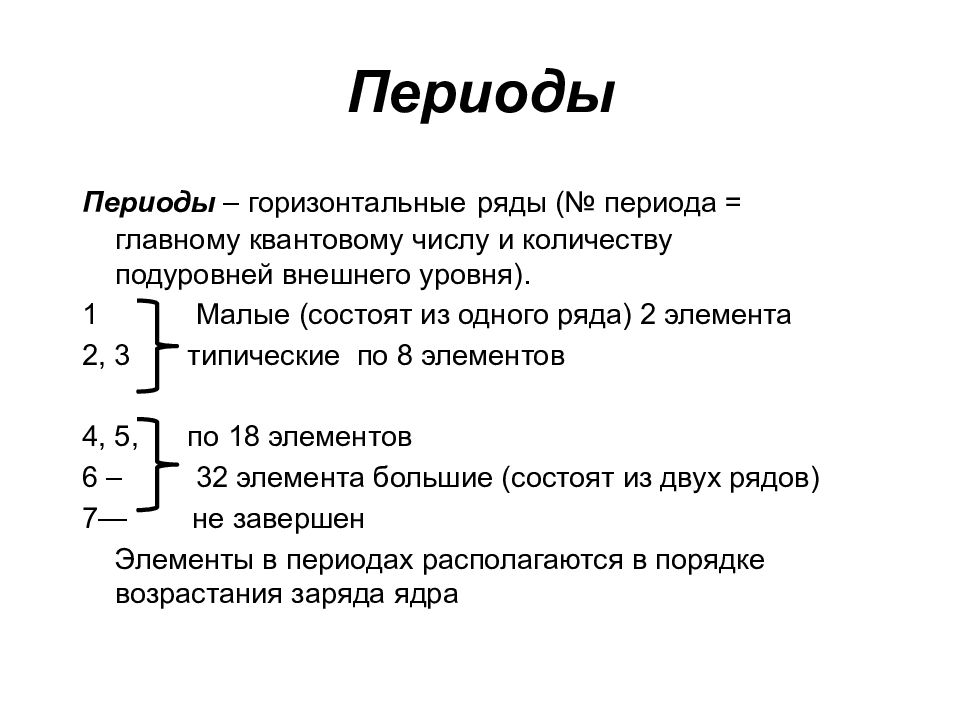
Слайд 69: Периоды
Периоды – горизонтальные ряды (№ периода = главному квантовому числу и количеству подуровней внешнего уровня). 1 Малые (состоят из одного ряда) 2 элемента 2, 3 типические по 8 элементов 4, 5, по 18 элементов 6 – 32 элемента большие (состоят из двух рядов) 7— не завершен Элементы в периодах располагаются в порядке возрастания заряда ядра
Слайд 70: Периоды
Каждый период (1 – й искл.) начинается щелочным металлом(типичный восстановитель ) и заканчивается галогеном ( типичный окислитель ). Последующий период от предыдущего отделяет инертный газ. Физический смысл периода – периодическое повторение свойств элементов и их соединений. Вывод : В периоде слева направо возрастают окислительные (неметаллические) свойства элементов и уменьшаются восстановительные (металлические). Исключение: инертные газы.
Слайд 71: Группы
Таблица состоит из восьми групп ( вертикальные графы). Каждая группа состоит из главной (А) и побочной (В) за исключением Vlll, которая состоит из трех побочных – триады- ( Fe, Co, Ni; Ru, Rh, Pd; Os, Ir, Pt ). Физический смысл номера группы – количество электронов на внешнем уровне (максимальная валентность, максимальная с.о., максимальное число химических связей).
Слайд 72: Правило октета
В химических реакциях атомы элементов завершают свою электронную оболочку до восьми электронов (октет) (исключение – 1-й период)
Слайд 73: Семейства
S- элементы l-ll (А) групп P - элементы lll-Vlll (А) групп d - элементы l-Vlll (В) групп f - лантаноиды, актиноиды.
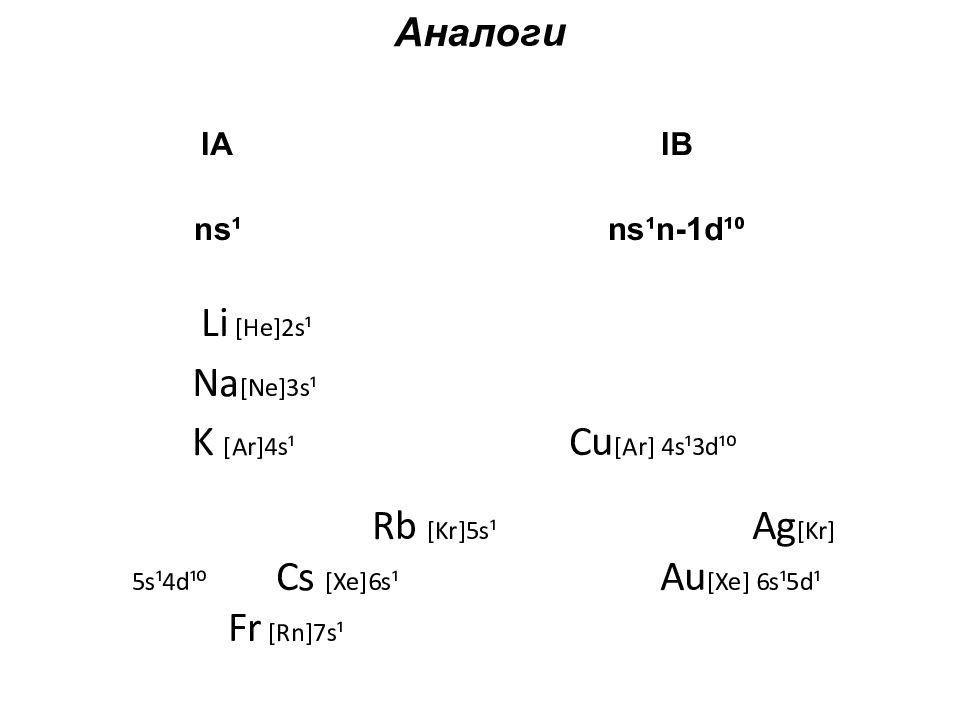
Слайд 74: Аналоги
l А l В ns¹ ns¹n-1d¹⁰ Li [He]2s¹ Na [Ne]3s¹ K [Ar]4s¹ Cu [Ar] 4s¹3d¹⁰ Rb [Kr]5s¹ Ag [Kr] 5s¹4d¹⁰ Cs [Xe]6s¹ Au [Xe] 6s¹5d¹ Fr [Rn]7s¹
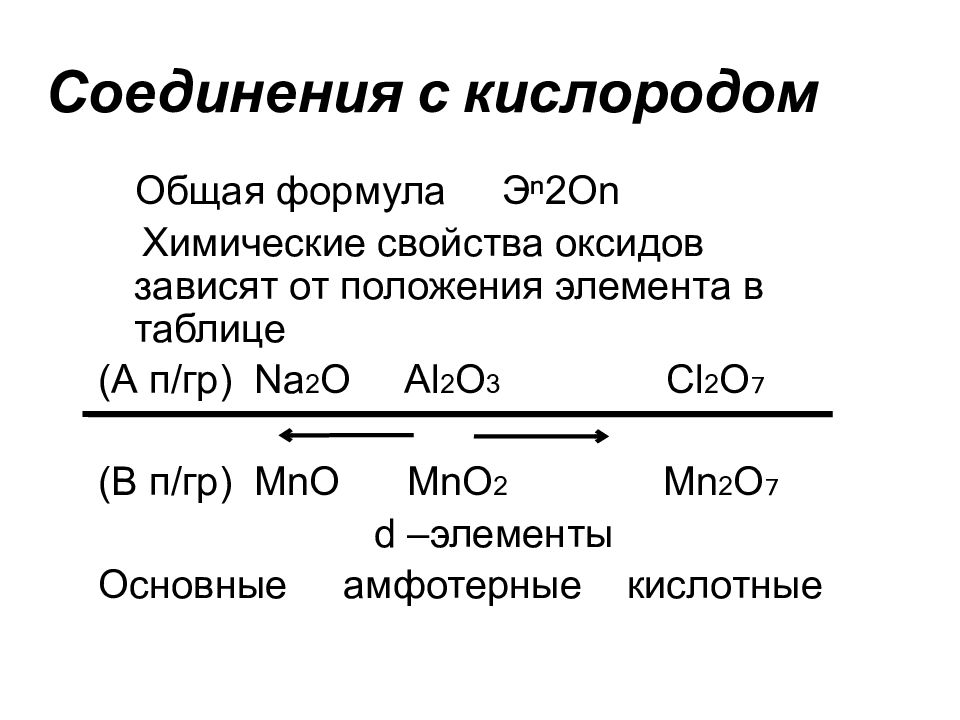
Слайд 75: Соединения с кислородом
Общая формула Э ⁿ2 О n Химические свойства оксидов зависят от положения элемента в таблице (А п/гр) Na 2 O Al 2 O 3 Cl 2 O₇ (В п/гр) MnO MnO 2 Mn 2 O₇ d –элементы Основные амфотерные кислотные
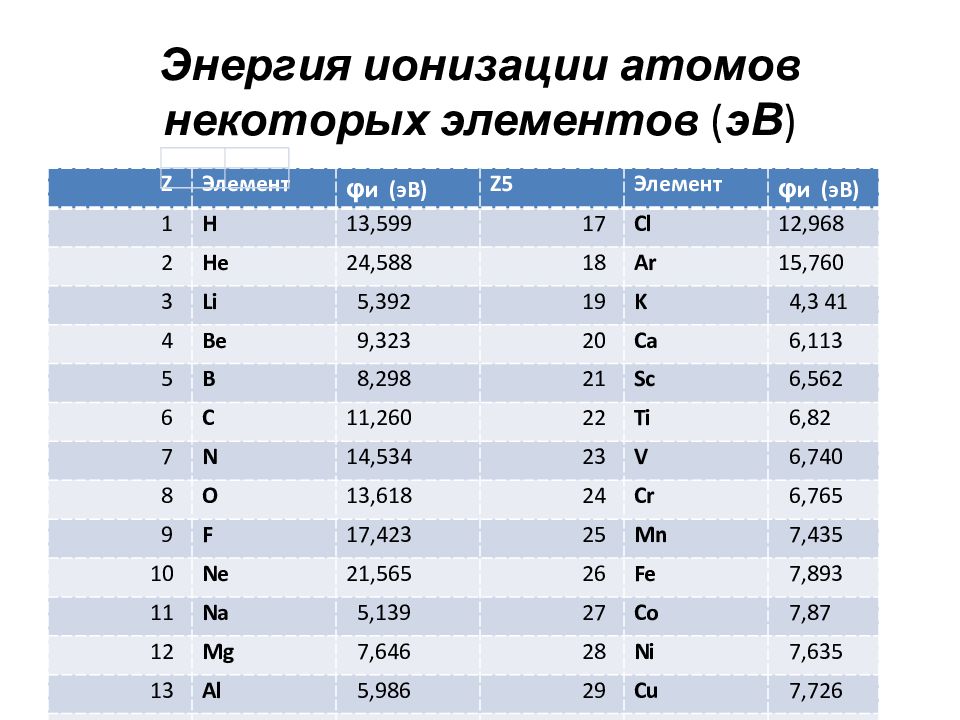
Слайд 77: Энергия ионизации
Важнейшая характеристика элемента, непосредственно связанная с электронной структурой атома Энергией ионизации ( φ и) называется энергия, которую необходимо затратить для отрыва и удаления электрона от атома, иона или молекулы. Выражается в эВ (1 эВ = 1,6 ∙10 ⁻ ¹⁹ Дж). Является мерой восстановительной способности атома. В периоде – слева направо –увеличивается В группе – сверху вниз - уменьшается
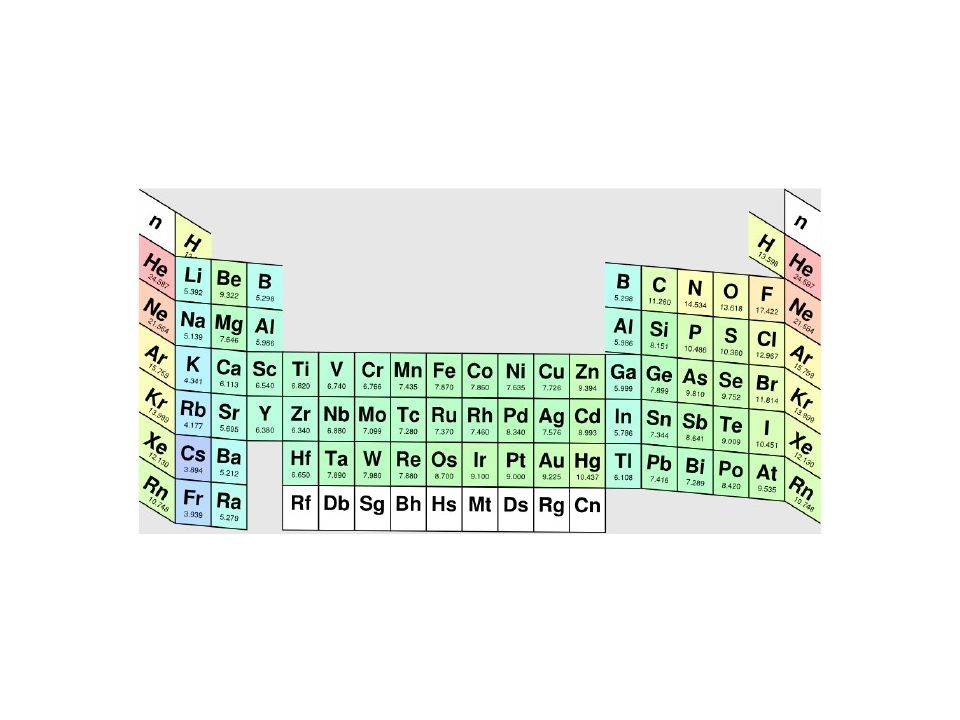
Слайд 78: Энергия ионизации атомов некоторых элементов ( эВ )
Z Элемент φ и (эВ) Z5 Элемент φ и (эВ) 1 H 13,599 17 Cl 12,968 2 He 24,588 18 Ar 15,760 3 Li 5,392 19 K 4,3 41 4 Be 9,323 20 Ca 6,113 5 B 8,298 21 Sc 6,562 6 C 11,260 22 Ti 6,82 7 N 14,534 23 V 6,740 8 O 13,618 24 Cr 6,765 9 F 17,423 25 Mn 7,435 10 Ne 21,565 26 Fe 7,893 11 Na 5,139 27 Co 7,87 12 Mg 7,646 28 Ni 7,635 13 Al 5,986 29 Cu 7,726 14 Si 8,152 30 Zn 9,394 15 P 10,487 31 Ga 5,998 16 S 10,360
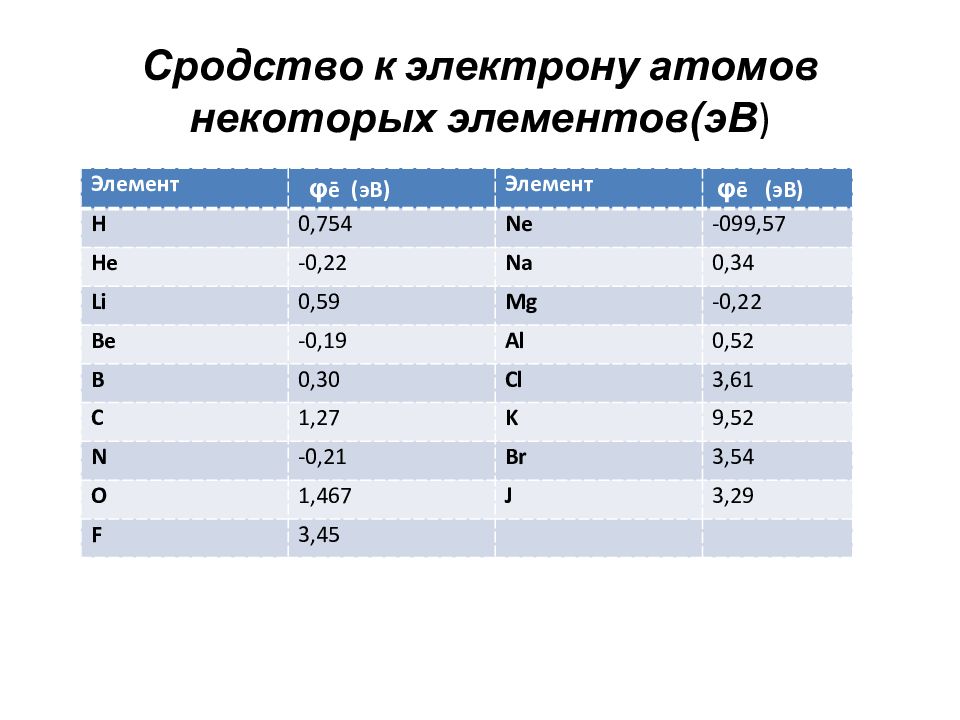
Слайд 79: Энергия сродства к электрону
Сродством к электрону ( φ ē ) называется энергия, которая выделяется при присоединении электрона к атому, молекуле или радикалу. Выражается в тех же единицах, что и энергия ионизации. Является мерой окислительной способности атома. В периоде слева направо – возрастает В группе сверху вниз – уменьшается
Слайд 80: Сродство к электрону атомов некоторых элементов(эВ )
Элемент φ ē (эВ) Элемент φ ē (эВ) H 0,754 Ne -099,57 He -0,22 Na 0,34 Li 0,59 Mg -0,22 Be -0,19 Al 0,52 B 0,30 Cl 3,61 C 1,27 K 9,52 N -0,21 Br 3,54 O 1,467 J 3,29 F 3,45
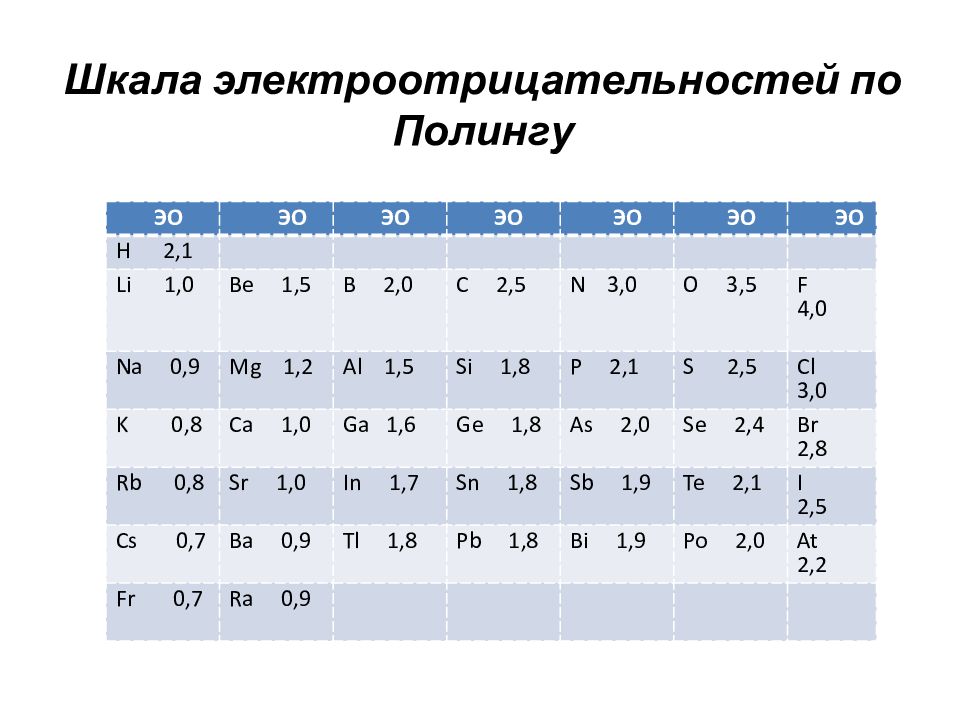
Слайд 81: Электроотрицательность
Для решения вопроса о том, какой из атомов легче отдает или присоединяет электрон, учитывают оба показателя, энергию ионизации и сродство к электрону. Согласно Малликену, полусумма энергии ионизации и сродства к электрону называется э л е к т р о о т р и ц а т е л ь н о с т ь ю (ЭО). ЭО =( φ и + φ ē) / 2 В периоде слева направо ЭО увеличивается В группе сверху вниз – уменьшается
Слайд 82: Шкала электроотрицательностей по Полингу
ЭО ЭО ЭО ЭО ЭО ЭО ЭО H 2,1 Li 1,0 Be 1,5 B 2,0 C 2,5 N 3,0 O 3,5 F 4,0 Na 0,9 Mg 1,2 Al 1,5 Si 1,8 P 2,1 S 2,5 Cl 3,0 K 0,8 Ca 1,0 Ga 1,6 Ge 1,8 As 2,0 Se 2,4 Br 2,8 Rb 0,8 Sr 1,0 In 1,7 Sn 1,8 Sb 1,9 Te 2,1 I 2,5 Cs 0,7 Ba 0,9 Tl 1,8 Pb 1,8 Bi 1,9 Po 2,0 At 2,2 Fr 0,7 Ra 0,9
Слайд 83: Атомные радиусы ( нм )
Li Be B C N O F 0,155 0,113 0,091 0,077 0,071 0,066 0,064 Na Mg Al Si P S Cl 0,189 0,160 0,143 0,134 0,130 0,104 0,099 l группа ll группа V группа Li 0,155 Be 0,113 N 0,071 Na 0,189 Mg 0,160 P 0,130 K 0,236 Ca 0,197 As 0,148 Rb 0,248 Sr 0,213 Sb 0,161 Cs 0,264 Ba 0,221 Bi 0,182
Слайд 84: Значение периодического закона
ПЗ обобщил большое число природных закономерностей: является научной основой химии. а) удалось систематизировать богатейший, но разрозненный материал по свойствам элементов и их соединений, б) уточнить многие понятия (пример: химический элемент и простое вещество). К моменту открытия были известны 63 элемента, предсказаны свойства 117, 118, 119, 120. ПЗ служит научной базой прогнозирования ПЗ сыграл решающую роль в выяснении сложной структуры атома а) удается определять физико-химические константы химических соединений на основе сопоставления известных величин б) ПЗ – фундамент неорганической химии помогает решению задач синтеза веществ с заданными свойствами, разработке новых материалов (полупроводников) подбору специфических катализаторов для различных химических процессов.
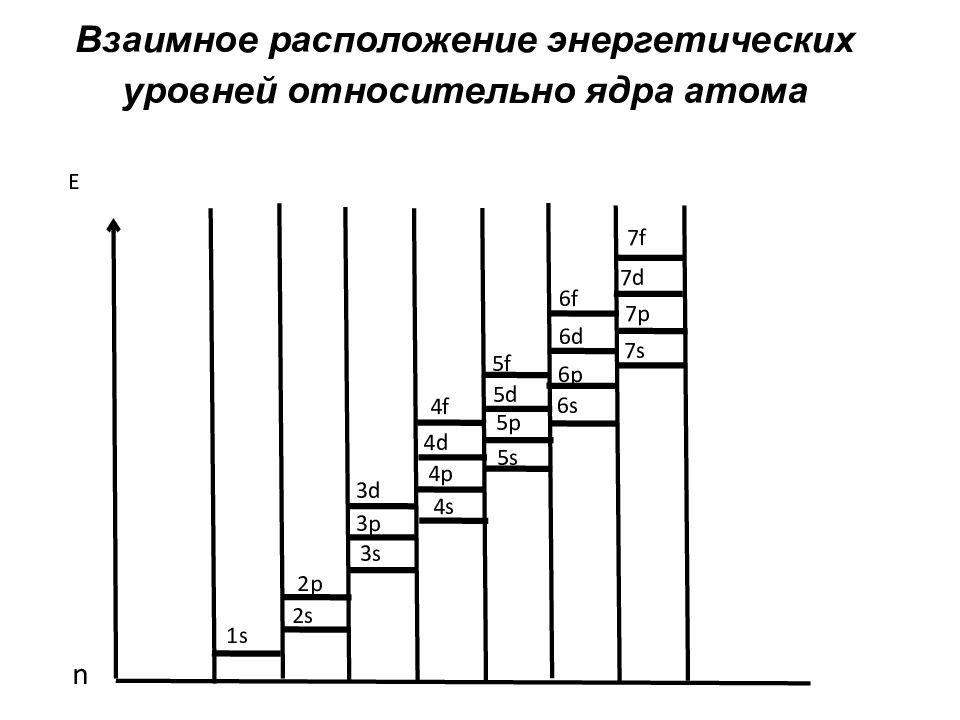
Слайд 86: Взаимное расположение энергетических уровней относительно ядра атома
1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 5d 5f 6s 6p 6d 6f 7s 7p 7d 7f n E
Слайд 87: Уравнение Шредингера
1926 г. Эрвин Шредингер Уравнение Шредингера связывает волновую функцию ( ψ ) с потенциальной энергией (U ) и его полной энергией ( E) : ν² ψ =8 π² m /h² ∙ (Е- U )∙ ψ =0 ν ² ψ = ∂²ψ /∂ х² + ∂² ψ /∂ у² + ∂² ψ /∂z² Сумма вторых производных волновой функции Ψ по координатам х, у и z ; m – масса электрона; h − постоянная Планка
Слайд 88: Основные положения квантовой механики
C овременная теория строения атома основана на законах, описывающих движение микрочастиц (микрообъектов). Поскольку массы и размеры микрочастиц чрезвычайно малы по сравнению с массами и размерами макроскопических тел, свойства и закономерности движения отдельной микрочастицы качественно отличаются от свойств и закономерностей движения макроскопического тела, давно уже изученных классической физикой. В 20-е годы ХХ в. возник новый раздел физики, описывающий движение и взаимодействия микрочастиц,- квантовая (или волновая) механика. Она основывается на представлении о квантовой энергии, волновом характере движения микрочастиц и вероятностном (статистическом) методе описания микрообъектов.
Последний слайд презентации: Лекция № 2: Принцип неопределенности
Кажущуюся двойственную природу микрочастиц объясняет установленный В.Гейзенбергом (1927 г.) принцип неопределенности: невозможно одновременно определить и скорость (или импульс р= mv ) и положение микрочастицы (ее координаты) Δ q Δ v ≥ h / m. (3) Произведение неопределенностей положения ( Δ q ) и скорости ( Δ v ) никогда не может быть меньше h / m. Из соотношения (3) следует, что чем точнее определены координаты частицы(чем менее неопределенность Δ q ), тем менее определенной становится величина ее скорости (больше Δ v ) и наоборот. Так, если положение электрона определено с точностью до 10 ¹² м, то неопределенность в скорости составит 58 000 км/с (при скорости электрона 2000 км/с). Для макрочастиц (тяжелых частиц) величина отношения h / m очень мала, поэтому для них справедливы законы классической механики, в рамках которых скорость и положение частицы могут быть точно определены одновременно. Квантование энергии, волновой характер движения микрочастиц, принцип неопределенности – все это показывает, что классическая механика совершенно непригодна для описания поведения микрочастиц. Так, состояние электрона в атоме нельзя представить как движение материальной частицы по какой-то орбите. Квантовая механика отказывается от уточнения положения электрона в пространстве; она заменяет классическое понятие точного нахождения частицы понятием статистической вероятности нахождения электрона в данной точке пространства или в элементе объема dv вокруг ядра.