Слайд 2
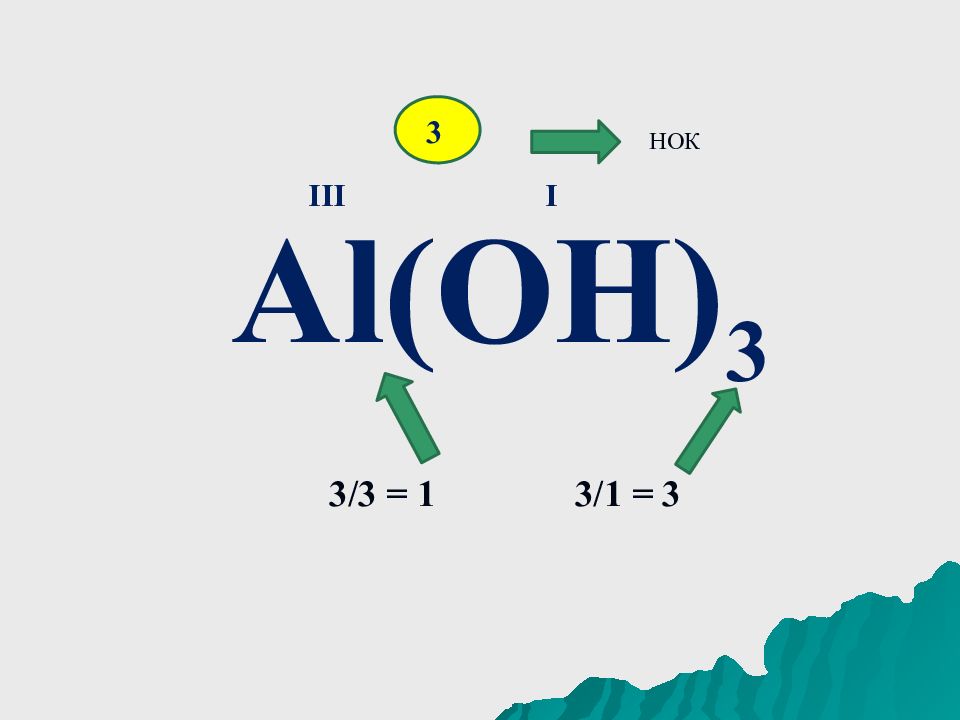
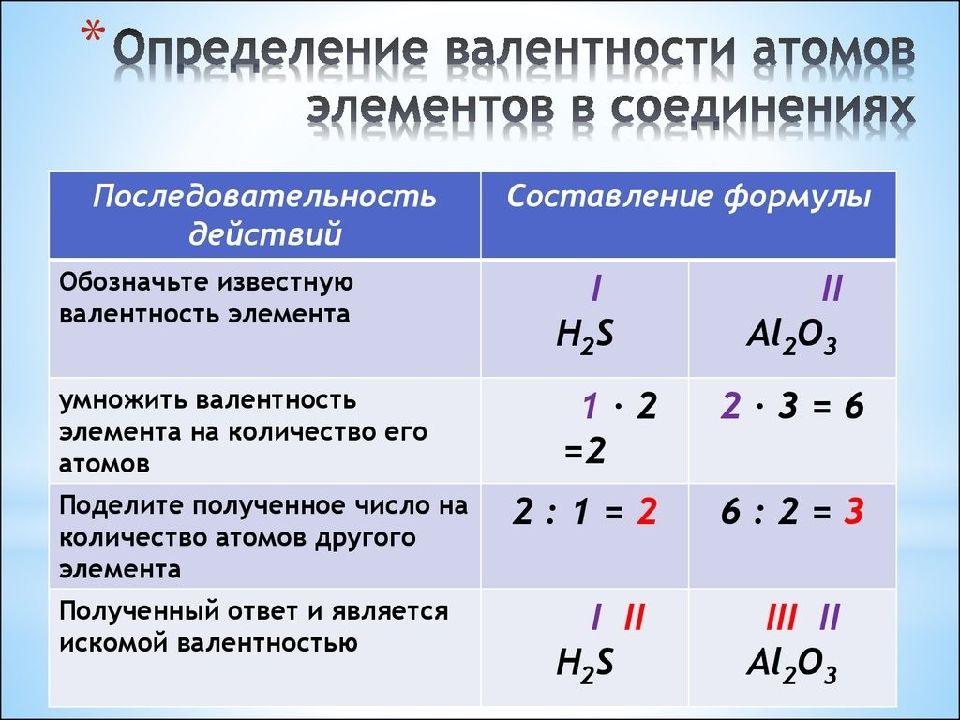
Валентность (от лат. « v alentia » - сила) - способность атома присоединять или замещать определённое число других атомов или атомных групп с образованием химической связи. Обозначается римскими цифрами
Слайд 3
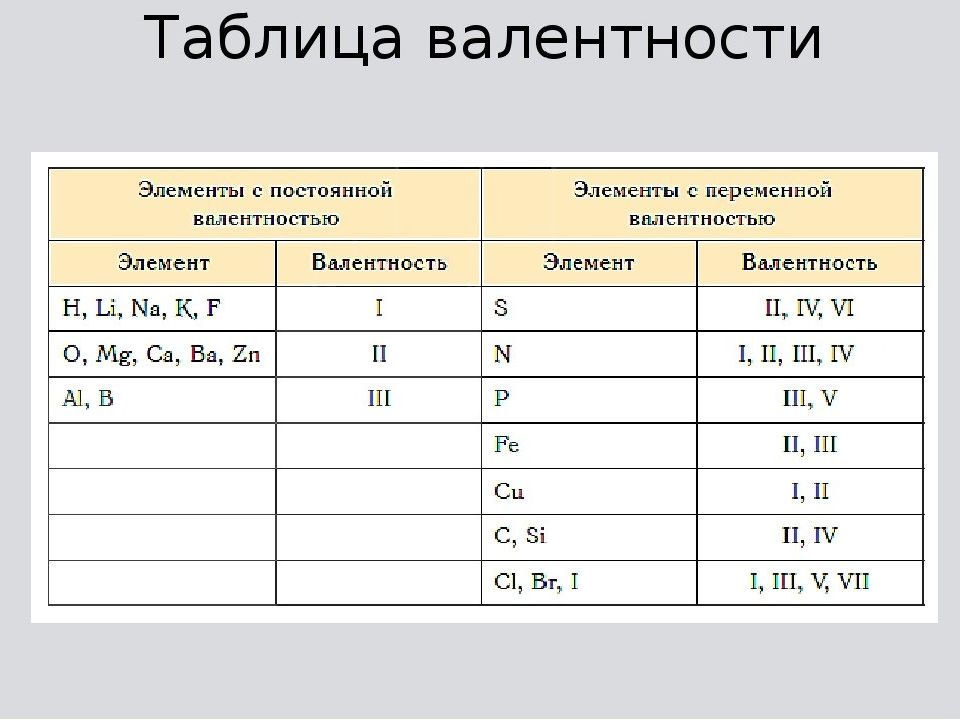
У металлов главных групп Периодической системы валентность равна номеру группы. У неметаллов высшая валентность элемента равна номеру его группы в Периодической системе Д.И. Менделеева. Низшая валентность находится как разница между числом 8 и номером группы, в которой расположен данный элемент
Слайд 4
! Валентность водорода всегда принимают за 1. ! Кислород всегда проявляет в своих соединениях валентность 2. ! Валентность алюминия и бора всегда равна 3
Слайд 10
Степень окисления (с.о.) - условный заряд атома данного элемента в соединении, вычисленный, исходя из предположения, что все атомы в молекуле ионизированы, т.е. имеют заряд. Обозначается арабскими цифрами со знаком + или -
Слайд 11
У металлов IA группы Периодической системы Д.И. Менделеева степень окисления в соединениях равна +1: Na +1 Cl −1, Li +1 2 O −2. У металлов IIA группы степень окисления всегда равна +2: Mg +2 F −1 2, Ba +2 O −2. Степень окисления алюминия - +3: Al +3 2 S −2 3. У фтора степень окисления постоянная и равна -1: H +1 F −1, K +1 F −1. Кислород почти всегда имеет степень окисления -2: Na +1 2 O −2, C +4 O 2 −2. Исключения - фторид кислорода и пероксиды: O +2 F −1 2, H +1 2 O −1 2. В большинстве соединений степень окисления водорода +1, но в соединениях с металлами она равна -1: H +1 Br −1, N −3 H +1 3, Na +1 H −1, Ca +2 H −1 2. У атомов остальных неметаллов максимальное значение степени окисления тоже равно номеру группы в Периодической системе. Минимальное значение степени окисления можно определить, если от номера группы отнять 8
Слайд 12
! Степень окисления простого вещества равна нулю. ! Сумма всех степеней окисления в веществе равна нулю. ! В сложных веществах степень окисления атомов металла всегда положительная. Атомы неметаллов имеют как положительные, так и отрицательные степени окисления
Слайд 14
Понятие валентности можно считать родственным такой характеристике, как степень окисления. Тем не менее, обе эти характеристики не тождественны друг другу. Валентность ≠ С.О.
Слайд 15
Говоря о степени окисления, подразумевают, что атом в веществе ионной (что важно) природы имеет некий условный заряд. И если валентность - это нейтральная характеристика, то степень окисления может быть отрицательной, положительной или равной нулю