Первый слайд презентации: Водород как химический элемент и простое вещество. Получение и физические свойства водорода
8 класс
Слайд 2: Отгадайте, о чём идёт речь
Я, газ, легчайший и бесцветный, Неядовитый и безвредный, Соединяясь с кислородом, Я для питья даю вам воду!
Слайд 4
В результате изучения темы,вы будете способны: 1. Описывать элемент и простое вещество водород по соответствующим схемам (плану); 2. Рассматривать способы получения и обнаружения Н 2 3. Описывать распространение и значение Н 2 4. Осуществлять рефлексию учебной деятельности
Слайд 5: План урока
1. Водород в природе. 2. Историческая справка. 3. Водород – химический элемент. 4. Водород – простое вещество. 5. Физические свойства водорода. 6. Получение и собирание водорода. 7. Применение водорода.
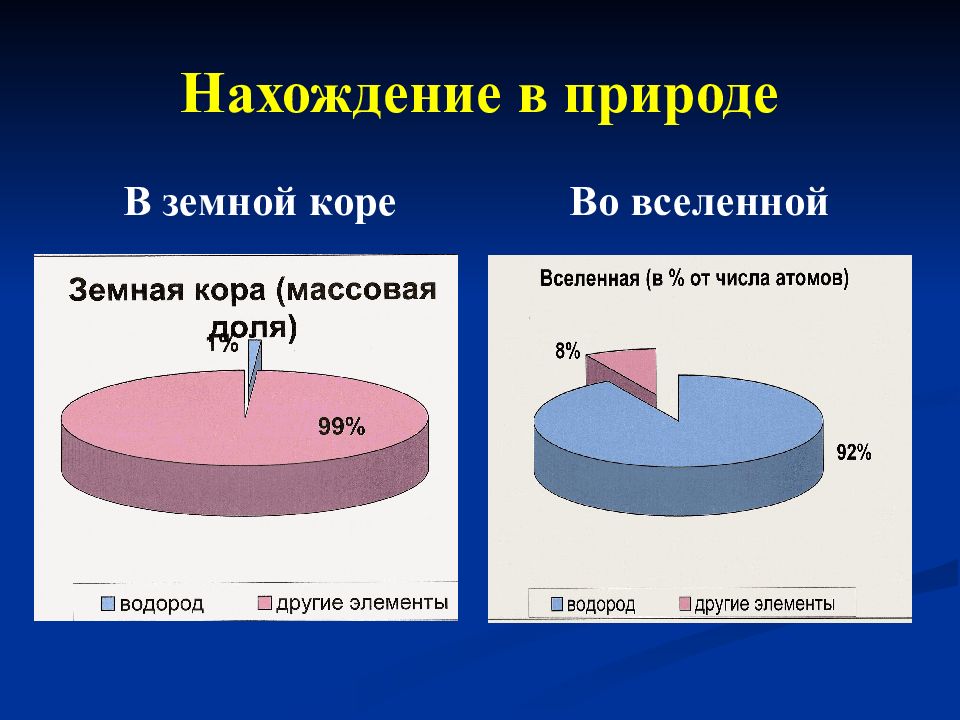
Слайд 6: 1.Водород в природе
Первый я на белом свете: Во вселенной, на планете, Превращаюсь в лёгкий гелий, Зажигаю Солнце в небе. Гость из космоса пришёл, В воде приют себе нашёл! !!!Объясните смысл этого стихотворения
Слайд 8: 2.Исторические сведения
Водород был известен ещё в XVI веке Теофрасту Парацельсу (1493-1541) Его получали Ван-Гельмонт (1577-1644), Роберт Бойль (1627-1691), Николя Лемери (1645-1715), Мих. Вас. Ломоносов (1711-1765), Джозеф Пристли и др.
Слайд 9: Всё те же открытия
В 1766 году известный английский учёный Генри Кавендиш получил «искусственный воздух» действием цинка на разведённую соляную кислоту. Это было совершенно новое вещество, которое хорошо горело и получило название «горючего воздуха».
Слайд 10: Открытие водорода
Лишь в 1787 году Антуан Лавуазье доказал, что «горючий воздух»,открытый в 1766 году, входит в состав воды, и дал ему название «гидрогениум», т.е. «рождающий воду», «водород».
Слайд 11: 3.Водород – химический элемент
Характеристика водорода по ПСХЭ. 1. Порядковый номер 2. Номер периода 3. Номер группы 4. Относит. атомная масса 5. Валентность водорода 6.Степень окисления 1 1,малый I гр,главная подгр. Ar(H)=1 I +1 и -1
Слайд 12
Водород-окислитель или восстановитель? Водород расположен в периодической системе в главных подгруппах I и VII групп. Это обусловлено сходством водорода и со щелочными металлами и с галогенами.
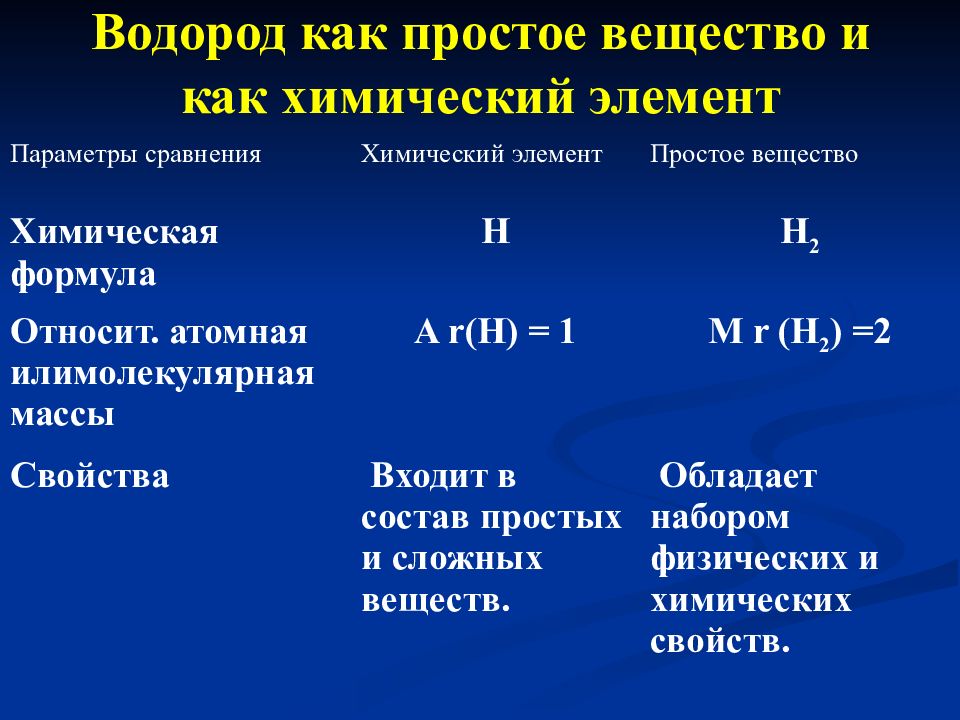
Слайд 14: Водород как простое вещество и как химический элемент
Параметры сравнения Химический элемент Простое вещество Химическая формула Н Н 2 Относит. атомная илимолекулярная массы A r(H) = 1 M r (H 2 ) =2 Свойства Входит в состав простых и сложных веществ. Обладает набором физических и химических свойств.
Слайд 15: Образование гремучей смеси
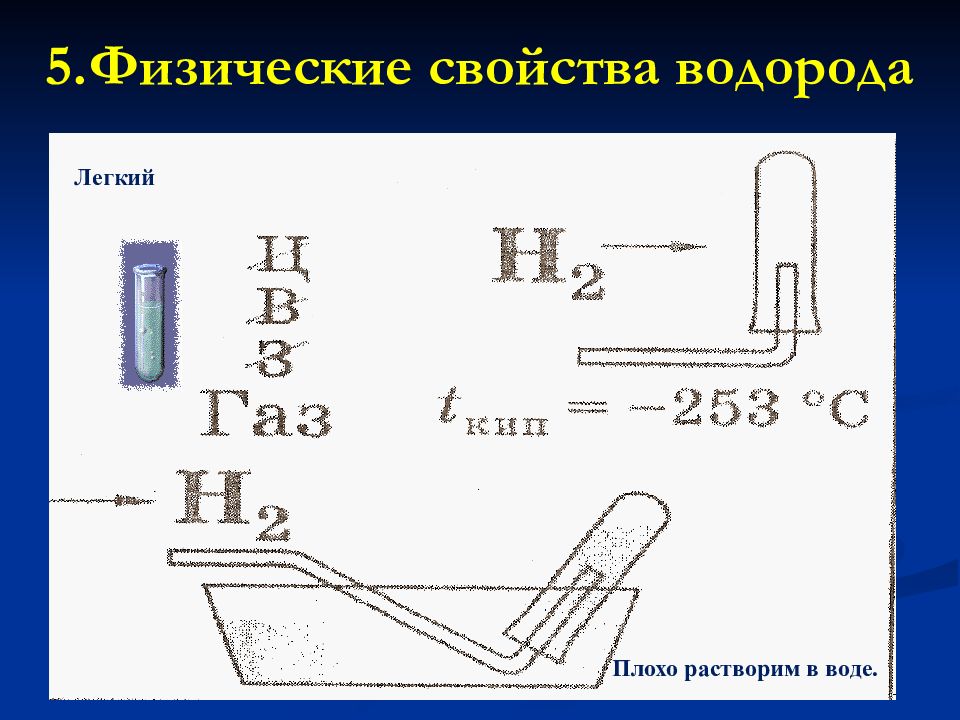
Обычно лёгок и летуч, Он вдруг становится могуч: Его нагрев неосторожно, Взорвать в округе всё возможно. 5. Физические свойства водорода.
Слайд 18: Ответьте на вопрос
Если бы перед вами стояла задача получить большое количество водорода, какое сырьё вы бы выбрали и почему ? 6.Получение водорода
Слайд 20
Zn + H 2 SO 4 = ZnSO 4 + H 2 ↑ В промышленности : 2СН 4 + О 2 = 2СО + 4Н 2 ↑ 2 H 2 O = 2H 2 ↑ + O 2 ↑ В лаборатории : 6.Получение водорода
Слайд 21: 6.Собирание водорода
Методом вытеснения воды Методом вытеснения воздуха
Слайд 22: Опыт: получение водорода в лаборатории
Обнаружение водорода – проверка его на чистоту
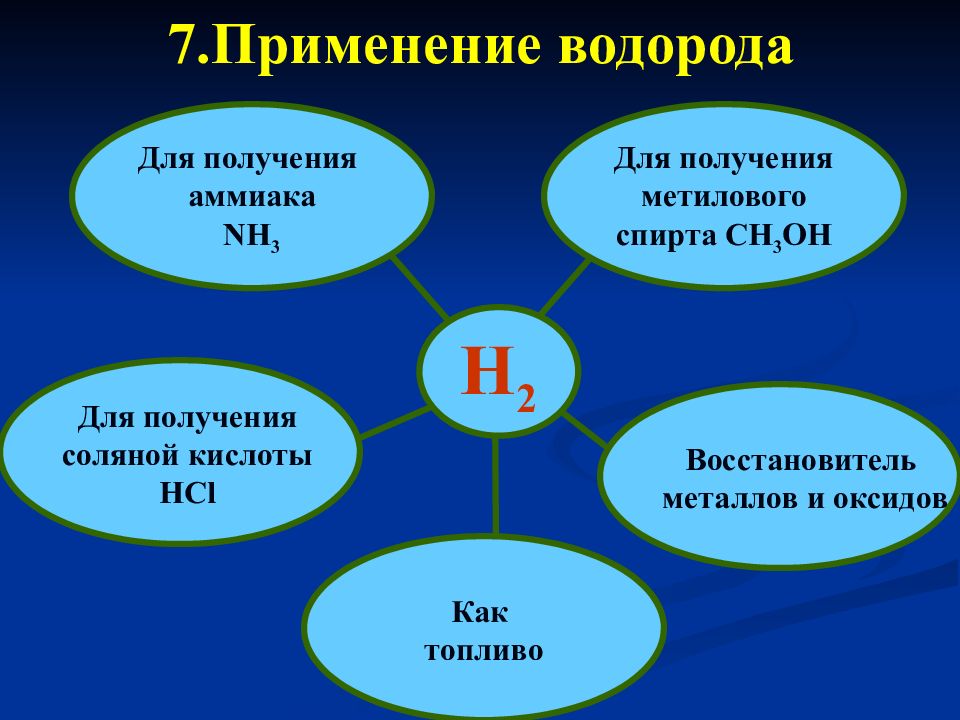
Слайд 23
H 2 Для получения аммиака NH 3 Восстановитель металлов и оксидов Для получения соляной кислоты HCl Как топливо Для получения метилового спирта С H 3 OH 7.Применение водорода
Слайд 24: Интересно знать, что…
Водородом заполняли дирижабли вплоть до 1937 года, пока не взорвался немецкий дирижабль «Гинденбург». Погибло 36 человек. Размеры дирижабля достигали размеров двух футбольных полей.
Слайд 25: ЭТО ИНТЕРЕСНО!
Если электролиз воды для получения водорода будет основан на использовании среднетемпературной (500-600° C ) теплоты, которая возникает при работе атомных электростанций, то сразу решается проблема экологически чистого топлива, ведь при сгорании водорода образуется ВОДА!
Слайд 26: БИОЛОГИЧЕСКАЯ РОЛЬ ВОДОРОДА
Образуя водородные связи, атомы водорода обусловливают структуру белков и нуклеиновых кислот, то есть хранит и реализует генетическую информацию! Он также участвует в биологическом окислении (т.есть обеспечивает живые клетки энергией), фотосинтезе у растений, поддержании гомеостаза. Вместе с кислородом ( O ) и углеродом (С) водород образует структурную и функциональную основы явлений жизни!
Слайд 27: Водородная энергетика
В недалёком будущем основным источником получения энергии станет реакция горения водорода, и водородная энергетика вытеснит традиционные источники получения энергии ( уголь, нефть и др.). При этом предполагалось, что для получения водорода в больших масштабах можно будет использовать электролиз воды. Будущее за водородом!!!
Слайд 28: Водородные автомобили
В 1979 году компания BMW выпустила первый автомобиль, вполне успешно ездивший на водороде, при этом не взрывавшийся и выпускавший из выхлопной трубы водяной пар. В эпоху усиливающейся борьбы с вредными выхлопами машина была воспринята как вызов консервативному автомобильному рынку. Вслед за BMW в экологическую сторону потянулись и другие производители. К концу века каждая уважающая себя автокомпания имела в запаснике хотя бы один концепт-кар, работающий на водородном топливе. Будущее за водородом!!!
Слайд 29: Водород и будущее
Слова «дейтерий» и «тритий» напоминают нам о том, что сегодня человек располагает мощнейшим источником энергии, высвобождающейся при реакции: 21Н + 31Н → 42Не +10 n + 17,6 МэВ. Эта реакция начинается при 10 млн градусов и протекает за ничтожные доли секунды при взрыве термоядерной бомбы, причем выделяется гигантское по масштабам Земли количество энергии. Водородные бомбы иногда сравнивают с Солнцем. Однако мы уже видели, что на Солнце идут медленные и стабильные термоядерные процессы. Солнце дарует нам жизнь, а водородная бомба – сулит смерть... Будущее за водородом!!!
Слайд 30
Но когда-нибудь настанет время – и это время не за горами, – когда мерилом ценности станет не золото, а энергия. И тогда изотопы водорода спасут человечество от надвигающегося энергетического голода: в управляемых термоядерных процессах каждый литр природной воды будет давать столько же энергии, сколько ее дают сейчас 300 л бензина. И человечество будет с недоумением вспоминать, что было время, когда люди угрожали друг другу животворным источником тепла и света... Будущее за водородом!!!
Последний слайд презентации: Водород как химический элемент и простое вещество. Получение и физические: Тест по теме “Водород. Хим. элемент и простое в-во ”
1. Водород в лаборатории получают взаимодействием А) железа с водой Б) оксида кальция с водой 2.Водород проявляет степень окисления в соединениях: А) +2 и – 2 В) 0 и + 3. Водород это газ: А) без цвета, вкуса, запаха, тяжелее воздуха В) без цвета, вкуса, с запахом, легче воздуха 4. В промышленности водород получают Б) из воздуха В) из воды 5. Укажите причину по которой водород считается топливом будущего Б) он самый легкий газ и его легко перевозить В) много запасов сырья для получения водорода В) цинка с соляной кислотой Б) +1 и -1 Б) без цвета, запаха, вкуса, легче воздуха А) из метана А) дешевле других видов топлива