Слайд 2
Алёхина Е.А. Механизмы взаимного влияния Типы и характеристики химических связей Классификация органических реакций Литература Содержание
Слайд 3
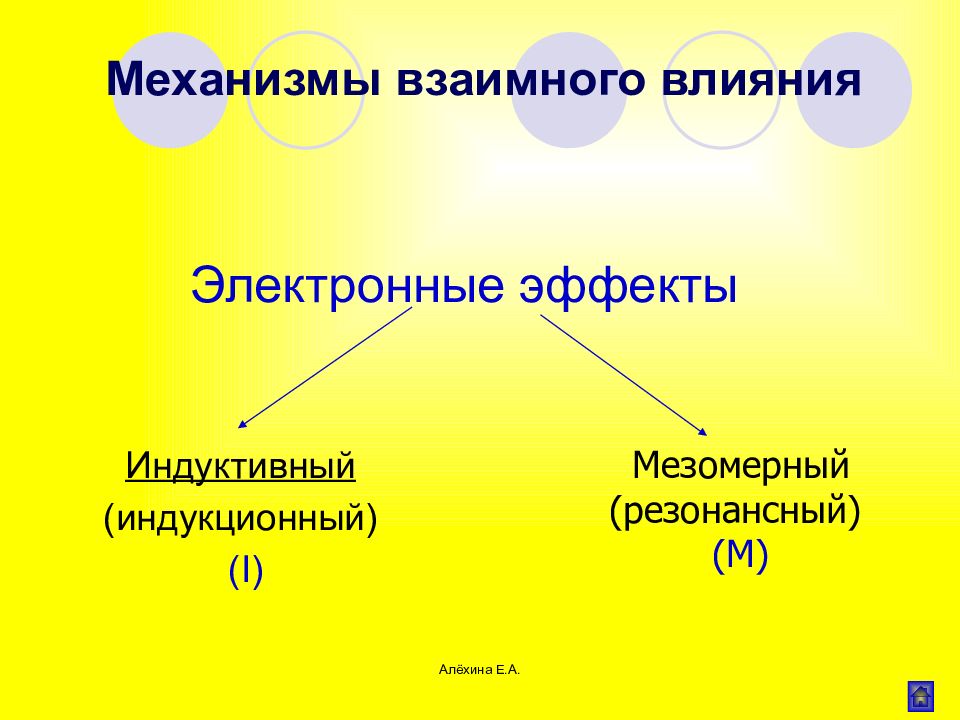
Алёхина Е.А. Электронные эффекты Индуктивный (индукционный) (I) Механизмы взаимного влияния Мезомерный (резонансный) ( M)
Слайд 4
Алёхина Е.А. смещение электронной плотности по -связи в сторону более электроотрицательного атома элемента или группы атомов. СН 3 – СН 2 – СН 2 – Cl Знак эффекта определяется зарядом, приобретаемым заместителем после смещения электронной плотности Например: – I В цепи индуктивный эффект затухает Индуктивный эффект ( I)
Слайд 5
Алёхина Е.А. Знак эффекта определяется зарядом, приобретаемым заместителем после смещения электронной плотности или Если смещение электронной плотности от углеродной основы, то «–», а если не углеродную основу, то «+» ). Индуктивный эффект ( I)
Слайд 6
Алёхина Е.А. Дают те атомы и группы атомов, которые обладают большей электроотрицательностью, чем углерод. Они оттягивают электронную плотность на себя. Отрицательный индуктивный эффект (- I) Х = - Hal ; -С N ; -NO 2 ; -OH; -CHO; -COOH; - COOR и т.д.
Слайд 7
Алёхина Е.А. Дают атомы и группы атомы, которые имеют элетроотрицательность меньшую по сравнению с углеродом. Отдают свою электронную плотность. Положительный индуктивный эффект (+ I) где Х= -СН 3 ; -CH 2 –CH 3 и т.д.
Слайд 8
Алёхина Е.А. 1. Величина индуктивного эффекта растет с увеличением заряда заместителя -NR 2 <-NO 2 <-NR 3 <=NR 2 Индуктивный эффект Индуктивный эффект Закономерности изменения величины и знака индуктивного эффекта
Слайд 9
Алёхина Е.А. 2. Чем больше электроотрицательность, тем сильнее отрицательный индуктивный эффект. В изоэлектронном ряду он растет слева направо, в группах снизу вверх. =CR 3 <-NR 2 <OR 2 -I<Br<Cl<-F Индуктивный эффект Закономерности изменения величины и знака индуктивного эффекта - I растет - I растет
Слайд 10
Алёхина Е.А. 3. У заместителей с кратными связями чем больше кратность, тем сильнее отрицательный индуктивный эффект Индуктивный эффект Закономерности изменения величины и знака индуктивного эффекта -NR 2 < =NR < N - I растет
Слайд 11
Алёхина Е.А. 4. Алкильные группы проявляют положительный индуктивный эффект тем сильнее, чем выше разветвленность -CH 3 <-CH 2 CH 3 <-CH(CH 3 ) 2 <-C(CH 3 ) 3 Индуктивный эффект Закономерности изменения величины и знака индуктивного эффекта + I растет
Слайд 12
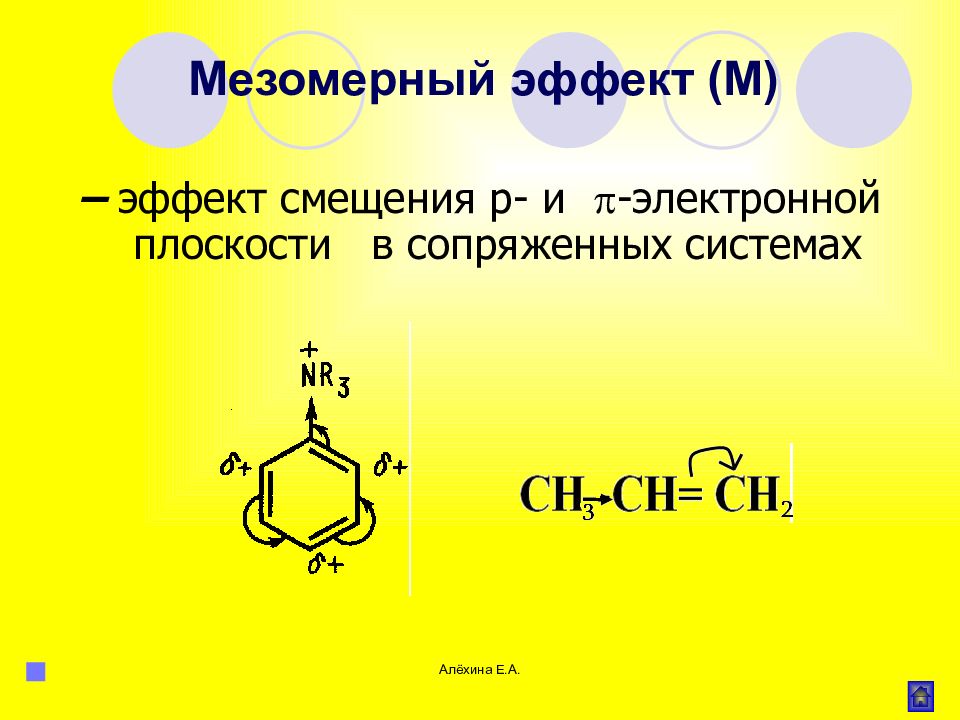
Алёхина Е.А. – эффект смещения р- и -электронной плоскости в сопряженных системах Мезомерный эффект (М)
Слайд 13
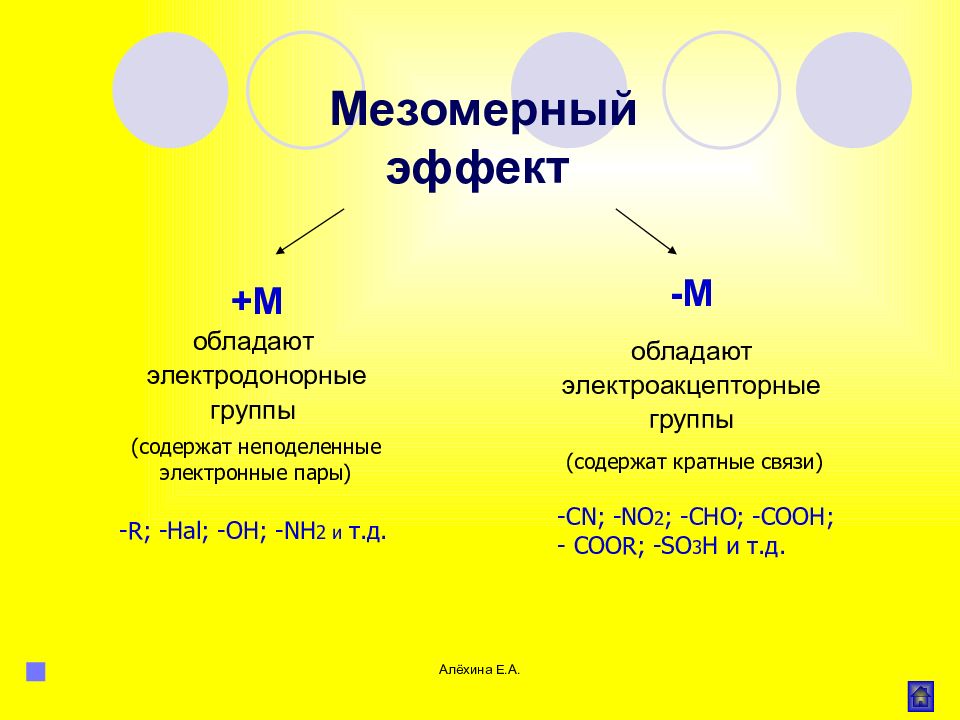
Алёхина Е.А. +М обладают электродонорные группы - R ; - Hal ; -OH; -NH 2 и т.д. -С N ; -NO 2 ; -CHO; -COOH; - COOR; -SO 3 H и т.д. Мезомерный эффект -М обладают электроакцепторные группы (содержат неподеленные электронные пары) (содержат кратные связи)
Слайд 14
Алёхина Е.А. 1. Величина мезомерного эффекта растет с увеличением заряда заместителя - М растет - М убывает Мезомерный эффект Закономерности изменения величины и знака мезомерного эффекта
Слайд 15
Алёхина Е.А. Отрицательный мезомерный эффект тем сильнее, чем больше электроотрицательность находящихся в заместителе атомов. - М растет - М растет Мезомерный эффект Закономерности изменения величины и знака мезомерного эффекта
Слайд 16
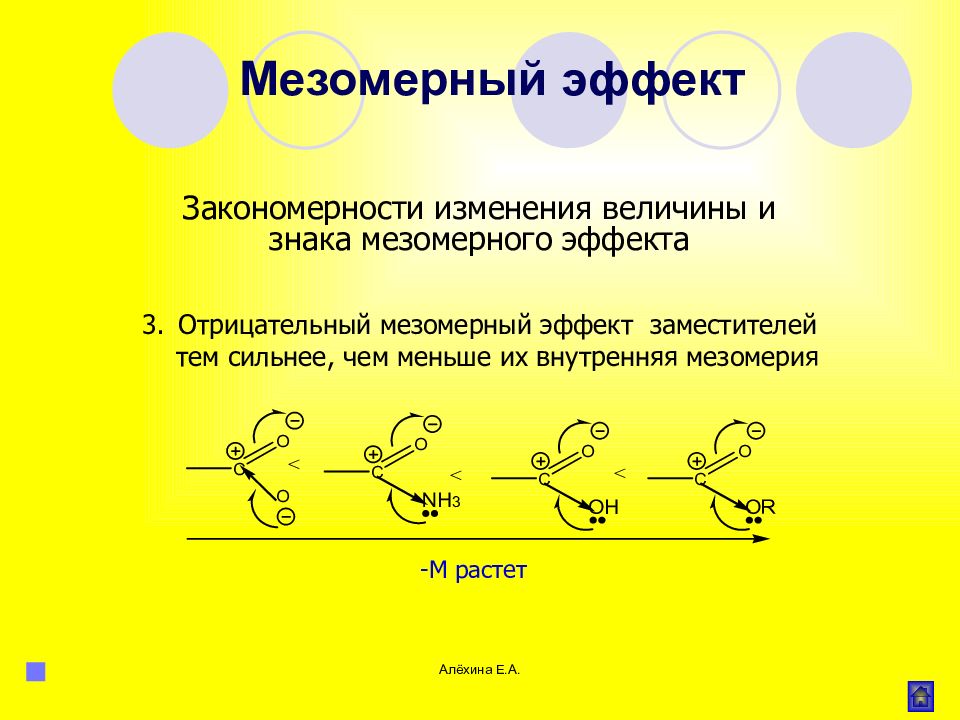
Алёхина Е.А. Отрицательный мезомерный эффект заместителей тем сильнее, чем меньше их внутренняя мезомерия -М растет Мезомерный эффект Закономерности изменения величины и знака мезомерного эффекта
Слайд 17
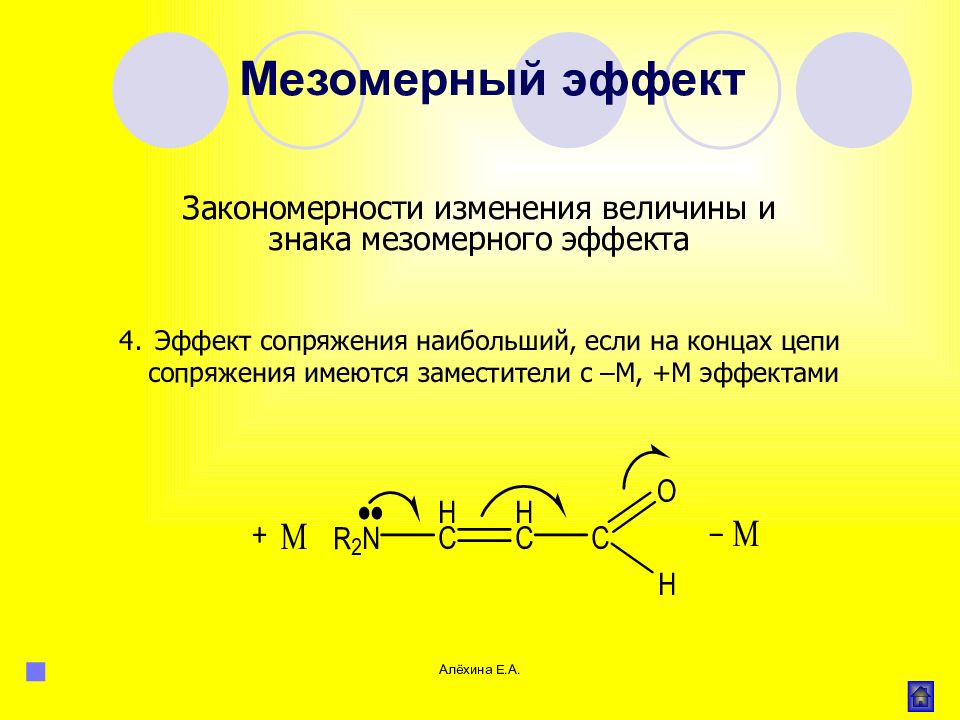
Алёхина Е.А. Эффект сопряжения наибольший, если на концах цепи сопряжения имеются заместители с –М, +М эффектами Мезомерный эффект Закономерности изменения величины и знака мезомерного эффекта
Слайд 18
Алёхина Е.А. Типы и характеристики химических связей органических соединений Электронная структура атома углерода Валентные состояния и типы гибридизации атома углерода в органических соединениях Различные виды перекрывания атомных орбиталей Типы химических связей Характеристики химических связей
Слайд 19
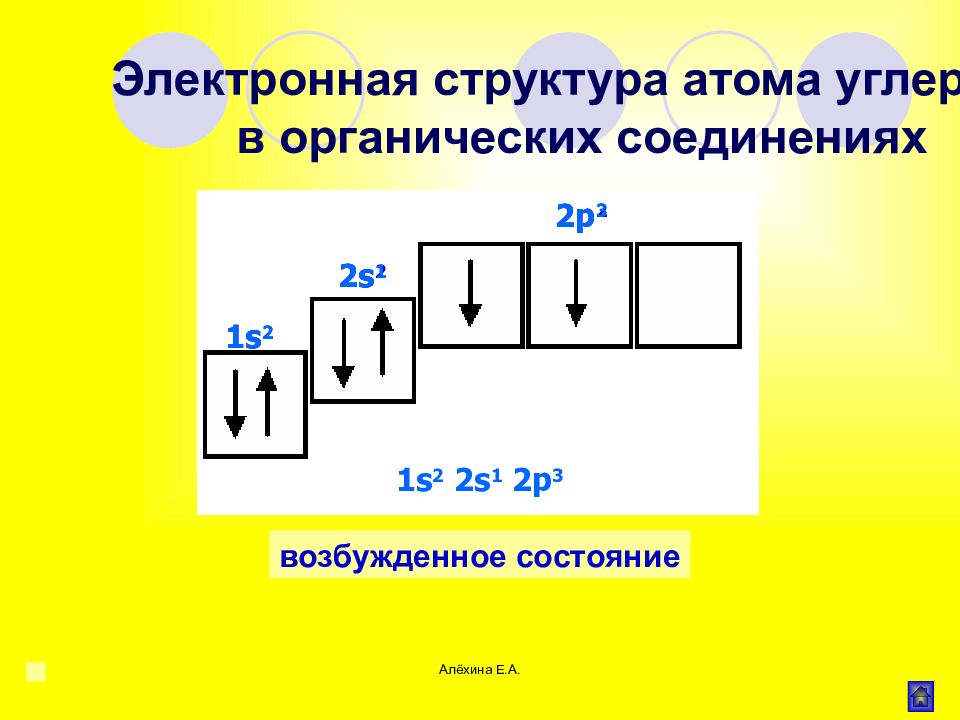
Алёхина Е.А. основное состояние возбужденное состояние Электронная структура атома углерода в органических соединениях 1 s 2 2s 2 2p 2 1 s 2 2s 1 2p 3 2p 2 2s 2 1 s 2 2p 3 2s 1 1 s 2
Слайд 20
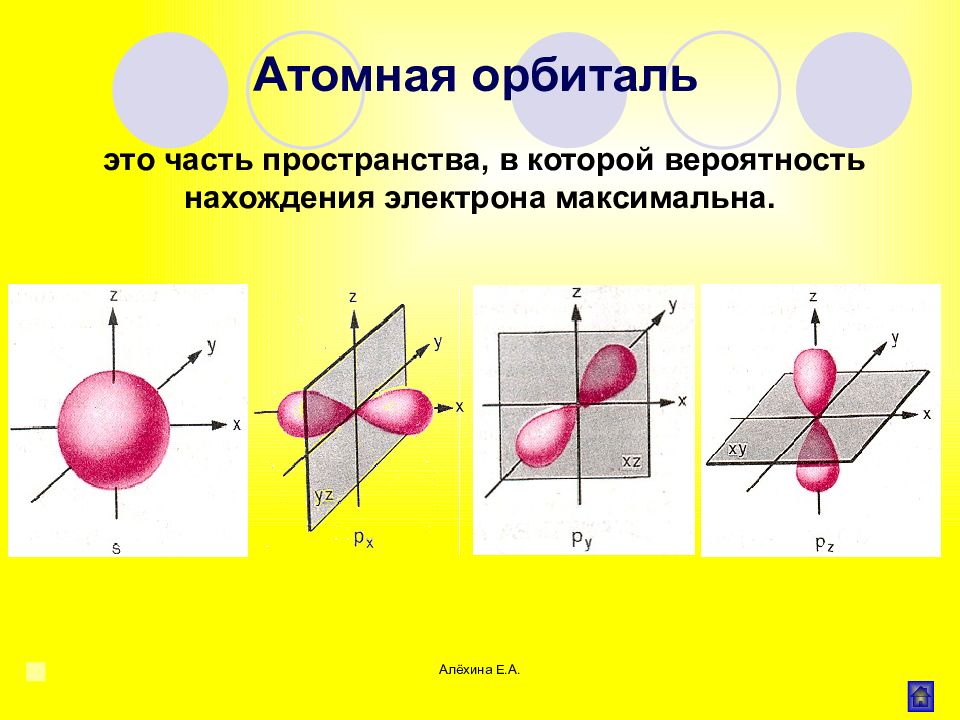
Алёхина Е.А. это часть пространства, в которой вероятность нахождения электрона максимальна. Атомная орбиталь
Слайд 21
Алёхина Е.А. Гибридизация Гибридизация в химии – это выравнивание электронных облаков по форме и энергии Гибридизация в биологии
Слайд 22
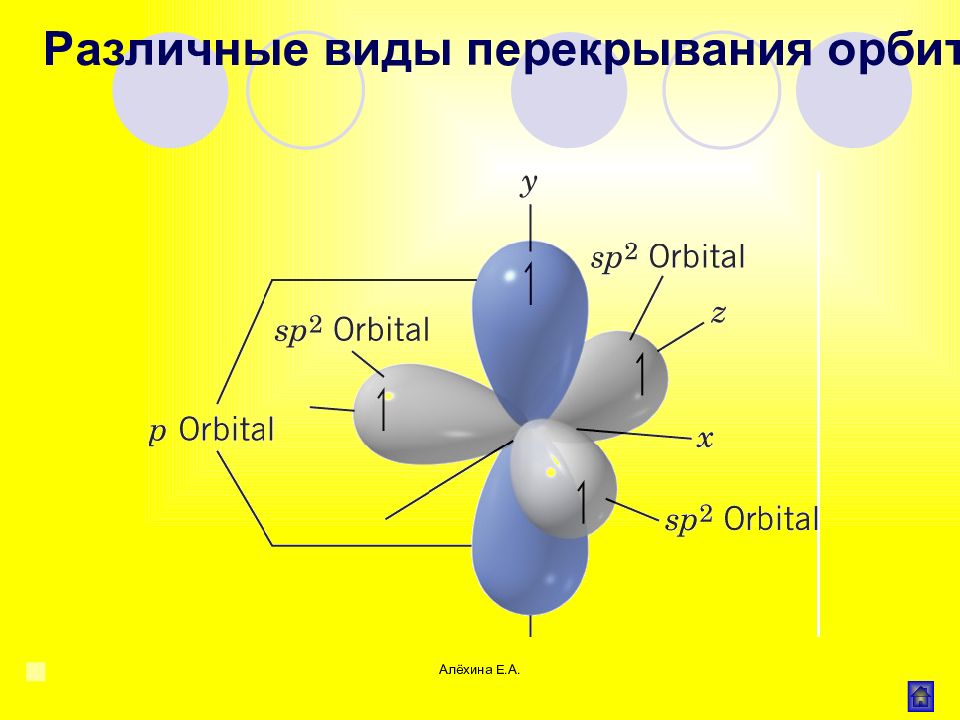
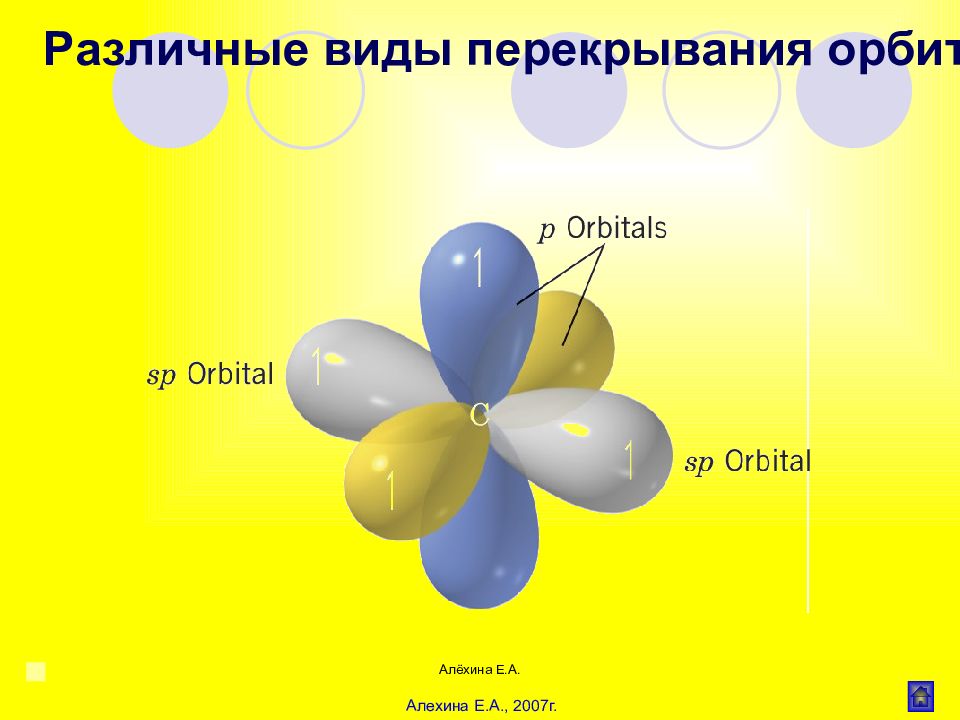
Алёхина Е.А. Валентные состояния углерода Типы связи у атома углерода Типы гибридизации атома углерода Изображение электронных облаков Первое 4 σ -связи sp 3 1s + 3p 4sp3 Второе 3 σ - и 1 π -связь sp 2 1s + 2p 3sp 2 Третье 2 σ - и 2 π -связи sp 1s + 1p 2sp Валентные состояния и типы гибридазации атома углерода в органических соединениях Алехина Е.А., 2007г.
Слайд 23
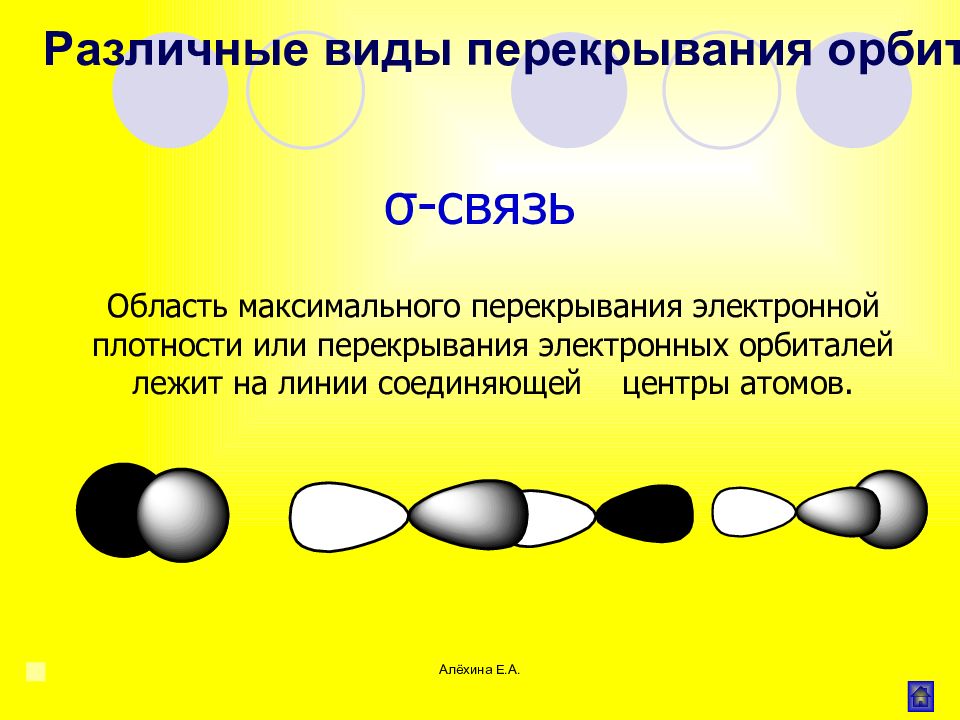
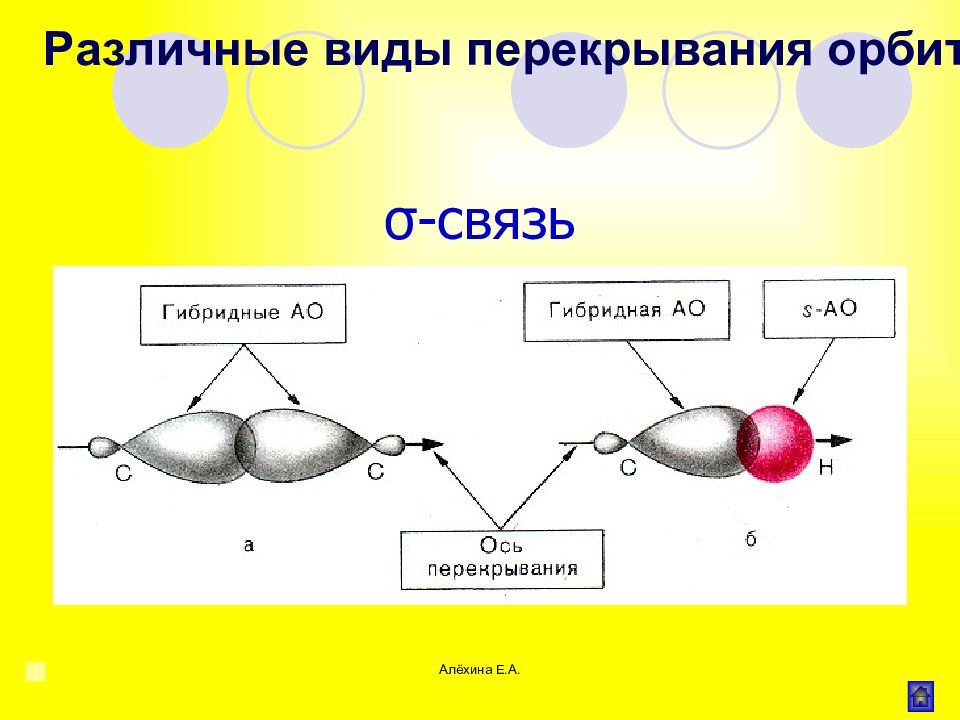
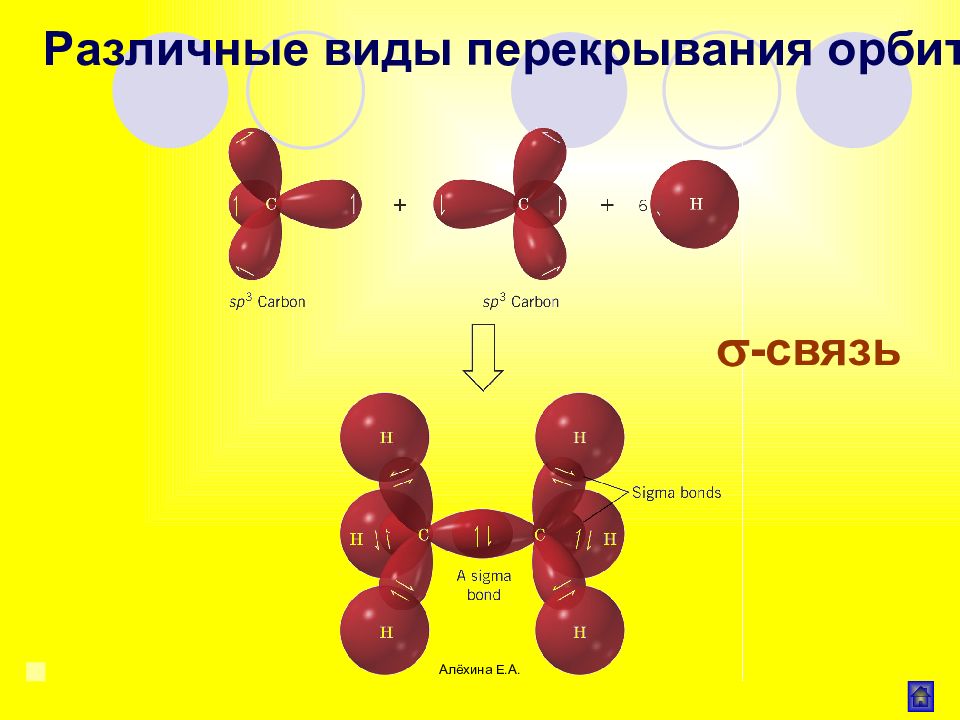
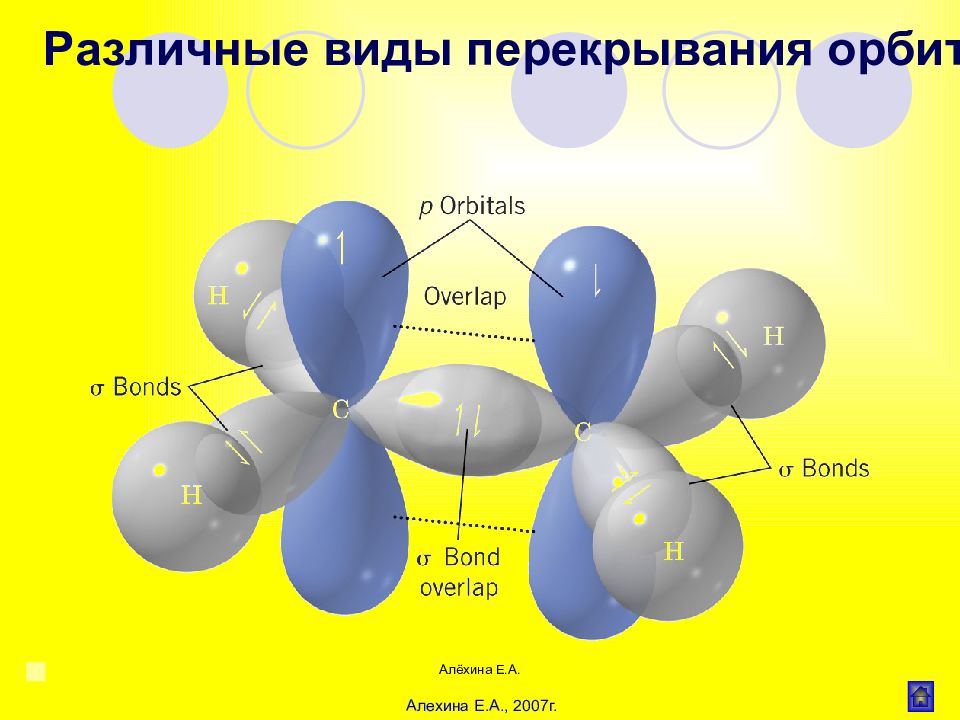
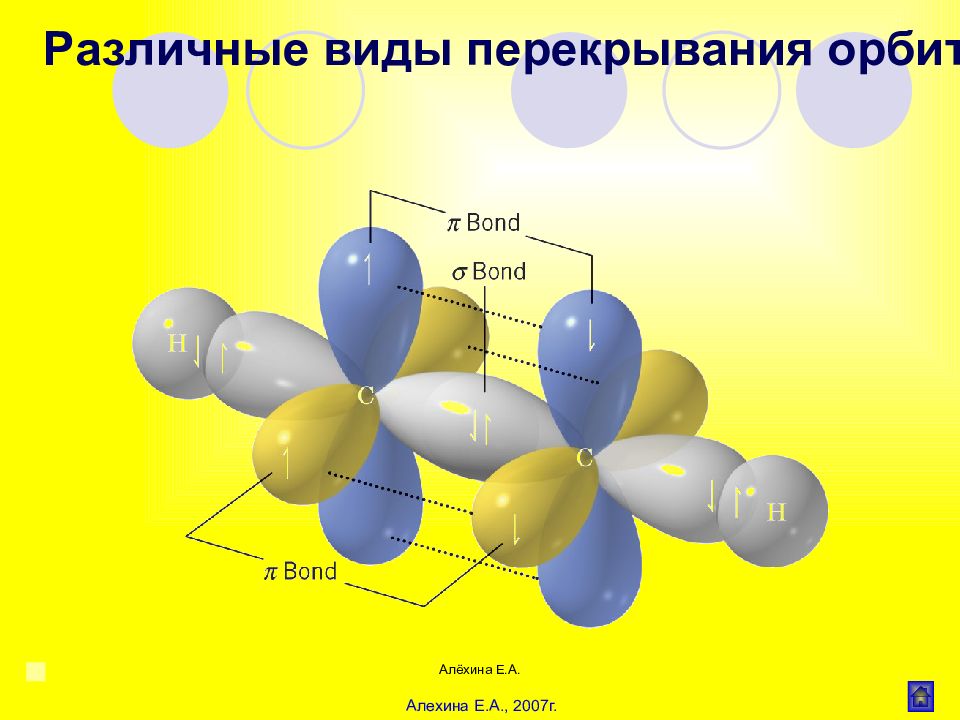
Алёхина Е.А. σ - связь Область максимального перекрывания электронной плотности или перекрывания электронных орбиталей лежит на линии соединяющей центры атомов. Различные виды перекрывания орбиталей
Слайд 25
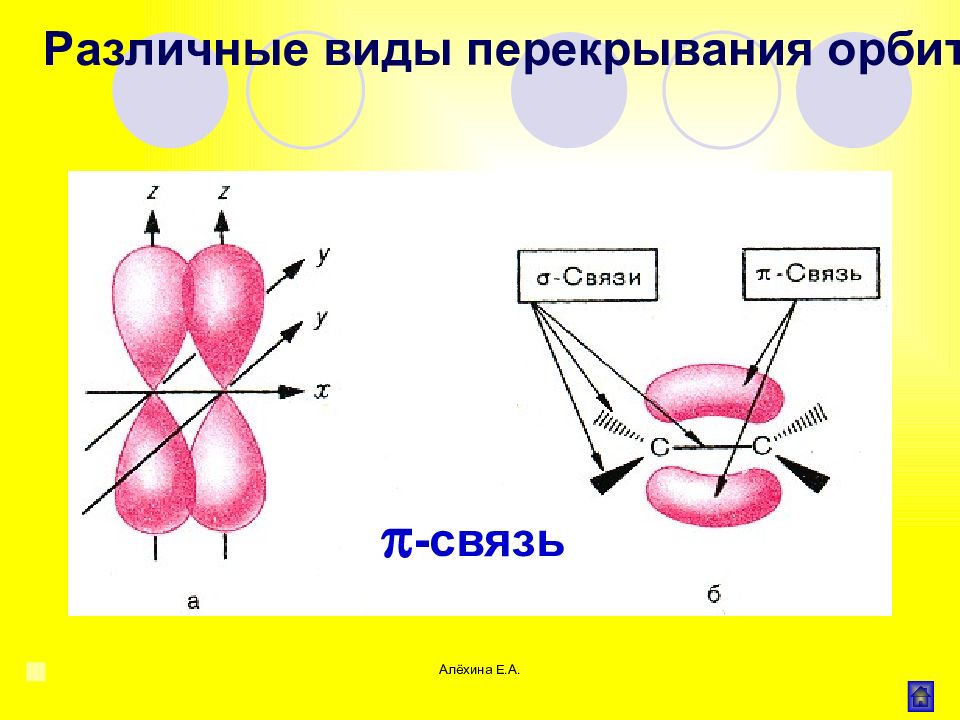
Алёхина Е.А. Связь образованная при перекрывании р- орбиталей соседних атомов Различные виды перекрывания орбиталей -связь
Слайд 32
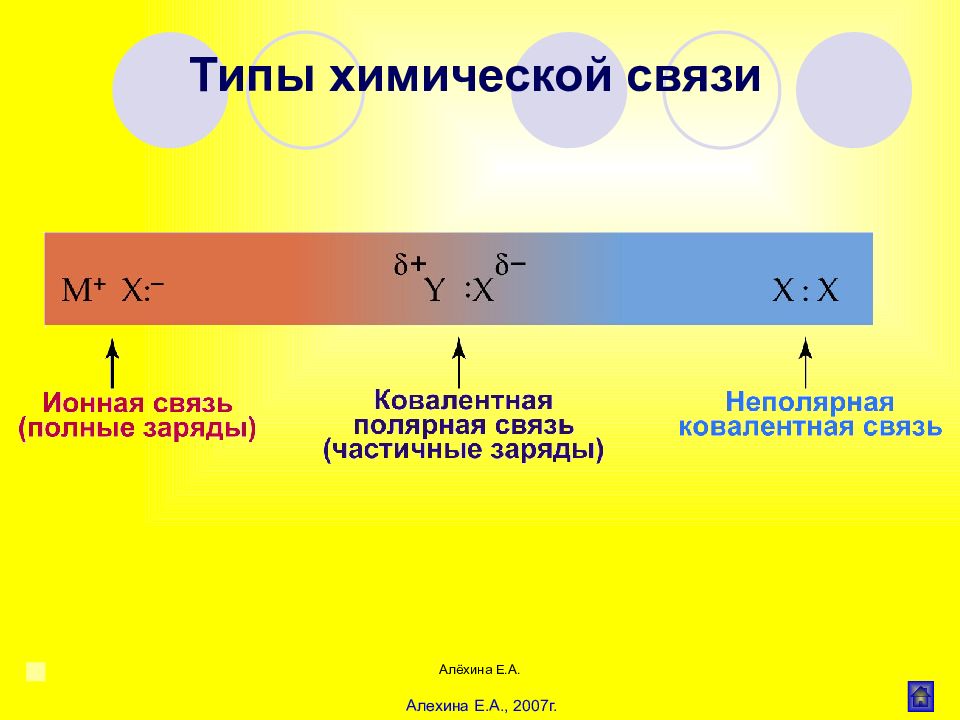
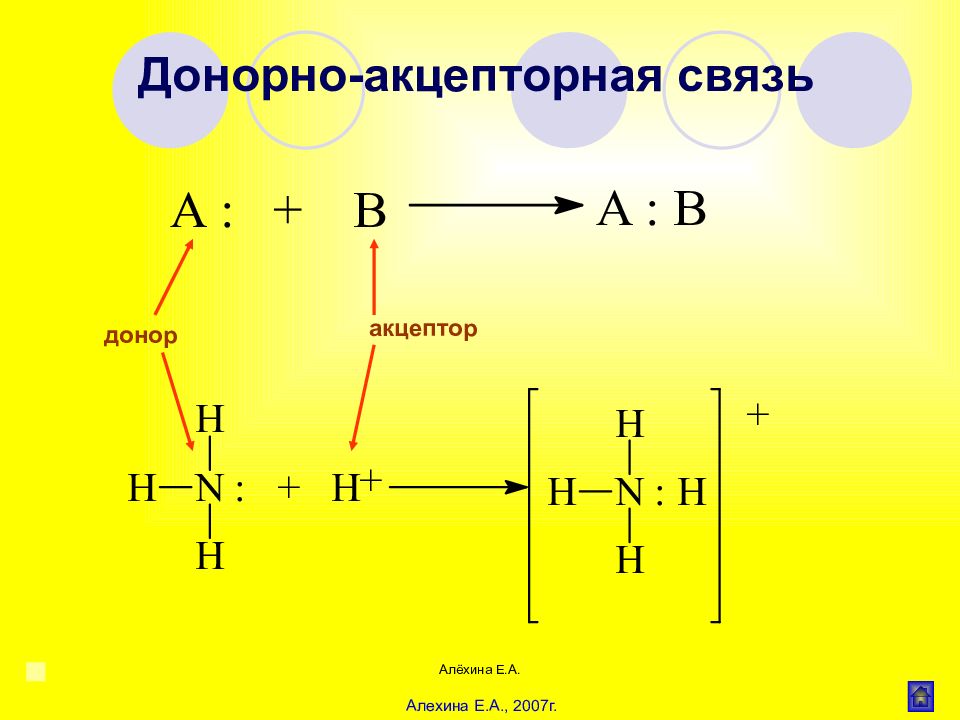
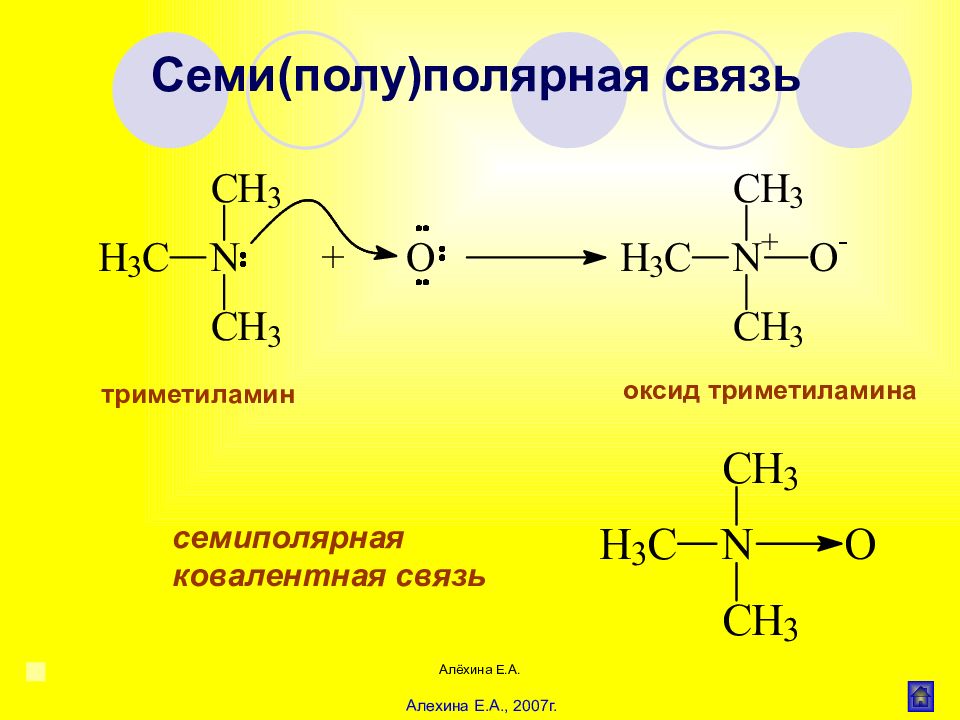
Алёхина Е.А. Ионная (гетерополярная) связь СН 3 СОО Na Ковалентная (гомеополярная) связь СН 3 -СН 3, Cl - Cl Донорноакцепторная (координационная) связь : NH 3 + Н + 3 HN : +Н [ NH 4 ] + CH 3 - NH 2 + Н + CH 3 - NH 3 + Семи(полу)полярная связь А : + В А+ : В– (или А В) Водородная связь Внутримолекулярная Межмолекулярная (ДНК и РНК) (вода, спирты, карб.кислоты) Основные типы химической связи в органических соединениях Алехина Е.А., 2007г.
Слайд 37
Алёхина Е.А. донор акцептор Донорно-акцепторная связь Алехина Е.А., 2007г.
Слайд 38
Алёхина Е.А. триметиламин оксид триметиламина семиполярная ковалентная связь Семи(полу)полярная связь Алехина Е.А., 2007г.
Слайд 39
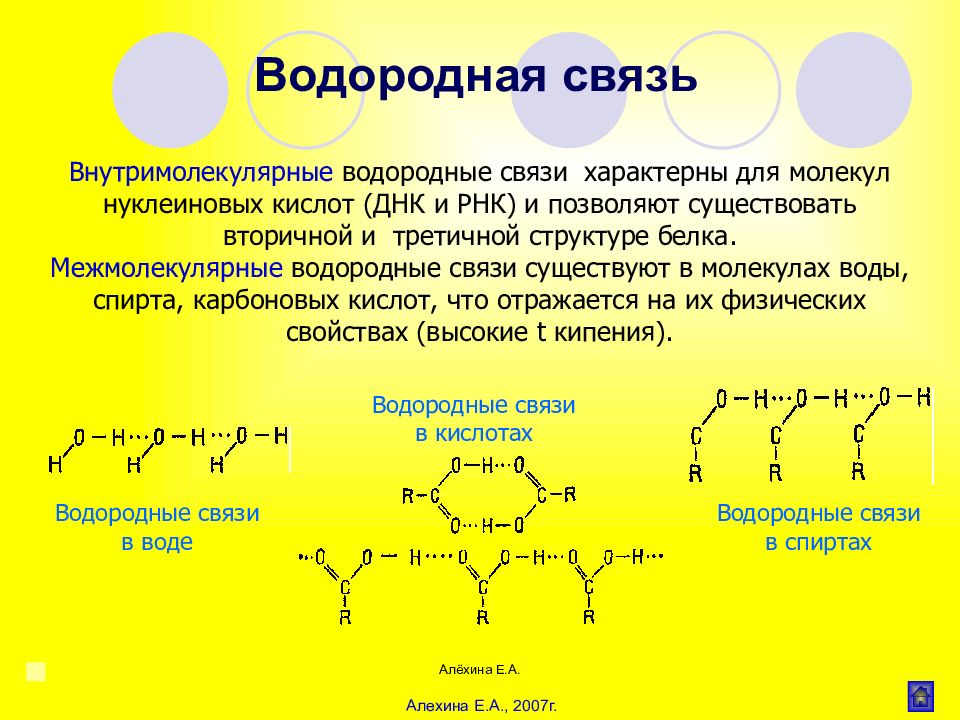
Алёхина Е.А. Водородная связь осуществляется при участии электроно-дефицитного атома водорода, ковалентно связанного с электроотрицательным атомом (фтор, кислород, азот). Он способен к дополнительному электростатическому взаимодействию с другим атомом, имеющим неподеленную пару электронов. Энергия водородных связей значительно меньше, чем ковалентных, т.е. они менее прочные. Существуют меж- и внутримолекулярные водородные связи, т. е. возникающие между атомами разных или одной и той же молекулы. Водородная связь 12,5—20 кДж/моль Алехина Е.А., 2007г.
Слайд 40
Алёхина Е.А. Внутримолекулярные водородные связи характерны для молекул нуклеиновых кислот (ДНК и РНК) и позволяют существовать вторичной и третичной структуре белка. Межмолекулярные водородные связи существуют в молекулах воды, спирта, карбоновых кислот, что отражается на их физических свойствах (высокие t кипения). Водородная связь Водородные связи в воде Водородные связи в спиртах Водородные связи в кислотах Алехина Е.А., 2007г.
Слайд 41
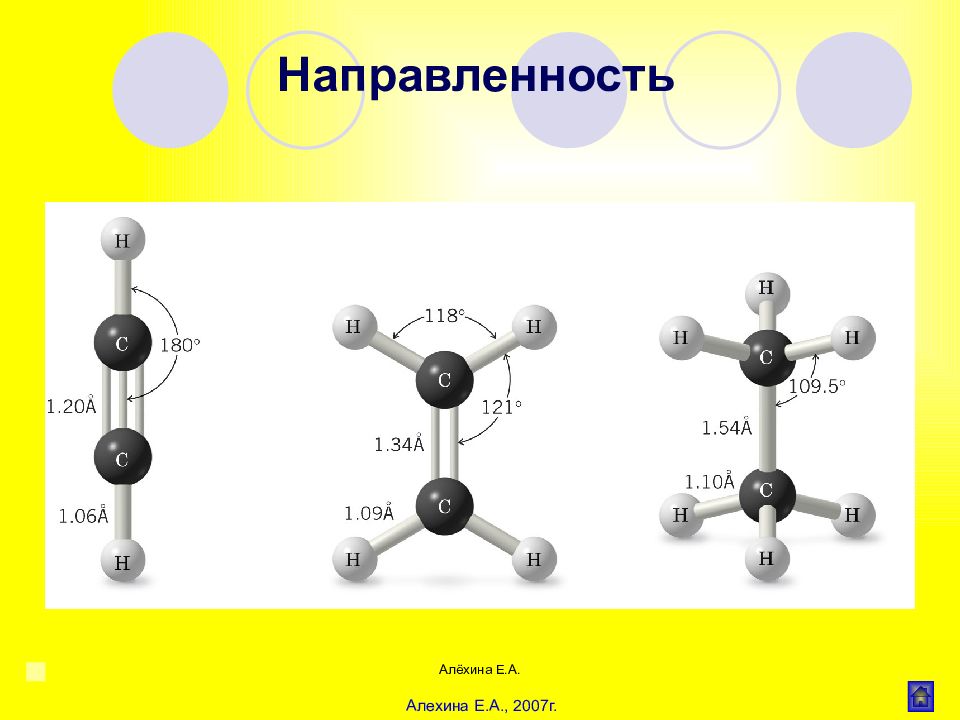
Алёхина Е.А. Прочность связи Энергия связи – энергия, затрачиваемая на разрыв этой связи или выделяющаяся при ее образовании в расчете на 1 моль частиц. Длина – равновесное расстояние между центрами ядер. Значения длины С-С связи колеблются от 1,204 до 1,543 А, в зависимости от типа гибридизации. Валентный угол для sp 3 -гибридных он равен 109,5 , для sp 2 -гибридных – 120 , для sp -гибридных – 180 . Полярность (поляризуемость) Дипольный момент для ковалентных связей от 0 до 3, для координационных 2-7, для ионных выше 7. Характеристики химической связи в органических соединениях Алехина Е.А., 2007г.
Слайд 42
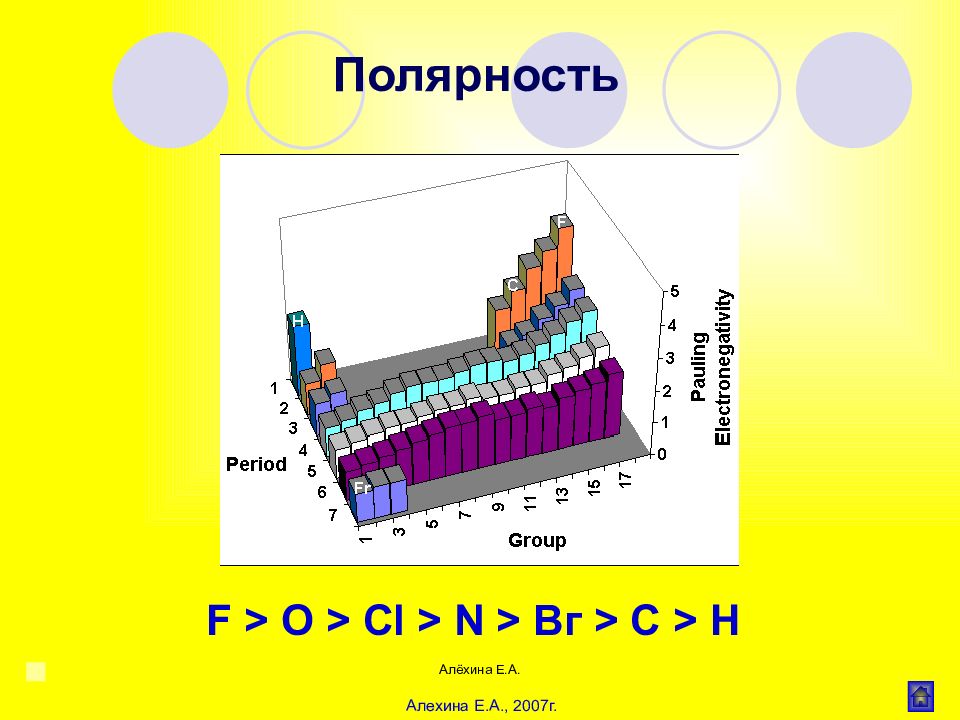
Алёхина Е.А. F > O > С l > N > Вг > С > Н Полярность Алехина Е.А., 2007г.
Слайд 44
Алёхина Е.А. способность изменять свою полярность, например, под влиянием внешнего воздействия. -связи поляризуются гораздо легче, чем -связи Поляризуемость Алехина Е.А., 2007г.
Слайд 45
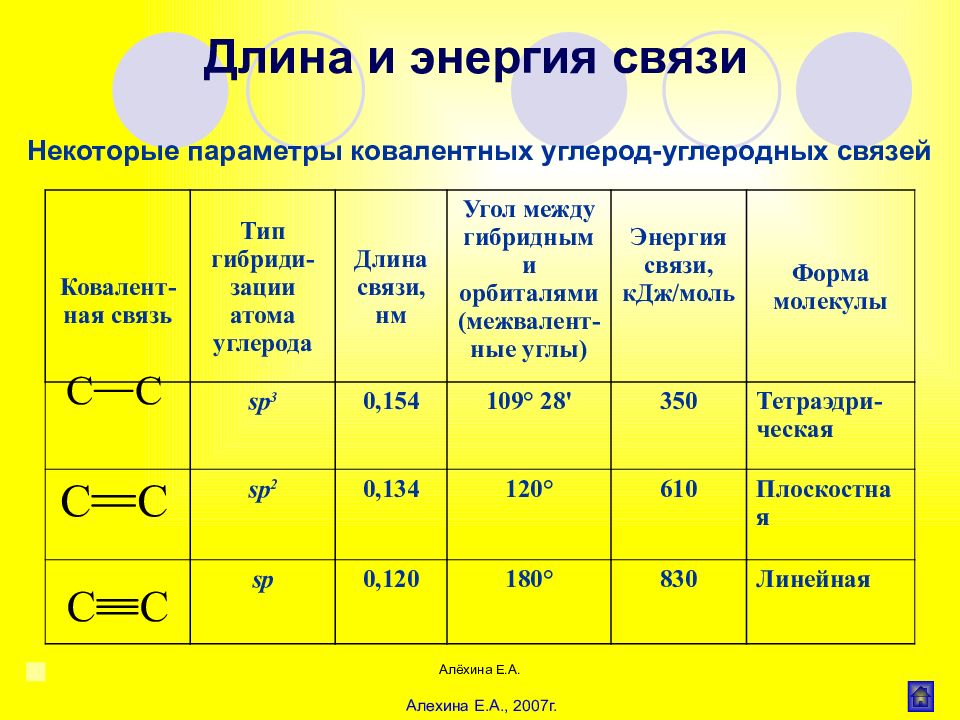
Алёхина Е.А. Некоторые параметры ковалентных углерод-углеродных связей Длина и энергия связи Алехина Е.А., 2007г. Ковалент-ная связь Тип гибриди- зации атома углерода Длина связи, нм Угол между гибридными орбиталями (межвалент-ные углы) Энергия связи, кДж/моль Форма молекулы sp 3 0,154 109° 28' 350 Тетраэдри-ческая sp 2 0,134 120° 610 Плоскостная sp 0,120 180° 830 Линейная
Слайд 47
Алёхина Е.А. I. По направлению ( результату ) реакции II. По типу разрыва связи III. По характеру реагирующих частиц IV. По молекулярности реакции Классификации органических реакций
Слайд 48
Алёхина Е.А. I. Классификация по направлению (результату) реакции Замещение ( substitution – S ); Присоединение ( addition – A ); Элиминирование ( elimination – E ) или отщепление
Слайд 49
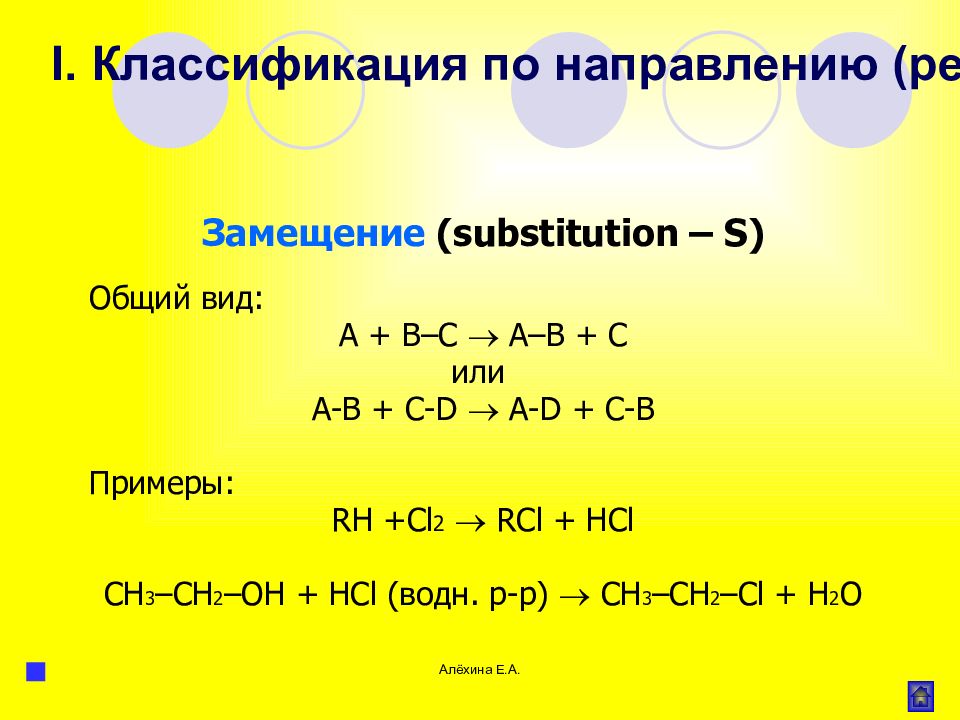
Алёхина Е.А. Замещение ( substitution – S ) Общий вид: А + В–С А–В + С или А-В + С- D A-D + С-В Примеры: RH + Cl 2 RCl + HCl CH 3 – CH 2 – OH + HCl (водн. р-р) CH 3 – CH 2 – Cl + H 2 O I. Классификация по направлению (результату) реакции
Слайд 50
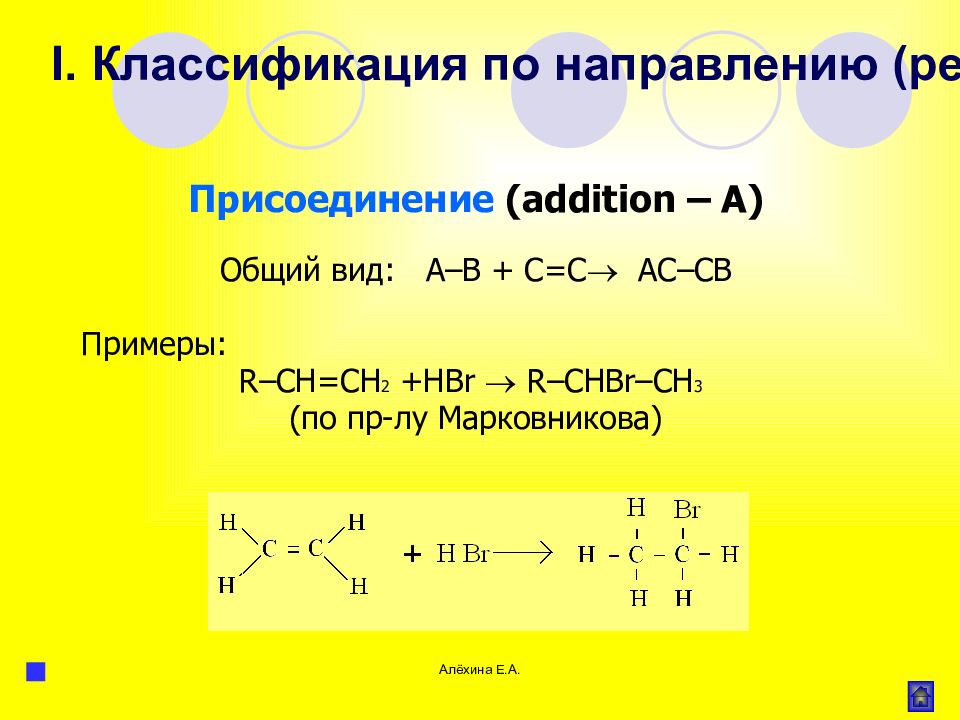
Алёхина Е.А. Присоединение ( addition – A ) Общий вид: А–В + С=С АС–СВ Примеры: R –С H = CH 2 + HBr R – CHBr – CH 3 (по пр-лу Марковникова) I. Классификация по направлению (результату) реакции
Слайд 51: Полимеризация
Алёхина Е.А. Полимеризация Соединения исходных веществ (мономеров) без выделения побочных продуктов, что приводит к образованию веществ, имеющих состав, тождественный составу мономеров. I. Классификация по направлению (результату) реакции
Слайд 52
Алёхина Е.А. Отщепление или элиминирование ( elimination – E ) Общий вид: АС–СВ А–В + С=С Примеры: СН 3 –С H 2 –ОН NaOH (спирт. р-р) CH 2 = CH 2 + Н 2 О I. Классификация по направлению (результату) реакции Алехина Е.А., 2007г.
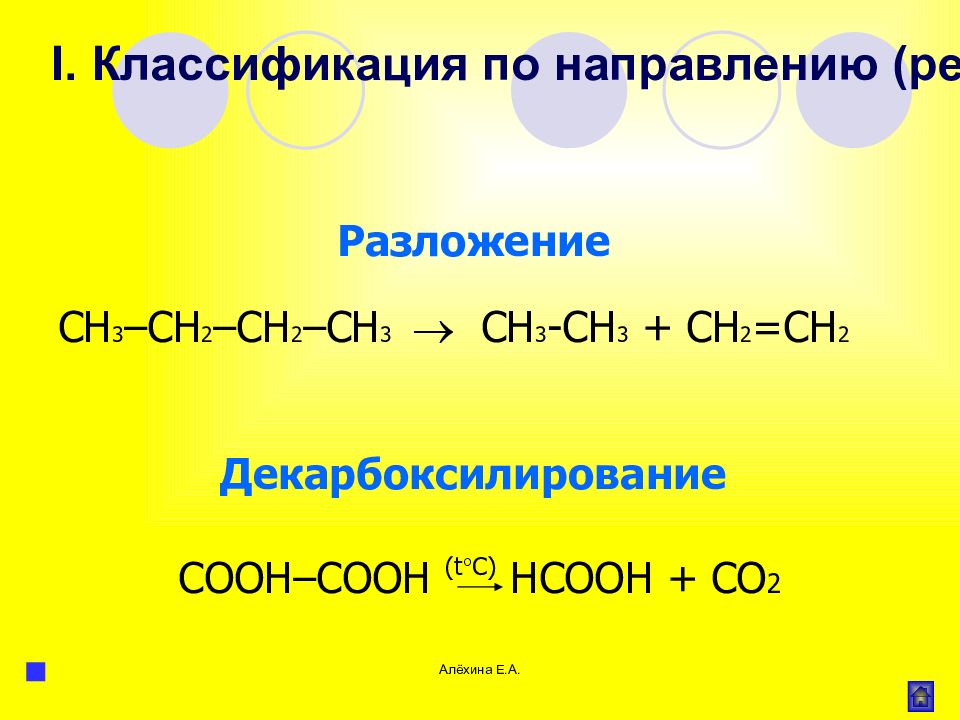
Слайд 53
Алёхина Е.А. Разложение СН 3 –СН 2 –СН 2 –СН 3 СН 3 -СН 3 + СН 2 =СН 2 I. Классификация по направлению (результату) реакции C ОО H – C ОО H ( t C ) HCOOH + С O 2 Декарбоксилирование
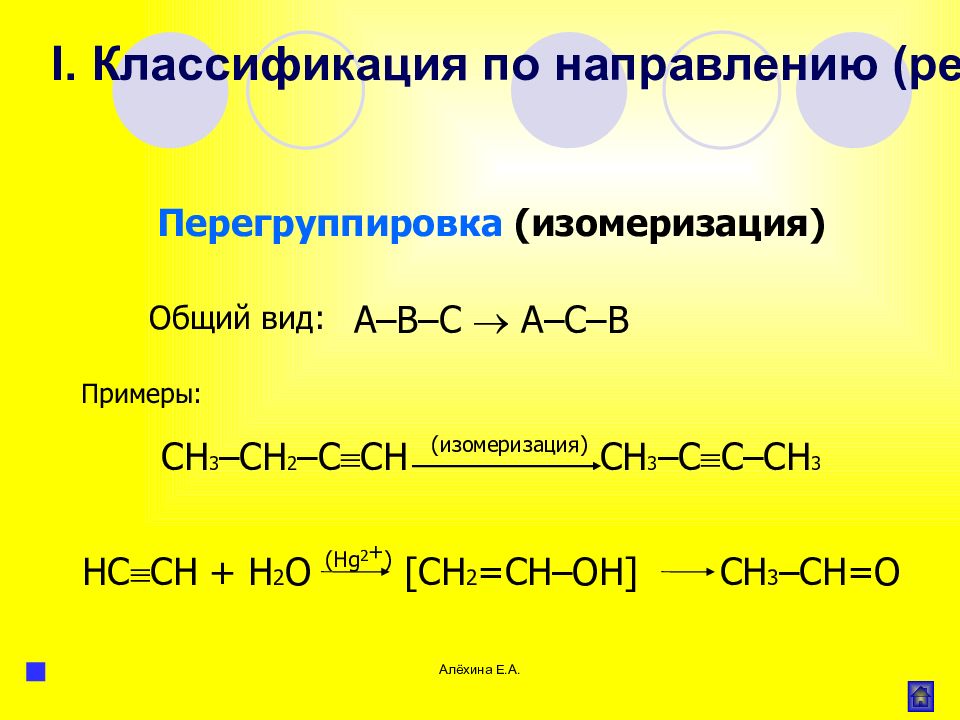
Слайд 54
Алёхина Е.А. Перегруппировка (изомеризация) А–В–С А–С–В CH 3 – CH 2 – C CH (изомеризация) CH 3 – C С–С H 3 НC CH + Н 2 О (Hg 2 + ) [CH 2 =CH–OH] СH 3 –CH=O Примеры: Общий вид: I. Классификация по направлению (результату) реакции
Слайд 55
Алёхина Е.А. Окислительно-восстановительные реакции Окисление 3СН 3 – С H 2 – ОН + K 2 Cr 2 O 7 + 4H 2 SO 4 3CH 3 –CH=O + Cr 2 (SO 4 ) 3 + К 2 SO 4 + 7 H 2 O Восстановление С H 2 = CH 2 + H 2 CH 3 – CH 3 I. Классификация по направлению (результату) реакции
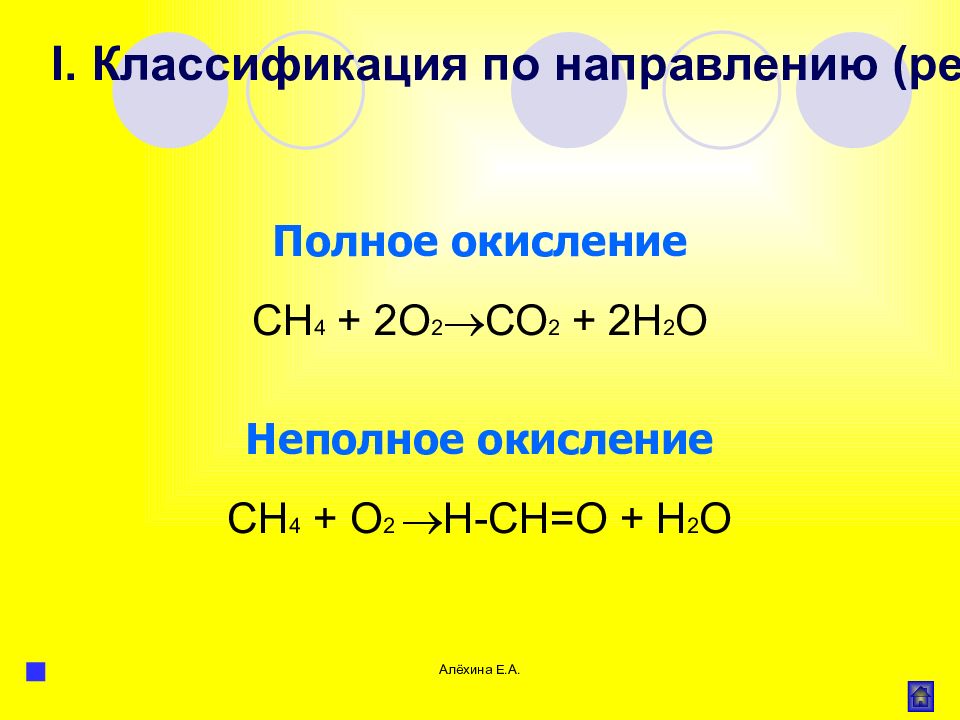
Слайд 56
Алёхина Е.А. Полное окисление СН 4 + 2О 2 СО 2 + 2Н 2 О Неполное окисление СН 4 + О 2 Н-СН=О + Н 2 О I. Классификация по направлению (результату) реакции
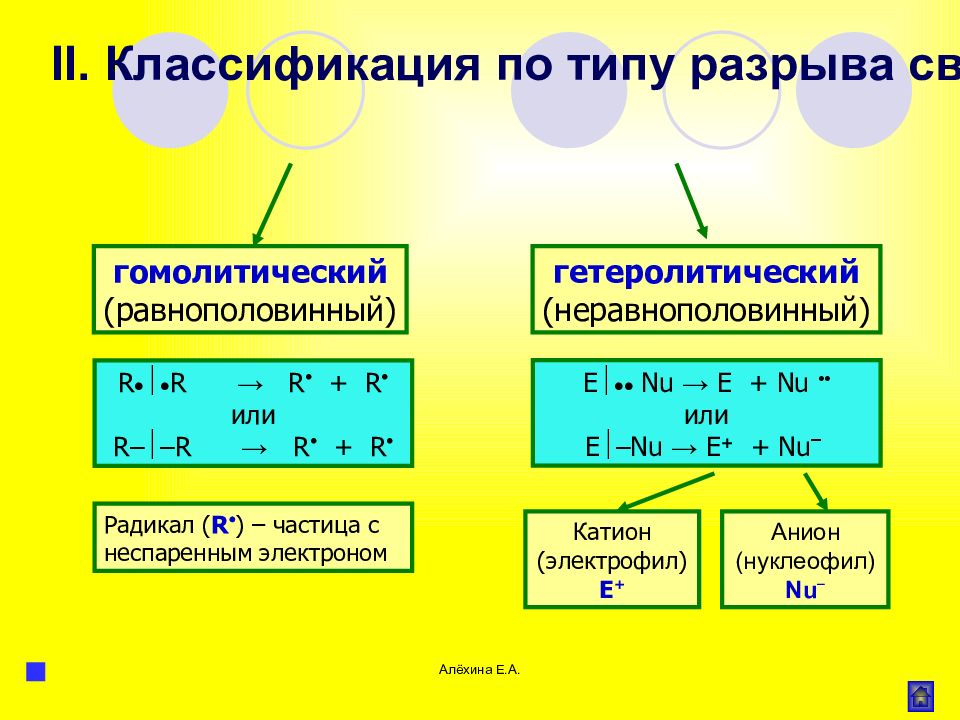
Слайд 57
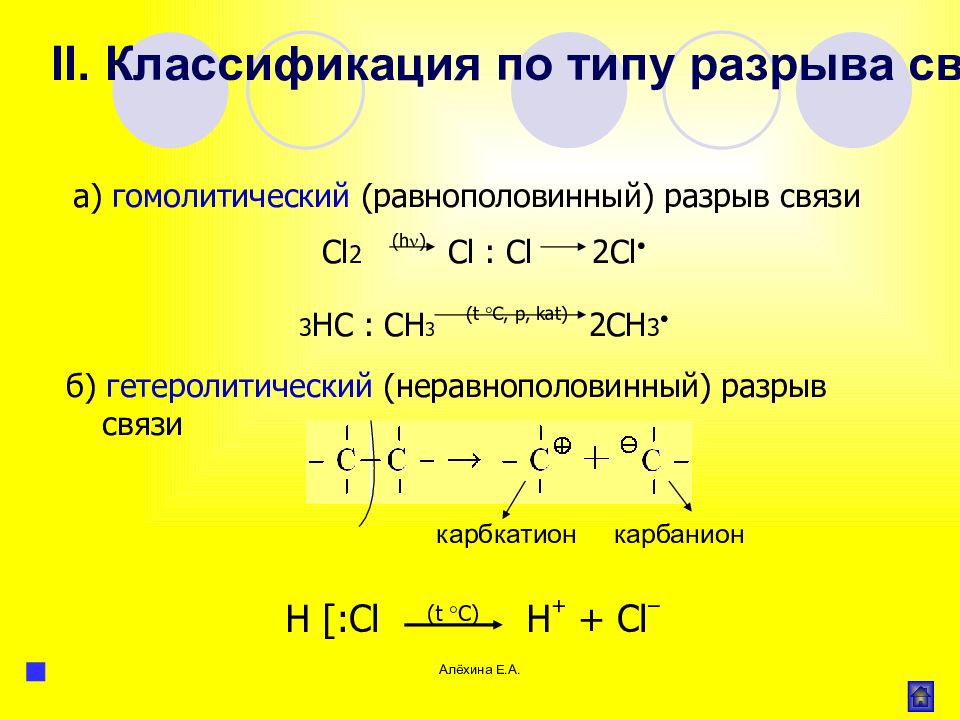
Алёхина Е.А. гомолитический (равнополовинный) гетеролитический (неравнополовинный) R R → R + R или R – – R → R + R E Nu → Е + Nu или E – Nu → Е + + Nu – Радикал ( R ) – частица с неспаренным электроном Катион (электрофил) Е + Анион (нуклеофил) Nu – II. Классификация по типу разрыва связи
Слайд 58
Алёхина Е.А. б) гетеролитический (неравнополовинный) разрыв связи карбкатион карбанион Cl 2 ( h ) Cl : Cl 2 Cl 3 НС : С H 3 ( t C, p, kat ) 2СН 3 а) гомолитический (равнополовинный) разрыв связи II. Классификация по типу разрыва связи H [: Cl ( t C ) H + + Cl –
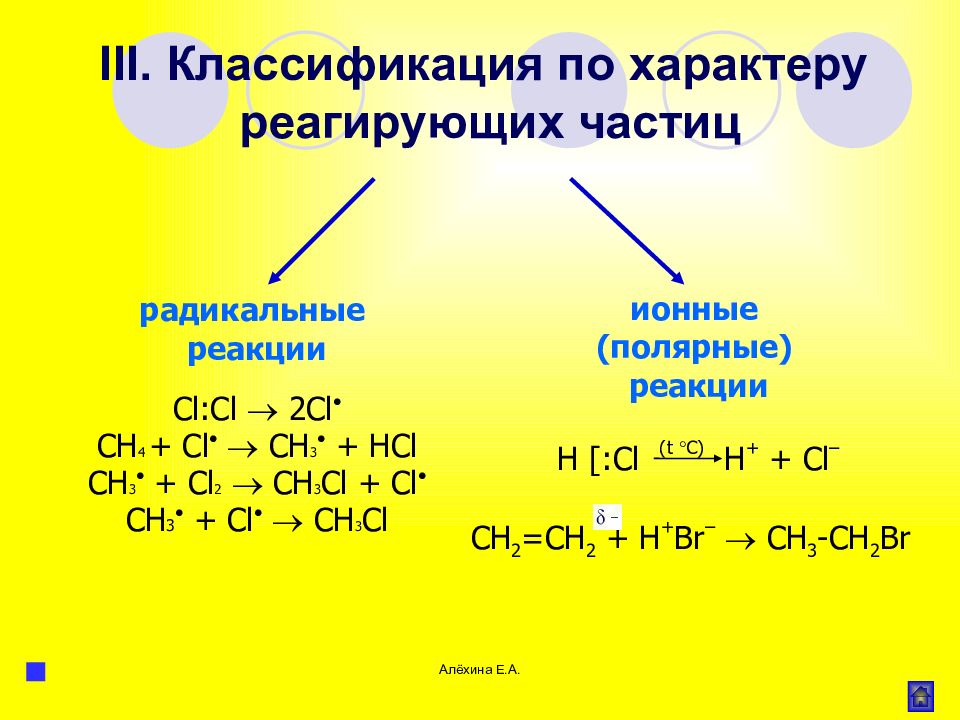
Слайд 59
Алёхина Е.А. Cl:Cl 2Cl С H 4 + Cl CH 3 + HCl С H 3 + Cl 2 CH 3 Cl + Cl С H 3 + Cl CH 3 Cl радикальные реакции ионные (полярные) реакции H [: Cl ( t C ) H + + Cl – III. Классификация по характеру реагирующих частиц СН 2 =СН 2 + H + Br – CH 3 -CH 2 Br
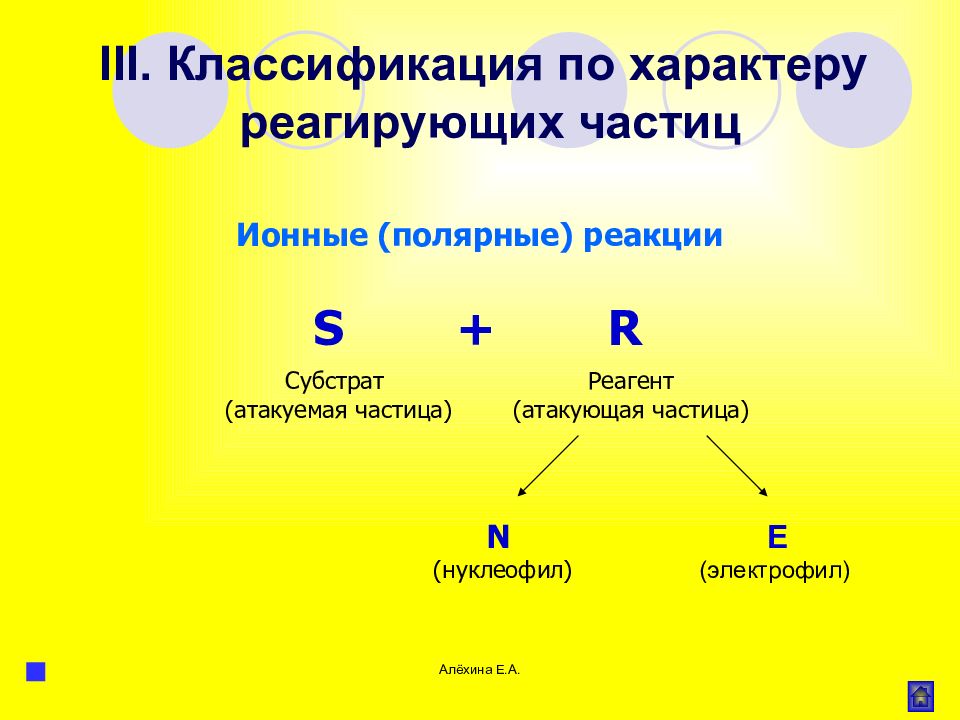
Слайд 60
Алёхина Е.А. E (электрофил) Ионные (полярные) реакции S + R Субстрат (атакуемая частица) Реагент (атакующая частица) N ( нуклеофил ) III. Классификация по характеру реагирующих частиц
Слайд 61
Алёхина Е.А. Нуклеофильные реагенты ( N ) Н У К Л Е О Ф И Л Ь Н Ы Е Ч А С Т И Ц Ы : сила ОН– О R – SR – RC О O – Hal – CN – NH 2 – : NH 3 R Ő H слабость III. Классификация по характеру реагирующих частиц
Слайд 62
Алёхина Е.А. Электрофильные реагенты (Е) Э Л Е К Т Р О Ф И Л Ь Н Ы Е Ч А С Т И Ц Ы : сила H+ H 3 О + C 6 H 5 N 2 + HNO 2 (OH–NO+) c лабость Различают реакции S N, S E, S R, A N, A E, A R III. Классификация по характеру реагирующих частиц
Слайд 63
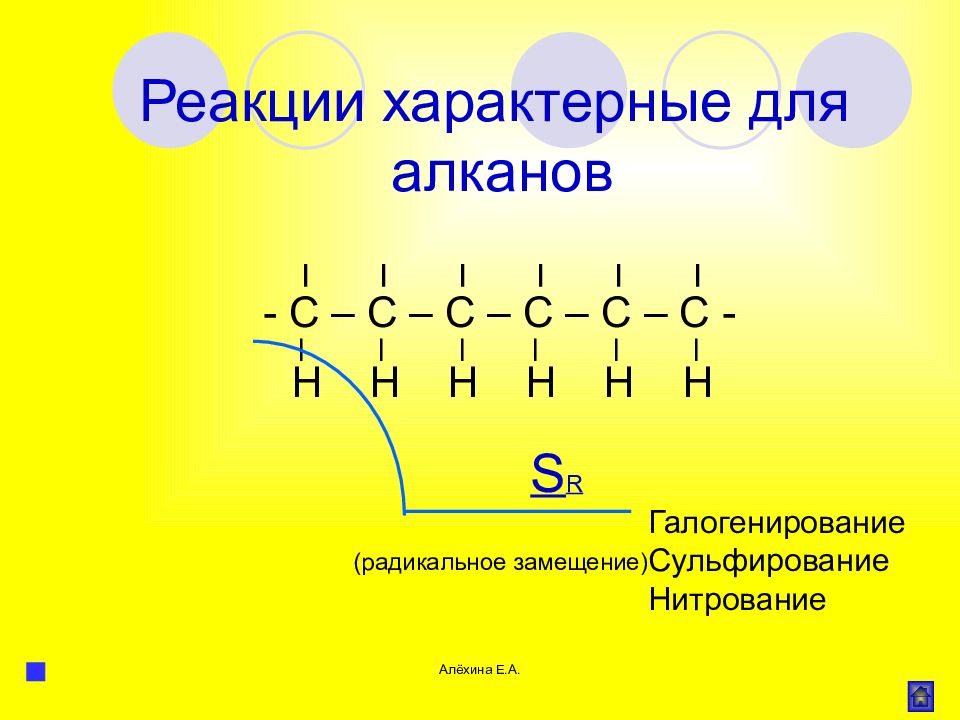
Алёхина Е.А. | | | | | | - С – С – С – С – С – С - | | | | | | Н Н Н Н Н Н S R Галогенирование Сульфирование Нитрование Реакции характерные для алканов (радикальное замещение)
Слайд 64
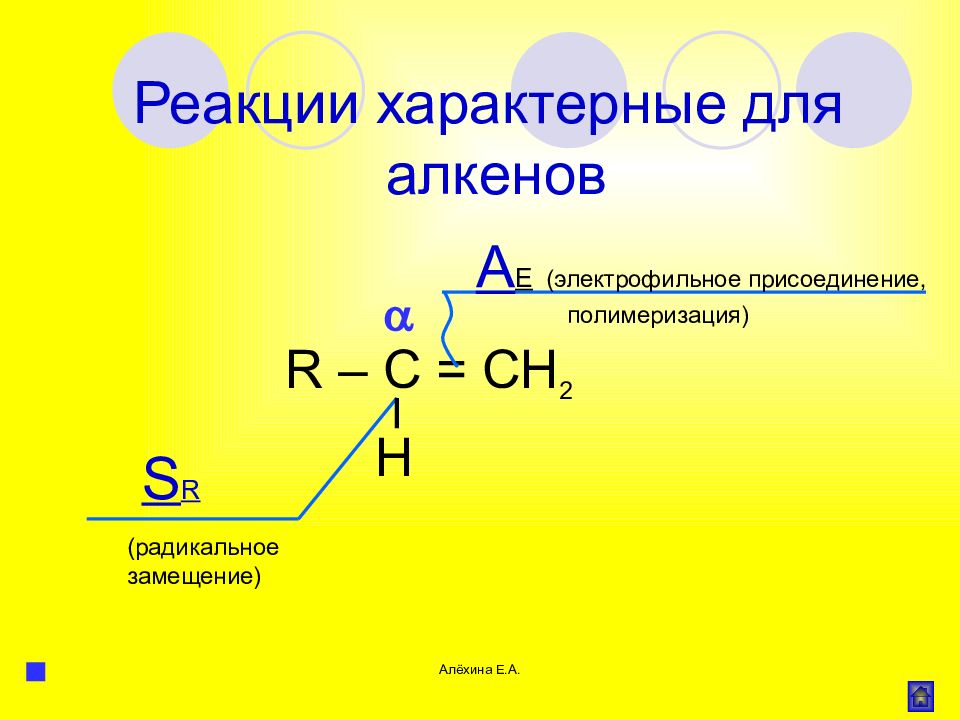
Алёхина Е.А. R – C = CH 2 Н S R (радикальное замещение) Реакции характерные для алкенов A E (электрофильное присоединение, полимеризация)
Слайд 65
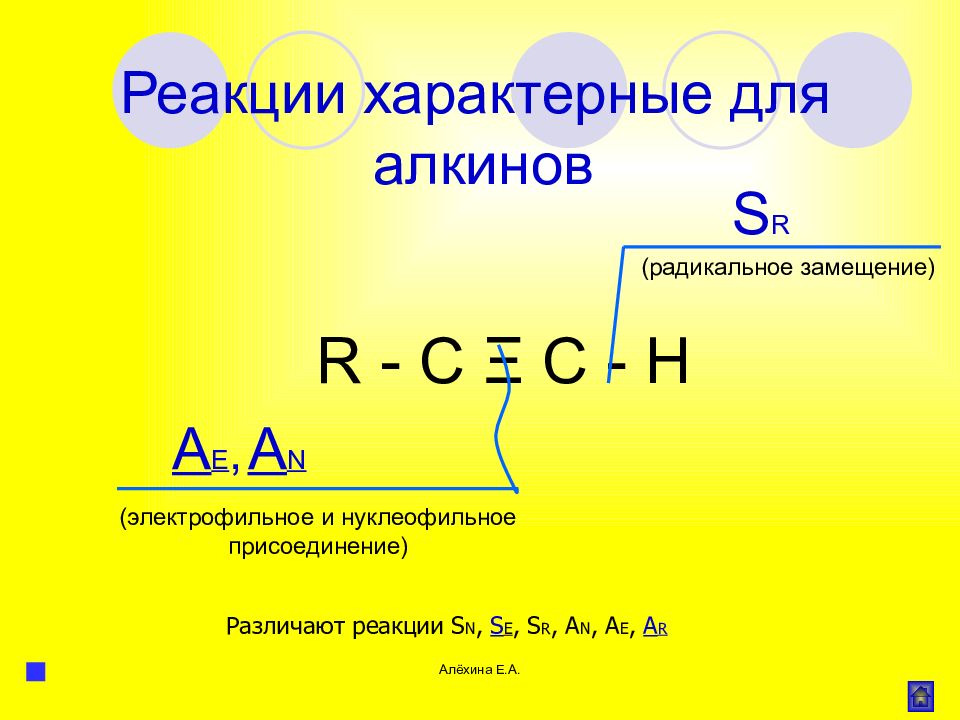
Алёхина Е.А. R - C Ξ C - H A E, S R A N (электрофильное и нуклеофильное присоединение) (радикальное замещение) Реакции характерные для алкинов Различают реакции S N, S E, S R, A N, A E, A R
Слайд 66
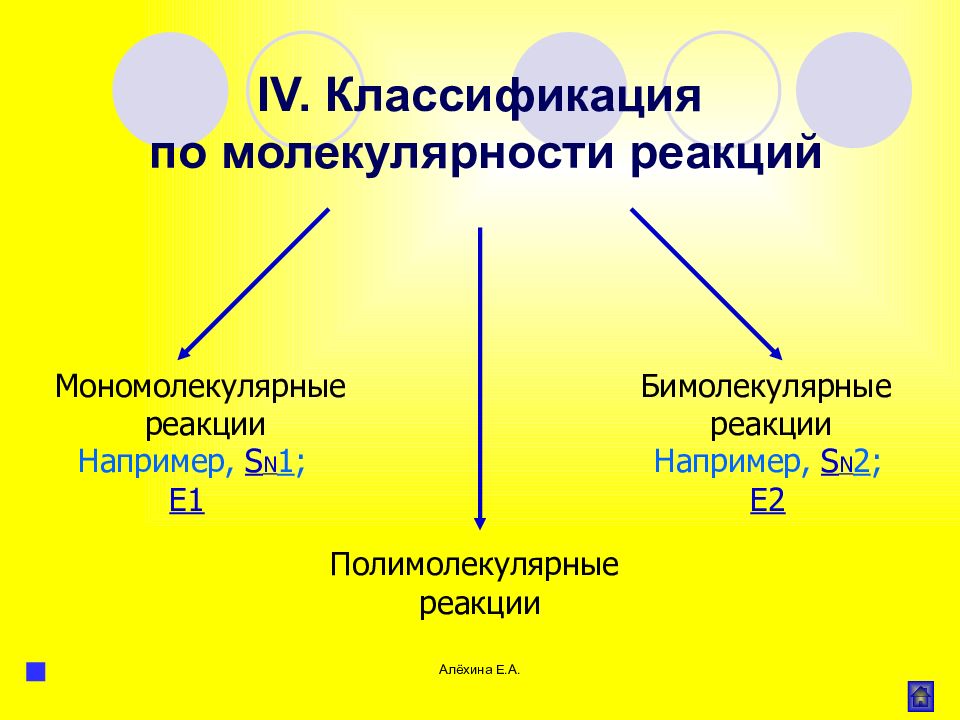
Алёхина Е.А. Мономолекулярные реакции Бимолекулярные реакции IV. Классификация по молекулярности реакций Например, S N 1 ; Е1 Например, S N 2 ; Е2 Полимолекулярные реакции
Последний слайд презентации: Алёхина Е.А. Введение в органическую химию
Алёхина Е.А. Литература Ким А.М. Органическая химия. – Новосибирск: Сиб. унив. изд-во, 2004. – 842 с. Перекалин В.В. и др. Органическая химия. – М.: Просвещение, – М., 1982. – 560 с. Степаненко Б.Н. Курс органической химии. В 2-х т. – М.: Высшая школа, 1981. Травень В.Ф. Органическая химия. В 2-х т. – М.: ИКЦ «Академкнига», 2005. Шабаров Ю.С. Органическая химия. В 2-х т. – М.: Химия, 1996.