Первый слайд презентации: Биологические мембраны
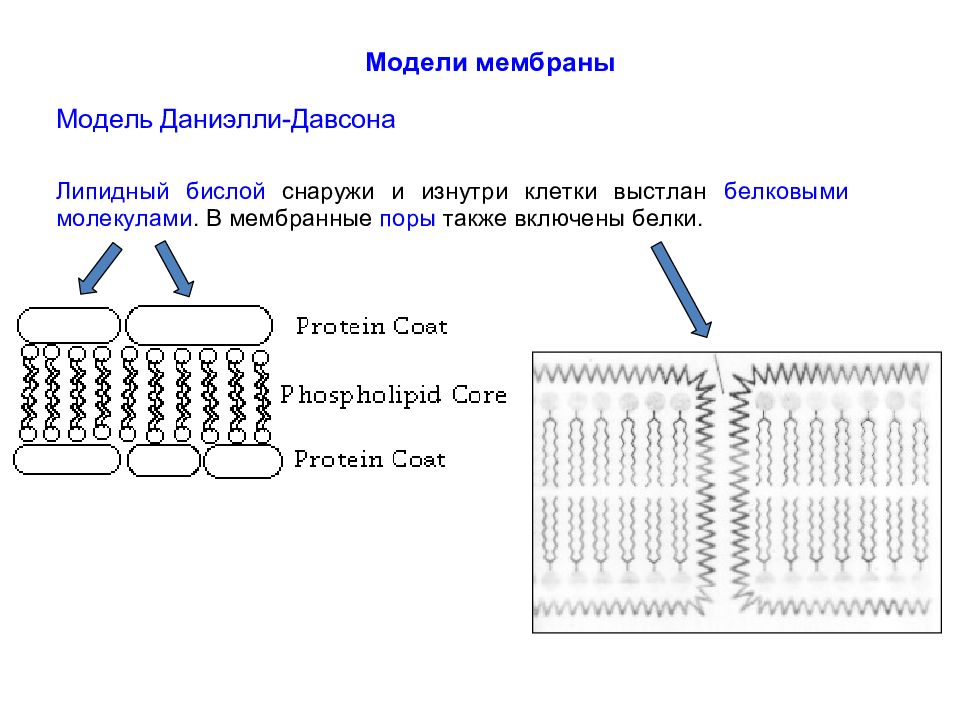
Д о середины XX в. мембрану рассматривали как относительно простое образование, выполняющее лишь немногие простые стереотипные для различных клеток функции. До 1960-х г.г. сведения о мембранах были сравнительно ограничены. Было известно, что мембраны несомненно очень тонкие (порядка 10 нм), состоят из липидного бислоя с интегрированными белковыми молекулами.
Слайд 4: Биологические мембраны
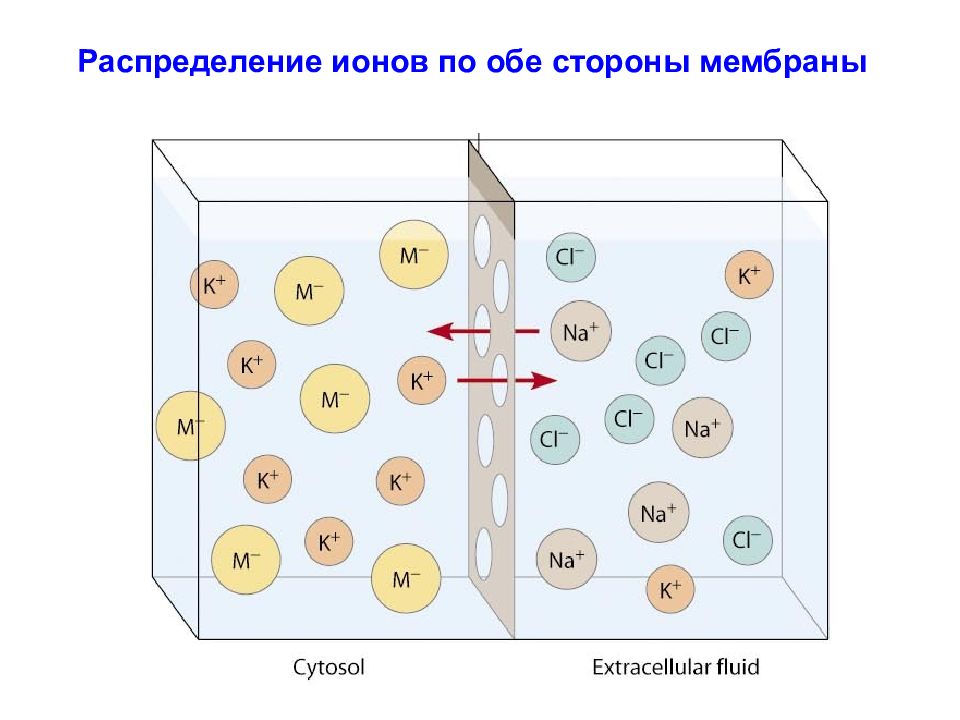
В покое мембраны являются электрически заряженными (поляризованными). Они имеют в своем составе водные поры, через которые транспортируются некоторые ионы, изменяющие заряд мембраны. Такие изменения заряда представляют собой различные потенциалы, обеспечивающие межклеточную коммуникацию. Транспорт (ток) ионов контролируется различными мембранными электрическими сенсорами и линганд-активируемыми рецепторами. Ионные токи вызывают генерацию нервных импульсов, градуальных потенциалов и иногда выделение медиаторов. Мембраны также способствуют росту и развитию дендритов и аксонов, необходимых для локального и дистантного межклеточного взаимодействия.
Слайд 5: Биологические мембраны
Новые методологические подходы 1970-х г.г. благодаря разработке новых методов рентгеноструктурного анализа, электронной микроскопии, кристаллографии, компьютерного анализа и моделирования, а также успехам в молекулярной биологии привели к новому пониманию значения клеточных мембран и открытию неизвестных прежде присущих им механизмов синаптического контроля и нейропластичности.
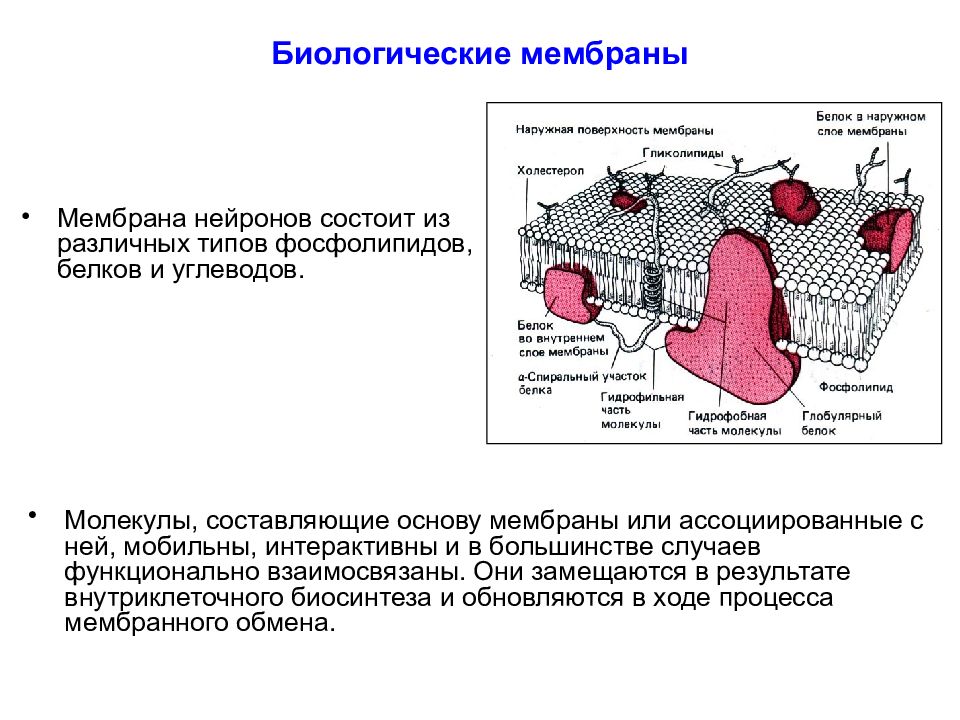
Слайд 9: Биологические мембраны
Мембрана нейронов состоит из различных типов фосфолипидов, белков и углеводов. Молекулы, составляющие основу мембраны или ассоциированные с ней, мобильны, интерактивны и в большинстве случаев функционально взаимосвязаны. Они замещаются в результате внутриклеточного биосинтеза и обновляются в ходе процесса мембранного обмена.
Слайд 10: Фосфолипиды клеточной мембраны
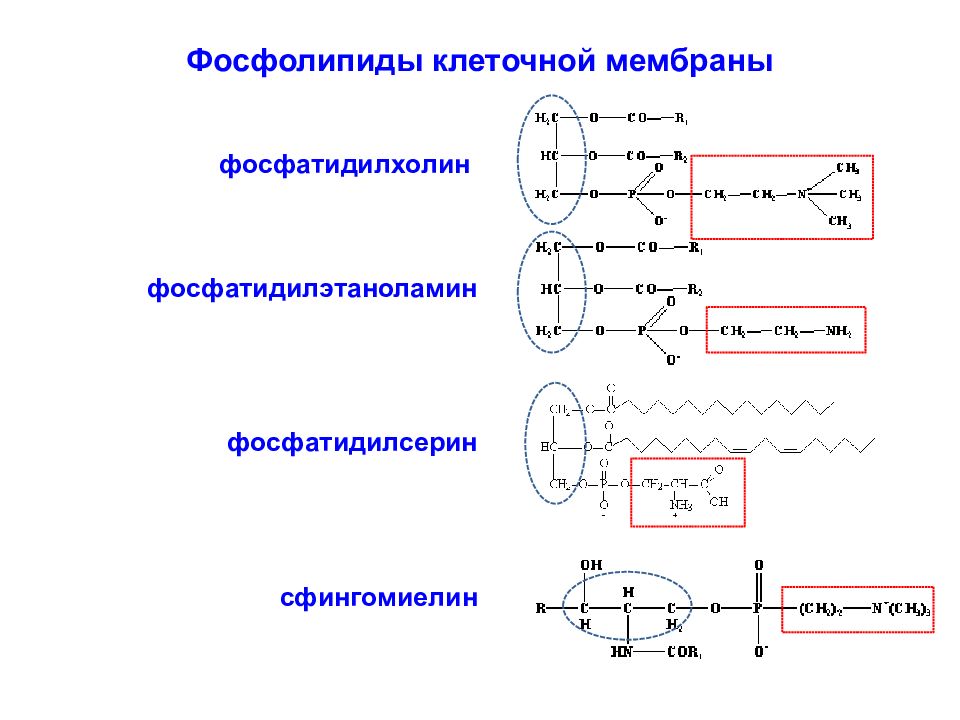
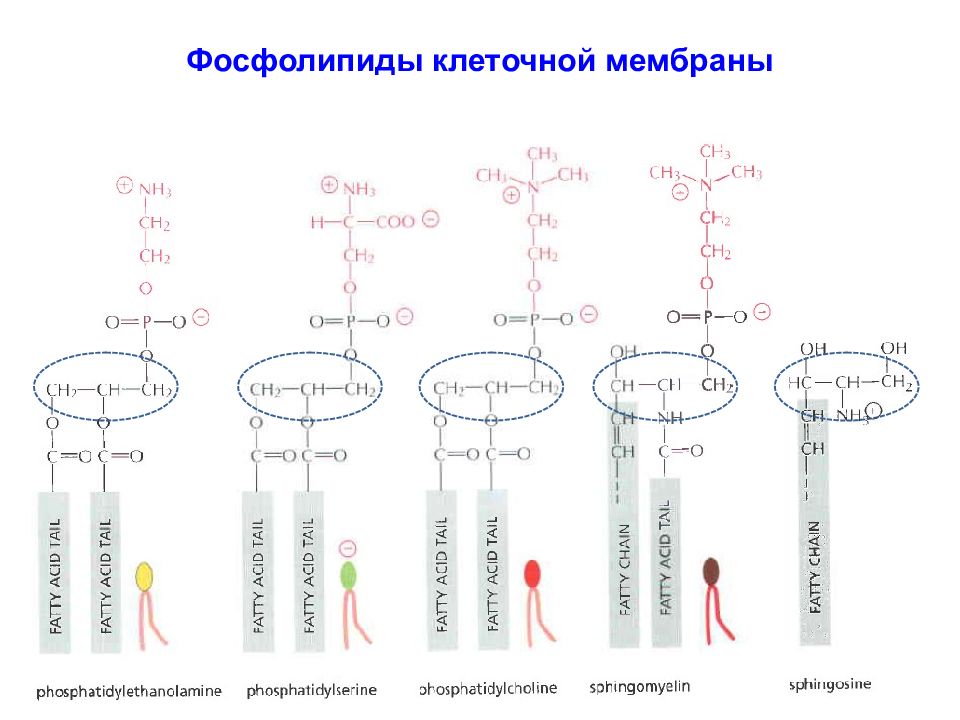
Основные компоненты бислоя мембраны представляют: фосфатидил-холин, сфинго-миелин, фосфатидил-этаноламин и фосфатидил-серин.
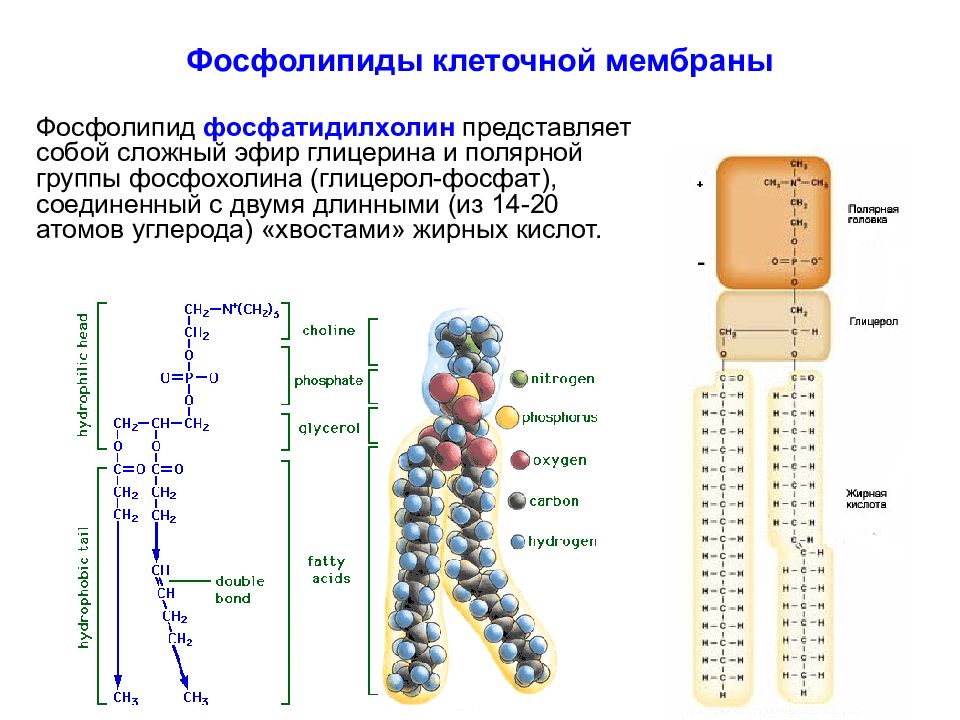
Слайд 11: Фосфолипиды клеточной мембраны
Фосфолипид фосфатидилхолин представляет собой сложный эфир глицерина и полярной группы фосфохолина (глицерол-фосфат), соединенный с двумя длинными (из 14-20 атомов углерода) «хвостами» жирных кислот.
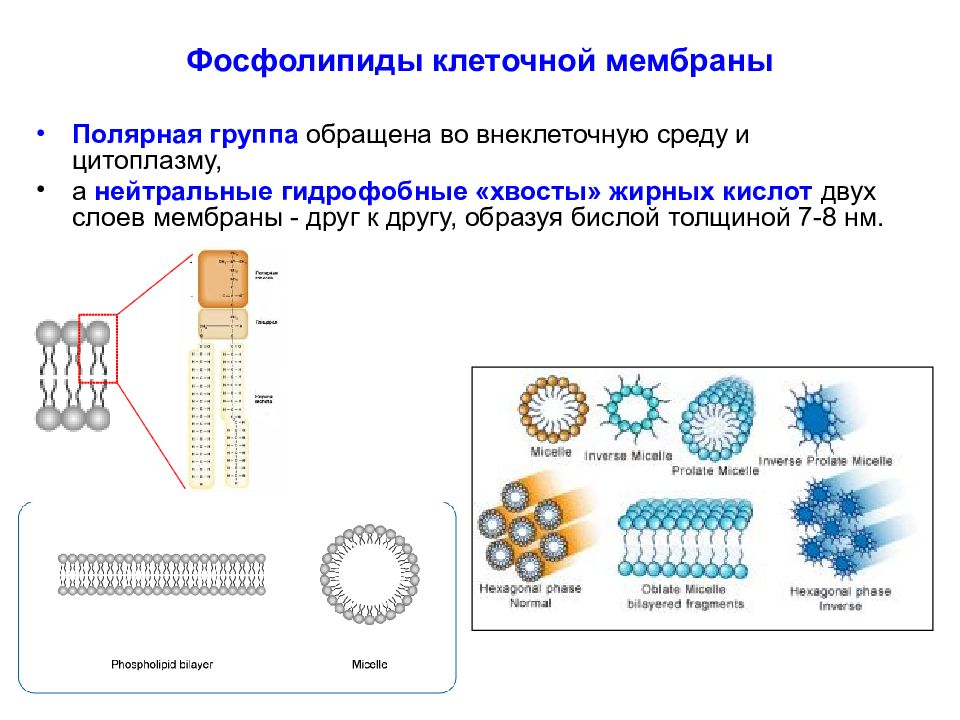
Слайд 12: Фосфолипиды клеточной мембраны
Полярная группа обращена во внеклеточную среду и цитоплазму, а нейтральные гидрофобные «хвосты» жирных кислот двух слоев мембраны - друг к другу, образуя бислой толщиной 7-8 нм.
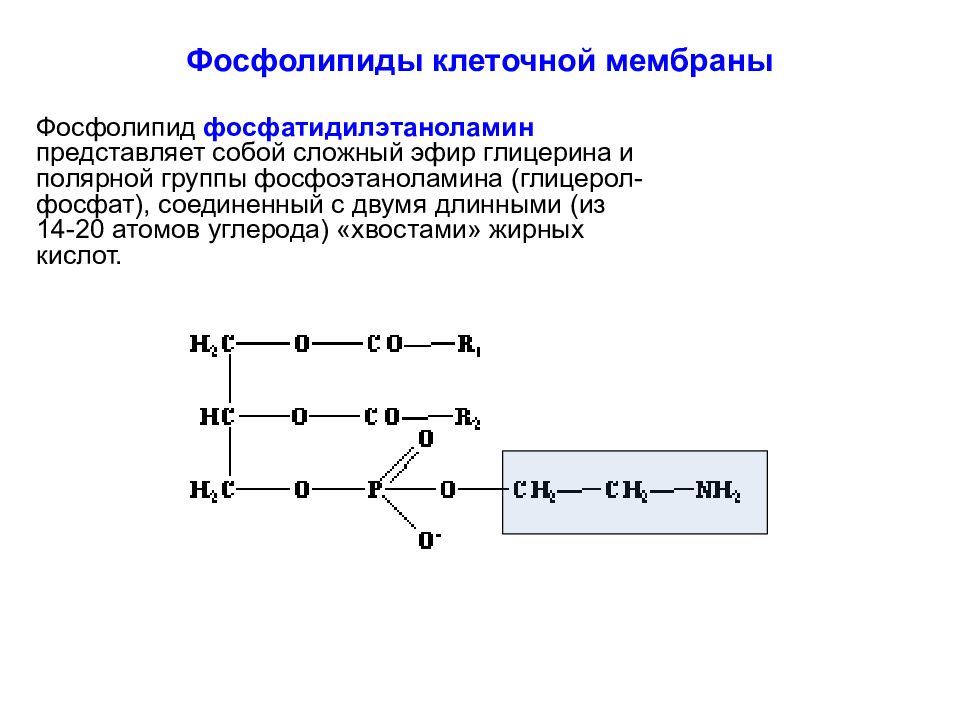
Слайд 13: Фосфолипиды клеточной мембраны
Фосфолипид фосфатидилэтаноламин представляет собой сложный эфир глицерина и полярной группы фосфоэтаноламина (глицерол-фосфат), соединенный с двумя длинными (из 14-20 атомов углерода) «хвостами» жирных кислот.
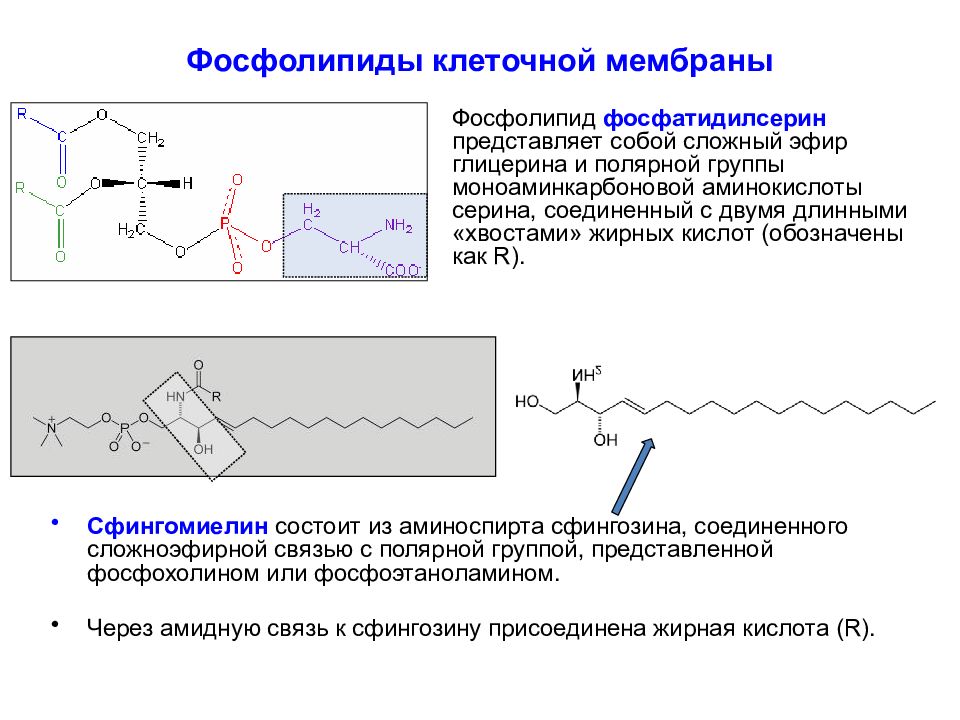
Слайд 14: Фосфолипиды клеточной мембраны
Фосфолипид фосфатидилсерин представляет собой сложный эфир глицерина и полярной группы моноаминкарбоновой аминокислоты серина, соединенный с двумя длинными «хвостами» жирных кислот (обозначены как R). Сфингомиелин состоит из аминоспирта сфингозина, соединенного сложноэфирной связью с полярной группой, представленной фосфохолином или фосфоэтаноламином. Через амидную связь к сфингозину присоединена жирная кислота ( R).
Слайд 15: Фосфолипиды клеточной мембраны
фосфатидилхолин фосфатидилэтаноламин фосфатидилсерин сфингомиелин
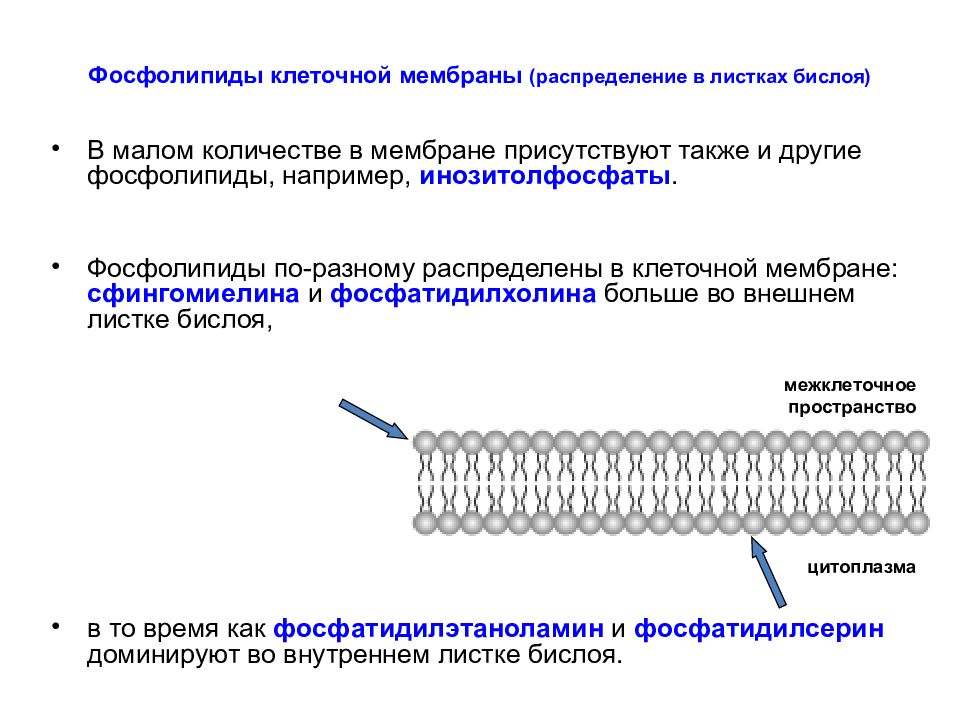
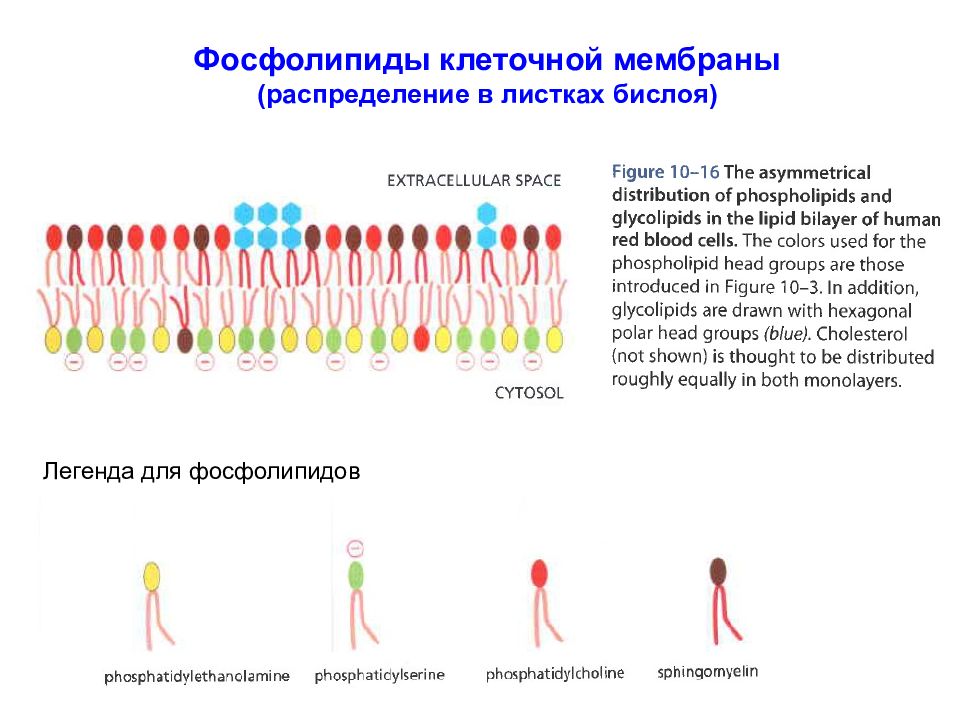
Слайд 17: Фосфолипиды клеточной мембраны (распределение в листках бислоя )
В малом количестве в мембране присутствуют также и другие фосфолипиды, например, инозитолфосфаты. Фосфолипиды по-разному распределены в клеточной мембране: сфингомиелина и фосфатидилхолина больше во внешнем листке бислоя, в то время как фосфатидилэтаноламин и фосфатидилсерин доминируют во внутреннем листке бислоя. цитоплазма межклеточное пространство
Слайд 18
Фосфолипиды клеточной мембраны (распределение в листках бислоя ) Легенда для фосфолипидов
Слайд 19: Фосфолипиды в мембране выполняют три главные функции:
Функции изолятора и барьера. Фосфолипидный бислой образует изолированные структуры, тем самым препятствуя проникновению в клетку полярных молекул, включая воду и электролиты. В то время как различные газы (например, О 2 и СО 2 ) и разнообразные растворимые в липидах вещества (например, этиловый спирт и местные анестетики) легко приникают через мембрану. Барьерные функции защищают клетку от потери жизненно важных полярных цитоплазматических компонентов и входа в клетку многих потенциально опасных внешних веществ. Внутриклеточная сигнализация. Производные мембранных фосфолипидов инозитол-1,2.3-трифосфат и диацилглицерол выполняют роль вторичных посредников. Электрические свойства. Фосфолипидный бислой вместе с открытыми каналами тока утечки в мембране демонстрирует свойства RC -цепочки и, соответственно, фильтра низких частот, а также и интегратора электрических входных сигналов.
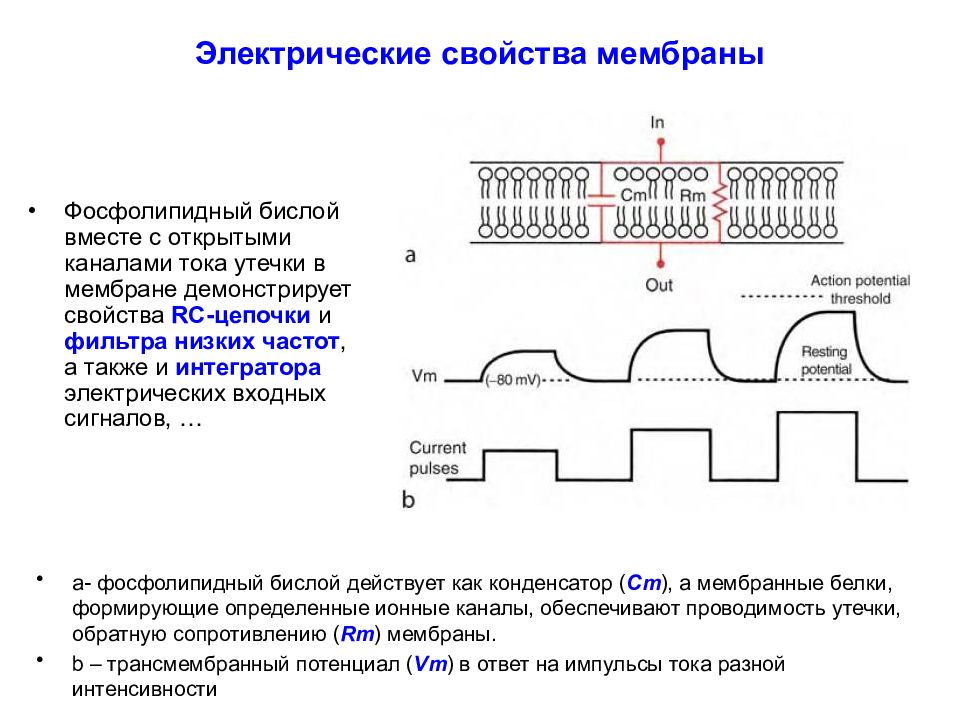
Слайд 20: Электрические свойства мембраны
Фосфолипидный бислой вместе с открытыми каналами тока утечки в мембране демонстрирует свойства RC -цепочки и фильтра низких частот, а также и интегратора электрических входных сигналов, … a - фосфолипидный бислой действует как конденсатор ( Cm ), а мембранные белки, формирующие определенные ионные каналы, обеспечивают проводимость утечки, обратную сопротивлению ( Rm ) мембраны. b – трансмембранный потенциал ( Vm ) в ответ на импульсы тока разной интенсивности
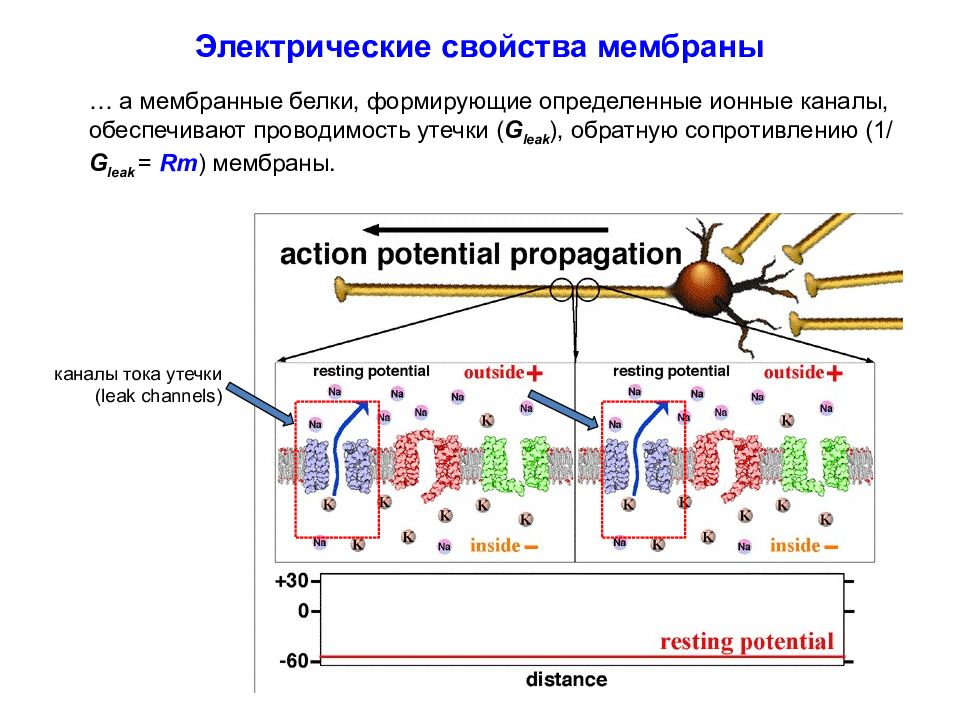
Слайд 21
каналы тока утечки (leak channels) Электрические свойства мембраны … а мембранные белки, формирующие определенные ионные каналы, обеспечивают проводимость утечки ( G leak ), обратную сопротивлению ( 1/ G leak = Rm ) мембраны.
Слайд 22: Фосфолипиды клеточной мембраны
Крайне тонкий и текучий липидный бислой клеточной мембраны характеризуется мембранной емкостью порядка 1 мкФ/см 2, которая обеспечивает заряд 8 10 -9 кулонов/см 2 при мембранном потенциале -80 мВ, что эквивалентно заряду 5 10 11 одновалентных ионов/см 2. Даже в покое в мембране открыты каналы для ионов K + и Na +, поэтому мембрана демонстрирует проводимость утечки. Как отражение свойства проводимости мембрана обладает сопротивлением около 1000 Ом ● см 2.
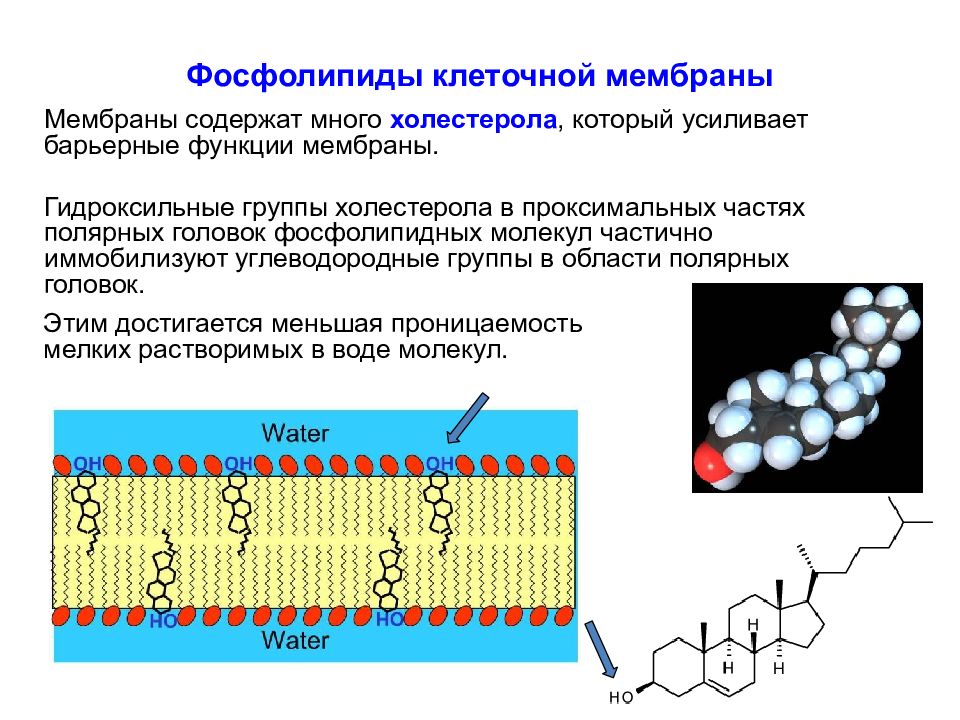
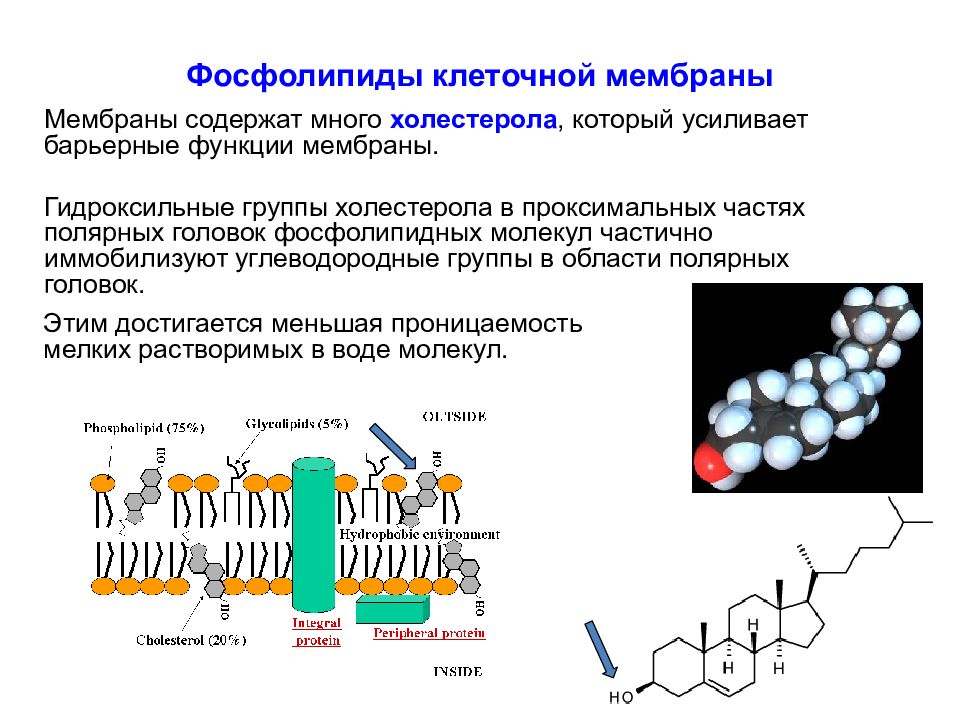
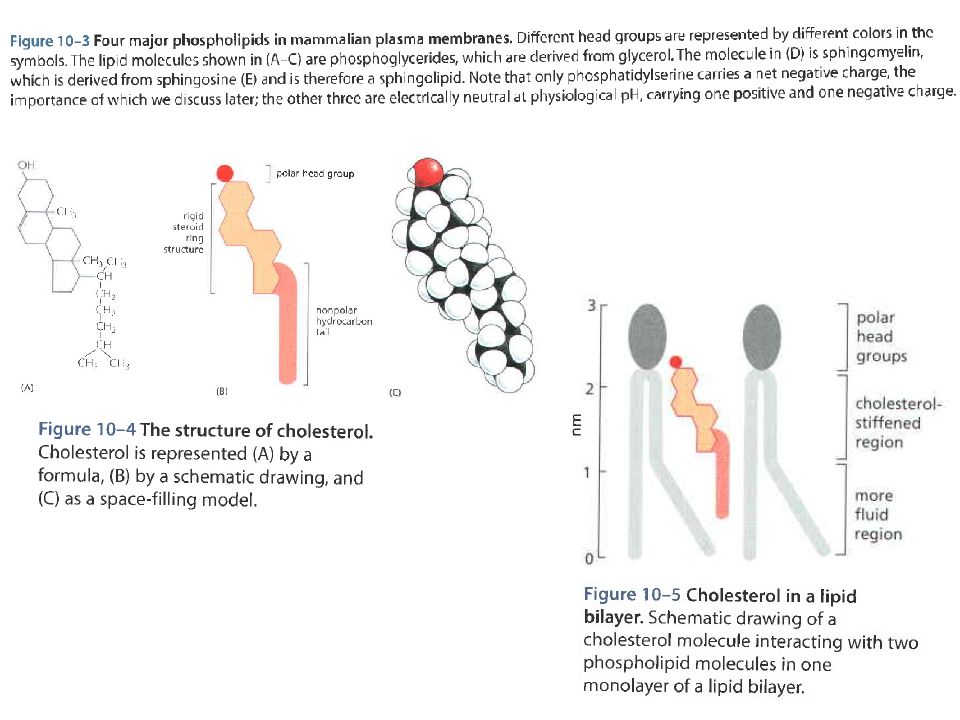
Слайд 23: Фосфолипиды клеточной мембраны
Мембраны содержат много холестерола, который усиливает барьерные функции мембраны. Гидроксильные группы холестерола в проксимальных частях полярных головок фосфолипидных молекул частично иммобилизуют углеводородные группы в области полярных головок. Этим достигается меньшая проницаемость мелких растворимых в воде молекул.
Слайд 24: Фосфолипиды клеточной мембраны
Мембраны содержат много холестерола, который усиливает барьерные функции мембраны. Гидроксильные группы холестерола в проксимальных частях полярных головок фосфолипидных молекул частично иммобилизуют углеводородные группы в области полярных головок. Этим достигается меньшая проницаемость мелких растворимых в воде молекул.
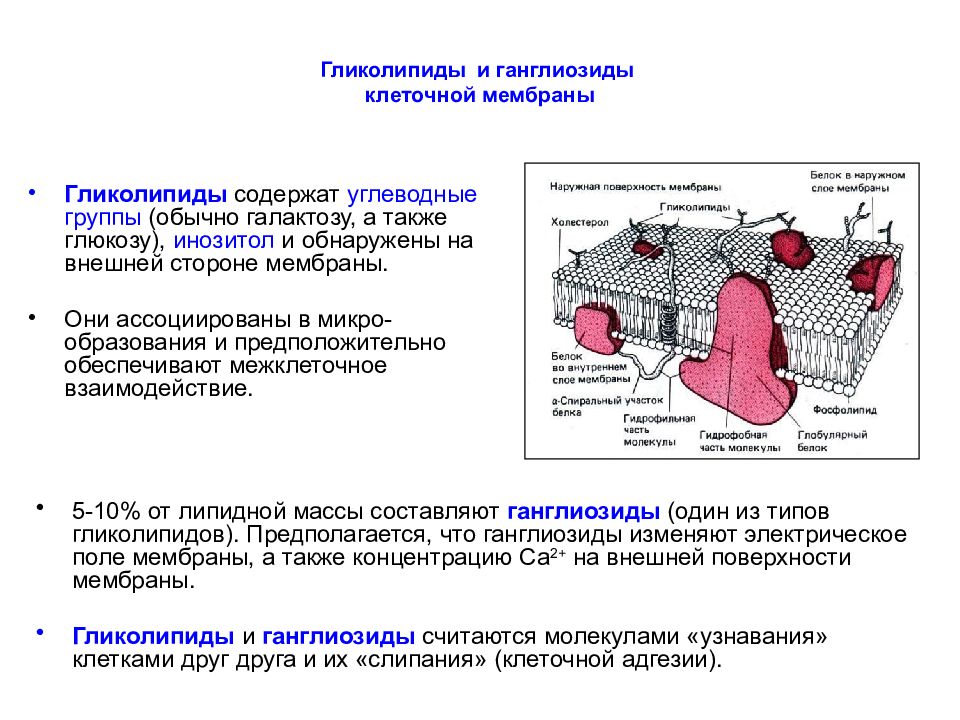
Слайд 26: Гликолипиды и ганглиозиды клеточной мембраны
Гликолипиды содержат углеводные группы (обычно галактозу, а также глюкозу), инозитол и обнаружены на внешней стороне мембраны. Они ассоциированы в микро-образования и предположительно обеспечивают межклеточное взаимодействие. 5-10% от липидной массы составляют ганглиозиды (один из типов гликолипидов). Предполагается, что ганглиозиды изменяют электрическое поле мембраны, а также концентрацию Са 2+ на внешней поверхности мембраны. Гликолипиды и ганглиозиды считаются молекулами «узнавания» клетками друг друга и их «слипания» (клеточной адгезии).
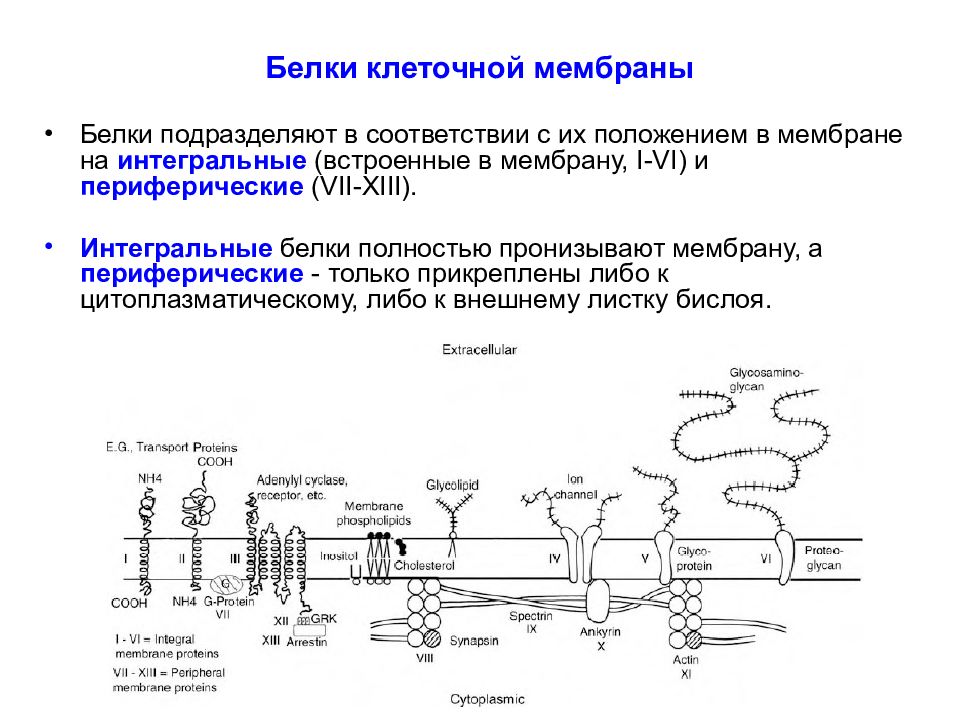
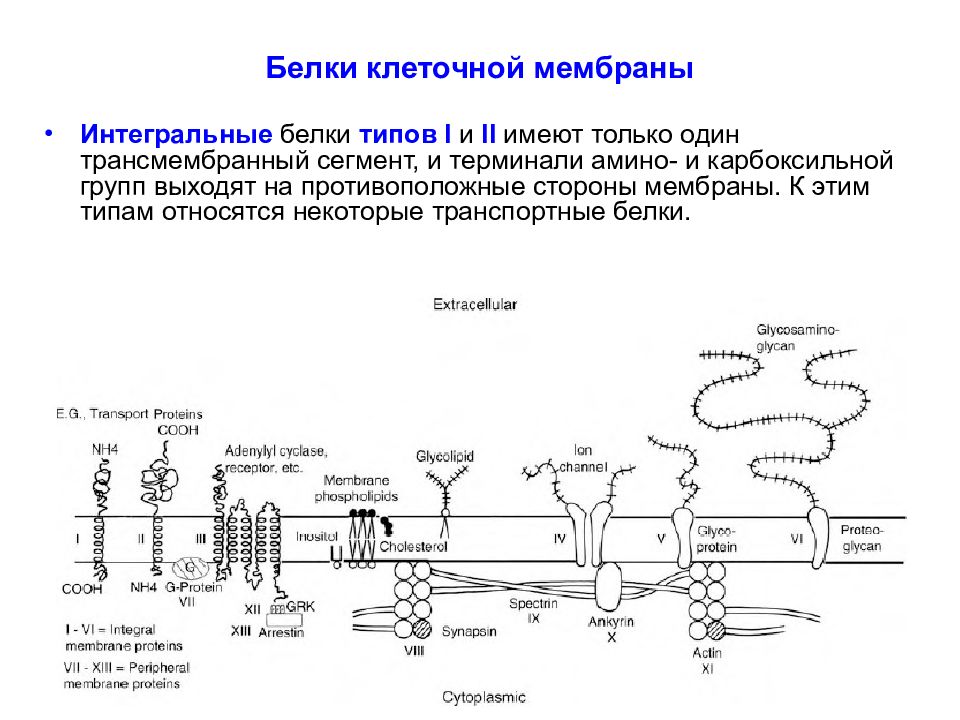
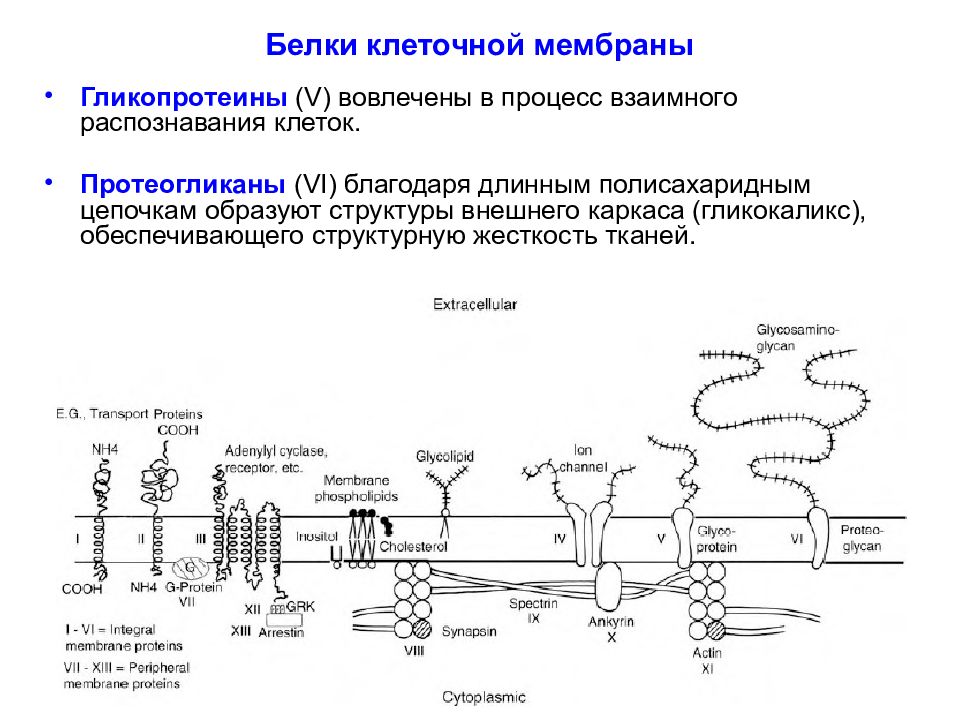
Слайд 27: Белки клеточной мембраны
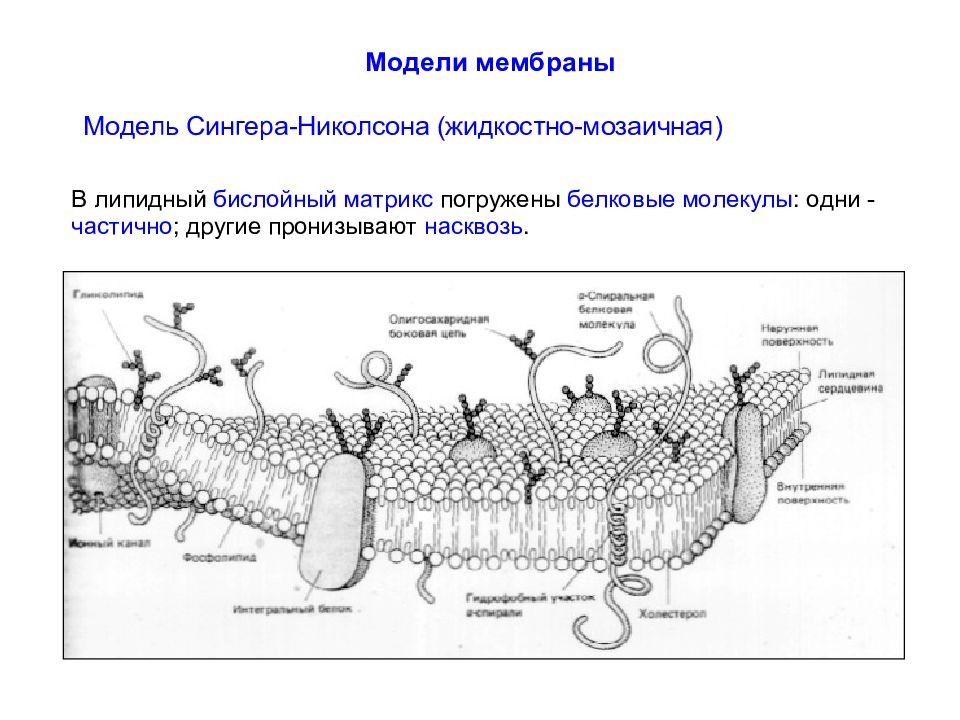
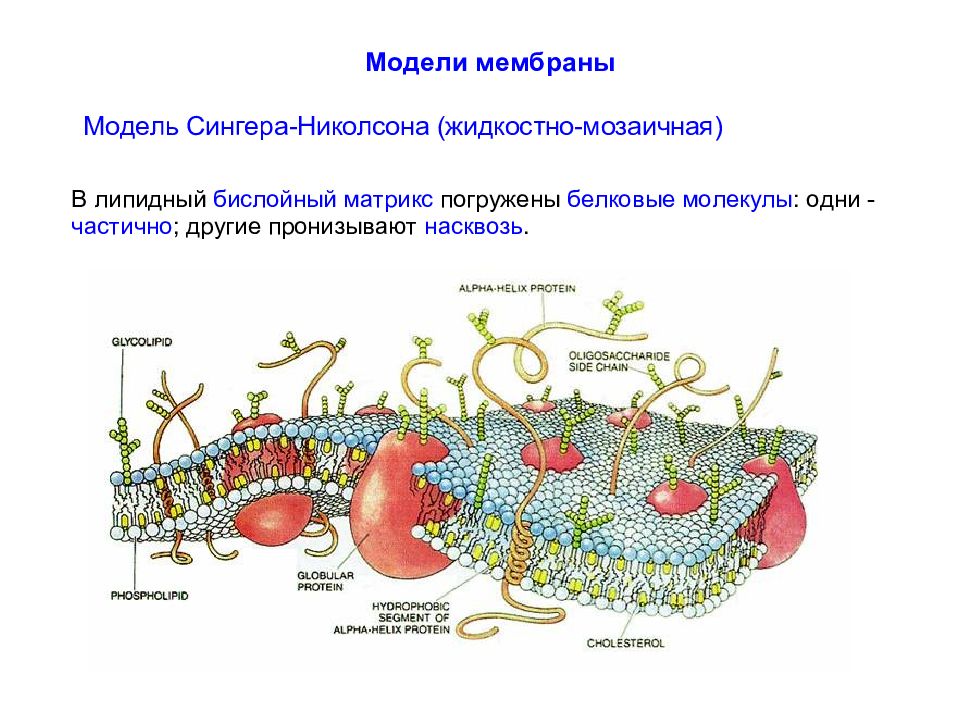
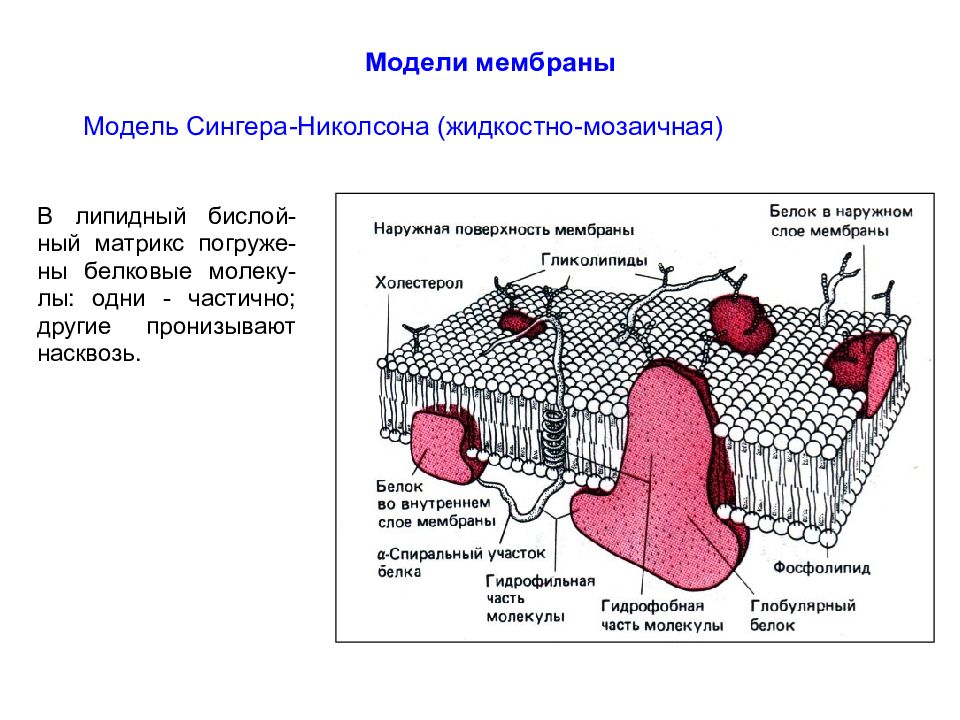
Белки подразделяют в соответствии с их положением в мембране на интегральные (встроенные в мембрану, I - VI ) и периферические ( VII - XIII ). Интегральные белки полностью пронизывают мембрану, а периферические - только прикреплены либо к цитоплазматическому, либо к внешнему листку бислоя.
Слайд 28: Белки клеточной мембраны
Интегральные белки типов I и II имеют только один трансмембранный сегмент, и терминали амино- и карбоксильной групп выходят на противоположные стороны мембраны. К этим типам относятся некоторые транспортные белки.
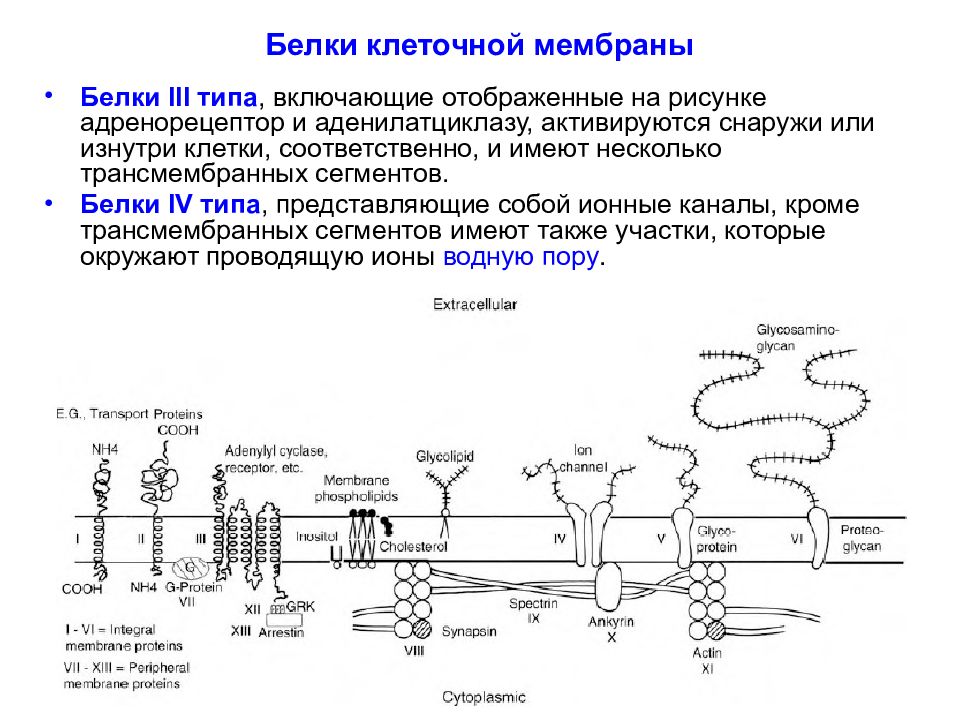
Слайд 29: Белки клеточной мембраны
Белки III типа, включающие отображенные на рисунке адренорецептор и аденилатциклазу, активируются снаружи или изнутри клетки, соответственно, и имеют несколько трансмембранных сегментов. Белки IV типа, представляющие собой ионные каналы, кроме трансмембранных сегментов имеют также участки, которые окружают проводящую ионы водную пору.
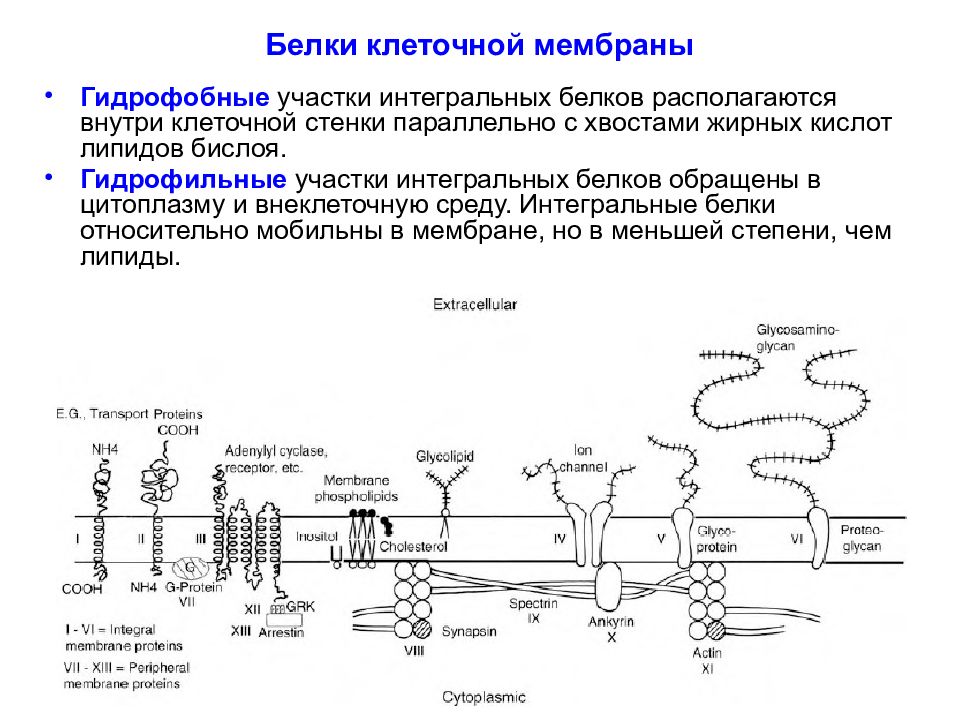
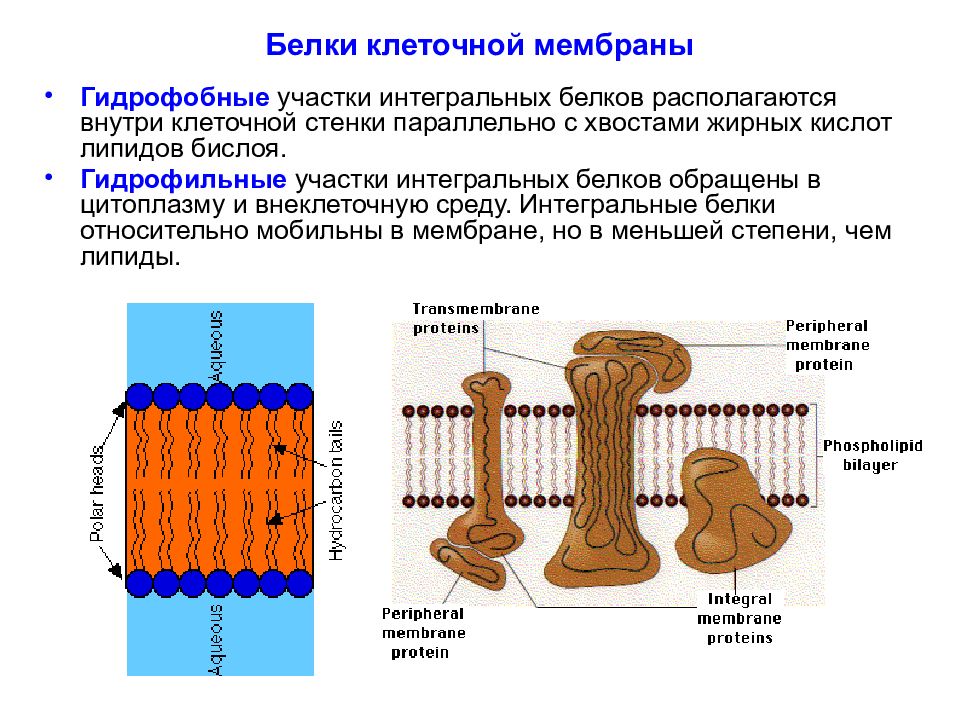
Слайд 30: Белки клеточной мембраны
Гидрофобные участки интегральных белков располагаются внутри клеточной стенки параллельно с хвостами жирных кислот липидов бислоя. Гидрофильные участки интегральных белков обращены в цитоплазму и внеклеточную среду. Интегральные белки относительно мобильны в мембране, но в меньшей степени, чем липиды.
Слайд 31: Белки клеточной мембраны
Гидрофобные участки интегральных белков располагаются внутри клеточной стенки параллельно с хвостами жирных кислот липидов бислоя. Гидрофильные участки интегральных белков обращены в цитоплазму и внеклеточную среду. Интегральные белки относительно мобильны в мембране, но в меньшей степени, чем липиды.
Слайд 32: Интегральные белки в мембране выполняют следующие функции
Транспортная функция. Ионные помпы (системы первичного активного транспорта) и обменники (системы вторичного активного транспорта) транспортируют ионы против их химических градиентов используя при этом энергию АТФ и энергию градиентов других ионов, соответственно. Ионные каналы обеспечивают проводимость растворенных в воде некоторых ионов по их электрохимическим градиентам. Транспортируют сахара и аминокислоты. Обеспечивают распознавание клеток друг друга при образовании клеточных агрегатов. Рецепторы нейромедиаторов, нейромодуляторов, гормонов и других химических передатчиков управляют проницаемостью ионов. Роль ферментов, катализирующих внутриклеточные каскады. Иммунореактивные элементы.
Слайд 33: Белки клеточной мембраны
Гликопротеины ( V ) вовлечены в процесс взаимного распознавания клеток. Протеогликаны ( VI ) благодаря длинным полисахаридным цепочкам образуют структуры внешнего каркаса (гликокаликс), обеспечивающего структурную жесткость тканей.
Слайд 34: Периферические белки в мембране выполняют следующие функции:
Роль ферментов, катализирующих внутриклеточные каскады ( например G- белки - VII). Поддержание мембранной структуры (белки актин - XI, анкирин - X, фодрин, спектрин - IX ). Связывают везикулы с элементами цитоскелета (например, синапсин - VIII ). Посредники роста и развития дендритов и аксонов. Обеспечивают процесс мембранного обмена – рециклирование лиганд-активируемых рецепторов и синаптических везикул (например, аррестин, клатрин - XIII ). Обеспечивают процесс отщепления G -белка от рецептора ( G-protein receptor kinase, GRK - XII ).
Слайд 35: Основные биологические процессы, происходящие с использованием ионных градиентов
Генерация электрического сигнала за счет градиента ионов Na + или (и) Ca 2+. Хемоосмотическое преобразование энергии - протонный градиент в митохондриях (теория Митчела). Существует специальный транспорт протонов ( Н + ), они выводятся из митохондрий в цитоплазму. Протонный градиент (градиент РН), как источник запасенной энергии, используется для окислительного фосфорилирования (АДФ -> АТФ). Транспорт веществ против градиента концентрации. Осуществляется за счет перемещения другого вещества по концентрационному градиенту. Например, за счет градиента Na + через клеточную мембрану транспортируются сахара и аминокислоты.
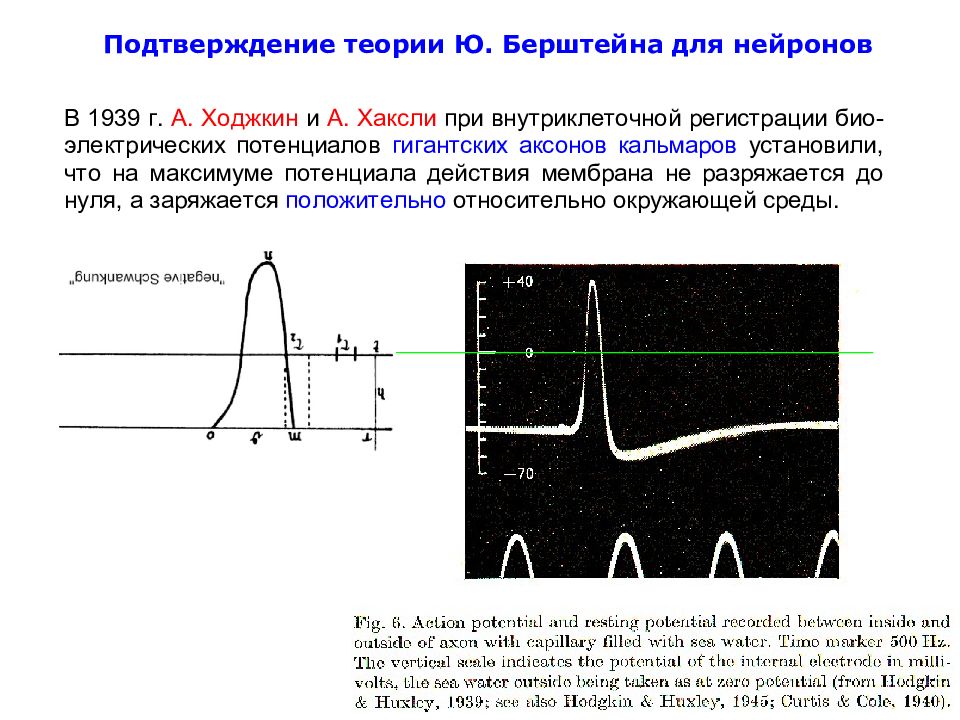
Слайд 38
Bernstein J (1868) Über den zeitlichen Verlauf der negative Schwankung des Nervenstroms. Pflügers Arch 1:173–207
Слайд 39
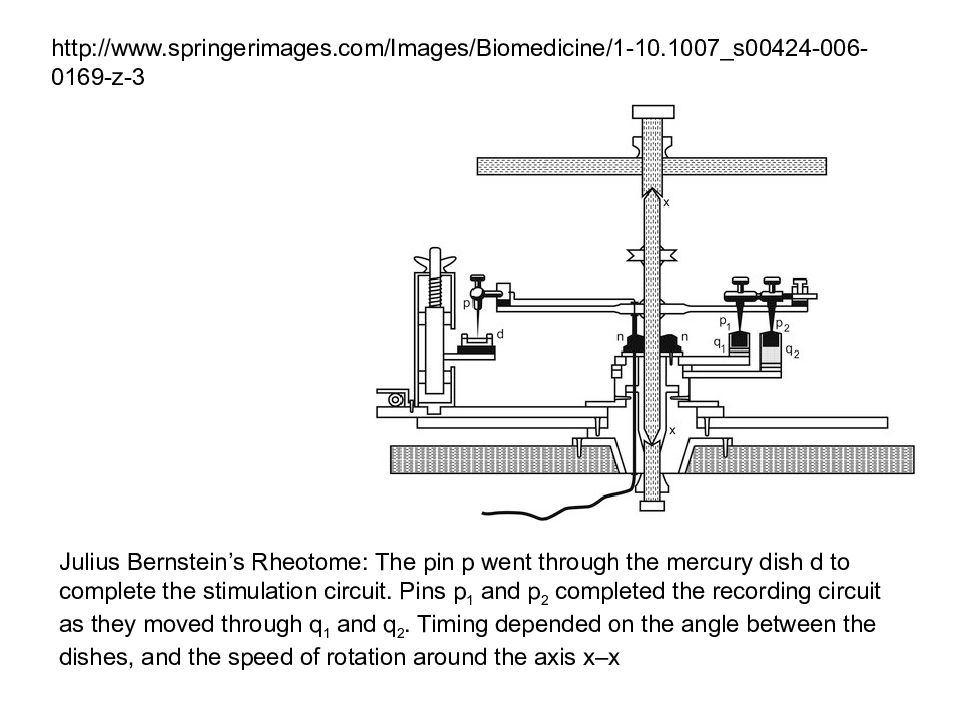
Julius Bernstein’s Rheotome: The pin p went through the mercury dish d to complete the stimulation circuit. Pins p 1 and p 2 completed the recording circuit as they moved through q 1 and q 2. Timing depended on the angle between the dishes, and the speed of rotation around the axis x–x http://www.springerimages.com/Images/Biomedicine/1-10.1007_s00424-006-0169-z-3
Слайд 40
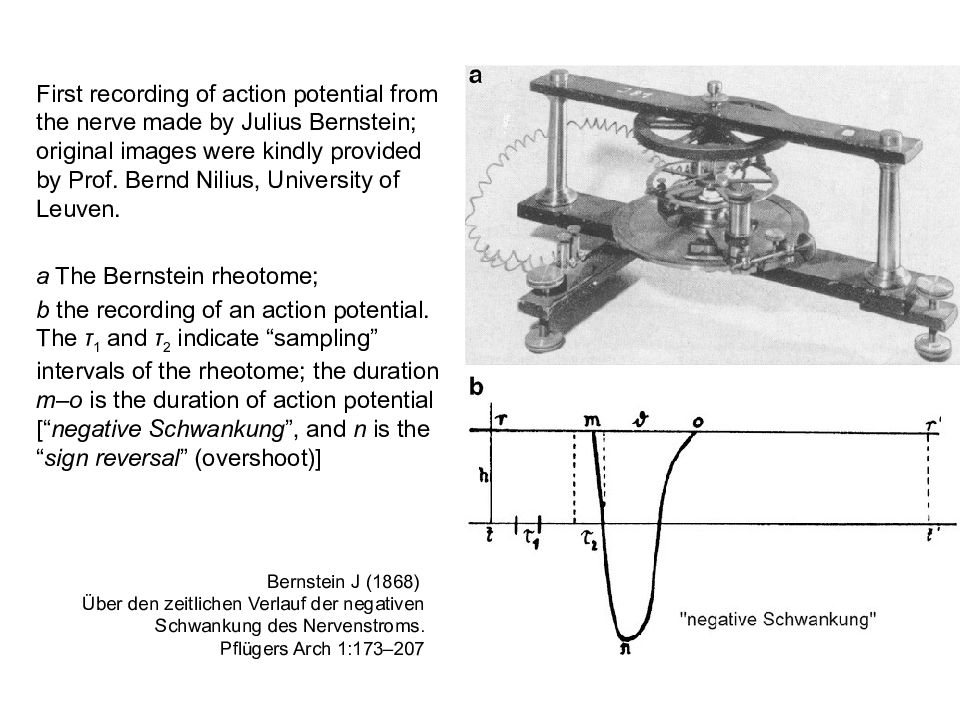
First recording of action potential from the nerve made by Julius Bernstein; original images were kindly provided by Prof. Bernd Nilius, University of Leuven. a The Bernstein rheotome ; b the recording of an action potential. The τ 1 and τ 2 indicate “sampling” intervals of the rheotome ; the duration m – o is the duration of action potential [“ negative Schwankung ”, and n is the “ sign reversal ” (overshoot)] Bernstein J (1868) Ü ber den zeitlichen Verlauf der negativen Schwankung des Nervenstroms. Pflügers Arch 1:173–207
Слайд 41
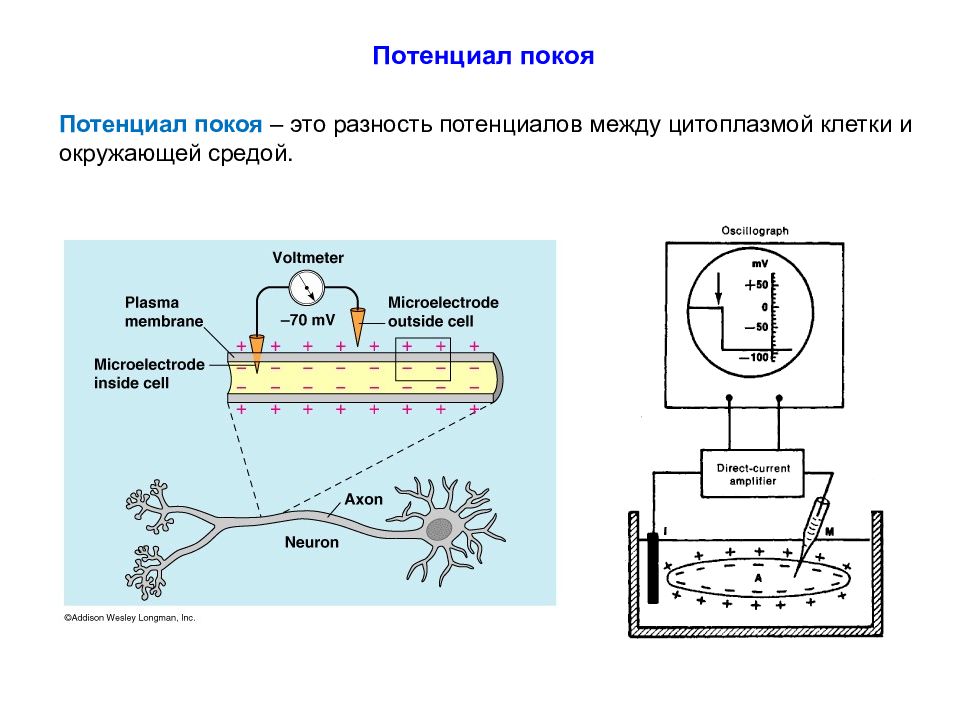
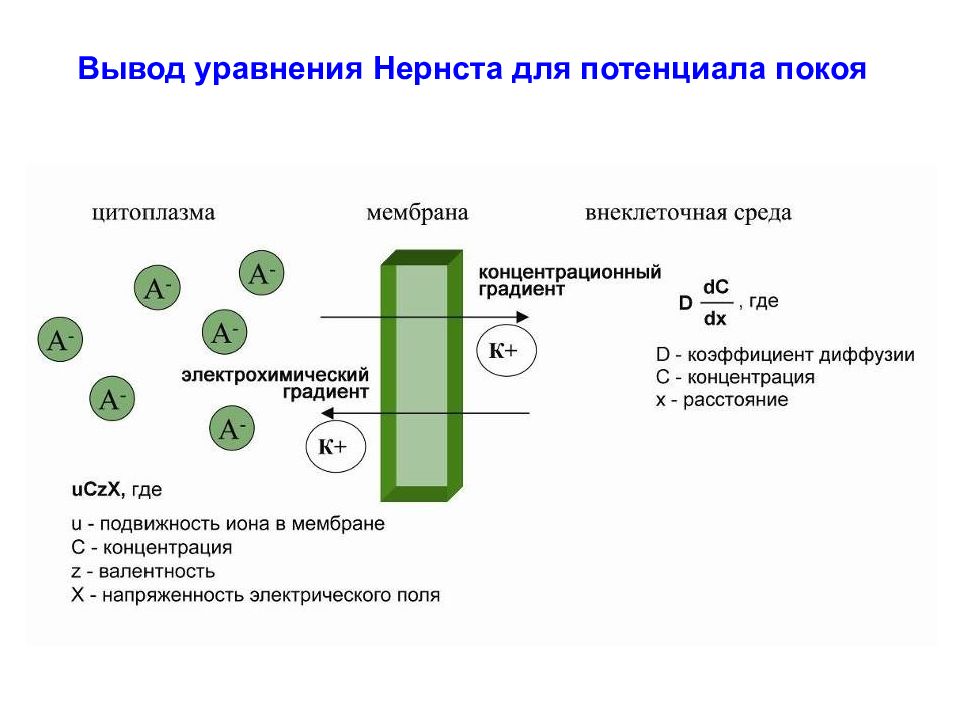
Потенциал покоя – это разность потенциалов между цитоплазмой клетки и окружающей средой.
Слайд 42
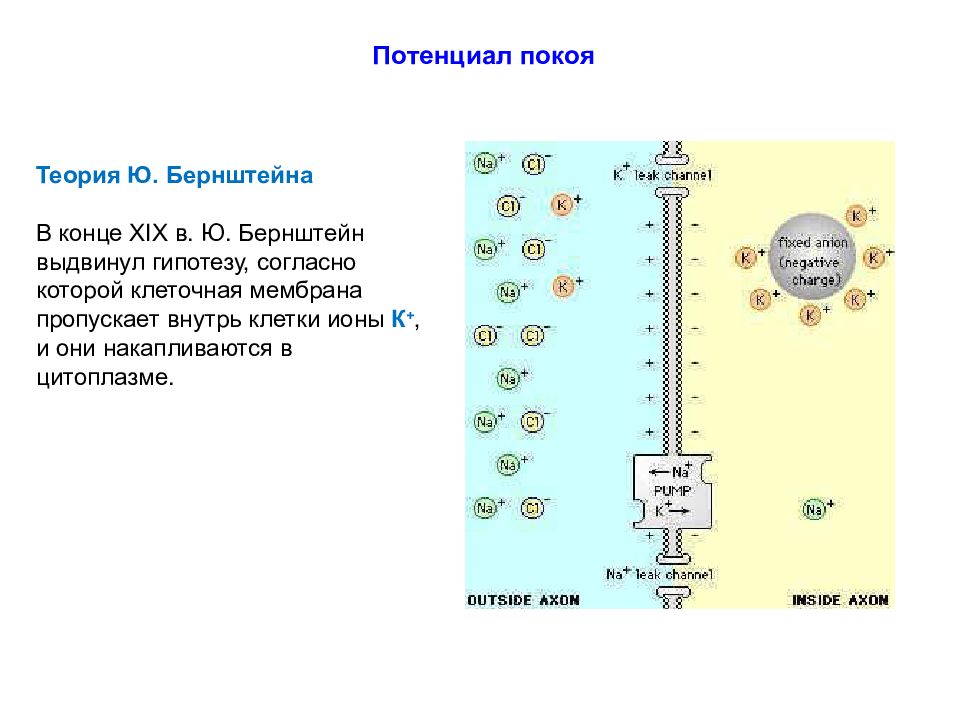
Теория Ю. Бернштейна В конце XIX в. Ю. Бернштейн выдвинул гипотезу, согласно которой клеточная мембрана пропускает внутрь клетки ионы К +, и они накапливаются в цитоплазме.
Слайд 44
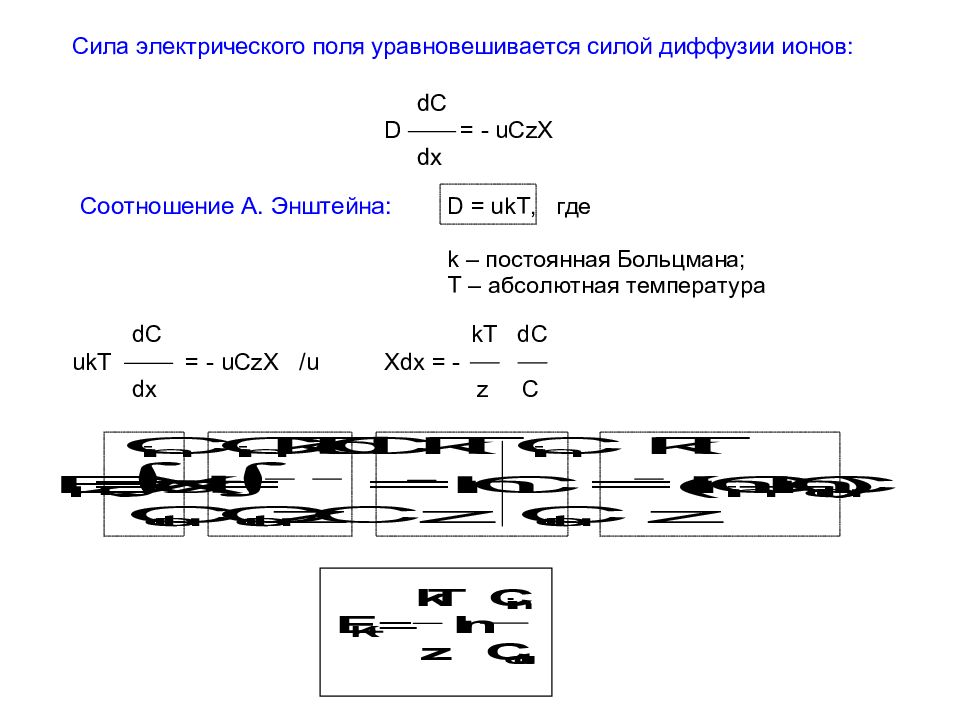
Потенциал покоя – это разность потенциалов между цитоплазмой клетки и окружающей средой. Теория Ю. Бернштейна В конце XIX в. Ю. Бернштейн выдвинул гипотезу, согласно которой клеточная мембрана пропускает внутрь клетки ионы К +, и они накапливаются в цитоплазме. В 1896 г. его ученик Василий Чаговец (1873-1941) подтвердил эту гипотезу и применил электролитическую теорию В. Нернста к биологическим системам и установил калиевую природу потенциала покоя. Расчет величины потенциала покоя по уравнению Нернста для калиевого электрода удовлетворительно совпал с измеренным потенциалом между саркоплазмой мышцы и окружающей средой, который составлял около – 70 мВ.
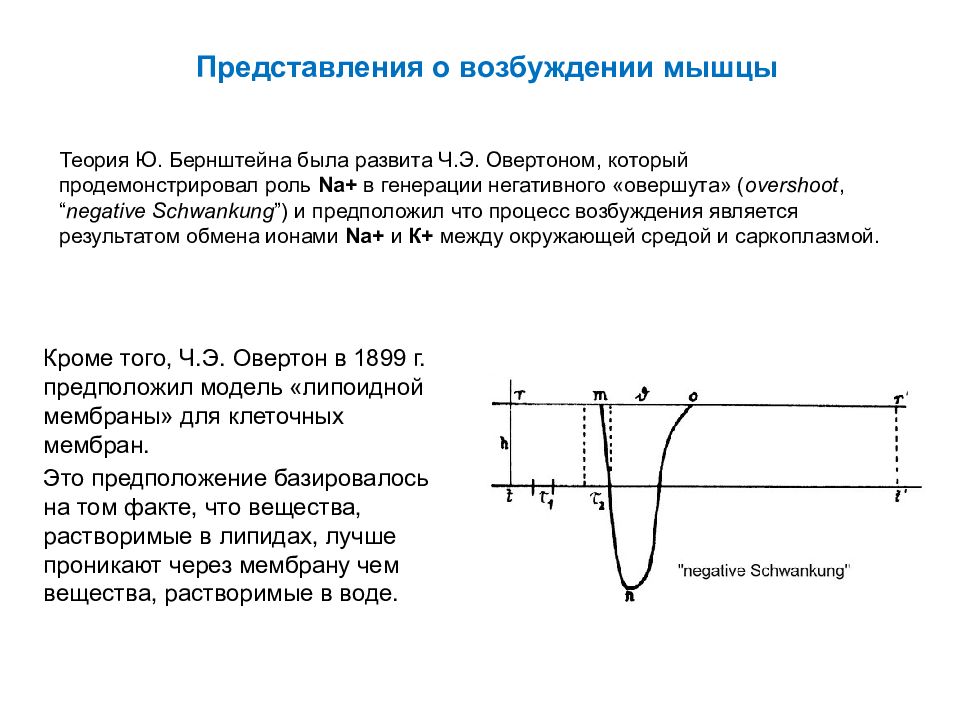
Слайд 45: Представления о возбуждении мышцы
Теория Ю. Бернштейна была развита Ч.Э. Овертоном, который продемонстрировал роль Na+ в генерации негативного « овершута » ( overshoot, “ negative Schwankung ”) и предположил что процесс возбуждения является результатом обмена ионами Na + и К+ между окружающей средой и саркоплазмой. Кроме того, Ч.Э. Овертон в 1899 г. предположил модель «липоидной мембраны» для клеточных мембран. Это предположение базировалось на том факте, что вещества, растворимые в липидах, лучше проникают через мембрану чем вещества, растворимые в воде.
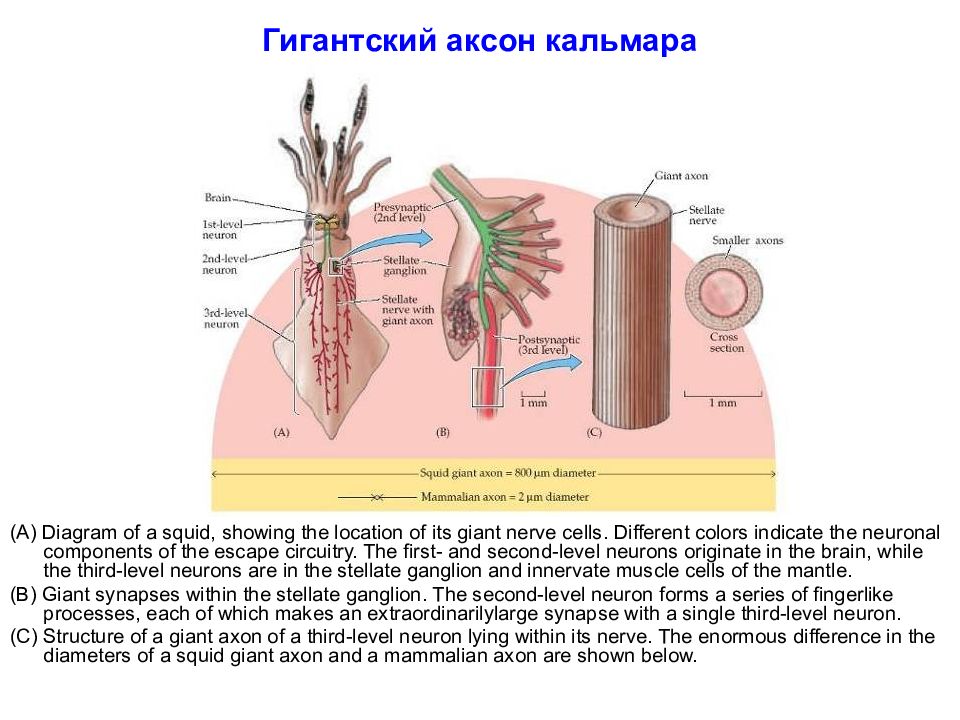
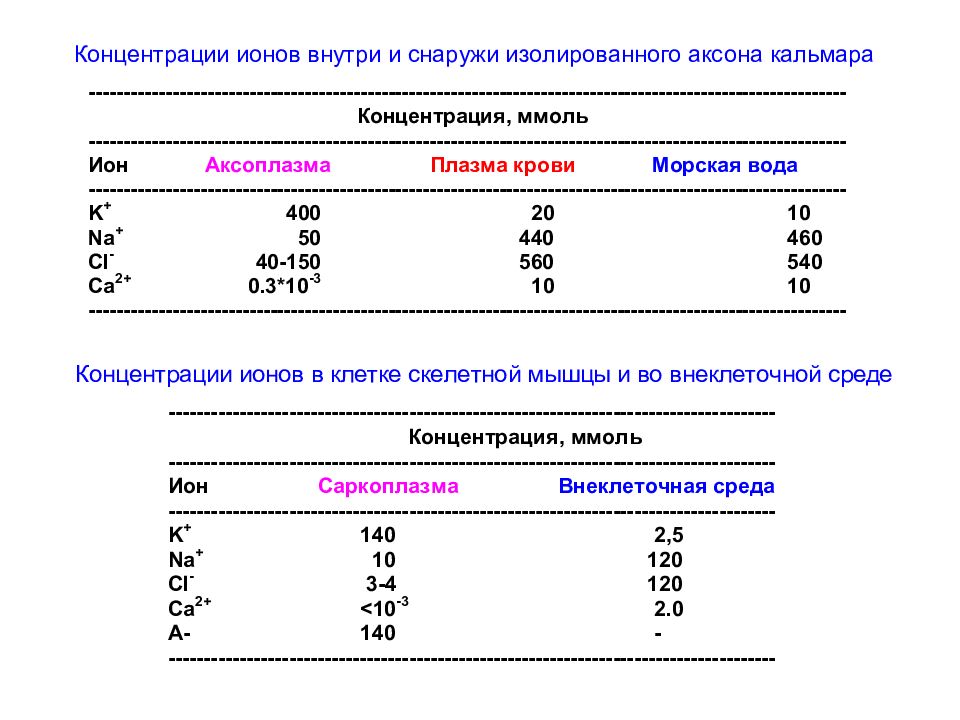
Слайд 46: Гигантский аксон кальмара
(A) Diagram of a squid, showing the location of its giant nerve cells. Different colors indicate the neuronal components of the escape circuitry. The first- and second-level neurons originate in the brain, while the third-level neurons are in the stellate ganglion and innervate muscle cells of the mantle. (B) Giant synapses within the stellate ganglion. The second-level neuron forms a series of fingerlike processes, each of which makes an extraordinarilylarge synapse with a single third-level neuron. (C) Structure of a giant axon of a third-level neuron lying within its nerve. The enormous difference in the diameters of a squid giant axon and a mammalian axon are shown below.
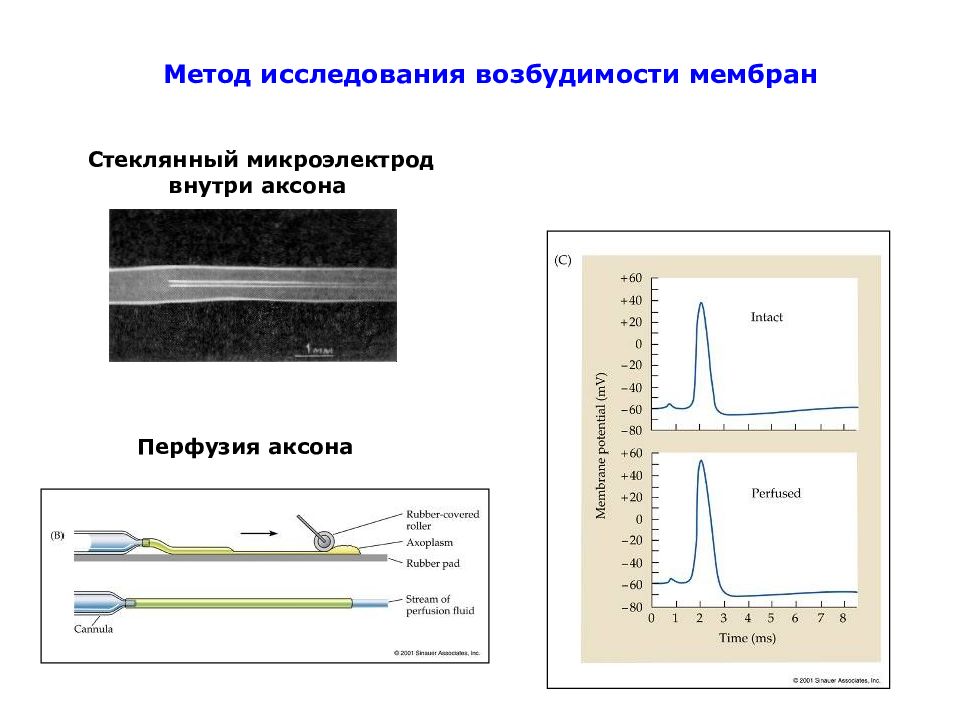
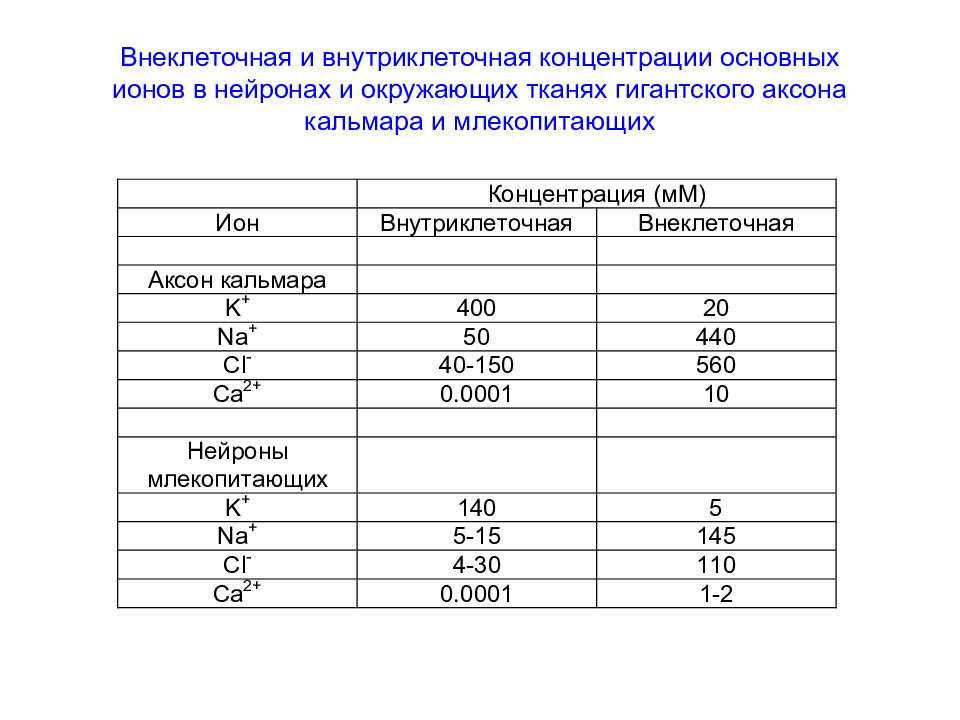
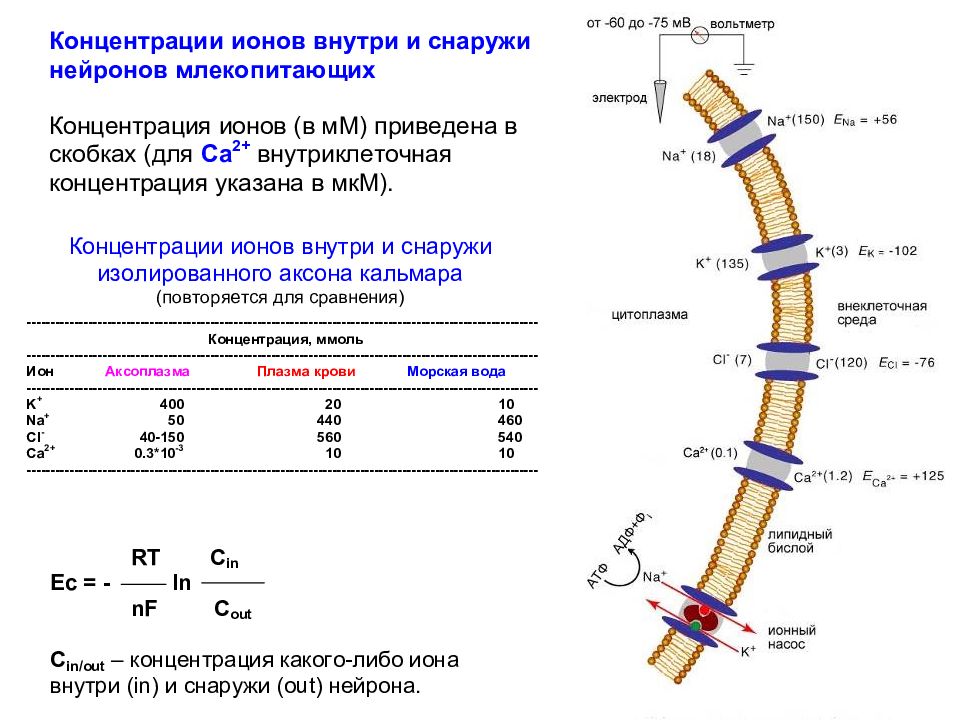
Слайд 52: Внеклеточная и внутриклеточная концентрации основных ионов в нейронах и окружающих тканях гигантского аксона кальмара и млекопитающих
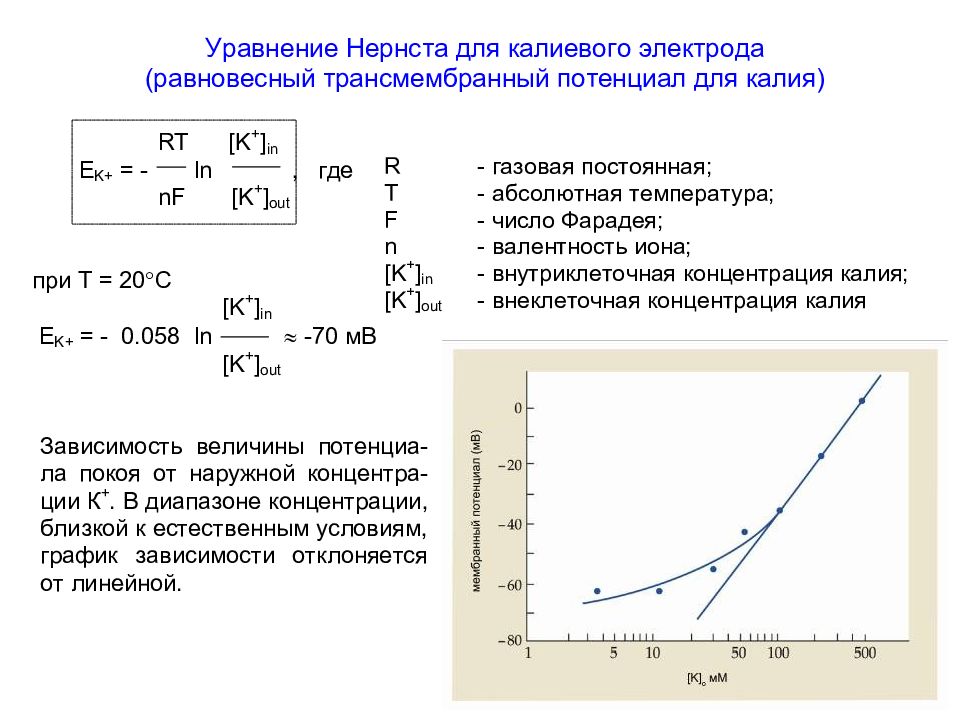
Слайд 58: Зависимость величины потенциала покоя от логарифма наружной концентрации ионов К + ([ K ] out )
В соответствии с уравнени - ем Нернста десятикратное увеличение внеклеточной концентрации ионов К + (например, от 50 до 500 мМ) приводит к снижению абсо - лютного значения ПП на 58 мВ. Прямая линия на рисунке отражает эту теоретическую зависимость. В действительности в диапазоне концентраций ионов К +, близких к естест - венным условиям (менее 50 мМ), график зависимости отклоняется от линейной функции из-за вклада в ПП ионов Na + и Cl -.
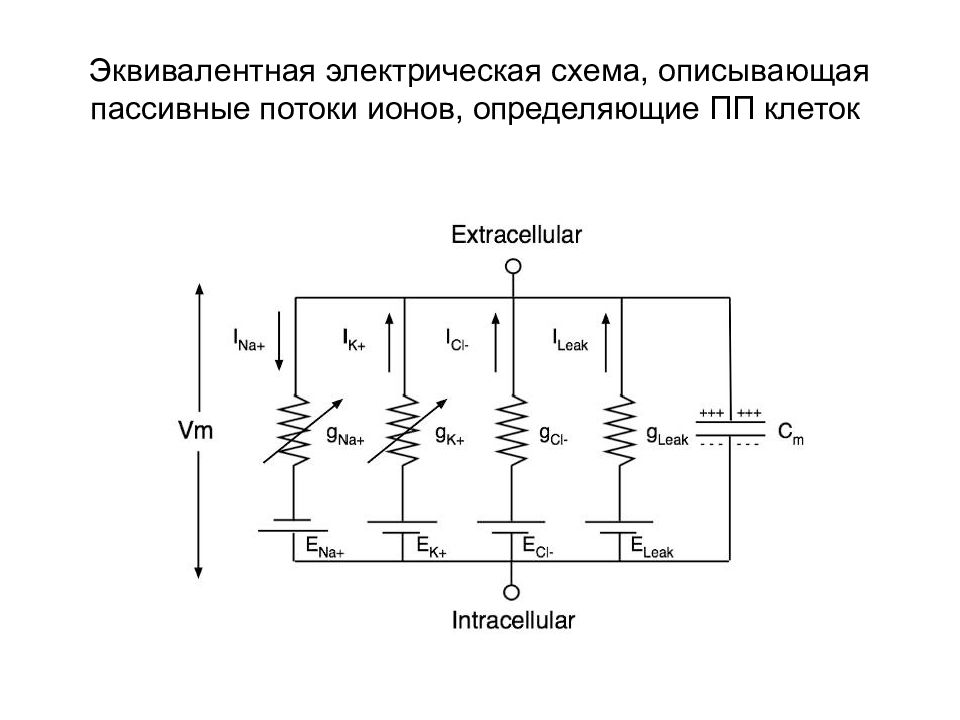
Слайд 60: Эквивалентная электрическая схема, описывающая пассивные потоки ионов, определяющие ПП клеток
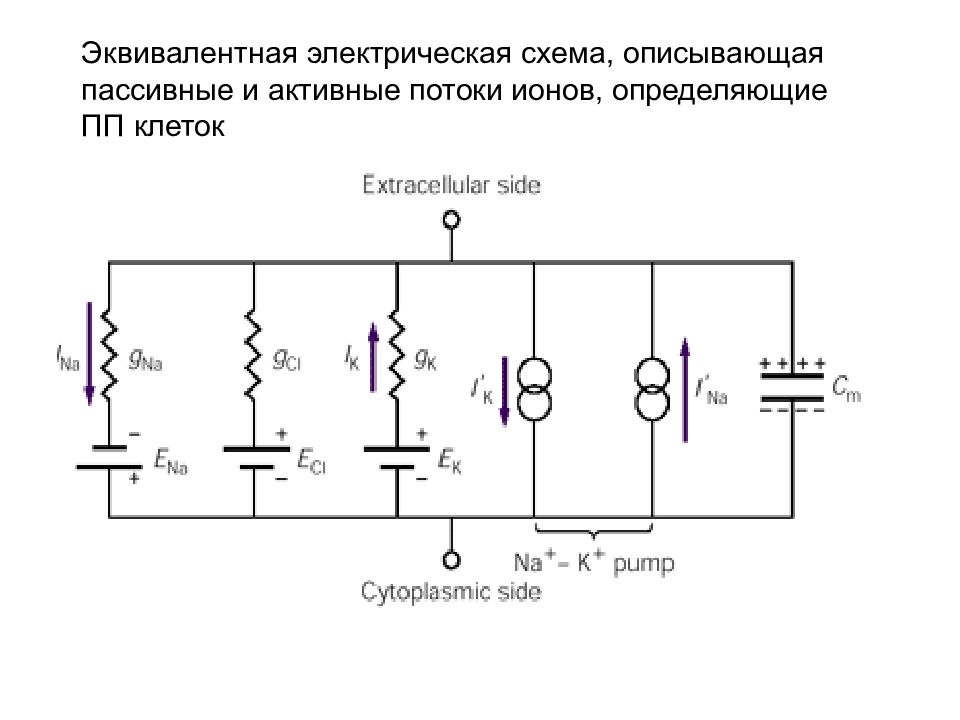
Слайд 61: Эквивалентная электрическая схема, описывающая пассивные и активные потоки ионов, определяющие ПП клеток
Последний слайд презентации: Биологические мембраны
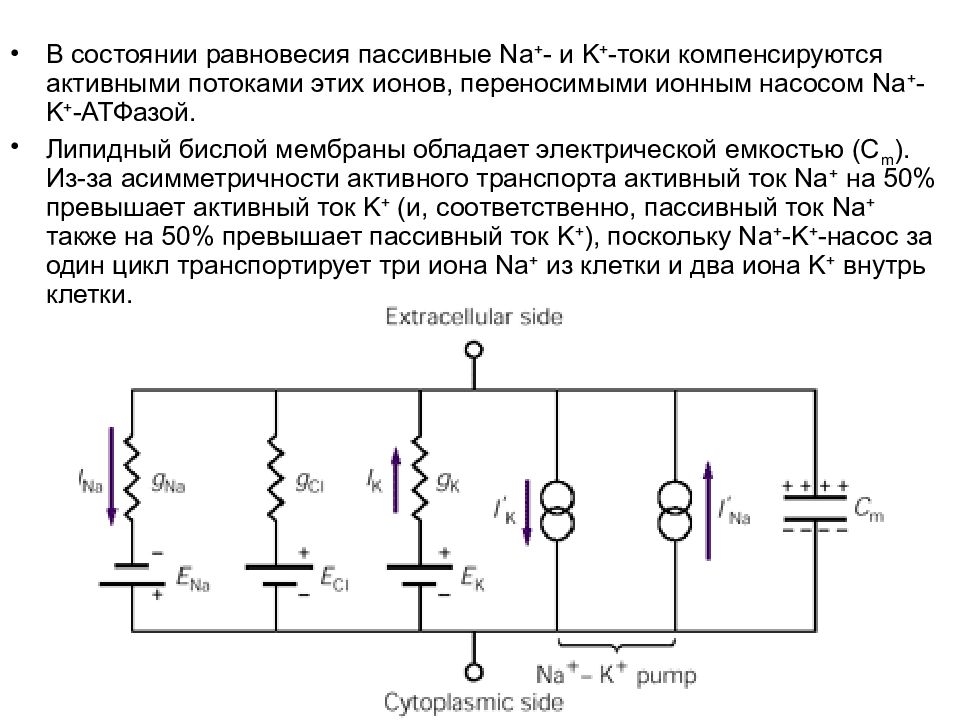
В состоянии равновесия пассивные Na + - и K + -токи компенсируются активными потоками этих ионов, переносимыми ионным насосом Na + - K + -АТФазой. Липидный бислой мембраны обладает электрической емкостью (C m ). Из-за асимметричности активного транспорта активный ток Na + на 50% превышает активный ток K + (и, соответственно, пассивный ток Na + также на 50% превышает пассивный ток K + ), поскольку Na + - K + -насос за один цикл транспортирует три иона Na + из клетки и два иона K + внутрь клетки.
















![Биологические мембраны Зависимость величины потенциала покоя от логарифма наружной концентрации ионов К + ([ K ] out )](https://s1.showslide.ru/s_slide/d8cf805c42db6d7f3f54c26b8a641324/49396140-a099-491d-b59c-33ccf4215612.jpeg)