Первый слайд презентации: Кальций
Орындаған: Калиева С.Д. Қабылдаған: КусаиноваА.К.
Слайд 2
Ca – 4 период, ІІ топтың негізгі топшасының элементі, сілтілік жер металы, s элемент. Реттік нөмірі 20, 20 протон, 20 нейтрон, ядро заряды +20, Электрондар саны – 20. A r – 40. Электрондық формуласы 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 4 s 2 Валенттілігі : ІІ Тотығу дәрежесі: 0, +2
Слайд 3
Алты тұрақты изоптоптың қоспасынан құралған тұрақты элемент : 40 Ca, 42 Ca, 43 Ca, 44 Ca, 46 Ca 48 Ca, Соның ең көп таралғаны 40 Ca (96, 97%).
Слайд 4: Кальцийдің ашылу тарихы
Кальцийдің табиғи қосылысы – әкті ғалымдар көп уақытқа дейін жай зат ретінде санап келді. 1808 жылы ағылшын химигі Г. Дэви аздап ылғанданған сөндірілген әкті элекролиздеп, сынап катодына амальгама түрінде түрінде бөлінген бұрын белгісіз металл бөліп алды, оған латынша “кальций – Calx” - әк деген атау берді. Гемфри Деви (1778 – 1829) Кальцийдің ашылу тарихы
Слайд 5
1811-1899 гг. Вильгельм Бунзен Электролиз әдісімен кальций, марганец, магний және т.б. металлдарды алды.
Слайд 6
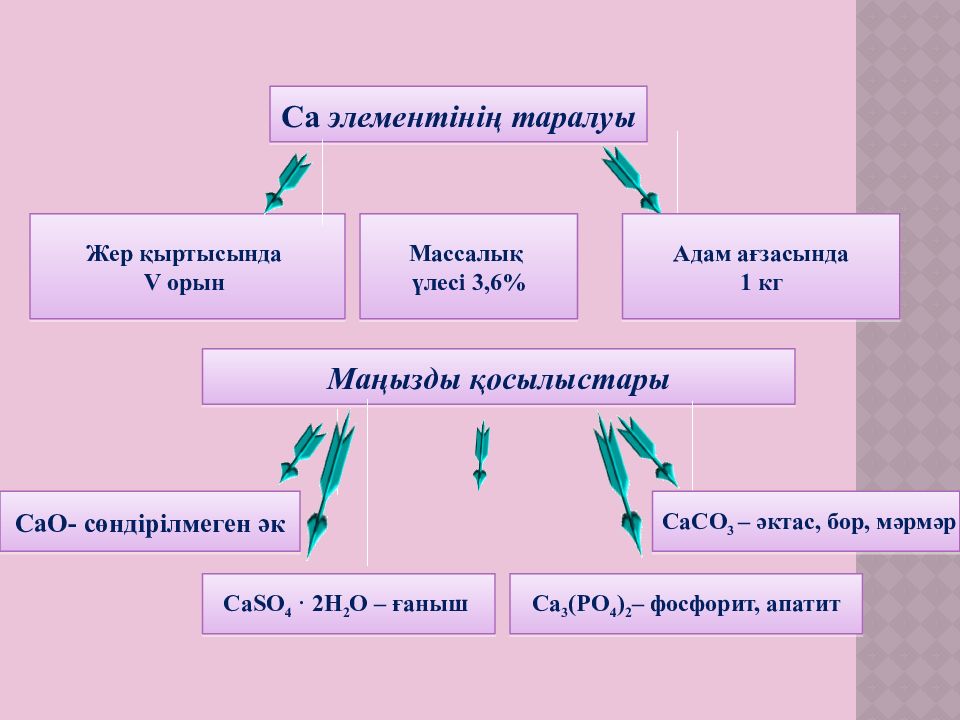
Са элементінің таралуы Жер қыртысында V орын Массалық үлесі 3,6 % Адам ағзасында 1 кг Маңызды қосылыстары CaO - сөндірілмеген әк СаCO 3 – әктас, бор, мәрмәр CaSO 4 · 2H 2 O – ғаныш Ca 3 (PO 4 ) 2 – фосфорит, апатит
Слайд 8
Физикалық қасиеттері Кальций ақ түсті, жеңіл (р=1,55 г/см 3 ), сілтілік металдардан қаттырақ зат, t°балқу = 851°С, керосиннің астында сақталады. Ат. н. 20; ат. м. 40,08; балқу t 842°С; қайнау t 1495°С тығыздығы 1,55 г/см 2. Түсі күмістей ақ, жеңіл металл, белгілі изотоптары 14, табиғи изотоптары 6. Негізгі минералдары: кальцит, ангидрит, гипс, флюорит, апатит, т.б. Алынуы: СаCL 2 эл тогы Са + CL 2
Слайд 9
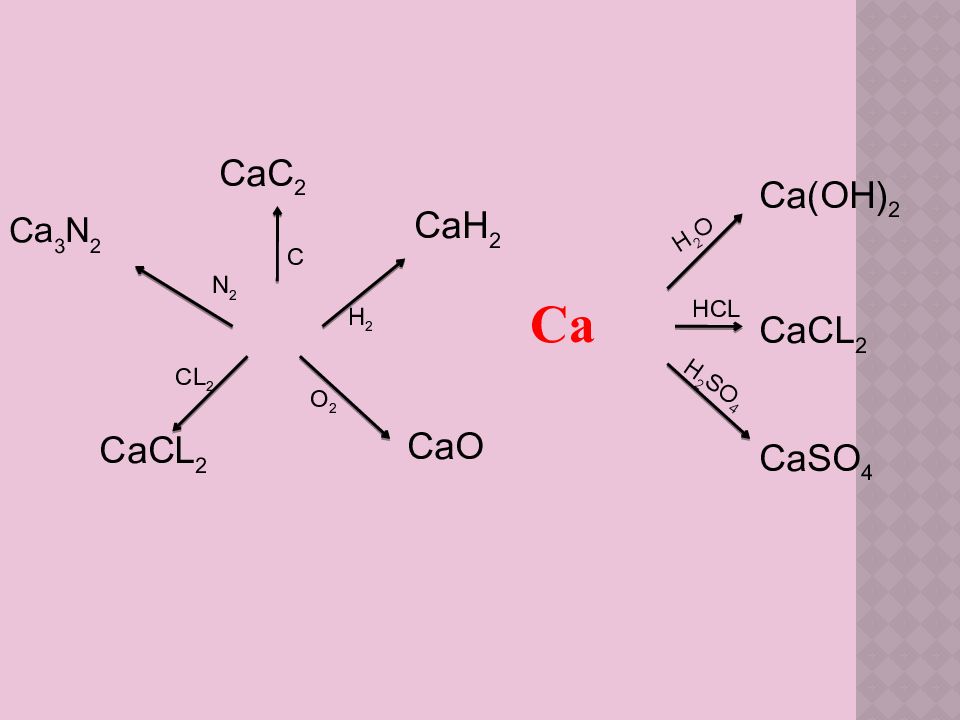
Химиялық қасиеттері Кальций белсенді металл болғандықтан көптеген реакцияларға түседі. Жай заттармен Са + Н2 = СаН2 кальций гидриді Са + С l2 = СаС l2 кальций хлориді 2Са + О2 = 2СаО кальций оксиді 6Са + 2 N2 Са N кальций нитриді Ca + 2 С =СаС2 кальций карбиді Күрделі заттармен Ca + 2 НОН = Са(ОН)2 + Н2↑ Ca + 2HCl= СаС l2 + Н2↑
Слайд 10
Ca Ca(OH) 2 CaCL 2 CaSO 4 N 2 C H 2 O 2 CL 2 H 2 O HCL H 2 SO 4 Ca 3 N 2 CaC 2 CaH 2 CaO Са CL 2
Слайд 11
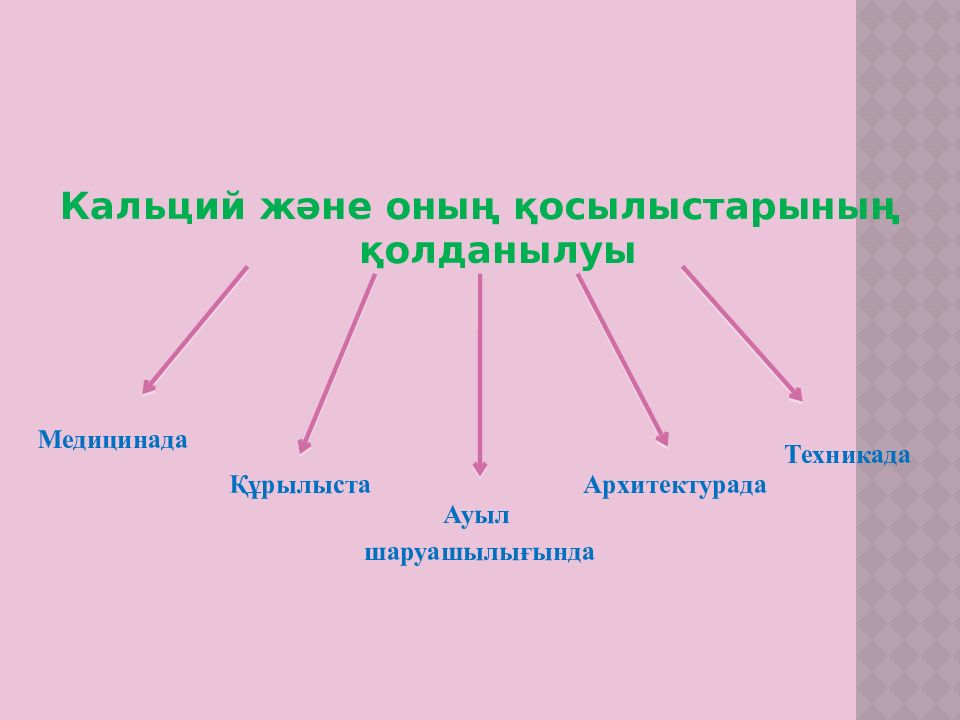
Кальций және оның қосылыстарының қолданылуы Медицинада Ауыл шаруашылығында Құрылыста Архитектурада Техникада
Слайд 12: Медицинада қолданылатын қосылыстары
Са 2+ CaCl 2 *6H 2 O – жүрек жұмысын реттеуші, қанды тоқтатушы, аллергияға, қабынуға қарсы, магний тұзымен уланғанда, уды кетіруші емдік шараларда қолданылады. CаSO 4 * 2H 2 O гипс, қолданылады тіс слепков дайындағанда, сынықтарды қатыру хирургияда.
Слайд 13: Биологиялық ролі
Табиғи суда көптеген минералдар ериді. Құрамында гидрокарбонаттар, хлоридтер, сульфаттар түрінде кальций мен магнийдің тұздары бар табиғи суларды кермек сулар деп атайды. Кермек суды қайнату, сөндірілген ізбес қосу, сода немесе натрий фосфатын қосу арқылы тұшытады. Ересек адамдарға тәулігіне 0,5 грамм кальций жеткілікті. Ал сүйекті қатайтуға аса қажет кальций, сиыр мен қой сүті, сүтпен жасалатын түрлі тағамдар ірімшік, сүзбе, сырда мол. Қара бидай наны мен жұмыртқаның сары уызы да кальцийге бай. Ағзаға бір тәулікке қажет кальций алу үшін жүз грамм сыр немесе жарты литр сүр жетеді.
Слайд 14
Са +2 иондары физиологиялық процестерде басты роль атқарады: адамның нерв жүйесінде, бала емізетін аналардың сүтінде, қанда болады. Кальций көбейсе адамның сүйектері қатаяды, ал жетіспеушілігі кішкентай балаларда рахит ауруын түзеді, екі қабат әйелдердің тісін құртады. Кальций (Ca) адамның тісі мен сүйектерінің негізін қалайды Қанқада- 94 % Ca 3 (PO 4 ) 2 ; Тісте- 84% Ca 3 (PO 4 ) 2 ∙ CaF 2 ; Тістің эмалі- 8%CaCO 3
Слайд 15: Табиғи қосылыстары :
сульфаттар CaS0 4 • 2Н 2 0 ғаныш, карбонаттар - СаС0 3, доломит СаС0 3 • 2MgC0 3 ; фосфаттары - фосфорит Са 3 (Р0 4 ) 2, апатит Са 5 (Р0 4 ) 3 0Н, фторапатит Са 5 (Р0 4 ) 3 Ғ, флюорит СаҒ 2.
Слайд 20
Магний (лат. Magnesіum ) Mg, элементтердің периодтық жүйесіндегі ІІ топтың элементі, атам нөмері 12, атам м. 24,312. Табиғатта үш изотопы бар: 24 Mg, 25 Mg, 26 Mg. Электрондық формуласы 1 s 2 2 s 2 2 p 6 3 s 2
Слайд 22: Физикалық қасиеті
Жер қыртысындағы масса бойынша мөлш. 2,1%. Ол барлық қосылыстарында екі валентті. Магний – күміс түсті ақ металл, атомдық массасы Қатты кездегі тығыздығы (250 С) г/см 3 1,74 Сұйық кездегі тығыздығы (6500 С) г/см 3 1,59 Балқу температурасы, 0 С 650 Қайнау температурасы, 0 С 1107 Меншікті электрөткізгіштігі, Ом ∙ см 4,5 ∙ 10 -6 Стандарттық электродтық потенциалы, В (Мg 2+ /Mg) -2.34
Слайд 23: Химиялық қасиеті
Ол қорғағыш оксидпленкамен қапталғандықтан, құрғақ ауада 350ӘС-қа дейінгі температурада тотықпайды, бірақ 600 — 650ӘС-та өздігінен тұтанып, жарқырай жанып, Магний оксидін ( MgO ) және аздап нитридін (Mg 3 N 2 ) түзеді. Құрамында бос оттек (О 2 ) жоқ суық сумен әрекеттеспейді ; қайнап жатқан судан Н 2 -ні ығыстырады. Сұйытылған қышқылдарда жеңіл ериді [ концентрленген күкірт қышқылының (H 2 SO 4 ) және HF ерітінділерінде пассивтеледі ]; сілтілердің суық ерітінділерінде ерімейді. Қыздырғанда сутегімен, галогендермен S, N 2, C-пен әрекеттеседі. Магнийді құрамында MgCl 2 бар балқымаларды электролиздеу арқылы, күйдірілген магнезит немесе доломитті металлотерм. ( ферросилицимен ) тотықсыздандыру және MgO-ін көміртерм. тотықсыздандыру арқылы алады.
Слайд 24: Магнийдің маңызды минералдары
Бурусит Mg(OH) 2 Форстерит Mg 2 SiO 4 Магнезит MgCO 3 Серпентин 3MgO ∙ 2SiO 2 ∙ H 2 O Кизерит MgSO 4 ∙ H 2 O Доломит MgCO 3 ∙ CaCO 3 Бишофит MgCl 2 ∙ 6H 2 O Лангбейнит 2MgSO 4 ∙ K 4 SO4 Кайнит MgSO 4 ∙ KCl ∙ 3H 2 O Карналлит KCl ∙ MgCl 2 ∙ 6H 2 O Полигалит MgSO 4 ∙ K 2 SO4 ∙ 2CaSO 4 ∙ 2H 2 O
Слайд 26
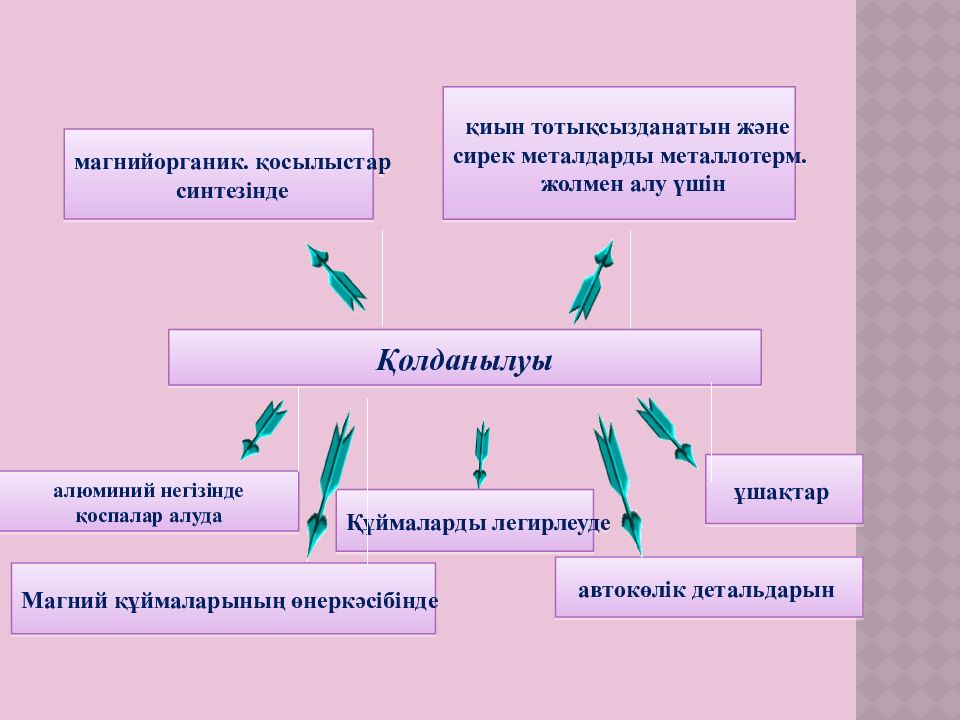
магнийорганик. қосылыстар синтезінде ұшақтар қиын тотықсызданатын және сирек металдарды металлотерм. жолмен алу үшін Қолданылуы алюминий негізінде қоспалар алуда автокөлік детальдарын Магний құймаларының өнеркәсібінде Құймаларды легирлеуде
Последний слайд презентации: Кальций: Медицинада қолданылатын қосылыстары
Mg 2 + Mg SO 4 * 7H 2 O (“ ағылшын тұзы ”) қолданады ішті айдайды. Магний клетканың құрамына сүйық түрде к і реді ( Mg 2+ ионы ). Ол комплекстердің құрамына кіреді, зат алмасуда нуклеин қышқылдарымен қатысады, жүйенің қуатына, бұлшық еттің қысқаруына әсер етеді. Mg 2+ иондары Ca 2+ иондарының антагонисты. Mg 2+ иондардың жетіспеушілігі жүректің қызметін бүзады,ал ол бұзушылықтар инфаркт- ауруын жоғарлатады. Адам әрбір нәрсеге ашуланса, ағзадағы магний « күйеді ». Сол үшін тез ашулы және женіл әсершіл адамдарда жүректің жұмыс етеуі нашарлайды, жүректің бұлшықеттерінде Mg 2+ иондары аз болады. Жалпы Mg 2+ иондары ағзада 42 мг 1кг салмаққа жуық.