Первый слайд презентации
Коллоидтық жүйелердің қасиеттері мен тұрақтылығы ДӘРІС № 14
Слайд 2
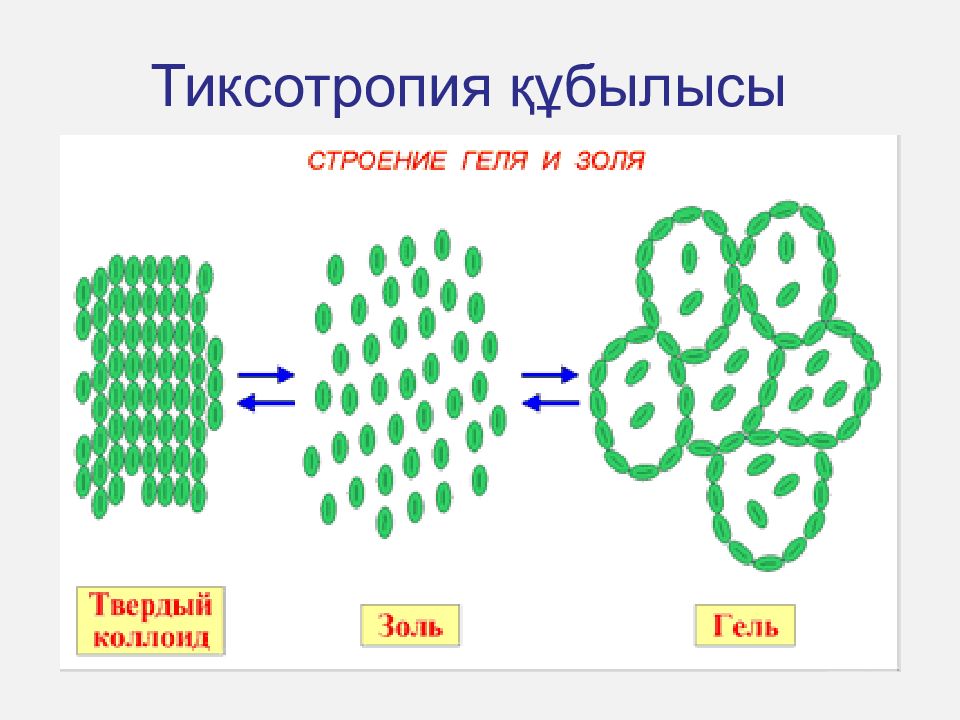
Сабақтың жоспары : Коллоидтық жүйелердің қасиеттері: Оптикалық (Тиндаль эффектісі) Молекулалық-кинетикалық (осмос, диффузия, броундық қозғалыс) Электрлік қасиеттері (электрофорез және электроосмос) Коагуляция және седиментация Коллоидтық жүйелердің тұрақтылығы: Агрегаттық тұрақтылық Кинетикалық тұрақтылық Электролиттік коагуляцияның заңдылықтары – Шульце-Гарди ережесі, лиотропттық қатар. Тиксотропия құбылысы
Слайд 3
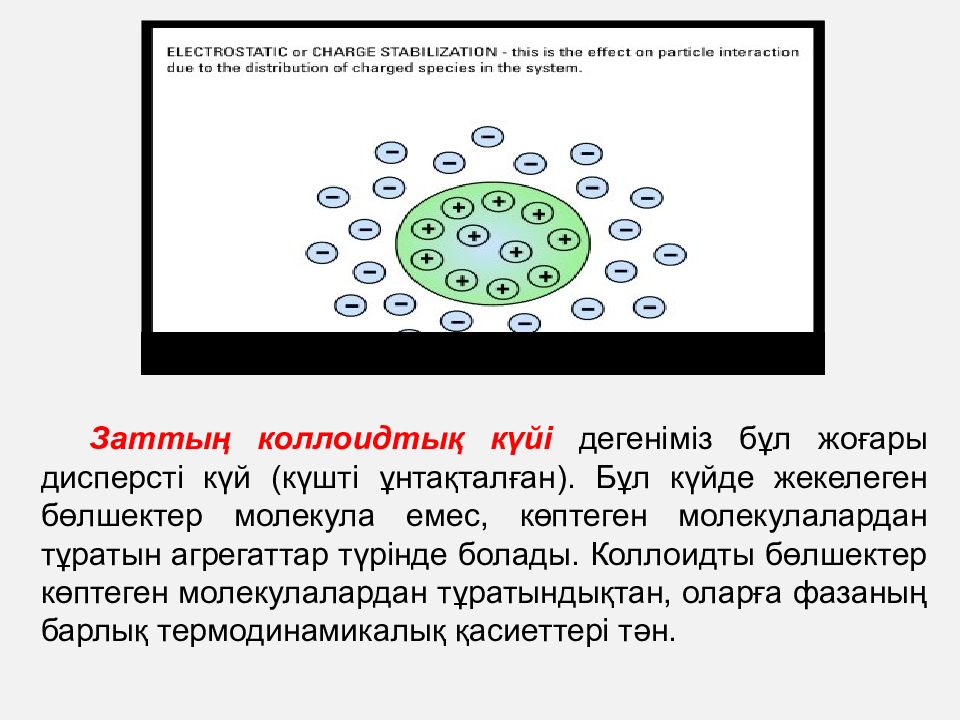
Заттың коллоидтық күйі дегеніміз бұл жоғары дисперсті күй (күшті ұнтақталған). Бұл күйде жекелеген бөлшектер молекула емес, көптеген молекулалардан тұратын агрегаттар түрінде болады. Коллоидты бөлшектер көптеген молекулалардан тұратындықтан, оларға фазаның барлық термодинамикалық қасиеттері тән.
Коллоидты жүйелердің оптикалық қасиеттері (дисперсті жүйедегі жарықтың шашырауы, ультрамикроскопия, нефелометрия) Коллоидты жүйелердің молекулярлы – кинетикалық қасиеттері (броундық қозғалыс, зольдердегі диффузия, осмостық қысым, седиментация, коагуляция) Коллоидты жүйелердің электрлік қасиеттері (электрофорез, электросмос, электрокинетикалық құбылыс, дзэта – потенциал, изоэлектрлік күй)
Жарықтың жүйе арқылы өтуі Дисперсті фаза бөлшектерінің сәуле толқын ұзындығынан кіші болғандықтан жарықтың сынуы Дисперсті фаза бөлшектерімен жарықтың шағылуы Жарықтың шашырауы (опалесценция) Дисперсті фазаның жарықты жұтлуы (абсорбция) нәтижесінде жарық энергиясының жылу энергиясына айналуы
Слайд 6
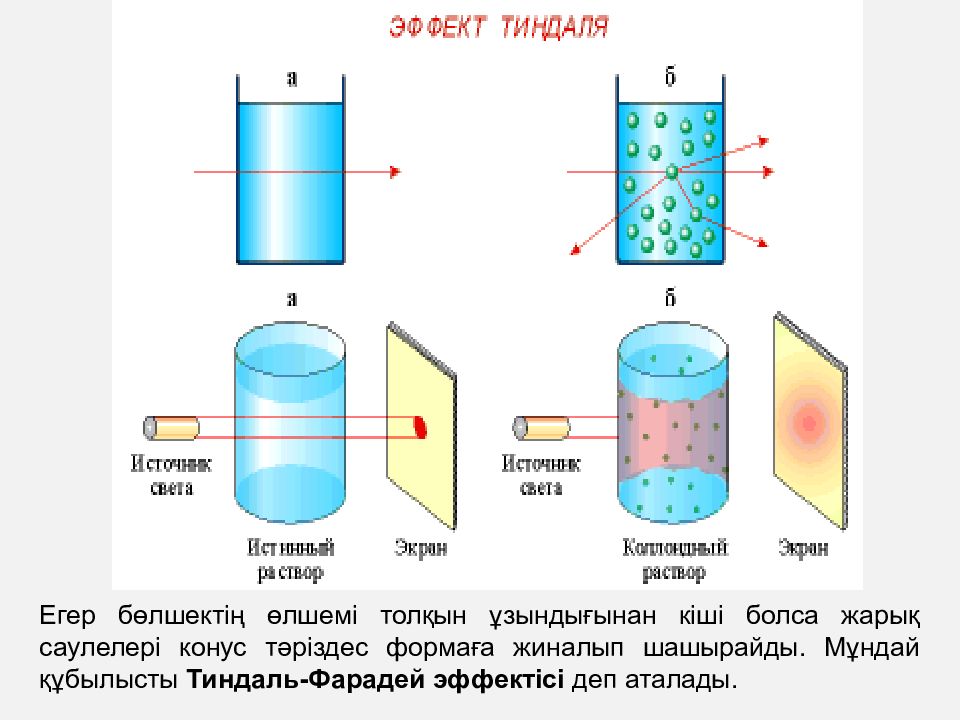
ЗОЛЬДЕРДІҢ ОПТИКАЛЫҚ ҚАСИЕТТЕРІ Жарықтың шашырауын жүйелі түрде зерттеу XIX ғасырдың ортасында басталды (1852 ж. Брюкке; 1857 ж. Фарадей; 1869 ж. Тиндаль). Әсіресе, жарық шашырауын Тиндаль өте тиянақты және нақтылы зерттеді, ол сондай-ақ, жарық шашырауын байқаудың бірден-бір жеңіл де қарапайым әдісін ұсынды. Тиндаль әдісі бойынша коллоидты ерітіндіні қараңғы жерге орналастырып, оның бүйір жағынан жарық сәулесін түсіреді. Осындағы бүйір жағынан көрінетін сәуле “ Тиндаль конусы не эффектісі “ деп аталды
Слайд 7
Егер бөлшектің өлшемі толқын ұзындығынан кіші болса жарық саулелері конус тәріздес формаға жиналып шашырайды. Мұндай құбылысты Тиндаль-Фарадей эффектісі деп аталады.
Слайд 8
Жарықтың шашырау (опалесценция құбылысы) теориясын Релей (1871-1899 ж.) зерттеген. Оның бұл теориясын бөлшек өлшемі түсетін жарық толқынының ұзындығынан бірнеше есе кіші, шар тәрізді, ток өткізбейтін жүйелерге қолдануға болады. Сұйытылған ортада тоқ өткізбейтін сфералық бөлшектермен шашыраған жарықтың интенсивтілігі Релей теңдеуімен анықталады:
Слайд 9
Зольдердің құрамын зерттеудің оптикалық әдістері Зольге түскен жарықтың өзгеруі мен осы өзгеріске тәуелді құбылыстар коллоидты жүйедегі бөлшектің түріне, өлшеміне, табиғатына, концентрациясына тәуелді болады. Бұл тәуелділіктерді оптикалық қасиетке негізделген әдістер арқылы зерттеуге болады екен. Өндірісте жиі қолданылатын нефелометрия мен ультрамикроскопия әдістері белгілі. Бұрын да айтылғандай, дисперсті системадағы жарықтың шашырауына байланысты құбылыстар бөлшектің түрі мен өлшемін анықтау үшін кеңінен қолданылады. Жарықтың шашырағандағы интенсивтілігін өлшеуге негізделіп, бөлшектердің концентрациясын анықтауға арналған аналитикалық әдісті нефелометрия деп атайды. Коллоидтық дәрежеде ұнталған бөлшектер кәдімгі микроскопта көрінбейді. Мұндайда ультрамикроскопты қолданады. 1903 жылы Р. Зигмонди мен Г. Зидентопф коллоидты бөлшектері бар жүйелерді оптикалық әдіс арқылы зерттеуді ұсынды. Олардың ультрамикроскопия деп атаған әдісі бойынша жекеленген бөлшектердің шашыратқан жарығы байқалады. Ультрамикроскопия әдісі коллоидты жүйедегі бөлшектердің орташа өлшемін аныктауға мүмкіндік береді.
Слайд 10: Зольдердің электрлік қасиеттері
Коллоидты ерітінділердегі фазааралық жанасу шегінде электрлік зарядтар туындайды. Коллоидты жүйенің электрлік қасиетін түсіну үшін, ондағы электр кинетикалық құбылыстарды және олармен тығыз байланыста болатын коллоидты бөлшектер мен электролиттердің өзара әрекеттесуін, сол сияқты осындағы бір фазаның екіншіден салыстырмалы жылжуынан туындайтын жайларды қарастыру қажет.
Слайд 12
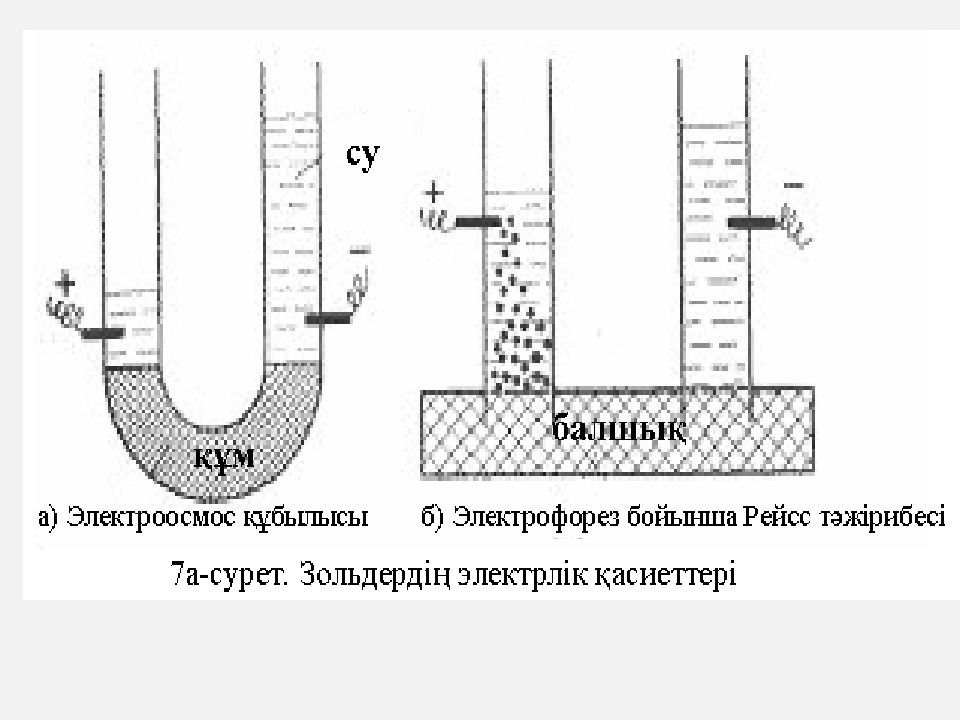
Коллоидты химиядағы электр кинетикалық құбылыстарды және онымен байланысты электрлік зарядтардың туындайтынын Москва университетінің профессоры Ф. Рейсс 1808 жылы ашты. Ол өз тәжірибелерінде бір түйір ылғалды балшыққа, екі шыны түтігін қадайды (б-сурет). Сонан соң, ол осы шыны түтік ішіне бірдей етіп жуылған кварцты құмын салып, бірдей деңгейге дейін су құяды. Шыны түтікке оң және теріс электродты енгізіп, оны тұрақты ток көзіне қосады. Біраз уақыт өткен соң электр өрісінің әсерінен балшық бөлшектері бөлініп, қүм арқылы сүзіліп өтеді де, оң зарядталған полюске жылжып көтеріледі. Демек, балшықтың бұл бөлшектері теріс зарядталған. Осы тұста, осы оң зарядталған шыны түтік ішіндегі су лайланады. Мұнда оң зарядталған бөлікте су тек лайланып қана қоймай, оның деңгейі төмендеп, теріс полюсті электроды бар шыны түтіктегі су деңгейі көтеріледі. Олай болса мұндағы су оң зарядталған. Бұл құбылыстарды одан әрі зерттегенде, олардың коллоидты жүйелерге де тән екені байқалды. Дисперстік фазаның электр өрісінде өзіне кері зарядталған электродқа карай жылжуы электрофорез деп аталады.
Слайд 13
Теріс электродтағы су деңгейінің көтерілу себебін табу мақсатымен Рейсс басқа да тәжірибелер жүргізді (7а-сурет). Ол негізінен U тәрізді шыны түтікшеге жуылған құм салып, оған су құяды. Бұл құрылғыдағы майда құм сүзгіш диафрагма ролін атқарады. Енді ондағы оң және теріс полюсті электродтарды тұрақты токқа қосқанда, шамалы уақыт өткен соң оның теріс полюсті бөлігіндегі су деңгейі жоғары көтеріліп, екінші бөліктегі төмендейді. Осы екі бөліктегі су деңгейі белгілі бір өлшемге дейін барып тоқталады. Көптеген тәжірибелер көрсеткендей, электрофорез кезіндегі коллоидты бөлшектер электр өрісінде белгілі бір жылдамдықпен козғалады. Сол сияқты осындай электр өрісіндегі сұйықта белгілі бір жылдамдықпен жылжумен катар коллоидты бөлшектер мен сұйықтардың мөлшері оған жұмсалатын потенциал айырымына және диэлектрлік өткізгіштігіне тура пропорционалды да, осы ортаның тұтқырлығына кері пропорционалдық байланыста болады екен. Бертон диафрагмалар деп аталатын қуыс заттар арқылы сұйықтың ондағы электр өрісі әсерінен жылжуы электроосмос құбылысы деп аталды.
Слайд 14
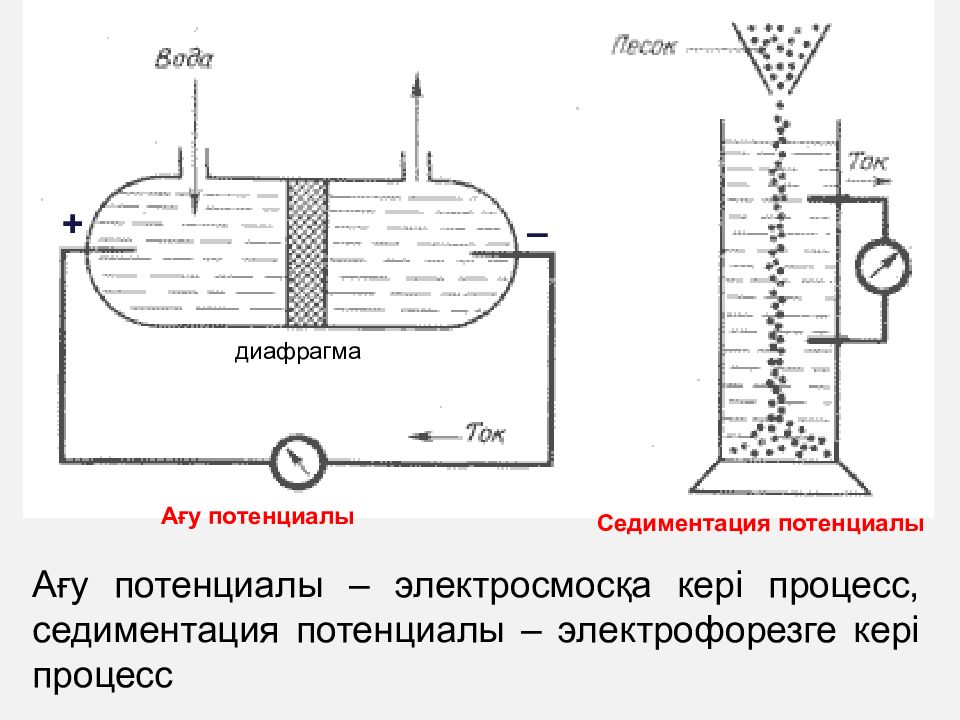
Ағу потенциалы – электросмосқа кері процесс, седиментация потенциалы – электрофорезге кері процесс диафрагма Ағу потенциалы Седиментация потенциалы + –
Слайд 15
Кезінде көпшілік назарына ілінген осы екі құбылыс жан-жақты және тиянақты зерттеліп, электрофорез бен электроосмос кұбылыстарына кері кұбылыстары ашылды. 1859 жылы Квинке диафрагмалы қуыс (кеуек) зат не өте ұсақ түтікшелер (капиллярлар) арқылы сұйықты механикалық күшпен, үлкен кысым туғызып өткізетін болса, онда әлгі диафрагма мен капиллярлы өткізгіштерде осы сұйықтың өтуіне қарсы тұрып, кедергі боларлықтай потенциал айырымы туындайтынын ашты. Бұл құбылыс ағу ә сері, ал онда пайда болатын потенциал айырымы ағу потенциалы деп аталады. 1879 жылы Дорн баска электр кинетикалық құбылысты байқайды : жылжымайтын сұйык арқылы қатты фаза қозғалғанда мысалы, судағы құм, тас түйірі секілділер шөккенде, оған қарсы тұратын потенциал айырымы пайда болады. Әрине, мұндай құбылыс электрофорезге кері, өйткені электрофорез кезінде электр өрісі әсерінен зарядталған коллоидты бөлшек жылжыса, коллоидты бөлшекті күшпен жүргізгенде электр өрісі туындайды. Мұны седиментация ( шөгу ), ал осы кезде пайда болатын потенциал айырымын седиментация потенциалы деп атайды.
Слайд 16
Мицелладағы қос электр қабат ын ың диффузиялық және адсорбциялық бөліктерінің арасындағы пайда болатын потенциал айырымын электрокинетикалы қ потенциал деп атайды. Әдетте бұл потенциалды гректің “ дзета ” әрпімен белгілейді және осыған орай оны дзета-потенциал деп те атай береді :
Слайд 17
Қолданбалы жағдайда электрокинетикалық потенциалдың шамасын есептеп шығару және оның оң не теріс екенін анықтау үшін электрофорез және электроосмос, ағу потенциалдарынан алынған мәліметтерді пайдаланады (Гельмгольц – Смолуховский теңдеуі): мұндағы К — коллоидты бөлшектің пішіне тәуелді болатын тұрақтылық ( мысалы, егер бөлшек шар тәрізді болса, K=6, ал цилиндр тәрізді болса, онда K=4); – дисперс тік ортаның т ұ тқырлығы; – ортаның диэлектрлік тұрақтылы ғы; 0 – абсолюттік диэлектрлік тұрақтылық (8,85*10 -12 Фар/м); Е (Н) – кернеу өрісінің градиенті (В/см) ; U – электр өрісінің әсерінен жылжитын бөлшектің орташа жылдамдығы.
Слайд 18
Коллоидтық ерітінділері нағыз ерітінділерге қарағанда тұрақтылығы аз болады. Коллоидтық жүйелер әртүрлі тұрақтылыққа ие болады: Агрегаттық тұрақтылық - коллоидтық бөлшектердің өзара бірігуіне және іріленуіне қарсы әсер ету қабілеті. Кинетикалық тұрақтылық - жүйенің барлық көлемі бойынша дисперстік фазаның біркелкі таралу қабілеті.
Слайд 19
КОАГУЛЯЦИЯ ҚҰБЫЛЫСЫ Коллоидты жүйелерде фазалар арасындағы беттің ауданы жоғары болғандықтан беттік энергия көп, сондықтан олар бірігу нәтижесінде оны азайтуға тырысады. Бұл процестер коагуляция және адсорбция арқылы жүреді. Дисперстік фаза бөлшектерінің өзара бірігуін коагуляция деп атайды. Коллоидтардың коагуляциясы әр түрлі факторлар әсерінен жүруі мүмкін: электролиттер қосу, механикалық әсер, температура, электр тоғы т.б.
Слайд 21
Лиофобты жүйелердің тұрақтылығына әсер ететін коллоидтық бөлшектерінің электр зарядтары және иондарының сольватациясы болады. Сондықтан коагуляцияның негізінде зарядсыздандыру және иондардың сольватациясын азайту тәсілдері жатады. Әдетте мұны электролит қосу арқылы алады. Электролитті қосқанда диффузиялық қабаттың азаюы -дзета потенциалдың азаюына әкеледі.
Слайд 22
22 Электролиттік коагуляция 1. Кез келген электролит коагуляцияны туғыза алады. Ол үшін оның концентрациясы, коагуляция табалдырығы деп аталатын бір шамадан жоғары болуы керек. Ко а гуляция табалдырығы – коагуляцияны туғызатын электролиттің минимальді концентрациясы аталады : C Т – коа г уляция табалдырығы, N эл – электролит концентрациясы, V эл – жұмсалған электролит тің көлемі, V золь – золь көлемі.
Слайд 23
2. Коагуляцияны коллоидты бөлшектердің зарядына қарсы зарядталған иондар туғызады. 3. Иондардың заряды неғұрлым көп болса, ионның коагуляциялаушы қабілеті соғұрлым жоғары болады. ( Шульце-Гарди ережесі ). Егер иондардың валенттіліктері бірдей болса, онда иондар радиусының ұзындығына сәйкес коагуляциялаушы қабілеті де артады. 4. Коагуляция нәтижесінде түзілген тұнбада коагуляцияға түсуші иондардың біразы болады.
Слайд 24
Лиофобты зольдердегі бөлшектердің өздігінен бірігуі автокоагуляция немесе зольдің қартаю ы деп аталады. Автокоагуляция жылдамдығы электролиттік коагуляциядан аз.
Слайд 25
Седиментация құбылысы Коллоидтық жүйенің кинетикалық тұрақтылығы ауырлық күші мен диффузия күшіне байланысты. Коагуляцияланған бөлшектердің ауырлық күші әсерінен тұнбаға түсуі седиментация деп аталады. Бөлшектердің тұну жылдамдығы олардың өлшеміне, ортаның тығыздығы мен тұтқырлығына және ауырлық күшіне тәуелді болады. Стокс заңы бойынша сфера тәріздес бөлшек тұтқырлы ортада қозғалғанда келесі формуламен анықталатын кедергі күшіне ( f ) ие болады: f = 6 r U мұндағы - ортаның тұтқырлығы, н сек/м 2, r – бөлшектердің радиусы, м., U – тұну жылдамдығы, м/сек.,