Первый слайд презентации
«Химиялық пәндер кафедрасы» ПРЕЗЕНТАЦИЯ Тақырып: Химиялық байланыс және оның адам өміріндегі маңызы. Дайындаған: Раимова Юлдуз Данияровна Топ: ЖМҚБ -08-22 Қабылдаған: Дауренбеков Қанат Нарбекович
Слайд 2
ЖОСПАР: Кіріспе Химиялық байланыс Негізгі бөлім Химиялық байланыстың негізгі түрлері Ковалентті байланыстың түзілу механизмі Ковалентті байланыстың қасиеттері: қаныққандығы, бағыттылығы, полярлығы Электрон бұлттарының қабысуы бойынша ковалентті байланыстың түрлері Сутектік байланыс және оның түрлері Сутектің байланыстың биологиялық рөлі Қорытынды Қолданылған материалдар
Слайд 3
Кіріспе: Химиялық байланыстар — химиялық элементтер арасындағы тұрақты тепе- тең күйдегі жүйе жасауға келіп тірелетін (молекула, ион, радикал) электромагниттік әсерлесу жиынтығы. Х имиялық байланыс — атомдардың химиялық қосылыс түзіп әрекеттесуі. Химиялық байланыстар атомдардың әрекеттесуі нәтижесінде пайда болған екі атомдық немесе көп атомдық тұрақты жүйелерде (молекулаларда, кристалдарда) түзіледі. Химиялық байланыс туралы ілім − қазіргі химияның негізгі проблемаларының бірі.Өйткені не себепті атомдардың бір-бірімен әрекеттесіп заттар түзетінін және олардың түзілу механизмдерін білмей тұрып, заттардың құрамын, құрылысын, реакцияласқыштық қабілетін білуге болмайды. Химиялық байланыстардың түзілу механизмін түсіндіру электрон ашылғаннан кейін ғана мүмкін болды. 1916 жылы неміс ғалымы В.Коссель бір элементтің электрон беруі, екінші элементтің осы электронды қосып алуынан түзілген иондардың арасындағы тартылыстың нәтижесінде химиялық байланыс түзіледі деген теориясын ұсынды. В.Коссель идеясы байланыстың иондық теориясын жасауға негізгі тірек болды. Бірақ бұл теория да бірдей атомдардың арасындағы байланыстың табиғатын түсіндіре алмады. Сол жылы американдық ғалым Г.Льюис әрекеттесетін атомдардың дара электрондарын ортақтастырудың нәтижесінде түзілген екі атомға да бірдей ортақ қос электрондар арқылы химиялық байланыс түзіледі деген теориясын ұсынды. Коссель мен Льюис теорияларын химиялық байланыс теориясының екі жағы деп қарастыруға болады. Өйткені Коссель теориясы бойынша химиялық байланыс (иондық) электрон беру, қосып алу нәтижесінде болған иондар арасында түзіледі, ал Льюис теориясы бойынша химиялық байланыс екі элементтің ортақтастырылған қос электрондары арқылы түзіледі. Қазіргі кезде қолданылатын химиялық байланыс туралы ілім Коссель мен Льюис теориялары негізінде дамыды.
Слайд 4
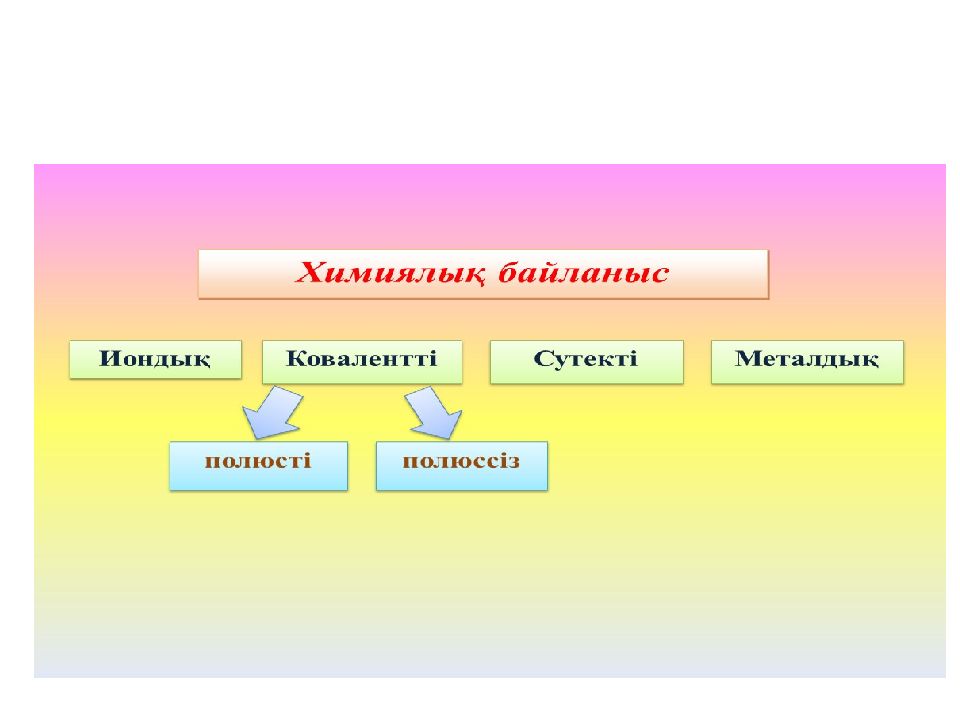
Химиялық байланыстардың түрлері Химиялық байланыс түзілген кезде әрекеттесуші атомдардың сыртқы электрондық қабаттарында өзгерістер жүреді. Байланыстың төрт түрі болады : Ковалентті байланыс Сутектік байланыс Иондық байланыс Металдық байланыс Химиялық байланыстың сандық сипаттамалары. Химиялық байланыстар энергетикалық және геометриялық параметрлерімен (өлшемдерімен) сипатталады. Байланыс энергиясы химиялық байланыс беріктігінің өлшемі. Бұл энергия байланысты бұзу (үзу) үшін қажет. Мұндай тұста молекула негізгі күйде және Т=0 Кельвин байланыс энергиясының шамасы 100-1000 кДж/моль аралығында болады. Геометриялық параметрлерге химиялық байланыстың ұзындығы (молекуладағы, коплекстегі, кристалдағы және т.б.); байланыстардың арасындағы бұрыштар жатады. Байланыс ұзындығы – ол молекуладағы немесе кристалдағы атомдар ядросы ортасының (центрлерінің) арақашықтығы. Әдетте, байланыс ұзындығы азайған сайын байланыс энергиясы өседі және оған сәйкес молекуланың тұрақтылығы да арта түседі.
Слайд 6
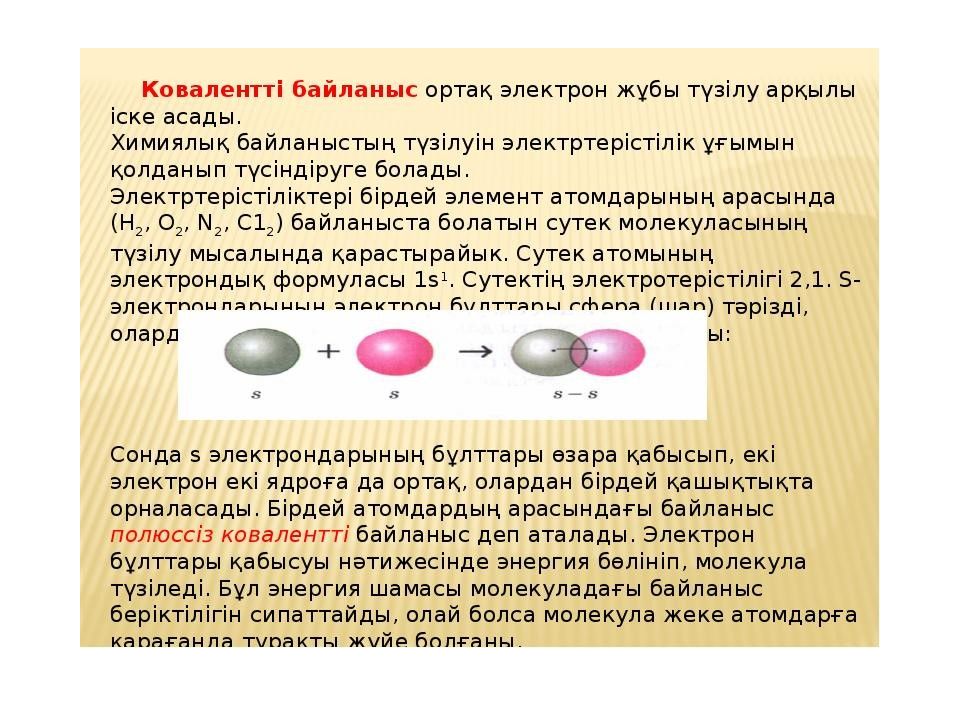
Коваленттік байланыс Атомдардан молекула түзілуінің ең басты шарты – молекула түзілгенде энергияның бөлінуі қажет, яғни атомдардың энергия қорынан молекуланың энергия қоры аз болуы керек. Әрекеттесуші атомдардың жұптаспаған электрондарының қатысуымен жалпы электрон жұбы түзілуі үшін олардың антипараллельді спині болуы керек. Мұндайда электрондық бұлттардың қайта жабылуы жүреді. Жалпы ( екеуіне ортақ ) электрондық жұптар арқылы іске асатын химиялық байланысты коваленттік деп атайды. Осындағы “ ковалентті ” сөзі “ біріккен ” деген мағынаны дәл білдіреді. Ковалентті байланыстың екі түрі бар: полюсті ( полярлы ) және полюссіз ( полярсыз ). Ковалентті полюссіз байланысты симметриялы электрондық бұлт түзетін жалпы электрондық жұп іске асырады. Байланыстың бұл түрі электртерістілігі бірдей атомдардың арасында туындайды : H2, О2, N2, F2, Cl2, Br2, J2, C, P, As, PH3, CS2. Мысалы ; хлор молекуласы түзілген кездегі электрондық жұп хлор атомдарының екеуіне бірдей қатысты. Ковалентті полюсті байланыс - әртүрлі екі атом арасында түзіледі, осындағы электрондық бұлт электртерістілеу атомға қарай ығысқан : HCl, H2 О, H2S, C О2 және т.б. Мысалы ; хлор мен сутек молекулаларының арасындағы реакция сатыларының біреуінде олардың атомдары әрекеттесіп, ковалентті байланыс түзеді : Мұндай жағдайдағы түзілген электрондық жұп электртерістілеу хлордың ядросы жағынан күштілеу тартылыс күшіне кезігеді. Электрондық жұптың ығысуы салдарынан хлор атомындағы теріс зарядтың тығыздылығы жоғарылайды δ-; ал сутек атомында оң зарядтың тығыздылығы артады δ+. Атом алатын зарядты ( δ+ немесе δ-) пәрменді ( эффективті ) заряд дейді. Коваленттік байланыстың донорлық-акцепторлық механизмі деп бір атомның байланыс түзбеген жұп электроны мен екінші атомның бос орбиталі қосылуы нәтижесінде түзілген байланысты айтады.Жұп электронын беретін атом донор, ал оны қабылдаған атом акцептор деп аталады.
Слайд 7
Коваленттік байланыстың бағытталуы молекулалардың кеңістіктік құрылымын ( пішінін ), яғни олардың геометриялық формасын тудырады. Мұны кәдімгі молекулалардың : НС l, Н2О және NH3 түзілу мысалында қарастырайық. Коваленттік байланыс атомдардың қосылу сызығының бойында электрон бұлттары, ( орбитальдары ) максимал бүркескен бағытта пайда болады. Хлорсутек НС l молекуласы сызықты, өйткені сутек атомының s- орбиталі мен хлор атомының p- орбиталінің бүркесуі есебінен түзіледі. Су молекуласы Н2О түзілгенде, оттек атомы екі валенттік р- электрондары арқылы сутекпен бұрышты молекула түзеді. Аммиак молекуласы NH3 түзілгенде байланыстар сутектің үш атомының s- электрондарымен байланысқан азот атомының үш р- орбиталінің үш осі бойына орналасады. Молекула дұрыс тригональді пирамида пішініне ие болады. Коваленттік байланыстың бағытталуы орталық атомның валенттік орбитальдарының гибридтенуіне және олардың кеңістікте орналасуына тәуелді. Орбитальдардың гибридтенуі – әр түрлі электрон бұлттарының араласуы және олардың пішіні мен энергиясы бойынша бірдей болуы. Бұл жағдайда электрон орбитальдарының алғашқы пішіні өзгереді, ассиметриялы және ядроның бір жағына қарай созылыңқы гибридті орбитальдар түзіледі. Гибридтік орбитальдардан түзілген химиялық байланыс бүркесуі көбірек болғандықтан, бастапқы орбитальдардың электрондары қатысында түзілген байланысқа қарағанда берік болады.
Слайд 9
Сутектік байланыс Сутектік байланыс табиғатта кең таралған және оның көптеген химиялық және биологиялық процестер үшін маңызы зор. Сутектік байланысты тек молекуласындағы сутек атомы күшті электртерістілікті атомдармен ( F, О, Cl, N, S, және т.б.) байланысқан зат қана түзе алады. Сутектік байланыс тек молекулааралық қана ( әртүрлі молекулалар арасында ) болмай, ол бір молекуланың ішінде де ( бір молекула ішіндегі әртүрлі топтар арасында ) бола алады. Сутек атомы – ішкі электрондық қауызы жоқ және өте кіші өлшемде болғандықтан, көрші теріс полюстенген атомның электрондық қауызы ішіне еніп кетуге қабілетті. Мысалы, құмырсқа қышқылындағы Н-О байланысты түзуші электрондар, электртерістілеу оттек атомына ығысқан. Сутек атомының ядросында ( протонда ) электрондық бұлт мүлдем қалмайды, мұндайда осы сутек атомы ядросы мен теріс зарядталған қышқылдың көрші молекуласындағы оттек атомының арасында электростатикалық тартылу туындайды. Бұл сутектік байланыстың пайда болуына әкеледі. Бұл байланыстың түзілуіне сутек атомындағы “ жартылай бос” 1 s- орбиталімен және электртерістілікті атомның бөлінбеген электрон жұбы орбиталінің донорлы – акцепторлық әрекеттесуі белгілі бір дәрежеде үлес қосады. Сутектік байланыстың түзілуін көрнекілеп, оны үш нүкте арқылы белгілей отырып көрсетуге болады. Сутектің байланыстың энергиясы (8-40 кДЖ /моль) мен ұзындығы коваленттік байланыстың энергиясы мен ұзындықтарымен және вандерваальстік күштің арасындағы аралық мәнде болады. Әйтсе де бұл энергия молекулалар арасындағы ассоциация ( бірігу ) үшін жеткілікті екен. Молекулааралық сутектік байланыстардың түзілуі заттар қасиеттерінің өзгеруіне әкеледі ( айтарлықтай : тұтқырлықтың, диэлектрлік тұрақтының, балқу және қайнау температураларының өзгеруі, балқу және бу түзу жылуының жоғарылауы ). Мысалы : судың, фторсутектің және аммиактың қайнау және балқу температуралары аномальды жоғары. Көптеген қосылыстарда ковалентті полярлы Н-О және Н- N байланыстар болады, сондықтан да сутектік байланыстар тек суда ғана болып қоймастан, сан алуан кристалдық заттарда, полимерлерде, белоктарда, тірі организмдерде байқалады.
Слайд 10
Заттардың агрегаттық күйі. Заттар газ түрінде, сұйық және қатты күйде немесе плазма көрінісінде бола алады : 1. Газ түріндегі күй : Газдағы молекулалар бірінен бірі алыс орналасады. Сондықтан газды күй, сұйық және қатты күйлермен салыстырғанда, ең кіші молекулааралық әрекеттесу күшімен сипатталады. Газ өзі орналасқан ыдыстың түрпішінін қабылдайды. 2. Сұйық күйі : Сұйықтағы молекулааралық әрекеттесу күші, газдағымен салыстырғанда үлкен, әйтсе де ол әлі түрпішіні мен көлемін сақтау үшін жеткіліксіз. 3. Қатты күй : Қатты заттардағы бөлшектер біріне бірі өте жақын орналасқан, олардың арасындағы әрекеттесу күшінің үлкендігі соншама, қатты заттың белгілі көлемі мен түрпішіні болады. Қатты күй кристалды және аморфты бола алады. 4. Плазмалық күй : Ионданған газ, ондағы оң және теріс электрлік зарядтардың көлемдік тығыздылықтары тең ( бұл ғарыштық кеңістік үшін басым, тән ). Қатты заттардың белгілі көлемі мен формасы болады, бөлшектері еркін қозғалып жүрмейді, олар тек өз осінен тербелмелі қозғалып, аморфты және кристалды күйлерде болады. Аморфты заттар тәртіпсіз орналасқан бөлшектерден тұрады. Бұлардың белгілі балқу температурасы болмайды. Олар қыздырғанда алдымен жұмсарады, сонан соң қоймалжың күйге көшеді. Аморфты заттарға шыны жатады. Кристалды затардың бөлшектері кеңістікте белгілі тәртіппен орналасып кристалдық торлар түзеді. Кристалдағы бөлшектердің орналасу орталықтары кристалдық тордың түйіндері деп аталады. Құрамындағы бөлшектердің кеңістікте белгілі тәртіппен орналасуына байланысты жеке кристалдардың немесе монокристалдардың тиісті геометриялық формалары болады. Геометриялық формаларына сәйкес бұл кристалдық жүйелер кубты, тетрагональды, гексагональды, ромбалық, моноклинді, триклинді болып бөлінеді.
Слайд 11
Кристалдық тор типтері Кристалдық жүйенің типі бөлшектің өлшемімен және табиғатымен, олардың арасындағы химиялық байланыс түрімен, температурамен және басқа да себептермен анықталынады. Тордағы бөлшектер орналасқанда, жүйенің энергиясы ең кіші мәнінде қалуы керек. Тордың төрт түрі белгілі. 1. Иондық тор: Бұл типтегі кристалдардың құрылымдық бірлігі оң және теріс зарядталған иондар болады, олардың арасында жоғары энергиямен сипатталынатын электростатикалық әрекеттесу жүреді. Әртүрлі зарядтағы иондардың өзара күшті тартылуы иондық кристалдардың жоғары беріктілігін қамтамасыз етеді, олардың балқу және қайнау температураларының айтарлықтай жоғары болуын түсіндіреді. 2. Атомдық тор. Кристалдардың түйіндерінде атомдар орналасады, олар бірімен бірі берік ковалентті байланыс түзеді. Атомдар түзетін кристалдардың қаттылығы жоғары, өйткені кез келген деформация коваленттік байланыстың бұзылуына әкеледі. Мұндай кристалдардың балқу және қайнау температурасы жоғары, ал ұшуы өте аз. Мысалы, алмазтың балқу температурасы − 3500°С, ал қайнау температурасы − 4200°С. 3. Молекулалық тор. Тор түйіндерінде молекулалар орналасады, олардың арасында вандерваальстік немесе сутектік байланыс күштері болады.. Молекулалық торлардағы молекулааралық әрекеттесу иондық және атомдық кристалдардағыдан едәуір әлсіздеу. Сондықтан молекулалық кристалдар төменгі температурада балқиды және ұшуға бейім. Мұндай заттар ток өткізбейді. Молекулалық торы бар заттарға йод, сахароза, камфора және т.б. мысал болады. 4. Металдық тор. Мұндай торлардың түйіндерінде металдардың иондары болады, ал валенттік электрондар бүкіл кристалл көлемінде таралған ( делокализденген ). Мұндай кристалдарды s- және р- металдар түзеді, олар аса жоғары емес балқу температурасымен және қаттылығымен сипатталынады. Онда “ электрондық газдың ” болуы жоғары ток және жылу өткізгіштікті қамтамасыз етеді, сол сияқты металға соғылғыштық және иілгіштік сипат береді.
Слайд 13
Бақылау тесті Су молекуласындағы байланыс: А) Иондық Б) Ковалентті полярлы В) ковалентті полярсыз Г) сутектік Д) металдық 2. Азот қышқылындағы азоттың коваленттігі тең: А) екі Б) бір В) төрт Г) үш Д) бес 3. Молекуласында тотығу дәрежесі нольге тең, ал валенттілігі бірге тең элемент А) HCL B) N2 C) NH3 D) CL2 E) O2 4. … байланыс молекулааралық байланысқа жатады А) ковалентті полярлы Б) ковалентті полярсыз В) Донорлы акцепторлы Г) сутектік 5. Хлор атомының максимальды коваленттілігі.... Тең А) бір В) төрт С) үш Д) бес Е) жеті
Слайд 14
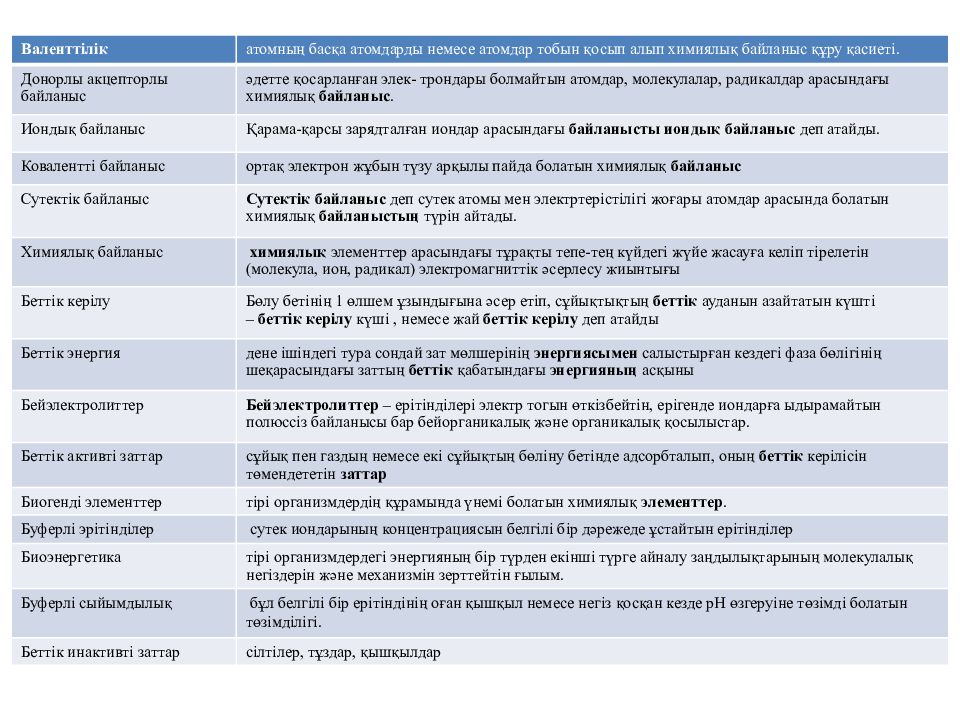
Валенттілік атомның басқа атомдарды немесе атомдар тобын қосып алып химиялық байланыс құру қасиеті. Донорлы акцепторлы байланыс әдетте қосарланған элек - трондары болмайтын атомдар, молекулалар, радикалдар арасындағы химиялық байланыс. Иондық байланыс Қарама-қарсы зарядталған иондар арасындағы байланысты иондық байланыс деп атайды. Ковалентті байланыс ортақ электрон жұбын түзу арқылы пайда болатын химиялық байланыс Сутектік байланыс Сутектік байланыс деп сутек атомы мен электртерістілігі жоғары атомдар арасында болатын химиялық байланыстың түрін айтады. Химиялық байланыс химиялық элементтер арасындағы тұрақты тепе- тең күйдегі жүйе жасауға келіп тірелетін (молекула, ион, радикал) электромагниттік әсерлесу жиынтығы Беттік керілу Бөлу бетінің 1 өлшем ұзындығына әсер етіп, сұйықтықтың беттік ауданын азайтатын күшті – беттік керілу күші, немесе жай беттік керілу деп атайды Беттік энергия дене ішіндегі тура сондай зат мөлшерінің энергиясымен салыстырған кездегі фаза бөлігінің шеқарасындағы заттың беттік қабатындағы энергияның асқыны Бейэлектролиттер Бейэлектролиттер – ерітінділері электр тогын өткізбейтін, ерігенде иондарға ыдырамайтын полюссіз байланысы бар бейорганикалық және органикалық қосылыстар. Беттік активті заттар сұйық пен газдың немесе екі сұйықтың бөліну бетінде адсорбталып, оның беттік керілісін төмендететін заттар Биогенді элементтер тірі организмдердің құрамында үнемі болатын химиялық элементтер. Буферлі эрітінділер сутек иондарының концентрациясын белгілі бір дәрежеде ұстайтын ерітінділер Биоэнергетика тірі организмдердегі энергияның бір түрден екінші түрге айналу заңдылықтарының молекулалық негіздерін және механизмін зерттейтін ғылым. Буферлі сыйымдылық бұл белгілі бір ерітіндінің оған қышқыл немесе негіз қосқан кезде рН өзгеруіне төзімді болатын төзімділігі. Беттік инактивті заттар сілтілер, тұздар, қышқылдар
Последний слайд презентации: Химиялық пәндер кафедрасы» ПРЕЗЕНТАЦИЯ Тақырып: Химиялық байланыс және оның
Пайдаланылған әдебиеттер Қ.Н.Дауренбеков, Қ.М. Серимбетова, А.Ш. Өмірқұлов. Химия Сейтембетов Т.С. Химия Ә.Қ. Патсаев, С.А. Шитыбаев, Қ.Н. Дауренбеков. Бейорганикалық және физколлоидтық химия Ә.Қ. Патсаев, С.А. Шитыбаев, Қ.Н. Дауренбеков, Т.С. Сейтембетов. Биоорганикалық химия Қ.Н.Дауренбеков, Ә.Қ. Патсаев. Биоорганикалық химия пәнінен тәжірибелік зертханалық сабақтарына қолданба Л. М. Түгелбаева, Р.Г. Рысқалиева, Р.К. Әшкеева. Жалпы химия Веренцова Л.Г, Нечепуренко Е.В, Батырбаева А,Ә, Карлова Э.К. Бейорганикалық коллоидты және физикалық химия Ә.Қ. Патсаев, Қуатбеков Ә.М, Бақтыбаев Ө,Б. Биоорганикалық химия практикумы