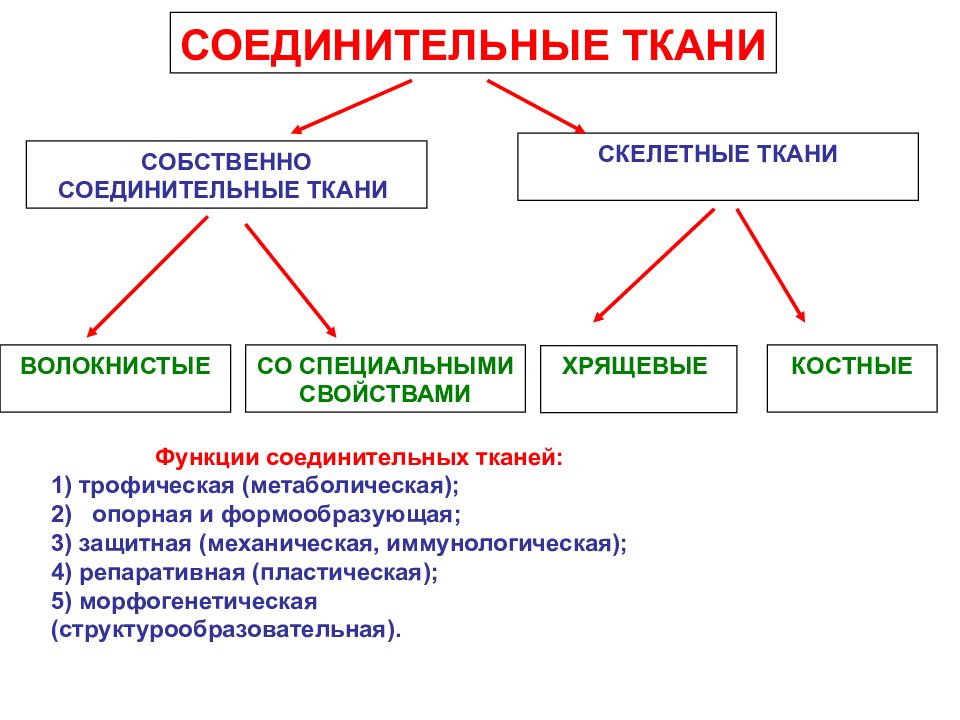
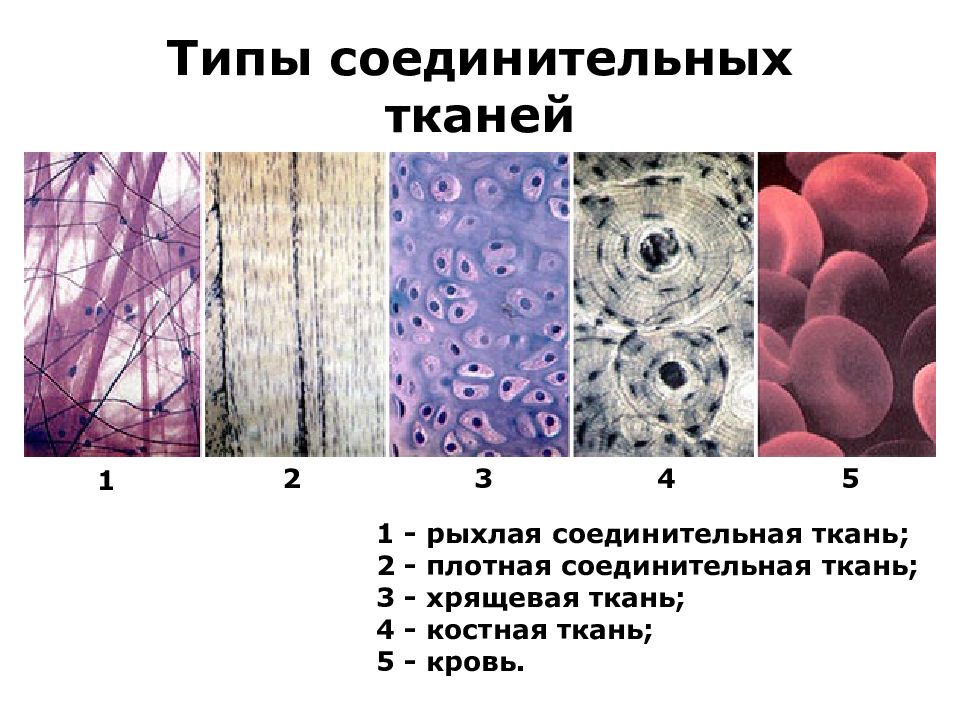
Первый слайд презентации: Лекция 22. Биохимия соединительной ткани
Дисциплина: Б1.Б.15. Биохимия Специальность: 31.05.02 Педиатрия НГМУ, кафедра медицинской химии д.б.н., доцент Суменкова Д.В.
Слайд 2: Актуальность темы
Широкая распространенность соединительной ткани в организме (до 50%), разнообразные функции, участие практически во всех физиологических и патологических процессах обусловливают необходимость изучения метаболизма соединительной ткани Соединительная ткань — это вне (меж-)клеточный матрикс вместе с клетками различного типа ( фибро -, хондро -, остеобласты,тучные клетки, макрофаги) и волокнистыми структурами. Функции соединительной ткани: опорная: формирование структуры органов (каркаса, стромы) защитная: формирование наружных покровов органов, регуляция функций макрофагов и клеток иммунной системы трофическая: обмен веществ между кровью и тканями межклеточные взаимодействия, регенерация Соединительная ткань является основным компонентом кожи и костей. Нарушения обмена соединительной ткани являются основой патогенеза ряда заболеваний человека. 2
Слайд 3: Цель лекции
Знать: Строение, свойства и функции основных биохимических компонентов соединительной ткани Химико-биологическую сущность метаболических процессов, происходящих в соединительной ткани организма ребенка и подростка на молекулярном и клеточном уровнях Знания биохимии соединительной ткани необходимы для формирования умения объяснять молекулярные механизмы возникновения ряда заболеваний, связанных с нарушением метаболизма соединительной ткани анализировать результаты лабораторных исследований, используемых для диагностики ряда заболеваний, для выявления патологических процессов в органах и системах 3
Слайд 4: План лекции
Биохимия межклеточного матрикса гетерополисахариды структурные и адгезивные белки Минерализованная соединительная ткань. Ремоделирование костной ткани. 4
Слайд 5: Биохимия Межклеточного матрикса
Гетерополисахариды и протеогликаны Структурные и адгезивные белки 5
Слайд 6: Межклеточный матрикс
Гетерополисахариды и протеогликаны Гликозамингликаны гиалуроновая кислота хондроитинсульфат дерматансульфат гепарансульфат гепарин кератансульфат Протеогликаны ( гликозамингликаны + белки) Белки Структурные коллаген эластин Адгезивные фибронектин ламинин нидоген 6
Слайд 7: Гликозамингликаны, или мукополисахариды (ГАГ)
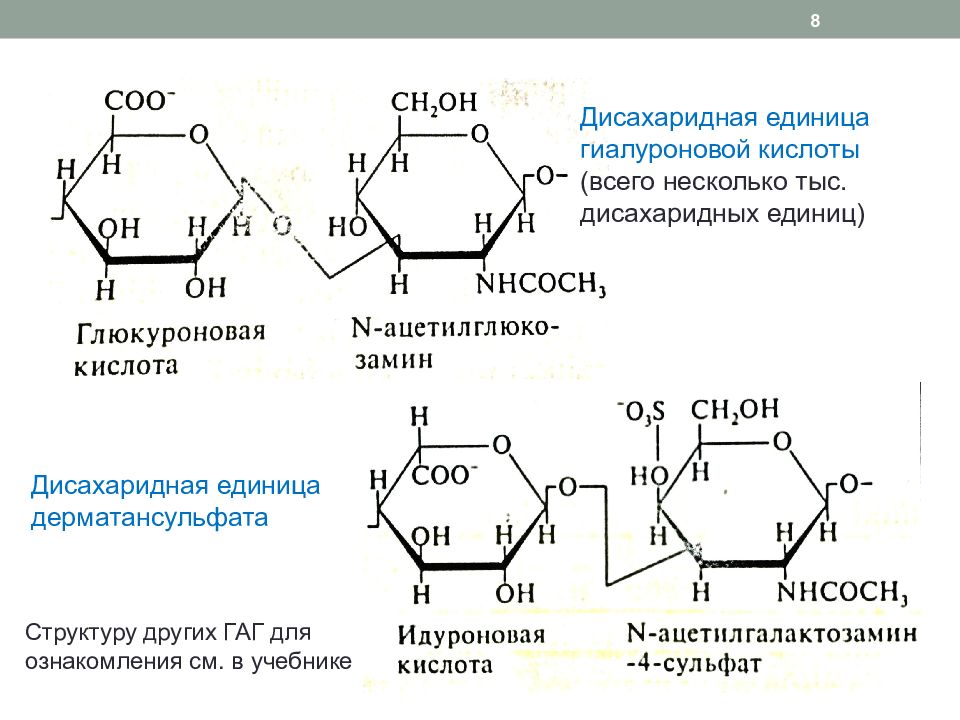
Линейные отрицательно заряженные гетерополисахариды, состоящие из повторяющихся дисахаридных звеньев (см. след. слайд): гексуроновая кислота ( глюкуроновая или идуроновая ) ацетилпроизводное аминосахара (глюкоз- или галактозамина ) Ацетилирование NH 2 группы аминосахаров приводит к исчезновению положительного заряда Карбоксильные группы кислот и сульфатные группы ацетилпроизводных аминосахаров придают большой отрицательный заряд – полианионные свойства, поэтому ГАГ: связывают Na +, К +, Ca 2+, воду (молекула гиалуроновой кислоты связывает 200 – 500 молекул воды, поэтому межклеточное вещество приобретает характер желеобразного матрикса) препятствуют прохождению отрицательно заряженных молекул, клеток (например, белков и эритроцитов через базальную мембрану клубочков почек) 7
Слайд 8
Дисахаридная единица гиалуроновой кислоты (всего несколько тыс. дисахаридных единиц) Дисахаридная единица дерматансульфата 8 Структуру других ГАГ для ознакомления см. в учебнике
Слайд 9: Особенности строения отдельных ГАГ
Кератансульфаты вместо гексуроновой кислоты содержат галактозу и к роме дисахаридных единиц – фукозу, маннозу, сиаловую кислоту Гепарин имеет большее количество сульфатных групп за счет сульфатированной глюкуроновой кислоты 9
Слайд 10: Функции гликозамингликанов и протеогликанов
Структурный компонент межклеточного матрикса Формируют тургор тканей ( гиалуроновая кислота) «Смазка» в суставах ( гиалуроновая кислота) Фильтрационный барьер в почках ( гепарансульфаты ) «Молекулярное сито»: препятствуют распространению патогенных микроорганизмов Рессоры в суставных хрящах Прозрачность роговицы ( кератан -, дерматансульфаты ) Антикоагуляция (гепарин) Межклеточные взаимодействия, клеточная адгезия ( гепарансульфаты ) Самые распространенные ГАГ - хондроитинсульфаты (Х-4-сульфат, Х-6-сульфат): хрящи, кожа, связки, сухожилия, артерии, роговица глаза 10
Слайд 11: Протеогликаны – основное вещество межклеточного матрикса
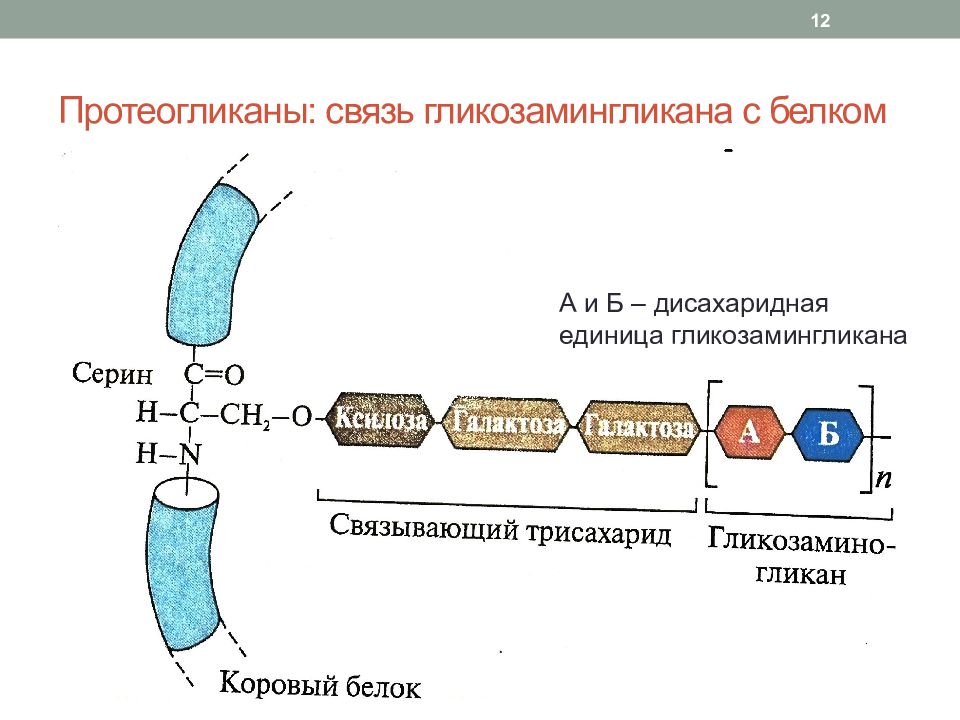
Состав протеогликанов : Гликозамингликаны (кроме гиалуроновой кислоты) – 90-95% Белковая часть – 5-10% Примеры протеогликанов : агрекан, версикан (крупные), декорин, бигликан, перлекан, люмикан, фибромодулин (малые) Связь гликозамингликана с белком осуществляется через связывающий трисахарид : ксилоза – галактоза – галактоза Связывание осуществляется через ОН-группу серина, треонина или NH 2 -группу аспарагина в молекуле белка 11
Слайд 12: Протеогликаны : связь гликозамингликана с белком
А и Б – дисахаридная единица гликозамингликана 12
Слайд 13: Синтез протеогликанов
1. Синтез белковой части 2. Образование линкерного трисахарида 3. Рост цепи гликозамингликана Реакции 2 и 3 этапов осуществляют гликозилтрансферазы, использующие в качестве субстрата активные формы сахаров (связанные с УДФ ). Все сахара синтезируются из глюкозы Источник NH 2 – глутамин, ацетильной группы – ацетил- КоА, сульфатной группы - фосфоаденозил-фосфосульфат (ФАФС) Активация сахара: присоединение УДФ к С1-фосфорилированному моносахариду при участии трансфераз : Галактоза-1-фосфат + УТФ → УДФ-галактоза + Н 4 Р 2 О 7 Нарушений синтеза протеогликанов не описано 13
Слайд 15: Катаболизм гликозамингликанов и протеогликанов
Полупериод жизни: 3 – 10 дней ( кератансульфат 120 дней) Осуществляют лизосомные протеазы, гликозидазы, сульфатазы Отсутствие или снижение активности ферментов приводит к нарушению катаболизма – лизосомные болезни – мукополисахаридозы (МПС) Типология МПС основана на виде фермента, недостаточность которого имеет место Например, МПС 1 типа (синдром Гурлера ) обусловлен недостаточностью идуронидазы. Накапливаются дерматансульфат, гепарансульфат и в повышенных количествах выводятся с мочой Клиническая картина: помутнение роговицы, гепатоспленомегалия, тугоподвижность суставов, дисплазия костей, грубые черты лица, ССЗ, отставание психического развития, смерть в первые 10 лет жизни 15
Слайд 16: Структурные белки соединительной ткани: Коллаген
Коллагены – семейство полиморфных фибриллярных белков (19 типов коллагена), имеющих трехспиральную структуру, сформированную скручиванием 3-х полипептидных α -цепей Идентифицировано более 20 различных α -цепей, каждая из которых кодируется отдельным геном. В разных тканях экспрессируются различные комбинации генов Наиболее распространенные типы коллагенов: I, II, III, IV Коллагены I (кости, роговица, сухожилия), II (хрящи, стекловидное тело), III (почки, печень, сосуды), IV (базальная мембрана) Пример обозначения вида коллагена: [ α 1 ( IV)] 2 α 2 (IV) – коллаген IV типа, состоящий из 2-х альфа-цепей варианта 1 и одной альфа-цепи варианта 2 16
Слайд 17: Коллаген: особенности строения
Пептидная левозакрученная α -спираль коллагена содержит 600 – 3000 АК (в отличие от α -спирали глобулярных белков она более развернута: на одни виток приходится 3 АК) Гли - Про- ГидПро – Гли -Ала- ГидПро - Гли -Лей- ГидПро (в спиральной цепи глицин всегда находится над глицином) Присутствие глицина в каждом триплете обеспечивает плотность укладки 3-х цепей Модифицированные АК: гидроксипролин и гидроксилизин Коллаген – неполноценный белок. Отсутствуют цистеин, триптофан, мало метионина, гистидина и тирозина Из 3-х α -цепей коллагена образуется правозакрученная суперспираль (глицин расположен по центральной оси, что способствует образованию линейной молекулы тропоколлагена и включению ее в волокно) 17
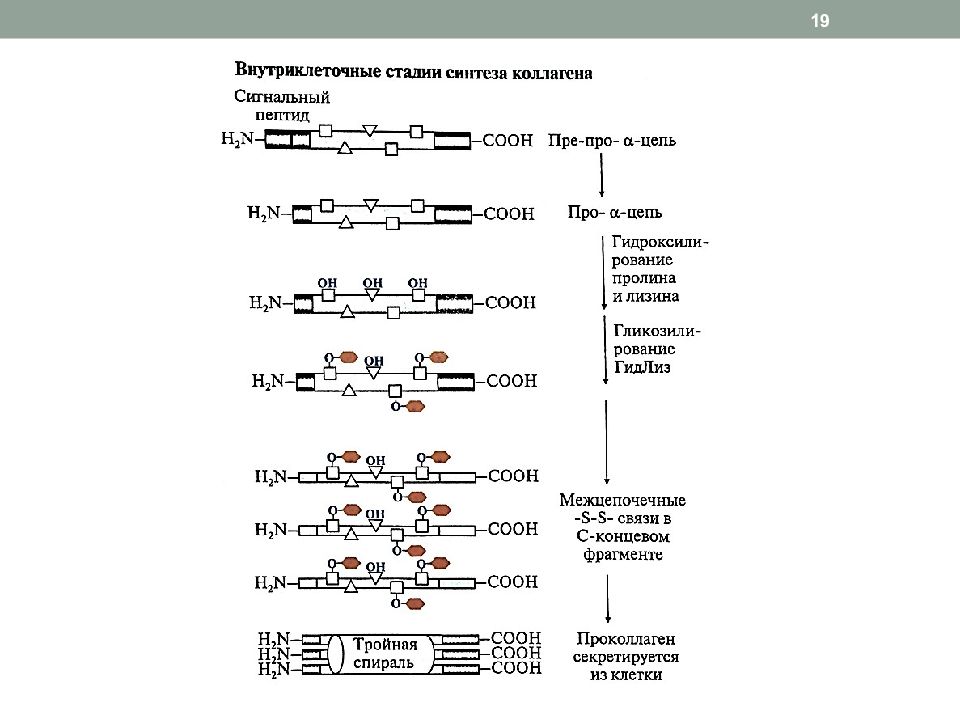
Слайд 18: Синтез и созревание коллагена
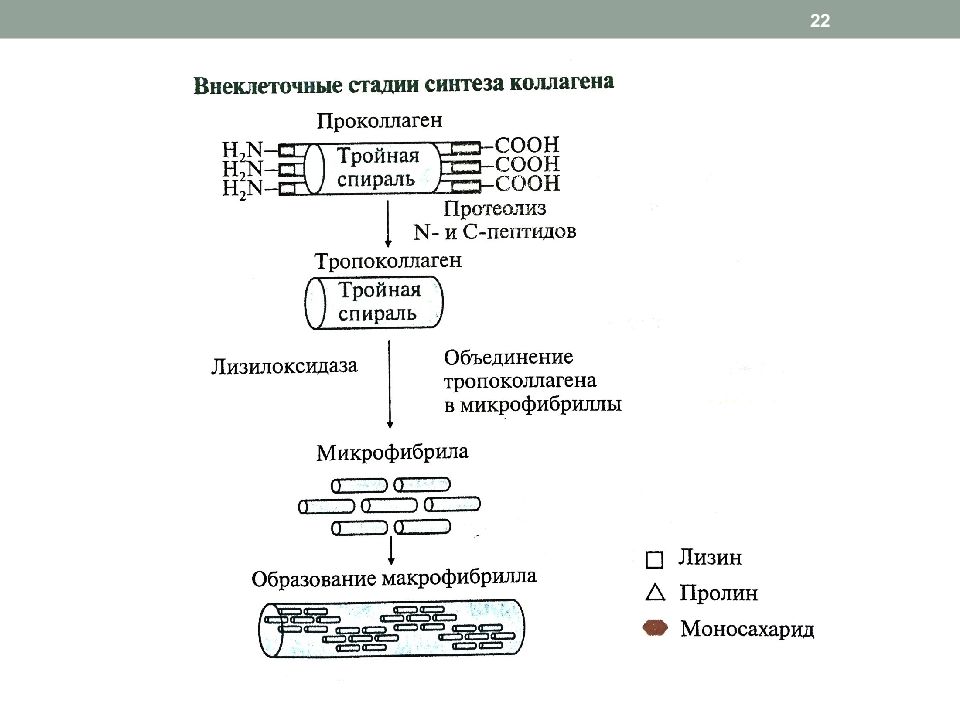
1. Внутриклеточный этап (фибробласты, хондробласты, остеобласты): образование пре-про- α -цепи, содержащей сигнальный пептид, облегчающий перемещение белка в ЭР образование про - α -цепи гидроксилирование пролина и лизина гликозилирование ГидЛиз образование дисульфидных связей в области N - и C -концевых пептидов (внутри- и межцепочечных) для формирования тройной спирали образование проколлагена из 3-х про- α -цепей 2. Внеклеточный этап частичный протеолиз N - и C -концевых неспирализованных пептидов, образование тропоколлагена дезаминирование лизина и гидроксилизина образование фибрилл коллагена 18
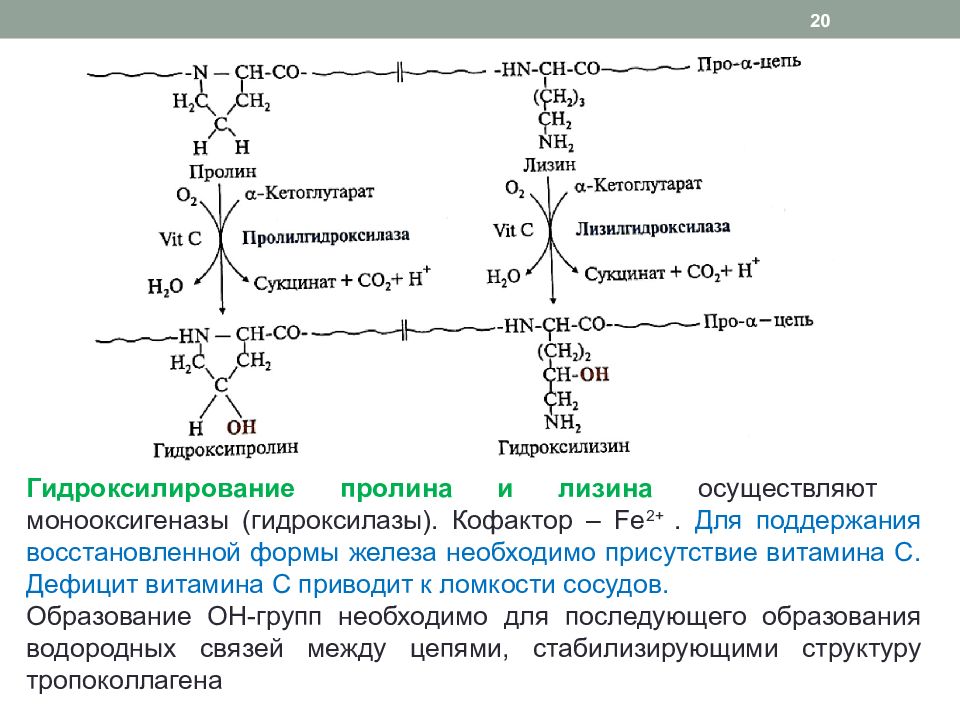
Слайд 20
Гидроксилирование пролина и лизина осуществляют монооксигеназы ( гидроксилазы ). Кофактор – Fe 2+. Для поддержания восстановленной формы железа необходимо присутствие витамина С. Дефицит витамина С приводит к ломкости сосудов. Образование ОН-групп необходимо для последующего образования водородных связей между цепями, стабилизирующими структуру тропоколлагена 20
Слайд 21
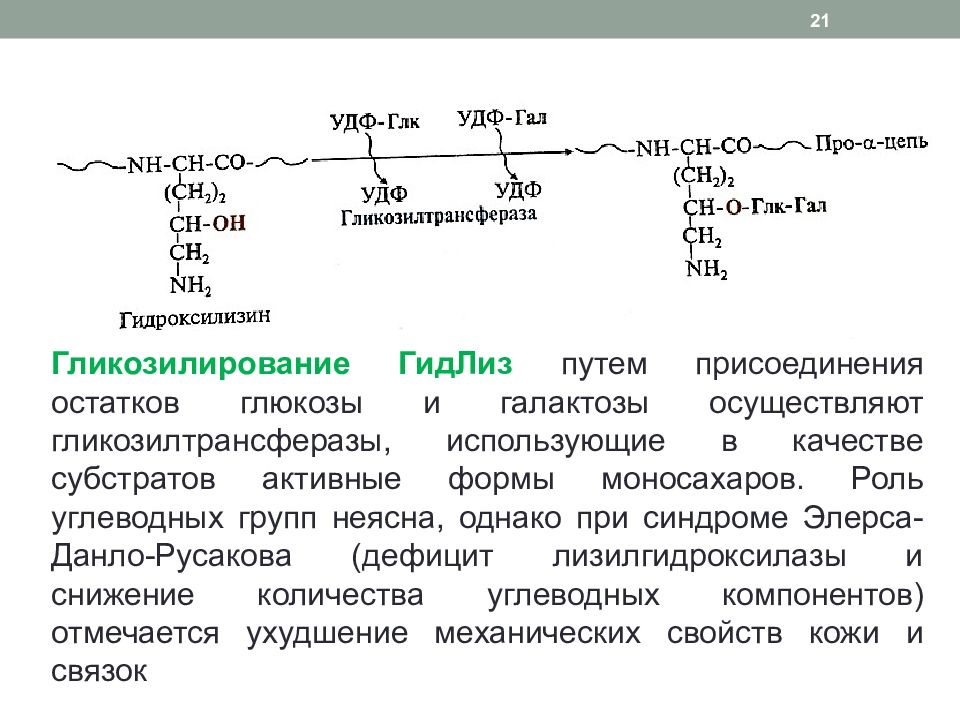
Гликозилирование ГидЛиз путем присоединения остатков глюкозы и галактозы осуществляют гликозилтрансферазы, использующие в качестве субстратов активные формы моносахаров. Роль углеводных групп неясна, однако при синдроме Элерса-Данло-Русакова (дефицит лизилгидроксилазы и снижение количества углеводных компонентов) отмечается ухудшение механических свойств кожи и связок 21
Слайд 23
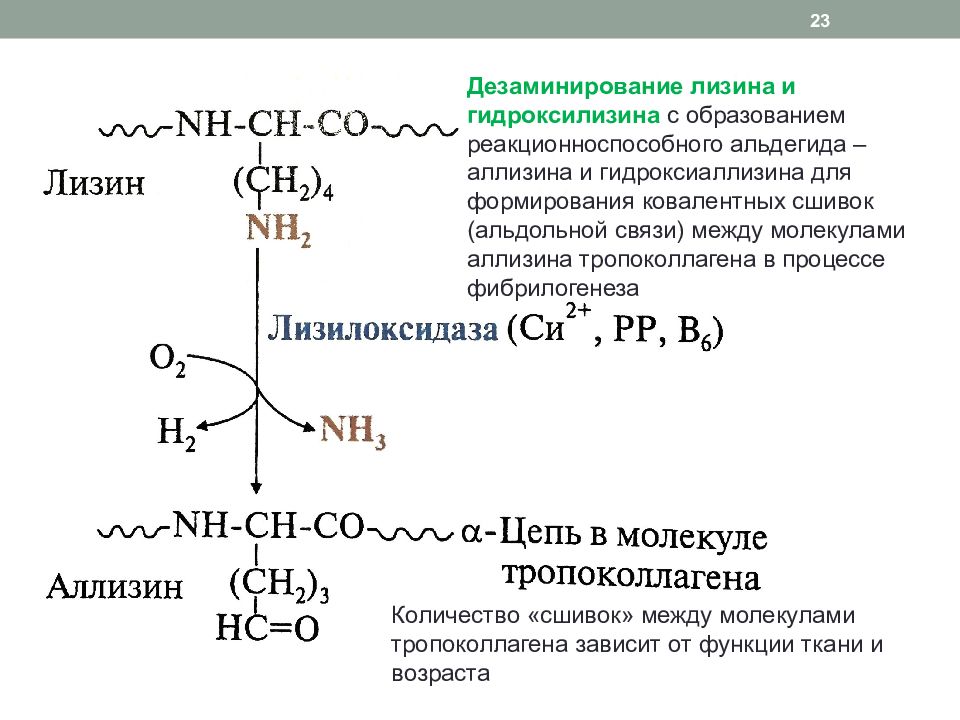
Дезаминирование лизина и гидроксилизина с образованием реакционноспособного альдегида – аллизина и гидроксиаллизина для формирования ковалентных сшивок ( альдольной связи) между молекулами аллизина тропоколлагена в процессе фибрилогенеза 23 Количество «сшивок» между молекулами тропоколлагена зависит от функции ткани и возраста
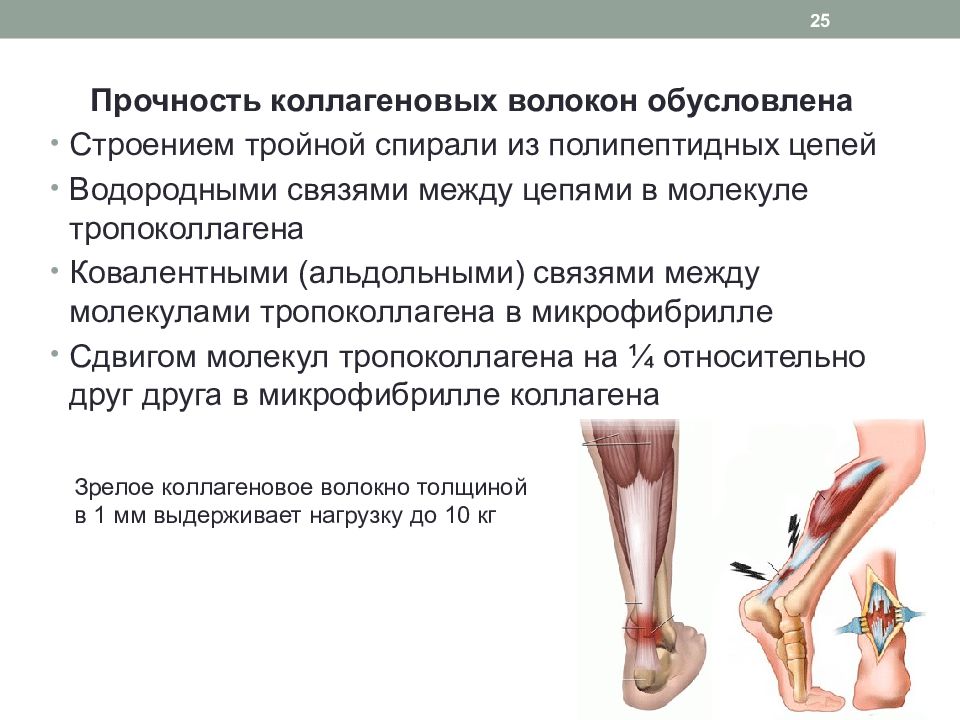
Слайд 25
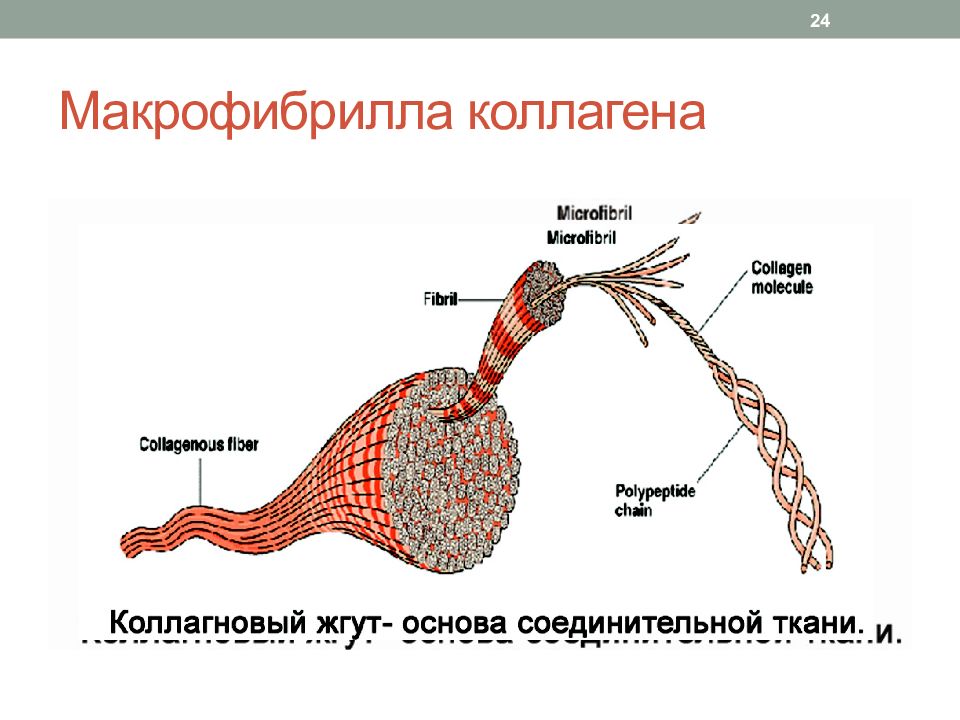
Прочность коллагеновых волокон обусловлена Строением тройной спирали из полипептидных цепей Водородными связями между цепями в молекуле тропоколлагена Ковалентными ( альдольными ) связями между молекулами тропоколлагена в микрофибрилле Сдвигом молекул тропоколлагена на ¼ относительно друг друга в микрофибрилле коллагена 25 Зрелое коллагеновое волокно толщиной в 1 мм выдерживает нагрузку до 10 кг
Слайд 26: Катаболизм коллагена
Коллаген – медленно обменивающийся белок (время полужизни – недели, месяцы). Обмен более активен у молодых людей до 20 лет. Синтез коллагена увеличивается, например, при заживлении ран. О скорости обмена коллагена судят по содержанию гидроксипролина в крови и моче (норма15-50 мг/ сут у взрослых после 20 лет). Протеолиз осуществляет коллагеназа – Са 2+, Zn 2+ -зависимая матриксная металлопротеиназа (ММР-1) – расщепляет молекулу на 2 фрагмента (1/4 и ¾). Дальнейший протеолиз осуществляют лизосомальные протеазы. Коллагеназа – индуцируемый фермент (синтез в фибробластах и макрофагах под влиянием цитокинов, эстрогенов и др.), механизм активации – частичный протеолиз. Небольшое количество ММР присутствует в матриксе в неактивной форме, ингибированные специфическим ингибитором TIMP Изменение активности ММР играет важную роль в патогенез ряда заболеваний (деструкция хряща при ревматоидном артрите, развитие сердечно-сосудистых патологий и др.). Например, снижение активности ММР при сахарном диабете наряду с гликозилированием коллагена способствует развитию микро- и макроангиопатий 26
Слайд 27: Регуляция обмена коллагена
Аскорбиновая кислота стимулирует синтеза коллагена, протеогликанов и пролиферацию фибробластов Половые гормоны регулируют синтез коллагена Коллаген и N -концевые пептиды после отщепления тормозят трансляцию коллагена (отрицательная обратная связь) Кортизол снижает экспрессию генов коллагена, ингибирует активность пролил- и лизилгидроксилазы 27
Слайд 28: Метаболизм коллагена
При старении увеличивается количество поперечных сшивок между молекулами тропоколлагена, затрудняющих действие коллагеназы уменьшается соотношение гликозамингликаны / коллаген уменьшается количество связанной воды увеличивается сухость кожи изменяются свойства хряща и сухожилий снижается прозрачность роговицы глаза «Человек стар в той степени, в какой постарела его соединительная ткань» (Слуцкий Л.И., 1969) 28
Слайд 29: Метаболизм коллагена
При патологии Нарушение катаболизма приводит к фиброзу органов Усиление распада происходит при аутоиммунных заболеваниях Нарушение синтеза. Основная причина – мутации в генах коллагена (гены очень большие, что увеличивает вероятность мутаций). Примеры таких патологий (известно более 250 синдромов): несовершенный остеогенез (повышенная ломкость костей, аномалии зубов, гиперподвижность суставов) хондродисплазии синдром Стиклера и Вагнера – нарушение синтеза коллагена в стекловидном теле с отслойкой сетчатки семейная аневризма аорты прогрессирующая миопия 29
Слайд 30: Структурные белки соединительной ткани: Эластин
Основной компонент волокон тканей, обладающих значительной эластичностью (сосуды, связки, легкие) 70 кДа, структура кодируется 1 геном 800 АК: глицин, валин, аланин, пролин (70%), ГидПро мало, отсутствуют ГидЛиз, цис, мет, три Нет строго определенной конформации Этапы синтеза эластина : образование мономерной формы – тропоэластина гидроксилирование пролина образование аллизина ( лизилоксидазная реакция) взаимодействие аллизина разных цепей тропоэластина с образованием десмозина ( пиридинолина ), который связывает между собой 2, 3, 4 молекулы эластина Наличие поперечных сшивок (структура десмозина ) и гибкой случайной конформации – основа « резиноподобных » свойств эластина 30
Слайд 31: Эластин
Время полураспада – 75 лет Протеолиз под действием эластазы (нейтрофилы) Нарушения образования эластина (в частности десмозина ) проявляются патологиями сердца, легких, сосудов (дефект сердечных клапанов, аневризмы аорты, варикоз, эмфизема легких) 31
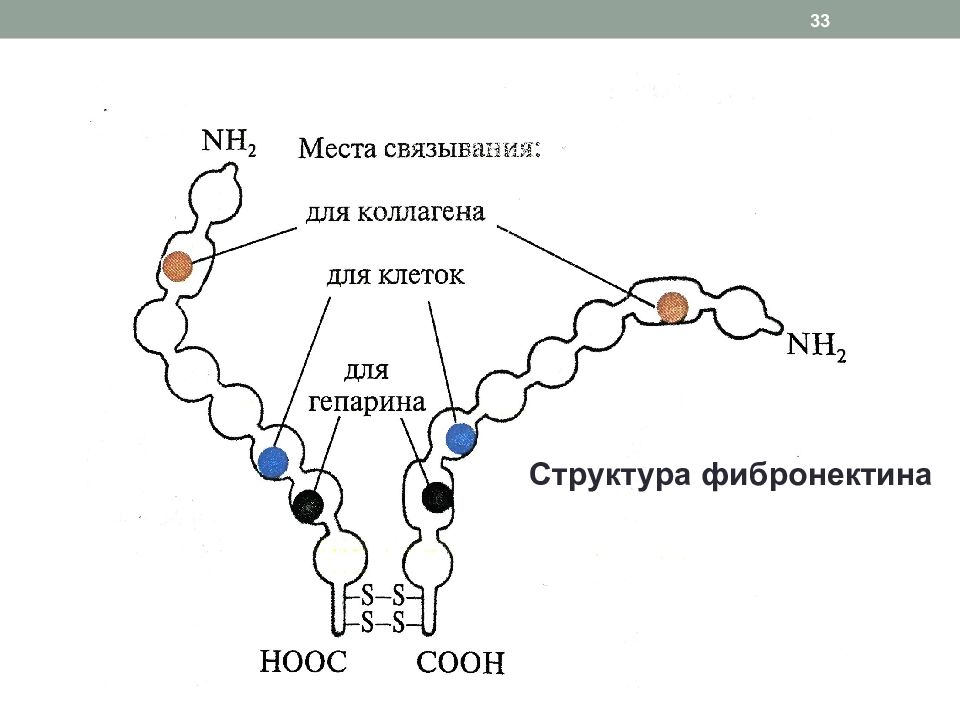
Слайд 32: Адгезивные белки соединительной ткани: фибронектин
Димер (2 цепи сходны, но не идентичны, соединены дисульфидными мостиками), г ликопротеин, 2500 АК, 1 ген Альтернативный сплайсинг является причиной образования различных по структуре и функциональной активности молекул фибронектина в разных клетках Имеет домены для связывания с клетками, с биомолекулами соединительной ткани, обеспечивая их ориентацию, интеграцию, адгезию клеток Взаимодействие с биомолекулами происходит за счет ковалентной связи между остатками лизина и глутамина под действием трансглутаминазы, которая также связана с фибронектином в одном из его доменов В опухолевой ткани снижено количество фибронектина, что является одной из причин метастазирования 32
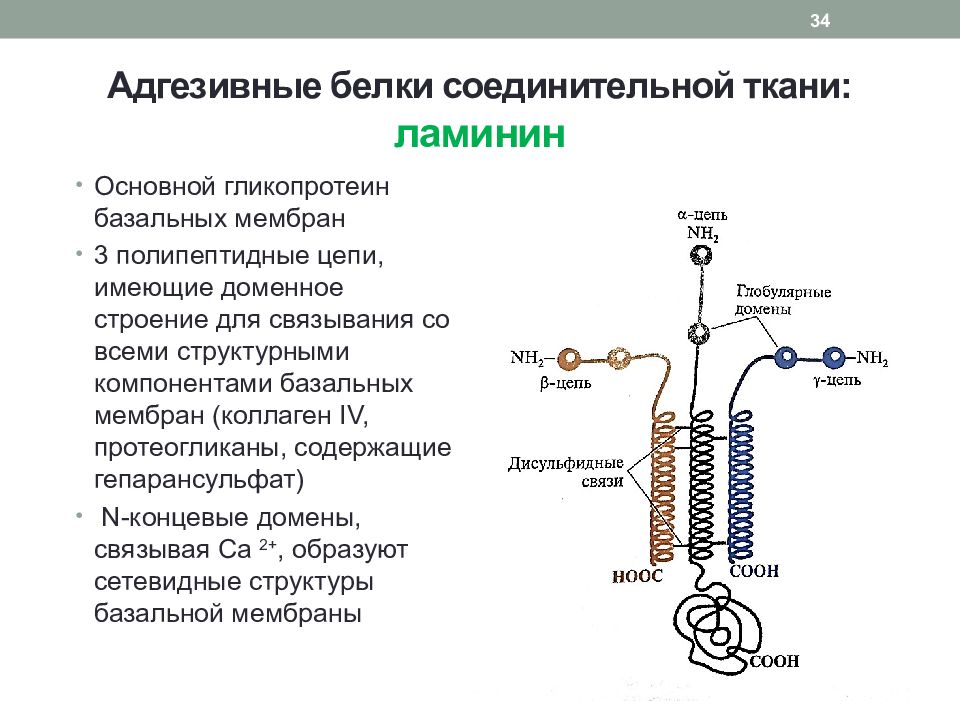
Слайд 34: Адгезивные белки соединительной ткани: ламинин
Основной гликопротеин базальных мембран 3 полипептидные цепи, имеющие доменное строение для связывания со всеми структурными компонентами базальных мембран (коллаген IV, протеогликаны, содержащие гепарансульфат ) N -концевые домены, связывая Са 2+, образуют сетевидные структуры базальной мембраны 34
Слайд 35: Адгезивные белки соединительной ткани: нидоген
Сульфатированный гликопротеин базальных мембран Одна полипептидная цепь Три глобулярных домена: центр связывания ламинина центр связывания коллагена IV типа центр связывания гепарансульфата 35
Слайд 36: Минерализованная соединительная ткань
Ремоделирование костной ткани Маркеры метаболизма костной ткани 36
Слайд 37: Кость – минерализованная соединительная ткань
Функции: размер и форма тела, защита внутренних органов, минеральный гомеостаз, кроветворение Основные клетки остеобласты (синтезируют органический компонент) остеоциты (участвуют в ремоделировании кости) остеокласты (секретируют ферменты, разрушающие органический компонент костного матрикса при ремоделировании ) Твердый (минерализованный) межклеточный матрикс неорганический компонент (65%): гидроксиапатиты кальция Са 10 (РО 4 ) 6 (ОН) 2 органические соединения: коллаген I типа, неколлагеновые белки, гликозамингликаны, протеогликаны, фосфолипиды, цитрат – матрица для формирования гидроксиапатитов 37
Слайд 38: Костный обмен
Костный обмен ( ремоделирование ) включает: резорбцию (разрушение) костной ткани костеобразование (обновление, реорганизация органической матрицы и ее минерализация) Ремоделирование костной ткани ускоряется при изменении физической нагрузки на ткань (снижение массы тела при похудании), при локальных воспалительных процессах (ревматоидный артрит), гормональных изменениях (дефицит эстрогенов, гиперпаратиреоз ) 38
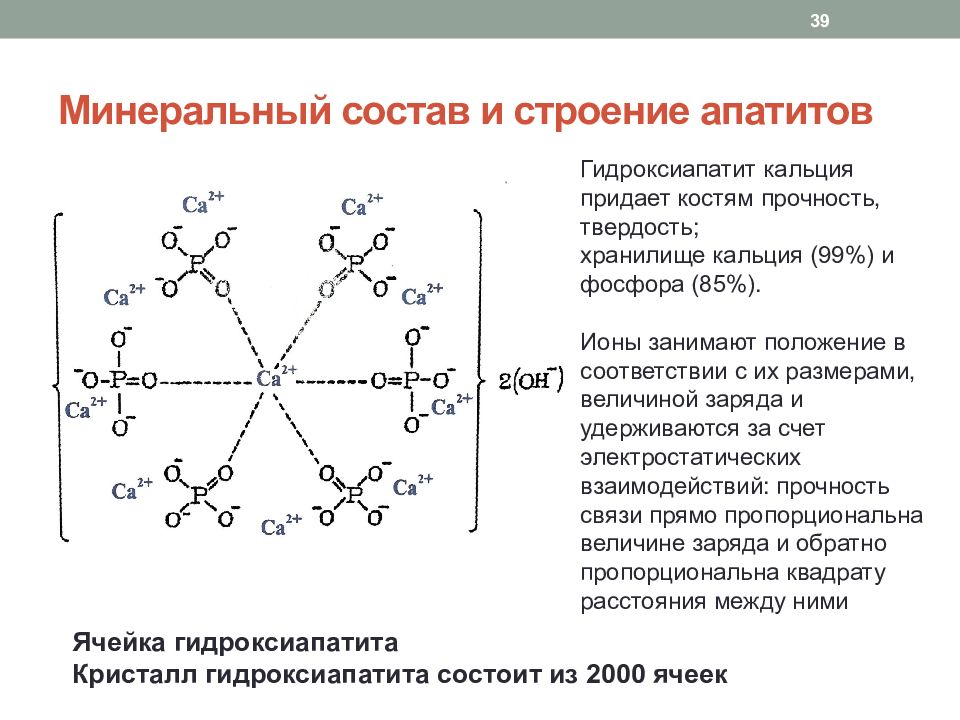
Слайд 39: Минеральный состав и строение апатитов
Ячейка гидроксиапатита Кристалл гидроксиапатита состоит из 2000 ячеек 39 Гидроксиапатит кальция придает костям прочность, твердость; хранилище кальция (99%) и фосфора (85%). Ионы занимают положение в соответствии с их размерами, величиной заряда и удерживаются за счет электростатических взаимодействий: прочность связи прямо пропорциональна величине заряда и обратно пропорциональна квадрату расстояния между ними
Слайд 40: Строение апатитов
Оптимальное расстояние между ионами Са 2+ и РО 4 3- задается органической матрицей. Изменение строения компонента матрицы приводит к нарушению минерализации или образованию кристаллов неправильной структуры, снижению прочности кости Апатиты легко обмениваются ионами с молекулами окружающей среды (изоморфные замещения), изменяется коэффициент Са /Р (в норме 1,33 – 2,0). Примеры изоморфных замещений: при недостатке кальция в пище его место занимает стронций (стронциевый апатит хрупкий) при ацидозе (сахарный диабет, голодание) Са 2 + замещается Н + (кристаллы разрушаются) 40
Слайд 41: Органические вещества кости: коллаген
Особенности строения коллагена I типа ( остеоколлагена ): Больше гидроксипролина, но меньше гидроксилизина Менее гликозилирован, при гликозилировании присоединяется галактоза (а не галактоза-глюкоза) Содержит меньше межцепочечных ковалентных связей ( альдольных сшивок) Содержит фосфорилированные остатки серина (для связывания кальция) Имеет специфические структуры – пиридинолин ( десмозин ) и дезоксипиридинолин ( изодесмозин ) ( см. структуру эластина ). Определение уровня данных структур в моче используется в диагностике остеопороза 41
Слайд 42: Органические вещества кости: неколлагеновые белки
Большинство неколлагеновых белков – гликопротеины или гликофосфопротеины ; присутствуют и в других тканях (например, эпителиальной) Остеонектин - связывает кальций, коллаген, гидроксиапатиты, формирует центры кристаллизации и инициирует процесс минерализации Остеокальцин (содержит карбоксиглутаминовую кислоту, образованную при участии витамина К) – участвует в Са 2+ -зависимом взаимодействии с фосфолипидами мембран клеток, активирует остеокласты, уменьшает связывание кальция с остеонектином, замедляет образование центров кристализации ; экспрессия гена регулируется кальцитриолом ; концентрация в крови отражает активность остеобластов Gla ( γ - глу )- протеин – активирует остеокласты 42
Слайд 43: Органические вещества кости: неколлагеновые белки
Неколлагеновые белки, содержащие RGD -последовательность: - Арг-Глу-Асп - ( комплементарна рецепторам остеокластов): Сиалопротеин, остеопонтин – стимулируют прикрепление остеокластов к кости; экспрессию гена остеопонтина регулирует кальцитриол Активированные остеокласты секретируют кислую фосфатазу, которая дефосфорилирует сиалопротеин и остеопонтин, вызывая потерю сродства к рецепторам остеокластов; происходит снижение активности остеокласта Тромбоспондин – адгезивный белок 43
Слайд 44: Другие органические вещества кости
Факторы роста и дифференцировки ( IGF-1, TGF- β, PDGF) Протеогликаны (ГАГ: хондроитин -, дерматан -, кератансульфаты ) – в гидратированном состоянии занимают большое по объему пространство в межклеточном матриксе, которое в дальнейшем должно стать костью; связывают кальций и являются его источником в процессе минерализации Липиды : фосфатидилсерин играет ведущую роль в связывании кальция на начальных этапах минерализации, обеспечении кальцием растущих кристаллов гидроксиапатитов, образовании их связи с белками Цитрат (активность цитратсинтазы высокая) – участвует в обмене кальция, образуя нерастворимые и растворимые соли Например, воздействие паратгормона на остеобласты способствует активации остеокластов, снижению рН, разрушению кости, приводит к увеличению содержания цитрата, образованию его солей с кальцием и повышению кальция в крови Ферменты : кислая фосфатаза (замедляет скорость резорбции, см. слайд 43) и щелочная фосфатаза (ЩФ) ( см. слайд 46 ) 44
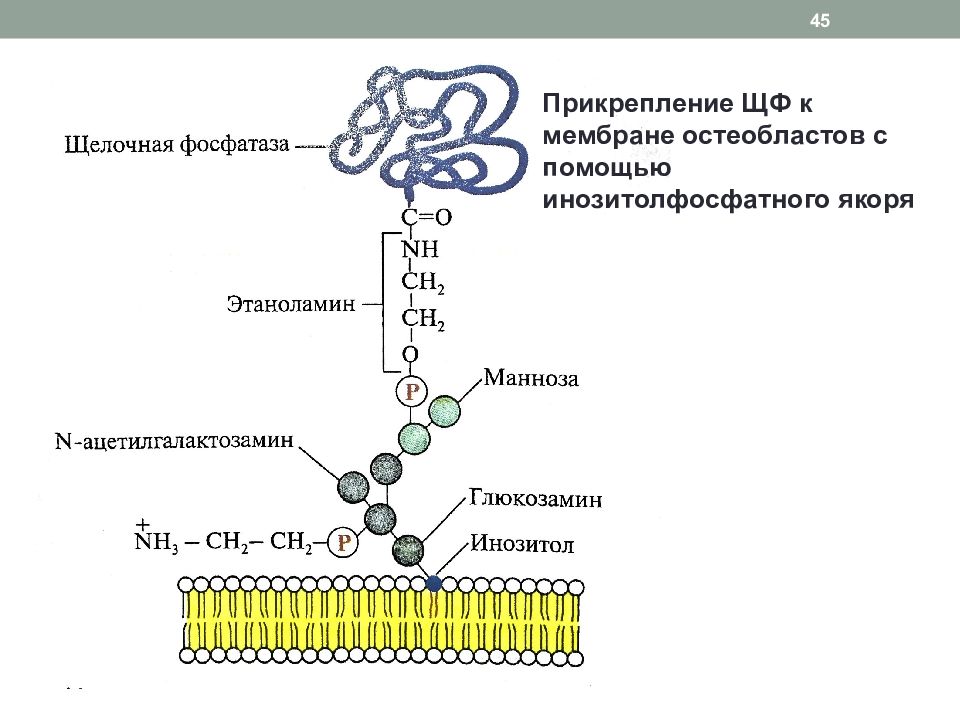
Слайд 45
45 Прикрепление ЩФ к мембране остеобластов с помощью инозитолфосфатного якоря
Слайд 46: Роль щелочной фосфатазы в костной ткани
Проявляет активность на стадии минерализации (рН 9,6) Катализирует реакцию дефосфорилирования фосфорорганических соединений матрикса кости Повышая концентрацию РО 4 3-, способствует образованию центров кристаллизации и формированию гидроксиапатитов Может переносить фосфатные остатки на органические соединения ( трансферазная активность), что приводит к изменению активности фосфопротеинов, участвующих в регуляции минерализации Отделившись от мембраны под действием фосфолипазы С, может высвобождаться в кровоток (активность ЩФ высокая у детей в период роста) 46
Слайд 47: Ремоделирование костной ткани
Каждые 10 лет костная ткань заменяется новой (ежегодно обновляется 5-10% скелета) Интенсивность обмена определяется соотношением скоростей резорбции и костеобразования: до 18 лет образование новой костной ткани идет быстрее, чем резорбция 18 – 40 лет – равновесие процессов после 40 лет скорость костеобразования снижается по сравнению с резорбцией, развивается остеопороз Ремоделирование = Резорбция (2-3 нед ) + костеобразование (2-3 мес ) 47
Слайд 48: Этапы цикла ремоделирования костной ткани
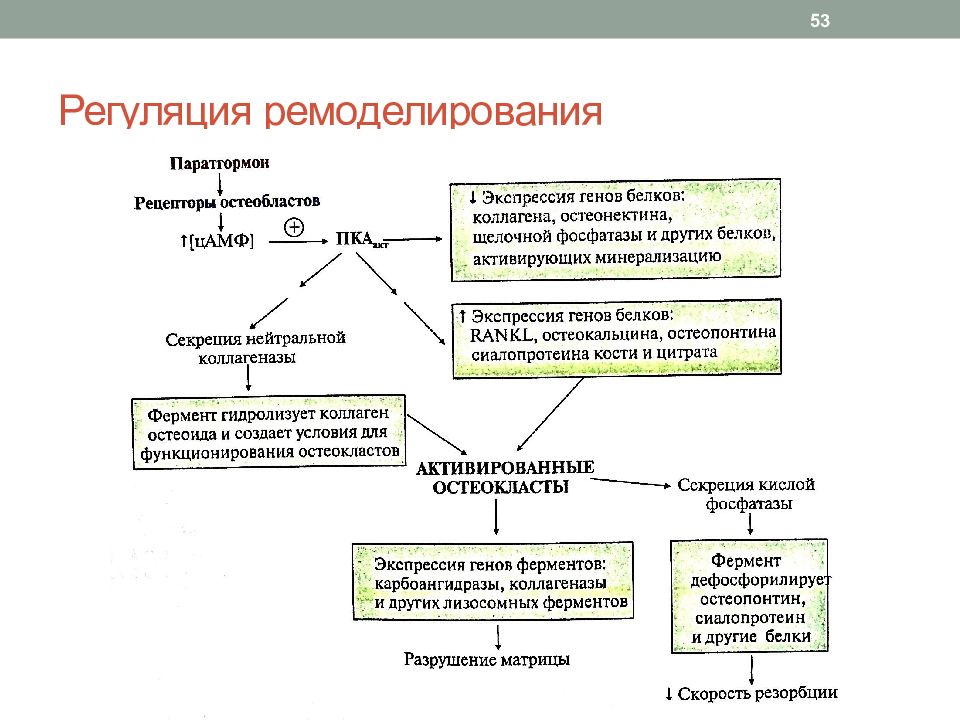
1. Активация: остеобласты под влиянием стимулирующих факторов секретируют фактор RANKL ( receptor activator of nuclear factor KB ligand ), стимулирующий образование колоний моноцитов, формирующих остеокласты коллагеназу, которая гидролизует коллаген остеоида (для связывания остеокласта с костью) остеокальцин, сиалопротеин, остеопонтин, Gla -протеин, которые участвуют в прикреплении остеокласта к кости 48
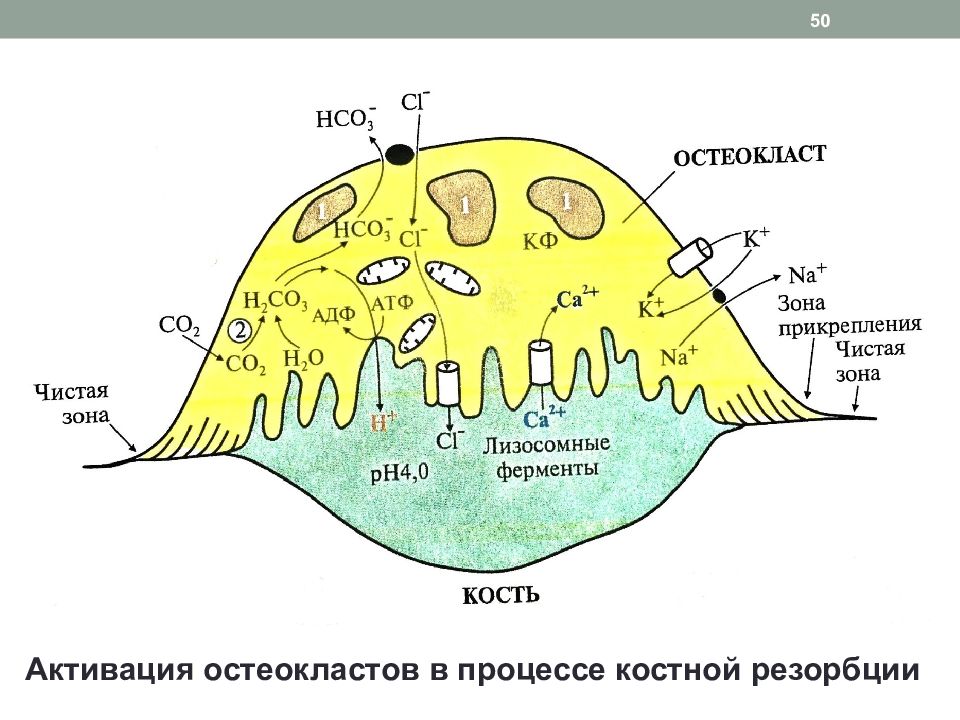
Слайд 49: Этапы цикла ремоделирования костной ткани
2. Резорбция: «работа» остеокластов Прикрепление остеокласта к кости Карбоангидразная реакция и диссоциация угольной кислоты с образованием Н + Перекачивание протонов из остеокласта в зону резорбции при помощи Н + -АТФ-азы, Н +,К + - АТФ-азы, переносчиков С l - / Н + и образование «щеточной» каемки (рН 3,5 – 4) Секреция лизосомальных ферментов – гидролаз Гидролиз коллагена и разрушение органической матрицы Вымывание кальция из апатитов Образование в кислой среде растворимых солей цитрата кальция и их поступление в кровь 49
Слайд 51: Этапы цикла ремоделирования костной ткани
3. Реверсия Действие локальных ростовых факторов на остеобласты приводит к синтезу белков матрикса, секреции остеопротегерина, который связывает RANKL и снижает активность остеокластов Секреция кислой фосфатазы остеокластами приводит к дефосфорилированию остеопонтина, сиалопротеина (белки-активаторы остеокластов), снижению активности остеокластов и к переходу к следующей стадии ремоделирования – костеобразованию 4. Костеобразование (минерализация): усиление оксигенации, синтез белков, протеогликанов, фосфорилирование белков матрикса (условие для формирования центров кристаллизации), формирование центров кристаллизации, рост кристаллов. По завершении процесса остеобласты теряют активность и превращаются в остеоциты. 51
Слайд 52: Регуляция ремоделирования
Паракринно-аутокринная (местная) регуляция: цитокины, фаторы роста, простагландины костной ткани Системная регуляция Основные регуляторы: Паратгормон Кальцитриол Кальцитонин Половые гормоны 52
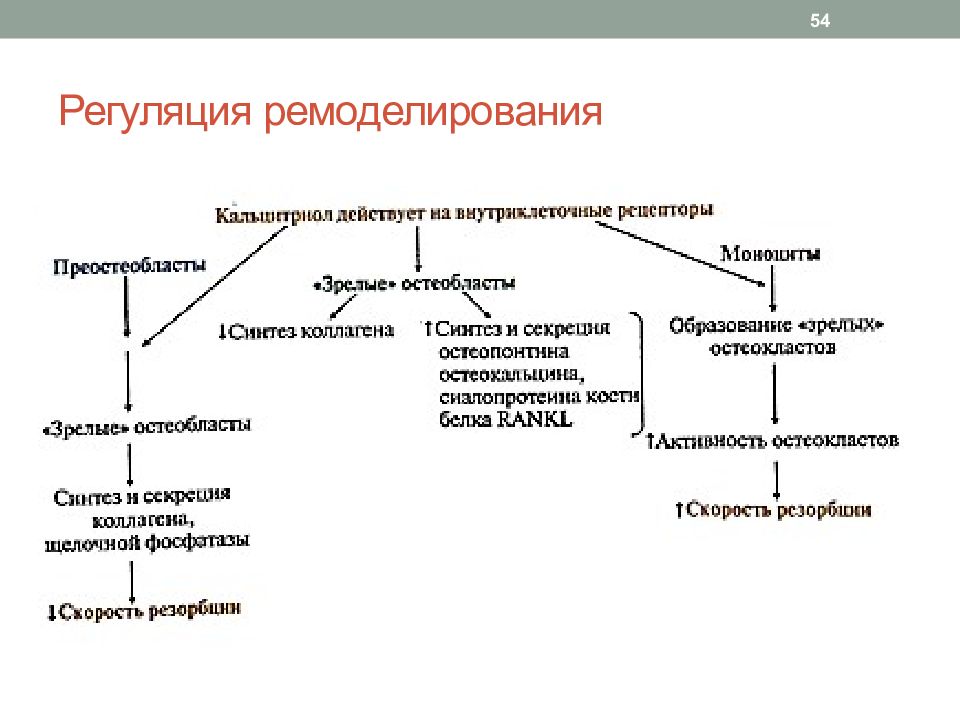
Слайд 55: Регуляция ремоделирования
55 ПК А фосфорилирует белок-переносчик Са2+, что приводит к поступлению Са2+ в цитозоль остеокласта из зоны резорбции; это вызывает деполяризацию мембраны и инактивацию остеокласта Кальцитонин оказывает большее влияние на растущие кости, поэтому образование костной ткани у детей и подростков происходит быстрее
Слайд 56: Регуляция ремоделирования
Кортизол замедляет костеобразование: подавляет пролиферацию остеобластов, синтез остеоколлагена, остеонектина, протеогликанов Кортизол стимулирует костную резорбцию: индуцирует синтез рецепторов к паратгормону Андрогены стимулируют в остеобластах синтез фактора, ингибирующего дифференцировку преостеокластов (наступление половой зрелости тормозит рост скелета в длину). Анаболический эффект гормонов наиболее активно проявляется в присутствии гормона роста Гормоны щитовидной железы. При гипертиреозе увеличивается скорость обмена кости, повышается экскреция кальция с мочой, костеобразование начинает отставать от резорбции. При гипотиреозе замедляется образование и минерализация кости 56
Слайд 57: Регуляция ремоделирования
Гормон роста повышает активность остеобластов, которые стимулируют остеокласты, поэтому происходит очаговая деминерализация, затем увеличение объема органической основы кости и ее минерализация Инсулин активирует метаболизм остеобластов, стимулирует синтез костного матрикса, обеспечивает минерализацию костной ткани. 57
Слайд 58: Регуляция ремоделирования
58 В остеобластах эстрогены стимулируют синтез остеоколлагена, остеонектина, ЩФ. Вызывают раннюю минерализацию, поэтому в период полового созревания происходит остановка роста скелета Эстрогены стимулируют синтез 1- α - гидроксилазы в почках (синтез кальцитриола ) и рецепторов к кальцитриолу в энтероцитах
Слайд 59: Маркеры метаболизма костной ткани
Для большинства патологических состояний характерно ускорение ремоделирования кости с усилением процесса резорбции Маркеры резорбции костной ткани: пиридинолин, дезоксипиридинолин (продукты деградации остеоколлагена ) остеопротегерин (остеокласт-ингибирующий фактор) / RANKL (стимулятор образования остеокластов) Маркеры формирования костной ткани: остеокальцин (активатор остеокластов) – снижение содержания – усиление минерализации щелочная фосфатаза специфические пептиды проколлагена I типа 59
Слайд 60: Заключение
Функции соединительной ткани обусловлены особенностями ее строения и метаболизма Нарушения метаболизма соединительной ткани лежат в основе патогенеза ряда заболеваний, таких как мукополисахаридозы ( лизосомные болезни, или болезни накопления вследствие снижения активности ферментов катаболизма гликозамингликанов ), латиризм (деформация позвоночника вследствие дестабилизации коллагеновых фибрилл в результате снижения активности лизилоксидазы ), патологии костной ткани, связанные с изоморфными замещениями, рахит, остеопетроз (дисфункция остеокластов вследствие недостаточности карбоангидразы), остеопороз. 60
Последний слайд презентации: Лекция 22. Биохимия соединительной ткани: Литература
1. Биохимия: учебник для студентов медицинских ВУЗов / Е. С. Северин -М.: ГЭОТАР-Медиа, 2014. -768 с. ( раздел 15 ) 2. Биологическая химия с упражнениями и задачами: учебник / ред. С. Е. Северин. - М.: ГЭОТАР-Медиа, 2013. - 624 с. (С. 301 – 324) 3. Биологическая химия: учебник для студентов медицинских вузов / А.Я. Николаев. – М.: Мед. информ. агенство, 2007. – 568 с. 61