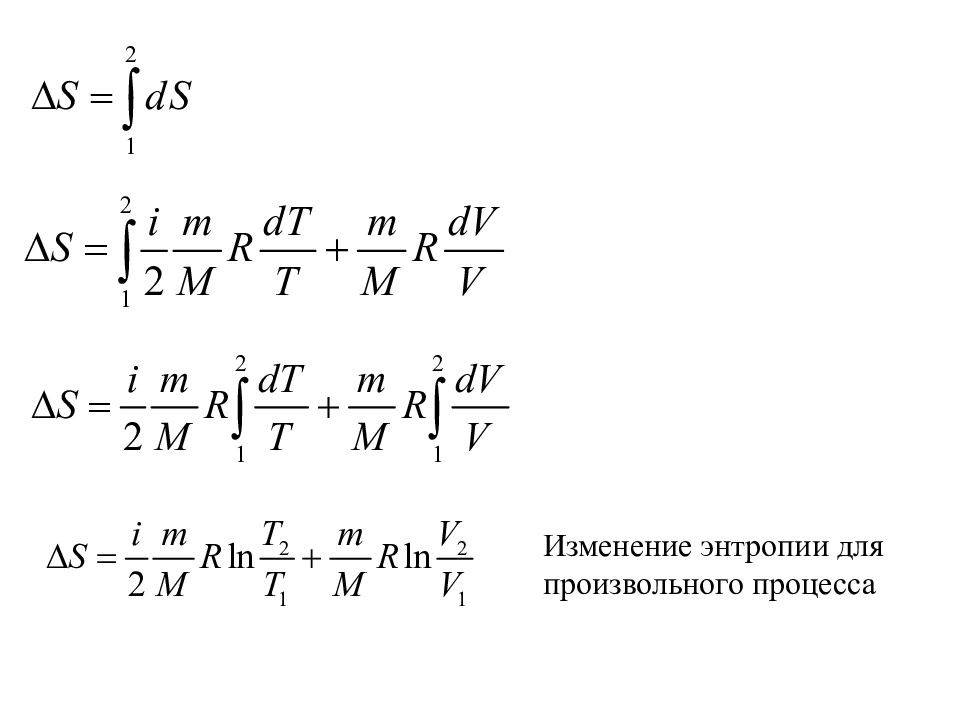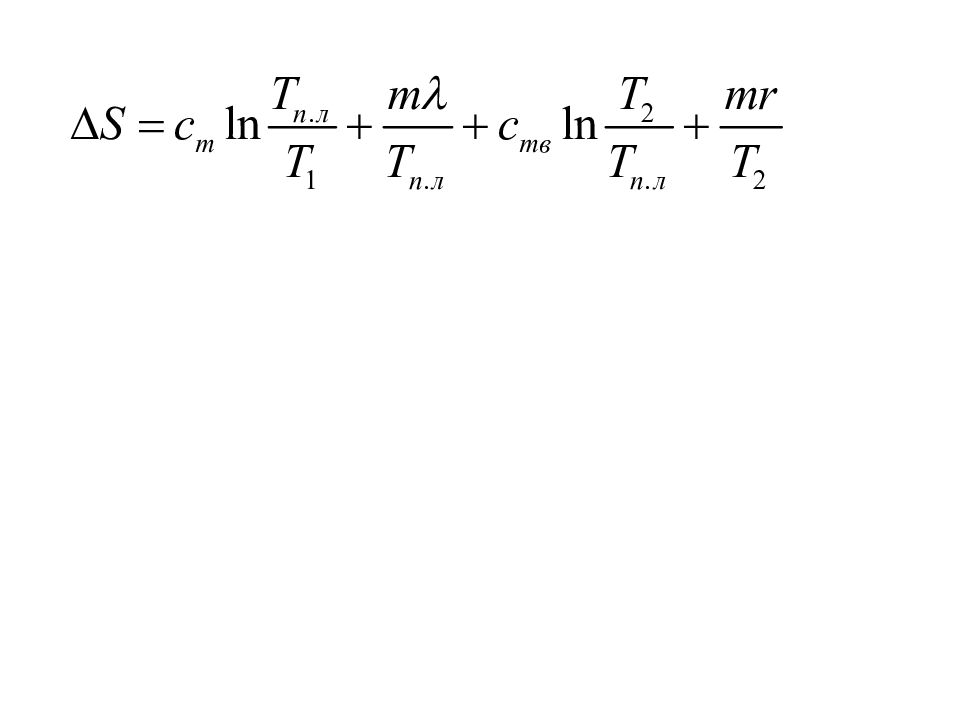Первый слайд презентации: Лекция 3 Три закона термодинамики
Слайд 2
1. Основные положения МКТ 1. Все тела состоят из атомов и молекул. 2. Атомы и молекулы находятся в непрерывном хаотическом движении. 3. Молекулы взаимодействуют с друг другом. На больших расстояниях они притягиваются, на малых – отталкиваются. 2
Слайд 3
2. Определения Масса молекулы M r – относительная молекулярная масса Концентрация частиц это отношение числа частиц к объему: Количество вещества 1 моль содержит 6,0221367·10 23 штук частиц. Число частиц в 1 моле, называется числом Авогадро, N A = 6,0221367·10 23 моль –1. 3
Слайд 4
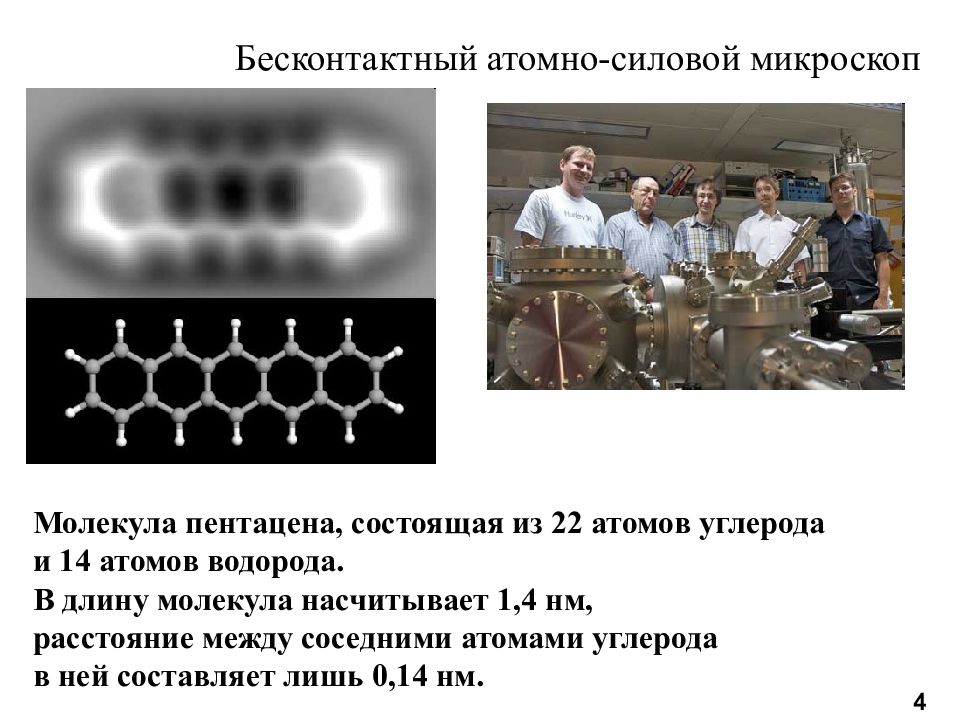
Молекула пентацена, состоящая из 22 атомов углерода и 14 атомов водорода. В длину молекула насчитывает 1,4 нм, расстояние между соседними атомами углерода в ней составляет лишь 0,14 нм. Бесконтактный атомно-силовой микроскоп 4
Слайд 5
5 3. Термодинамические параметры. Объем - область пространства, занимаемая данной системой частиц. Объём V [ V ] = м 3 Давление p 1 атм = 1, 013·10 5 Па, Давление - мера силового действия частиц на поверхность, численно равная силе нормального давления, действующую на единицу поверхности при столкновении частиц с этой поверхностью.
Слайд 6
Температура – физическая величина, характеризующая состояние термодинамического равновесия. Температура Т Температура - мера средней кинетической энергии поступательного движения молекул. 6
Слайд 7
7 4. Уравнения и законы. Парциальное давление – это давление, которое оказывал бы на стенки сосуда отдельный газ смеси, если бы находился в сосуде один. (от англ. part – часть) Давление p смеси газов на стенки сосуда равно сумме парциальных давлений p 1, p 2, p 3,... Закон Дальтона о парциальных давлениях
Слайд 8
8 Уравнение состояния идеального газа - уравнение Менделеева - Клапейрона
Слайд 9
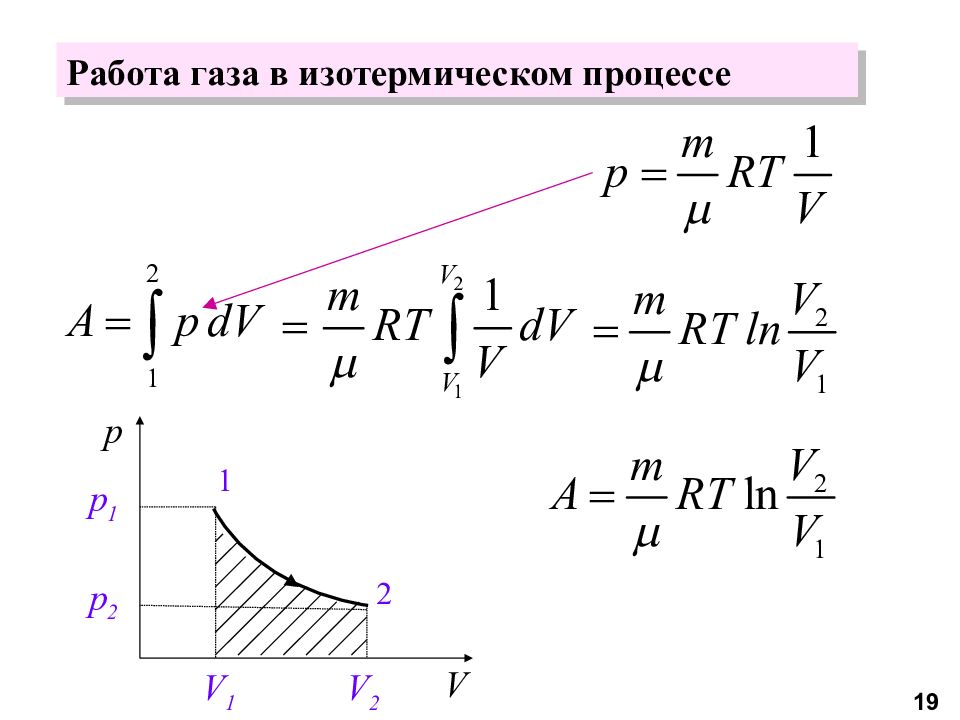
Закон Бойля-Мариотта Процесс, происходящий при постоянной температуре, называется изотермическим, а соответствующая ему кривая – изотермой 9
Слайд 10
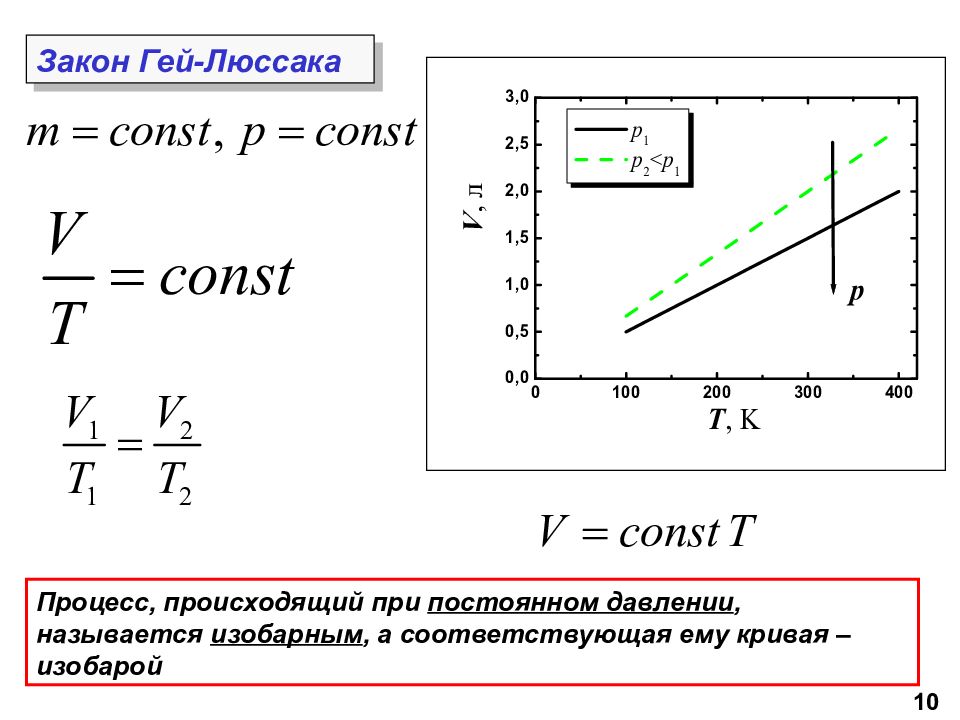
10 Процесс, происходящий при постоянном давлении, называется изобарным, а соответствующая ему кривая – изобарой Закон Гей-Люссака
Слайд 11
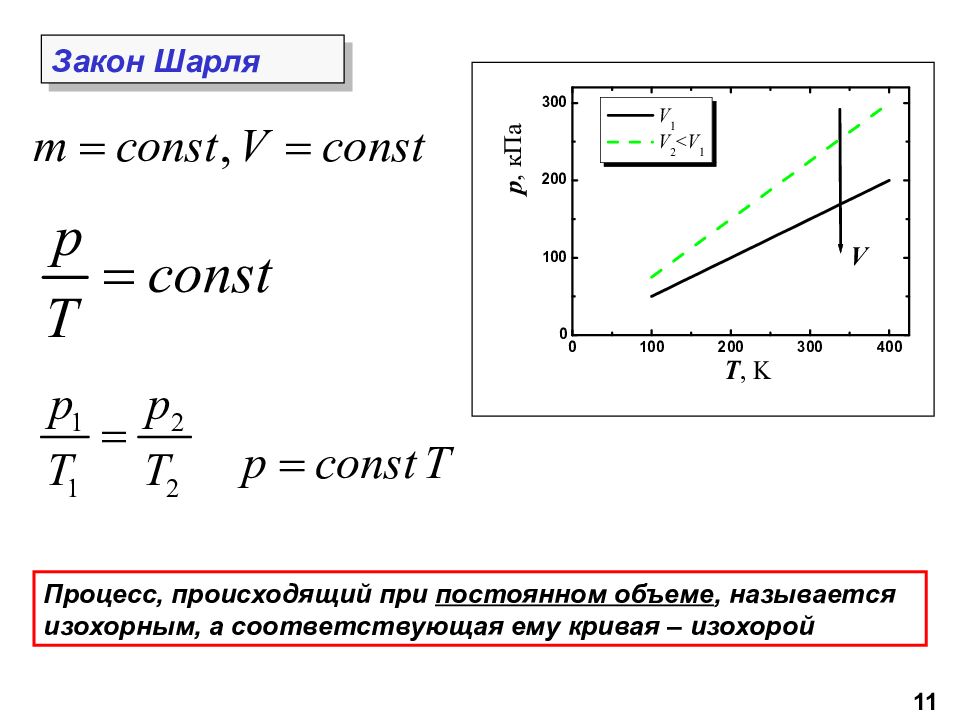
Процесс, происходящий при постоянном объеме, называется изохорным, а соответствующая ему кривая – изохорой Закон Шарля 11
Слайд 12
4. Первый закон термодинамики. Количество теплоты, переданное системе, идет на увеличение ее внутренней энергии и на совершение системой работы над внешними телами. функция состояния ТД системы - функция процесса ТД системы 12
Слайд 13
Внутренняя энергия идеального одноатомного газа равна суммарной кинетической энергии поступательного движения молекул газа Внутренняя энергия газа. Внутренняя энергия тела есть суммарная энергия его молекул С учетом числа степеней свободы: Изменение внутренней энергии определяется только изменением температуры 13
Слайд 14
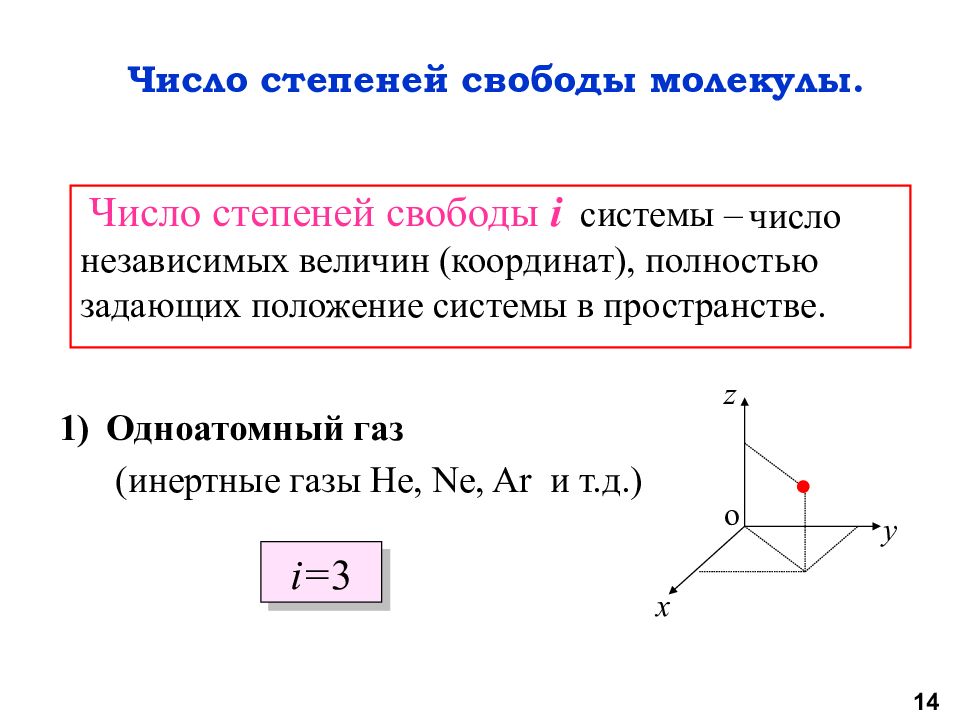
Число степеней свободы i системы – Одноатомный газ (инертные газы He, Ne, Ar и т.д.) x y z o i = 3 число независимых величин (координат), полностью задающих положение системы в пространстве. Число степеней свободы молекулы. 14
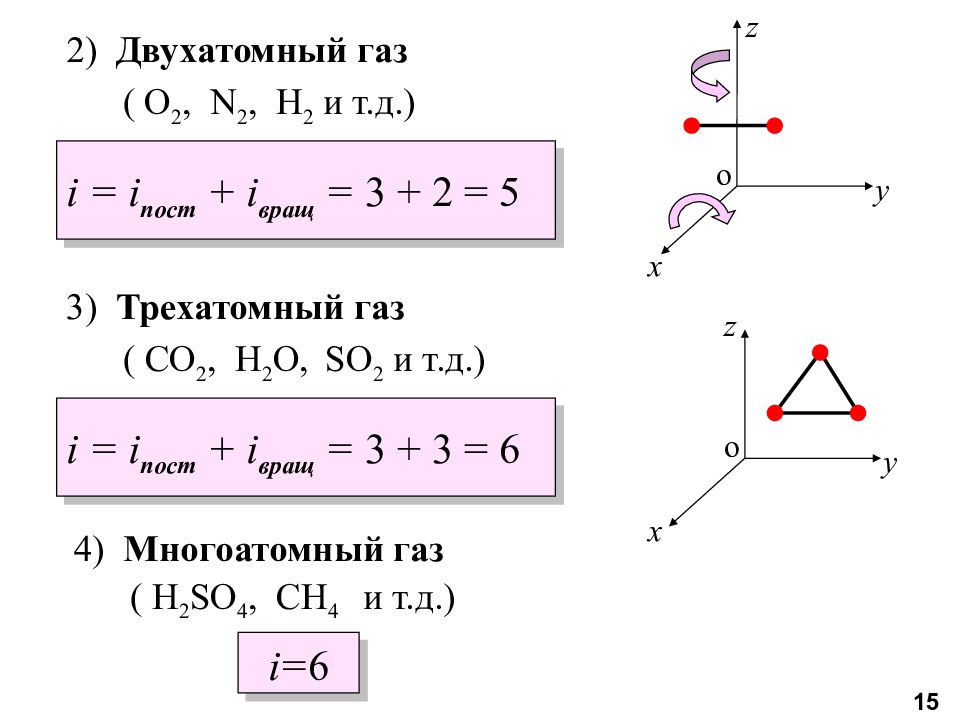
Слайд 15
2) Двухатомный газ ( O 2, N 2, H 2 и т.д.) i = i пост + i вращ = 3 + 2 = 5 3) Трехатомный газ ( CO 2, H 2 O, SO 2 и т.д.) i = i пост + i вращ = 3 + 3 = 6 x y z o 4) Многоатомный газ ( H 2 SO 4, CH 4 и т.д.) i = 6 y z x o 15
Слайд 16
Количество теплоты Количество теплоты -это энергия, которая передается от одного тела к другому при их контакте или другими способами, например, излучением. не является функцией состояния функция процесса 16
Слайд 17
Элементарная работа газа совершается при изменении объема газа и равна произведению давления на приращение объема газа. x S Работа газа 17
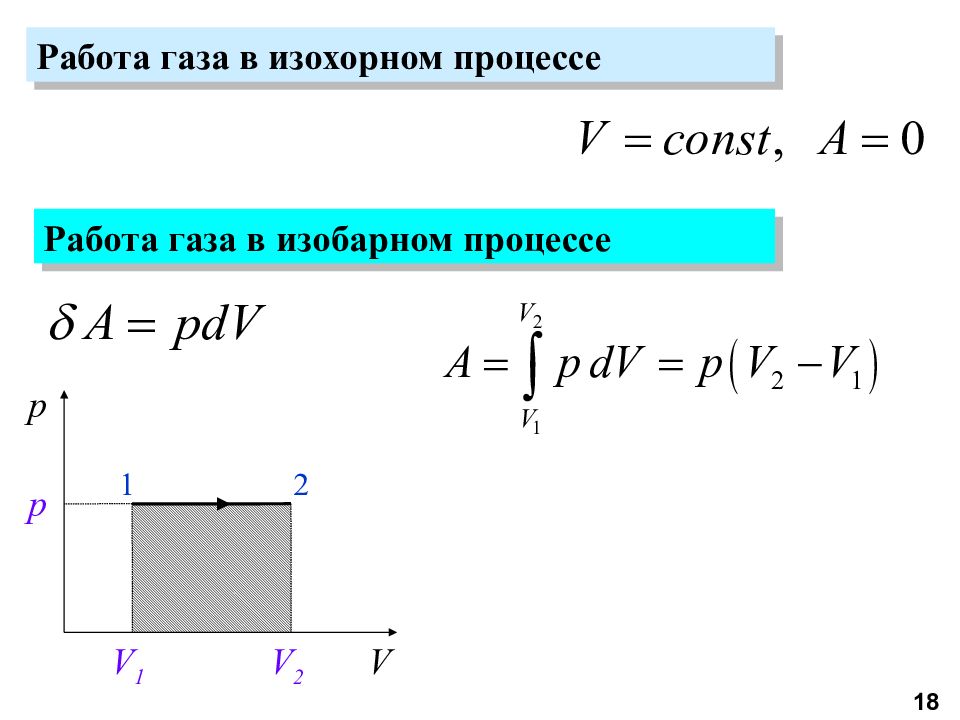
Слайд 18
Работа газа в изохорном процессе Работа газа в изобарном процессе p V 1 p V 2 V 1 2 18
Слайд 20
5. Теплоемкость. Теплоемкостью тела ( газа ) называется количество теплоты, которое необходимо подвести к нему (или отнять от него) для его нагревания (охлаждения) на 1 К Удельная теплоемкость Удельной теплоемкостью называется теплоемкость единицы массы вещества, удельная теплоемкость численно равна количеству теплоты, которое требуется для изменения температуры 1 кг вещества на величину dT 20
Слайд 21
Молярной теплоемкостью численно равна количеству теплоты, которое требуется для изменения температуры 1 моля вещества на величину dT Молярная теплоемкость 21
Слайд 22
Теплоёмкость идеального газа при постоянном объеме – молярная теплоёмкость идеального газа при V=const 22
Слайд 23
Теплоёмкость идеального газа при постоянном давлении – молярная теплоёмкость идеального газа при p=const 23
Слайд 25
Адиабатический (адиабатный) процесс – это процесс, протекающий в системе без теплообмена с окружающей средой. Процесс, происходящий в условиях теплоизоляции (термостат). Очень быстро протекающий процесс (теплообмен с окружающей средой произойти не успевает, взрыв). Работа совершается за счёт изменения внутренней энергии системы. 25 6. Адиабатический процесс.
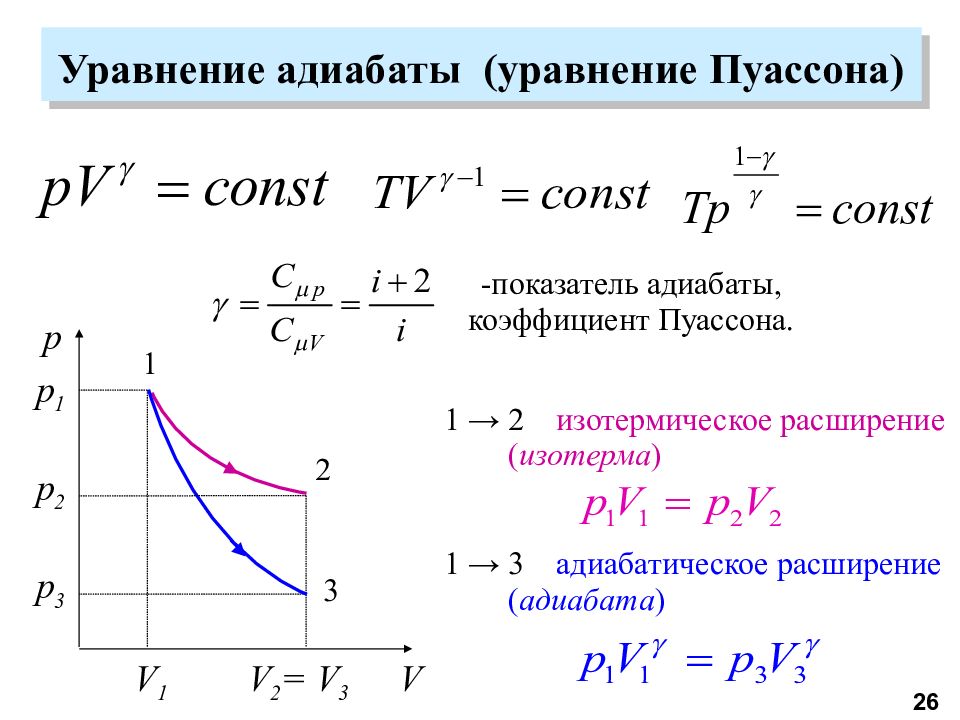
Слайд 26: Уравнение адиабаты (уравнение Пуассона)
1 → 3 адиабатическое расширение ( адиабата ) V p V 1 p 3 p 1 1 2 V 2 = V 3 3 p 2 1 → 2 изотермическое расширение ( изотерма ) -показатель адиабаты, коэффициент Пуассона. 26
Слайд 28
Второе начало ТД определяет направление протекания необратимых процессов. 28 7. Второе начало термодинамики. (закон термодинамики) Формулировка Клаузиуса (1850) Невозможен циклический процесс, единственным результатом которого была бы передача теплоты от менее нагретого тела к более нагретому. Невозможна самопроизвольная передача теплоты от холодного тела к теплому.
Слайд 29
Никакой двигатель не может преобразовывать теплоту в работу со стопроцентной эффективностью. Формулировка Карно (1824) Невозможно создать вечный двигатель второго рода – тепловой двигатель, работающий без холодильника с коэффициентом полезного действия η = 100%.
Слайд 31
Необратимый процесс – это ТД процесс, который может самопроизвольно протекать только в одном направлении. Примеры: диффузия; теплопроводность. торможение Если в замкнутой системе происходит необратимый процесс
Слайд 32
Если в замкнутой системе происходит обратимый процесс, Примеры: собственные (незатухающие) механические колебания; собственные (незатухающие) электромагнитные колебания. адиабатный процесс. Обратимый процесс – это процесс, при котором перевод системы из конечного состояния в начальное осуществляется через те же самые промежуточные состояния, что и перевод системы из начального состояния в конечное. При этом в окружающей систему среде не должно остаться никаких изменений.
Слайд 33
33 Пример: Согласно первому началу термодинамики, Из уравнения Менделеева-Клапейрона: Вычисление энтропии идеального газа:
Слайд 35
Изменение энтропии в адиабатическом процессе Изменение энтропии в изотермическом процессе
Слайд 36
Изменение энтропии в изохорическом процессе Изменение энтропии в изобарном процессе
Слайд 37
Найти изменение энтропии при превращении 10 г льда в пар Нагревание льда до 0С Плавление льда при 0С Нагревание воды до 100С Испарение воды 100C
Слайд 39
39 Энтропия системы пропорциональна натуральному логарифму числа микросостояний, которые реализуют данное макросостояние системы. 8. Статистический смысл энтропии.
Слайд 40
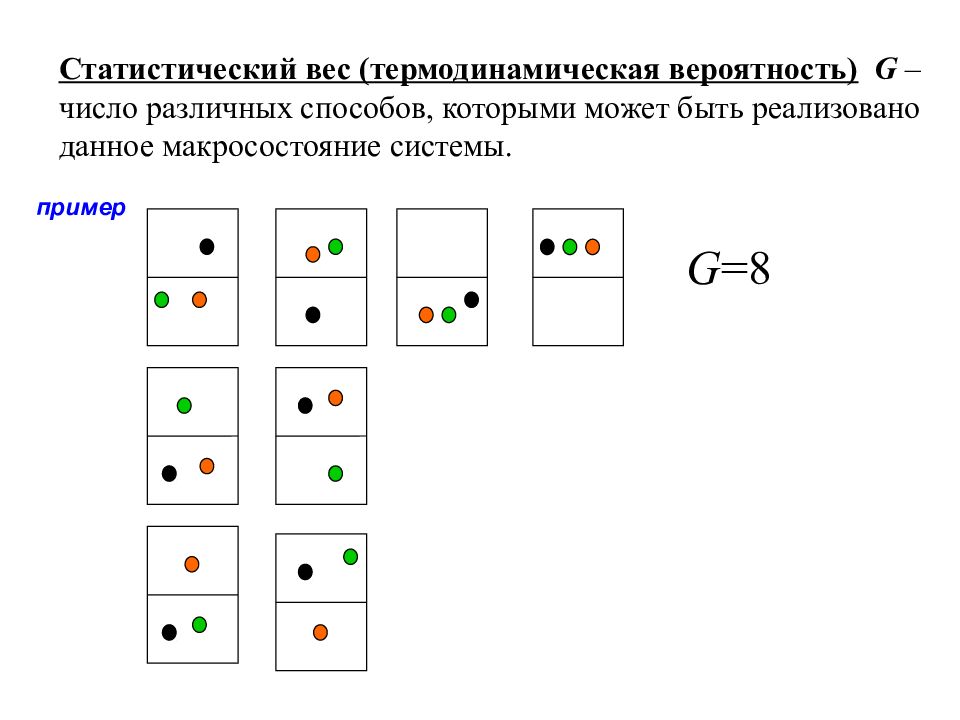
Статистический вес (термодинамическая вероятность) G – число различных способов, которыми может быть реализовано данное макросостояние системы. пример G = 8
Слайд 41
Например: S 1 кг пара > S 1 кг воды > S 1 кг льда. Чем больше беспорядка, тем больше стат.вес данного состояния, тем больше энтропия. Энтропия является мерой беспорядка в статистической системе 41 Энтропия аддитивная величина.
Слайд 43
9. Третий закон термодинамики Энтропия системы становится равной нулю для однозначно упорядоченной системы Энтропия любой термодинамической системы стремится к нулю при стремлении к нулю абсолютной температуры системы: 43 Абсолютный ноль температуры не может быть достигнут Физика сверхнизких температур - криогенная физика.
Слайд 44
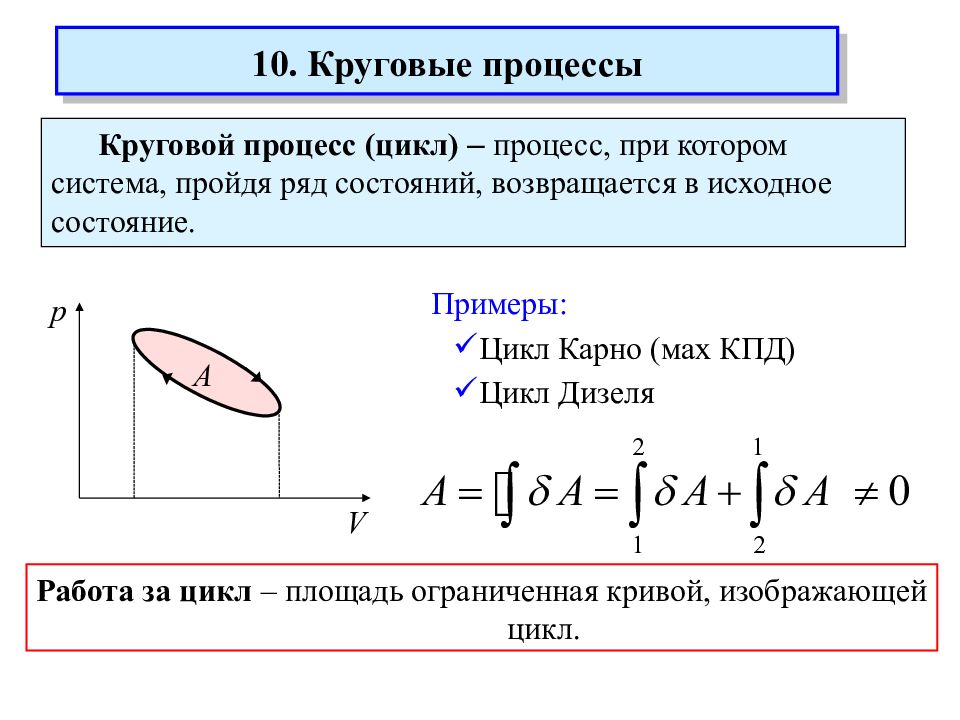
Круговой процесс (цикл) – процесс, при котором система, пройдя ряд состояний, возвращается в исходное состояние. V А p Примеры: Цикл Карно (мах КПД) Цикл Дизеля 10. Круговые процессы Работа за цикл – площадь ограниченная кривой, изображающей цикл.
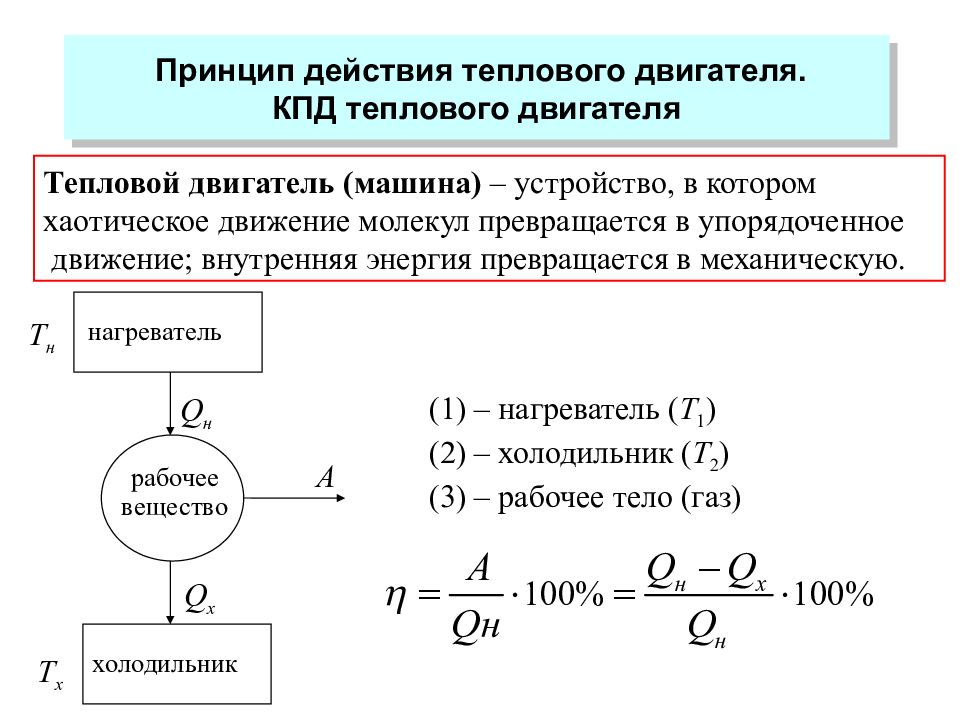
Слайд 45: Принцип действия теплового двигателя. КПД теплового двигателя
Тепловой двигатель (машина) – устройство, в котором хаотическое движение молекул превращается в упорядоченное движение; внутренняя энергия превращается в механическую. нагреватель холодильник рабочее вещество Q н Q х А T н T х – нагреватель ( Т 1 ) – холодильник ( Т 2 ) – рабочее тело (газ)
Слайд 46
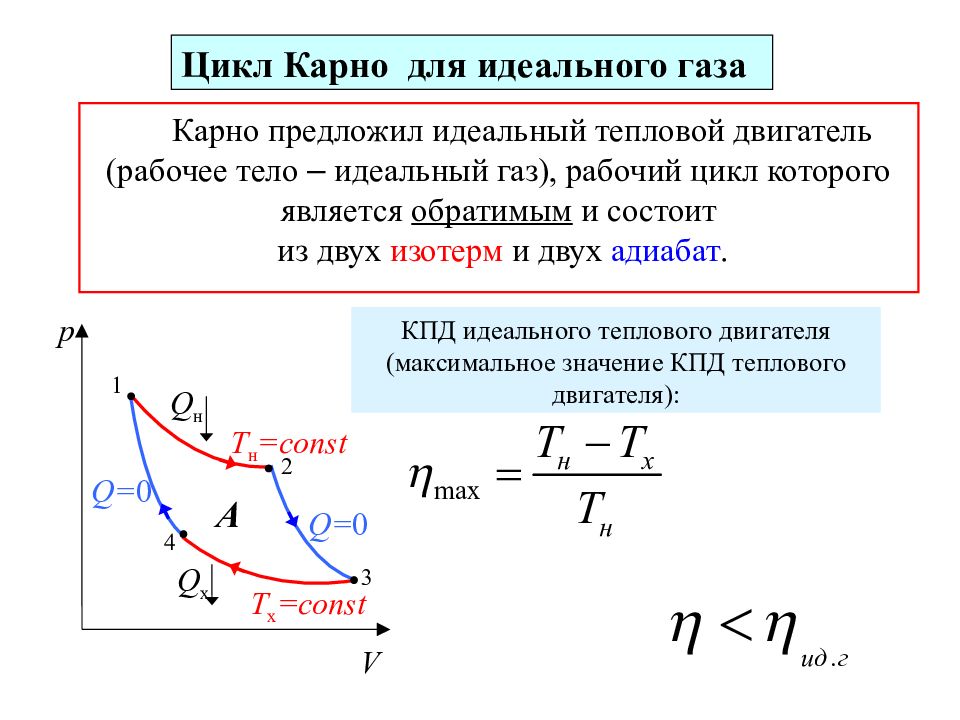
Карно предложил идеальный тепловой двигатель (рабочее тело – идеальный газ), рабочий цикл которого является обратимым и состоит из двух изотерм и двух адиабат. p V Т н =const Т х =const Q н Q х Q = 0 Q = 0 1 2 3 4 А Цикл Карно для идеального газа КПД идеального теплового двигателя (максимальное значение КПД теплового двигателя):
Слайд 47
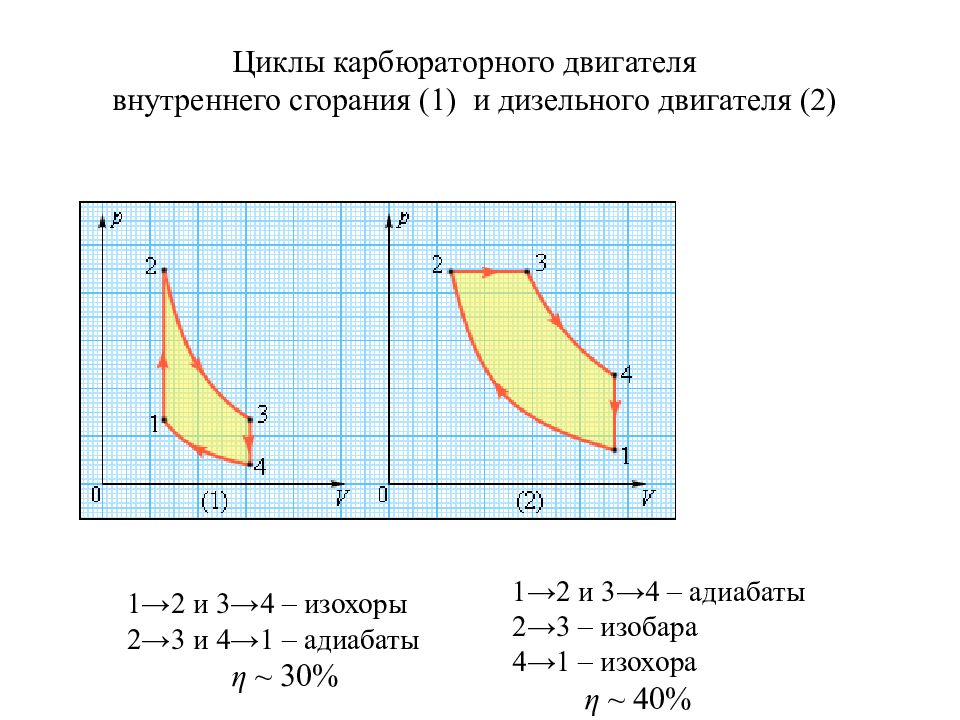
Циклы карбюраторного двигателя внутреннего сгорания (1) и дизельного двигателя (2) 1 →2 и 3→4 – изохоры 2→3 и 4→1 – адиабаты η ~ 30% 1→2 и 3→4 – адиабаты 2→3 – изобара 4→1 – изохора η ~ 40%