Первый слайд презентации
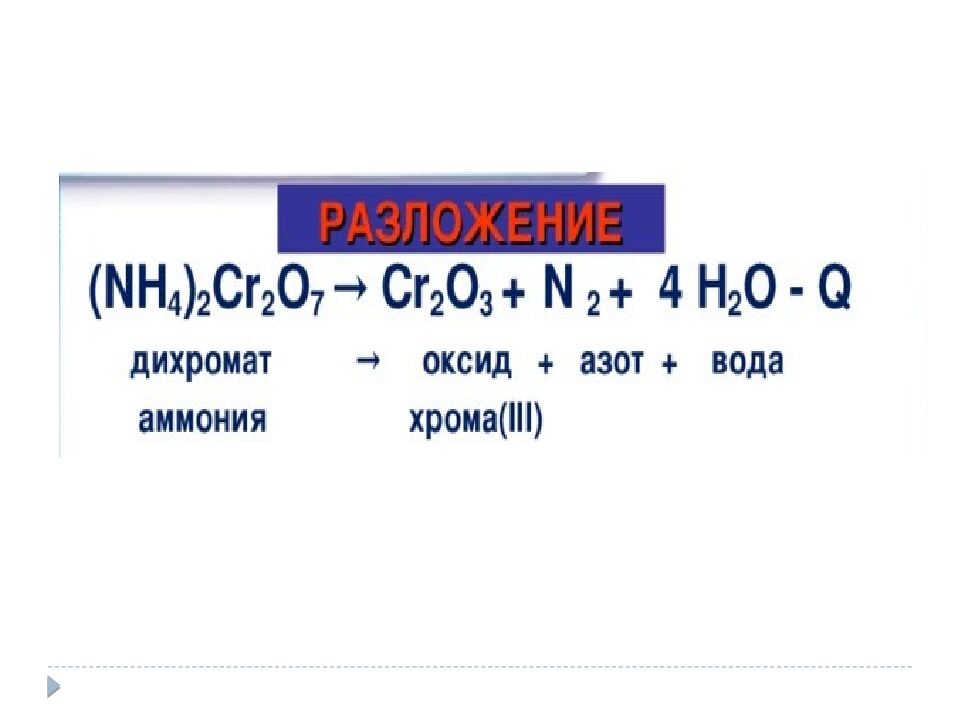
Расставьте степень окисления элементов в соединениях. K 2 SO 4 + BaCl 2 → BaSO 4 + 2 KCl CaCO 3 → CO 2 + H 2 O Чем отличаются реакции? 2 Al(OH) 3 → Al 2 O 3 + 3 H 2 O (NH 4 ) 2 Cr 2 O 7 → Cr 2 O 3 + N 2 + H 2 O
Слайд 2
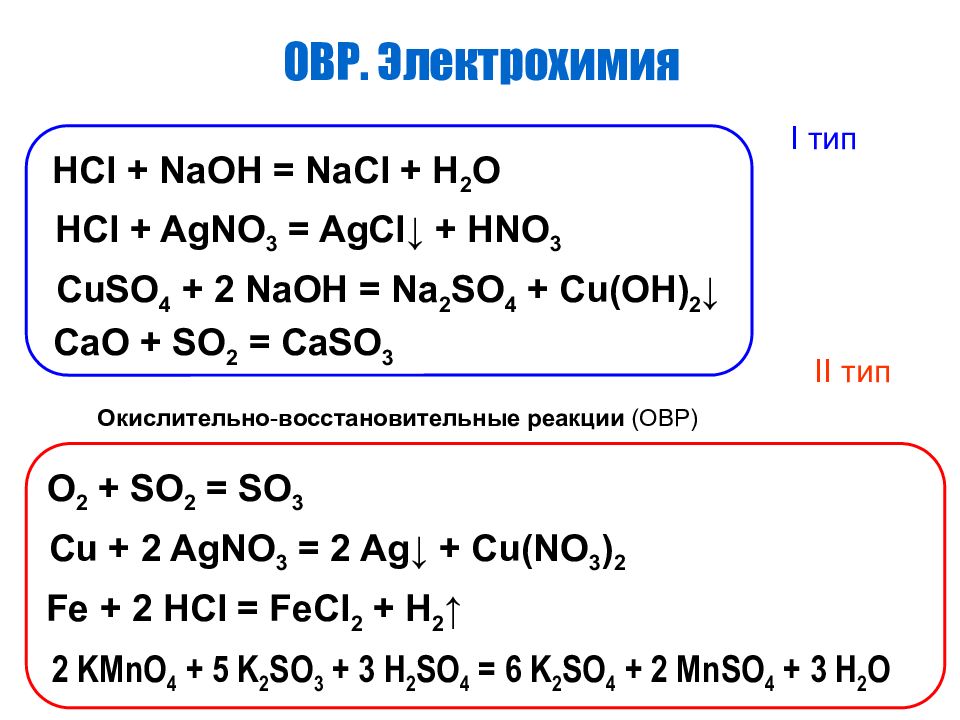
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ (ОВР) « Кто-то теряет, а кто-то находит.»
Слайд 3
Где с горы летит огонь, И дымит со всех сторон, Там опасный хулиган, Вновь проснувшийся …
Варианты ответов: По изменению степени окисления у отдельных элементов. По наличию хотя бы одного простого вещества. По типу химической реакции.
Слайд 6: Вывод :
К окислительно-восстановительным реакциям относятся: все реакции замещения ; только те реакции соединения и разложения, в которых участвует хотя бы одно простое вещество; реакции горения. Все реакции ионного обмена не будут являться окислительно-восстановительными !
Слайд 7
Окисление – процесс отдачи электронов. Восстановление – процесс присоединения электронов. Окислитель – элемент, принимающий электроны. Восстановитель – элемент, отдающий электроны.
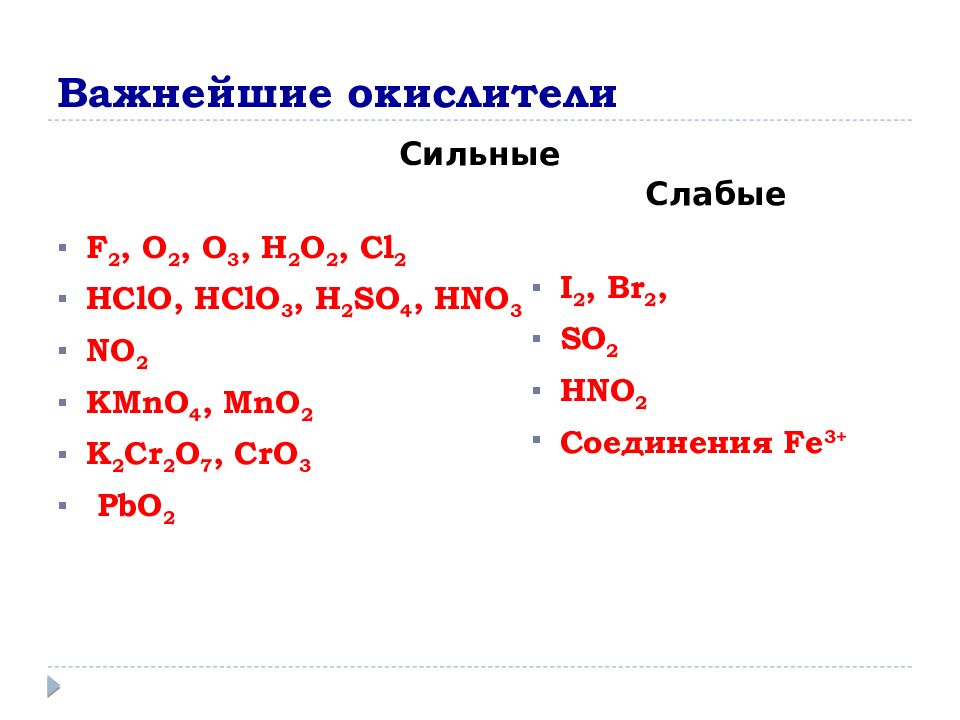
Слайд 8: Важнейшие окислители
Сильные F 2, O 2, O 3, H 2 O 2, Cl 2 HClO, HClO 3, H 2 SO 4, HNO 3 NO 2 KMnO 4, MnO 2 K 2 Cr 2 O 7, CrO 3 PbO 2 Слабые I 2, Br 2, SO 2 HNO 2 Соединения Fe 3+
Слайд 9
Сильные Щелочные и щелочно-земельные металлы Mg, Al, H 2 HI и йодиды HBr и бромиды H 2 S и сульфиды NH 3, PH 3, H 3 PO 3 C, CO Соединения Fe 2+, Cr 2+ Слабые Малоактивные металлы ( Pb, Cu, Ag, Hg) HCl SO 2 HNO 2 Альдегиды, спирты, муравьиная кислота, щавелевая кислота, глюкоза Важнейшие восстановители
Слайд 10
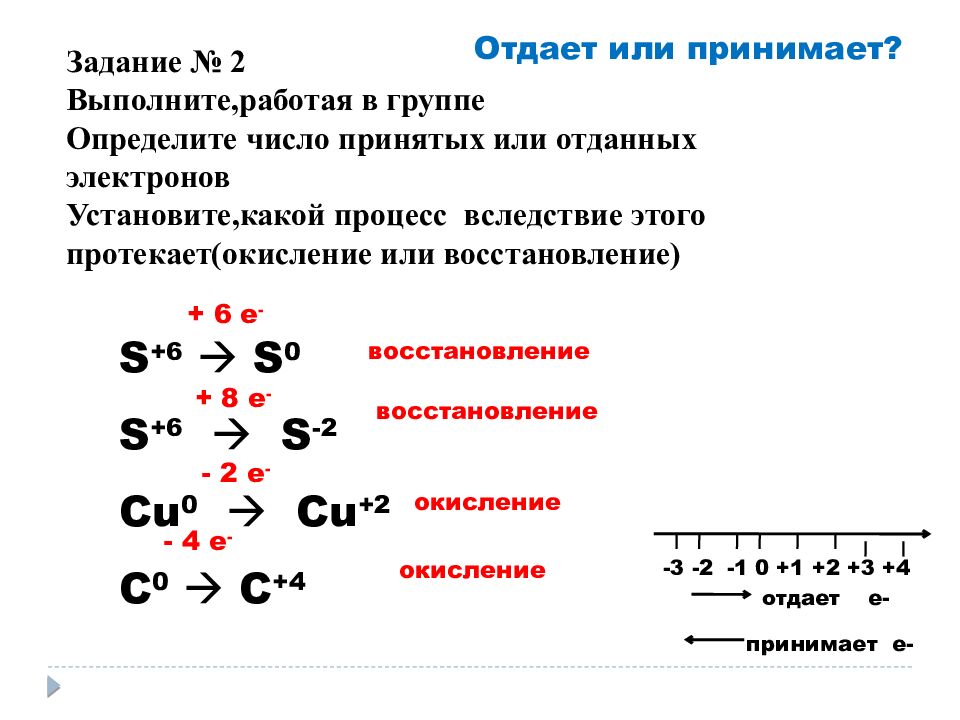
Отдает или принимает? S +6 S 0 S +6 S -2 Cu 0 Cu +2 C 0 C +4 + 6 e - + 8 e - - 2 e - - 4 e - восстановление восстановление окисление окисление -3 -2 -1 0 +1 +2 +3 +4 отдает е- принимает е- Задание № 2 Выполните,работая в группе Определите число принятых или отданных электронов Установите,какой процесс вследствие этого протекает(окисление или восстановление)
Слайд 11: Составление уравнений окислительно-восстановительных реакций
Метод электронного баланса применяется при рассмотрении ОВР, протекающих при: сплавлении веществ, термическом разложении, взаимодействии твердого вещества с газообразным (обжиг), при взаимодействии сухих солей и металлов с практически безводными кислотами
Слайд 12
Расстановка коэффициентов с использованием метода электронного баланса. 1. Расставить степени окисления элементов в веществах. HCl + Al → AlCl 3 + H 2 + 1 - 1 +3 - 1 0 0 2. Подчеркнуть элементы, меняющие свою степень окисления. H Cl + Al → Al Cl 3 + H 2 + 1 - 1 +3 - 1 0 0 3. Выписать элементы, меняющие степень окисления, количество отданных и принятых электронов. 2 H – 2 ē → H 2 + 1 0 Al + 3 ē → Al +3 0 Восстановитель Окислитель Окисление Восстановление 4. Составить баланс электронов, указать восстановитель, окислитель, процессы окисления и восстановления. 2 H – 2 ē → H 2 + 1 0 Al + 3 ē → Al +3 0 2 3 3 2 5. Расставить коэффициенты, сначала полученные, затем методом подбора. 6 HCl + 2 Al = 2 AlCl 3 + 3 H 2