Первый слайд презентации
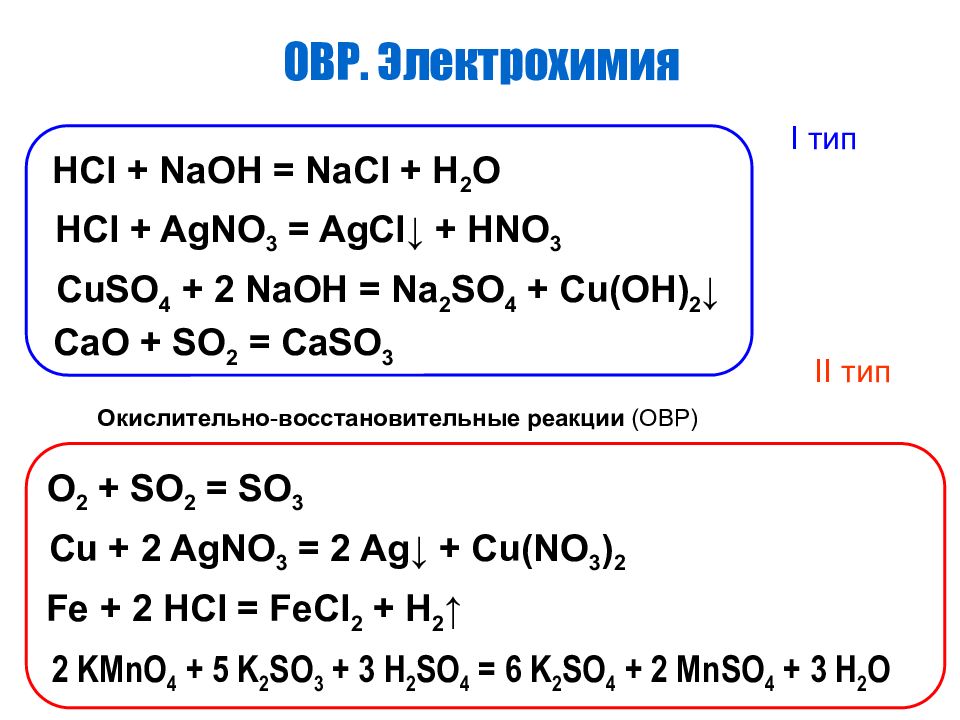
ОВР. Электрохимия HCl + NaOH = NaCl + H 2 O HCl + AgNO 3 = AgCl ↓ + HNO 3 CuSO 4 + 2 NaOH = Na 2 SO 4 + Cu(OH) 2 ↓ CaO + SO 2 = CaSO 3 O 2 + SO 2 = SO 3 Cu + 2 AgNO 3 = 2 Ag ↓ + Cu(NO 3 ) 2 Fe + 2 HCl = FeCl 2 + H 2 ↑ 2 KMnO 4 + 5 K 2 SO 3 + 3 H 2 SO 4 = 6 K 2 SO 4 + 2 MnSO 4 + 3 H 2 O I тип II тип Окислительно - восстановительные реакции (ОВР)
Слайд 2
Степень окисления ( O xidation S tate, OS ) OS элемента в химическом соединении – это условный заряд, который приписывается его атому в предположении, что вещество состоит из ионов (положительным считается заряд менее ЭО-элемента). В простых веществах каждый из атомов имеет нулевую OS. В случае соединений с полярными связями значение OS рассчитывается на основании принципа электронейтральности. OS элемента в его соединениях: водорода (+1), исключение: гидриды (-1); кислорода - (-2), исключение: фториды (OF 2, O 2 F 2 ) и соединения со связью О-О - пероксиды (H 2 O 2 ), надпероксиды (NaO 2 ), озониды (KO 3 ) и т.п. Пример: значение OS хлора в HClO 4, HCl, серы в Na 2 S 4 O 6 и азота в NH 3 равны соответственно (+7), (-1), (+5/2) и (-3).
Слайд 3
OS чаще не совпадает и с валентным состоянием атома в соединении. Так, в ионе NH 4 + OS азота (-3), а валентность равна 4. Но в молекуле CO 2, OS и валентности атомов численно почти равны ( OS ” + ”). OS имеет и реальную основу (!) Например: для выделения одного моля железа из раствора соли железа(III) требуется три моля электронов. Понятие OS оказывается полезным при рассмотрении ОВР и при установлении стехиометрических соотношений в них. OS не отражает истинного распределения валентных электронов между атомами в молекуле, т.е. не совпадает с их эффективным зарядом ( δ ). Так, OS хлора и кислорода в ClO 4 - (+7) и (-2), а δ равны (+1,0) и (-0,5). Даже в т. н. ионных соединениях ( CsF ) δ (+0,93 и -0,93), а OS (+1 и -1).
Слайд 4
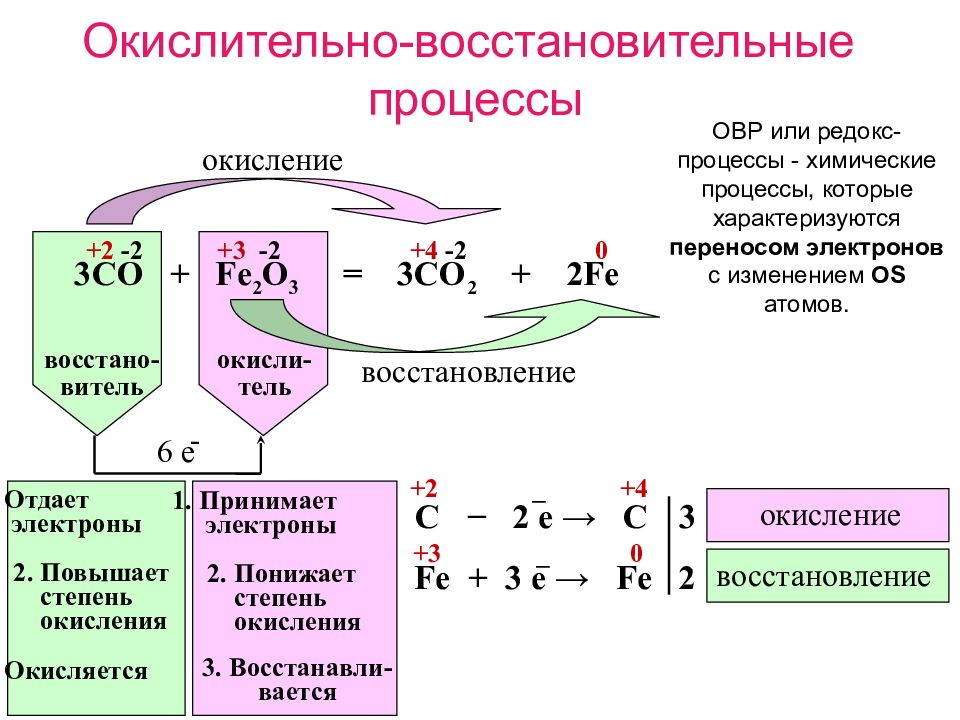
ОВР или редокс-процессы - химические процессы, которые характеризуются переносом электронов с изменением OS атомов. Окислительно-восстановительные процессы 3СО + Fe 2 O 3 = 3CO 2 + 2Fe +2 -2 +3 -2 +4 -2 0 восстановление окисление окисли-тель восстано-витель 6 e - 1. Отдает электроны 2. Повышает степень окисления 3. Окисляется 1. Принимает электроны 2. Понижает степень окисления 3. Восстанавли- вается С − 2 е → C 3 Fe + 3 е → Fe 2 окисление восстановление +2 _ +4 + 3 _ 0
Слайд 5
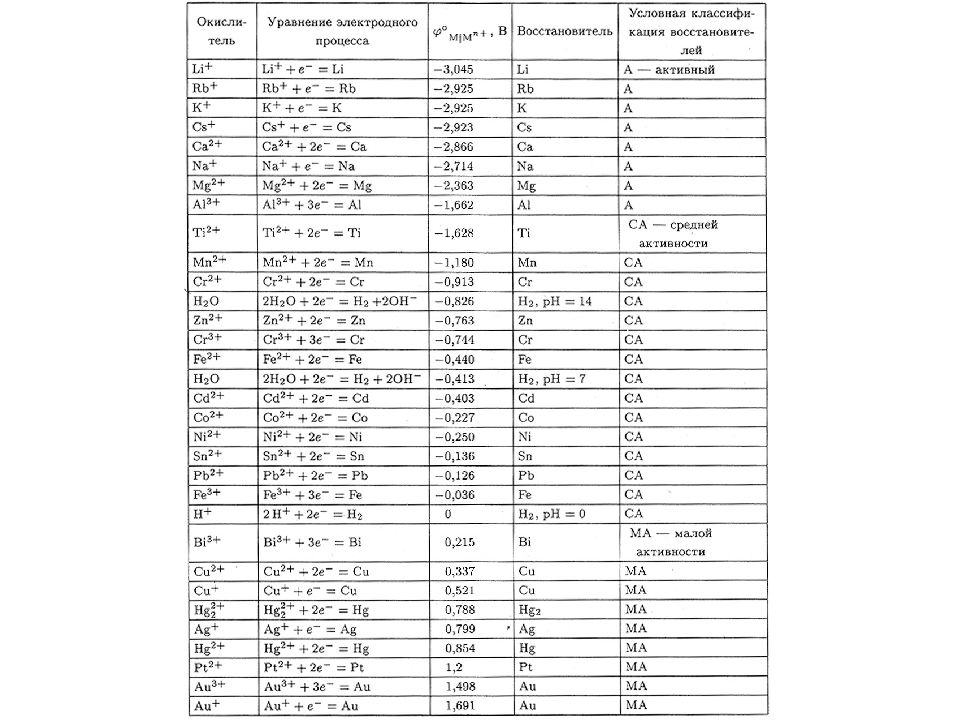
Окислители содержат в своем составе элементы, которые в ходе реакции понижают свою OS На практике применяют: из соединений неметаллов: - свободные неметаллы верхней части VI и VII групп с высокой ЭО ( F 2, Cl 2, O 2 и др.) - кислоты ( H Cl, H 2 SO 4 (разб.), H 2 S O 4 (конц.), H N O 3 ) - H 2 O 2, K Cl O 3, K Cl O 4 и др. из соединений металлов: - соединения металлов в высших OS K 2 Cr 2 O 7, K 2 Cr O 4, K Mn O 4, Mn O 2, Pb O 2, Fe Cl 3, Hg Cl 2, [ Ag (NH 3 ) 2 ]OH и др. Ox
Слайд 6
Восстановители содержат в своем составе элементы, которые в ходе реакции повышают свою OS На практике применяют: из соединений металлов: - соединения металлов в низших OS Fe(II), Sn(II), Cr(II), Cu(I) и др. - свободные металлы ( Na, K, Mg, Al, Zn и др.) из соединений неметаллов: - свободные неметаллы с невысокой ЭО ( Н 2, С, Si и др. ) C O, H 2 S, Cl - и др. - соединения неметаллов в низших OS Red
Слайд 8
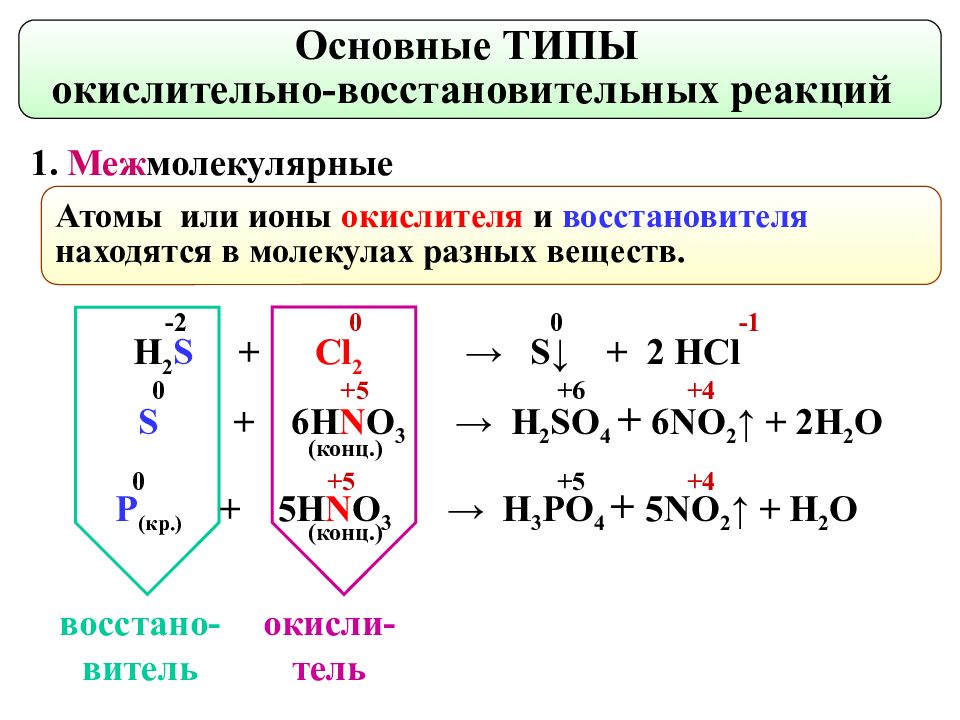
1. Меж молекулярные Основные ТИПЫ окислительно-восстановительных реакций Атомы или ионы окислителя и восстановителя находятся в молекулах разных веществ. окисли- тель восстано- витель H 2 S + Cl 2 → S↓ + 2 HCl S + 6 H N O 3 → H 2 S O 4 + 6 NO 2 ↑ + 2 H 2 O P ( кр. ) + 5H N O 3 → H 3 P O 4 + 5NO 2 ↑ + H 2 O -2 0 0 - 1 0 +5 +6 +4 0 +5 + 5 +4 ( конц. ) ( конц. )
Слайд 9
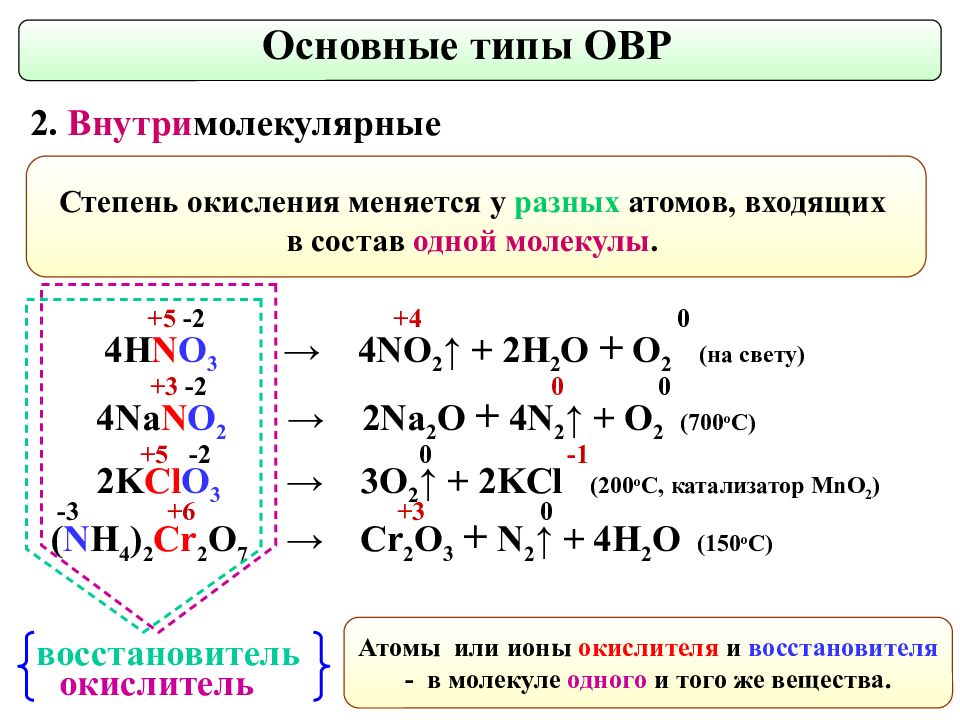
Степень окисления меняется у разных атомов, входящих в состав одной молекулы. Основные типы ОВР 2. Внутри молекулярные окислитель восстановитель 4H N O 3 → 4NO 2 ↑ + 2 H 2 O + O 2 ( на свету ) 4Na N O 2 → 2 Na 2 O + 4N 2 ↑ + O 2 ( 700 о С ) 2K Cl O 3 → 3 O 2 ↑ + 2KCl (200 o C, катализатор MnO 2 ) ( N H 4 ) 2 Cr 2 O 7 → Cr 2 O 3 + N 2 ↑ + 4H 2 O (150 о С ) + 5 -2 + 4 0 + 5 -2 0 -1 - 3 + 6 +3 0 + 3 -2 0 0 Атомы или ионы окислителя и восстановителя - в молекуле одного и того же вещества.
Слайд 10
3. Дис пропорционирование Основные типы ОВР Один элемент с неустойчивой степенью окисления, находясь в одной молекуле, может быть одновременно и окислителем, и восстановителем. В результате ОВР образуются соединения этого элемента с разными устойчивыми степенями окисления. неуст. OS уст. OS 1 ( > неуст. OS ) уст. OS 2 ( < неуст. OS ) 2 N O 2 ↑ + 2 H 2 O → 4HNO 3 + HNO 2 2H 2 O 2 → 2 H 2 O + O 2 ↑ 4K Cl O 3 → KCl + 3KCl O 4 3K 2 Mn O 4 + 2H 2 O → 2KMnO 4 + MnO 2 + 4KOH Cl 2 + H 2 O → HCl + HClO 0 - 1 +1 +4 +5 +3 -1 -2 0 +5 - 1 + 7 +6 +7 + 4
Слайд 11
Основные типы ОВР 4. Кон пропорционирование ( со пропорционирование или усреднение ) Атомы одного и того же элемента с неустойчивыми ( при совместном присутствии ! ) степенями окисления в разных молекулах превращаются в одно соединение этого элемента с устойчивой степенью окисления. 2 K Mn O 4 + 3 Mn SO 4 + 2H 2 O → 5 MnO 2 + K 2 SO 4 + 2H 2 SO 4 3 H 2 S O 4 + H 2 S → 4 SO 2 ↑ + 4H 2 O 2 K I O 3 + 10 K I + 6H 2 SO 4 → 6 I 2 + 6K 2 SO 4 + 6H 2 O +6 -2 + 4 +7 +2 + 4 +5 -1 0 уст. OS неуст. OS ( > уст. OS) неуст. OS ( < уст. OS)
Слайд 12
Способы подбора коэффициентов в ОВР Газообразные и Твердые фазы. Расплавы. Пример 1: один окислитель, один восстановитель Метод электронного баланса ( отдачи – присоединения е - ) Cr 2 O 3 + Na N O 3 + Na 2 CO 3 →K 2 CrO 4 +NaNO 2 +2CO 2 (400-600 о С ) окислитель восстано - витель 1. Выписываются атомы или ионы восстановителя и его окисленной формы, а также окислителя и его восстановленной формы, с указанием числа отданных или принятых электронов. 2. Число принятых и отданных электронов уравниваются дополнительными множителями. 2С r − 6 е → 2 Cr 1 N + 2 е → N 3 окисление восстановление +3 _ +6 +5 _ +3
Слайд 13
(NH 4 ) 2 Cr 2 O 7 → Cr 2 O 3 + N 2 ↑ + 4 H 2 O (150 о С ) Cr 2 O 3 + KClO 3 + 2 K 2 CO 3 → 2 K 2 CrO 4 + KCl + 2 CO 2 ( 6 00 о С ) Cr 2 O 3 + 3 NaNO 3 + 2 Na 2 CO 3 → 2 Na 2 CrO 4 + 3 NaNO 2 + 2 CO 2 3. Полученные множители ставятся к продуктам окисления и восстановления в правую часть уравнения. 4. Далее коэффициенты ставятся: к ионам металлов I-IIA гр., к кислотным остаткам, к атомам водорода ; проверка - по равенству числа атомов кислорода в правой и левой частях. 2С r − 6 е → 2 Cr 1 N + 2 е → N 3 +3 _ +6 +5 _ +3 2С r − 6 е → 2 Cr 1 Cl + 6 е → Cl 1 +3 _ +6 +5 _ -1 2С r − 6 е → 2 Cr 1 2N + 6 е → N 2 1 -3 _ 0 +6 _ +3
Слайд 14
Пример 2: один окислитель, два восстановителя 4 FeS 2 + 11 O 2 → 8 SO 2 + 2 Fe 2 O 3 Число электронов, отданное двумя восстановителями, суммируется, и уравнивается дополнительными множи-телями с учетом числа электронов, принятых окислителем 2S − 10 е → 2S Fe − 1 е → Fe O 2 + 4 е → 2O 11 0 _ -2 - 1 _ +4 восстановители окислитель +2 _ +3 11 e 4 - 2 Fe ( Cr O 2 ) 2 + 7 K N O 3 +4Na 2 CO 3 → Fe 2 O 3 +4 Na 2 CrO 4 + 7 KNO 2 +4CO 2 +3 _ +6 4 Cr − 12 е → 4 Cr +5 _ + 3 N + 2 е → N 7 окислитель восстановители 2 Fe − 2 е → 2Fe +2 _ +3 14 e 1 -
Слайд 15
Пример 3: два окислителя, один восстановитель Число электронов, принятое двумя окислителями, суммируется и уравнивается дополнительными множителями с электронами, отданными восстановителем. 7 P 4 + 6 I 2 + 48 H 2 O → 12 PH 4 I + 16 H 3 PO 3 0 _ + 3 2I 2 + 4 е → 4 I P 4 - 1 2 е → 4P 12 e 4 0 _ -1 окислители восстановитель 1 6 e 3 - P 4 + 1 2 е → 4P 0 _ - 3 - 2 Cr O 5 + 14K I +10H 2 SO 4 → 7 I 2 + Cr 2 (SO 4 ) 3 +7K 2 SO 4 +10H 2 O 8O + 8 е → 8O -1 _ -2 -1 _ 0 2I - 2 е → I 2 2e 7 окислители восстановитель 2 Cr + 6 е → 2Cr +6 _ +3 14 e 1 - -
Слайд 16
Метод полуреакций Способы подбора коэффициентов в ОВР Ограничение : может быть использован только для ОВР, протекающих в растворах. Преимущества : – используются ионные частицы, реально существующие в водном растворе; - не требуется расчетов OS. Red-Ox реакции в РАСТВОРАХ Правило – сильные электролиты представляются в виде ионов, а неэлектролиты, слабые электролиты, газы и осадки – в виде молекул.
Слайд 17
При составлении схем полуреакций важно уметь определять среду, в которой протекает полуреакция Если в схеме полуреакции идет уменьшение числа атомов кислорода, то она протекает в кислой среде NO 3 - → NO 2 - NO 3 - + 2Н + + 2e - → NO 2 - + Н 2 О MnO 4 - + 8H + + 5е - → Mn 2+ + 4H 2 O 3 атома кислорода 2 атома кислорода MnO 4 - → Mn 2+ 4 атома кислорода 0 атомов кислорода Cr 2 O 7 2- + 14H + + 6 е - → 2Cr 3 + + 7H 2 O Cr 2 O 7 2- → Cr 3 + 7 атомов кислорода 0 атомов кислорода выделяется Н 2 О
Слайд 18
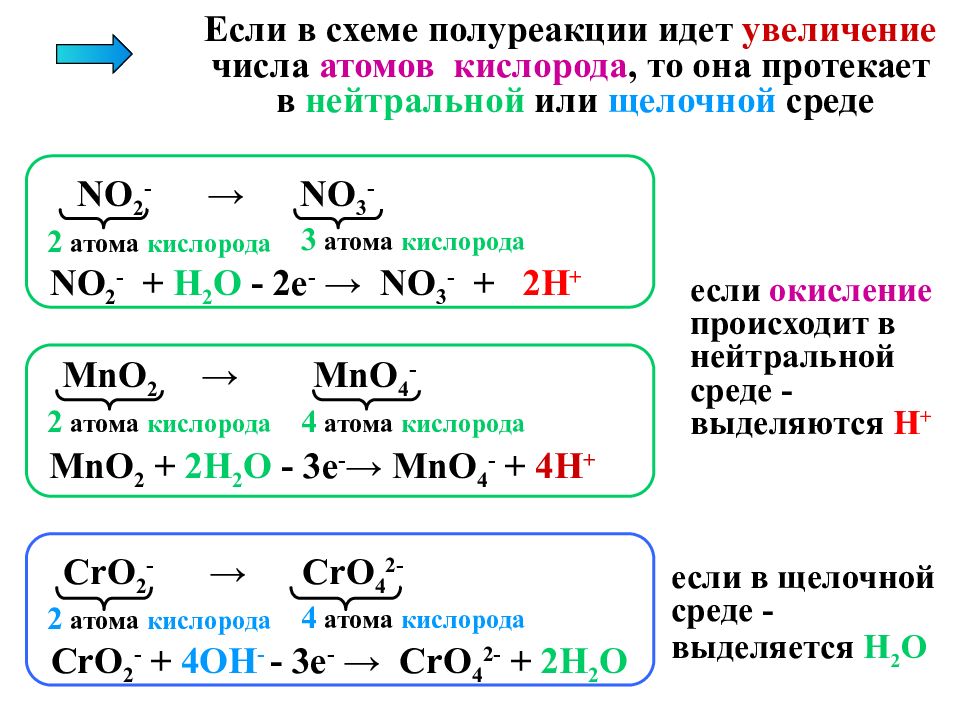
Если в схеме полуреакции идет увеличение числа атомов кислорода, то она протекает в нейтральной или щелочной среде NO 2 - → NO 3 - NO 2 - + Н 2 О - 2e - → NO 3 - + 2Н + 2 атома кислорода 3 атома кислорода MnO 2 → MnO 4 - MnO 2 + 2 Н 2 О - 3e - → MnO 4 - + 4 Н + 2 атома кислорода 4 атома кислорода CrO 2 - → CrO 4 2- CrO 2 - + 4O Н - - 3e - → CrO 4 2- + 2 Н 2 О 2 атома кислорода 4 атома кислорода если окисление происходит в нейтральной среде - выделяются Н + если в щелочной среде - выделяется Н 2 О
Слайд 19
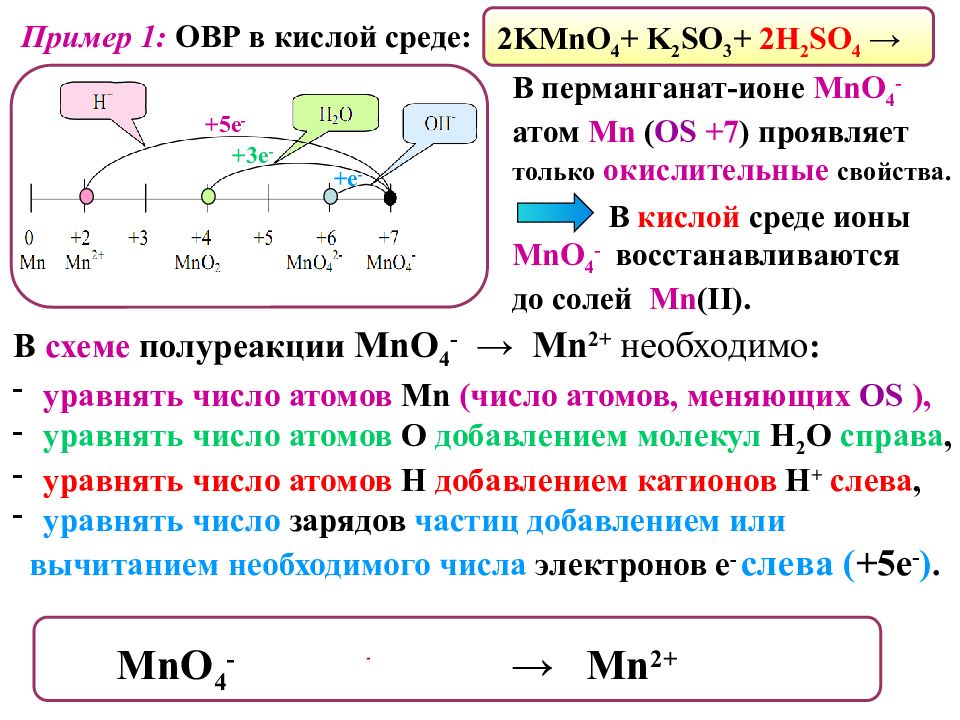
Пример 1: ОВР в кислой среде: 2 KMnO 4 + K 2 SO 3 + 2H 2 SO 4 → +5 е - + е - +3 е - В перманганат-ионе MnO 4 - атом Mn ( OS +7 ) проявляет только окислительные свойства. В кислой среде ионы MnO 4 - восстанавливаются до солей Mn (II). MnO 4 - + 8H + + 5 е - → Mn 2+ + 4H 2 O В схеме полуреакции MnO 4 - → Mn 2+ необходимо : уравнять число атомов Mn ( число атомов, меняющих OS ), уравнять число атомов О добавлением молекул Н 2 О справа, уравнять число атомов Н добавлением катионов Н + слева, уравнять число зарядов частиц добавлением или вычитанием необходимого числа электронов е - слева ( +5е - ).
Слайд 20
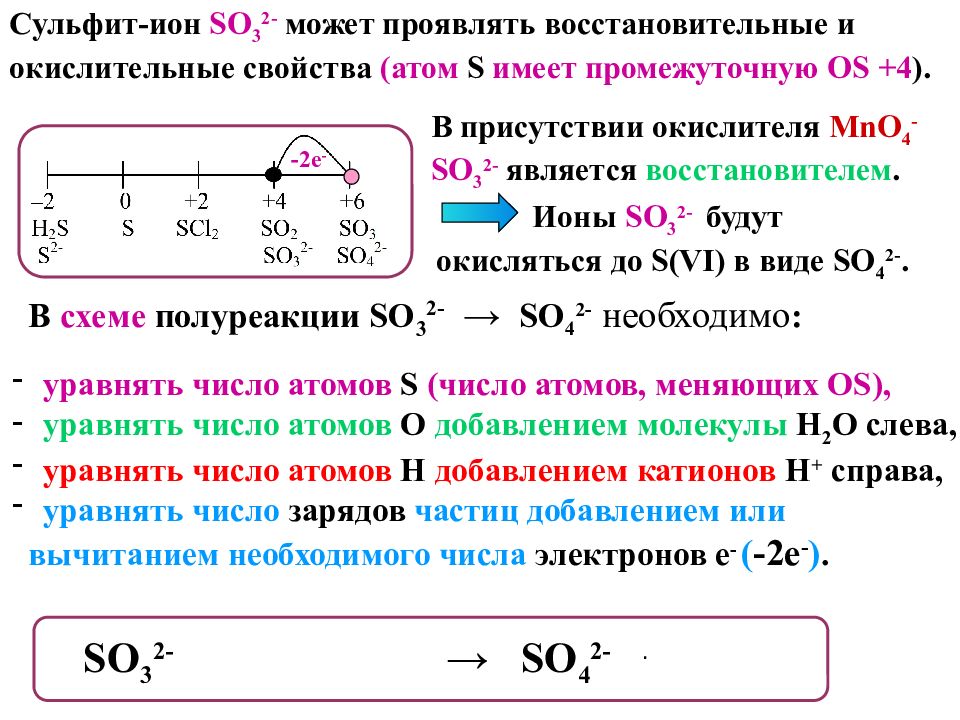
Сульфит-ион SO 3 2- может проявлять восстановительные и окислительные свойства ( атом S имеет промежуточную OS +4 ). В присутствии окислителя MnO 4 - SO 3 2- является восстановителем. -2 е - Ионы SO 3 2- будут окисляться до S(VI) в виде SO 4 2-. В схеме полуреакции SO 3 2- → SO 4 2- необходимо : SO 3 2- + H 2 O - 2 е - → SO 4 2 - + 2H + уравнять число атомов S ( число атомов, меняющих OS), уравнять число атомов О добавлением молекулы Н 2 О слева, уравнять число атомов Н добавлением катионов Н + справа, уравнять число зарядов частиц добавлением или вычитанием необходимого числа электронов е - ( -2е - ).
Слайд 21
Составив схемы полуреакций, уравниваем число отданных и принятых электронов, находим коэффициенты, на которые следует умножить число частиц одной и второй полуреакций: SO 3 2- + H 2 O - 2 е - → SO 4 2 - + 2H + 5 MnO 4 - + 8H + + 5 е - → Mn 2+ + 4H 2 О 2 Выписываем суммарное ионно-молекулярное уравнение: 2MnO 4 - + 16H + + 5SO 3 2- + 5 H 2 O → 2Mn 2+ + 8H 2 О + 5SO 4 2- + 10H + Сокращаем подобные ионы Н + и молекулы Н 2 О : Дописываем противоионы, и получаем готовое уравнение: 2MnO 4 - + 5SO 3 2- + 6H + → 2Mn 2+ + 5SO 4 2- + 3 H 2 О 2KMnO 4 + 5K 2 SO 3 + 3H 2 SO 4 → 2MnSO 4 + 6K 2 SO 4 + 3 H 2 О
Слайд 22
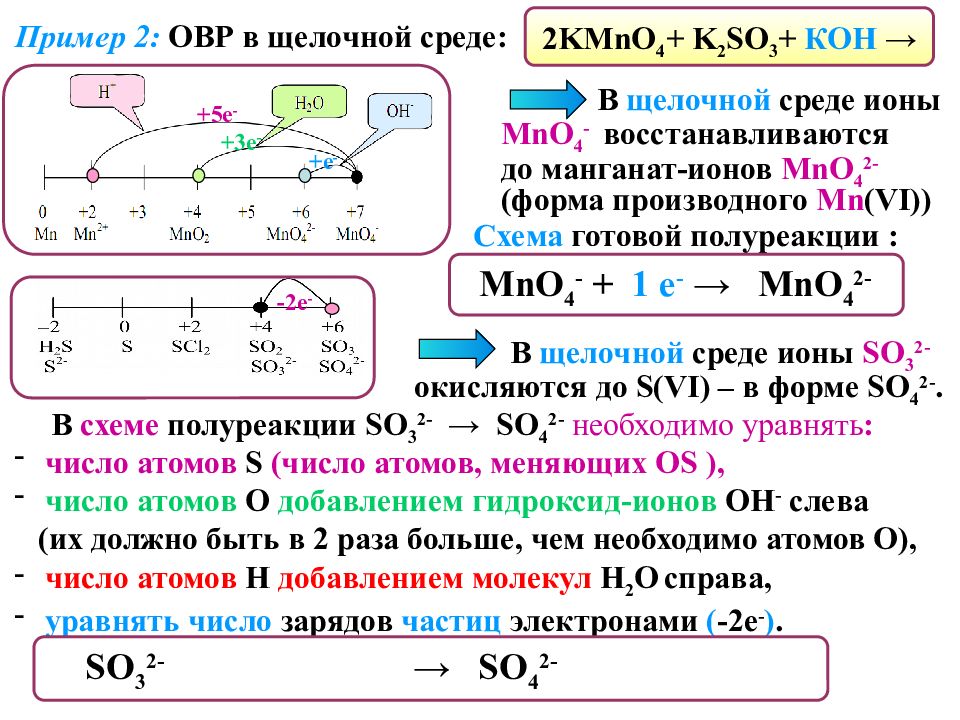
Пример 2 : ОВР в щелочной среде: 2 KMnO 4 + K 2 SO 3 + КОН → В щелочной среде ионы MnO 4 - восстанавливаются до манганат-ионов MnO 4 2 - ( форма производного Mn (VI) ) +5 е - + е - +3 е - MnO 4 - + 1 е - → MnO 4 2 - C хема готовой полуреакции : В щелочной среде ионы SO 3 2- окисляются до S(VI) – в форме SO 4 2-. -2 е - В схеме полуреакции SO 3 2- → SO 4 2- необходимо уравнять : число атомов S ( число атомов, меняющих OS ), число атомов О добавлением гидроксид-ионов ОН - слева (их должно быть в 2 раза больше, чем необходимо атомов О), число атомов Н добавлением молекул Н 2 О справа, уравнять число зарядов частиц электронами ( -2е - ). SO 3 2- + 2 OH - - 2 е - → SO 4 2 - + H 2 О
Слайд 23
Составив схемы полуреакций, уравниваем число отданных и принятых электронов, находим коэффициенты, на которые следует умножить число частиц одной и второй полуреакций: MnO 4 - + 1е - → MnO 4 2 - 2 SO 3 2- + 2 OH - - 2 е - → SO 4 2 - + H 2 О 1 В нейтральной среде уравнивается как в щелочной ( с учетом протекания реакции MnO 4 - + 3е - → MnO 2 ) Выписываем суммарное ионно-молекулярное уравнение: 2MnO 4 - + SO 3 2- + 2ОН - → 2Mn О 4 2- + SO 4 2- + H 2 О Дописываем противоионы и получаем готовое уравнение: 2 К MnO 4 + К 2 SO 3 + 2КОН → 2 К 2 Mn О 4 + К 2 SO 4 + H 2 О
Слайд 24
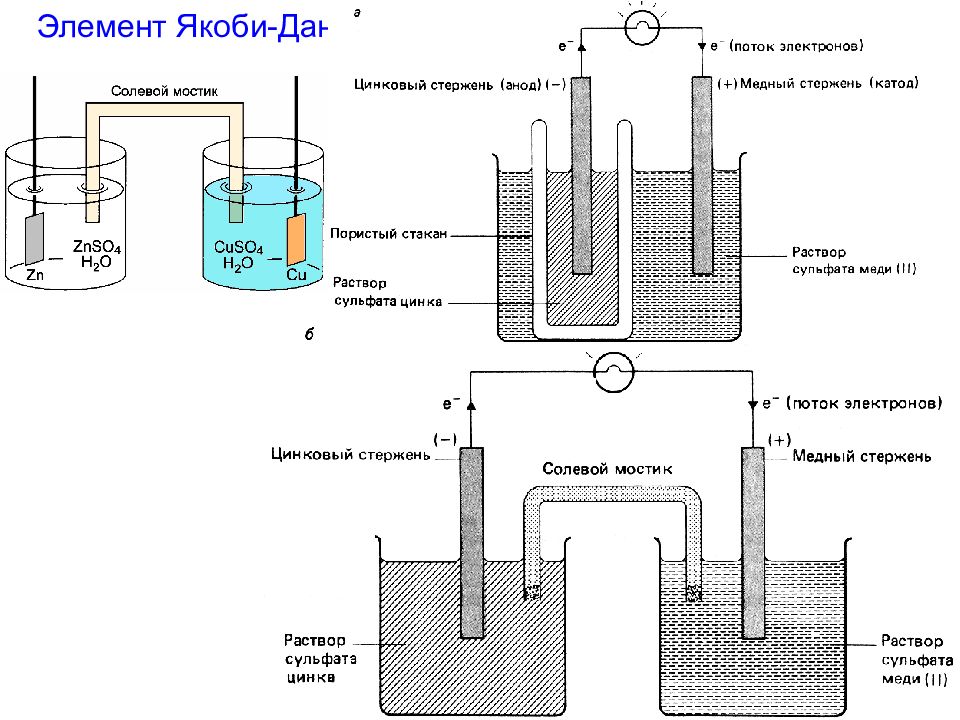
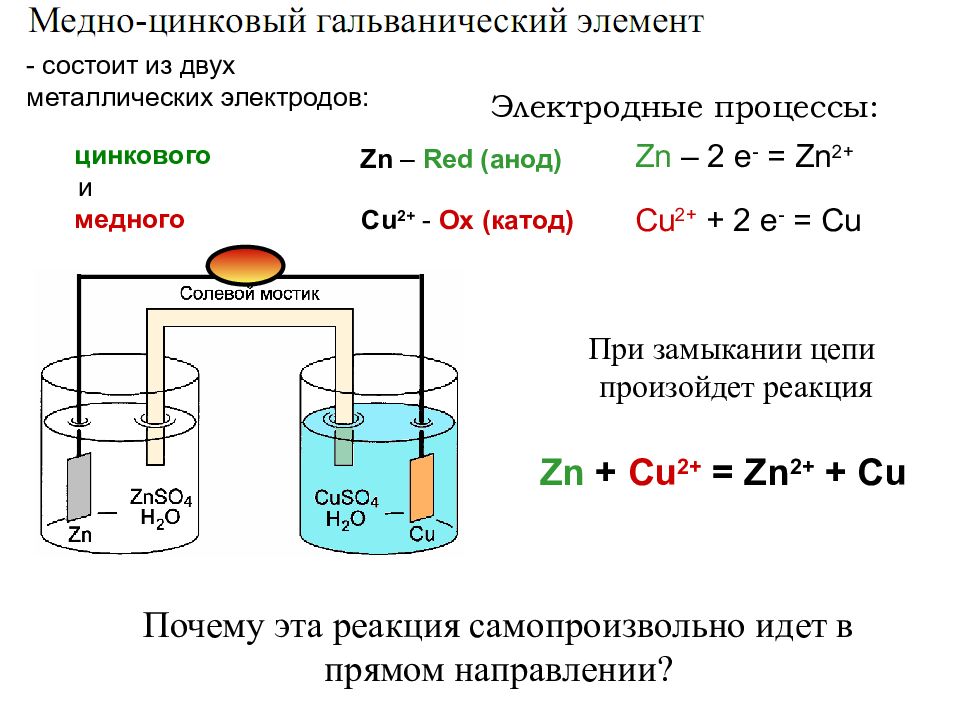
ОВР – непосредственный переход электронов от Red к Ox Zn + Cu 2+ = Zn 2+ + Cu Zn – 2 e - = Zn 2+ Cu 2+ + 2 e - = Cu Zn - Red Cu 2+ - Ox объединяет две полуреакции Гальванические элементы – химические источники тока (ХИТ), в которых происходят практически необратимые реакции ХИТ, в которых происходят практически обратимые реакции, называют аккумуляторами (можно многократно перезаряжать) Электродные потенциалы Из подобных наблюдений Бекетов составил ряд напряжений ( РН ) металлов, однако наиболее объективная оценка относительной активности металлов м.б. получена методом изучения электродных Пт. Если этот процесс провести так, чтобы обе полуреакции были пространственно разделены, а электроны переходили от Red к Ox по внешней цепи ( электрический ток! ), то химическую энергию ОВР можно превратить в электрическую
Слайд 26
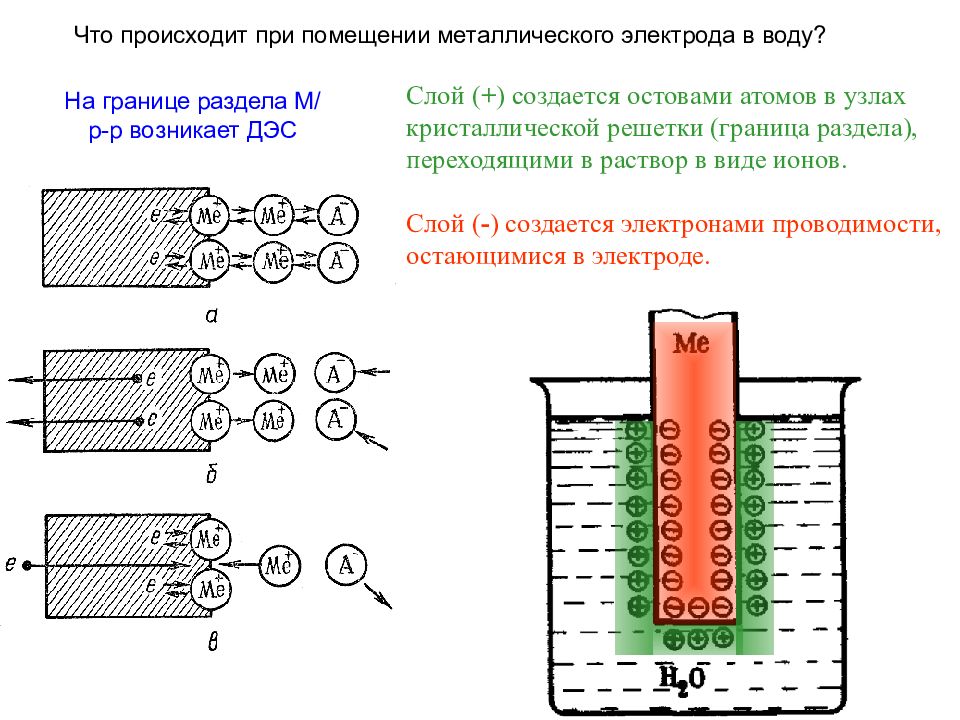
Что происходит при помещении металлического электрода в воду? На границе раздела М/р-р возникает ДЭС Слой ( + ) создается остовами атомов в узлах кристаллической решетки (граница раздела), переходящими в раствор в виде ионов. Слой ( - ) создается электронами проводимости, остающимися в электроде.
Слайд 27
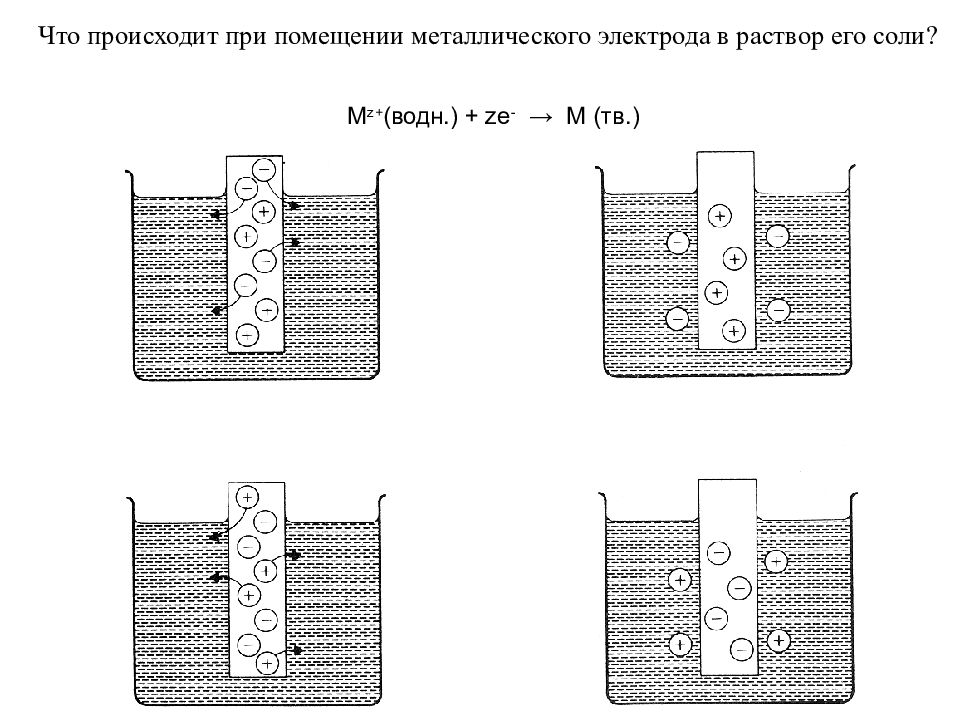
Что происходит при помещении металлического электрода в раствор его соли? M z+ (водн.) + ze - → M (тв.) M (тв.) → M z+ (водн.) + ze -
Слайд 28
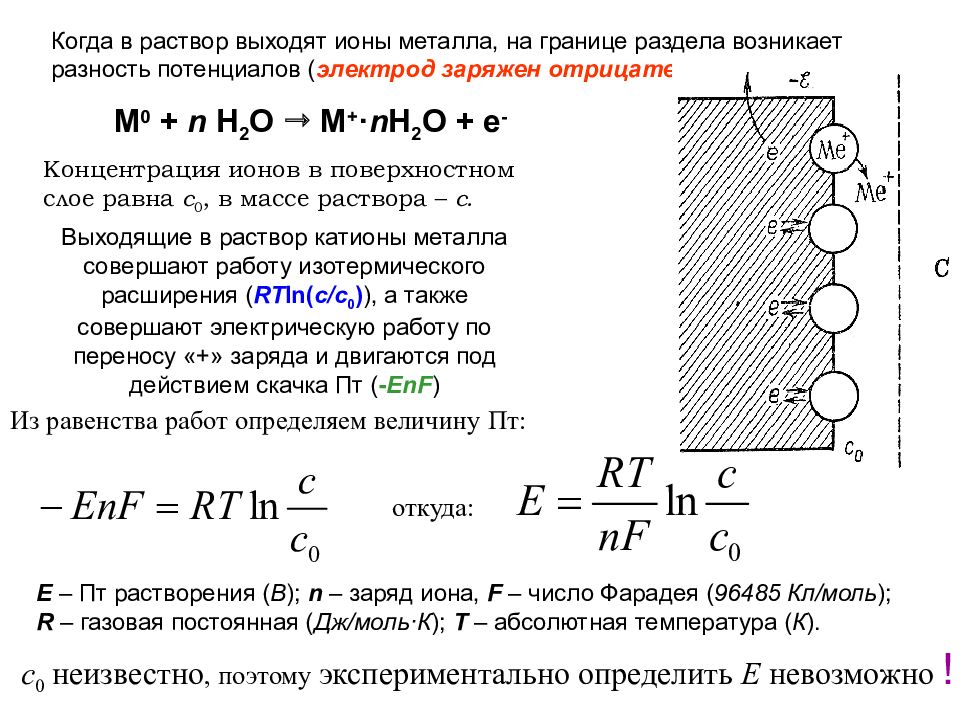
Когда в раствор выходят ионы металла, на границе раздела возникает разность потенциалов ( электрод заряжен отрицательно ! ) M 0 + n H 2 O M + · n H 2 O + e - Выходящие в раствор катионы металла совершают работу изотермического расширения ( RT ln( c/c 0 ) ), а также совершают электрическую работу по переносу «+» заряда и двигаются под действием скачка Пт ( - EnF ) Концентрация ионов в поверхностном слое равна с 0, в массе раствора – с. Из равенства работ определяем величину Пт: откуда: Е – Пт растворения ( В ); n – заряд иона, F – число Фарадея ( 96485 Кл/моль ); R – газовая постоянная ( Дж/моль · К ); T – абсолютная температура ( К ). с 0 неизвестно, поэтому экспериментально определить Е невозможно !
Слайд 29
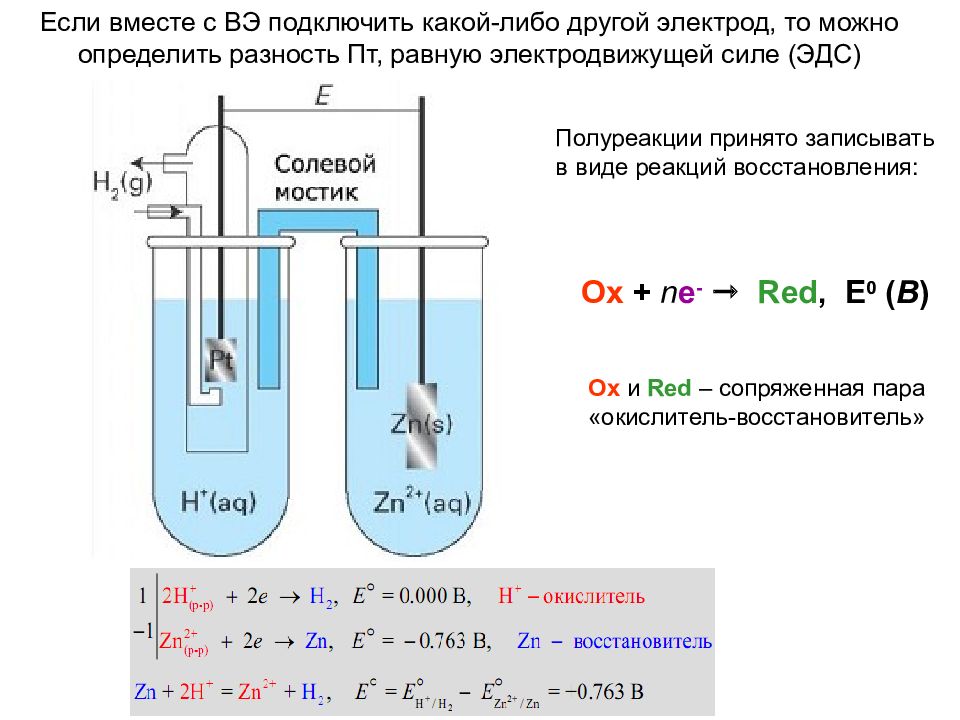
Однако ! Можно измерить разность потенциалов с каким-либо электродом сравнения ! Нормальным (стандартным) называют Пт растворения металла, погруженного в раствор собственной соли с концентрацией (активностью), равной 1 (моль экв)/л, измеренный относительно электрода сравнения, Пт которого условно принят равным 0. За такой электрод принят водородный электрод (ВЭ) Раствор H 2 SO 4 c C m = 2 N ( f = 0.5, a = 1). Электрод – Pt, покрытая Pt- чернью ( высокая Пв ) Поток газообразного водорода с p H2 = 1 атм 2H + + 2e - H 2
Слайд 30
Если вместе с ВЭ подключить какой-либо другой электрод, то можно определить разность Пт, равную электродвижущей силе (ЭДС) Ox + n e - Red, E 0 ( В ) Ox и Red – сопряженная пара «окислитель-восстановитель» Полуреакции принято записывать в виде реакций восстановления:
Слайд 31
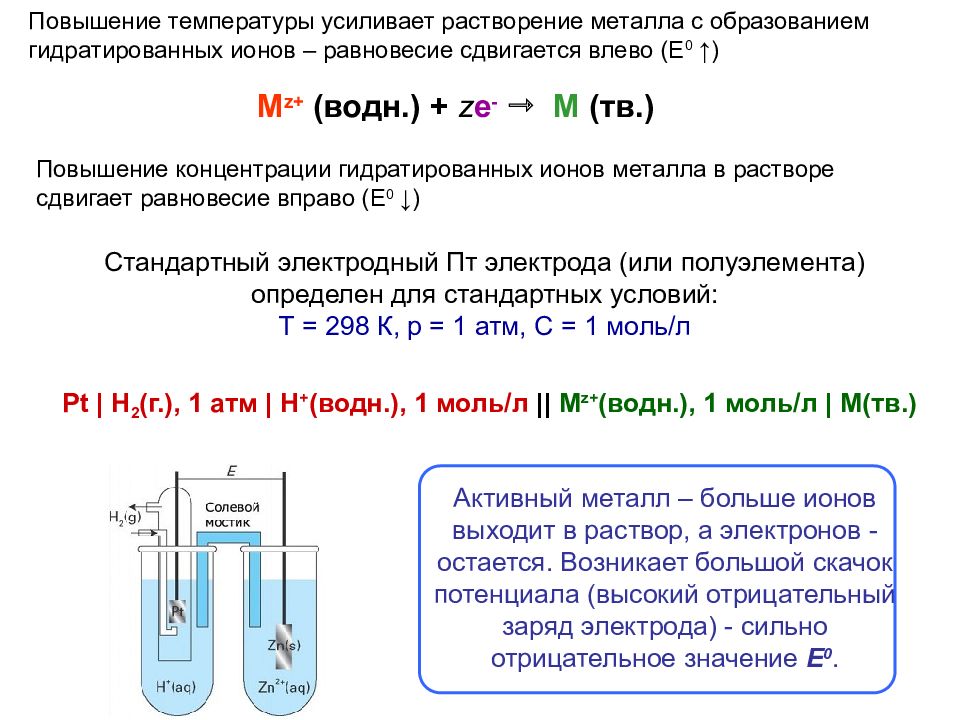
Стандартный электродный Пт электрода (или полуэлемента) определен для стандартных условий: Т = 298 К, р = 1 атм, С = 1 моль/л M z+ ( водн.) + z e - М ( тв. ) Активный металл – больше ионов выходит в раствор, а электронов - остается. Возникает большой скачок потенциала (высокий отрицательный заряд электрода) - сильно отрицательное значение Е 0. Повышение температуры усиливает растворение металла с образованием гидратированных ионов – равновесие сдвигается влево (Е 0 ↑ ) Повышение концентрации гидратированных ионов металла в растворе сдвигает равновесие вправо (Е 0 ↓) Pt | H 2 ( г. ), 1 атм | H + ( водн. ), 1 моль/л || M z+ ( водн. ), 1 моль/л | M( тв. )
Слайд 33
В растворе FeSO 4 Pt- электрод приобретает отрицательный заряд вследствие проявления восстановительной способности ионов Fe 2+ (при переходе их в Fe 3+ ). Окислительно - восстановительные электроды Их потенциал определяется не природой металла ( его в этом случае специально берут достаточно инертным по отношению к растворителю ), а редокс - свойствами ионов раствора. Например, Pt- электрод, опущенный в подкисленный раствор KMnO 4, заряжается положительно, теряя электроны за счет стремления MnO 4 − принять их при переходе в Mn 2+. ( Pt ) MnO 4 − / Mn 2+ ( Pt )Fe 3+ / Fe 2+
Слайд 34
Zn + Cu 2+ = Zn 2+ + Cu - состоит из двух металлических электродов: цинкового и медного При замыкании цепи произойдет реакция Zn – 2 e - = Zn 2+ Cu 2+ + 2 e - = Cu Zn – Red (анод) Cu 2+ - Ox (катод) Электродные процессы: Почему эта реакция самопроизвольно идет в прямом направлении?
Слайд 35
Количественная оценка окислительно-восстановительных реакций - Направление окислительно-восстановительных реакций? Из термодинамики мы знаем, что решить эти задачи можно с использованием свободной энергии Гиббса Δ G о - Глубину протекания окислительно-восстановительных реакций? Рассчитывать ∆ G в случае редокс-процессов проще по формуле: ∆ G = − nF · ∆ E Тогда ∆ G < 0 при ∆ E > 0 Как определить:
Слайд 36
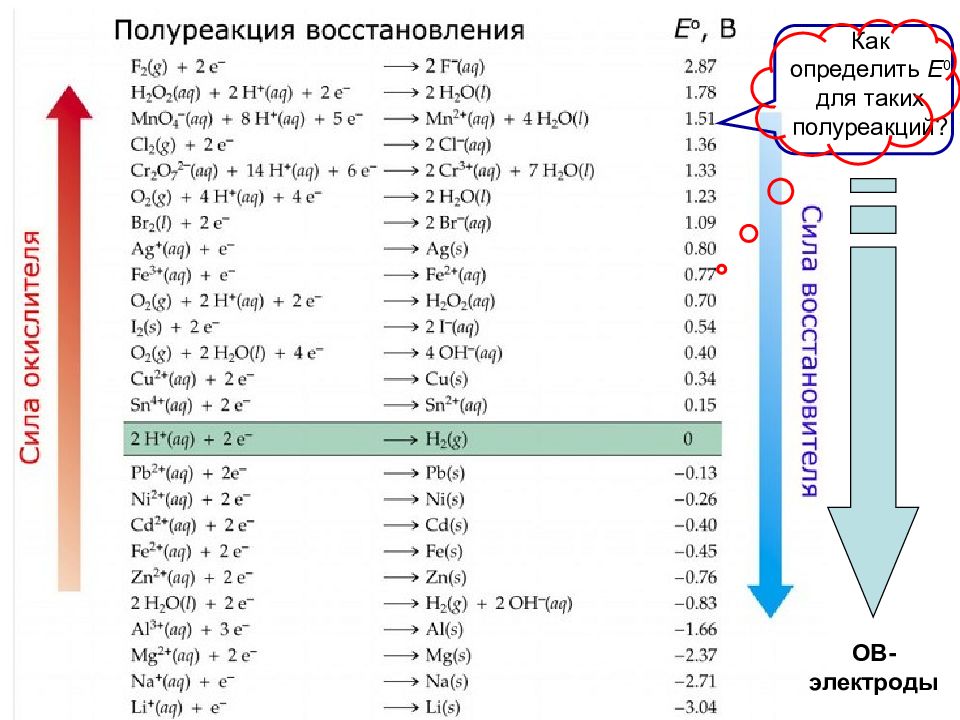
Т.е., для любой пары электрохимических систем чем больше стандартный Пт E 0 1 ( Ox 1 - сильный окислитель ), и чем меньше стандартный Пт E 0 2 ( Red 2 - сильный восстановитель), Это правило используется при подборе второго компонента ОВР для заданного окислителя (или восстановителя) при ст. у. тем больше разность Е 0 для пары Ox 1 / Red 2, и тем глубже будет протекать ОВР (∆G < 0 ) В элементе Даниэля–Якоби электроны самопроизвольно движутся от анода к катоду, т.е. от системы с низким Е 0 к системе с высоким Е 0 : Ox 1 + n e - Red 1, E 0 1 ( В ) Ox 2 + m e - Red 2, E 0 2 ( В ) -
Слайд 37
Пример: С помощью каких реагентов можно окислить в щелочной среде MnO 2 до MnO 4 - ? Находим электродный потенциал, характеризующий равновесие между MnO 2 и MnO 4 - в щелочной среде: MnO 2 + 4 ОН - - 3e - → MnO 4 - + 2 Н 2 О Е o = 0.60 B Окислителями по отношению к рассматриваемой системе могут быть СИСТЕМЫ с электродными потенциалами, превышающими 0.6 В. Пользуясь таблицей стандартных электродных потенциалов, можно предложить в качестве окислителей такие системы: S 2 O 8 2- + 2e - → 2SO 4 2- Е o = 2.01 B BrO - + Н 2 О + 2e - → Br - + 2 ОН - Е o = 0.76 B Cl 2 + 2e - → 2Cl - Е o = 1.36 B
Слайд 38
Следовательно, для окисления MnO 2 до MnO 4 - в щелочной среде можно использовать вещества: При этом будут протекать химические реакции: KBrO, K 2 S 2 O 8 или Cl 2 В реальных условиях реакция № 1 может протекать только до определенного предела ( Δ Е 0 < 0. 5 В ). Реакции № 2 и 3 идут «до конца» (равновесие сильно сдвинуто вправо). Δ E 0, B 0.16 1.41 0.76 № 1. 2. 3.
Слайд 39
Итак, при протекании ОВР система приближается к состоянию равновесия, при котором Δ G = 0 и Δ Е = 0. По мере протекания ОВР исходные вещества будут расходоваться, а продукты накапливаться ( если они не будут удаляться из сферы реакции ) При этом восстановительный потенциал окислителя будет уменьшаться, а потенциал восстановителя – увеличиваться (как будет показано далее), пока они не сравняются и не будет достигнуто состояние равновесия. Практический критерий возможности самопроизвольного протекания ОВ-реакции – Δ Е 0 > 0,5 В (что соответствует Δ G 0 < -50 кДж ) Поэтому ОВР между сопряженными парами, имеющими близкие значения Е 0, не может пройти "до конца". Например, для реакции Pb 2+ + Sn = Pb + Sn 2+ Δ Е 0 = 0,01 В ( Δ G 0 = -4 кДж ), равновесие установится при соизмеримых С Pb2+ и C Sn2+ в растворе. Если Ox или Red (или тот и другой) имеют несколько последовательных продуктов восстановления или окисления соответственно, то на какой стадии остановится ОВР ?
Слайд 40
Формы представления стандартных электродных потенциалов Диаграммы Фроста А.А. Фрост, 1951 г. США Диаграммы Латимера У.М. Латимер, 1938 -1952 г.г. США Диаграммы Пурбе М. Пурбе, 1963 г. Бельгия Линейное изображение потенциалов взаимоперехода Red-Ox форм цель: расчеты цель: наглядность График зависимости стандартного электродного потенциала от степени окисления Red-Ox форм График зависимости стандартного электродного потенциала от диапазона рН существования Red-Ox форм цель: наглядность
Слайд 41
Диаграммы Латимера MnO 4 − → MnO 4 2 − → MnO 2 → Mn 3+ → Mn 2+ → Mn 0 +0.564 B +2.26 B +0.95 B +1.51 B - 1.18 B Позволяют оценить термодинамическую устойчивость веществ в водном растворе ( рН = 0 – кислая среда и рН = 14 – щелочная среда) Обобщение количественных данных о стандартных электродных потенциалах ( Е о ) для конкретного элемента рН = 0 Пример: Диаграммы Латимера для марганца рН = 14 MnO 4 − → MnO 4 2 − → MnO 2 → Mn 2 О 3 → Mn (ОН) 2 → Mn 0 +0.564 B + 0.6 0 B +0. 1 5 B - 0. 23 B - 1. 56 B Форма в высшей максимальной степени окисления ( +7 ) СЛЕВА СПРАВА Форма в низшей минимальной степени окисления ( 0 ) +7 +7
Слайд 42
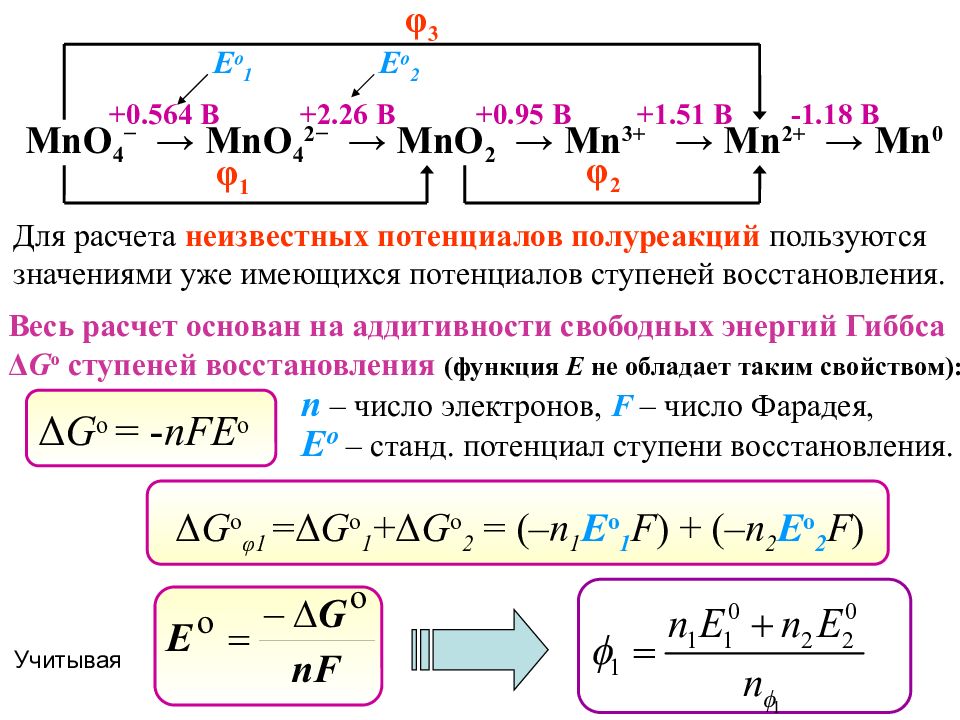
MnO 4 − → MnO 4 2 − → MnO 2 → Mn 3+ → Mn 2+ → Mn 0 +0.564 B +2.26 B +0.95 B +1.51 B -1.18 B Над стрелкой приводится табличное значение стандартного электродного потенциала ( Е о ) в расчете на один (!) электрон е _ В данной диаграмме запись означает, MnO 4 − → MnO 4 2 − +0.564 B что для полуреакции MnO 4 − + ē → MnO 4 2 − Mn 2+ → Mn 0 -1.18 B Запись означает, что для полуреакции Mn 2+ + 2 ē → Mn 0 , а для расчетов необходимо будет использовать
Слайд 43
MnO 4 − → MnO 4 2 − → MnO 2 → Mn 3+ → Mn 2+ → Mn 0 +0.564 B +2.26 B +0.95 B +1.51 B -1.18 B φ 1 φ 2 φ 3 Для расчета неизвестных потенциалов полуреакций пользуются значениями уже имеющихся потенциалов ступеней восстановления. Весь расчет основан на аддитивности свободных энергий Гиббса Δ G o ступеней восстановления (функция Е не обладает таким свойством): Δ G o = - nFE o n – число электронов, F – число Фарадея, E o – станд. потенциал ступени восстановления. Е o 1 Е o 2 Δ G o φ 1 = Δ G o 1 + Δ G o 2 = (– n 1 E o 1 F ) + ( – n 2 E o 2 F ) Учитывая
Слайд 44
MnO 4 − → MnO 4 2 − → MnO 2 → Mn 3+ → Mn 2+ → Mn 0 +0.564 B +2.26 B +0.95 B +1.51 B -1.18 B φ 1 o φ 2 o φ 3 o + 1. 70 B + 1.2 3 B + 1. 51 B Е o 1 Е o 2 1) MnO 4 − → MnO 4 2 − 2) MnO 4 2 − → MnO 2 +2 е _ +1 е _ Δ G o =(– n 1 E o 1 F )+( – n 2 E o 2 F )=(-1 ∙ 0.564 F ) +(-2 ∙ 2.26 F) = -5.088 F Дж MnO 4 − + 8H + + 5 e − → Mn 2+ + 4H 2 O φ 3 o = 1.51 В MnO 4 − + 4 H + + 3 e − → Mn О 2 + 2 H 2 O φ 1 o = 1. 70 В MnO 2 + 4 H + + 2 e − → Mn 2+ + 2 H 2 O φ 2 o = 1. 23 В
Слайд 45
MnO 4 − → MnO 4 2 − → MnO 2 → Mn 3+ → Mn 2+ → Mn 0 +0.564 B +2.26 B +0.95 B +1.51 B По диаграмме Латимера легко предсказать: 1) Формы, образование которых в данных условиях (кислая среда, рН=0) невозможно : - 1.18 B рН = 0 (кислая среда) процесс восстановление Mn 2+ до Mn 0 ( отрицательное значение потенциала ). Однако обратная реакция Mn 0 → Mn 2+ идет самопроизвольно (!) - 1.18 B (!)
Слайд 46
MnO 4 − → MnO 4 2 − → MnO 2 → Mn 3+ → Mn 2+ → Mn 0 +0.564 B +2.26 B +0.95 B +1.51 B - 1.18 B 2) Неустойчивые формы, склонные к диспропорционированию : рН = 0 По диаграмме Латимера легко предсказать: Как правило, значения потенциалов на всех диаграммах Латимера уменьшаются слева направо. Поэтому указанием на склонность данной частицы к диспропорционированию является нарушение монотонности УМЕНЬШЕНИЯ значений потенциалов
Слайд 47
MnO 4 − → MnO 4 2 − → MnO 2 → Mn 3+ → Mn 2+ → Mn 0 +0.564 B +2.26 B +0.95 B +1.51 B - 1.18 B рН = 0 Ион, подвергающийся диспропорционированию, выступает и в качестве окислителя (в диаграмме все формы слева направо, как правило – окислители ) и в качестве восстановителя (!) Чтобы выступить в качестве восстановителя – ( Δ Е о = Е о ок – Е о восст > 0 ), значение потенциала Е о над стрелкой справа на диаграмме Латимера должно быть БОЛЬШЕ, чем значение Е о слева (!) Диспропорционировать могут ионы MnO 4 2- и Mn 3+ ! 3 MnO 4 2 − + 4Н + → 2 MnO 4 − + MnO 2 + 2Н 2 О 2 Mn 3+ + 2Н 2 О → Mn 2+ + MnO 2 + 4Н + < <
Слайд 48
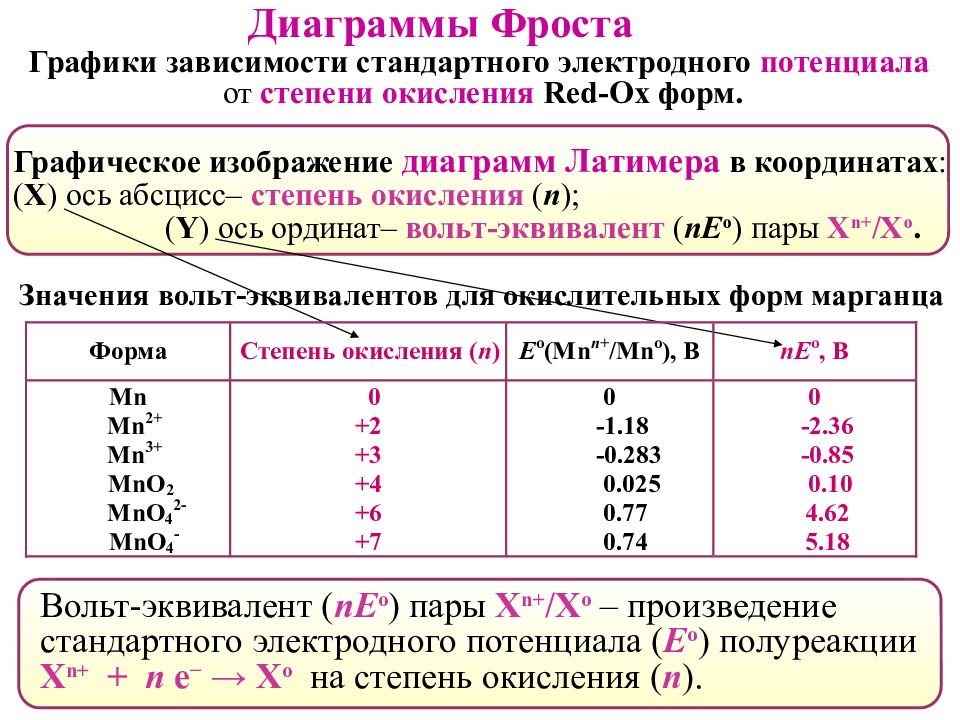
Диаграммы Фроста Графики зависимости стандартного электродного потенциала от степени окисления Red-Ox форм. Вольт-эквивалент ( nE о ) пары X n+ / X o – произведение стандартного электродного потенциала ( Е о ) полуреакции X n+ + n e − → X o на степень окисления ( n ). Графическое изображение диаграмм Латимера в координатах : ( Х ) ось абсцисс– степень окисления ( n ) ; ( Y ) ось ординат– вольт-эквивалент ( nE о ) пары X n+ / X o. Значения вольт-эквивалентов для окислительных форм марганца
Слайд 49
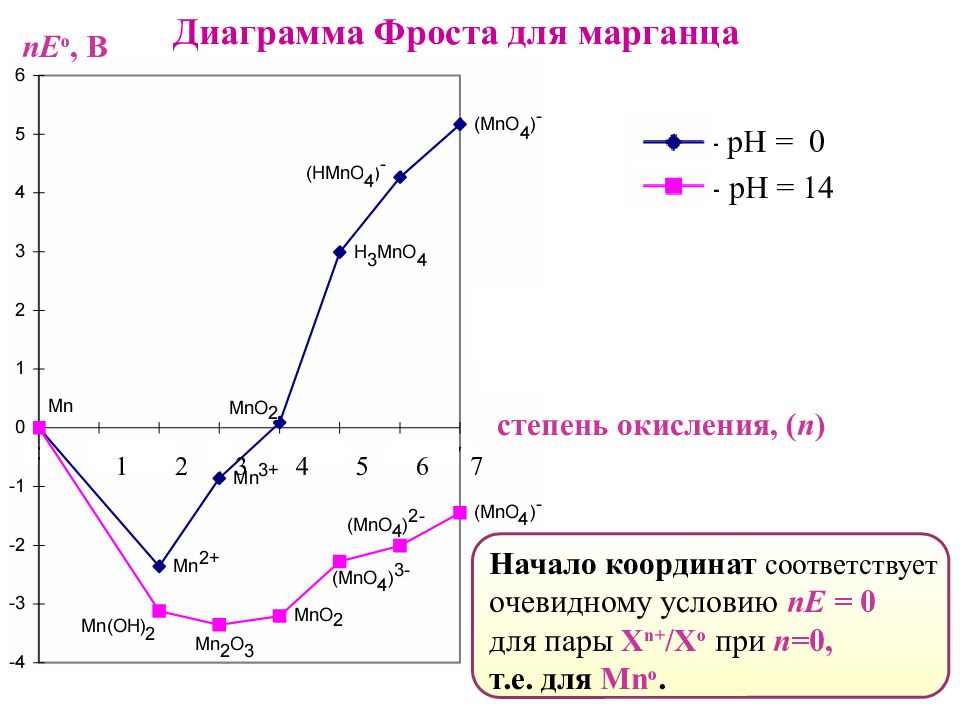
Диаграмма Фроста для марганца - рН = 0 - рН = 14 степень окисления, ( n ) 1 2 3 4 5 6 7 Начало координат соответствует очевидному условию nE = 0 для пары X n+ / X o при n =0, т.е. для Mn o. nE о, В
Слайд 50
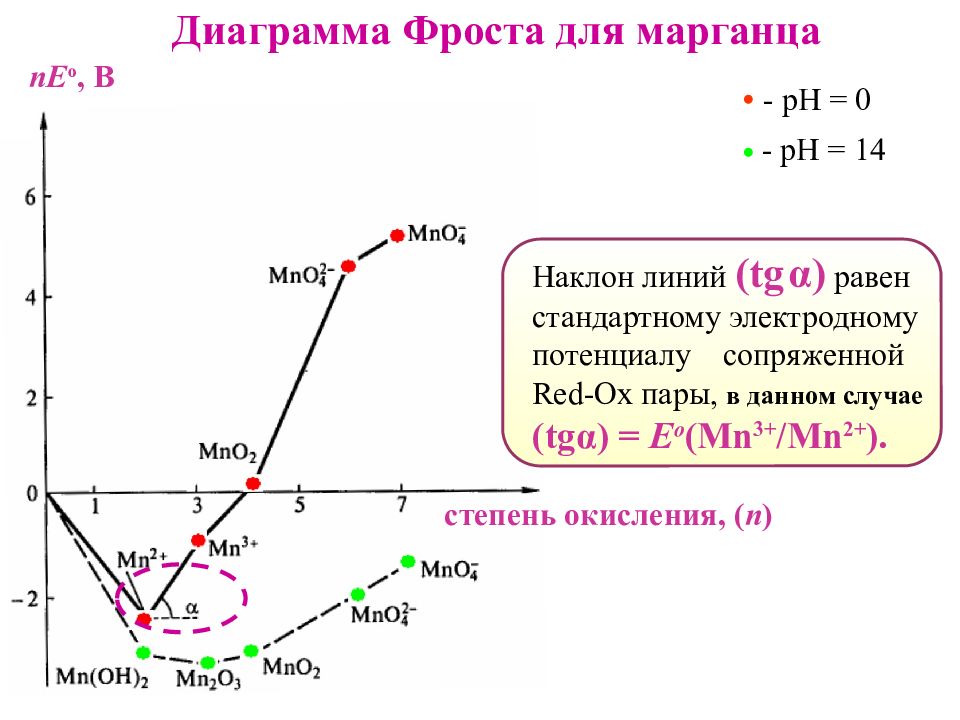
Диаграмма Фроста для марганца - рН = 0 - рН = 14 Наклон линий ( tg α ) равен стандартному электродному потенциалу сопряженной Red-Ox пары, в данном случае ( tg α ) = Е о ( Mn 3+ /Mn 2+ ). степень окисления, ( n ) nE о, В
Слайд 51
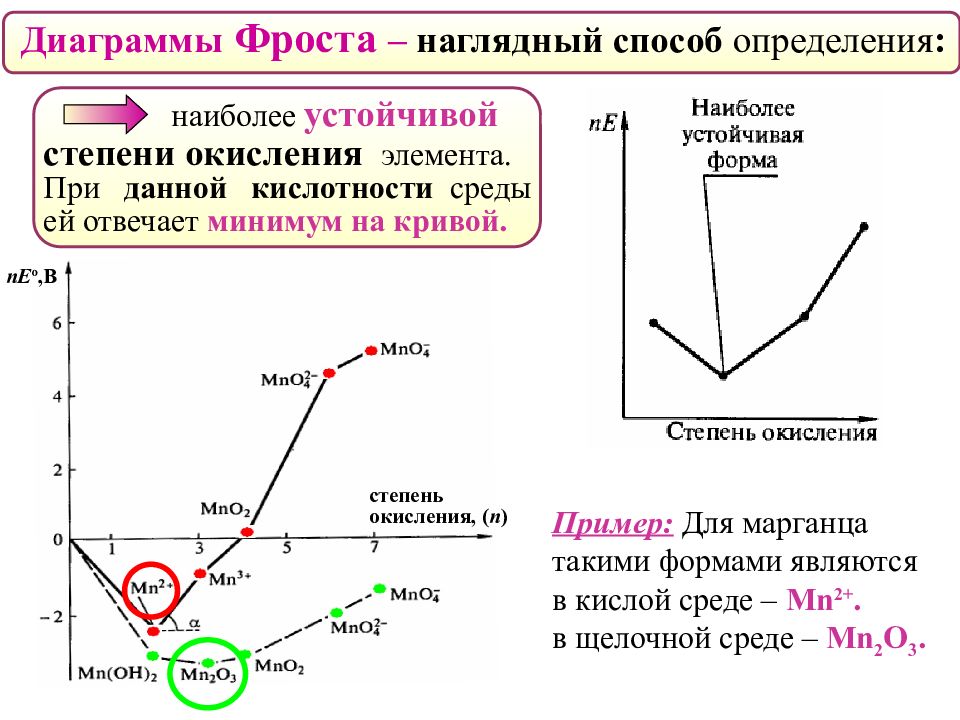
Диаграммы Фроста – наглядный способ определения : наиболее устойчивой степени окисления элемента. При данной кислотности среды ей отвечает минимум на кривой. Пример: Для марганца такими формами являются в кислой среде – Mn 2+. в щелочной среде – Mn 2 O 3. nE о,В степень окисления, ( n )
Слайд 52
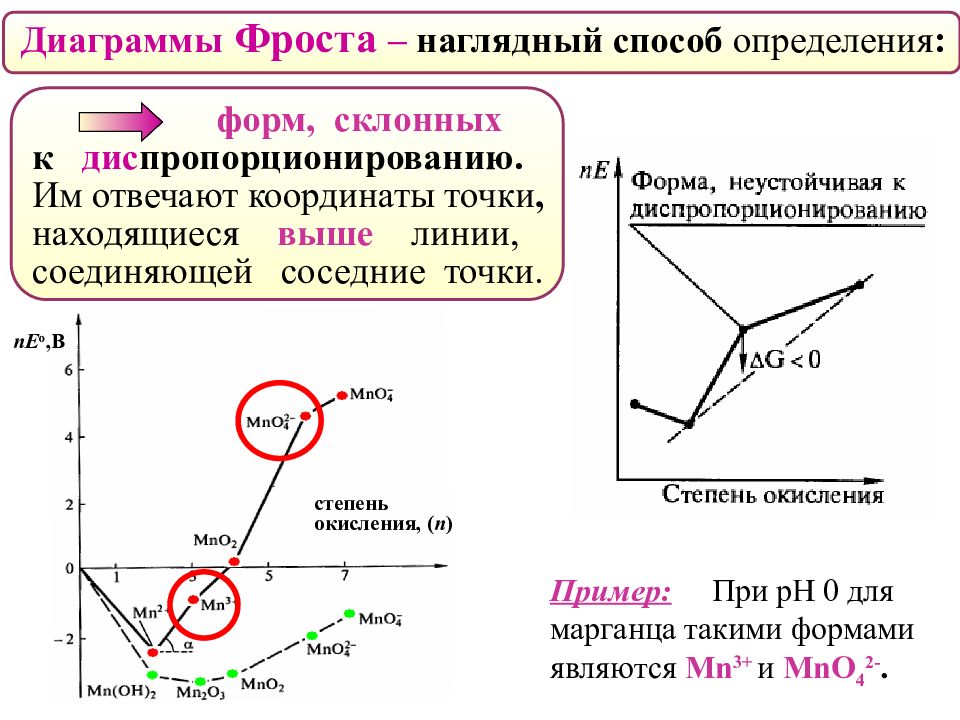
Диаграммы Фроста – наглядный способ определения : форм, склонных к дис пропорционированию. Им отвечают координаты точки, находящиеся выше линии, соединяющей соседние точки. Пример: При рН 0 для марганца такими формами являются Mn 3 + и MnO 4 2-. nE о,В степень окисления, ( n )
Слайд 53
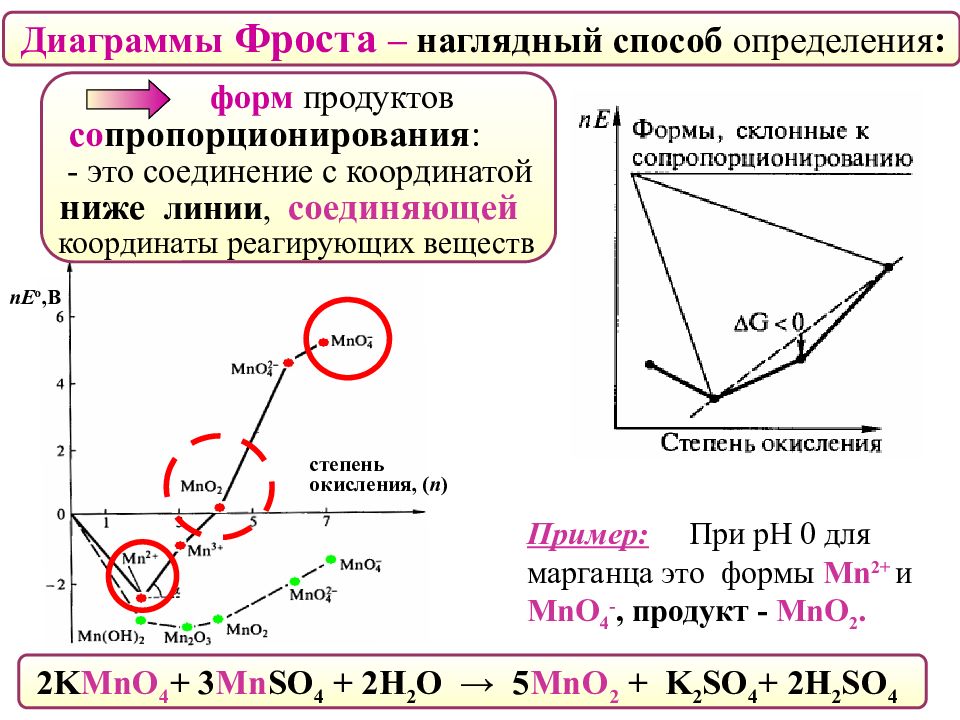
nE о,В степень окисления, ( n ) Диаграммы Фроста – наглядный способ определения : форм продуктов со пропорционирования : - это соединение с координатой ниже линии, соединяющей координаты реагирующих веществ 2 K MnO 4 + 3 Mn SO 4 + 2H 2 O → 5 MnO 2 + K 2 SO 4 + 2H 2 SO 4 Пример: При рН 0 для марганца это формы Mn 2 + и MnO 4 -, продукт - MnO 2.
Слайд 54
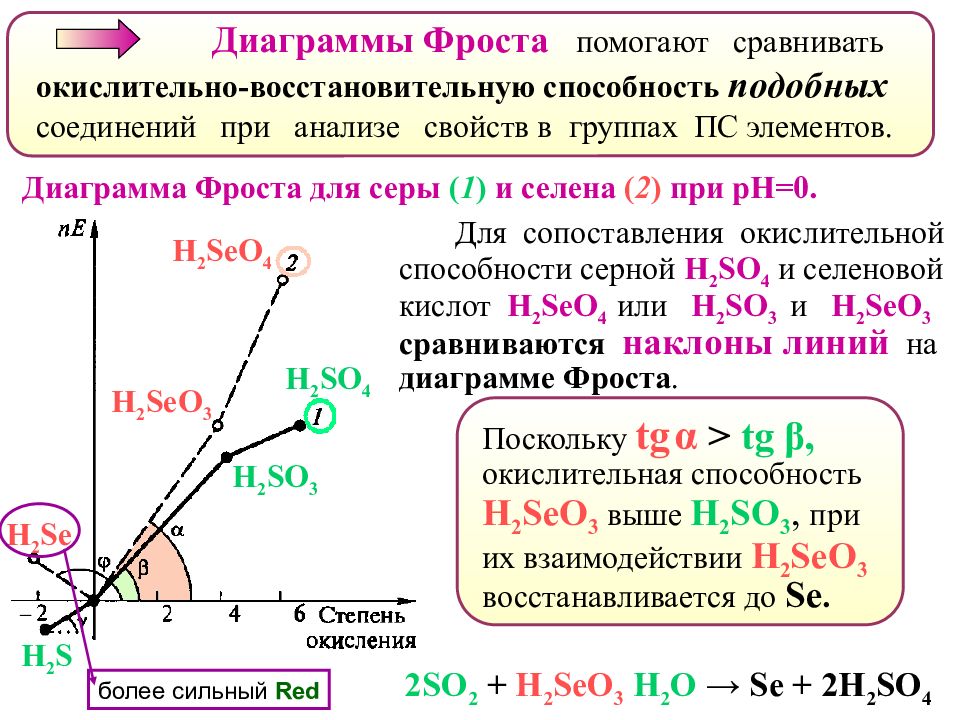
Диаграммы Фроста помогают сравнивать окислительно-восстановительную способность подобных соединений при анализе свойств в группах ПС элементов. Диаграмма Фроста для серы ( 1 ) и селена ( 2 ) при рН=0. Для сопоставления окислительной способности серной H 2 SO 4 и селеновой кислот H 2 SeO 4 или H 2 SO 3 и H 2 SeO 3 сравниваются наклоны линий на диаграмме Фроста. H 2 SO 4 H 2 SeO 4 H 2 SeO 3 H 2 SO 3 2 SO 2 + H 2 SeO 3 Н 2 О → Se + 2 Н 2 SO 4 Поскольку tg α > tg β, окислительная способность H 2 SeO 3 выше Н 2 SO 3, при их взаимодействии H 2 SeO 3 восстанавливается до Se. H 2 S H 2 Se более сильный Red
Слайд 55
График зависимости стандартного электродного потенциала от рН с учетом существования всех Red-Ox форм в растворе. - термодинамические диаграммы, - построены с помощью уравнения Нернста, - отражают взаимосвязь между фазами системы, линии ограничения представляют реакции между фазами, - позволяют определить продукты Red-Ox реакций при разных значениях рН среды. Диаграммы Пурбе – фазовые диаграммы.
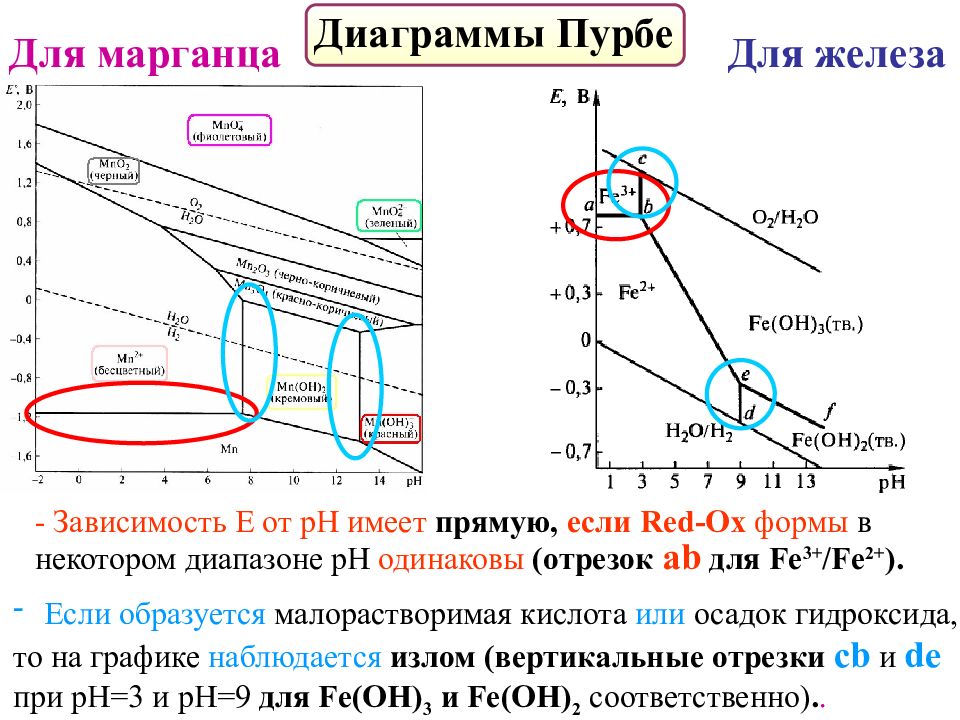
Слайд 56
Диаграммы Пурбе Для марганца Для железа - Зависимость Е от рН имеет прямую, если Red-Ox формы в некотором диапазоне рН одинаковы ( отрезок а b для Fe 3+ /Fe 2+ ). Если образуется малорастворимая кислота или осадок гидроксида, то на графике наблюдается излом ( вертикальные отрезки с b и de при рН=3 и рН=9 для Fe (ОН) 3 и Fe (ОН) 2 соответственно ).. .
Слайд 57
Н.Н.Бекетов рассматривал восстановительные возможности свободных металлов по отношению к растворенным солям других металлов, и по отношению к кислотам (вытеснение водорода). Оказалось, например, что протекают реакции Zn + CuSO 4 = ZnSO 4 + Cu Zn + Pb(NO 3 ) 2 = Zn(NO 3 ) 2 + Pb Pb + Cu(NO 3 ) 2 = Pb(NO 3 ) 2 + Cu а также: Zn + 2 H + = Zn 2+ + H 2 ↑ Pb + 2 H + = Pb 2+ + H 2 ↑ Из подобных наблюдений Бекетов создал ряд напряжений ( РН ) металлов Из экспериментов можно составить ряд: Zn... Pb... H... Cu Однако для активных металлов наблюдаются осложнения: ZnCl 2 + Mg + 2 H 2 O Zn(OH)Cl ↓ + Mg(OH)Cl ↓ + H 2 ↑ Наиболее объективная оценка относительной активности металлов м.б. получена методом изучения электродных Пт. Ряд напряжений металлов
Слайд 59
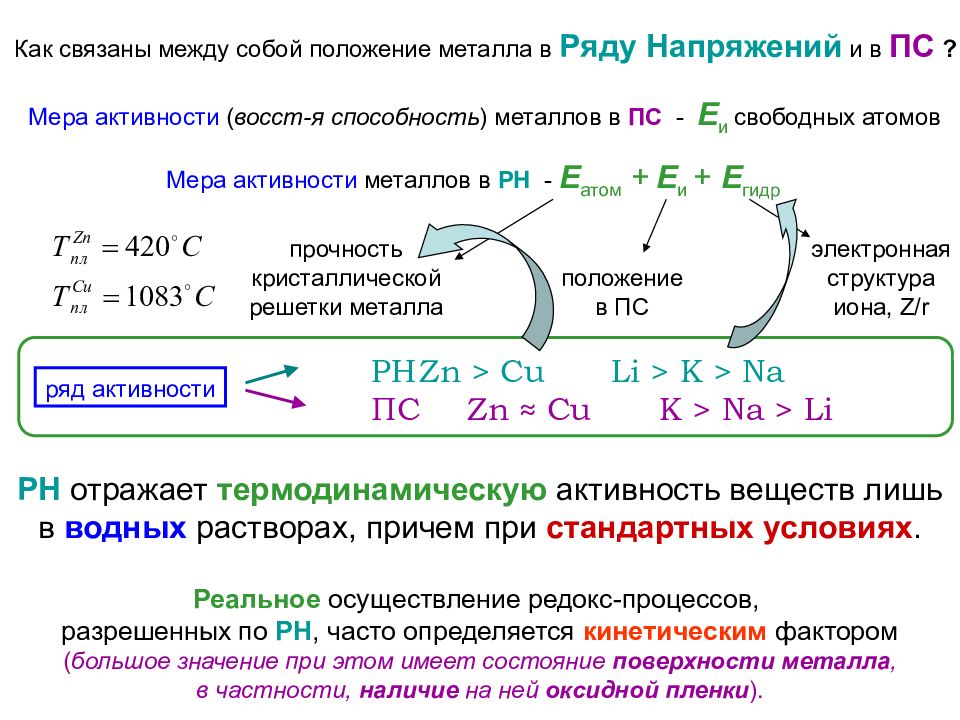
Как связаны между собой положение металла в Ряду Напряжений и в ПС ? Мера активности ( восст-я способность ) металлов в ПС - Е и свободных атомов Мера активности металлов в РН - Е атом + Е и + Е гидр прочность кристаллической решетки металла положение в ПС электронная структура иона, Z/r ряд активности РН Zn > Cu Li > K > Na ПС Zn ≈ Cu K > Na > Li Реальное осуществление редокс-процессов, разрешенных по РН, часто определяется кинетическим фактором ( большое значение при этом имеет состояние поверхности металла, в частности, наличие на ней оксидной пленки ). РН отражает термодинамическую активность веществ лишь в водных растворах, причем при стандартных условиях.
Слайд 60
В зависимости от положения в РН металлы делят на три условные группы Активные Средней активности Малоактивные Li - Al Al – (H 2 ) (H 2 ) - Au 2. Взаимодействие с водой: Активные Средней активности Малоактивные реагируют ( вытесняют Н 2 ) реагируют, пассивируются : ( Al, Ti, Cr, Fe, Co, Ni, Zn, Sn, Pb ) не реагируют Ca + H 2 O = Ca(OH) 2 + H 2 ↑ оксидные пленки на поверхности ! H + - окислитель Ca - восстановитель 1. Взаимное вытеснение металлов: Более активные металлы ( правее магния ) вытесняют менее активные (стоящие правее в РН ) из растворов их солей.
Слайд 61
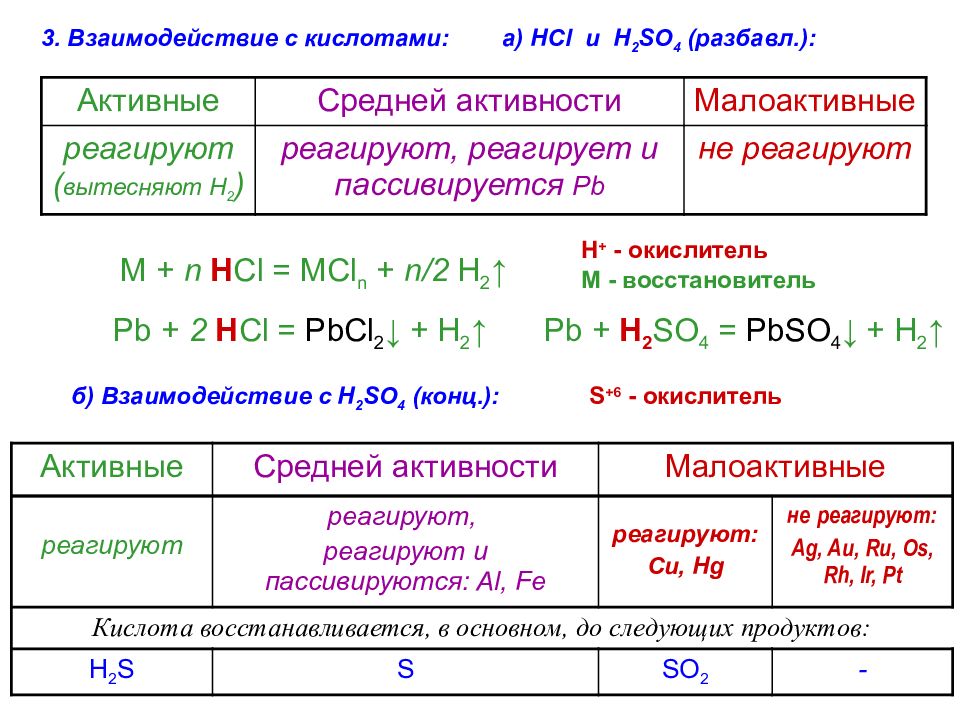
3. Взаимодействие с кислотами: а) HCl и H 2 SO 4 ( разбавл. ) : Активные Средней активности Малоактивные реагируют ( вытесняют Н 2 ) реагируют, реагирует и пассивируется Pb не реагируют M + n H Cl = MCl n + n/2 H 2 ↑ H + - окислитель М - восстановитель Pb + 2 H Cl = PbCl 2 ↓ + H 2 ↑ Pb + H 2 SO 4 = PbSO 4 ↓ + H 2 ↑ б) Взаимодействие с H 2 SO 4 ( конц. ) : Активные Средней активности Малоактивные реагируют реагируют, реагируют и пассивируются : Al, Fe реагируют : Cu, Hg не реагируют : Ag, Au, Ru, Os, Rh, Ir, Pt Кислота восстанавливается, в основном, до следующих продуктов: H 2 S S SO 2 - S + 6 - окислитель
Слайд 62
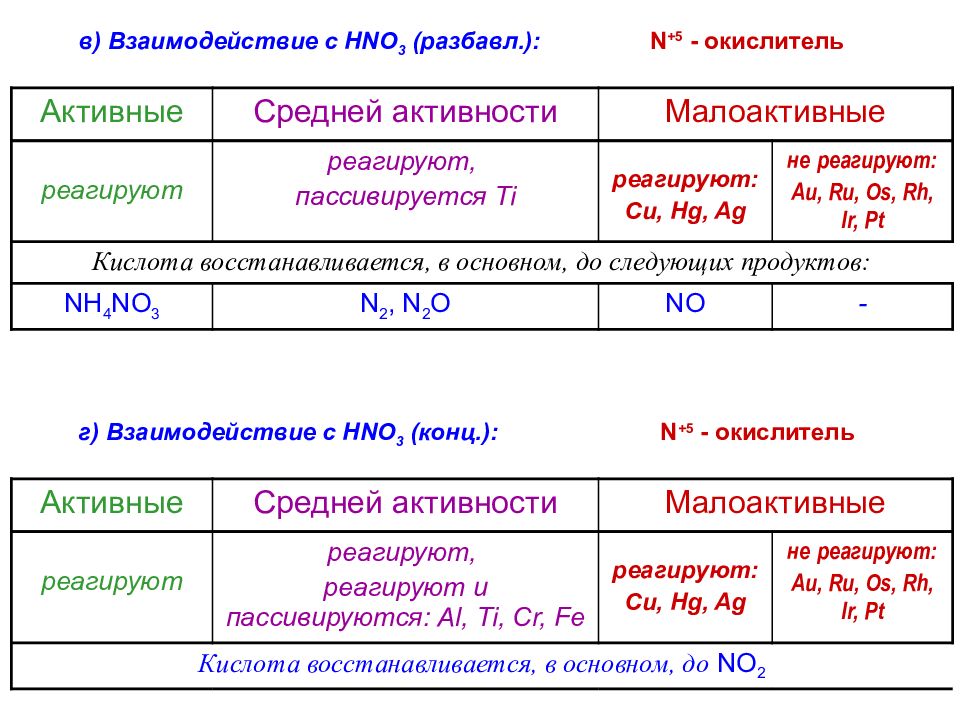
в) Взаимодействие с HNO 3 ( разбавл. ) : Активные Средней активности Малоактивные реагируют реагируют, пассивируется Ti реагируют : Cu, Hg, Ag не реагируют : Au, Ru, Os, Rh, Ir, Pt Кислота восстанавливается, в основном, до следующих продуктов: NH 4 NO 3 N 2, N 2 O NO - г) Взаимодействие с HNO 3 ( конц. ) : Активные Средней активности Малоактивные реагируют реагируют, реагируют и пассивируются : Al, Ti, Cr, Fe реагируют : Cu, Hg, Ag не реагируют : Au, Ru, Os, Rh, Ir, Pt Кислота восстанавливается, в основном, до NO 2 N + 5 - окислитель N + 5 - окислитель
Слайд 63
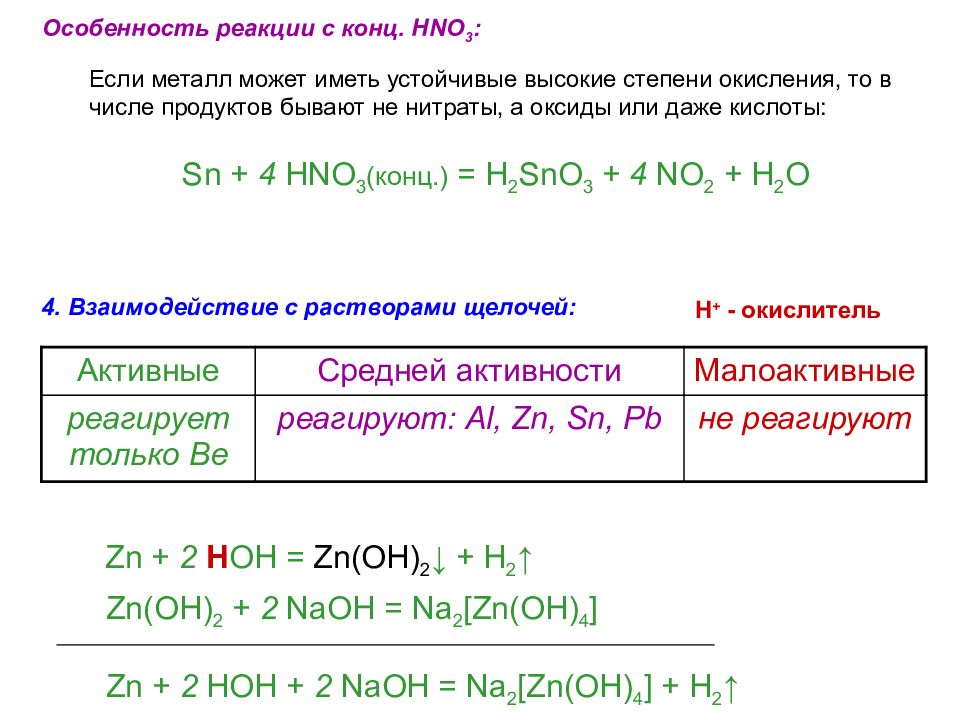
4. Взаимодействие с растворами щелочей: Активные Средней активности Малоактивные реагирует только Be реагируют : Al, Zn, Sn, Pb не реагируют H + - окислитель Zn + 2 H OH = Zn(OH) 2 ↓ + H 2 ↑ Zn(OH) 2 + 2 NaOH = Na 2 [Zn(OH) 4 ] Zn + 2 HOH + 2 NaOH = Na 2 [Zn(OH) 4 ] + H 2 ↑ Особенность реакции с конц. HNO 3 : Если металл может иметь устойчивые высокие степени окисления, то в числе продуктов бывают не нитраты, а оксиды или даже кислоты: Sn + 4 HNO 3 (конц.) = H 2 SnO 3 + 4 NO 2 + H 2 O
Слайд 64
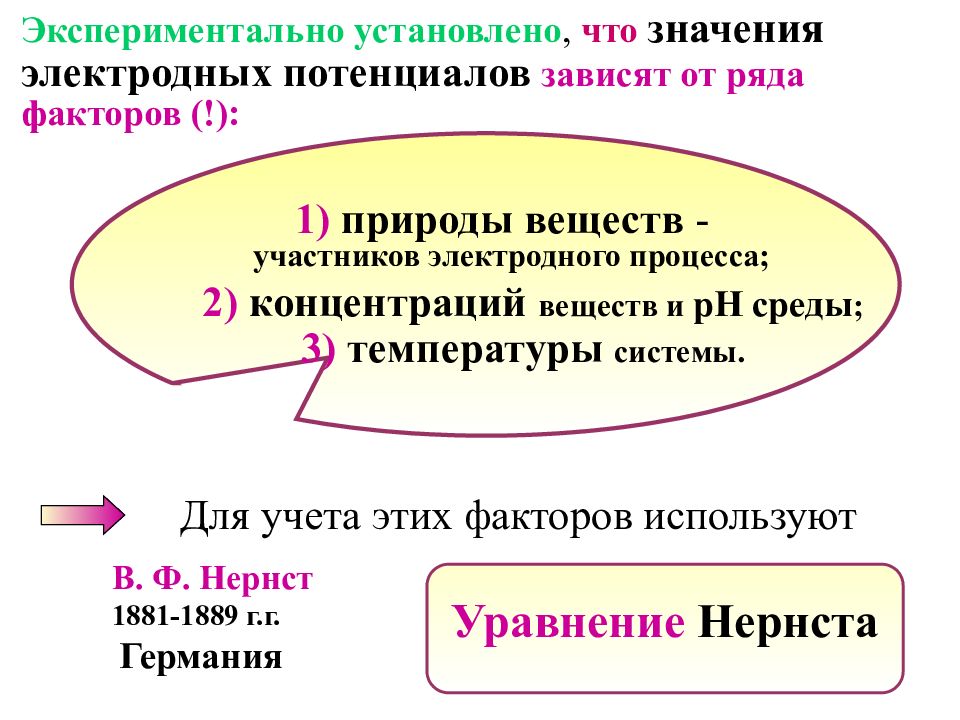
Экспериментально установлено, что значения электродных потенциалов зависят от ряда факторов (!): 1) природы веществ - участников электродного процесса; 2) концентраций веществ и рН среды ; 3) температуры системы. Уравнение Нернста В. Ф. Нернст 1 881-1889 г.г. Германия Для учета этих факторов используют
Слайд 65
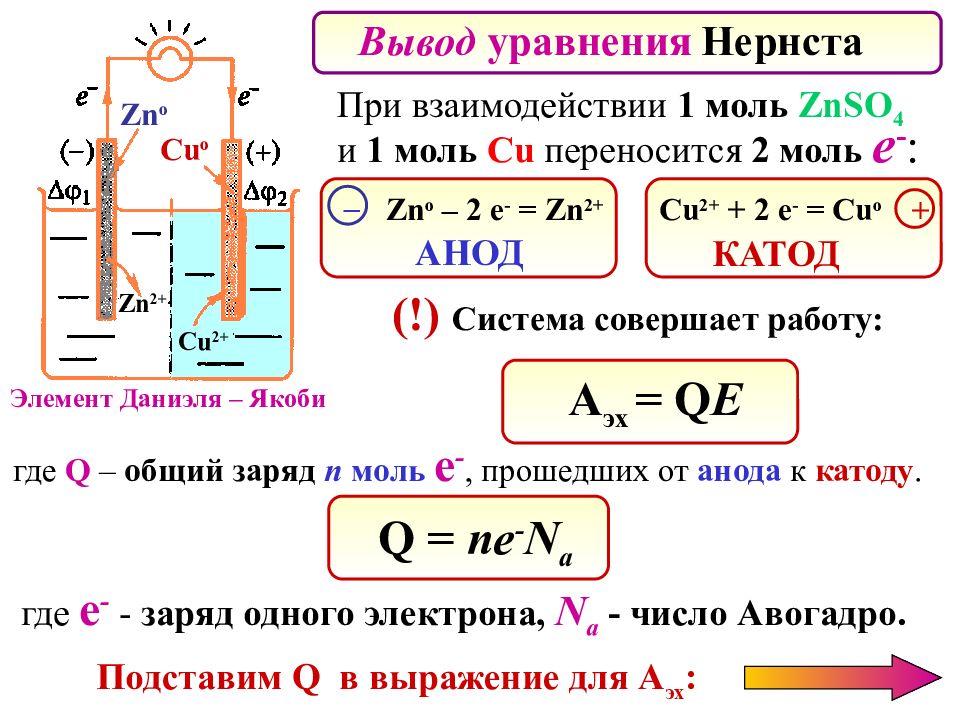
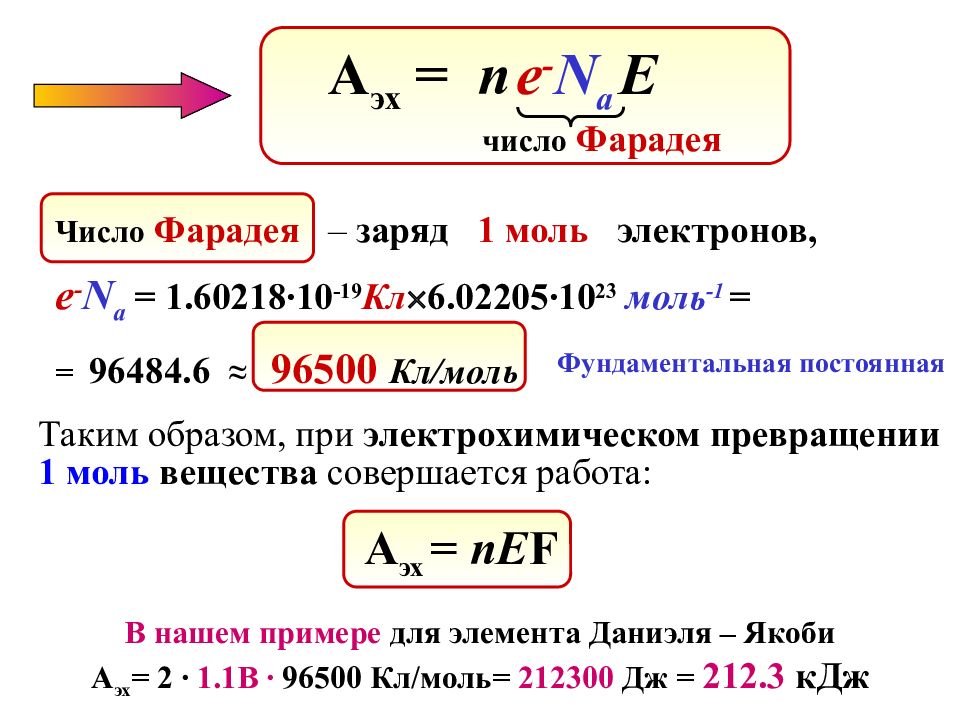
Вывод уравнения Нернста Элемент Даниэля – Якоби Zn 2+ Zn о Cu о Cu 2+ При взаимодействии 1 моль ZnSO 4 и 1 моль Cu переносится 2 моль e - : Zn o – 2 e - = Zn 2+ Cu 2+ + 2 e - = Cu o – + (!) Система совершает работу: А эх = Q E где Q – общий заряд n моль е -, прошедших от анода к катоду. КАТОД АНОД где е - - заряд одного электрона, N a - число Авогадро. Q = n е - N a Подставим Q в выражение для А эх :
Слайд 66
В нашем примере для элемента Даниэля – Якоби А эх = 2 ∙ 1.1B ∙ 96500 Кл/моль = 2123 00 Дж = 212. 3 кДж А эх = n е - N a E число Фарадея Число Фарадея – заряд 1 моль электронов, е - N a = 1.60218 ∙10 -19 Кл 6.02205 ∙10 23 моль -1 = = 96484.6 ≈ 96500 Кл/моль А эх = nE F Таким образом, при электрохимическом превращении 1 моль вещества совершается работа: Фундаментальная постоянная
Слайд 67
Энергия Гиббса Δ G o – это максимальная полезная работа, которую может совершать система ( при const T и Р ). В нашем случае это электрохимическая работа (над окружающей средой). Δ G o ≤ - А эх для неравновесных необратимых процессов. или Δ G o = - А эх для равновесных обратимых Red-Ox процессов, в которых отсутствуют др. виды работ, кроме работы расширения р Δ V. Δ G o = - n F E o Е характеризует глубину и направление протекания процесса, аналогично Δ G : 1) Е > 0, Δ G < 0 : « → » самопроизвольный процесс, протекает в прямом направлении ( см. гальванический элемент ). 2) Е < 0, Δ G > 0 : « ← » самопроизвольный процесс, протекает в обратном направлении, а для проведения реакции в прямом направлении необходимо приложить внешнюю ЭДС ( см. электролиз ). 3) Е = 0, Δ G = 0 : « » Red-Ox система находится в состоянии равновесия.
Слайд 68
Запишем уравнение изотермы Вант-Гоффа для расчета значения Δ G, отличного от Δ G o : Для Red-Ox реакции : аА + bB cC + dD где а - активности продуктов и реагентов в данных условиях ( р,Т ). Чтобы перейти к потенциалам, учитывая связь Δ G и Е, разделим обе части уравнения на - nF :
Слайд 69
или получим запись уравнения Нернста в форме, удобной для расчетов: Аналогичное выражение можно записать для любой полуреакции Red-Ox системы: Ox + n e - → Red Для активностей: Для концентраций: Учитывая, что при Т = 298 К ,
Слайд 70
Активность твердой фазы ( Fe o ) принимается постоянной. Пример 1: Записать уравнения Нернста для Red-Ox систем: 2) Sn 4+ + 2e - → Sn 2+ 1) Fe 2+ + 2e - → Fe о 3) Cr 2 O 7 2- + 14H + + 6 е - → 2Cr 3 + + 7H 2 O Активность воды принимается постоянной.
Слайд 71
Пример 2: Записать уравнение Нернста для водородного электрода: 2Н + + 2e - → Н 2 Потенциал водородного электрода E = - 0.059pH = 0 В (рН 0), = -0.41 В (рН 7), = -0.82 В (рН 14)
Слайд 72
Пример 3: Записать уравнение Нернста для процесса: О 2 + 4Н + + 4 e - → 2Н 2 О Потенциал кислородного электрода E = 1.228 - 0.059pH = 1.23 В (рН 0), = 0.8 1 В (рН 7), = 0.4 0 В (рН 14) [H 2 O] = const (вносим в Е 0 ) ; По закону Генри [O 2 ] = k p O 2 парц. При p O 2 парц. = 1 атм
Слайд 73
Окислительно - восстановительные свойства воды Устойчивость веществ в водном растворе В водном растворе не могут (!) существовать те вещества, которые вызывают восстановление или окисление воды. Термодинамическая неустойчивость вещества с данной OS в водном растворе может быть обусловлена: Способностью в кислой среде ( [ Н + ] = 1 моль/л, рН = 0 ) восстанавливать катионы водорода: или в щелочной среде ( [ Н + ] =10 -14 моль/л, [OH - ] = 1 моль/л, рН=14 ) восстанавливать водород воды: 2Н + + 2 е - → Н 2 E o = 0. 000 B 2Н 2 О + 2 е - → Н 2 + 2ОН - E o = - 0. 828 B
Слайд 74
Ниже приведены примеры реакций с участием веществ, способных окислять или восстанавливать воду: Окисление: 4 K 2 FeO 4 + 10H 2 O → 8KOH + 4Fe(OH) 3 + 3O 2 4 KMnO 4 + 2H 2 O → 4MnO 2 + 4KOH + 3O 2 Восстановление: Si + 4KOH + H 2 O → K 2 SiO 3 + 2H 2 4 Fe ( O Н) 2 + O 2 + 2 H 2 O → 4Fe(OH) 3 2) Способностью в кислой среде окислять кислород (О -2 ) воды: или в щелочной среде окислять кислород (О -2 ) гидроксид-ионов: 2Н 2 О - 4 е - → О 2 + 4Н + E o = 1.229 B 4ОН - - 4 е - → О 2 + 2Н 2 О E o = 0.401 B
Слайд 75
Влияние комплексообразования на протекание окислительно - восстановительных реакций Комплексообразование практически ВСЕГДА (!) приводит к УМЕНЬШЕНИЮ электродного потенциала по сравнению с соответствующей Red -Ox системой без него. Это связано с тем, что комплекс образуется либо только на основе окисленной формы, либо, в случае образования комплекса обеими формами, комплекс на базе окисленной формы более устойчив. В результате наблюдается уменьшение активности и концентрации окисленной формы по сравнению с восстановленной формой и электродный потенциал системы снижается по сравнению с системой без комплексообразования.
Слайд 76
Примеры влияния комплексообразования на электродный потенциал электрохимических систем
Слайд 77
Zn + Cu 2+ = Zn 2+ + Cu Zn – 2 e - = Zn 2+ Cu 2+ + 2 e - = Cu Zn – Red (анод) Cu 2+ - Ox (катод) (в стандартных условиях: С = 1 моль/л, Т = 298К) Электродные процессы: Гальванический элемент Элемент Даниэля-Якоби Элемент Д.-Я. работает за счет снижения концентрации ионов меди и за счет растворения цинковой пластинки. Как следствие, в процессе работы ГЭ значение его э.д.с. постепенно снижается до нуля.
Слайд 78
Например, рассмотрим работу КГЭ на основе медных электродов: Концентрационный элемент (КГЭ) работает за счет разности концентраций (активностей) растворов двух электродов И природа твердой фазы электродов, и качественный состав их растворов могут быть одинаковы. Согласно формуле Нернста электрод с большей концентрацией Cu 2+ (С 2 ) имеет более положительный потенциал и, следовательно, является катодом. Поэтому при замыкании цепи электроны перетекают на него, вызывая химические процессы восстановления на катоде : (−)Cu | CuSO 4 || CuSO 4 | Cu(+) С 1 < С 2 Cu 2+ + 2e − → Cu (за счет чего С 2 снижается), и окисления на аноде : Cu − 2e − → Cu 2+ (за счет чего С 1 растет). е – КГЭ работает до выравнивания концентраций (активностей) ионов в жидких фазах электродов. Δ E = E 0 (Cu 2+ | Cu) + 0,029 lgС 2 − E 0 (Cu 2+ | Cu) − 0,029 lgС 1 = 0,029 lgС 2 /С 1 е – Δ E = E 0 (Cu 2+ | Cu) + 0,029 lg [ Сu 2+ ]
Слайд 79
Топливный элемент (электрохимический генератор) - ГЭ, в котором используется принцип подачи активных реагентов по мере их расходования, может работать долгое время, Здесь протекают следующие реакции: на катоде : O 2 + 2H 2 O + 4e − → 4OH − ; на аноде : 2H 2 + 4OH − → 4H 2 O + 4e −. При работе данного элемента значение к.п.д. значительно выше, чем при сжигании H 2 в O 2 с образованием пара.
Слайд 80
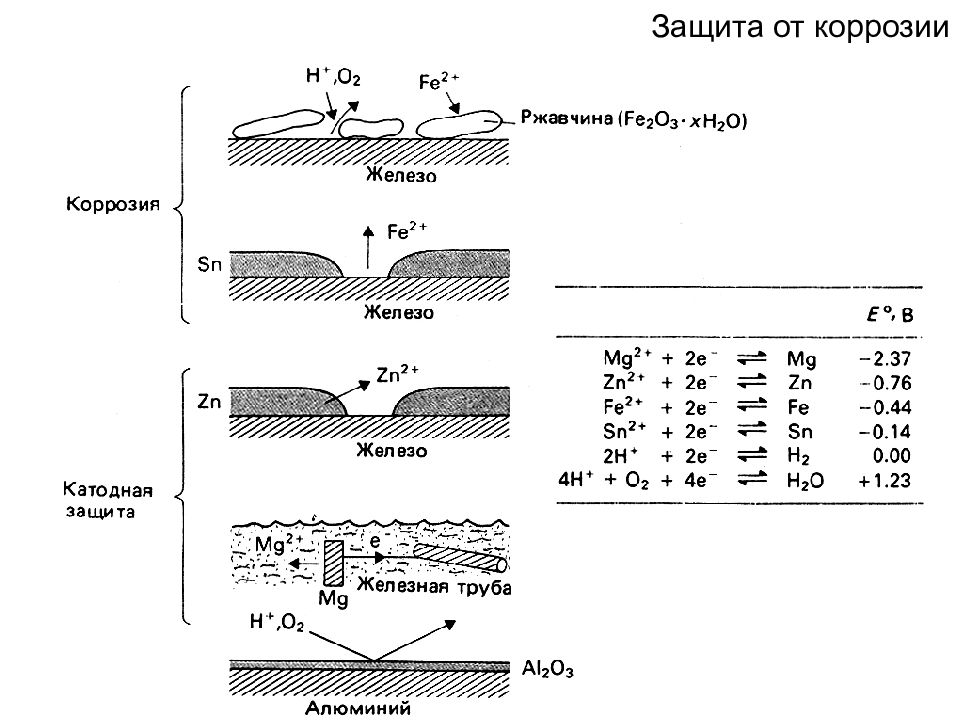
Коррозия металлов - самопроизвольное разрушение металлических материалов, происходящее под химическим воздействием окружающей среды Химическая коррозия – под действием газов или растворов неэлектролитов Fe + O 2 → FeO + Fe 2 O 3 + Fe 3 O 4 - «окалина» Fe 3 С + O 2 → Fe + CO 2 - «обезуглероживание Пв» Fe 3 С + H 2 → Fe + CH 4 - «водородная хрупкость» стали Способы защиты от газовой коррозии: Легирование металлов Создание защитных покрытий Замена агрессивной газовой атмосферы Более распространена коррозия в воде и водных растворах электролитов -
Слайд 81
Электрохимическая коррозия металлов Важнейшие окислители – растворенный кислород и ионы водорода По степени т/д неустойчивости металлы делят на 5 групп (в соответствии с их положением в РН ) 1. Группа Ме повышенной т/д нестабильности - Пт ВЭ при рН 7 (Li … Fe) Окисляются водой даже в нейтральных средах (а также в кислых и от О 2 ) 2. Группа Ме т/д нестабильных - Пт ВЭ при рН 0 (Cd … W) Окисляться водой (рН 7) в нейтральных средах не могут, но неустойчивы в кислых средах и в любых средах в присутствии О 2
Слайд 82
3. Группа Ме промежуточной т/д стабильности - Пт О 2 при рН 7 (Bi … Rh) Устойчивы в любых кислых и нейтральных средах в отсутствие О 2 4. Группа Ме высокой т/д стабильности (Hg, Pd, Ir, Pt) Устойчивы в присутствии О 2 в нейтральных средах - Пт О 2 при рН 7 - Пт О 2 при рН 0 4. Металл полной т/д стабильности (Au) Золото не может быть окислено О 2 в любой среде - Пт О 2 при рН 0
Слайд 84
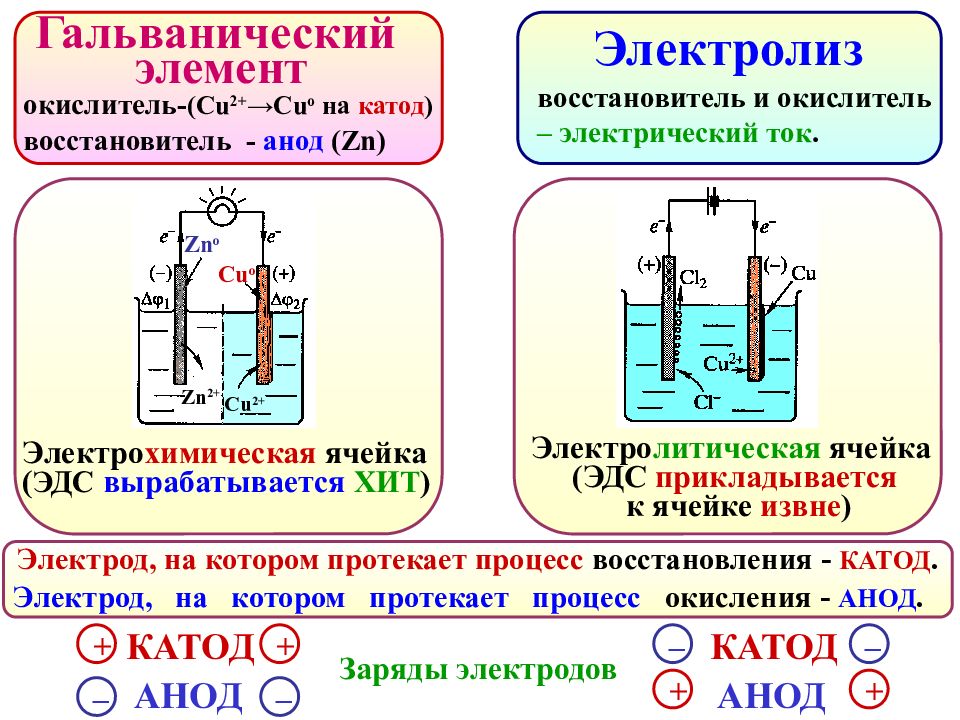
Гальванический элемент Электролиз Электрод, на котором протекает процесс окисления - АНОД. Электрод, на котором протекает процесс восстановления - КАТОД. восстановитель и окислитель – электрический ток. окислитель- ( Cu 2+ →С u о на катод ) восстановитель - анод (Zn) + – + КАТОД АНОД – + – + КАТОД АНОД – Zn 2+ Zn о Cu о Cu 2+ Заряды электродов Электро литическая ячейка (ЭДС прикладывается к ячейке извне ) Электро химическая ячейка ( ЭДС вырабатывается ХИТ )
Слайд 85
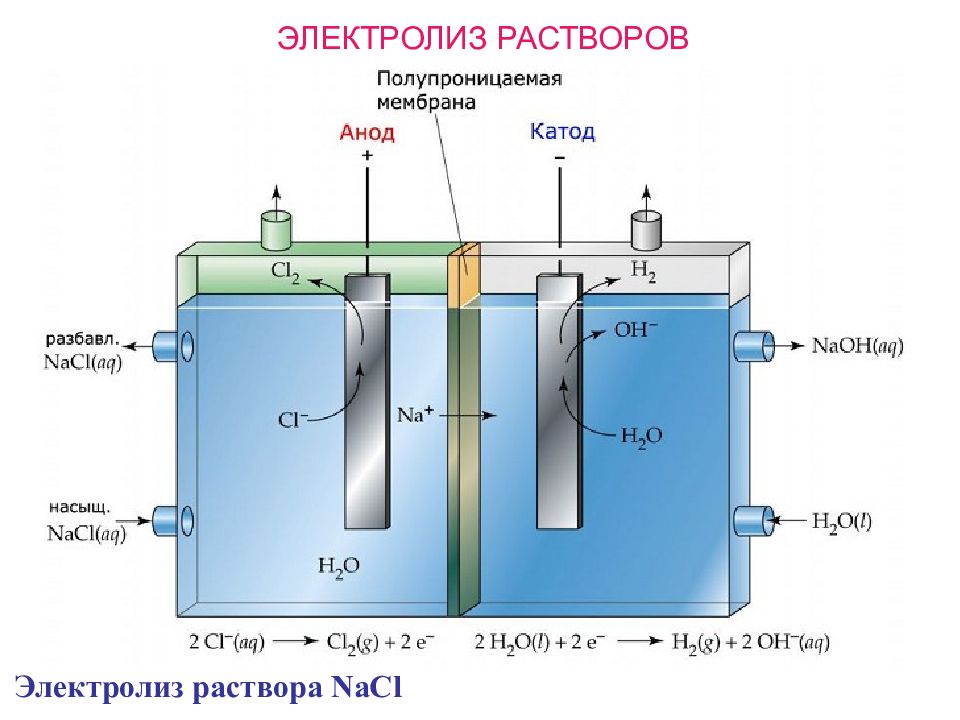
ЭЛЕКТРОЛИЗ Это окислительно-восстановительный процесс, протекающий на электродах при пропускании постоянного электрического тока через раствор или расплав электролита. Электроды : инертные (стержни из графита или платиновые Э.) растворимые (медные, железные, никелевые Э). При подключении к источнику тока, на электродах накапливаются противоположные заряды: КАТОД – отрицательно-заряженный электрод К(-) с избытком электронов (процесс восстановления ). АНОД – положительно-заряженный электрод А(+) с дефицитом электронов (процесс окисления ). На катоде в первую очередь восстанавливаются ионы, имеющие НАИБОЛЬШЕЕ значение электродного потенциала. На аноде в первую очередь окисляются ионы, имеющие НАИМЕНЬШЕЕ значение электродного потенциала.
Слайд 86
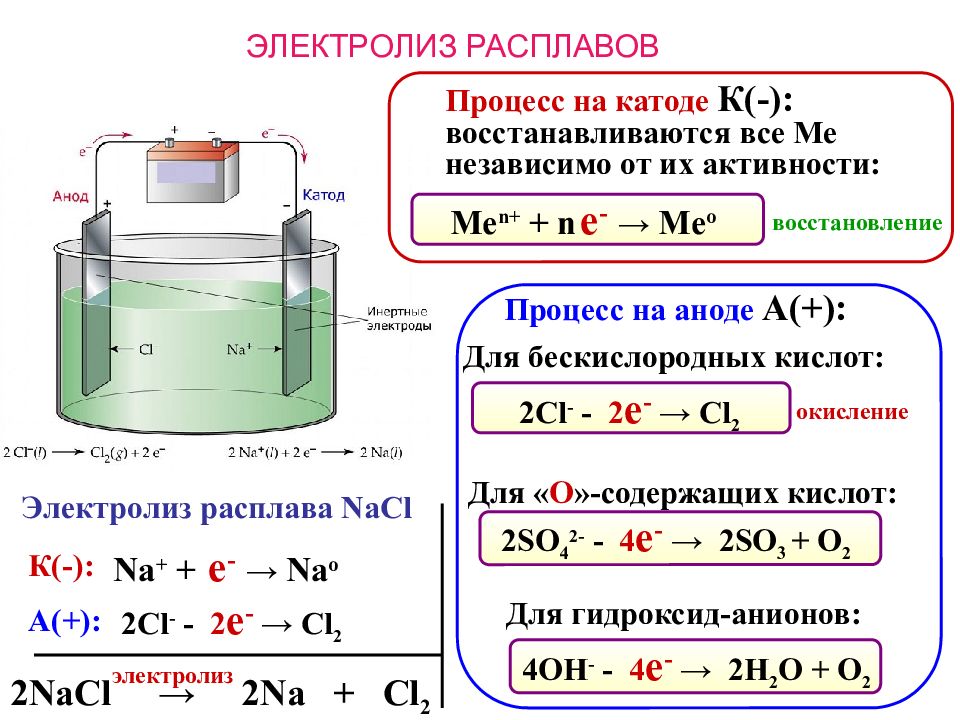
ЭЛЕКТРОЛИЗ РАСПЛАВОВ Процесс на катоде К(-): восстанавливаются все Ме независимо от их активности: Электролиз расплава NaCl восстановление Me n + + n е - → Me o 2NaCl → 2Na + Cl 2 Процесс на аноде А(+): электролиз Для бескислородных кислот: К(-): А(+): Na + + е - → Na o 2 Cl - - 2 е - → Cl 2 окисление 2 Cl - - 2 е - → Cl 2 Для « О »-содержащих кислот: Для гидроксид-анионов: 2 SO 4 2- - 4 е - → 2 SO 3 + O 2 4OH - - 4 е - → 2 H 2 O + O 2
Слайд 88
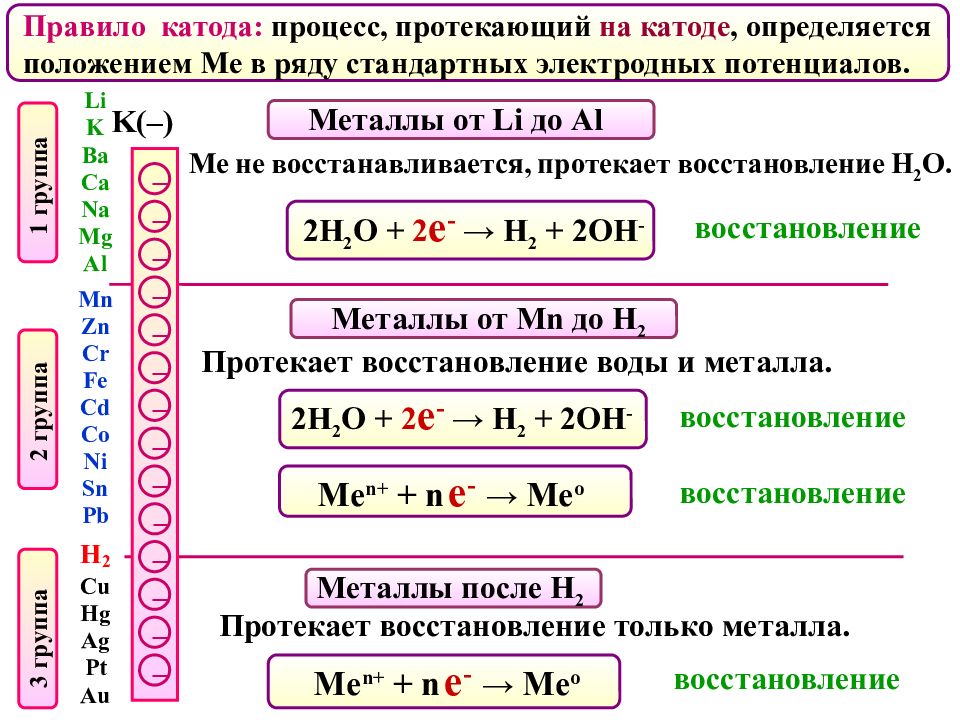
Правило катода: процесс, протекающий на катоде, определяется положением Ме в ряду стандартных электродных потенциалов. K(–) – – – – – – – – – – – – – – Металлы от Li до Al Металлы от Mn до H 2 Металлы после H 2 восстановление восстановление восстановление восстановление Ме не восстанавливается, протекает восстановление Н 2 О. 2Н 2 О + 2 е - → Н 2 + 2ОН - Протекает восстановление воды и металла. Me n + + n е - → Me o Протекает восстановление только металла. 2Н 2 О + 2 е - → Н 2 + 2ОН - Me n + + n е - → Me o
Слайд 89
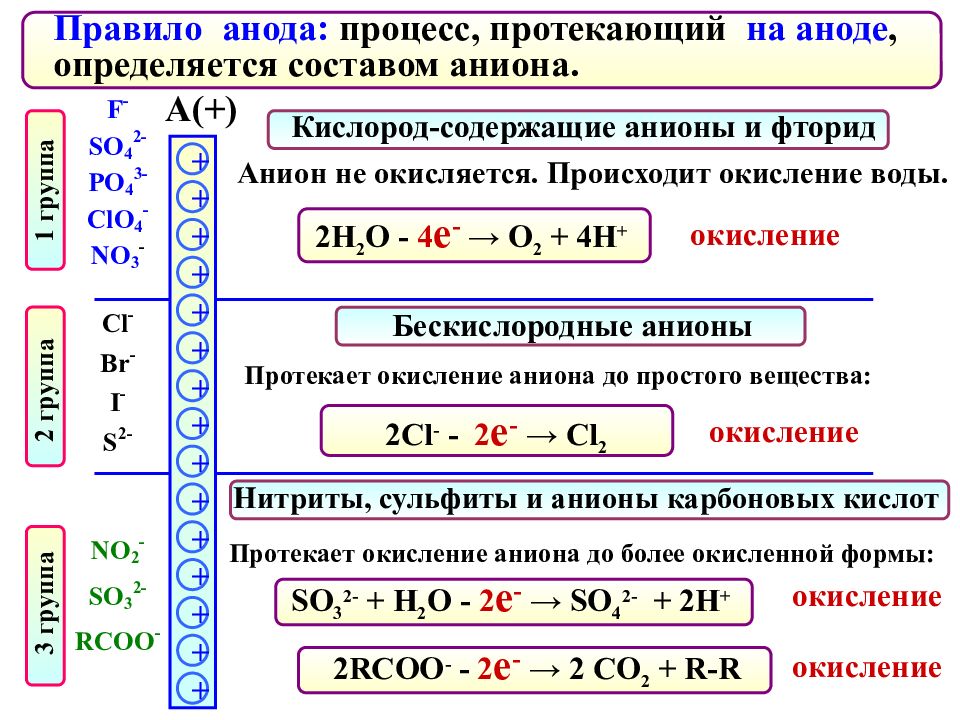
Правило анода: процесс, протекающий на аноде, определяется составом аниона. А ( + ) Бескислородные анионы Нитриты, сульфиты и анионы карбоновых кислот + + + + + + + + + + + + + + + Кислород-содержащие анионы и фторид 2Н 2 О - 4 е - → О 2 + 4Н + Протекает окисление аниона до более окисленной формы: Анион не окисляется. Происходит окисление воды. окисление Протекает окисление аниона до простого вещества: 2 Cl - - 2 е - → Cl 2 SO 3 2- + Н 2 О - 2 е - → SO 4 2 - + 2Н + 2RCOO - - 2 е - → 2 CO 2 + R-R окисление окисление окисление
Слайд 90
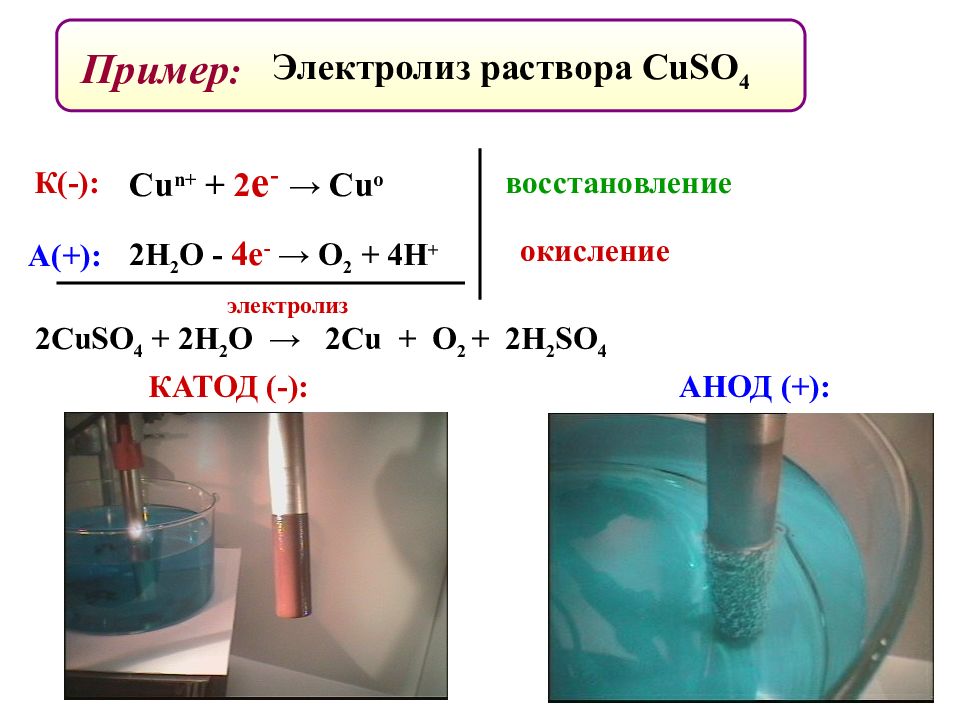
Пример : Электролиз раствора CuSO 4 КАТОД (-): АНОД (+): К(-): А(+): 2Н 2 О - 4е - → О 2 + 4Н + окисление восстановление Cu n + + 2 е - → Cu o 2CuSO 4 + 2H 2 O → 2Cu + O 2 + 2H 2 SO 4 электролиз
Слайд 91
Законы М. ФАРАДЕЯ ( XIX в.) ЭЛЕКТРОЛИЗ I. II. При электролизе различных химических соединений равные количества электричества приводят к электрохимическому превращению эквивалентных количеств веществ. Масса образующегося при электролизе вещества пропорциональна количеству прошедшего через раствор электричества. Первый и второй законы электролиза вместе описываются следующим выражением: где М(В) –эквивалентная масса вещества В, I - сила тока, t - время, F - число Фарадея