Первый слайд презентации: 1 0 - сынып
ПЕРИОД ЖӘНЕ ТОП БОЙЫНША ЭЛЕМЕНТТЕР ҚАСИЕТТЕРІНІҢ ӨЗГЕРУ ЗАҢДЫЛЫҚТАРЫ. 1-БӨЛІМ Химия
Слайд 2
Сабақ мақсат ы : Химиялық элемент атомдарының физикалық қасиеттерінің өзгеру заңдылықтарын сипаттау: атом радиусы, иондану энергиясы, электронтартқыштық, электртерістілік және тотығу дәрежесі.
Слайд 3
Химиялық элементтердің периодтық жүйесі – элементтердің әртүрлі қасиеттерінің атом ядросы зарядына тәуелділігін белгілейтін химиялық элементтердің жіктелу реті.
Слайд 4
Химиялық элементтердің атом ядросы сыртындағы электрондардың энергетикалық деңгейлерге бөлініп орналасу заңдылықтары: 1) Атомның электрондары энергиясына сай электрондық топтарға бөліп орналасады. Ядроға жақын қабатқа ең көп болғанда екі электрон, ал екінші қабатқа сегіз электрон орналасады. 2) Атомдардағы электрондық қабаттың саны сол элемент орналасқан периодтың нөміріне сәйкес, бұл периодтық кестедегі период нөмірінің физикалық мәні болып саналады.
Слайд 5
3) Ең сыртқы қабатта орналасқан электрондар ядромен нашар байланысқан, сол үшін олар қозғалғыш келеді. Бұл электрондар валенттік электрондар деп аталады, және сол элементтің қосылыстағы валенттілігін көрсетеді. Бір топта орналасқан элементтердің валенттілік электрондары бірдей және ол топ нөміріне тең. Бұл топ нөмірінің физикалық мәні. 4) Периодтарда сыртқы энергетикалық деңгей электрондармен толады, ең соңғы элементте сыртқы энергетикалық деңгей толып бітеді. Сол себепті соңғы топтағы элементтердің қасиеті салғырт.
Слайд 6
5) Бір периодтан келесі периодқа өткенде жаңа энергетикалық деңгей пайда болады. Бұл элементтер қасиетінің күрт секірмелі өзгерісіне әкеледі. 6) Элементтер қасиетінің периодты өзгеруі атомдардың сыртқы энергетикалық деңгейіндегі электрондар санының бірдей болуымен түсіндіріледі.
Слайд 7
Период – сілтілік металдан басталып, инертті газбен аяқталатын электрондық деңгейлер саны бірдей элементтердің көлденең қатары. Топ – ең сыртқы энергетикалық деңгейлеріндегі электрон сандары бірдей, қасиеттері біршама ұқсас элементтердің тік қатары. Табиғи ұяластар – химиялық қасиеттерінде ұқсастық болуына орай біріккен химиялық элементтер тобы. Металдар – электр тоғымен жылуды жақсы өткізетін, пластикалық қасиеті жоғары, жылтыр заттар. Мұндай қасиеттердің болуы металдардың ішкі құрылымымен байланысты.
Слайд 8
Электртерістілік – атомдардың өзіне электрон тарту қабілеті. Электртерістілік период бойынша солдан оңға қарай, ал топ бойынша төменнен жоғары қарай артады. Атомның периодты өзгеретін қасиеттері
Слайд 9
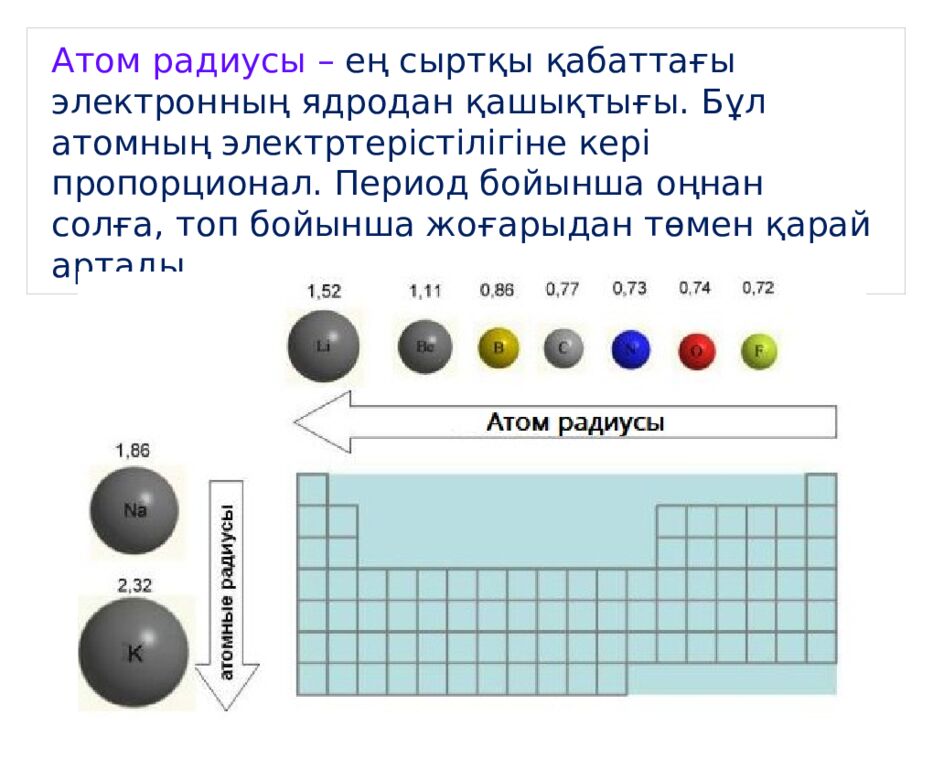
Атом радиусы – ең сыртқы қабаттағы электронның ядродан қашықтығы. Бұл атомның электртерістілігіне кері пропорционал. Период бойынша оңнан солға, топ бойынша жоғарыдан төмен қарай артады.
Слайд 10
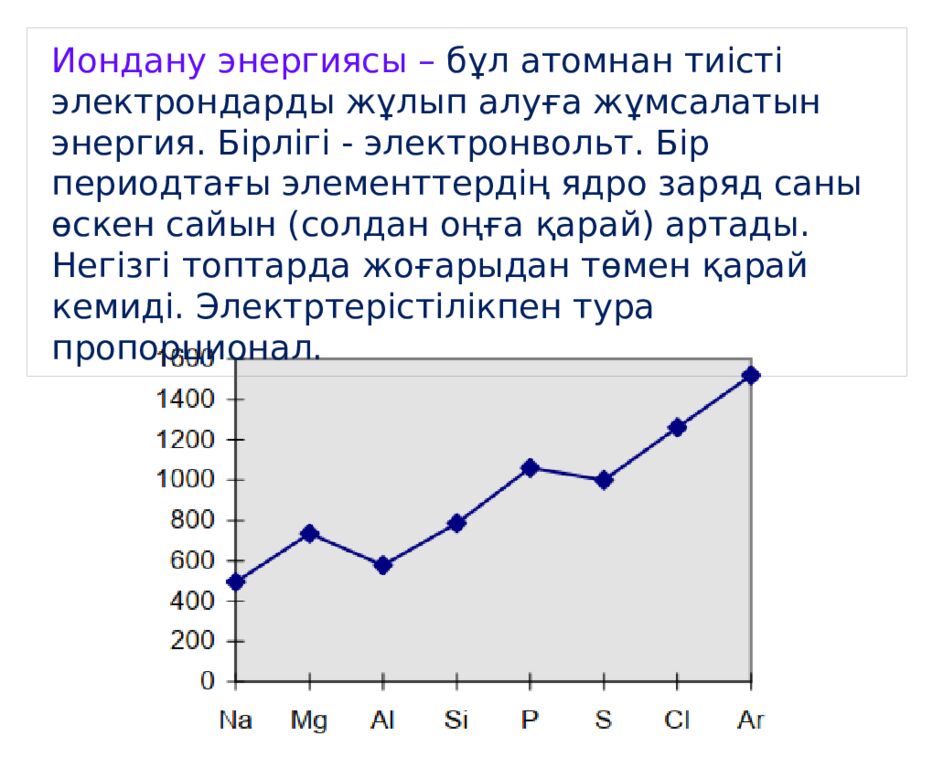
Иондану энергиясы – бұл атомнан тиісті электрондарды жұлып алуға жұмсалатын энергия. Бірлігі - электронвольт. Бір периодтағы элементтердің ядро заряд саны өскен сайын (солдан оңға қарай) артады. Негізгі топтарда жоғарыдан төмен қарай кемиді. Электртерістілікпен тура пропорционал.
Слайд 11
Металдық және бейметалдық – бейметалдық қасиет электртерістілігімен тура пропорционал. Элемент атомының электртерістілігі артқан сайын бейметалдық қасиет, кеміген сайын металдық қасиеті артады. Тотықтырғыштық және тотықсыздандырғыштық қасиет – тотықтырғыштық қасиет бейметалдықпен, тотықсыздандырғыштық металдық қасиетпен тура пропорционал. Яғни, металдық қасиет артқан сайын тотықсыздандырғыштық қасиет артады, бейметалдық қасиет артқан сайын тотықтырғыштық қасиет артады. Элемент жай заттарының периодты өзгеретін қасиеттері
Слайд 12
Күрделі заттардың қасиеті – қышқылдығы және негіздік қасиеті болып жіктеледі. Күрделі заттардың негіздік қасиеті металдық қасиетпен, қышқылдық қасиеті бейметалдық қасиетпен тура пропорционал. Элементтердің периодтық заңы – химиялық элементтердің атом, ядро, заряд саны (протон саны) артуына байланысты, элемент атомдарының қасиеті және олардан түзілетін жай және күрделі заттардың қасиеттерінің периодты түрде өзгеруі.