Первый слайд презентации
1 тарау. Жалпы химия 2 бөлім. Атом құрылысы Кванттық сандар. Материалдық дүниенің екі жақты табиғаты
Слайд 4
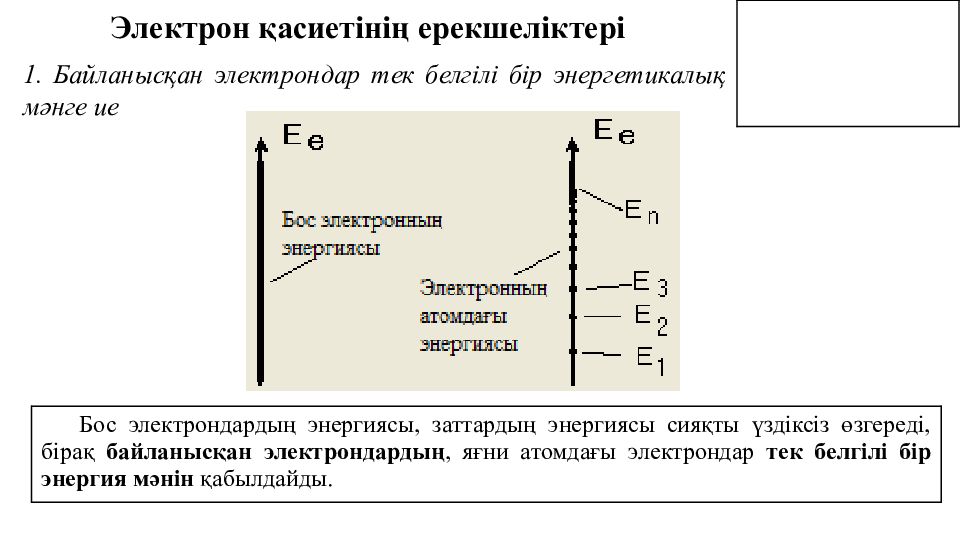
Электрон қасиетінің ерекшеліктері Бос электрондардың энергиясы, заттардың энергиясы сияқты үздіксіз өзгереді, бірақ байланысқан электрондардың, яғни атомдағы электрондар тек белгілі бір энергия мәнін қабылдайды. 1. Байланысқан электрондар тек белгілі бір энергетикалық мәнге ие
Слайд 5
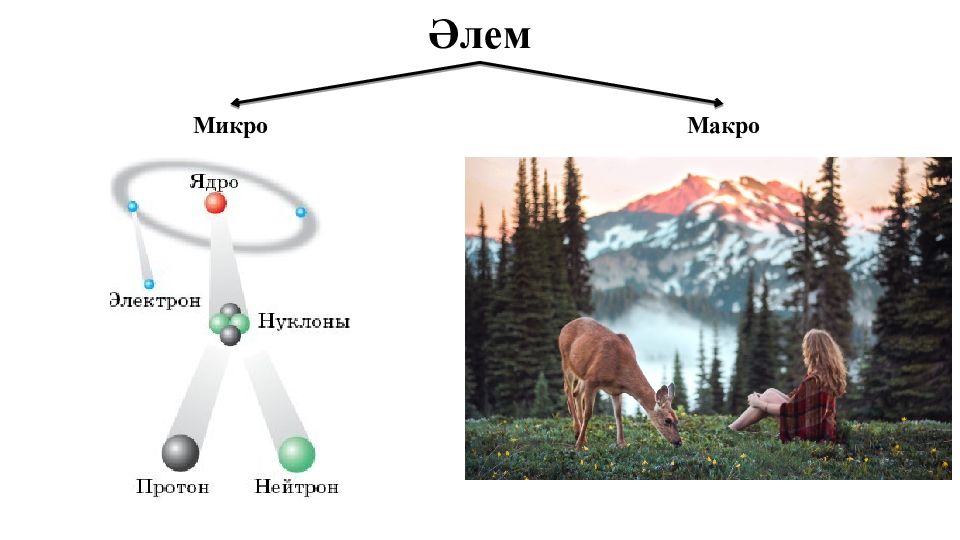
Материалды дүниенің екі жақты қасиеті Макс Планк 1858-1947 ж Альберт Эйнштейн 1879-1955 ж Луи де Бройль 1892-1987 ж Е = h Мұндағы Е – энергия, Һ –Планк тұрақтысы, 6,626*10 -34 Дж*с – тербеліс жиілігі; Е = mc 2
Слайд 6
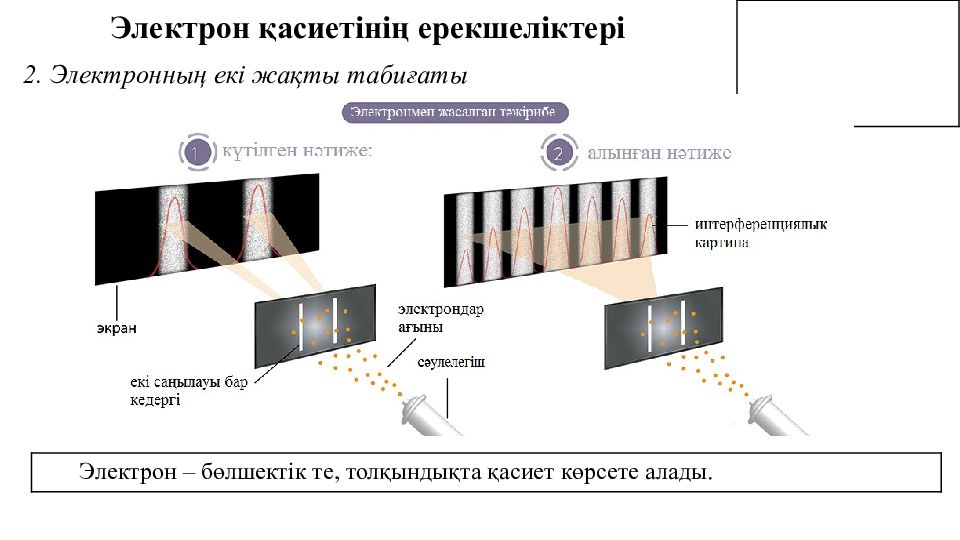
Электрон қасиетінің ерекшеліктері Электрон – бөлшектік те, толқындықта қасиет көрсете алады. 2. Электронның екі жақты табиғаты
Слайд 7
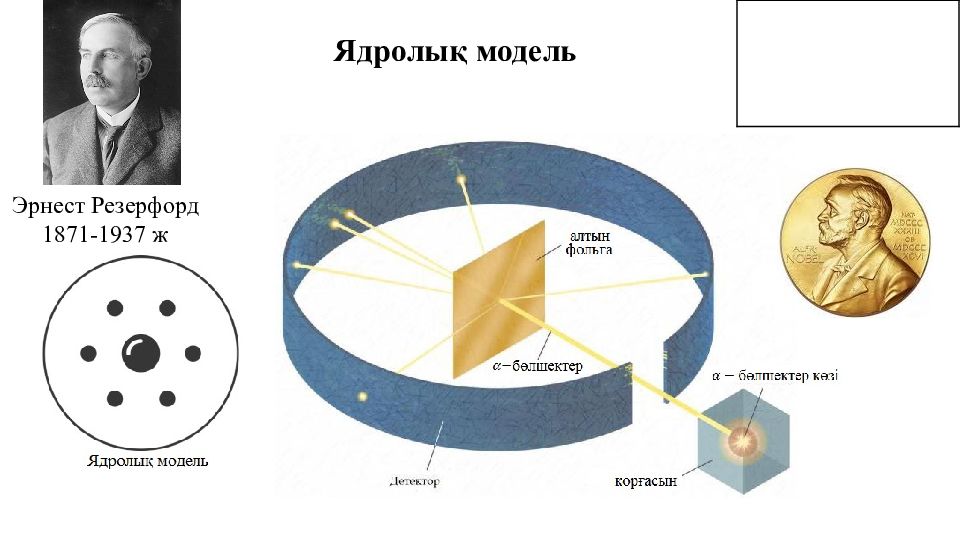
Эрвин Шредингер 1887-1961 ж Атом құрылысының қазіргі теориясы микробөлшектердің екі жақты табиғатын, яғни бөлшектік (корпускулалық) және толқындық табиғатын қоса алып түсіндіреді. Шредингер атомдағы электрондардың таралуын математикалық теңдеулер арқылы анықтады. Электрон бұлты электронның болу ықтималдығы ең жоғары аймақ. Электронның болу ықтималдылығы ең жоғары аймақты орбиталь деп атайды. Атом құрылысының қазіргі теориясы Вернер Гейзенберг 1901-1976 ж
Слайд 8
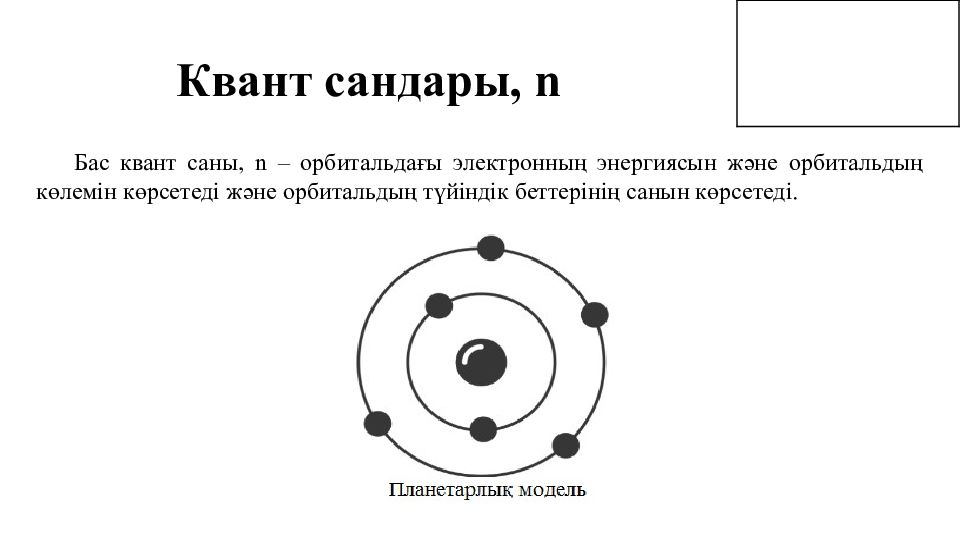
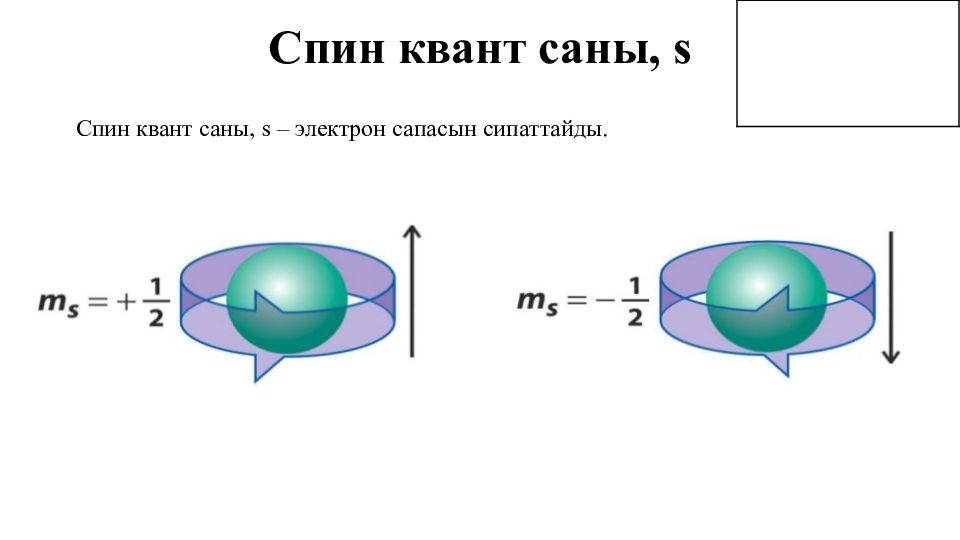
Квант сандары, n Бас квант саны, n – орбитальдағы электронның энергиясын және орбитальдың көлемін көрсетеді және орбитальдың түйіндік беттерінің санын көрсетеді.
Слайд 9
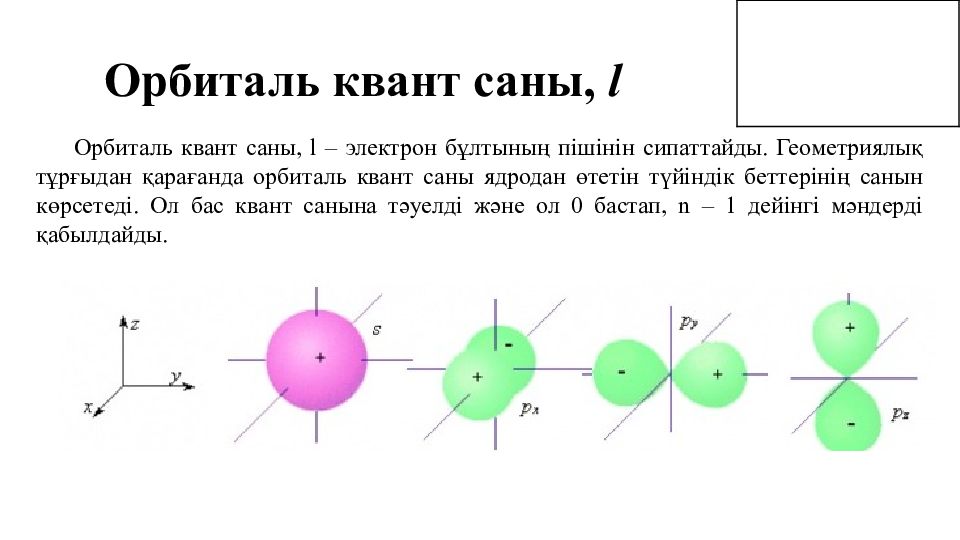
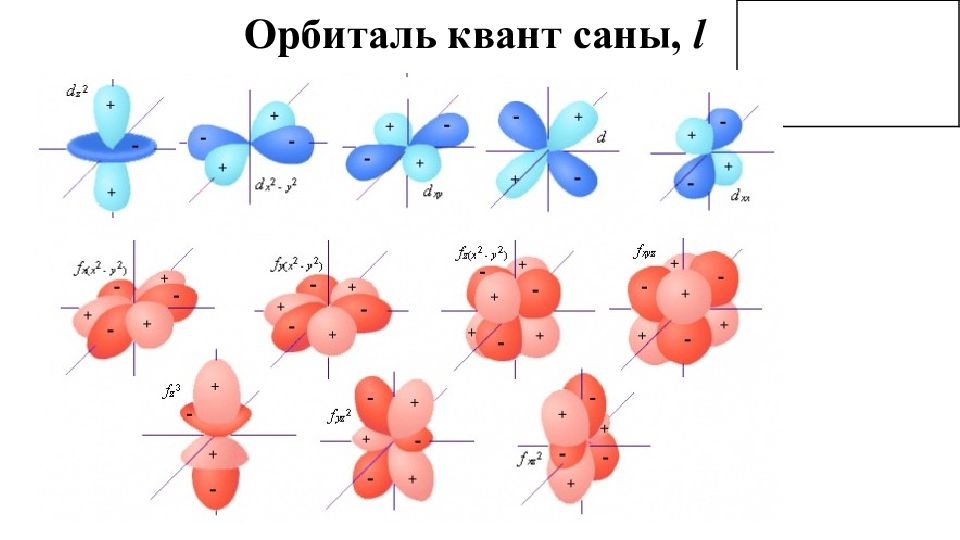
Орбиталь квант саны, l Орбиталь квант саны, l – электрон бұлтының пішінін сипаттайды. Геометриялық тұрғыдан қарағанда орбиталь квант саны ядродан өтетін түйіндік беттерінің санын көрсетеді. Ол бас квант санына тәуелді және ол 0 бастап, n – 1 дейінгі мәндерді қабылдайды.
Слайд 11
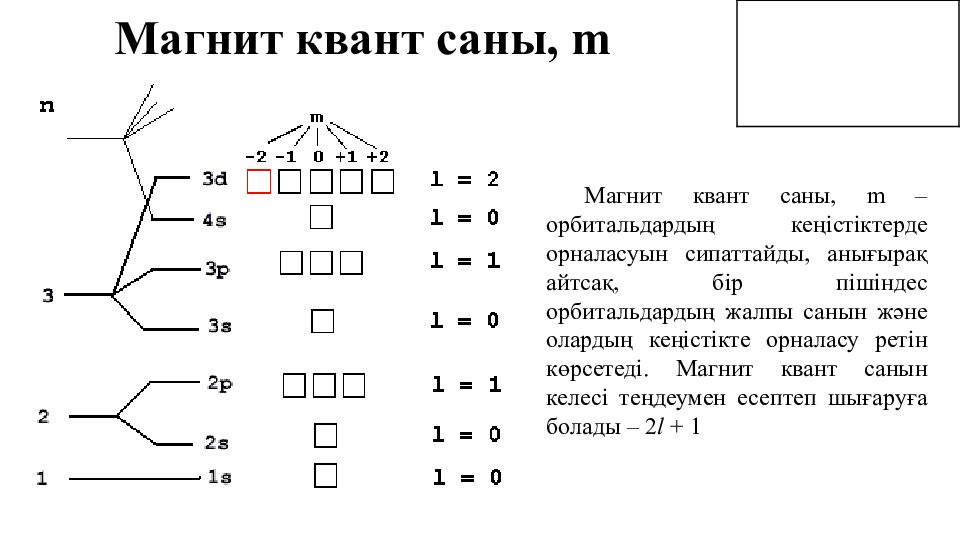
Магнит квант саны, m Магнит квант саны, m – орбитальдардың кеңістіктерде орналасуын сипаттайды, анығырақ айтсақ, бір пішіндес орбитальдардың жалпы санын және олардың кеңістікте орналасу ретін көрсетеді. Магнит квант санын келесі теңдеумен есептеп шығаруға болады – 2 l + 1