Первый слайд презентации: Современные методы анализа биологического материала
Слайд 2
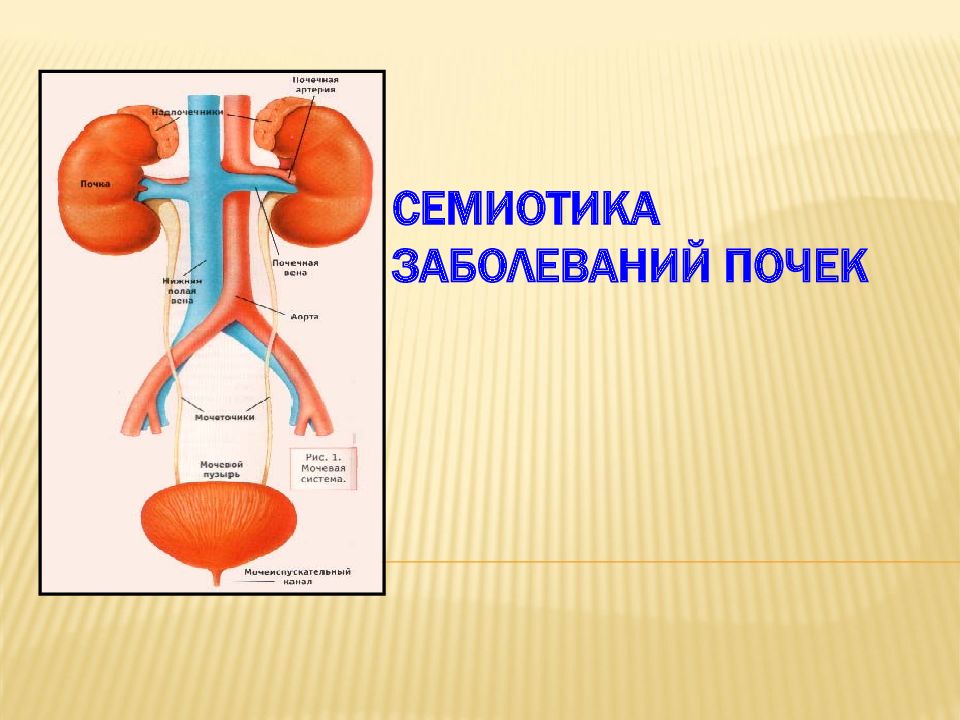
Материалом для лабораторного исследования может быть любой биологический субстрат. • Выделения человеческого организма - мокрота, моча, кал, слюна, пот, отделяемое из половых органов. • Жидкости, получаемые с помощью прокола или откачивания, - кровь, экссудаты и транссудаты, спинномозговая жидкость. • Жидкости, получаемые с помощью инструментально-диагностической аппаратуры, -содержимое желудка и двенадцатиперстной кишки, жёлчь, бронхиальное содержимое. • Ткани органов, получаемые методом биопсии - ткани печени, почек, селезёнки, костного мозга; содержимое кист, опухолей, желёз.
Слайд 3: Определение концентрации гемоглобина
Важнейшие из методов определения концентрации гемоглобина — колориметрические. Они широко применяются на практике ввиду их простоты и доступности. Гематитовый метод (метод Сали). Основан на превращении гемоглобина при прибавлении к крови хлористо-водородной кислоты в хлоргемин (хлорид гематита) коричневого цвета, интенсивность окраски которого пропорциональна содержанию гемоглобина. Полученный раствор хлорида гематита разводят водой до цвета стандарта, соответствующего известной концентрации гемоглобина. Определение проводят в упрощенном колориметре — гемометре Сали. Промышленность выпускает гемометры, содержащие грамм-процентную шкалу. За идеальную норму принимают концентрацию гемоглобина в крови, равную 16,67 г%, или 166,7 г/л. При соблюдении всех правил работы с гемометром у одного и того же больного при определении гемоглобина в разных порциях крови получают расхождение результатов в пределах ± 0,3 г% (3 г/л).
Слайд 4: Цианметгемо-глобиновый метод
Он основан на превращении гемоглобина в цианметгемоглобин при добавлении к крови реактива. Концентрацию цианметгемоглобина измеряют фотометрически. В качестве реактива употребляют раствор Драбкина (NaHCO3 — 1 г, KCN — 0,05 г, K3[Fe(CN)6] — 0,2 г, дистиллированной воды — до объема 1 л). Под влиянием железисто-синеродистого калия гемоглобин окисляется до метгемоглобина, который затем превращается при помощи цианина калия в цианметгемоглобин (гемоглобинцианид). Через 20 мин, необходимых для полного превращения гемоглобина в гемоглобинцианид, измеряют экстикцию при длине волны 540 нм и толщине слоя в 1 см против воды на спектрофотометре СФ-4 или на ФЭК-М и ему подобном фотоэлектроколориметре
Слайд 5
Цифровой гемоглобинометр HG-202 Гемоглобинометр Hb-20 Существуют колориметры, специально разработанные для определения гемоглобина, — гемоглобинометры. В большинстве из них используется цианметгемоглобиновый метод. Гемоглобинометры могут работать независимо или в комплексе со счетчиками частиц. Так, гемоглобинометр “Культер” (Франция), который можно применять самостоятельно, дает прямые показания гемоглобина в граммах на 100 мл. Прибор имеет высокую точность и воспроизводимость ± 0,1 г% (1 г/л).
Слайд 6: Исследование желчи
Колориметрическим методом по Мейленграхту можно ориентировочно определить концентрацию билирубина. При взаимодействии сульфаниловой кислоты с нитритом натрия образуется диазофенилсульфоновая кислота (диазосмесь), которая дает со связанным (прямым) билирубином сыворотки розово-фиолетовое окрашивание. По его интенсивности судят о концентрации связанного билирубина, дающего прямую реакцию. При добавлении к сыворотке крови кофеинового реактива несвязанный (непрямой) билирубин переходит в растворимое диссоциированное состояние и также дает розово-фиолетовое окрашивание с диазосмесью одновременно с прямым билирубином. По интенсивности окраски, образующейся после добавления кофеинового реактива, определяют концентрацию общего билирубина. По разнице между общим и связанным (прямым) билирубином находят содержание несвязанного (непрямого) билирубина. Исследование желчи
Слайд 7
Для определения прямого билирубина в пробе измерения на ФЭКе производят спустя 5—10 мин после добавления диазосмеси, так как при более длительном стоянии в реакцию вступает непрямой билирубин.
Слайд 8
Для определения прямого билирубина в пробе измерения на ФЭКе производят спустя 5—10 мин после добавления диазосмеси, так как при более длительном стоянии в реакцию вступает непрямой билирубин.
Слайд 9
Цветная реакция Либермана и Бурхарда. С помощью этого метода производят количественное определение холестерина в желчи. Холестерин в присутствии уксусного ангидрида и смеси уксусной и серной кислот дает зеленое окрашивание.
Слайд 10
К 2,1 мл смеси реактивов добавляют 0,1 мл исследуемого материала (желчи). Пробирку энергично встряхивают 10—12 раз и ставят в термостат на 10 мин при температуре 37 °С. Измерения производят на ФЭКе против реактива 1 при красном светофильтре (630—690 нм) в кювете с толщиной слоя в 5 мм.
Слайд 11: Современные методы анализа мочи
исследование химического состава мочи - определение содержания в моче глюкозы, белка, нитритов, билирубина, уробилиногена, кетонов, рН, гемоглобина;
Слайд 12
Для выполнения анализов мочи применяется целый ряд специальных аналитических методов с применением специализированного оборудования. С целью обеспечения высокой производительности и повышения точности анализов все шире в современных лабораториях применяются автоматизированные методы анализа мочи.
Слайд 13
Контейнер для сбора биоматериала Современные методы исследования химического состава мочи и ее физических свойств выполняются с нативными образцами. Для исследования осадка мочи необходимо приготовить специальный аналитический препарат. Для этого применяется метод центрифугирования мочи с последующей диспергацией осадка в определенном количестве мочи. От качества выполнения этой процедуры существенным образом зависит точность результата анализа. Центрифугирование мочи выполняется в обычных стеклянных или пластиковых центрифужных пробирках с применением обычных центрифуг. Основным недостатком работы на этих центрифугах является то, что необходимо сливать надосадочную жидкость и при этом остаточный объем жидкости стандартизировать не возможно.
Слайд 14
Пробирка для микроскопии осадка мочи « СenSlide » В пробирку вносится 5 мл. мочи. Далее центрифуга, управляемая микропроцессором, вращает пробирки согласно запрограммированным времени и скорости. В конце цикла центрифугирования мочевой осадок равномерно распределяется в зоне просмотра пробирки и полностью готов к микроскопическому анализу. После центрифугирования пробирка вставляется в специальный держатель пробирок, который помещается на предметный столик микроскопа. Держатель пробирок устанавливает каждую пробирку в одну и туже позицию на предметном столике микроскопа, поэтому дополнительной фокусировки при смене пробирок не требуется.
Слайд 15
Новая технология приготовления препарата для анализа осадка мочи имеет следующие преимущества: - специальный режим центрифугирования с автоматическим выключением обеспечивает равномерное распределение осадка мочи в зоне просмотра пробирки; - пробирки являются одновременно пробирками для центрифугирования и слайдами для микроскопии; - при их использовании исчезает необходимость в предметных и покровных стеклах и в переносе осадка; - максимальное снижение количества этапов исследования позволяет на 80 % сократить общее время анализа; - закрытость системы существенно снижает риск передачи инфекций и биологического заражения окружающей среды. Центрифуга для микроскопии осадка мочи « СenSlide 2000»
Слайд 16
В подавляющей части специализированных анализаторов мочи применяется метод сухой химии. В основе данного метода лежат цветные реакции, приводящие к изменению окраски тестовой зоны полоски. В зависимости от химических свойств определяемого аналита используются как обычные химические реакции, так и ферментативные (например, глюкозооксидазная реакция при определении содержания глюкозы в моче). Некоторые аналиты определяют по их собственной ферментативной активности (лейкоциты, гемоглобин). Изменение окраски тестовых зон определяется либо визуально – сравнивается окраска зоны с цветовой шкалой на пенале, либо с помощью специального отражательного фотометра. Последний метод оценки цветной реакции более предпочтителен, поскольку позволяет получить объективный результат анализа. Визуальная оценка реакций существенно зависит как от характера освещения в помещении, так и от особенностей цветовосприятия зрения лаборанта.
Слайд 17
Анализаторы мочи на тест-полосках делятся на три группы: Первая группа представляет собой специализированные отражательные фотометры с ручным помещением тест-полоски в фотометрическую зону. Это наиболее простые и дешевые приборы. Отличительной особенностью этого класса приборов является то, что хронометраж реакции – время между смачиванием тест-полоски мочой и фотометрированием, должен осуществлять лаборант. Удлинение этого времени относительно номинального может приводить к завышенным результатам анализа, а поспешность лаборанта приводит к заниженным результатам. Во второй группе анализаторов фотометрирование осуществляется автоматически в строго определенное время. Для этого в приборе имеется специальный транспортер тест-полосок. В приборах первой и второй группы процедура смачивания тест-полоски мочой выполняется лаборантом вручную. От того, как эта процедура будет выполнена - время нахождения тест-полоски в моче, удаление избытка мочи на тест-полоске – зависит результат анализа. Аккуратный лаборант эту процедуру выполняет легко и четко и, как следствие, получает хорошо воспроизводимые результаты. В настоящее время для минимизации влияния человеческого фактора на результат исследования все шире стали применяться полностью автоматические анализаторы мочи, в которых нанесение проб мочи на тестовые зоны, хронометраж реакции и фотометрирование выполняются автоматически.
Слайд 18
Следующим шагом аналитического этапа является определение белка в моче. В настоящее время в некоторых лабораториях с целью экономии времени и средств анализ на белок в моче делают в два этапа. Сначала все пробы мочи анализируют качественным методом с применением сульфосалициловой кислоты или полуколичественным методом с применением тест-полосок. Затем для положительных проб выполняется количественный анализ. Это серьезная ошибка. Применение тест-полосок не позволяет определить протеинурию, обусловленную глобулинами, так как реагент, который используется в тест-полосках всех производителей ( бромфеноловый синий) селективно чувствителен к альбуминовым фракциям. Качественные же методы, основанные на реакции преципитации белков в кислой среде, нередко дают ложные результаты. Это связано с влиянием различных факторов на результат анализа, такими как: мутность (если моча не центрифугирована), рН мочи, рентгеноконтрасные красители с органическими йодидами, присутствие кристаллина, лекарств, в частности пенициллина, цефалоспоринов и др. При относительно невысоких концентрациях белка в моче эти факторы и их сочетание могут приводить, как к завышенным результатам измерений, так и к заниженным. При этом результат измерения будет очень сильно зависеть от того, как лаборант проведет анализ. Так, например, встряхивание пробирки значительно ускоряет образование крупных преципитатов.
Слайд 19
Согласно Приказу №45 от 97.02.2000 года, погрешность измерения не должна превышать 20%. Многие исследования у нас в России и за рубежом показали, что только пирогалловый метод позволяет обеспечить такую точность. Поэтому был разработан новый анализатор белка в моче, предназначенный для рутинных количественных анализов концентрации белка в моче с применением красителя пирогалловый красный (ПГК). Анализатор белка в моче «Микролаб 600»
Последний слайд презентации: Современные методы анализа биологического материала: Почему пирогалловый метод позволяет получать более точные результаты измерения концентрации белка в моче?
Во-первых, за счет большей кратности разведения пробы мочи в реакционной смеси. Если в сульфосалициловом методе отношение проба мочи:реагент составляет 1:3, то в пирогаллоловом методе оно может быть в пределах от 1:10 до 1:50 в зависимости от варианта методики, что значительно уменьшает влияние состава мочи на результат измерения. Во-вторых, реакция протекает в сукцинатном буфере, то есть при стабильном рН. И, наконец, сам принцип метода, можно сказать, более «прозрачный». Молибдат натрия и краситель пирогаллоловый красный образуют комплекс с молекулой белка. Это приводит к тому, что молекулы красителя в свободном состоянии не поглощающие свет на длине волны 600 нм в комплексе с белком свет поглощают. Таким образом, мы как бы метим каждую молекулу белка красителем и в результате получаем, что изменение оптической плотности реакционной смеси на длине волны 600 нм четко коррелирует с концентрацией белка в моче. Причем, поскольку сродство пирогаллолового красного к разным фракциям белка практически одинаковое, метод позволяет определять общий белок мочи.