Первый слайд презентации: Презентация Та қырыбы: Кешенді қосылыстар
Орындаған : Елибаева.А Топ: Жалпы медицина, 102 «Б» Қабылдаған : Өмірқұлов.А Оңтүстік Қазақстан мемлекеттік фармацевтика академиясы Фармакогнозия және химия кафедрасы
Слайд 3
Комплексті қосылыстар ( лат. complexus — үйлесімділік, қамту ), немесе координациялық қосылыстар ( лат.. со — « бірге » және ordinatio — « реттілік ») — бөлшектер ( бейтарап молекулалар немесе иондар ), берілген комплекс түзушіге ионға ( немесе атомға ) лиганда деп аталатын бейтарап молекуланың немесе басқа ионның қосылу нәтижесінде түзілетін қосылыс.
Слайд 4
Координациялық теорияның негізін қалаушы Швед химигі Альфред Вернер болды. Бұл теорияны орыс ғалымдары Л.А.Чугаев, И.И.Черняев және А.А.Гринберг еңбектерінде толықтырды. ( 1866 – 1919 ) Швед химигі Альфред Вернер
Слайд 5
Комплексті қосылыстардың маңызы Халық шаруашылығында қолданады: оларды Pt металдарын, Au, Ag, Cu, Ni, Co алуға және тазалауға пайдаланылады.Сирек кездесетін металдарды бөлуге аналитикалық химияда сапалық, сандық анализдерге қолданады. Металдарды коррозиядан қорғауға қолданады. Металдарға жабысқақ қасиеті бар тұрақты және ерімейтін комплексті қосылыстар коррозия процесін баяулатады немесе мүлдем тоқтатады.
Слайд 6
Комплексті қосылыстар жануарлар мен өсімдіктердің тіршілік процестерінде үлкен роль атқарады. Адамдар мен жануарлар қанының құрамындағы гемоглобин тыныс алу процесін қамтамасыз етеді. Гемоглобин – комплекс - белок глобинмен байланысқан күрделі протеид. Гемоглобинді қанның тыныс алу пигменті деп атайды. Ол оттегін қайтымды түрде қосып алып, оны өкпеден қан тамырлары арқылы барлық ұлпаларға жеткізеді, ол ұлпадан көмірқышқыл газын тасымалдайды. Темірдің тотығу д әрежесінің оңай өзгеруінің арқасында, гемоглобин оттегімен оңай қосылады да, оны ұлпаға ешқандай қиындықсыз береді.
Слайд 7
Комплекс түзуші элементтерді “ тіршілікті ұйымдастырушылар ” деп атайды. Соңғы кезде Pt- ң және Pd- дың комплексті қосылыстарын қатерлі ауруларды емдеуге пайдалануға болады. Хелатты комплексті қосылыстарды бүйректегі тастарды ерітуге және судың кермектігін жоюға қолданылады. Комплексті қосылыстарды клиникаларда дәрі-дәрмек ретінде қолданып, әр түрлі ауруларды емдеуді хелатты терапия деп атайды. Трилон Б көптеген металл иондарымен комплексті қосылыстар түзеді. Сондықтан ағзада кальций тұздары бөліне жүретін ауруларды емдеуге пайдаланылады. НООС-СН 2 CH 2 COOH N-CH 2 -CH 2 -N немесе Na 2 H 2 Tr Na ООС-СН 2 CH 2 COONa
Слайд 8
Комплексті қосылыстардың қолданылуы: Полимерлер синтездеуде катализатор ретінде қолданылады ; атмосфералық азотты байланыстыру үшін қолданылады; синтетикалық жуғыш заттарды алу үшін; металдар коррозиямен күресу үшін; лак пен бояғыш заттарды алу үшін ;
Слайд 9
Комплексті қосылыстар әдетте ашық түсті келеді Гемоглобин қанға қызыл түс береді ; хлорофилл – өсімдіктерге жасыл түс береді ; – бұл комплексті қосылыстар.
Слайд 10
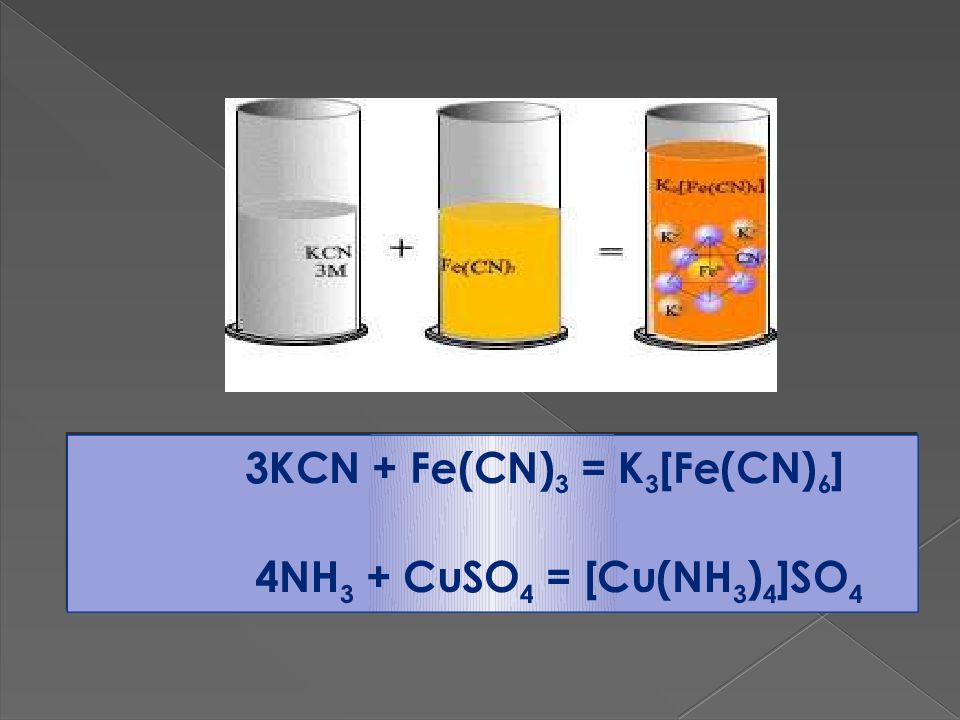
Қазір атом құрылысы тұрғысынан негізгі және қосымша валенттілік мәні толық анықталды. Негізгі валенттілік ионды немесе ковалентті байланыс, ал қосымша валенттілік – ковалентті байланыстың бір түрі – донорлы – акцепторлы механизм арқылы түзіледі. Донорлы – акцепторлы механизм арқылы ковалентті байланыс түзілуі үшін бір элемент атомының бос орбиталі, ал басқа атомның байланыс түзуге қатыспаған жұп электроны болуы тиіс. Жұп электроны бар атом электрондарын бос орбиталі бар атомға беріп байланысады. Құрамында донорлы – акцепторлық механизм арқылы ең кемінде бір байланысы бар қосылыстарды комплексті қосылыстар деп атайды.
Слайд 11
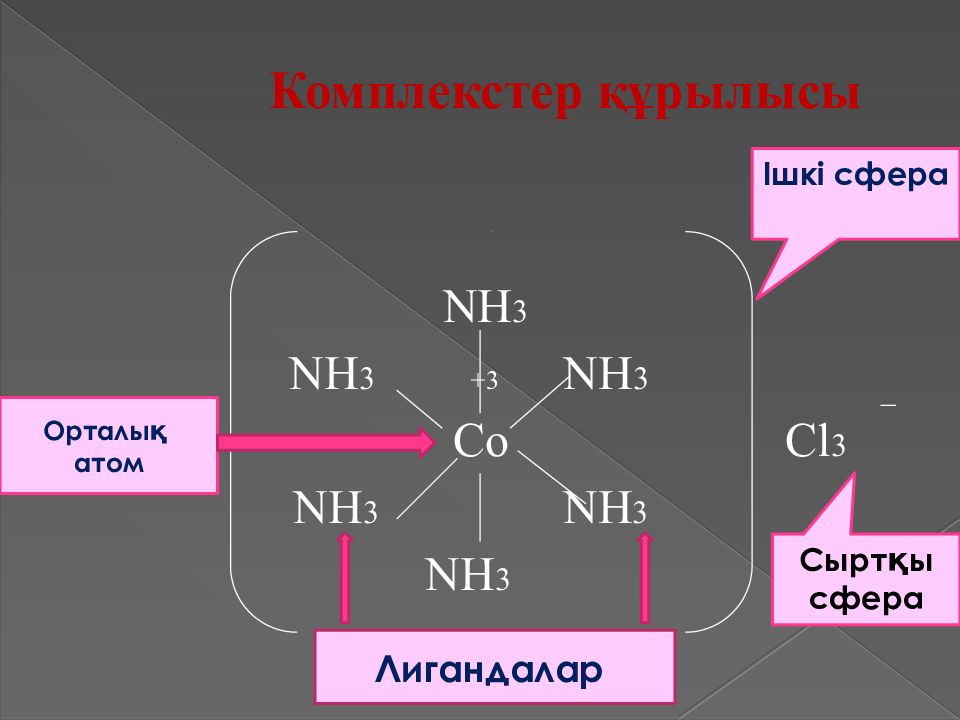
Комплекстер құрылысы NH 3 NH 3 +3 NH 3 Co Cl 3 NH 3 NH 3 NH 3 Ішкі сфера Сыртқы сфера Лигандалар Орталық атом
Слайд 12
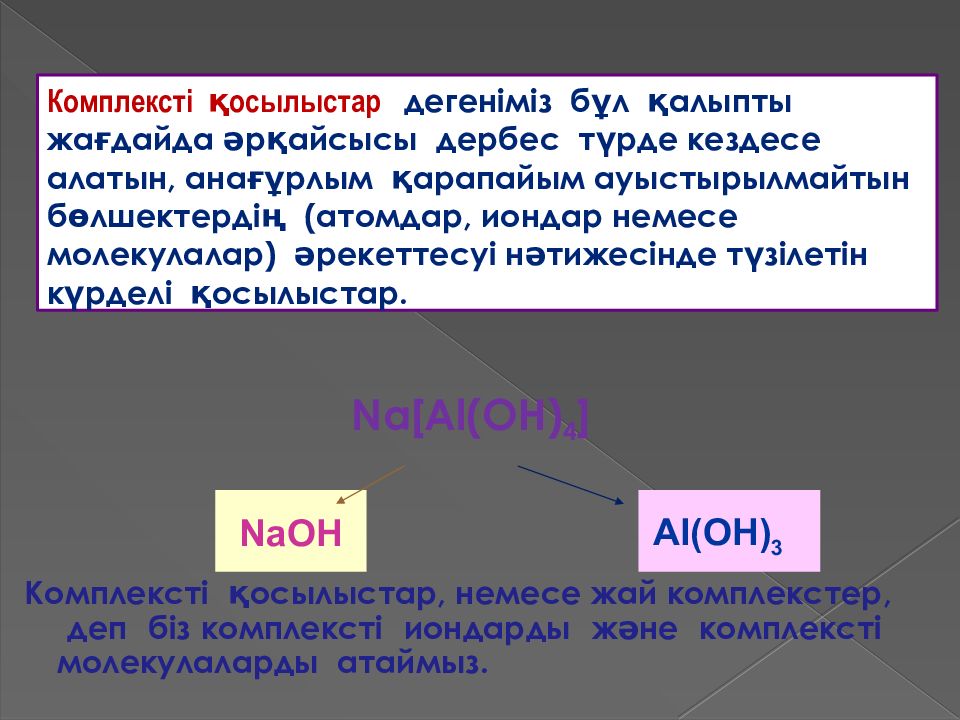
Комплексті қосылыста р, немесе жай комплекстер, деп біз комплексті иондарды және комплексті молекулаларды атаймыз. Комплексті қосылыстар дегеніміз бұл қалыпты жағдайда әрқайсысы дербес түрде кездесе алатын, анағұрлым қарапайым ауыстырылмайтын бөлшектердің (атомдар, иондар немесе молекулалар) әрекеттесуі нәтижесінде түзілетін күрделі қосылыстар. Na [ Al(OH) 4 ] N aOH Al(OH) 3
Слайд 13: Координациялық теорияның негізг і қағидалары
1 ) Комплексті қосылыстарда оң зарядты ортада орналасқан атомның (металл) комплекс түзушінің - орны зор. Комплекс түзуші ( орталық катион) - ваканттық е - орбитальдары бар металл катионы. Катиондар : металдар (d- элементтер ) : С u +2, Co +3, Fe +3, Hg +2 және т.б. ( р-элементтер сирек ): Al +3 ( бейметалдар кейде ): В +3, Si +4.
Слайд 14: Координациялық теорияның негізг і қағидалары
2.Комплекс түзушінің айналасында бөлінбеген электрон жұптары бар теріс зарядты иондар немесе бейтарап молекулалар - лигандалар орналасады. Координациялық теорияның негізг і қағидалары Молекулалар : H 2 O, NH 3, Аниондар : CN -, OH -, Cl -, Br -, NO 2 - .. .. .. Лигандалар Б өлінбеген электрон жұптары тағы басқа галогендер
Слайд 15: Координациялық теорияның негізг і қағидалары
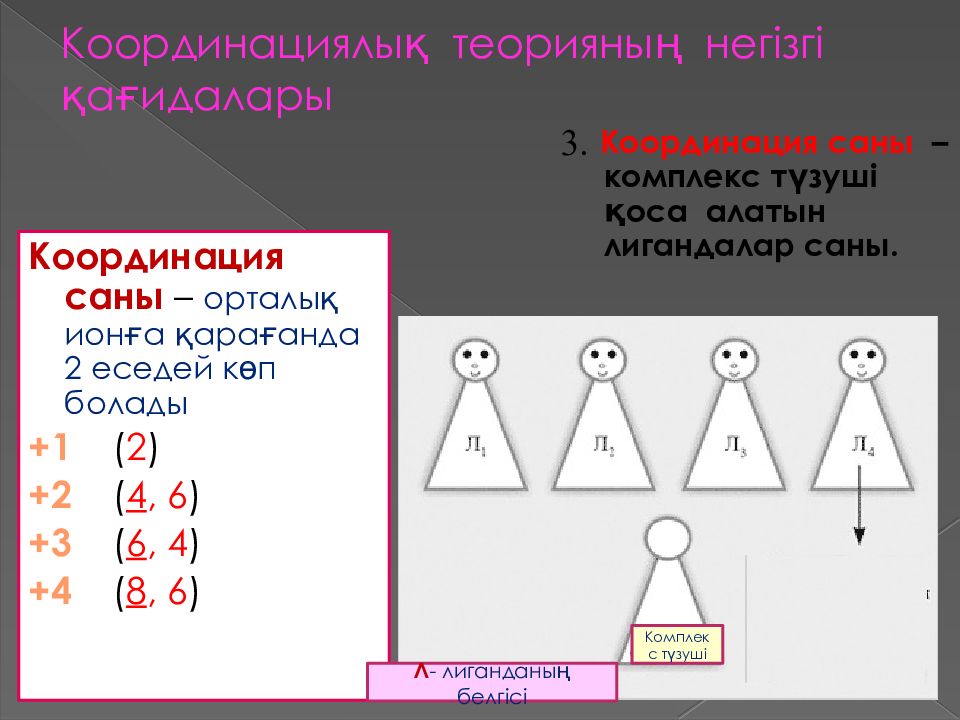
Координация саны – комплекс түзуші қоса алатын лигандалар саны. 3. Координация саны – орталық ионға қарағанда 2 еседей көп болады +1 ( 2 ) +2 ( 4, 6 ) +3 ( 6, 4 ) +4 ( 8, 6 ) Л - лиганданы ң белгісі Комплекс түзуші
Слайд 16: Координациялық теорияның негізг і қағидалары
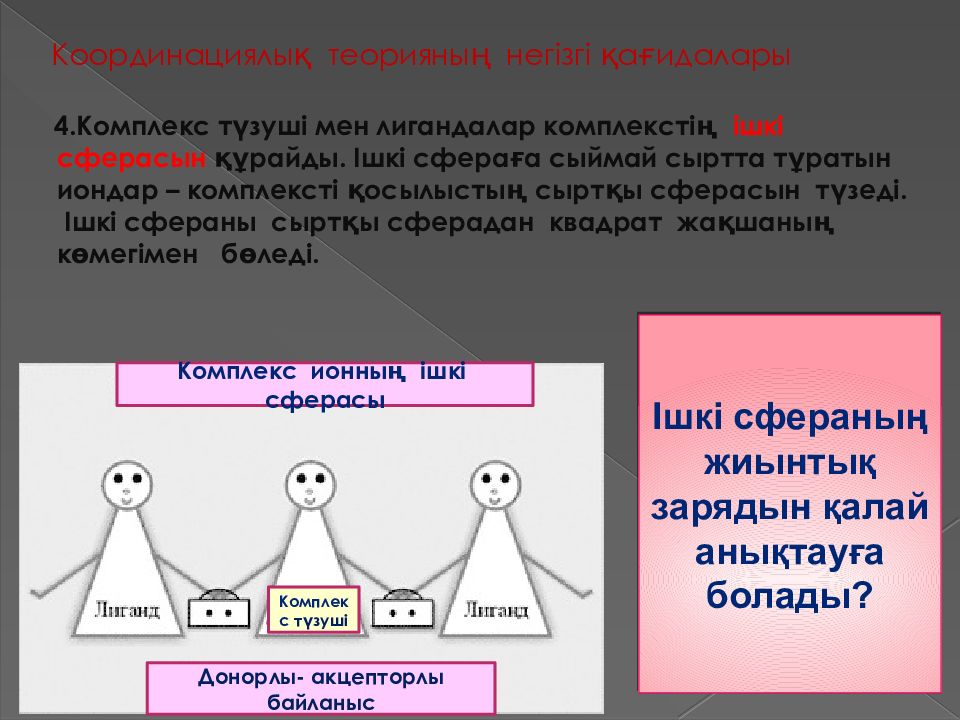
4. Комплекс түзуші мен лигандалар комплекстің ішкі сферасын құрайды. Ішкі сфераға сыймай сыртта тұратын иондар – комплексті қосылыстың сыртқы сферасын түзеді. Ішкі сфераны сыртқы сферадан квадрат жақшаның көмегімен бөледі. [ Cu (NH 3 ) 4 ] +2 Ішкі сфераның жиынтық зарядын қалай анықтауға болады ? Комплекс ионның ішкі сферасы Комплекс түзуші Донорлы - акцепторлы байланыс
Слайд 17
Комплекстің ішкі сферасындағы әрбір лиганданың орын саны - лиганданың координациялық сыйымдылығы деп аталады. Монодентанты лигандалар – координациялық сыйымдылығы = 1 Cl -, Br -, I -, CN -, NH 3 және т.б. Бидентантты лигандалар – координациялық сыйымдылығы =2 SO 4 2-, CO 3 2-, C 2 O 4 2- және т.б. К 3 [Fe(C 2 O 4 ) 3 ] Полидентантты лигандалар – лигандалардың координациялық сыйымдылығы 3,4,6.
Слайд 18
Комплексті ион мен комплекс түзушінің зарядын анықтау. Комплексті қосылыс молекуласының заряды болмайды, яғни электробейтарап бөлшек болып табылады. Егер лиганда болып молекула табылатын болса, онда комплексті ионның заряды комплекс түзушінің зарядына тең болады. Егер лиганда болып молекула және ион табылатын болса, онда комплексті ионның заряды комплекс түзуші мен лигандалардың зарядтарының алгебралық қосындысына тең болады. Комплексті ионның заряды арқылы комплекс түзушінің зарядын есептеуге болады. Ол үшін барлық лигандалардың зарядын ескеру қажет: K 3 [Fe 3+ (CN) 6 ] 3- (-3)-(-1*6)=-3+6=+3 K 4 [Fe 2+ (CN) 6 ] 4- (-4)-(-1*6)=-4+6=+2
Қазіргі кезде комплекс қосылыстарындағы химиялық байланысты мына үш түрлі теория түсіндіреді : валенттік байланыс әдісі; кристалл өрісі теориясы; молекулалық орбитальдар әдісі. Бұл теориялар комплекс қосылыстарының құрылысын, қасиетін түсіндіруде бір-бірін толықтырып тұрады. Валенттік байланыс (ВБ) әдісі негізінде жұп ортақ электрондар көмегімен және көбінесе донорлық- акцепторлық механизм арқылы комплекс иондар түзілетіні алынады. Осы әдіс көмегімен көптеген комплекс қосылыстарының түзілуі, олардың магниттік қасиеттері, координациялық санның мәні жақсы түсіндіріледі. Осы әдіс арқылы комплекс қосылыстарға түсінікті анықтама берілген.
Слайд 20
Кристалл өрісі теориясы бойынша комплекс түзуші ион мен лигандалар арасында ионаралық не ион - дипольдік және электрстатикалық тартылыс күштері арқылы байланыс түзіледі. Бұл теория комплекс қосылыстарының оптикалық қасиеттерін жақсы түсіндіреді, ал ковалентті байланысы бар болған кезде қиыншылыққа кезігеді. Молекулалық орбитальдар әдісі комплекс түзуші мен лигандаларды біртұтас алып қарастырады. Комплекстің қасиеті ядролармен электрондардан тұратын жүйе математикалық есептеу жолымен анықталады. Ядролар сыртында электрондар байланыстырушы және босаңдатқыш орбитальдар бойымен атомдық орбитальдардың сызықтық комбинациясы негізінде орналасады.
Слайд 21: Комплексті қосылыстардың құрылысы
Ішкі комплексті қосылыстарда берік байланыс түзілуі үшін электрондарды жұптастыру арқылы екі d-орбитальді босату тиімді болады: Co 3+ 4 s 4 р 3 d Кобальт атомының бос орбитальдары, аммиак молекуласындағы азот атомдарының бөлінбеген электрон жұптары үшін ваканция болып табылады. Комплексті қосылыстағы ішкі координациялық сфераның түзілуі төмендегіше орындалады: .. NH 3 NH 3 .. NH 3 .. NH 3 .. NH 3 .. NH 3 .. Co 3+
Слайд 22
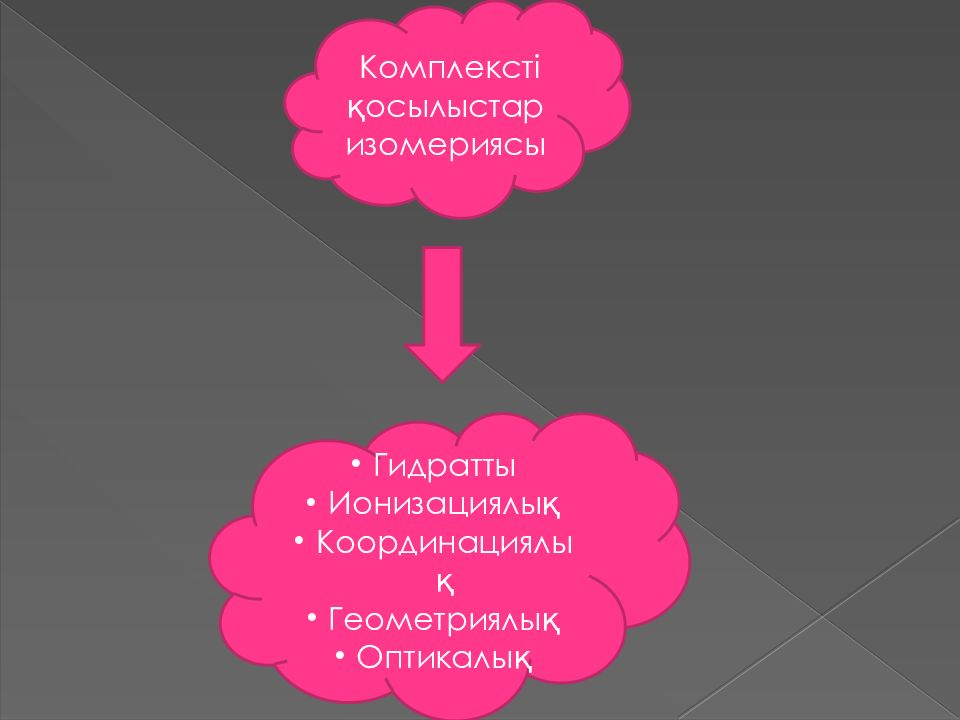
Комплекс қосылысындағы изомерия Заттардың сандық және сапалық құрамы бірдей, бірақ қасиеттері әртүрлі болатын құбылысты изомерия деп атайды. Изомерия құбылысы комплекс қосылыстарына да тән. Мұндай изомерияның бірнеше түрі кездеседі: геометриялық, оптикалық, гидраттық, ионизациялық, тұздық,координациялық. Геометриялық изомерия комплекс құрамындағы лигандалардың өзара орналасуына байланысты. Егер лигандалар біріне - бірі жақын орналасса – цис, қарама - қарсы орналасса транс изомер болады. Егер комплексті қосылыста су молекулалары болса, оның ішкі және сыртқы сферада орналасуына қарай әртүрлі гидратты изомерия болады. Комплекс қосылыстарында қышқыл қалдықтарының ішкі және сыртқы сферада орналасуына байланысты ионизациялық изомерия болады.
Слайд 23
Гидратты Ионизациялық Координациялық Геометриялық Оптикалық Комплексті қосылыстар изомериясы
Слайд 24
КҚ изомериясы Изомерлер- қ ұрамдары бірдей, бірақ құрылысы мен қасиеттері әртүрлі заттар. Изомерия құбылысы комплексті қосылыстарда өте кең таралған Гидраттық немесе сольватты изомерия су молекуласының комплекс құрамында әртүрлі орналасуынан болады. Иондық изомерия аниондардың ішкі сфера мен сыртқы сфераға әртүрлі таралуынан болады. [Pt(NH 3 ) 3 Br]NO 2 және [ Pt(NH 3 ) 3 (NO 2 )] В r
Слайд 25
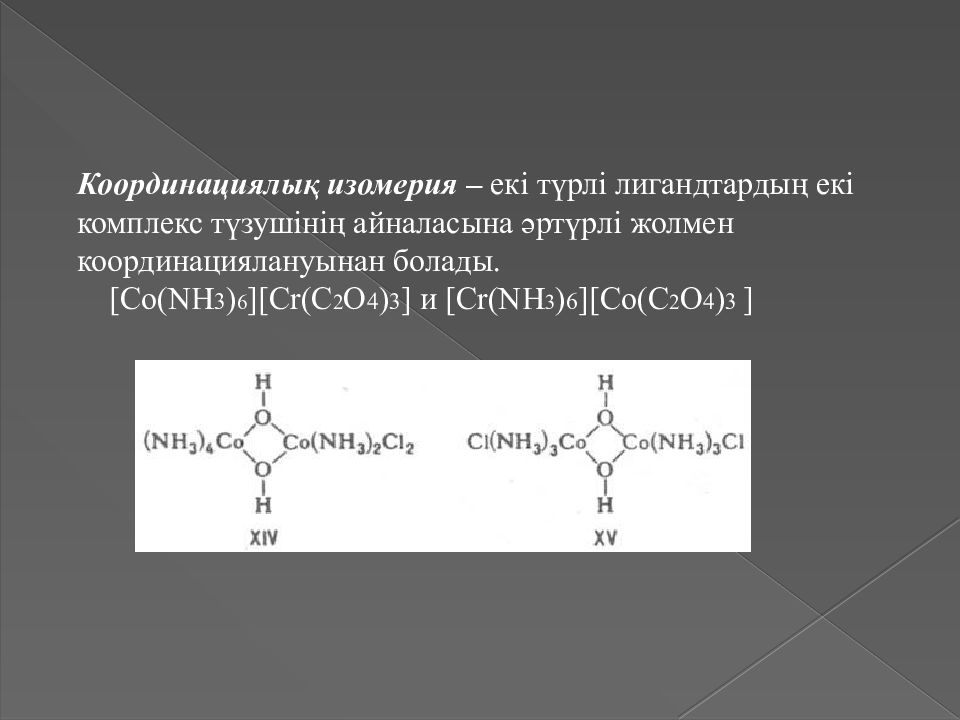
Координациялық изомерия – екі түрлі лигандтардың екі комплекс түзушінің айналасына әртүрлі жолмен координациялануынан болады. [Co(NH 3 ) 6 ][Cr(C 2 O 4 ) 3 ] и [Cr(NH 3 ) 6 ][Co(C 2 O 4 ) 3 ]
Слайд 26
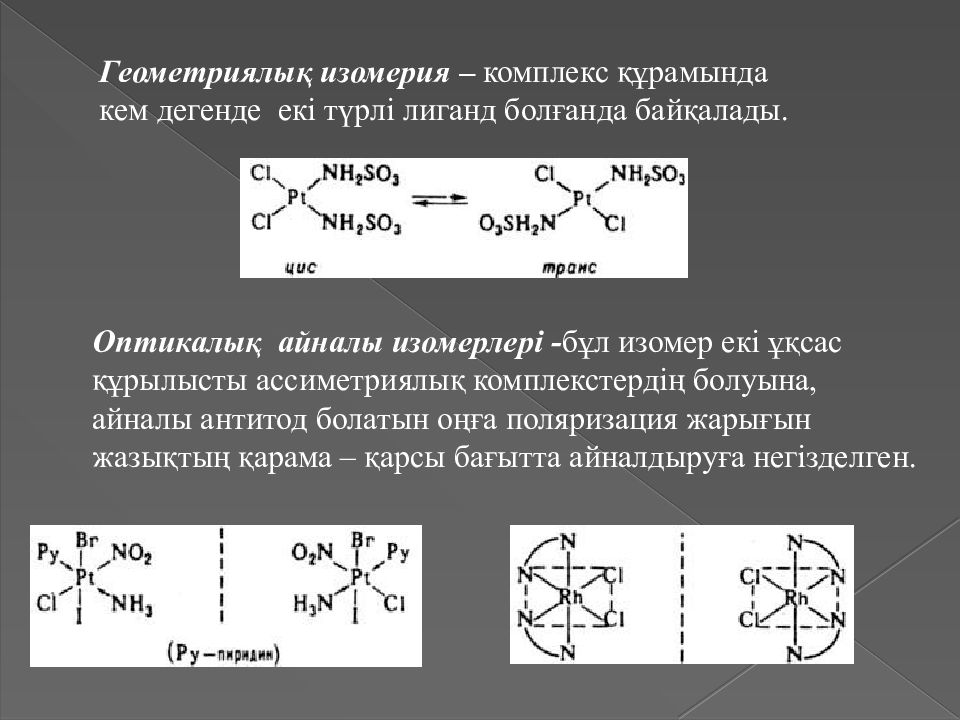
Геометриялық изомерия – комплекс құрамында кем дегенде екі түрлі лиганд болғанда байқалады. Оптикалық айналы изомерлері - бұл изомер екі ұқсас құрылысты ассиметриялық комплекстердің болуына, айналы антитод болатын оңға поляризация жарығын жазықтың қарама – қарсы бағытта айналдыруға негізделген.
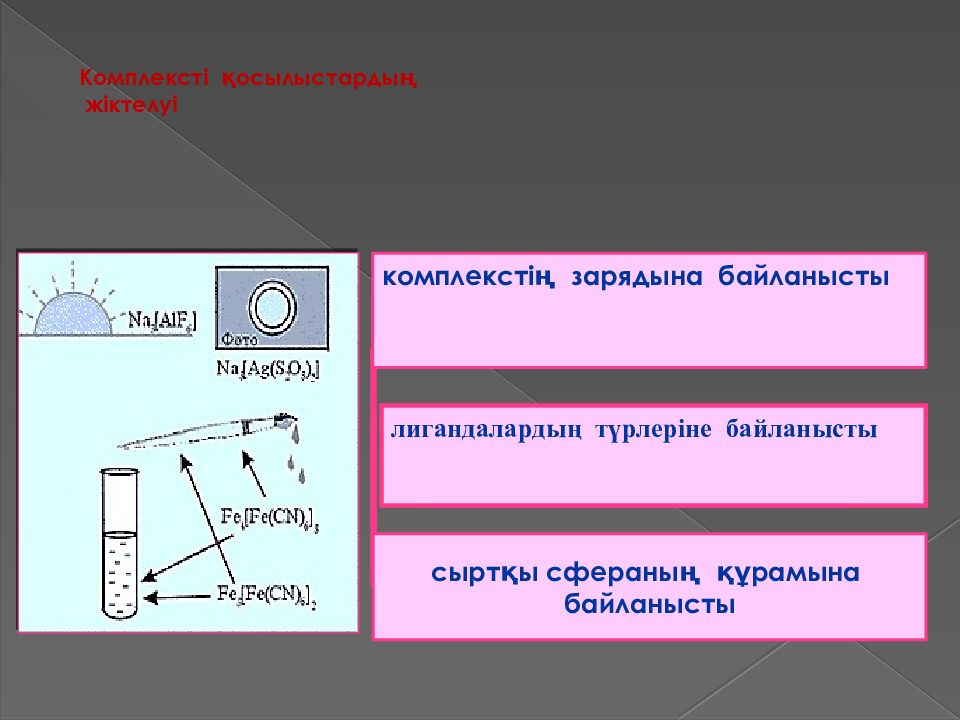
Слайд 28: Комплексті қосылыстардың жіктелуі
лигандалардың түрлеріне байланысты Комплексті қосылыстардың жіктелуі комплекстің зарядына байланысты по составу внешней сферы сыртқы сфераның құрамына байланысты
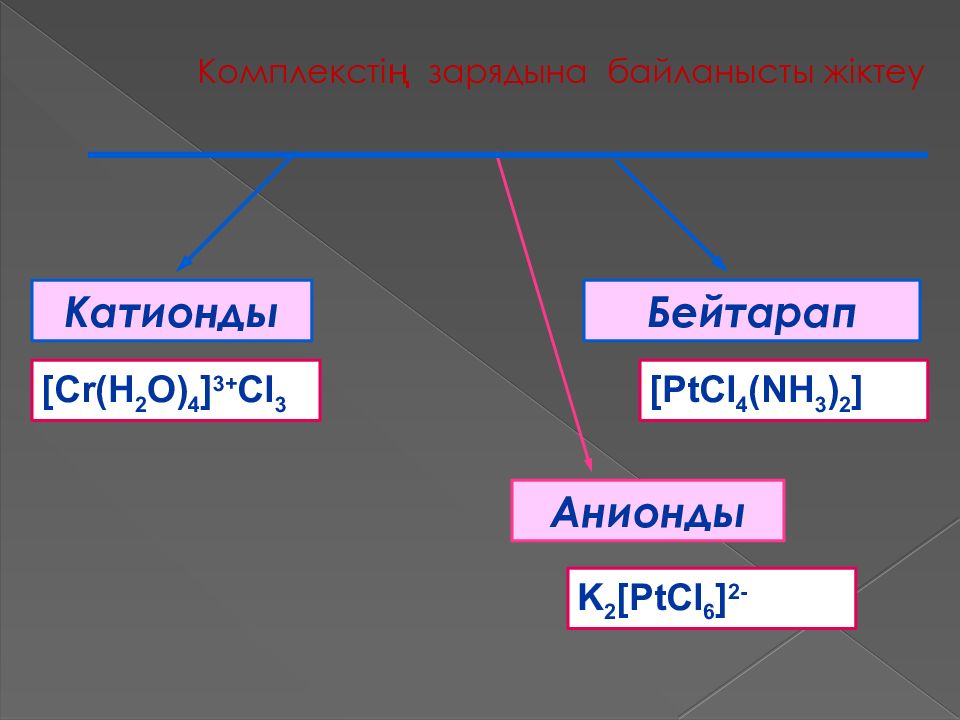
Слайд 29: Комплекст ің зарядына байланысты жіктеу
Катионды Бейтарап Анионды [Cr(H 2 O) 4 ] 3+ Cl 3 [PtCl 4 (NH 3 ) 2 ] K 2 [PtCl 6 ] 2-
Слайд 30
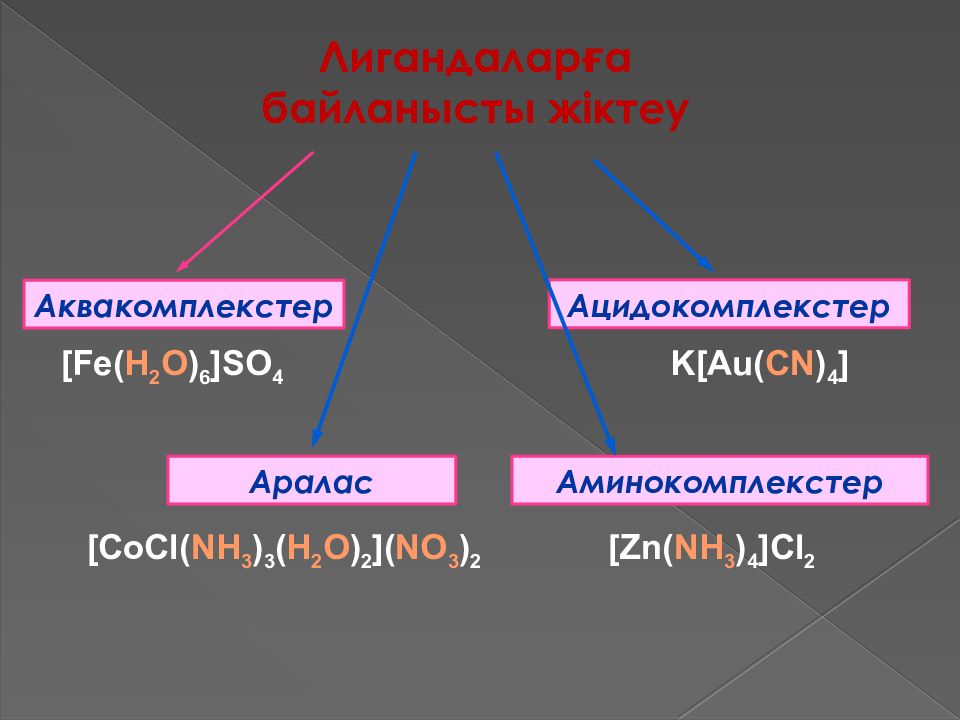
Лигандаларға байланысты жіктеу Аквакомплекстер Аралас Ацидокомплекстер Аминокомплекстер [Fe( H 2 O ) 6 ]SO 4 K[Au( CN ) 4 ] [Zn( NH 3 ) 4 ]Cl 2 [CoCl( NH 3 ) 3 ( H 2 O ) 2 ]( NO 3 ) 2
Слайд 31
Аквокомплекстер. Олардың құрамындағы лигандалар су молекулалары болады. Кей аквокомплекстер құрамындағы су молекулалары сыртқы сферада болуы мүмкін. Олар кристалданған кезде құрамына су молекулалары да кіреді. Алайда, су молекуласы қыздырғанда бөлініп кетеді. Ациодокомплекстер. Олардың құрамындағы лигандалар қышқыл қалдықтары болып табылады. Кейбір қышқылдарды комплекс түрінде көрсетуге болады. Гидросокомплекстерді де осы типке қосады.
Слайд 32
Аммиакаттар және амминнаттар. Комплекс ион құрамында аммиак не амминдер болады. Амминдер әртүрлі болады. Көпядролы комплекстер қосылыстар. Құрамына екі немесе одан да көп бір элемент не әртүрлі элемент комплекс түзуші кіреді. Ол комплекс түзушілер бір - бірімен топтар көмегімен байланысады. Циклді немесе хелат комплекс қосылыстар. Ішкі сферада лигандалар цикл түзеді.
Слайд 33
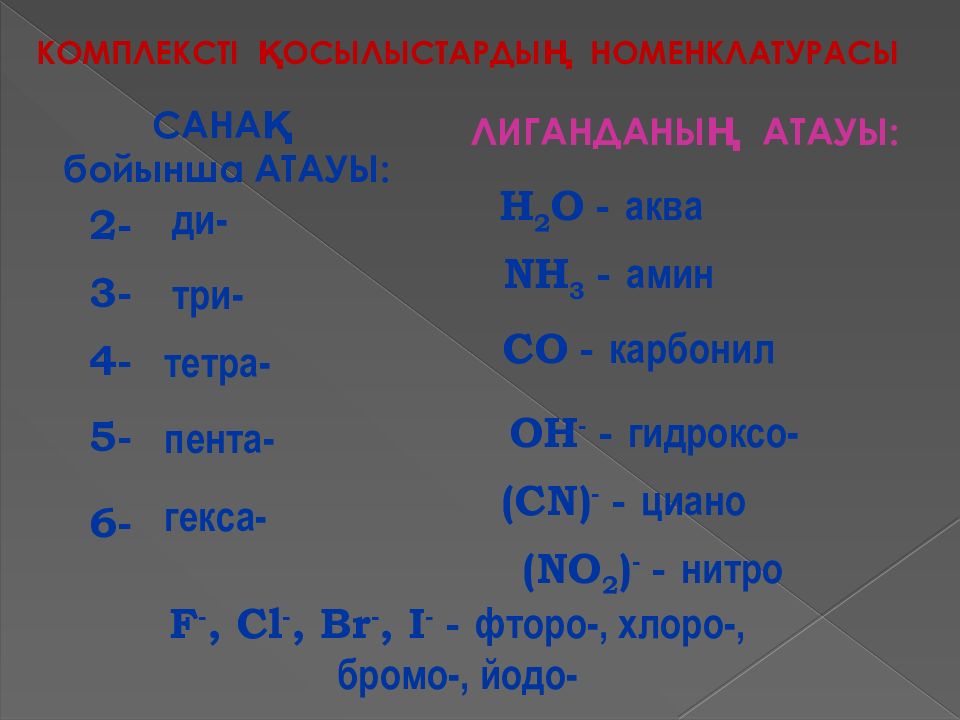
КҚ номенклатурасы 1962 жылы химиктердің Халықаралық Одағы (І UPAC ) ұсынған номенклатурасы қолданылады. Теріс зарядты лигандтардың атауына «О» деген жалғау жалғанады С I- хлоро -, С N- циано -. Электробейтарап лигандтар былай аталады: H 2 O– аква NH 3 - аммин CO - карбонил NO - нитрозил OH - гидроксо O -окси т.б. Комплекс құрамындағы лигандтардың саны грек сан есімдерімен белгіленеді: ди (екі), три (үш), тетра(төрт), пента (бес), гекса (алты) т.б.
Слайд 34
Комплексті қосылыстардың номенклатурасы мен аталуы Бірінші катион, сонан соң анион атауы аталады. Комплекс атауы бір сөз болып жазылады. Комплексті қосылыстарды атау ережесі : 2. Комплексті атағанда алдымен лигандаларды санайды ( алфавиттің алғашқы әріптерімен сонан соң, орталық атомды атайды. 3. Бейтарап лигандаларды өзгеріссіз атайды ; теріс зарядталған лигандалар үшін «о» жалғауы жалғанады. 4. Егер комплексте бірдей лигандалар саны бірнеше болса, онда олардың атауының алдына сәйкес келетін грек сандарын қолданады ; 5. Комплекс түзушінің заряды комплекстің зарядына байланысты. 5.1. Бейтарап және катионды комплекс үшін – атау септігі 5.2. Анионды комплекс үшін - латын тілінде ( « ат ») жұрнағы жалғанады.
Слайд 35
КОМПЛЕКСТІ ҚОСЫЛЫСТАРДЫҢ НОМЕНКЛАТУРАСЫ 2- 4- 3- 5- 6- ди - три - тетра - пента - гекса - САНАҚ бойынша АТАУЫ: ЛИГАНДАНЫҢ АТАУЫ: H 2 O - аква NH 3 - амин С O - карбонил O Н - - гидроксо- (С N) - - циано F -, Cl -, Br -, I - - фторо-, хлоро-, бромо-, йодо- ( NO 2 ) - - нитро
Слайд 36
натрийдің тетрагидроксоцинкаты КОМПЛЕКСТІ ҚОСЫЛЫСТАРДЫҢ НОМЕНКЛАТУРАСЫ Na + 2 4 ] (OH) - [Zn +2 [Cr +3 (H 2 O) 0 6 ] Cl - 3 хромның (ІІІ) гексааквахлориді K + 2 [Hg +2 I - 4 ] калийдің тетрайодо (ІІ) меркураты
Слайд 37
КОМПЛЕКСТІ ҚОСЫЛЫСТАРДЫҢ АТАУЫ Na 3 [AlF 6 ] Na[Al(OH) 4 ] K 4 [Fe(CN) 6 ] натрийдің гексафтороалюминаты натрийдің тетрагидроксоалюминаты калийдің гексационоферраты (II)
Слайд 38
[Cu(NH 3 ) 4 ]SO 4 мыстың (ІІ) тетрааминсульфаты [Ag(NH 3 ) 2 ] Cl күмістің диамминхлориді хромның (ІІІ) гексааквахлориді [Cr(H 2 O) 6 ]Cl 3 КОМПЛЕКСТІ ҚОСЫЛЫСТАРДЫҢ АТАУЫ
Слайд 39: Қорытынды:
Комплексті қосылыстар – құрамына комплексті иондар кіретін күрделі заттар. Комплексті ион – бұл d - металдар мен лигандалардан тұратын иондар. Лиганда – d - металмен донорлы - акцепторлы байланыс түзетін комплексті ионның құрамына енетін молекула немесе ион. Координациялық сан – комплексті ионның құрамына енетін лигандалар саны.
Последний слайд презентации: Презентация Та қырыбы: Кешенді қосылыстар: Қолданылған әдебиеттер
Ж.Шоқыбаев. «Бейорганикалық және аналитикалық химия» Н.С. Ахметов. Общая и неорганическая химия. М.: Высшая школа. 2003. С. 107-113. Чернобельская Г.М. Методика обучения химии в средней школе. М.: ВЛАДОС, 2000. Учебная программа по дисциплине «Общая и неорганическая химия». 2001. 19 с. М.И. Сафарова. Общая и неорганическая химия в схемах и таблицах. Ч.1. Теоретические основы неорганической химии. Учебное пособие. Саратов. СВИРХБЗ. 2006. С. 80. Интернет желісі