Слайд 2
1. Беттік энергия және беттік керілу 2. Беттік керілудің орта полярлығына тәуелділігі 3. Беттік белсенді заттар 4. Беттік ак т ивтілі к
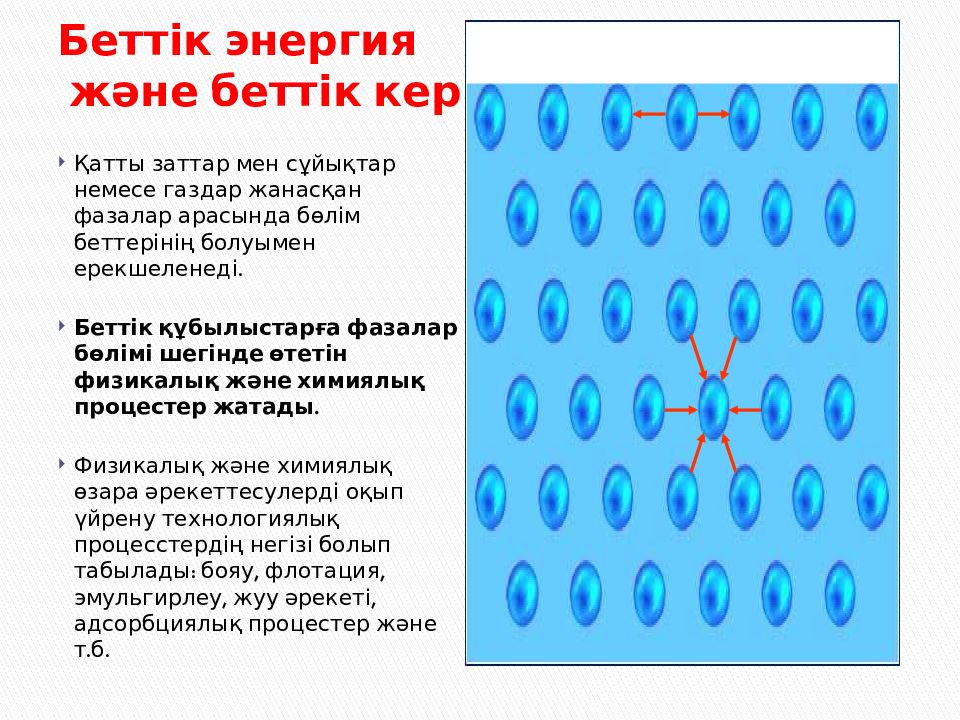
Слайд 3: Беттік энергия және беттік керілу
Қатты заттар мен сұйықтар немесе газдар жанасқан фазалар арасында бөлім беттерінің болуымен ерекшеленеді. Беттік құбылыстарға фазалар бөлімі шегінде өтетін физикалық және химиялық процестер жатады. Физикалық және химиялық өзара әрекеттесулерді оқып үйрену технологиялық процесстердің негізі болып табылады: бояу, флотация, эмульгирлеу, жуу әрекеті, адсорбциялық процестер және т.б.
Слайд 4
Барлық беттік процестердің жүруі еркін беттік энергиямен байланысты. Беттік энергия беттік өлшемнің беттік керілу туындысына тең. G = σ ∙ s d G = σ ∙ ds σ – беттік керілу, s – беттің өлшемі.
Слайд 5
Сұйықтың беттік мөлшерін азайтуға себепші болатын аралық шектің бірлік өлшеміндегі ұзындығына әсер етуші күшті беттік керілу күші немесе жай ғана беттік керілу дейді. Беттік керілу тәуелді: Сұйықтықтың табиғатына; Температураға σ↓, Т↑; Қысымға σ↓; Р ↑; Еріген заттардың табиғаты мен концентрациясына (↓мүмкін, ↑ және әсер етпейді).
Слайд 6: Беттік керілу құбылысына мысалдар
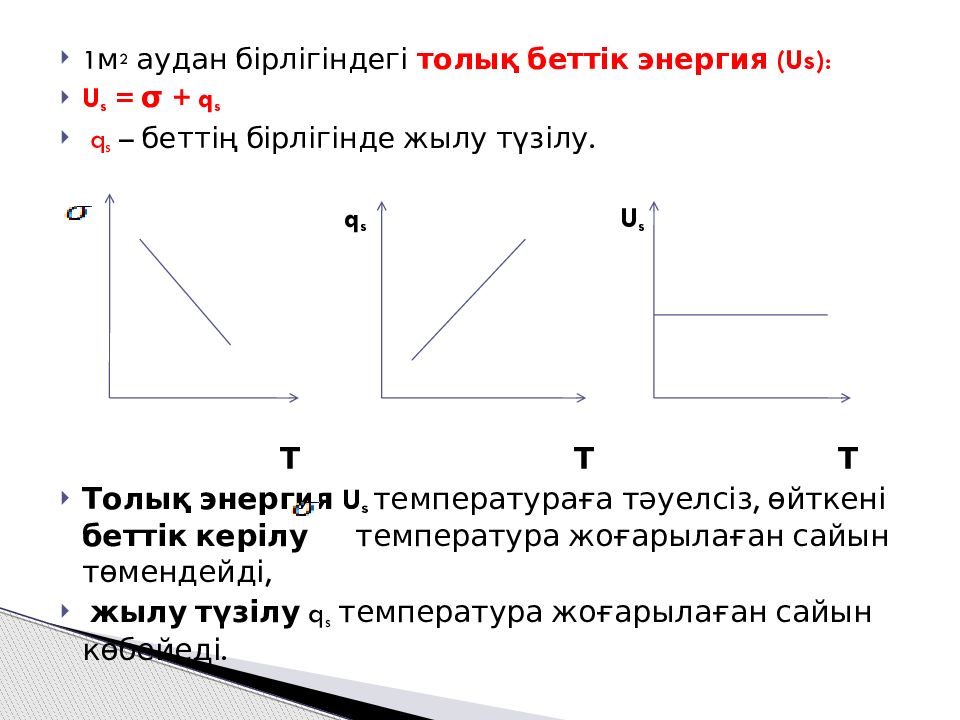
Слайд 7
1м 2 аудан бірлігіндегі толық беттік энергия (Us) : U s = σ + q s q s – беттің бірлігінде жылу түзілу. q s U s Т Т Т Толық энергия U s температураға тәуелсіз, өйткені беттік керілу температура жоғарылаған сайын төмендейді, жылу түзілу q s температура жоғарылаған сайын көбейеді.
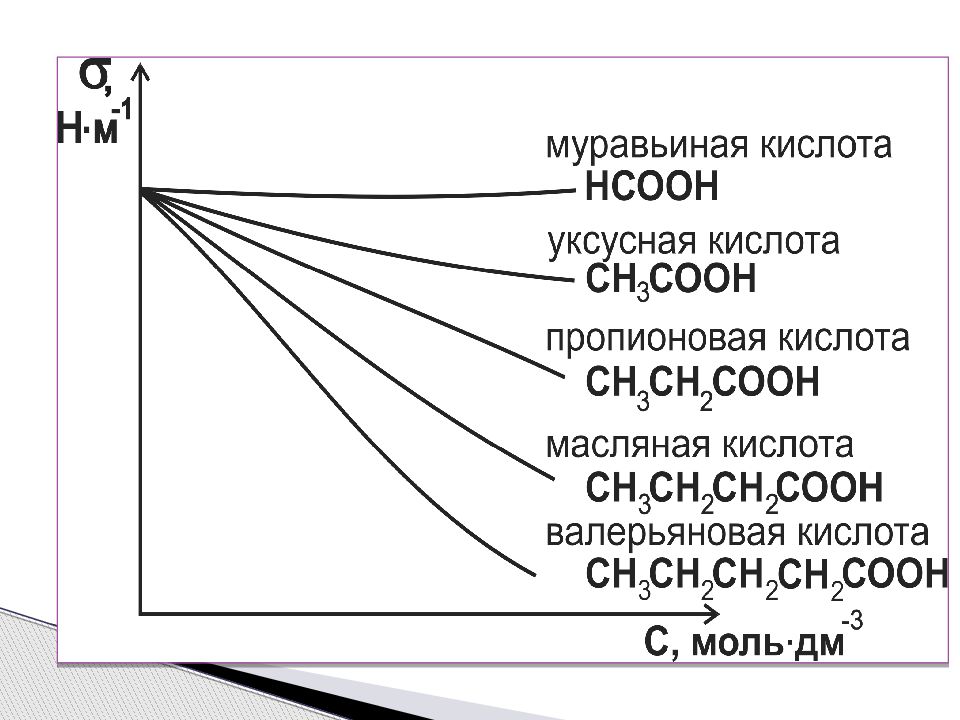
Симметриялы құрылымды молекулалары бар сұйықтар үшін (бензол, көміртегі тетрахлориді, қаныққан көмірсутектер) беттік керілу полярлық функциясы болып табылады. Полярлығы жоғары болған сайын, беттік керілу де жоғары болады. Ассиметриялы құрылысы бар сұйықтар үшін (қышқылдар, спирттер, аминдер, кетондар) беттік керілу өзгермейді. Беттік керілудің орта полярлығына тәуелділігі
Слайд 9
Беттік керілудің сұйықтың полярлығына тәуелділігі. 1 – симметриялы молекулалар үшін; 2 – ассиметриялы молекулалар үшін. 1 2 П
Слайд 10
Сұйық-газ және сұйық-сұйық жүйеде беттік керілу фазалардың полярлығының айырымымен анықталады. Ре биндер ережесі: Фазалардың полярлылығының айырымы ∆П көп болса, бөлім шегінің беттік керілуі де жоғары болады. ∆П өлшемін келесі формула бойынша есептейді: ∆П = П 1 - П 2 = П 1, П 2 – фазалардың полярлығы; ε – 1 және 2 фазалардың диэлектрлік өткізгіштігі
Слайд 11: Беттік белсенді заттар
Беттік керілудің жоғарылауын туғызатын заттардың еруі беттік инактивті заттар деп аталады. Беттік керілуді өзгертпейтін заттардың еруі беттік активсіз заттар деп аталады. Оларға көп полярлы топтары бар заттар жатады. Беттік керілуді төме н дететін заттардың еруі беттік активті заттар (БАЗ) деп аталады. БАЗ – ға симметриялы емес құрылысы бар полярлы (-СООН, -ОН, - NH 2, -NО 2 ) және полярсыз топтары бар органикалық қосылыстар жатады. Беттік белсенді заттар
Слайд 12
Зат Қосылыстар кластары Беттік активті заттар ( БАЗ ) Спирттер, карбон қышқылдары, күрделі эфирлер, аминдер Беттік инактивті заттар ( БИЗ ) Бейорганикалық қышқылдар, тұздар, негіздер, аминосірке қышқылы (глицин) Беттік активтігі жоқ заттар ( БАЖЗ ) Сахароза
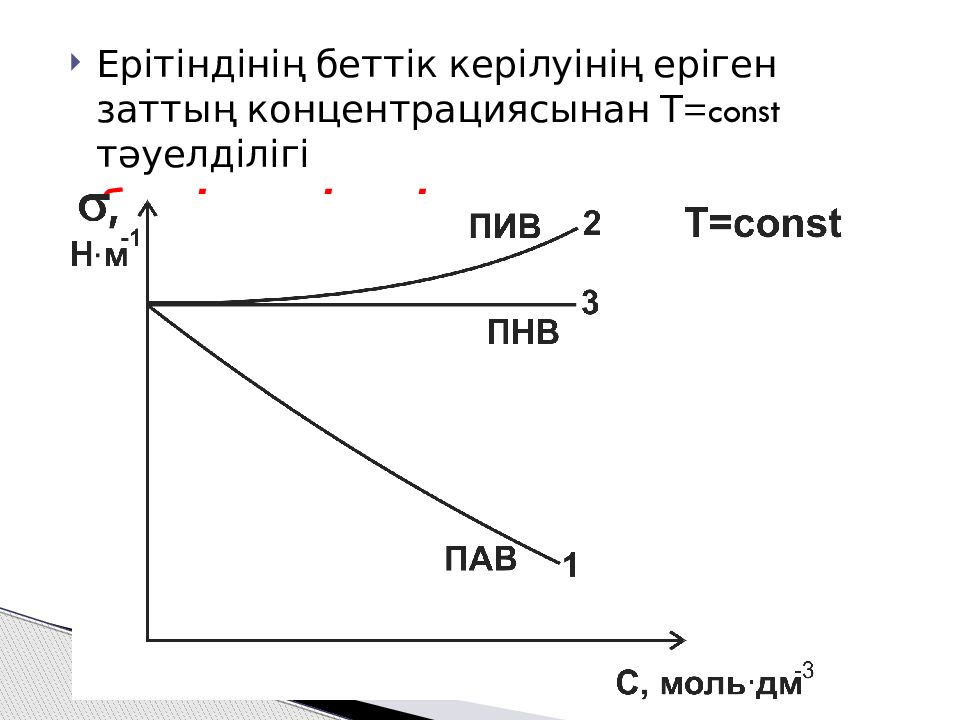
Слайд 13
Ерітіндінің беттік керілуінің еріген заттың концентрациясынан Т=const тәуелділігі беттік керілудің изотермасы деп аталады.
Слайд 14
1 – беттік активті заттар үшін 2 – беттік инактивті заттар үшін 3 – беттік активсіз заттар
Слайд 15
БАЗ бөлінеді: A. Ионогенді БАЗ (анионактивті, катионактивті, амфотерлі); Б. Ионогенді емес БАЗ. A. Ионогенді БАЗ: 1.Анионактивті БАЗ – суда беттік активті аниондар түзілумен диссоциацияланатын БАЗ. Оларға: карбон қышқылдары мен олардың тұздары (сабын), C 17 H 33 COONa – Na олеаты, алкилсульфаттар (RSO 3 Me), фосфаттар т.б. Анионактивті БАЗ иондары теріс зарядталған. 2.Катионактивті БАЗ - суда беттік активті катиондар түзілумен диссоциацияланатын БАЗ. Катионды БАЗ: біріншілік, екіншілік, үшіншілік аминдердің тұздары, алкилпиридинді қосылыстар т.б. Катионактивті БАЗ иондары оң зарядталған.
Слайд 16
3. Амфотерлі БАЗ – екі функционалды топтары бар БАЗ (қышқылдық және негіздік сипаттағы). Оларға алкиламиноқышқылдар R NH 2 СООН т.б. Б. Ионогенді емес БАЗ иондарға диссоциацияланбайтын молекулалары бар заттар: этилен окисінің молекулалары бар жоғары молекулалы спирт немесе қышқылдар жатады: (С n Н 2n+1 (ОСН 2 СН 2 ) m ОН).
Слайд 17: БАЗ-дың практикада қолданылуы
Бетонды пластификациялау Бетонның бірігуін баяулатқыштар БАЗ-ды диспергатор, стабилизатор, флотореагенттер, жуатын дезинфекциялайтын құралдар ретінде қолданады. Флотация ағынды сулардың үстінен мұнай қалдықтарын, майларды алып тастау үшін қолданылады.
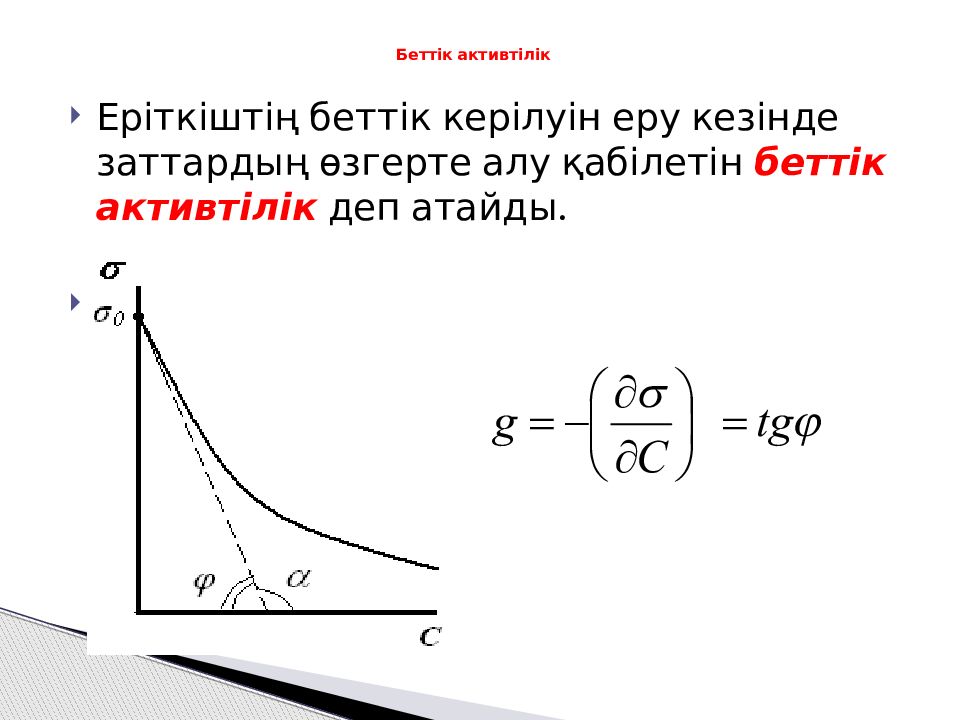
Слайд 18: Беттік ак т ивтілік
Еріткіштің беттік керілуін еру кезінде заттардың өзгерте алу қабілетін беттік активтілік деп атайды. Беттік ак т ивтілік
Слайд 19: Дюкло-Траубе ережесі
Қосылыстардың беттік активтілігі үлкен болған сайын, молекуланың полярлы ассиметриясы күштірек байқалады. БАЗ молекуласының полярсыз бөлігінің беттік активтілікке әсері Дюкло-Траубе ережесімен сипатталады: Берілген гомологтық қатардағы БАЗ көміртегі тізбегі ұзындығының бір СН 2 топқа өсуі кезінде қаныққан май қышқылдарының сулы ерітінділердегі беттік активтілігі 3-3,5 есе өседі. Дюкло-Траубе ережесі
Слайд 21: Шишковский теңдеуі
Беттік керілудің концентрациядан тәуелділігі Шишковский теңдеуімен өрнектеледі: - ерітінді мен еріткіштің беттік керілуі; с – концентрация; А,В – тұрақты константалар. Шишковский теңдеуі
Слайд 22: Ылғалдану, жайылу, адгезия, когезия
Беттік керілу мен фаза ішіндегі молекул а аралық өзара әрекет ылғалдану мен қатты және сұйық бетте сұйық тамшыларының жайылу процестерін тудырады. 1. Ылғалдану – сұйықтың қатты затпен және басқа сұйықпен ауамен жанасқандағы өзара әрекеттесуі нәтижесінде болатын беттік құбылыс. Ылғалдаудың технологиялық процестерде – бояу, сіңдіру, маталарды бояу, кен байыту, флотация т.б. үлкен маңызы бар. Ылғалдану, жайылу, адгезия, когезия
Слайд 23
2. Жайылу : Сұйық тамшы қатты дененің бетіне түссе мынадай болуы мүмкін: 1) Тамшы жайылады. 2) Шар тәрізді болуы мүмкін. 3) Қатты денемен шеттік бұрыш жасай аздап жайылады.
Слайд 24
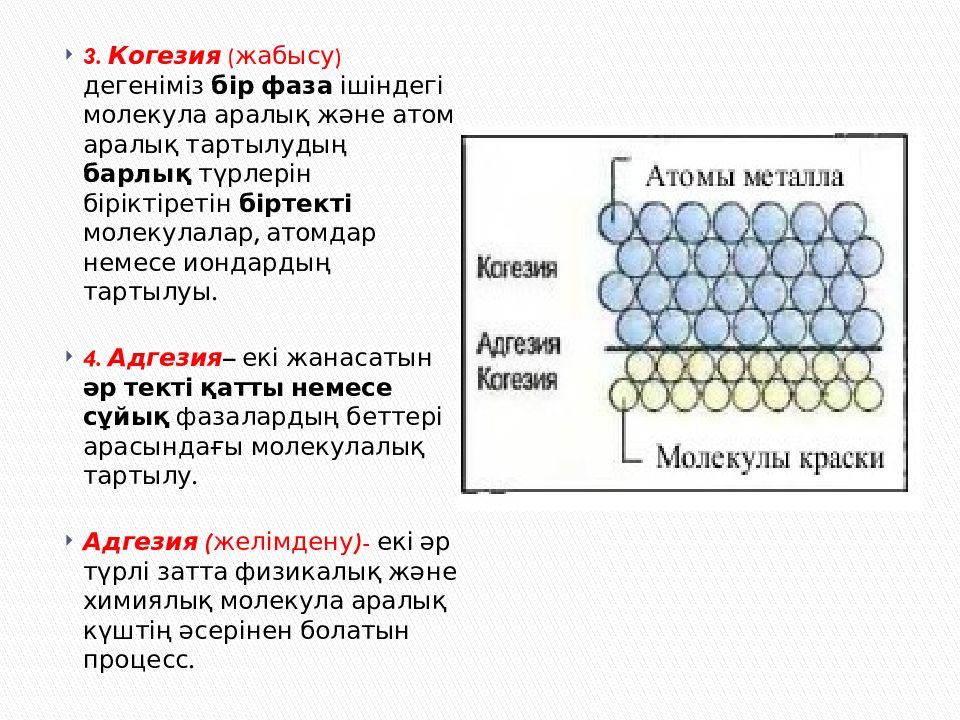
3. Когезия (жабысу) дегеніміз бір фаза ішіндегі молекула аралық және атом аралық тартылудың барлық түрлерін біріктіретін біртекті молекулалар, атомдар немесе иондардың тартылуы. 4. Адгезия – екі жанасатын әр текті қатты немесе сұйық фазалардың беттері арасындағы молекулалық тартылу. Адгезия ( желімдену ) - екі әр түрлі затта физикалық және химиялық молекула аралық күштің әсерінен болатын процесс.
Слайд 25
Адгезия мен когезия құбылыстары көптеген технологиялық процестерде маңызды роль атқарады: желімдеу; лак бояулы және гальваникалық жабындыларда; бояу процесінде; баспа жұмыстарында; металлдарды біріктіру (сварка) т.б.