Первый слайд презентации: Валидация аналитических методик
Слайд 3: Цель:
1. миниминизация и количественная оценка возможности возникновения ошибок 2. 3. одним методом можно определять разные вещества 4.
Слайд 4
5. Один метод на разном оборудовании – различная точность (погрешности) 6. Методика – метод + пробоподготовка – погрешности 7. Персонал (случайные ошибки)
Идентификация веществ _______________________________________________________________ Количественное определение _________________________________ Контроль предельно допустимых значений содержания примесей Определение количественного содержаний веществ в ЛП
Слайд 7: Особенности
Слайд 8: Основные документы, регламентирующие процесс валидации :
общая фармакопейная статья ОФС в USP, ОФС РФ «Валидация фармакопейных методов», ГОСТ РФ «Точность (правильность и прецизионность) методов и результатов измерений», ГОСТ Р ИСО 5725-1-2002 (является полным аутентичным текстом международного стандарта ИСО 5725-1-1994), документы IUPAK (Международный союз фундаментальной и прикладной химии) и ICН — международной конференции по гармонизации технических требований к регистрации лекарств для человека в странах ЕС, Японии и США.
Слайд 9: Документы
ICH – международная организация по гармонизации Q2A руководство по валидации аналитических методик - термины и определения Содержит основные этапы и принципы Q2B Процедура проведения валидации аналитических методов Рекомендации по отдельным этапам
Слайд 10: организация процесса валидации методики
1. Разработать протокол валидации или рабочий процесс для валидации, в котором определить приложение, цель и область метода, эксплуатационные параметры и критерий приемки, валидационные эксперименты; 2. Определить необходимые рабочие характеристики оборудования, квалифицировать материалы, например, стандарты и реактивы; 3. Исполнить эксперименты предвалидации, корректировать параметры метода или критерии приемки в случае необходимости; 4. Исполнить полные внутренние и внешние эксперименты валидации; 5. Разработать СОП (стандартную операционную процедуру) для рутинного выполнения метода, определить критерии для ревалидации; 6. Определить тип и частоту испытаний пригодности метода; 7. Документировать эксперименты и результаты валидации в отчете.
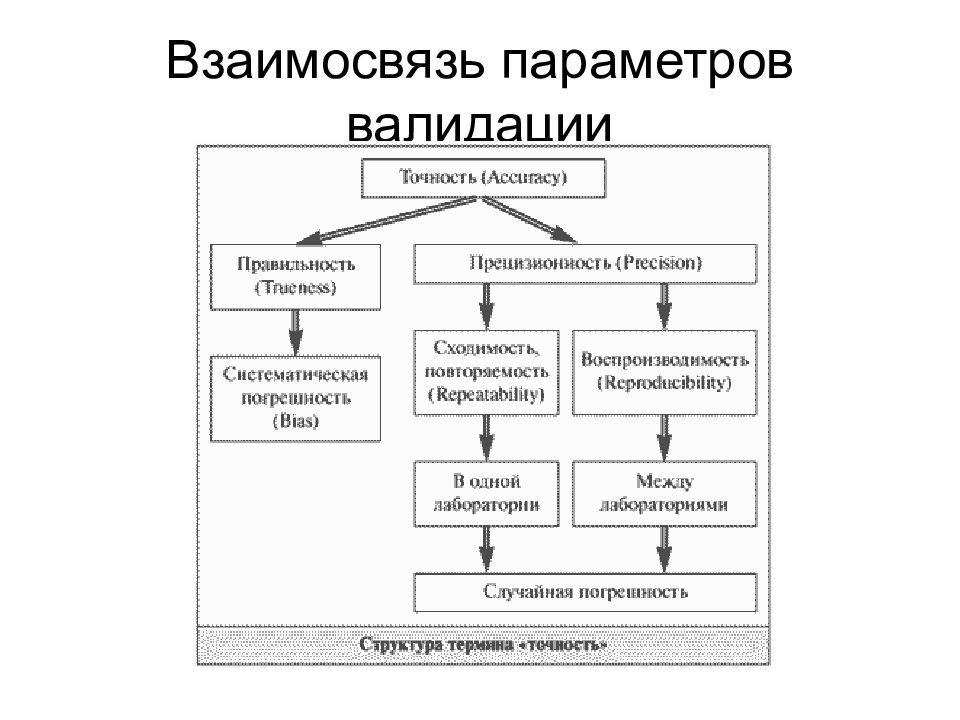
Слайд 11: Валидационные характеристики аналитических методов
_____________________ (precision) ____________________ (accuracy) ; ____________________ (reproducibility) ; ____________________ (repeatability) ____________________ (robustness) ; ___________________ (linearity); ______________________________________ (range) _________________________________________ (specificity) ; ______________________ (limit of detection - LOD ) ; ____________________________________________ ( limit of quantitation LOQ) ;
Слайд 13: Точность (рrecision)
- Показатель правильности - значение систематической ошибки. Правильность оценивается на основе не менее 9 результатов определений по всему диапазону концентраций ( __________________________________________________________________________________________________________ ) и не менее 6 определений при 100%
Слайд 14: Правильность ( аccuracy, тrueness)
- зависит только от случайных факторов не связана с истинным значением измеряемой величины выражается величиной стандартного отклонения (коэффициент вариации) показатели прецизионности - повторяемость (сходимость) и воспроизводимость
Слайд 15: повторяемость ( r epeatability)
- степень согласованности результатов измерений (испытаний), полученных одним и тем же методом на идентичных объектах испытаний, в одной и той же лаборатории, одним и тем же испытателем, с использованием одного и того же оборудования, в пределах короткого промежутка времени. Повторяемость оценивается величиной относительного стандартного отклонения S r, которая не должна превышать 2%.
Слайд 16: Воспроизводимость ( r eproducibility)
- мера совпадения результатов измерений, полученных одним и тем же методом, на идентичных образцах, в разных лабораториях, разными испытателями, с использованием различного оборудования. Воспроизводимость: Оценивается величиной относительного стандартного отклонения S r, которая не должна превышать 3%. Выражает точность результатов испытаний, проведенных в условиях различных лабораторий
Слайд 17: Устойчивость ( robustness )
- (изменение состава, скорости потока или рН мобильной фазы в методах ВЭЖХ, температуры в ГХ, длины волны в УФВ- методах, рН среды и др.) Изучаются в ходе робастности: Параметры методики Стабильность растворов ВЭЖХ – смена колонки
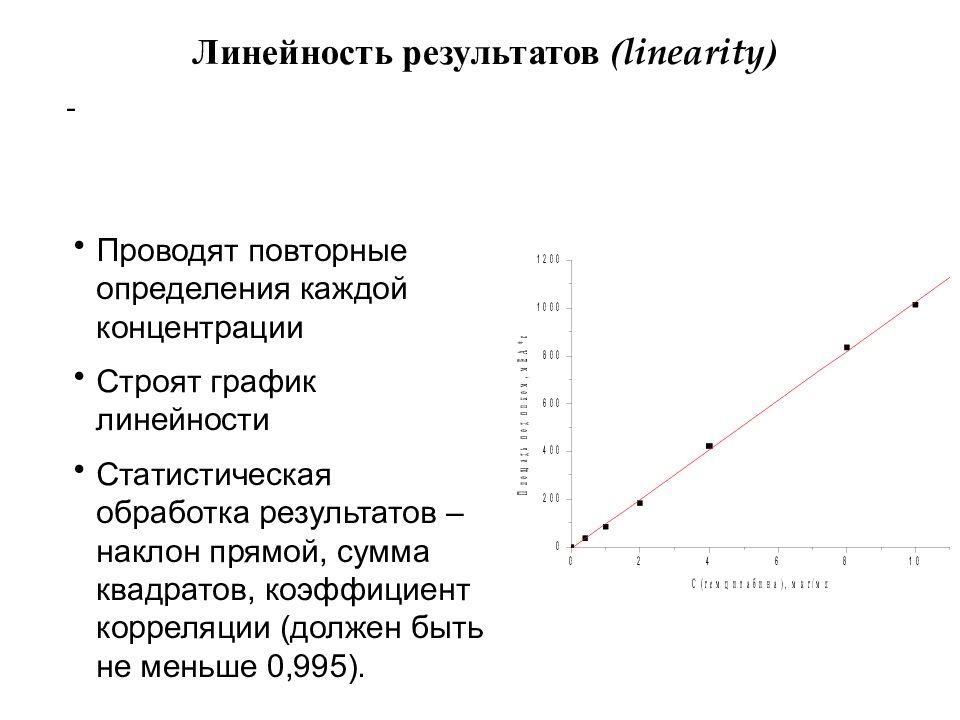
Слайд 18: Линейность результатов ( linearity )
- Проводят повторные определения каждой концентрации Строят график линейности Статистическая обработка результатов – наклон прямой, сумма квадратов, коэффициент корреляции (должен быть не меньше 0,995).
Слайд 19: Специфичность, селективность ( s pecifity, s electivity)
– Определяется: способностью достоверно определять лекарственное вещество в присутствии примесных соединений, продуктов деградации и вспомогательных веществ.
Слайд 20: Предел обнаружения ( limit of detection )
- Предел обнаружения обычно выражается как концентрация анализируемого вещества в образце, например, в % или долях на миллион (ppm), миллиард ( ppb ). Соотношение сигнал/шум (для методов с базовыми шумами)
Слайд 21: Пригодность системы ( s ystem suitability)
- Параметры пригодности системы обеспечивают соблюдение валидности метода в тех случаях, когда в процессе анализа возможны некоторые внутрилабораторные изменения условий анализа. Тесты пригодности системы зависят от типа метода, но особенно важны для хроматографических методов.
Слайд 23: Категория / типы методик
Категории: Трансфер (проверка пригодности в условиях конкретной лаборатории) Методика, разработанная впервые …. Типы: 1. фармакопейные 2. нефармакопейные (производидитель) Испытуемые образцы: Субстанция ЛП
Слайд 24: План валидации
- первый этап Содержание: Лист утверждения Состав валидационной группы Описание аналитического метода Условия эксперимента Порядок проведения валидации и критерии приемлемости График проведения Бланки-формы
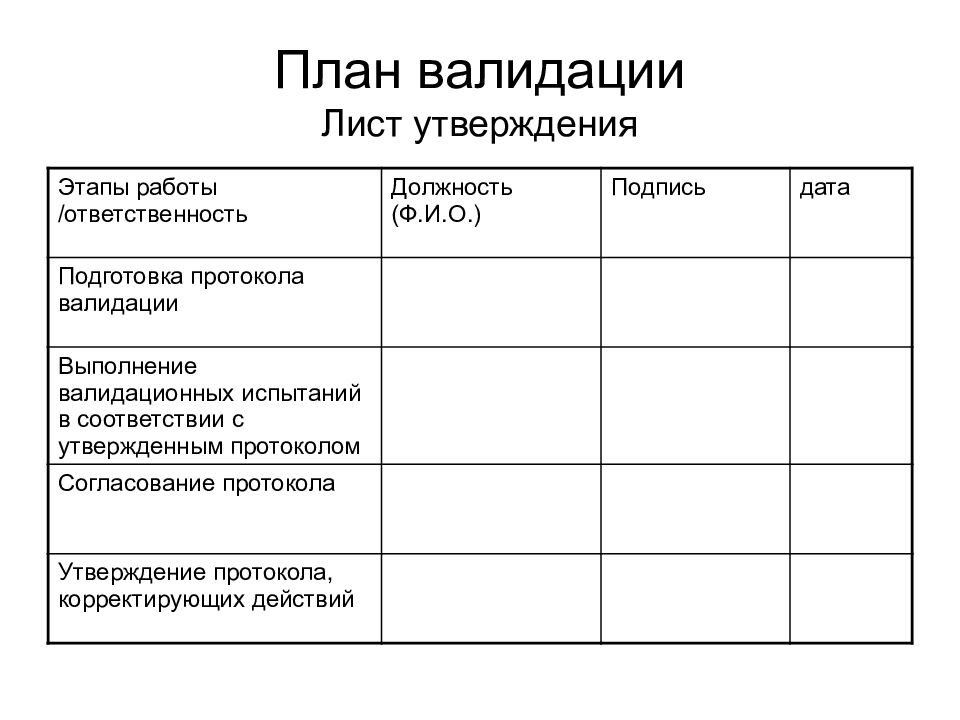
Слайд 25: План валидации Лист утверждения
Этапы работы /ответственность Должность (Ф.И.О.) Подпись дата Подготовка протокола валидации Выполнение валидационных испытаний в соответствии с утвержденным протоколом Согласование протокола Утверждение протокола, корректирующих действий
Слайд 26: Порядок тестирования валидационных характеристик
Специфичность Точность Диапазон Пределы Правильность Линейность Робастность
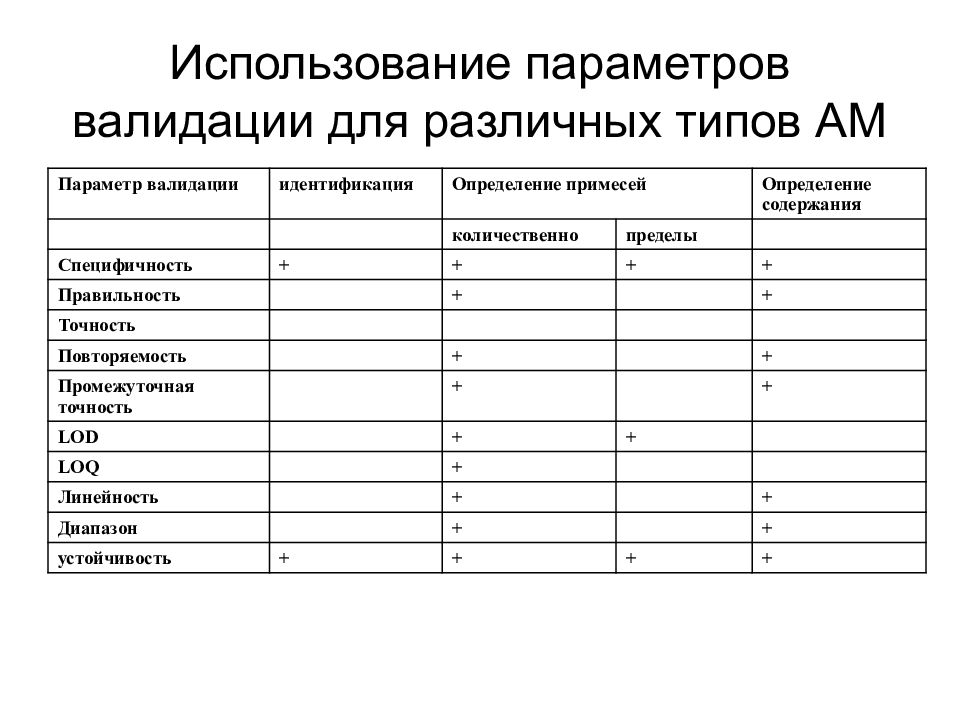
Слайд 27: Использование параметров валидации для различных типов АМ
Параметр валидации идентификация Определение примесей Определение содержания количественно пределы Специфичность + + + + Правильность + + Точность Повторяемость + + Промежуточная точность + + LOD + + LOQ + Линейность + + Диапазон + + устойчивость + + + +
Слайд 29: Валидация спектрофотометрических методик
При проведении валидации необходимо доказать, что методика позволяет контролировать качество данного ЛС на оборудовании и в условиях данной лаборатории, а также в любой другой лаборатории на любом другом оборудовании, при условии, что оно отвечает требованиям Фармакопеи и/или дополнительным требованиям. Особенностью валидации многоволнового СФ-анализа - прогноз погрешности должен обязательно предшествовать экспериментальной валидации — бессмысленно экспериментально проверять методику, которая заранее дает неприемлемо высокую погрешность.
Слайд 30
В отчет о валидации методики обычно рекомендуется включать : — цель и контекст метода (область применения, процедура); — тип анализируемых веществ и матрицы; — детальную информацию о реактивах, эталонах и приготовлении контрольных (стандартных) образцов; — процедуры для проверок качества стандартов и используемых реактивов; — соображения безопасности; — параметры метода; — критические параметры, установленные при испытании прочности; — перечень оборудования и его функциональных и эксплуатационных характеристик, например (для хроматографии), размеры ячейки, шум базовой линии, диапазон температур колонки;
Последний слайд презентации: Валидация аналитических методик
— детальные условия проведения экспериментов, включая подготовку пробы; — процедуры вычислений и статистической обработки результатов; — процедуры для контроля качества в процессе эксплуатации методики (например, испытания пригодности системы); — графическую информацию, например хроматограммы, спектры и калибровочные кривые; — пределы эксплуатационных данных для принятия метода; — ожидаемую неопределенность результатов измерения; — критерии для ревалидации; — специалистов, которые разрабатывали и первоначально валидировали метод; — резюме и заключения.