Первый слайд презентации: Аминокислоты и белки
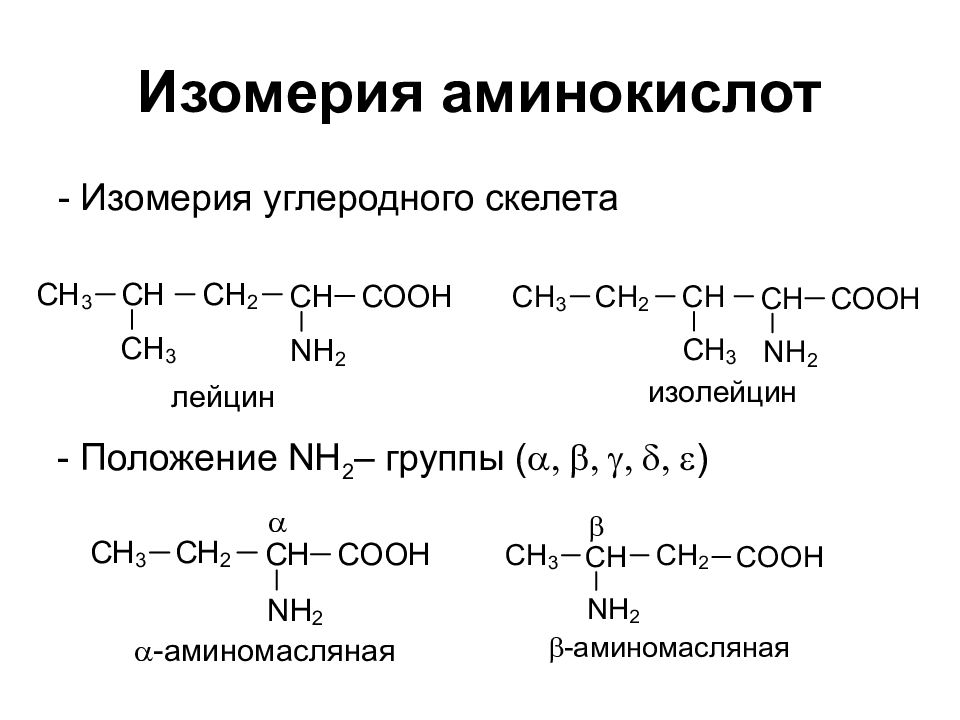
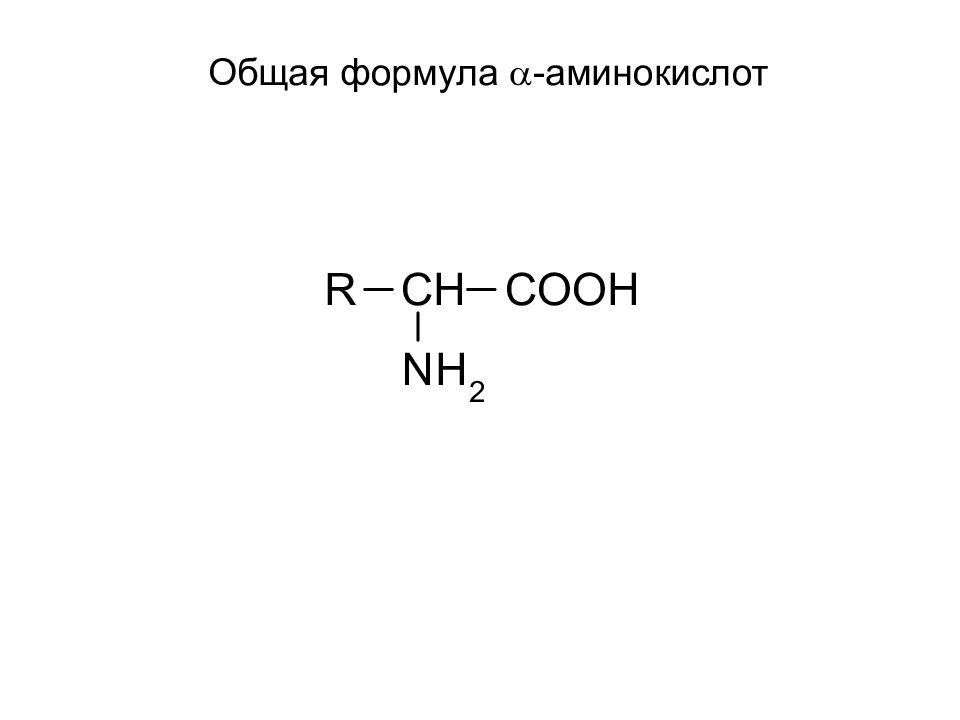
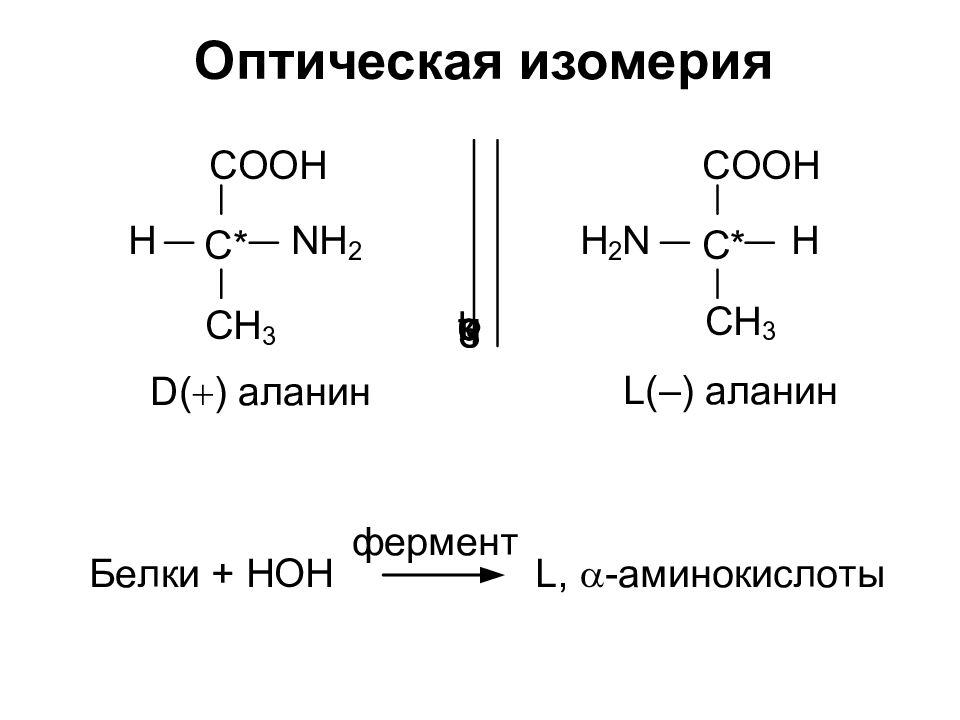
Слайд 2: Изомерия аминокислот
- Изомерия углеродного скелета - Положение NH 2 – группы ( a, b, g, d, e )
Слайд 5
Незаменимые a - аминокислоты Валин Лейцин Изолейцин Лизин Треонин Метионин Фенилаланин Триптофан
Слайд 6
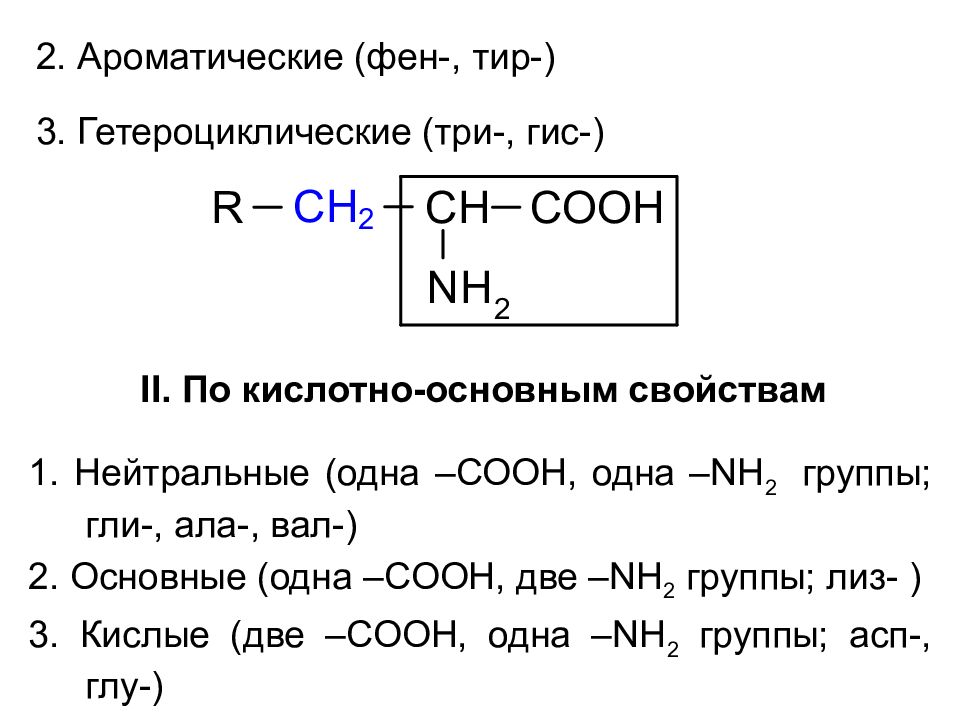
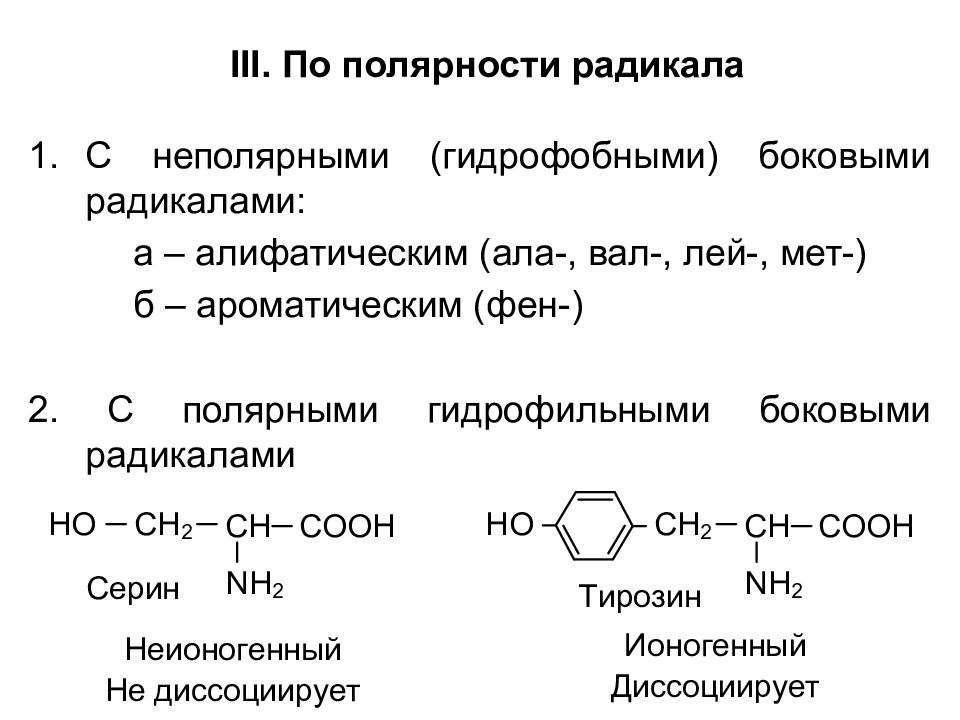
Классификация По химической природе радикала Алифатические (гли-, ала-, вал-, лей-) по дополнительным функциональным группам: – OH ( сер-, тре- ) – COOH ( асп-, глу- ) – NH 2 CO ( аспарагин, глутамин ) – NH 2 (лиз-) – SH ( цис- ), -S- ( мет- )
Слайд 7
2. Ароматические (фен-, тир-) 3. Гетероциклические (три-, гис-) II. По кислотно-основным свойствам 1. Нейтральные (одна – COOH, одна –NH 2 группы; гли-, ала-, вал-) 2. Основные (одна – COOH, две – NH 2 группы; лиз- ) 3. Кислые (две –COOH, одна – NH 2 группы; асп-, глу-)
Слайд 8
III. По полярности радикала С неполярными (гидрофобными) боковыми радикалами: а – алифатическим (ала-, вал-, лей-, мет-) б – ароматическим (фен-) 2. С полярными гидрофильными боковыми радикалами
Слайд 9
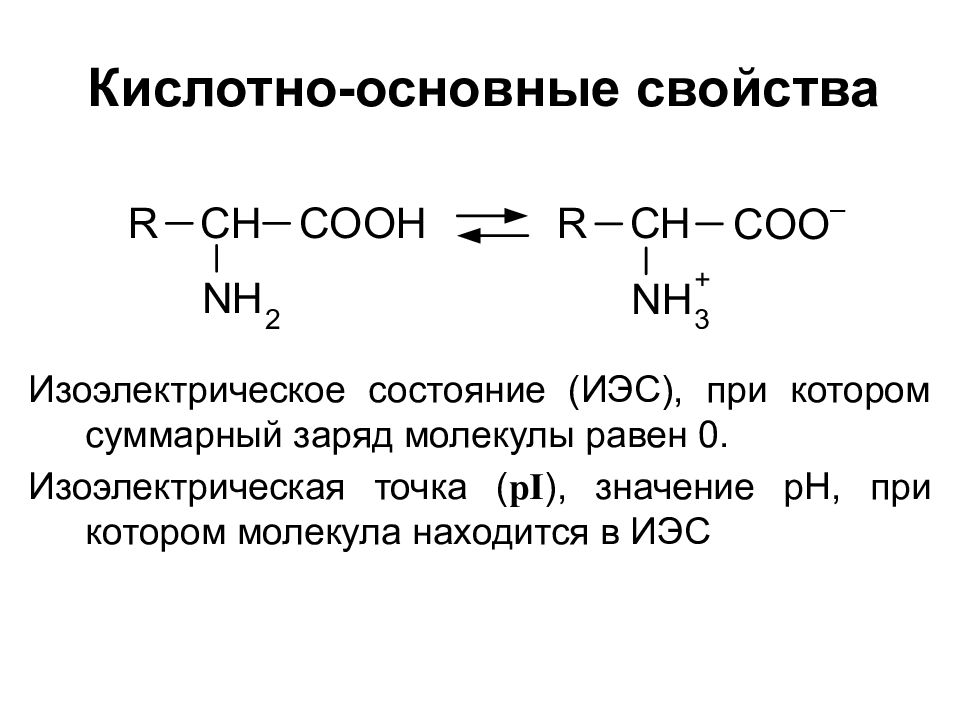
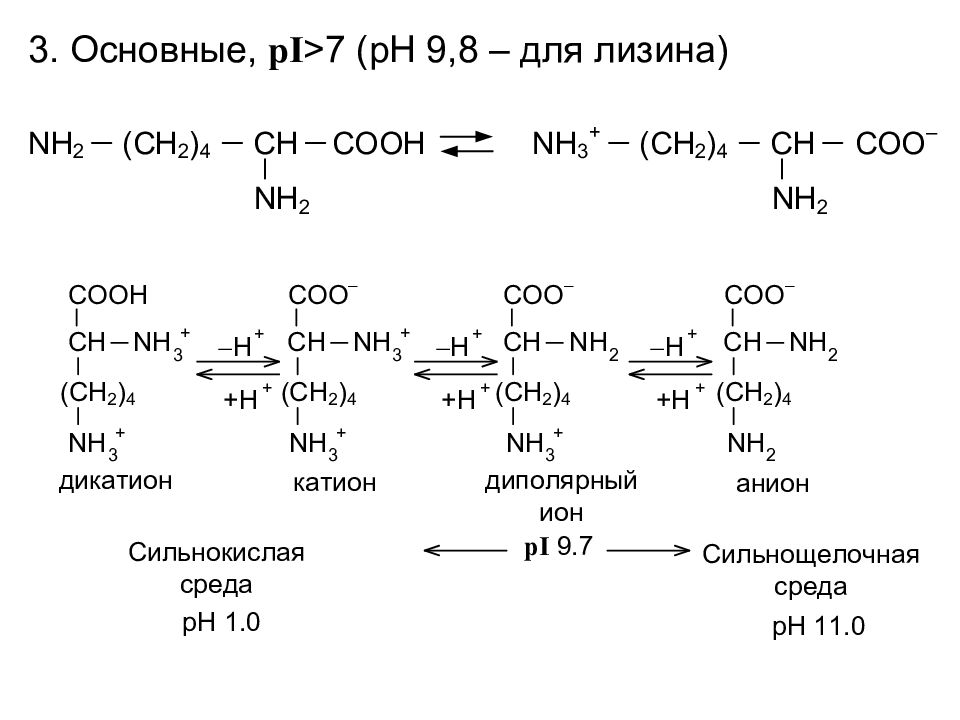
Кислотно-основные свойства Изоэлектрическое состояние (ИЭС), при котором суммарный заряд молекулы равен 0. Изоэлектрическая точка ( pI ), значение pH, при котором молекула находится в ИЭС
Слайд 10
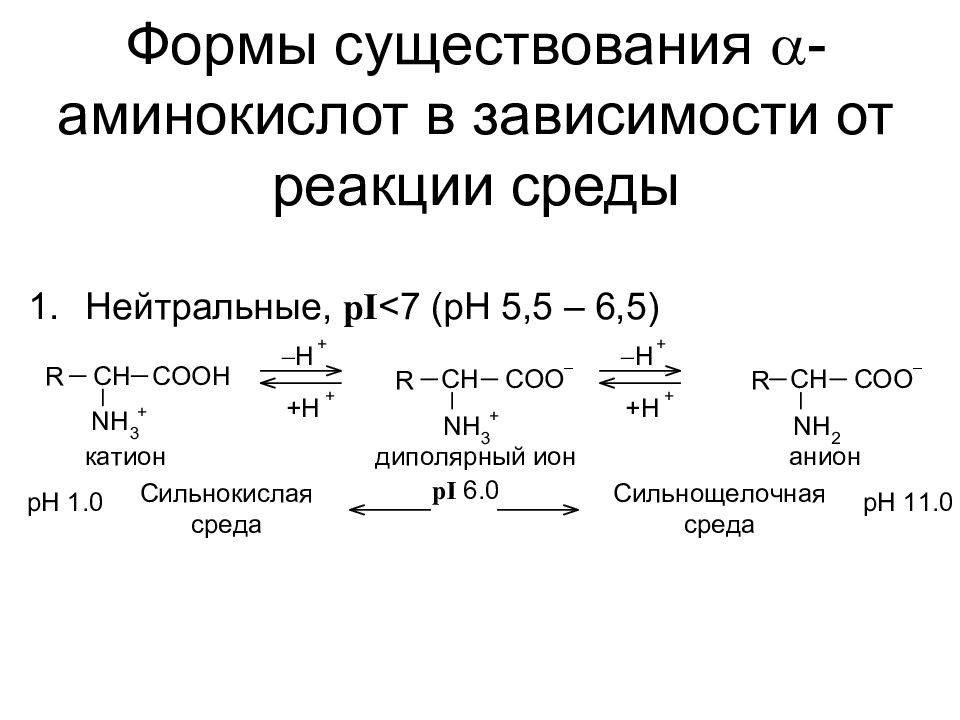
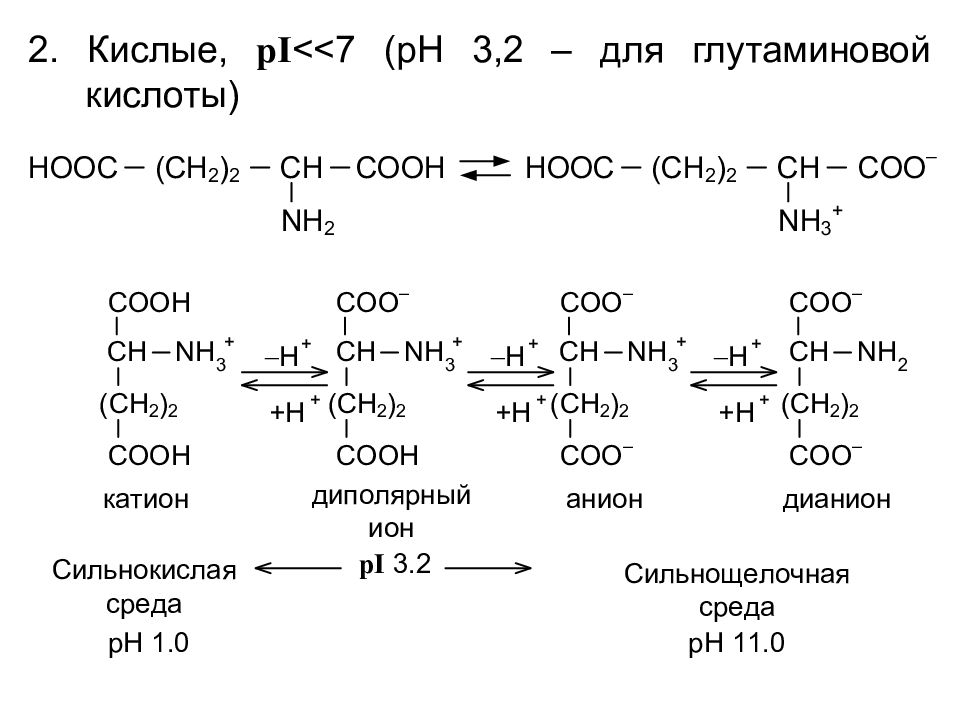
Формы существования a - аминокислот в зависимости от реакции среды Нейтральные, pI <7 (pH 5,5 – 6,5)
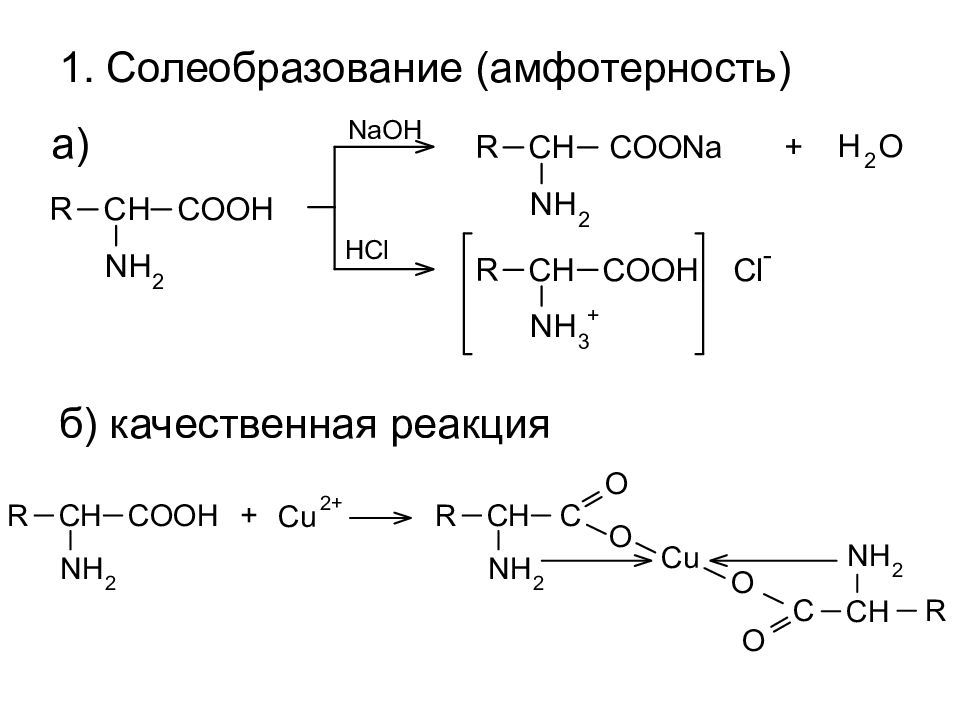
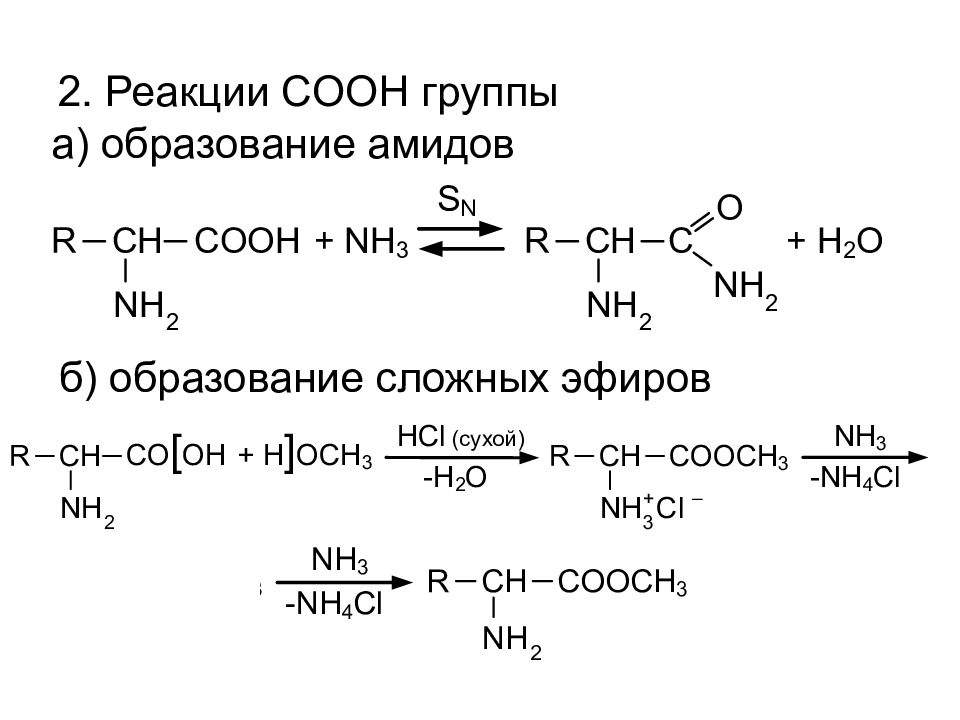
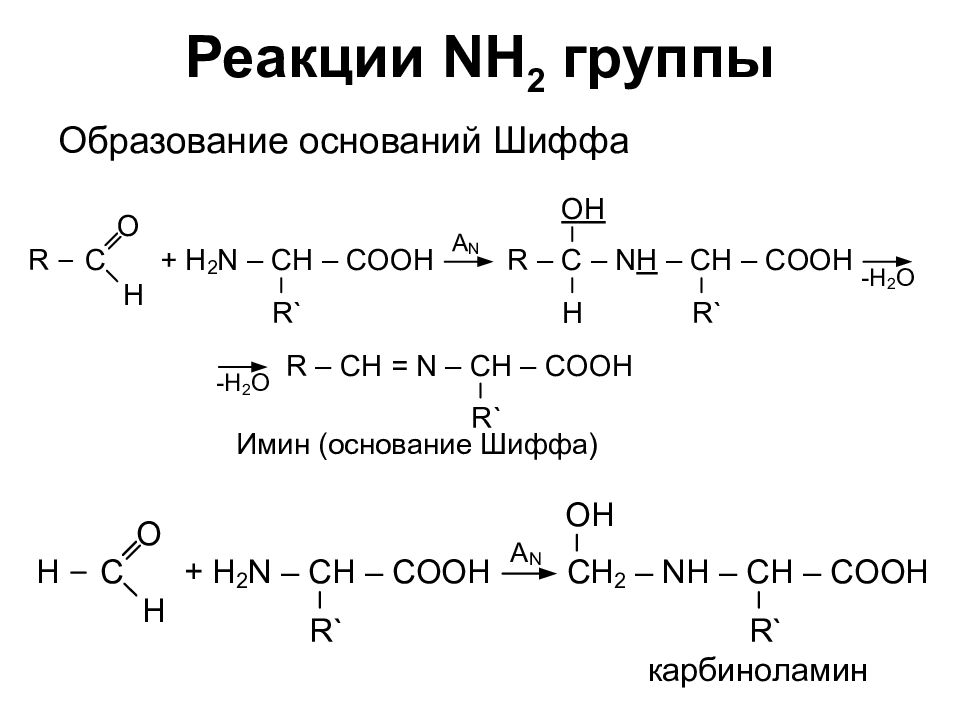
Слайд 14: 2. Реакции COOH группы
б) образование сложных эфиров а) образование амидов
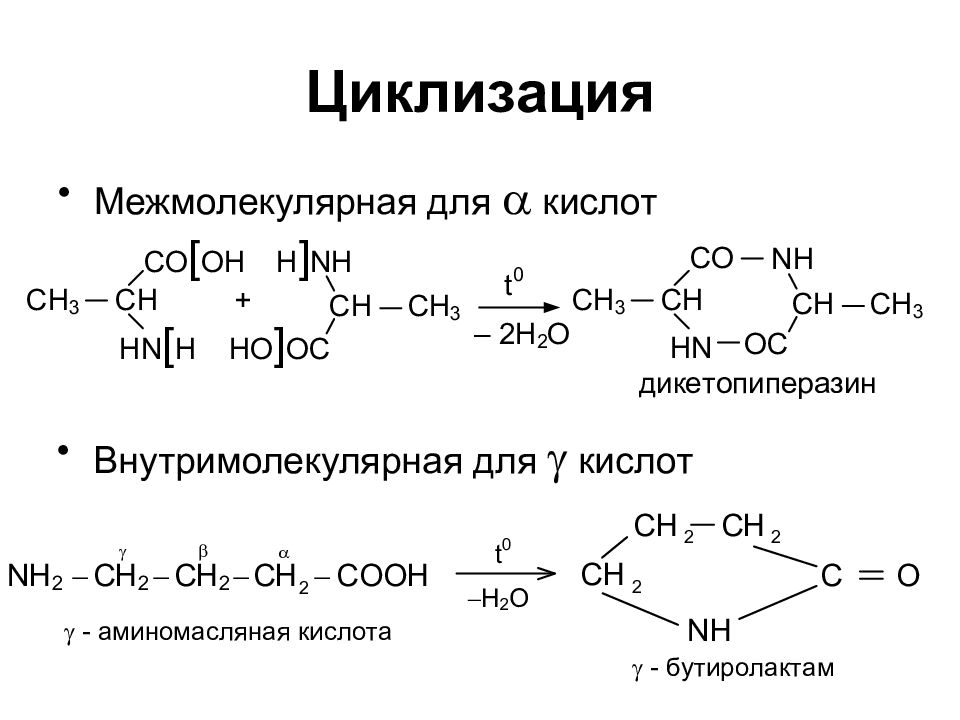
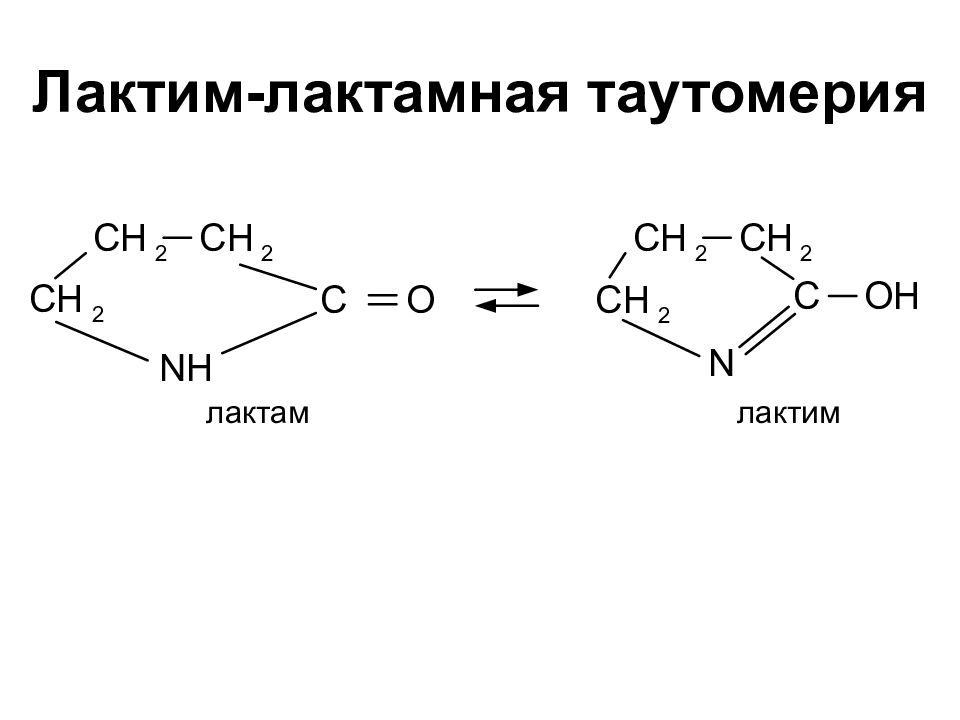
Слайд 16: Циклизация
Межмолекулярная для a кислот Внутримолекулярная для g кислот
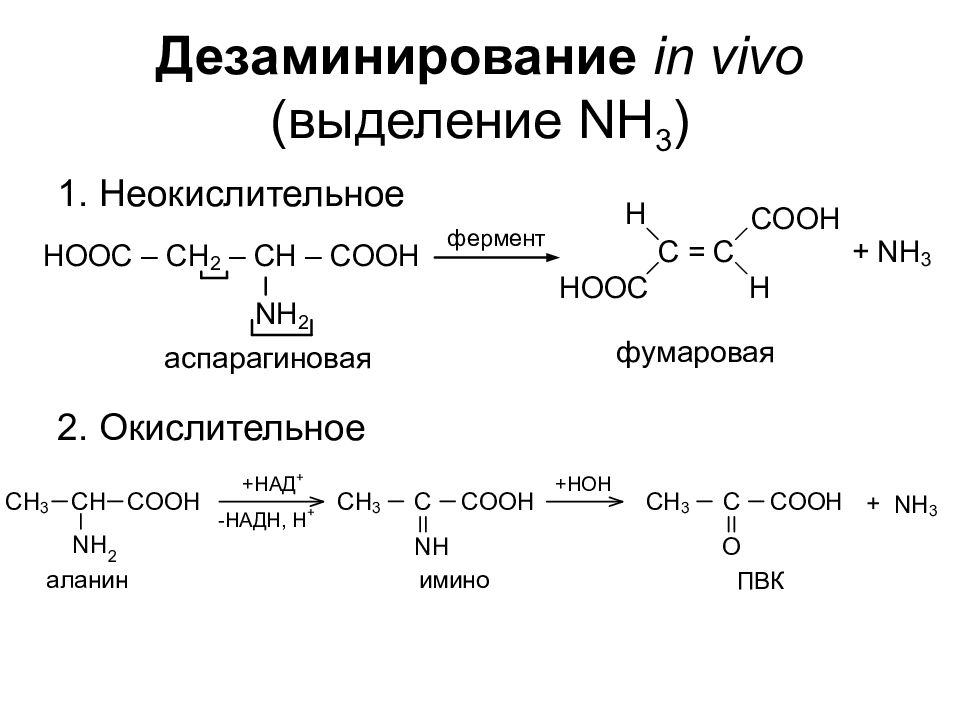
Слайд 19: Дезаминирование in vivo (выделение NH 3 )
1. Неокислительное 2. Окислительное
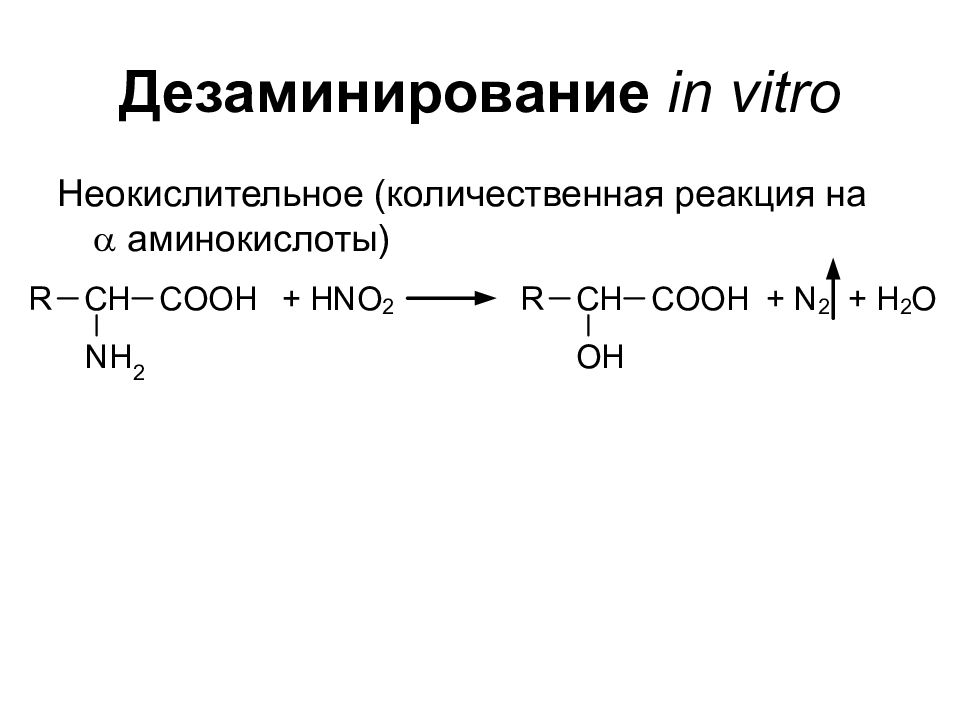
Слайд 20: Дезаминирование in vitro
Неокислительное ( количественная реакция на a аминокислоты )
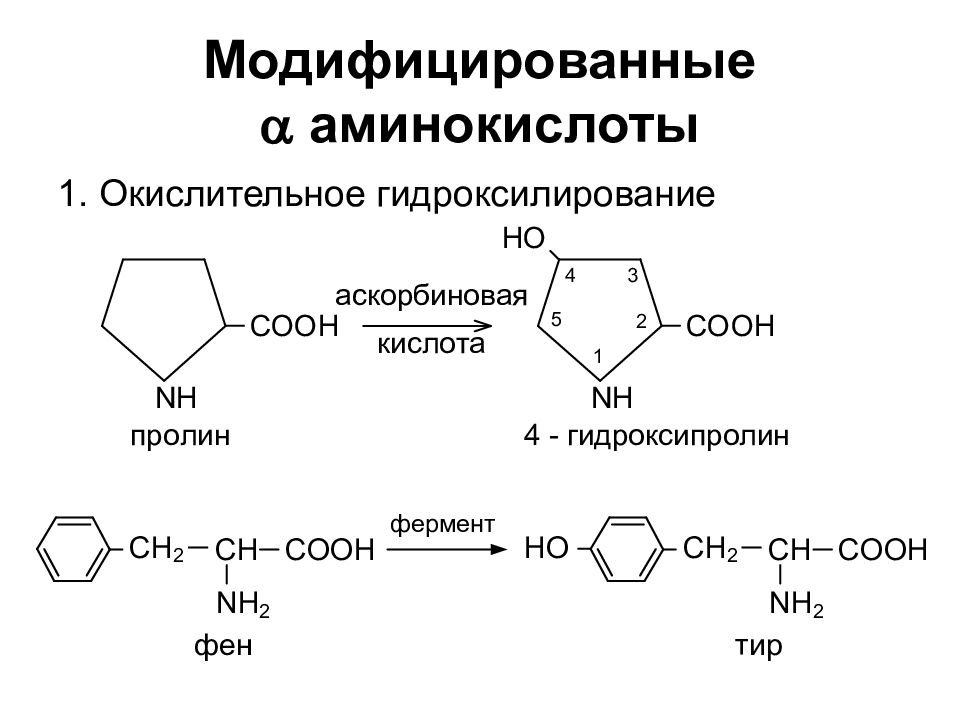
Слайд 22
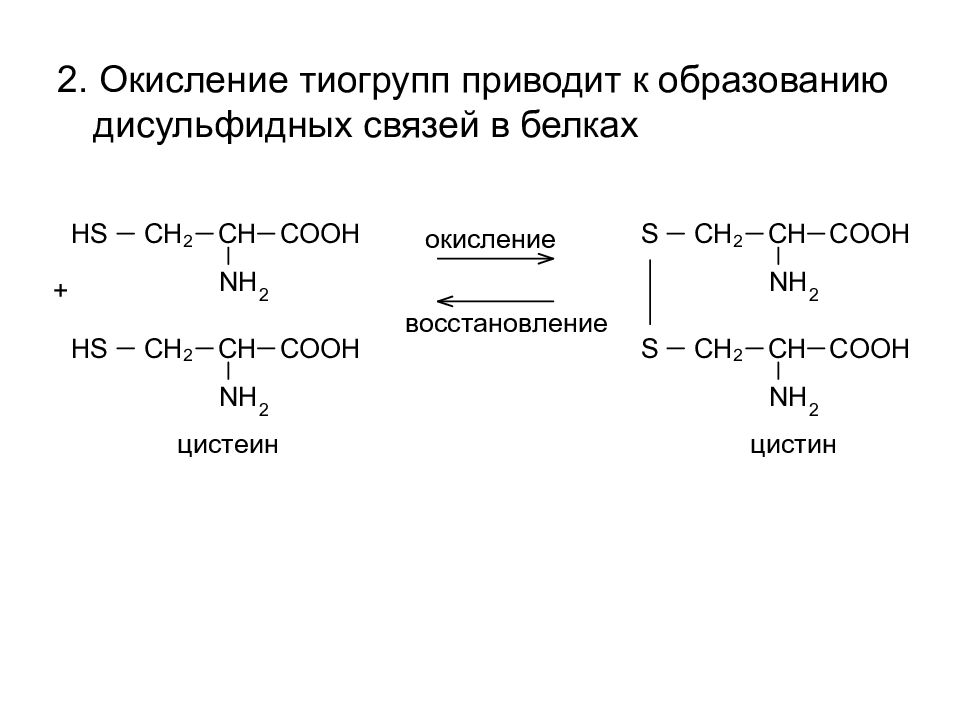
2. Окисление тиогрупп приводит к образованию дисульфидных связей в белках
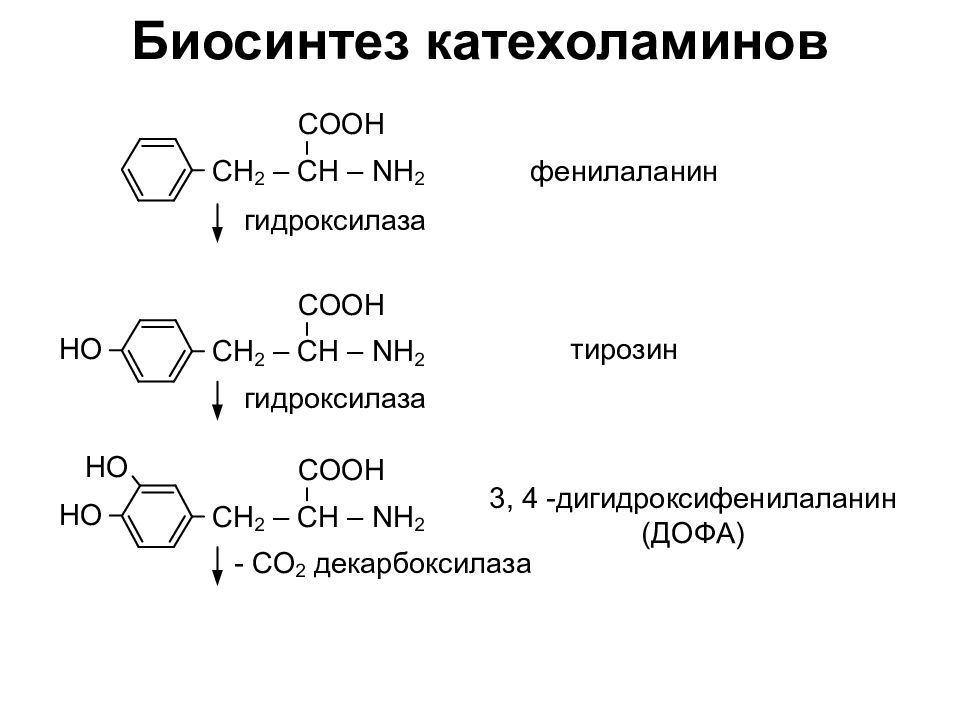
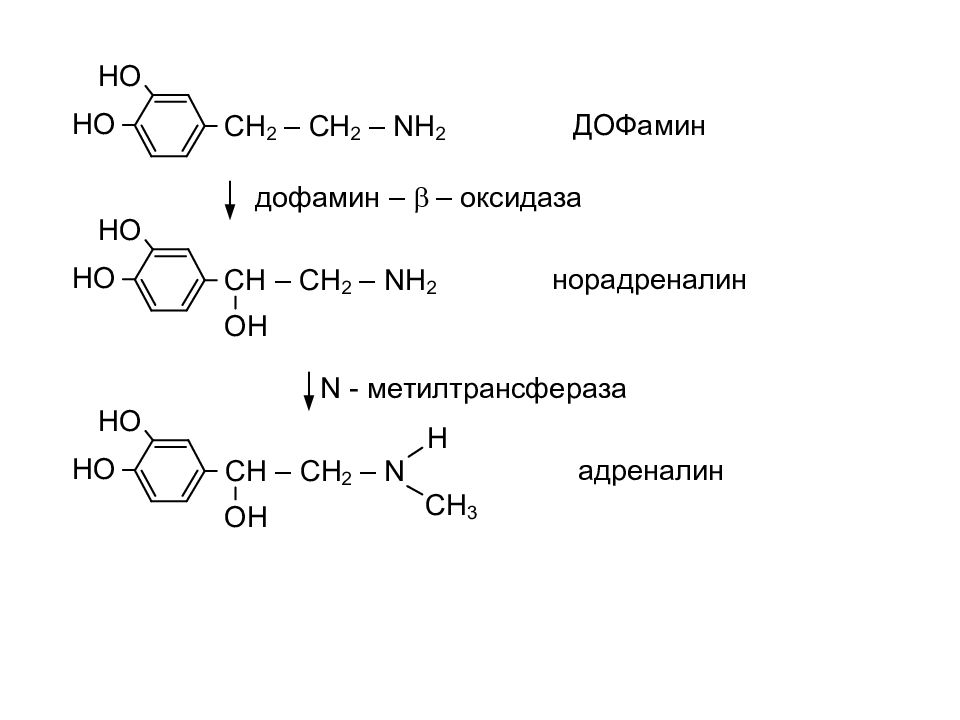
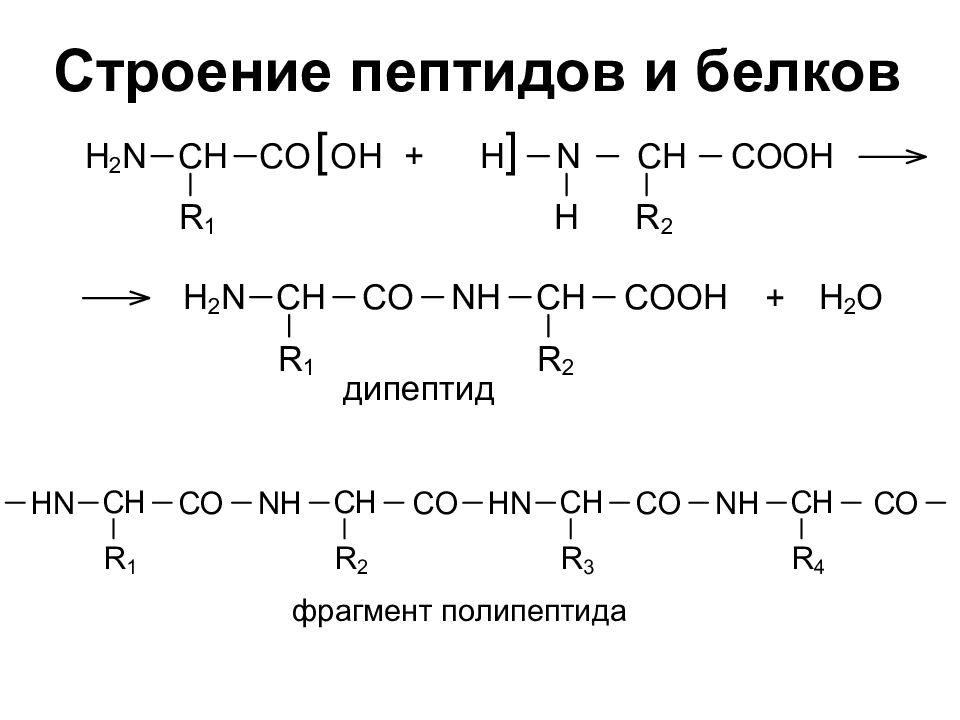
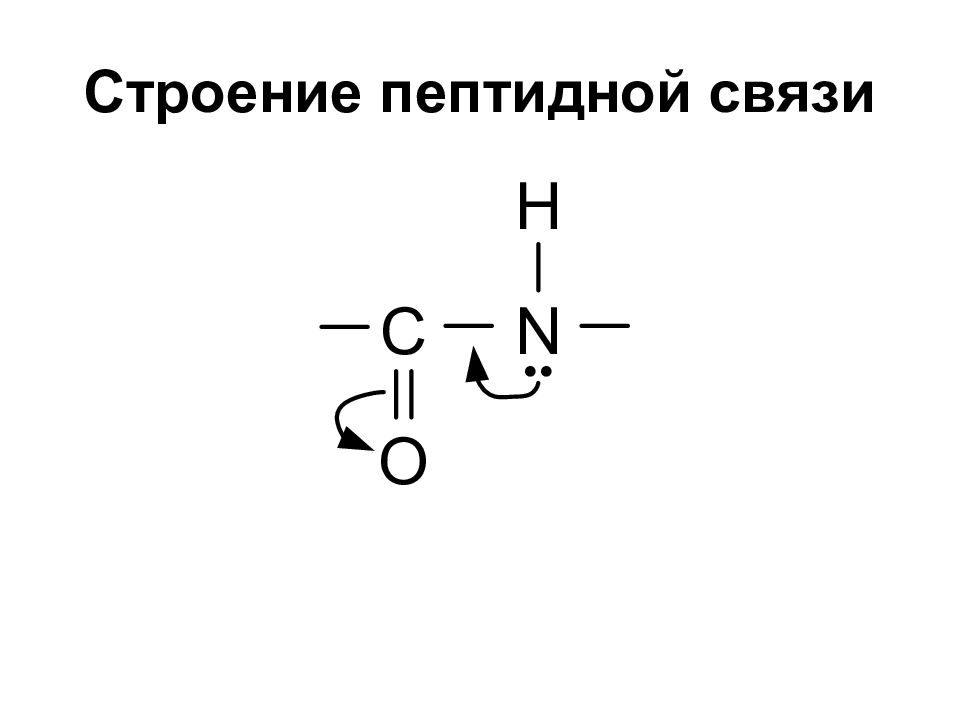
Слайд 26: Пептиды. Белки
Пептиды – соединения, построенные из a аминокислот и связанные между собой пептидными связями. Классификация пептидов по количеству аминокислот: Олиго пептиды < 10 аминокислот Поли пептиды от 10 – 100 аминокислот Белки > 100 аминокислот
Слайд 27
Сложные белки в зависимости от природы простетической группы подразделяются: Металлопротеины (ионы металлов) Фосфопротеины (остаток H 3 PO 4 ) Гликопротеины (углеводная часть) Липопротеины (липидная часть) Нуклеопротеины (нуклеиновые кислоты)
Слайд 29
Функции белков Структурная. Белки являются стройматериалом для всего живого. На 80% из белков состоят мышцы, 63% – кожа, 57% – печень. Транспортная. Перенос низкомолекулярных веществ в виде комплексов с белками. Двигательная. Мышечное сокращение за счет белков актина и миозина. Защитная. Иммунная защита основана на действии антител.
Слайд 30
Ферментативная. Регуляция скорости биохимических процессов с помощью ферментов. Регуляторная (гормоны). Запасные белки (казеин, яичный альбумин).