Первый слайд презентации: Лекция 6
1 Аминокислоты. Пептиды. Кафедра общей и медицинской химии Лекция 6
Слайд 2
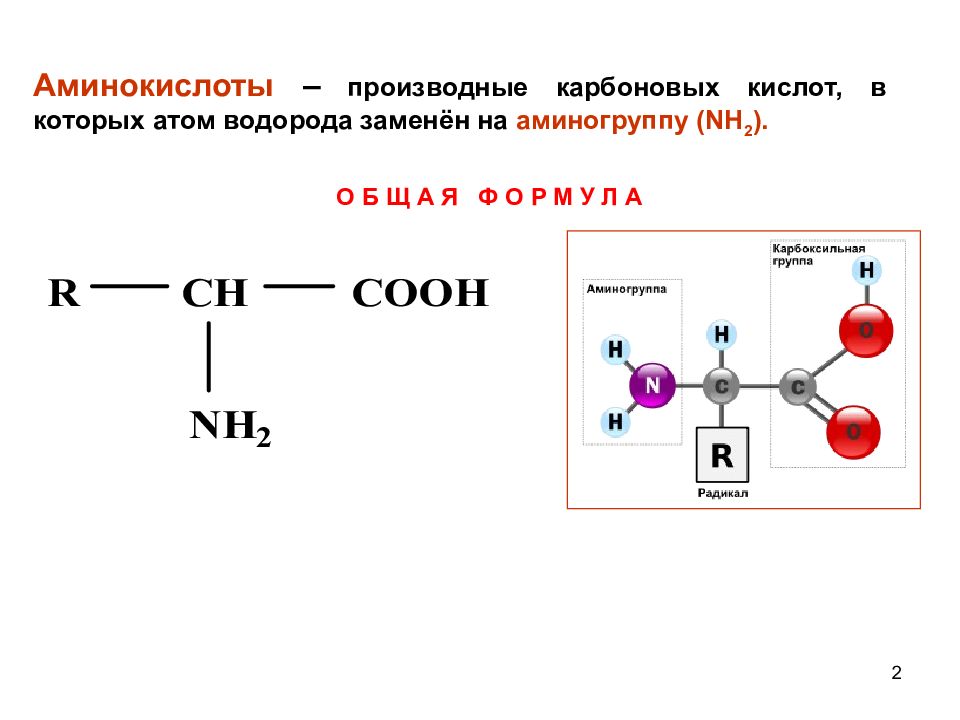
2 Аминокислоты – производные карбоновых кислот, в которых атом водорода заменён на аминогруппу ( NH 2 ). О Б Щ А Я Ф О Р М У Л А
Слайд 3
3 По положению аминогруппы различают α, β, γ, ε – структурные изомеры. CH 2 CH 2 COOH NH 2 3-аминопропановая кислота -аланин Структурные изомеры аминокислот β - аланин способствует синтезу карнозина – (дипептид -β –аланилгистидин) в мышечных клетках. Повышает выносливость мышц, увеличивает энергообеспечение и продолжительность работы мышечных волокон. Входит в состав ряда биологически активных соединений (кофермент аланин, пантотеновая кислота и др.) α β Не является незаменимой аминокислотой, но является единственной природной бета-аминокислотой
Слайд 4
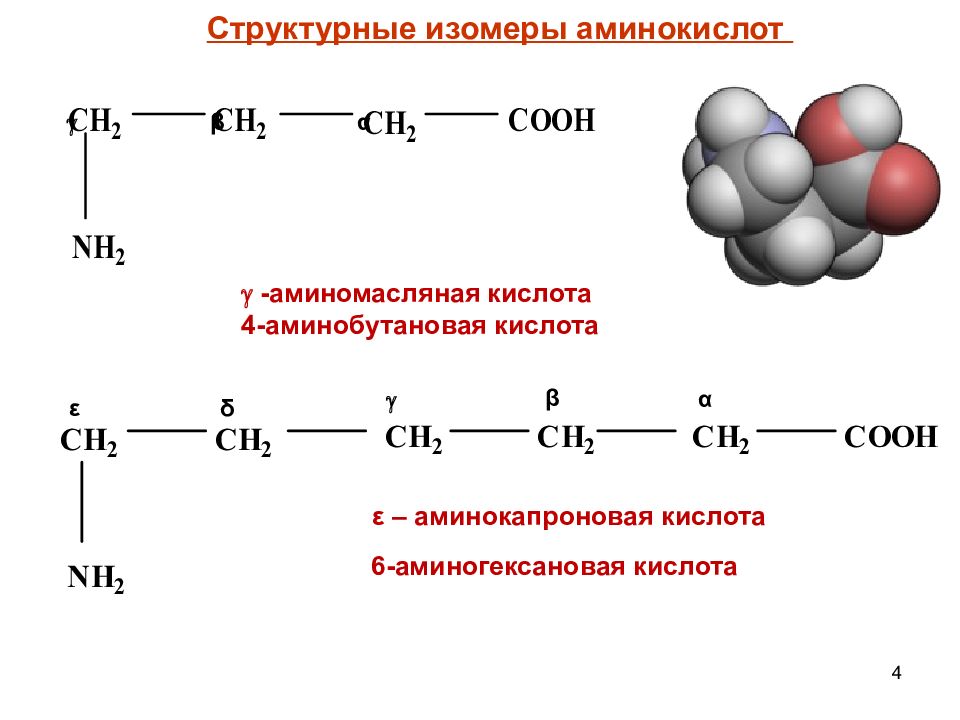
4 α β -аминомасляная кислота 4-аминобутановая кислота Структурные изомеры аминокислот α β δ ε ε – аминокапроновая кислота 6-аминогексановая кислота
Слайд 5
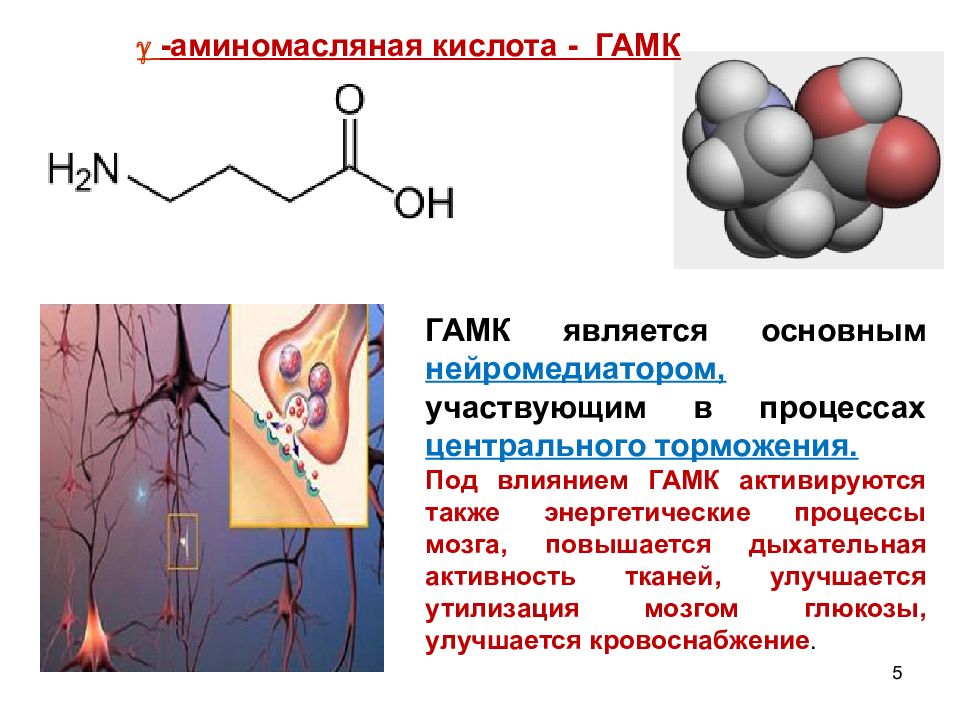
5 ГАМК является основным нейромедиатором, участвующим в процессах центрального торможения. Под влиянием ГАМК активируются также энергетические процессы мозга, повышается дыхательная активность тканей, улучшается утилизация мозгом глюкозы, улучшается кровоснабжение. -аминомасляная кислота - ГАМК
Слайд 6: аминомасляная кислота
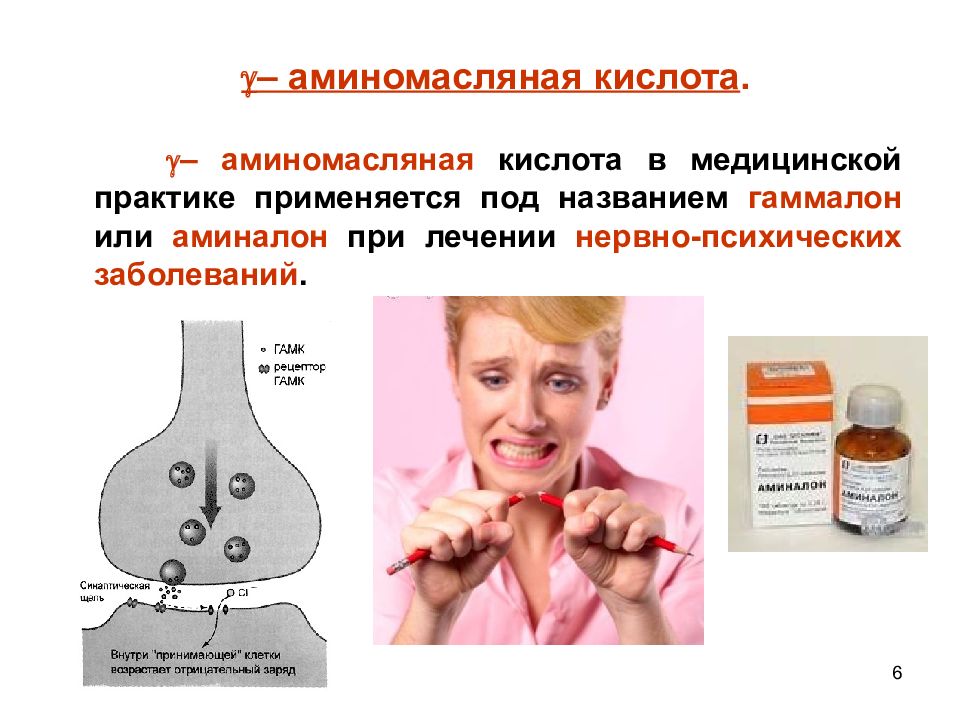
– аминомасляная кислота в медицинской практике применяется под названием гаммалон или аминалон при лечении нервно-психических заболеваний. 6
Слайд 7
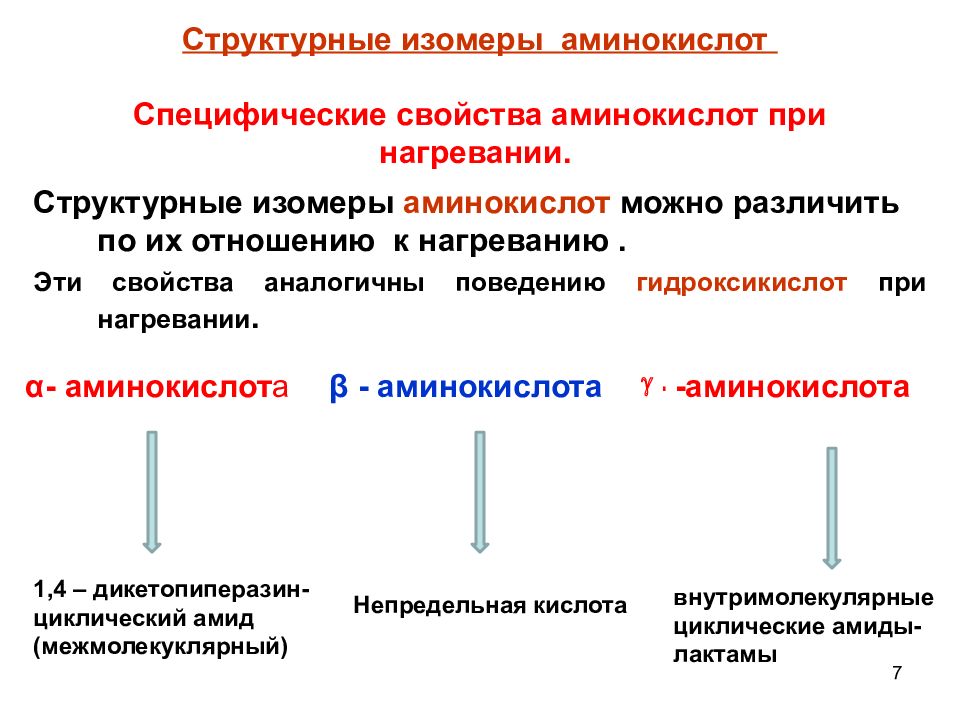
7 Структурные изомеры аминокислот Структурные изомеры аминокислот можно различить по их отношению к нагреванию. Эти свойства аналогичны поведению гидроксикислот при нагревании. Специфические свойства аминокислот при нагревании. α - аминокислот а β - аминокислота - -аминокислота 1,4 – дикетопиперазин-циклический амид (межмолекуклярный) Непредельная кислота внутримолекулярные циклические амиды-лактамы
Слайд 8
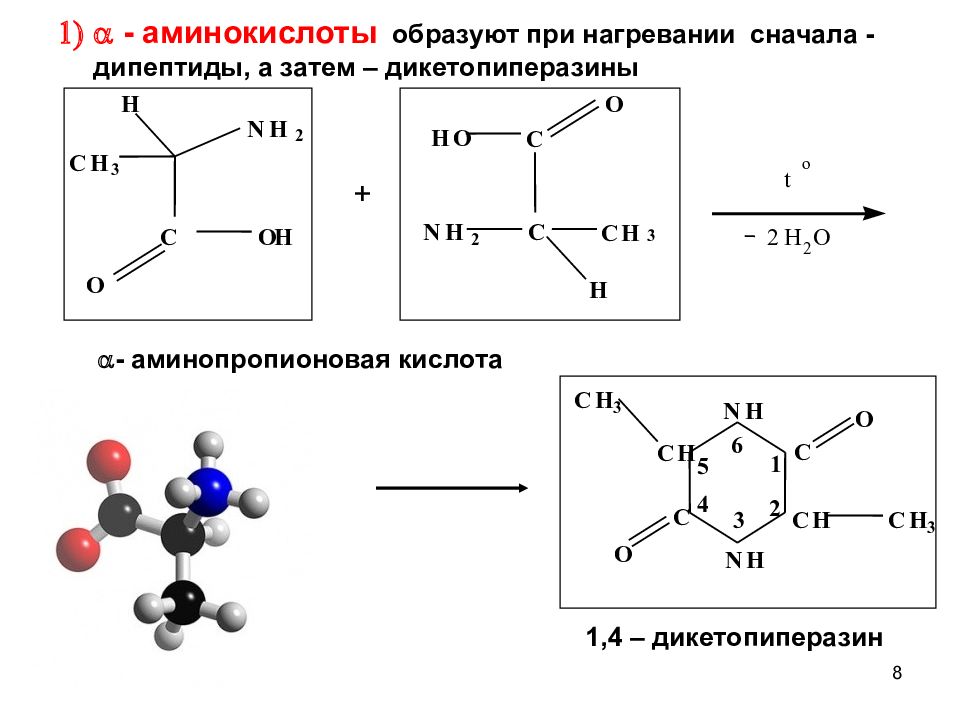
8 o t 2 H 2 O N H C O C H C H 3 N H C О C H C H 3 1 2 3 4 5 6 O H N H 2 H C H 3 C O H O C C H C H 3 O N H 2 - аминокислоты образуют при нагревании сначала - дипептиды, а затем – дикетопиперазины - аминопропионовая кислота 1,4 – дикетопиперазин +
Слайд 9
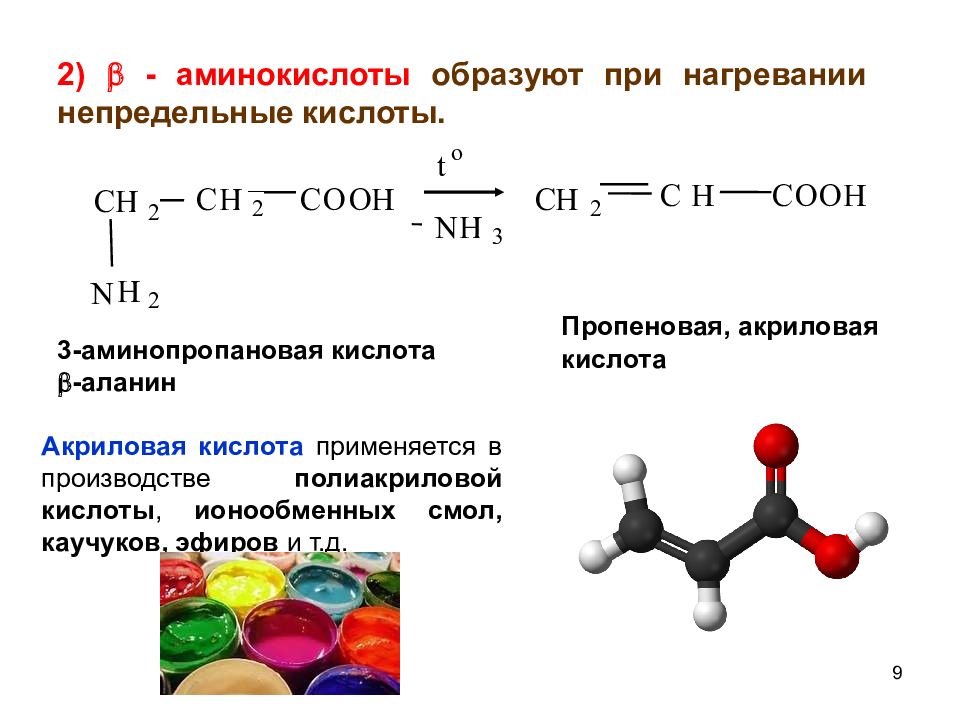
9 2 N H t o N H 3 C H 2 C H C O O H C Н 2 C H C O O H 2 2) - аминокислоты образуют при нагревании непредельные кислоты. 3-аминопропановая кислота -аланин Пропеновая, акриловая кислота Акриловая кислота применяется в производстве полиакриловой кислоты, ионообменных смол, каучуков, эфиров и т.д.
Слайд 10
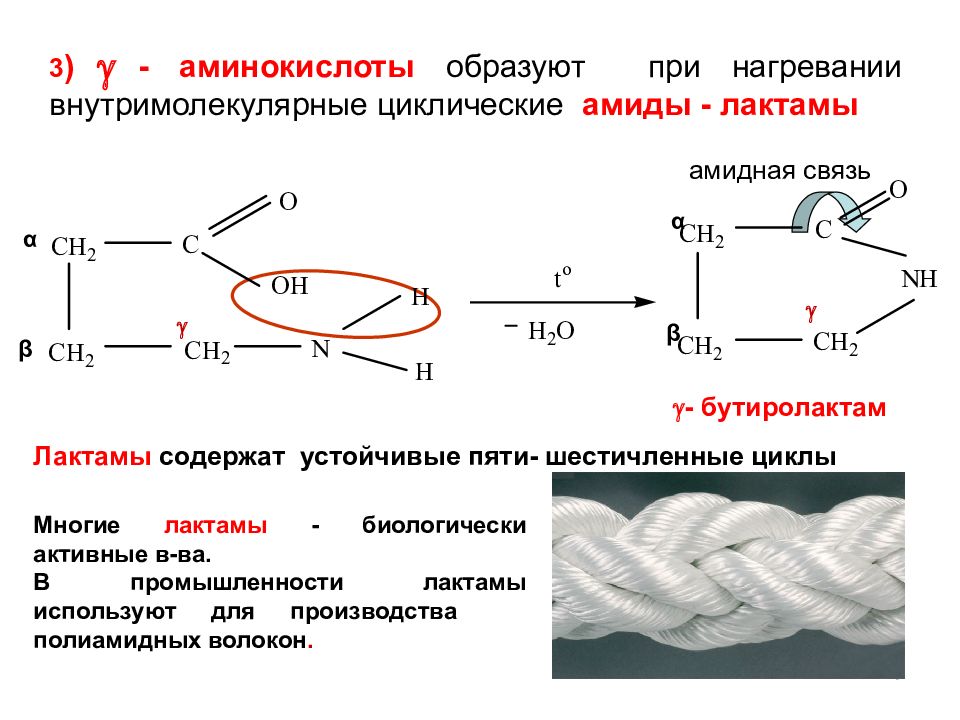
10 амидная связь α β α β 3 ) - аминокислоты образуют при нагревании внутримолекулярные циклические амиды - лактамы Лактамы содержат устойчивые пяти- шестичленные циклы Многие лактамы - биологически активные в-ва. В промышленности лактамы используют для производства полиамидных волокон. - бутиролактам
Слайд 11
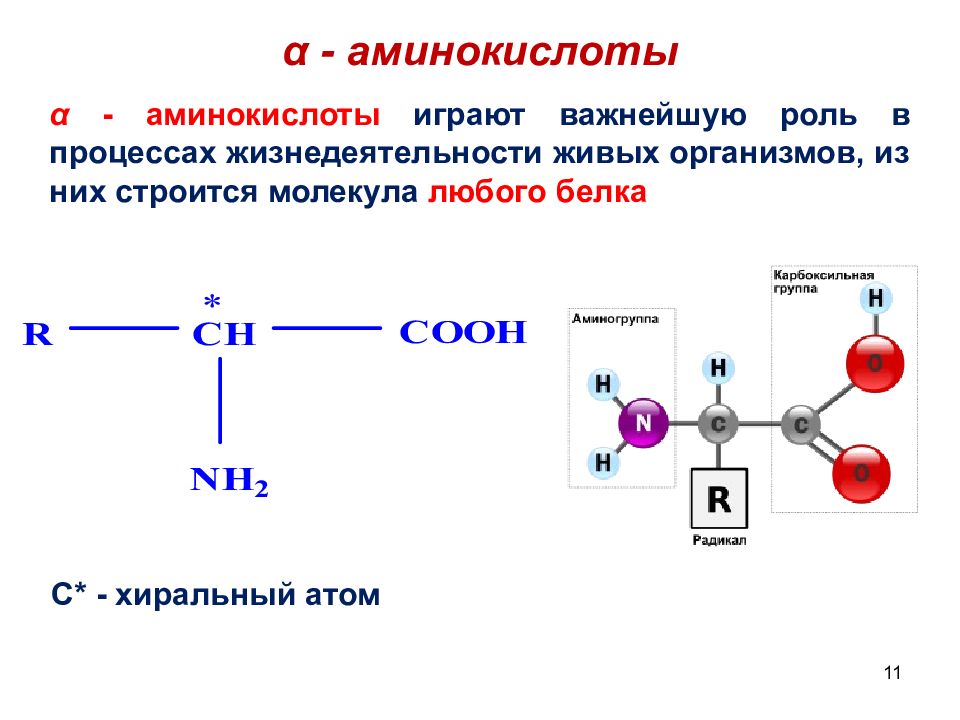
11 α - аминокислоты α - аминокислоты играют важнейшую роль в процессах жизнедеятельности живых организмов, из них строится молекула любого белка C* - хиральный атом
Слайд 12: КЛАССИФИКАЦИЯ АМИНОКИСЛОТ
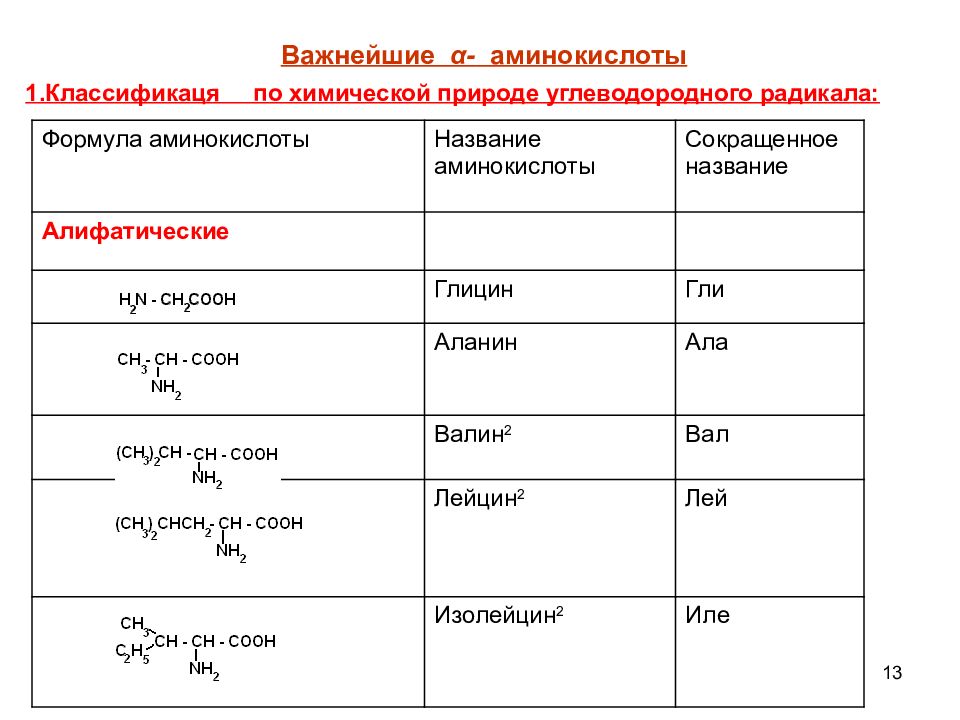
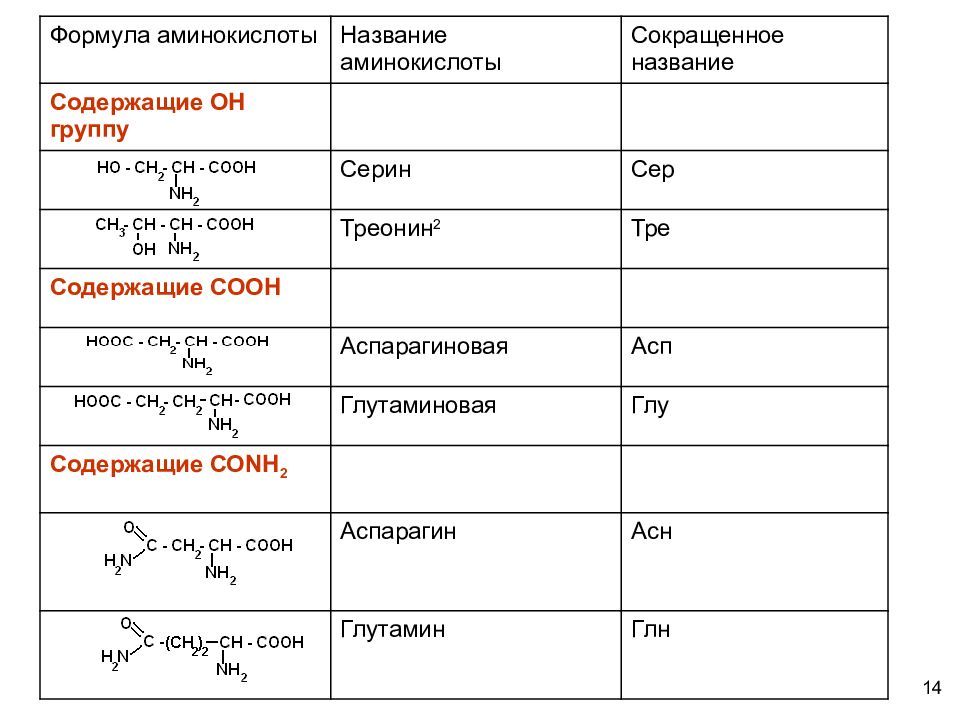
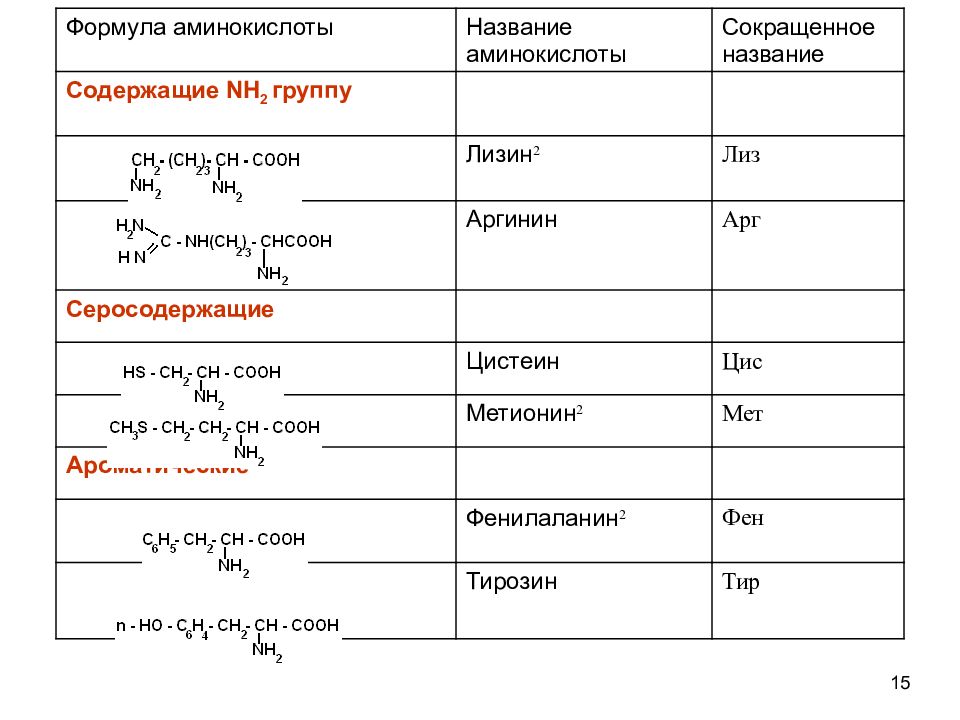
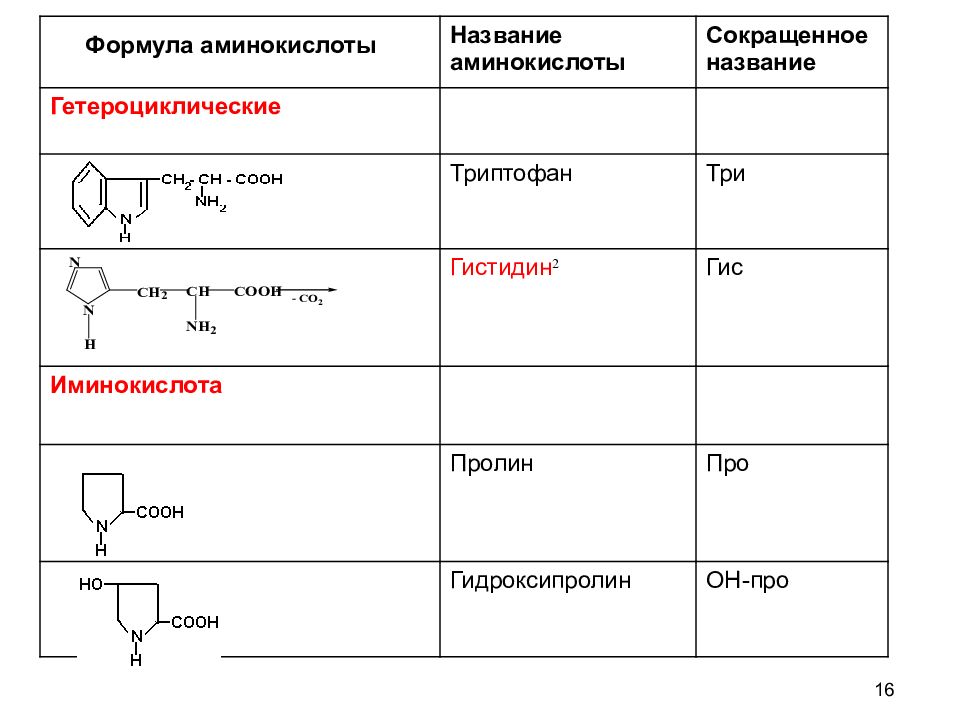
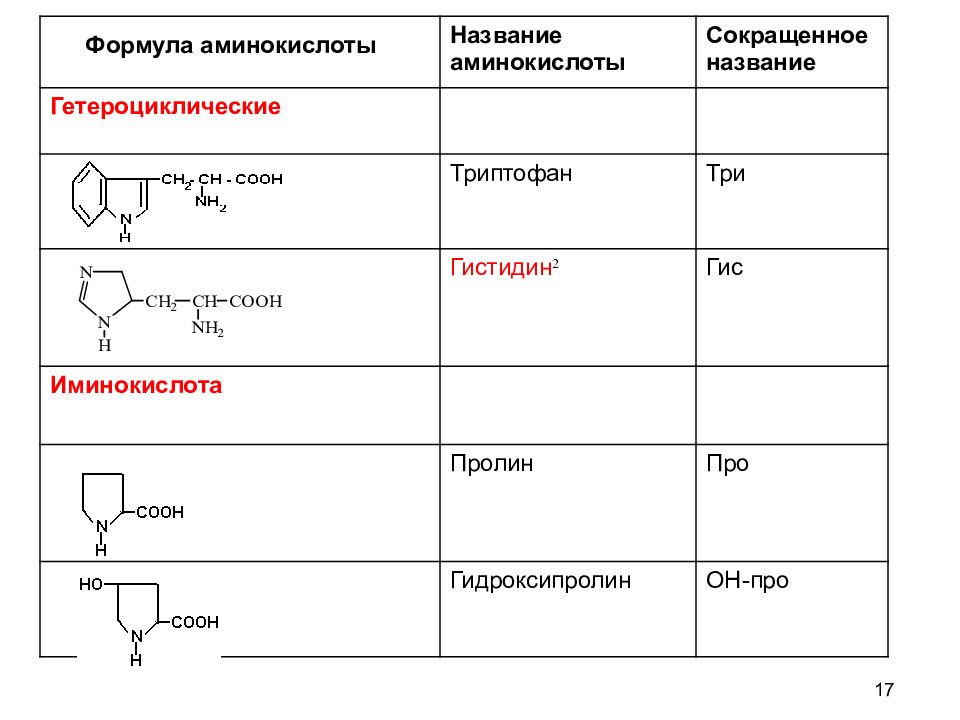
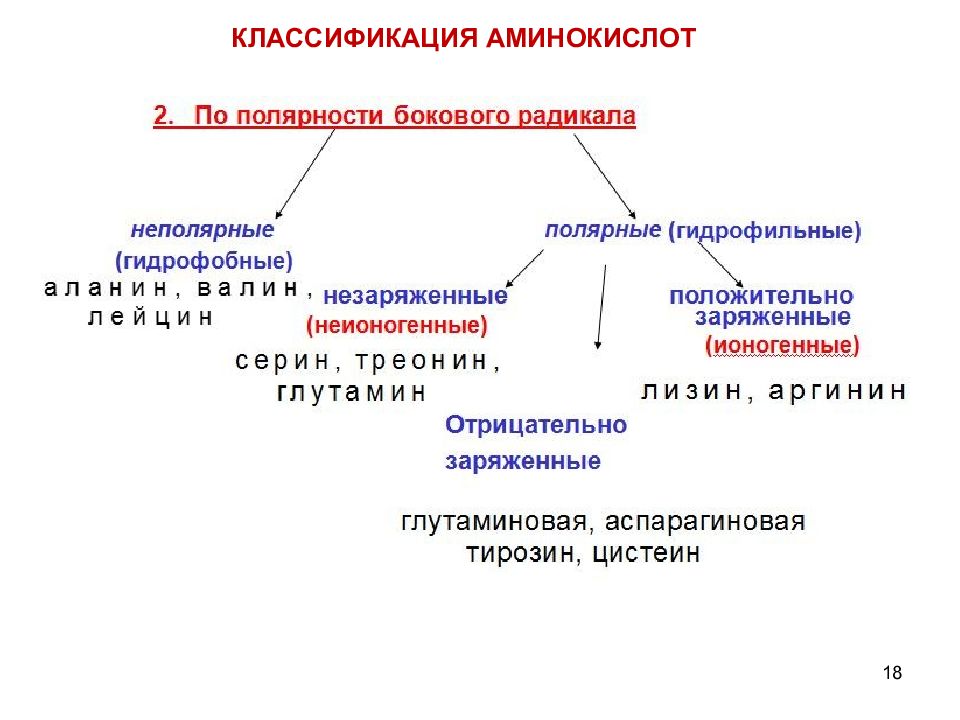
12 КЛАССИФИКАЦИЯ АМИНОКИСЛОТ Для аминокислот существует несколько классификаций в зависимости от того, какой признак положен в основу. 1. По химической природе углеводородного радикала: а) алифатические: глицин, аланин, валин, лейцин, изолейцин содержащие ОН- группу: серин, треонин содержащие СООН – группу: аспарагиновая, глутаминовая содержащие NH 2 CO – группу: аспарагин, глутамин содержащие NH 2 – группу: лизин, аргинин серосодержащие: цистеин, цистин, метионин б) ароматические: фенилаланин, тирозин в) гетероциклические: триптофан, гистидин г) иминокислоты : пролин
Слайд 13
13 Формула аминокислоты Название аминокислоты Сокращенное название Алифатические Глицин Гли Аланин Ала Валин 2 Вал Лейцин 2 Лей Изолейцин 2 Иле Важнейшие α - аминокислоты 1.Классификаця по химической природе углеводородного радикала:
Слайд 14
14 Формула аминокислоты Название аминокислоты Сокращенное название Содержащие ОН группу Серин Сер Треонин 2 Тре Содержащие СООН Аспарагиновая Асп Глутаминовая Глу Содержащие СО N Н 2 Аспарагин Асн Глутамин Глн
Слайд 15
15 Формула аминокислоты Название аминокислоты Сокращенное название Содержащие NH 2 группу Лизин 2 Лиз Аргинин Арг Серосодержащие Цистеин Цис Метионин 2 Мет Ароматические Фенилаланин 2 Фен Тирозин Тир
Слайд 16
16 Название аминокислоты Сокращенное название Гетероциклические Триптофан Три Гистидин 2 Гис Иминокислота Пролин Про Гидроксипролин ОН-про Формула аминокислоты
Слайд 17
17 Название аминокислоты Сокращенное название Гетероциклические Триптофан Три Гистидин 2 Гис Иминокислота Пролин Про Гидроксипролин ОН-про Формула аминокислоты
Слайд 19
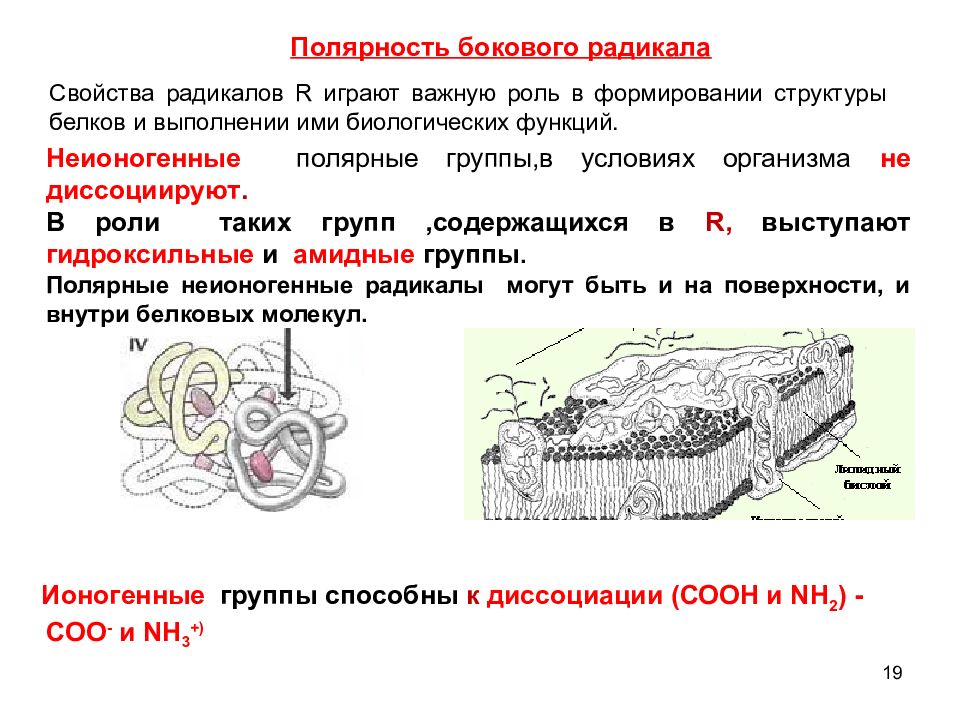
19 Полярность бокового радикала Свойства радикалов R играют важную роль в формировании структуры белков и выполнении ими биологических функций. Неионогенные полярные группы,в условиях организма не диссоциируют. В роли таких групп,содержащихся в R, выступают гидроксильные и амидные группы. Полярные неионогенные радикалы могут быть и на поверхности, и внутри белковых молекул. Ионогенные группы способны к диссоциации ( СООН и NH 2 ) - COO - и NH 3 +)
Слайд 20: 3. По количеству амино - и карбоксильных групп :
20 3. По количеству амино - и карбоксильных групп : 1 амино- и 1 карбоксильная группа – нейтральные 1 амино- 2 карбоксильные группы – кислые 2 амино- 1 карбоксильная группа - основные В водных растворах молекулы аминокислот заряжаются по-разному, приобретая положительные или отрицательные заряды,в зависимости от состава. КЛАССИФИКАЦИЯ АМИНОКИСЛОТ
Слайд 21
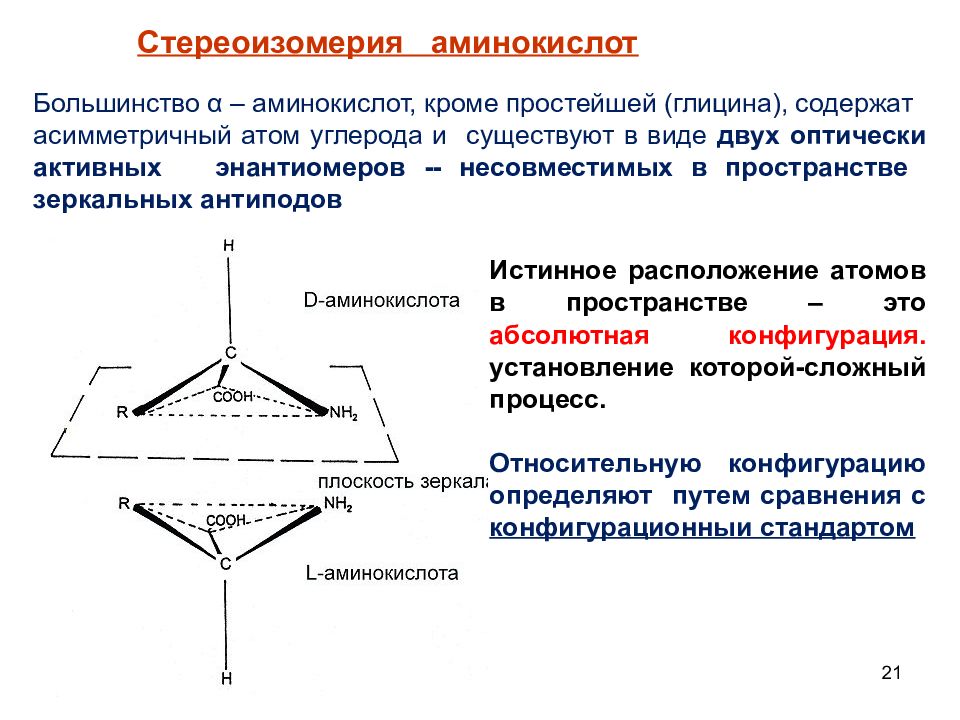
21 Стереоизомерия аминокислот Большинство α – аминокислот, кроме простейшей (глицина), содержат асимметричный атом углерода и существуют в виде двух оптически активных энантиомеров -- несовместимых в пространстве зеркальных антиподов Истинное расположение атомов в пространстве – это абсолютная конфигурация. установление которой-сложный процесс. Относительную конфигурацию определяют путем сравнения с конфигурационныи стандартом
Слайд 22
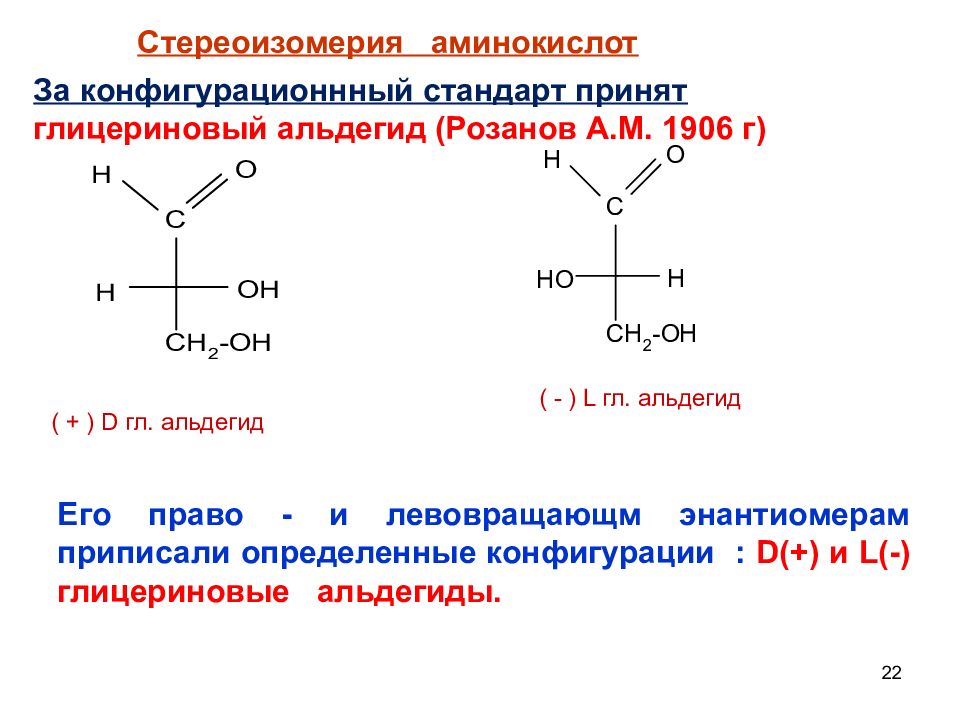
22 Стереоизомерия аминокислот За конфигурационнный стандарт принят глицериновый альдегид (Розанов А.М. 1906 г) Его право - и левовращающм энантиомерам приписали определенные конфигурации : D(+) и L (-) глицериновые альдегиды. ( + ) D гл. альдегид ( - ) L гл. альдегид
Слайд 23
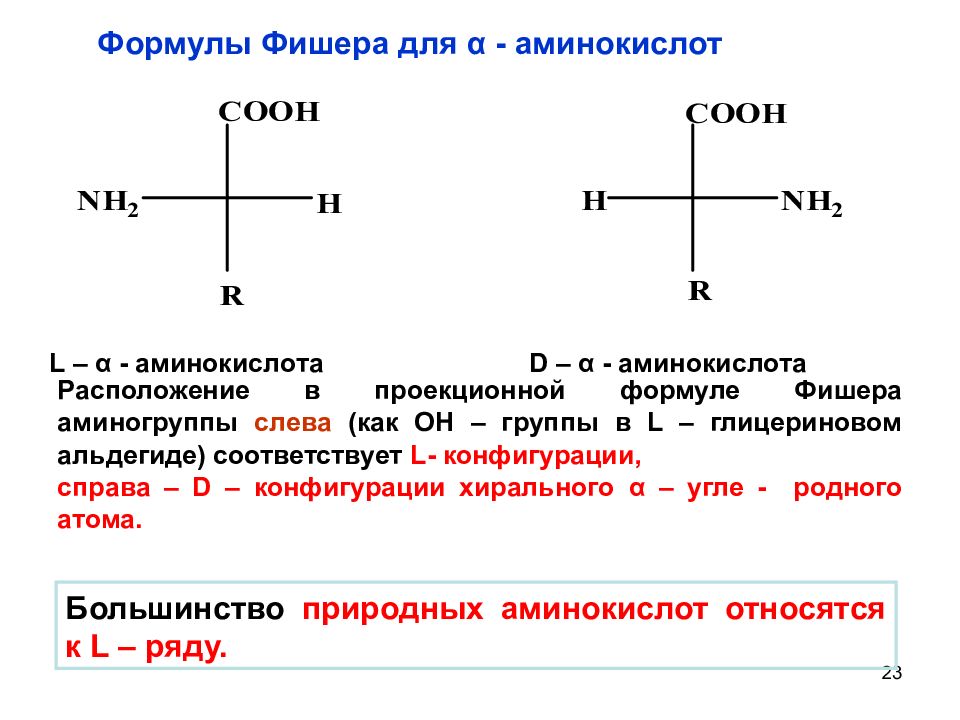
23 L – α - аминокислота D – α - аминокислота Большинство природных аминокислот относятся к L – ряду. Расположение в проекционной формуле Фишера аминогруппы слева (как ОН – группы в L – глицериновом альдегиде) соответствует L- конфигурации, справа – D – конфигурации хирального α – угле - родного атома. Формулы Фишера для α - аминокислот
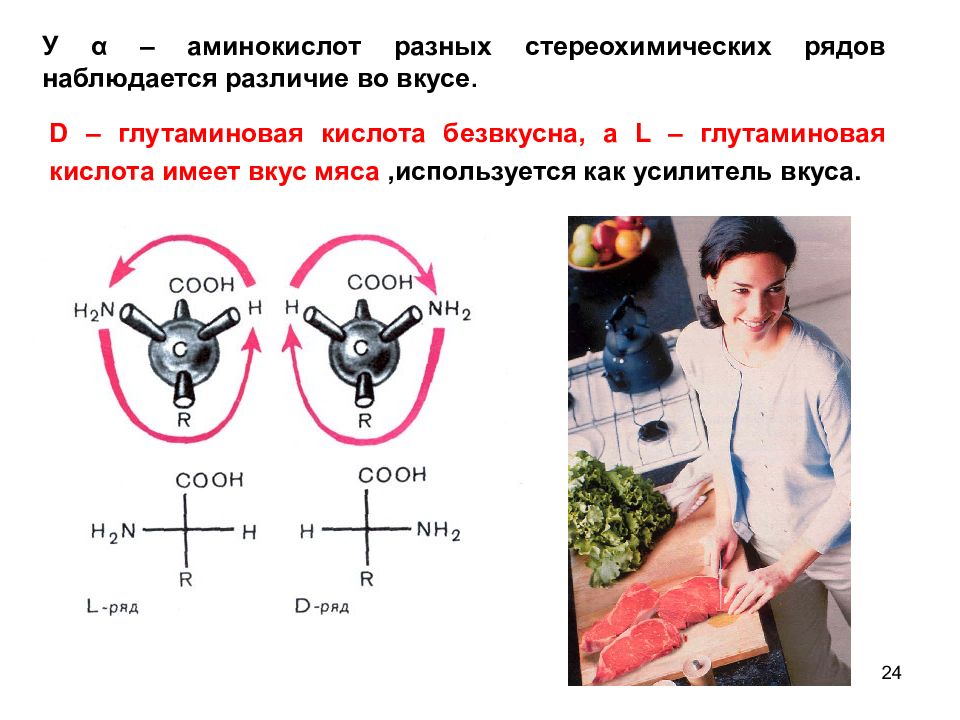
24 У α – аминокислот разных стереохимических рядов наблюдается различие во вкусе. D – глутаминовая кислота безвкусна, а L – глутаминовая кислота имеет вкус мяса,используется как усилитель вкуса.
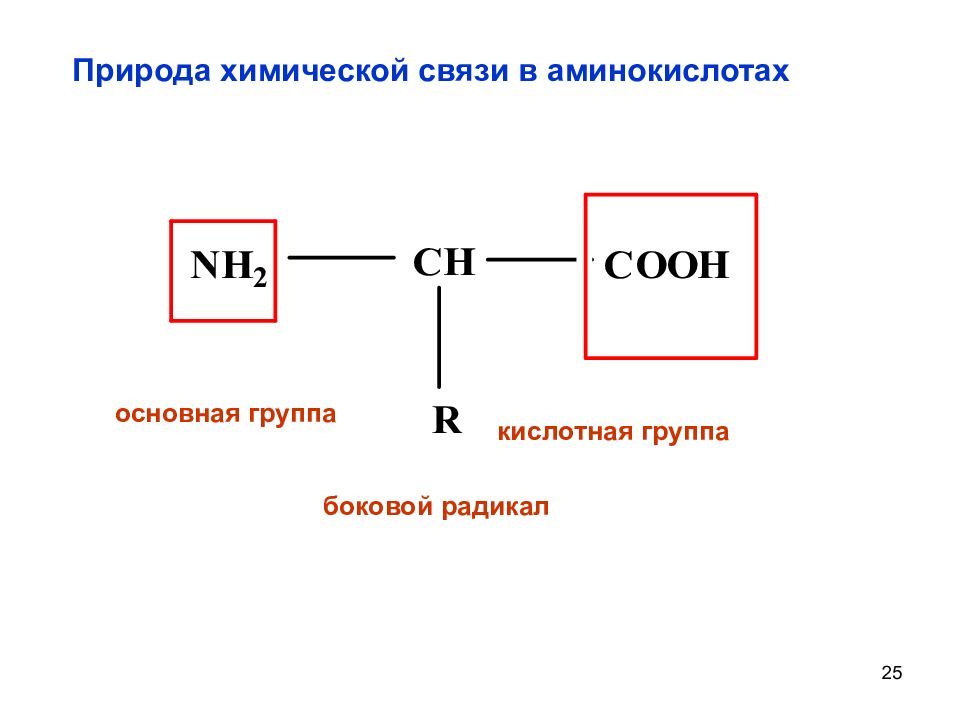
Слайд 25: Природа химической связи в аминокислотах
25 Природа химической связи в аминокислотах боковой радикал основная группа кислотная группа
Слайд 26
26 кислотно-основные свойства, то есть амфотерные свойства карбоксильной группы (образование функциональных производных – реакции S N ). свойства аминогруппы ( ацилирование, алкилирование и др.) специфические свойства, обусловленные взаимным влиянием функциональных групп друг на друга ( декарбоксилирование, дезаминирование ). Химические свойства аминокислот
Слайд 27
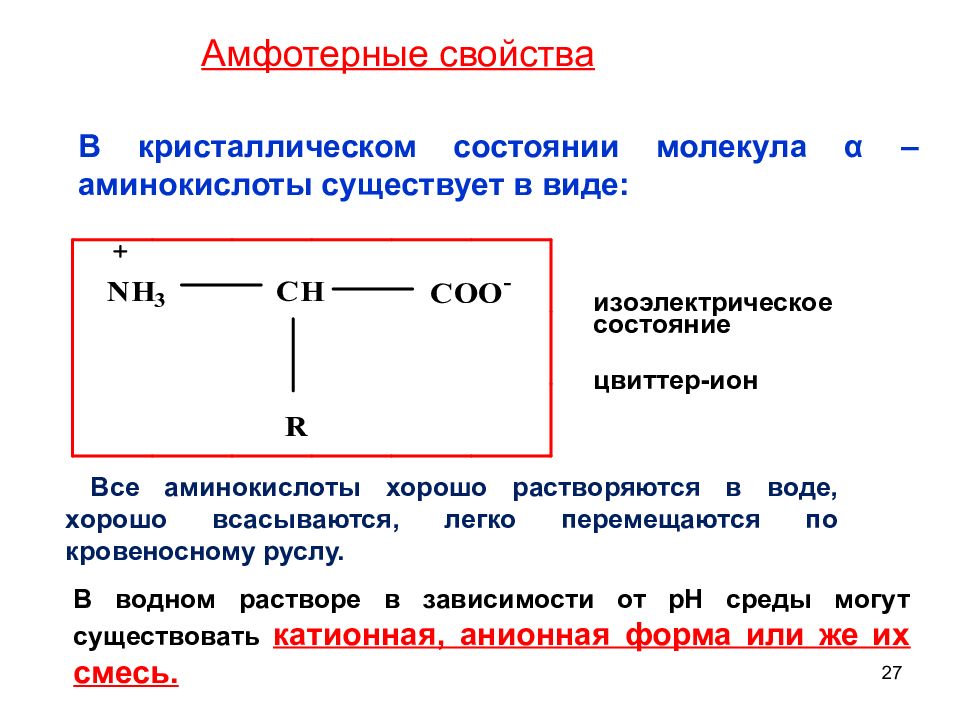
27 В кристаллическом состоянии молекула α – а минокислоты существует в виде: изоэлектрическое состояние цвиттер-ион В водном растворе в зависимости от рН среды могут существовать катионная, анионная форма или же их смесь. Амфотерные свойства Все аминокислоты хорошо растворяются в воде, хорошо всасываются, легко перемещаются по кровеносному руслу.
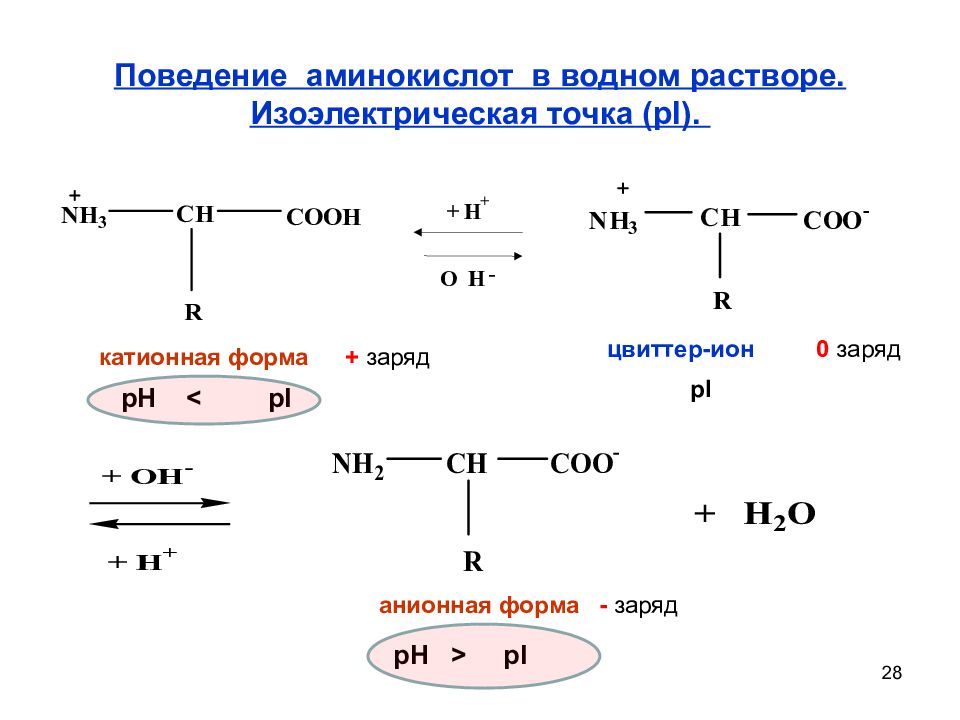
Слайд 28: Поведение аминокислот в водном растворе. Изоэлектрическая точка ( pI )
28 Поведение аминокислот в водном растворе. Изоэлектрическая точка ( pI ). + H + O H - катионная форма цвиттер-ион анионная форма + заряд 0 заряд - заряд pH < pI pH > pI pI
Слайд 29
29 Поведение аминокислот в водном растворе. Катионная форма +заряд цвиттер-ион 0 заряд анионная форма - заряд pH < pI < pH Значение рН, при котором концентрация биполярных ионов максимальна, а катионных и анионных форм минимальна, называют изоэлектрической точкой ( pI ). Состояние электронейтральности аминокислоты называют изоэлектрическим состоянием. pK k 1 + pK к2 2 pI =
Слайд 30
30 Для большинства аминокислот pI лежит в слабокислой области. Если в аминокислоте две карбоксильные группы,то pI – в сильнокислой области: глутаминовая (3,2), аспарагиновая (3,0) Если в аминокислоте две аминогруппы, то pI - в щелочной области: лизин (9,8), аргинин (10,8). Поведение аминокислот в водном растворе.
Слайд 31
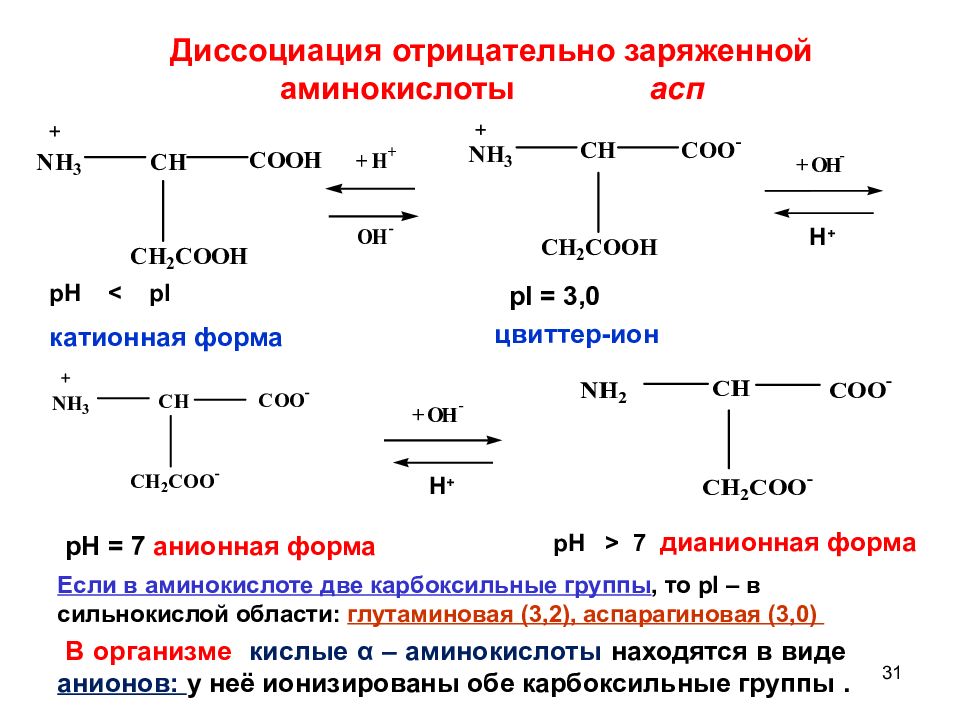
31 pI = 3,0 цвиттер-ион pH = 7 анионная форма pH < pI катионная форма pH > 7 дианионная форма + O H - H + + O H - H + Если в аминокислоте две карбоксильные группы, то pI – в сильнокислой области: глутаминовая (3,2 ), аспарагиновая (3,0) В организме кислые α – аминокислоты находятся в виде анионов: у неё ионизированы обе карбоксильные группы. Диссоциация отрицательно заряженной аминокислоты асп
Слайд 32
32 Диссоциация положительно заряженной аминокислоты - лизина Если в аминокислоте две аминогруппы, то pI - в щелочной области: лизин (9,8), аргинин (10,8). В организме основные α – аминокислоты находятся в виде катионов: у неё протонированы обе аминогруппы.
Слайд 33
33 В изоэлектрической точке аминокислота обладает особыми свойствами: минимальной электрофоретической подвижностью минимальной растворимостью максимальным осаждением in vivo ни одна аминокислота не находится в изоэлектрическом состоянии. Поведение аминокислот в водном растворе. Практическое значение образования зарядов in vitro – смесь аминокислот при электрофорезе можно разделить на отдельные аминокислоты.
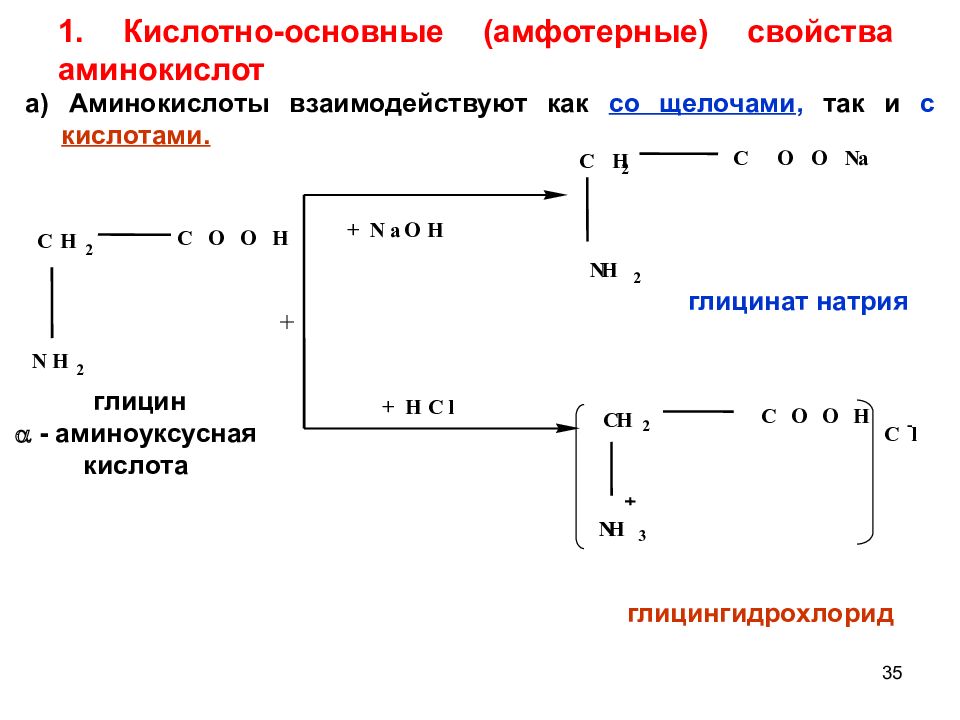
Слайд 35: 1. Кислотно-основные (амфотерные) свойства аминокислот
35 1. Кислотно-основные (амфотерные) свойства аминокислот + + N a O H + H C l C H 2 C O O N a N H 2 C O O H N H 2 C H 2 глицингидрохлорид глицинат натрия глицин - аминоуксусная кислота l - C H 2 N H 3 C O O H C а) Аминокислоты взаимодействуют как со щелочами, так и с кислотами.
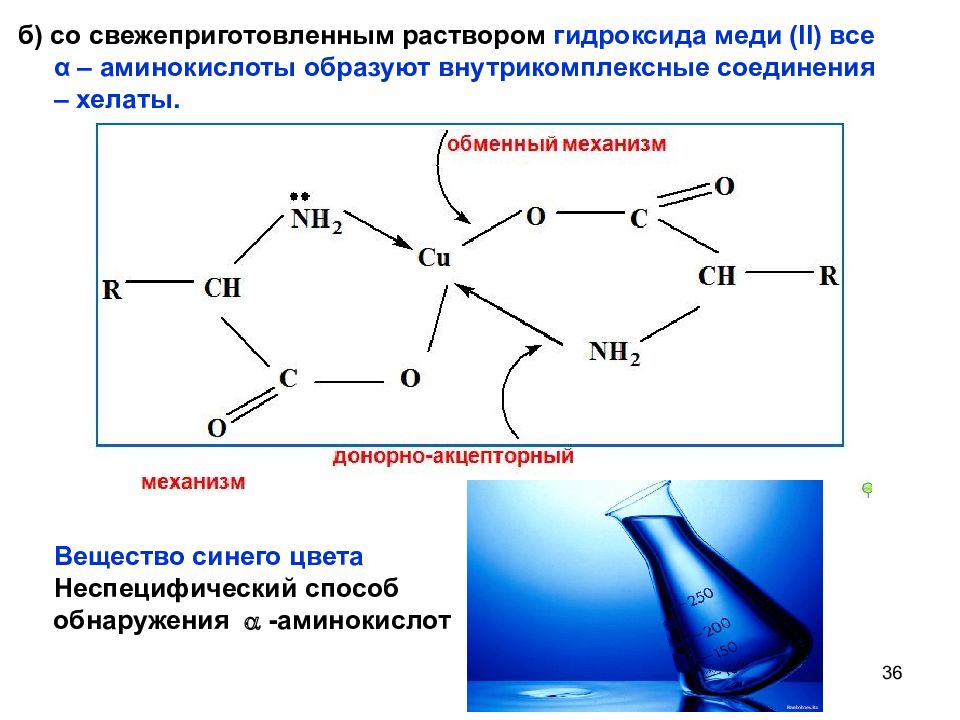
Слайд 36
36 б) со свежеприготовленным раствором гидроксида меди ( II ) все α – аминокислоты образуют внутрикомплексные соединения – хелаты. Вещество синего цвета Неспецифический способ обнаружения -аминокислот
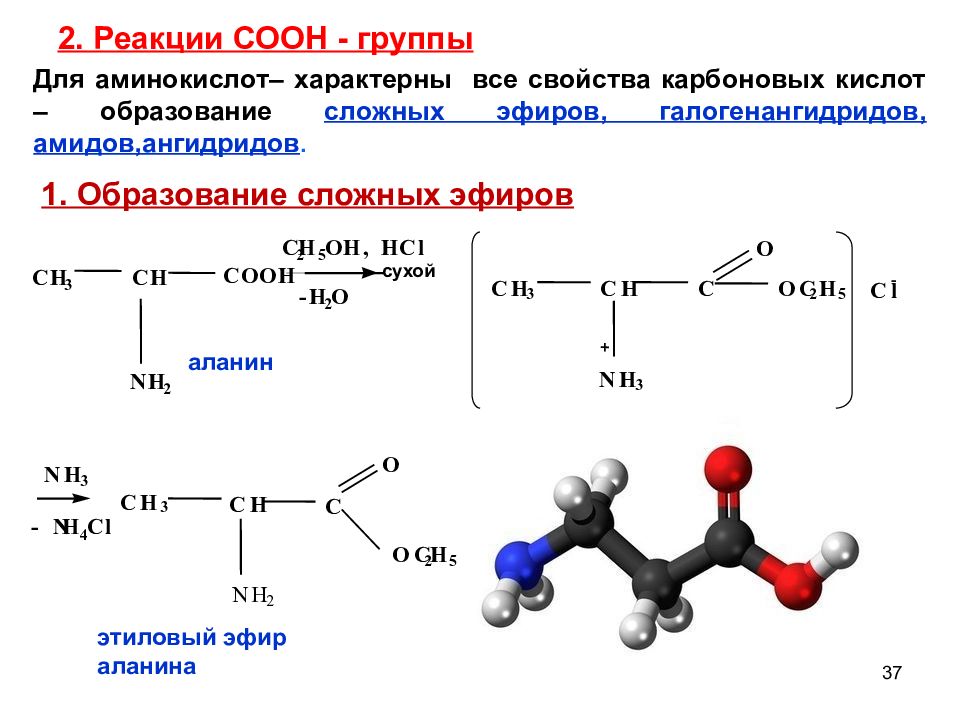
Слайд 37: 2. Реакции СООН - группы
37 O N H 3 - N H 4 C l C H 3 C H C N H 2 O C 2 H 5 этиловый эфир аланина N H 2 - H 2 O C H 3 C H C O O H C 2 H 5 O H , H C l аланин сухой C H 3 C H N H 3 C O C 2 H 5 O C l - Для аминокислот– характерны все свойства карбоновых кислот – образование сложных эфиров, галогенангидридов, амидов,ангидридов. 1. Образование сложных эфиров
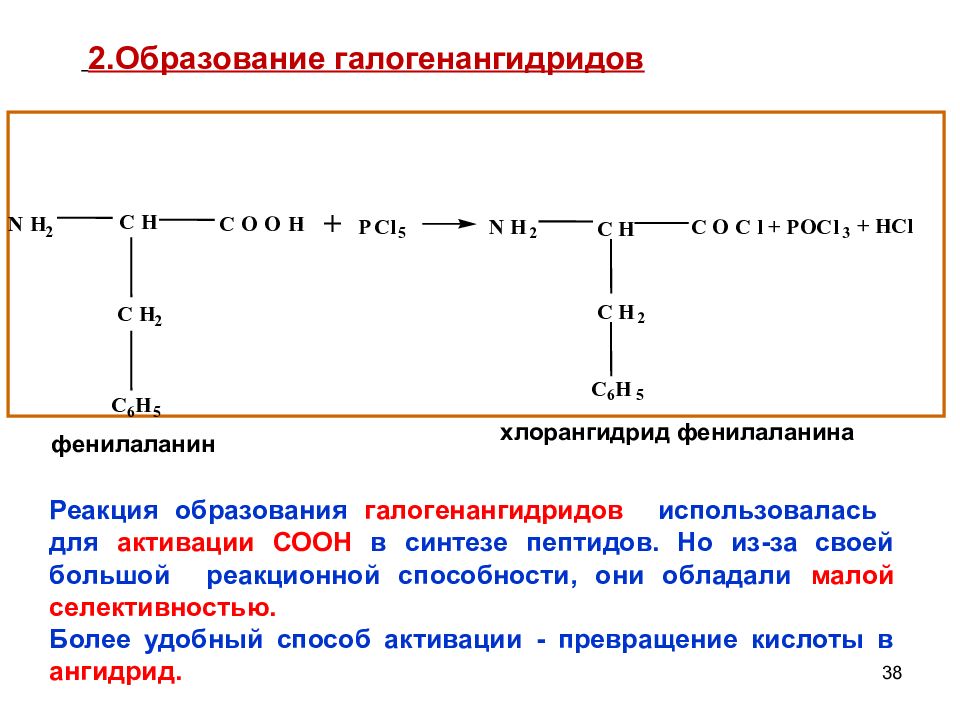
Слайд 38
38 + P C l 5 N H 2 C H C H 2 C 6 H 5 C O O H фенилаланин N H 2 C H C H 2 C 6 H 5 C O C l + + H C l P O C l 3 хлорангидрид фенилаланина 2.Образование галогенангидридов Реакция образования галогенангидридов использовалась для активации СООН в синтезе пептидов. Но из-за своей большой реакционной способности, они обладали малой селективностью. Более удобный способ активации - превращение кислоты в ангидрид.
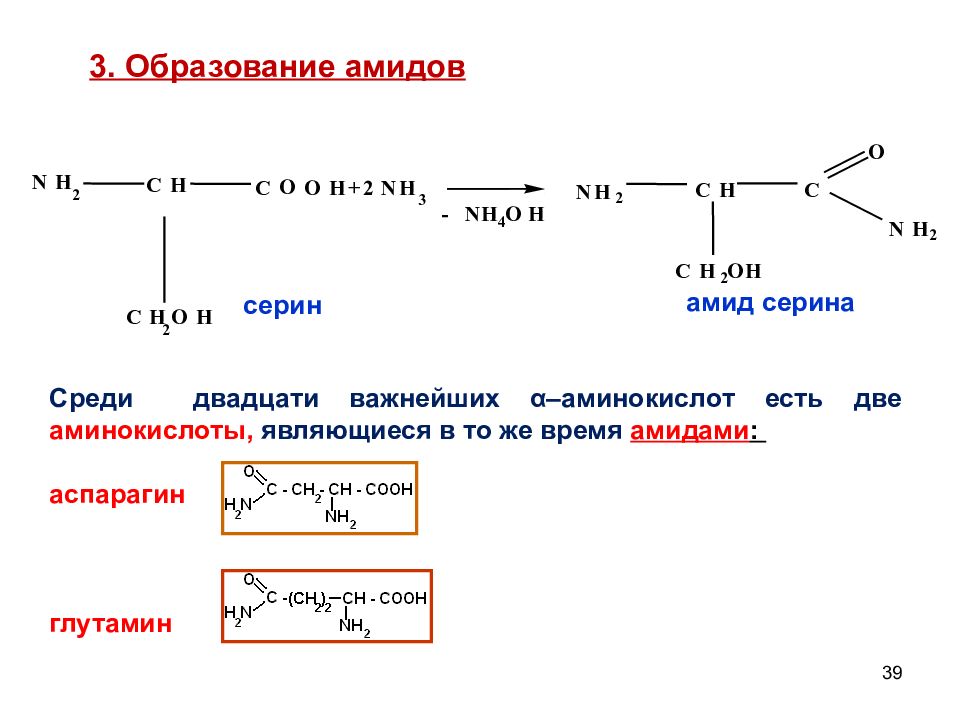
Слайд 39
39 - N H 4 O H N H 2 C H C O O H C H 2 O H + 2 N H 3 серин N H 2 C H C H 2 O H C N H 2 O амид серина 3. Образование амидов Среди двадцати важнейших α –аминокислот есть две аминокислоты, являющиеся в то же время амидами : аспарагин глутамин
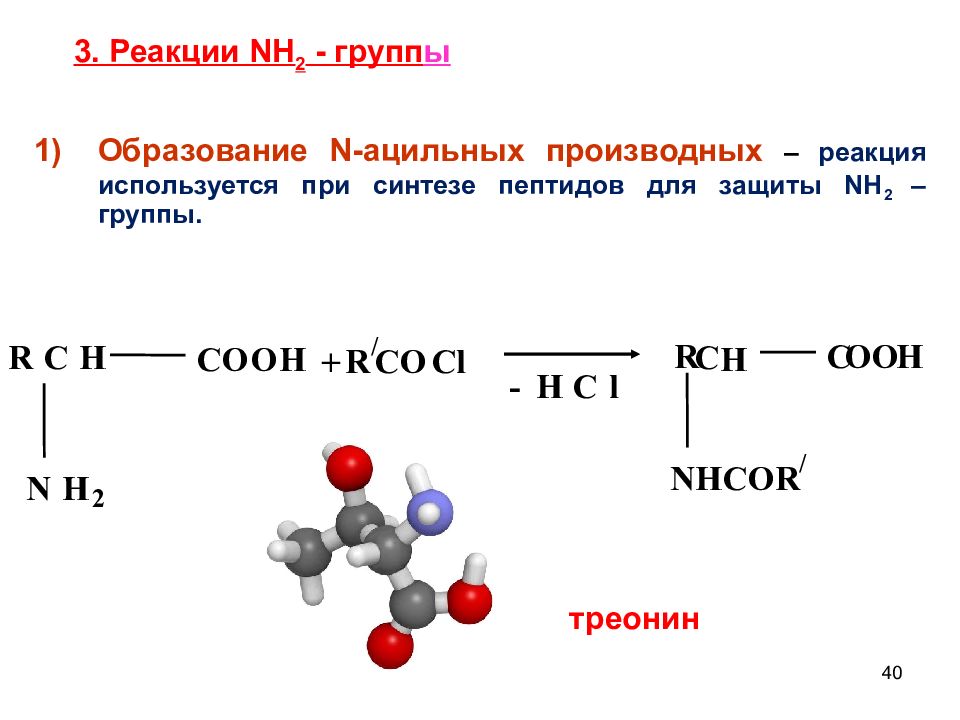
Слайд 40: 3. Реакции NH 2 - групп ы
40 3. Реакции NH 2 - групп ы R C H C O O H N H 2 + R / C O C l R C H N H C O R / C O O H - H C l Образование N- ацильных производных – реакция используется при синтезе пептидов для защиты NH 2 – группы. -+ треонин
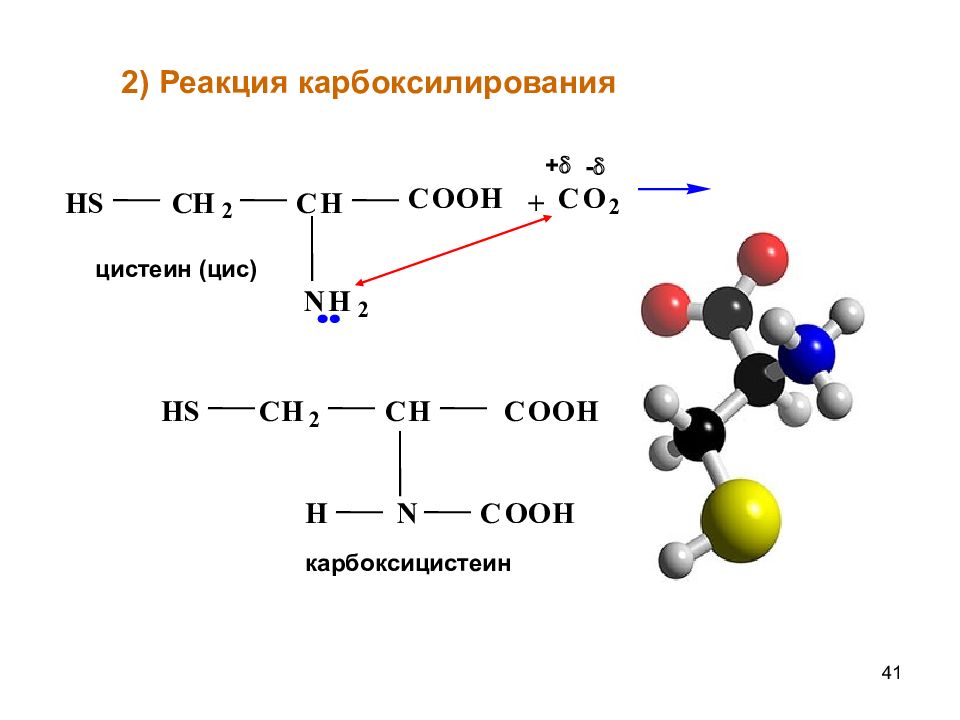
Слайд 41
41 + C O 2 + - H S C H 2 C H N H 2 C O O H цистеин (цис) H S C H 2 C H C O O H H N C O O H карбоксицистеин 2) Реакция карбоксилирования
Слайд 42: 4. Биохимические превращения аминокислот
42 4. Биохимические превращения аминокислот α – аминокислоты и белки не запасаются организмами и должны поступать пищей. Основным источником α - аминокислот для живого организма служат пищевые белки. В результате ферментативного гидролиза белков в желудочно-кишечном тракте образуются α - аминокислоты. α - аминокислоты всасываются в пищеварительном тракте, переносятся кровью в печень и другие ткани и органы. Первый источник α -аминокислот в организме - экзогенный
Слайд 43
43 1 ) Декарбоксилирование – образование биогенных аминов из α - аминокислот ( лиз, цис, три, сер, асп) – метаболическое превращение аминокислот C O 2 N H 2 C H C O O H C H 2 O H серин i n v i v o декарбоксилаза + пиридоксальфосфат + N H 2 C H 2 O H C H 2 коламин (идёт на синтез липидов) Биологически важные химические реакции Реакции декарбоксилирования в отличие от других процессов промежуточного обмена аминокислот являются необратимыми. Они катализируются специфическими ферментами — декарбоксилазами аминокислот.
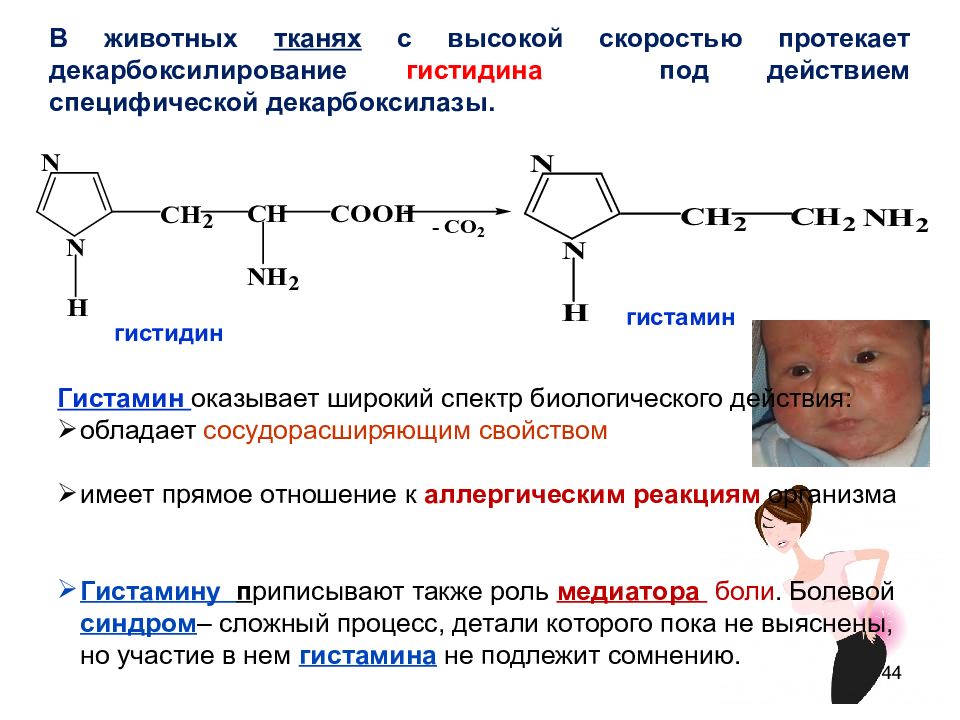
Слайд 44
44 гистамин гистидин В животных тканях с высокой скоростью протекает декарбоксилирование гистидина под действием специфической декарбоксилазы. Гистамин оказывает широкий спектр биологического действия: обладает сосудорасширяющим свойством имеет прямое отношение к аллергическим реакциям организма Гистамину п риписывают также роль медиатора боли. Болевой синдром – сложный процесс, детали которого пока не выяснены, но участие в нем гистамина не подлежит сомнению.
Слайд 45
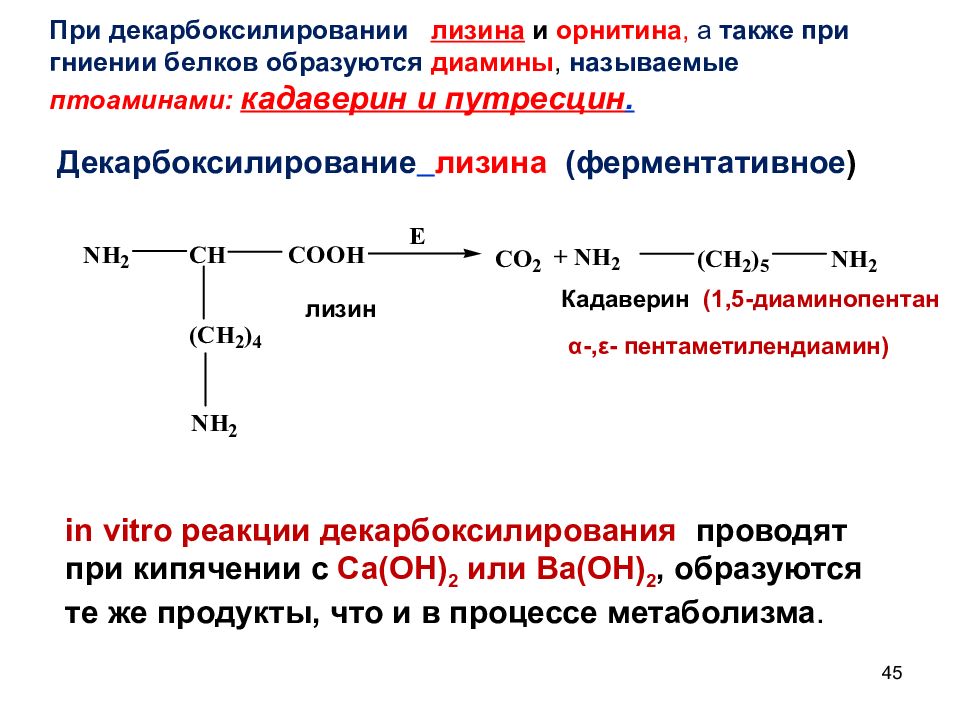
45 При декарбоксилировании лизина и орнитина, а также при гниении белков образуются диамины, называемые птоаминами: кадаверин и путресцин. Декарбоксилирование лизина (ферментативное ) Кадаверин (1,5-диаминопентан α-,ε- пентаметилендиамин) лизин in vitro реакции декарбоксилирования проводят при кипячении с Ca(OH) 2 или Ba(OH) 2, образуются те же продукты, что и в процессе метаболизма.
Слайд 46
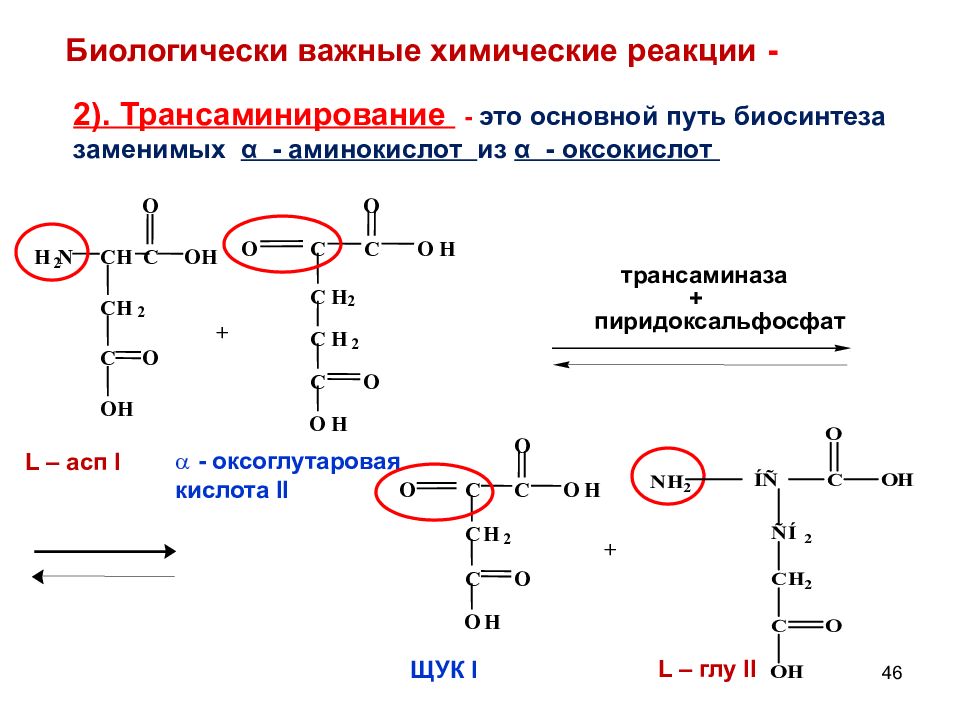
46 + С C C H 2 O H O C O H O O С Н 2 + H 2 N C H C C H 2 O H O C O H O L – асп I - оксоглутаровая кислота II трансаминаза + пиридоксальфосфат С C C H 2 O H O C O H O O ЩУК I L – глу II Биологически важные химические реакции - 2). Трансаминирование - это основной путь биосинтеза заменимых α - аминокислот из α - оксокислот
Слайд 47
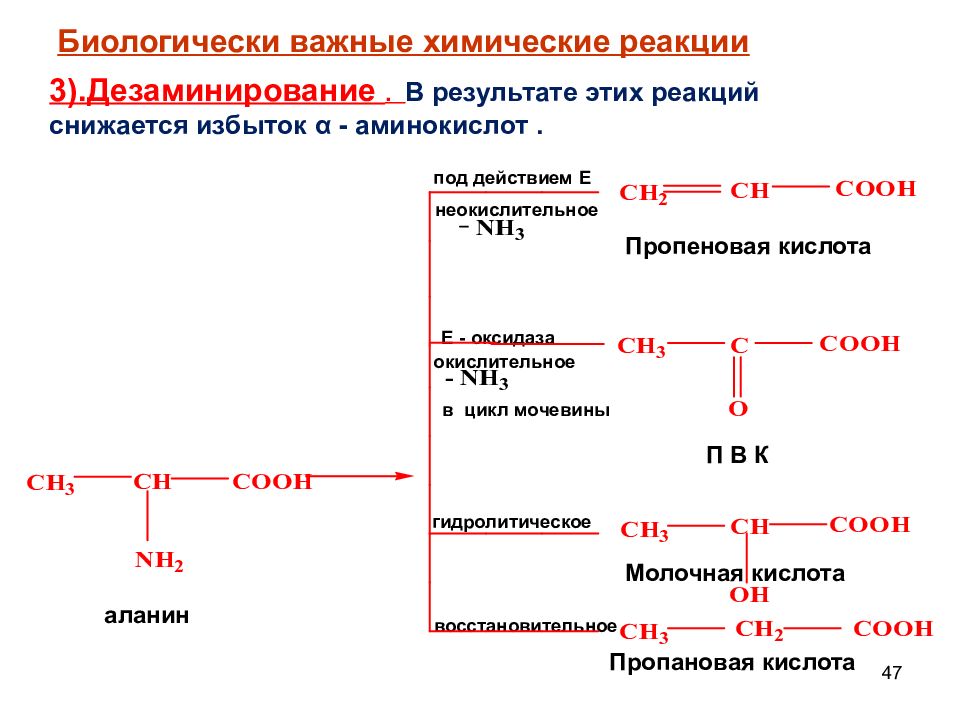
47 неокислительное под действием Е окислительное Е - оксидаза в цикл мочевины П В К гидролитическое восстановительное аланин Пропеновая кислота Молочная кислота Пропановая кислота Биологически важные химические реакции 3).Дезаминирование. В результате этих реакций снижается избыток α - аминокислот.
Слайд 48
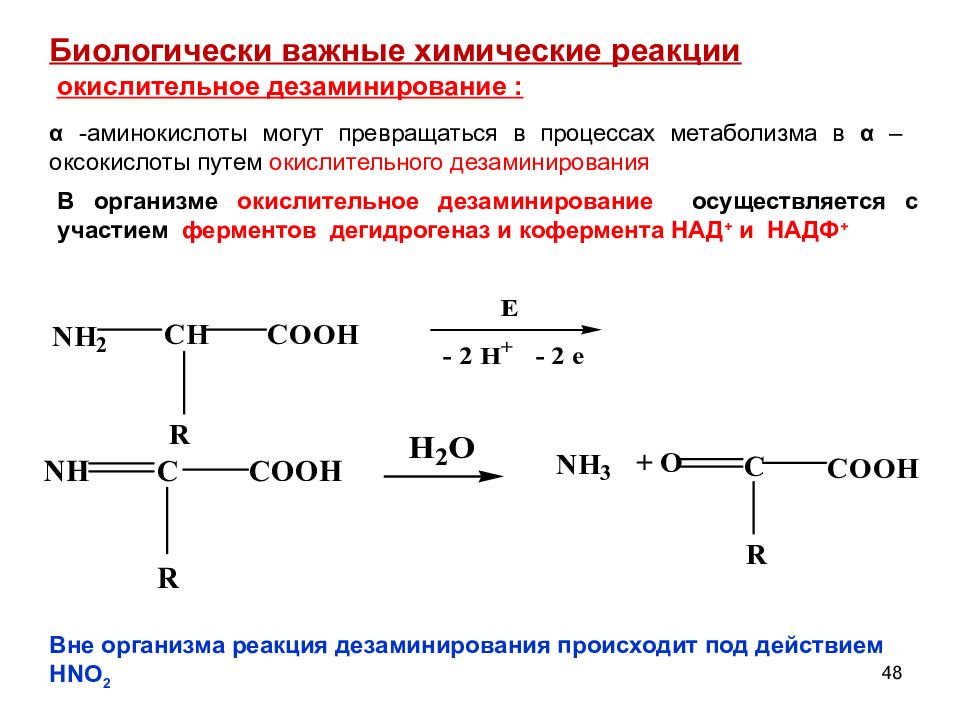
48 окислительное дезаминирование : Биологически важные химические реакции α -аминокислоты могут превращаться в процессах метаболизма в α –оксокислоты путем окислительного дезаминирования В организме окислительное дезаминирование осуществляется с участием ферментов дегидрогеназ и кофермента НАД + и НАДФ + Вне организма реакция дезаминирования происходит под действием HNO 2
Слайд 49
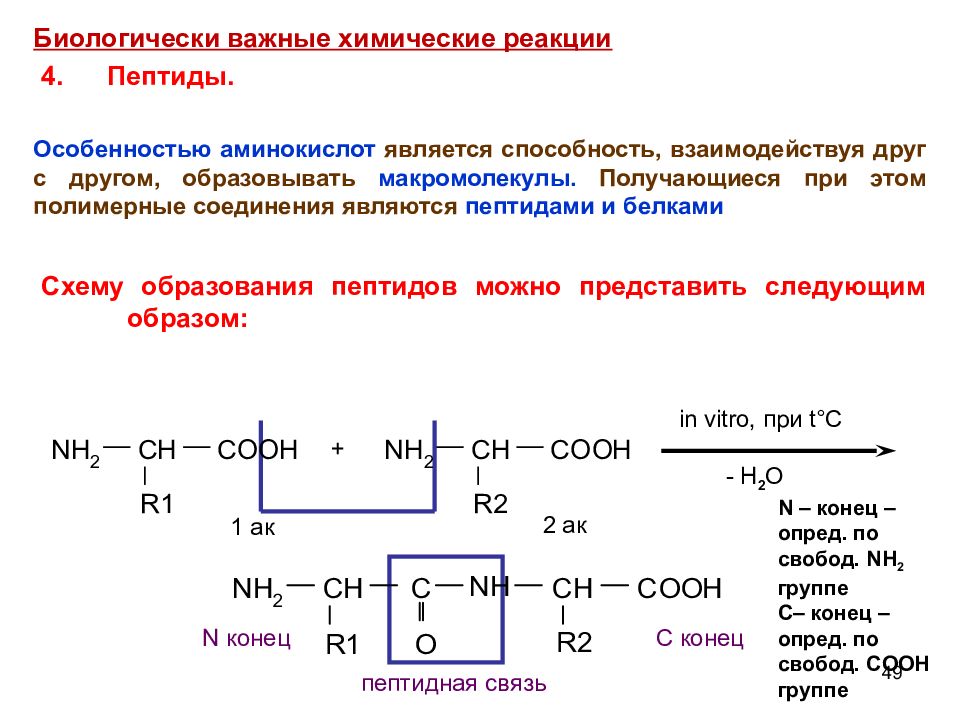
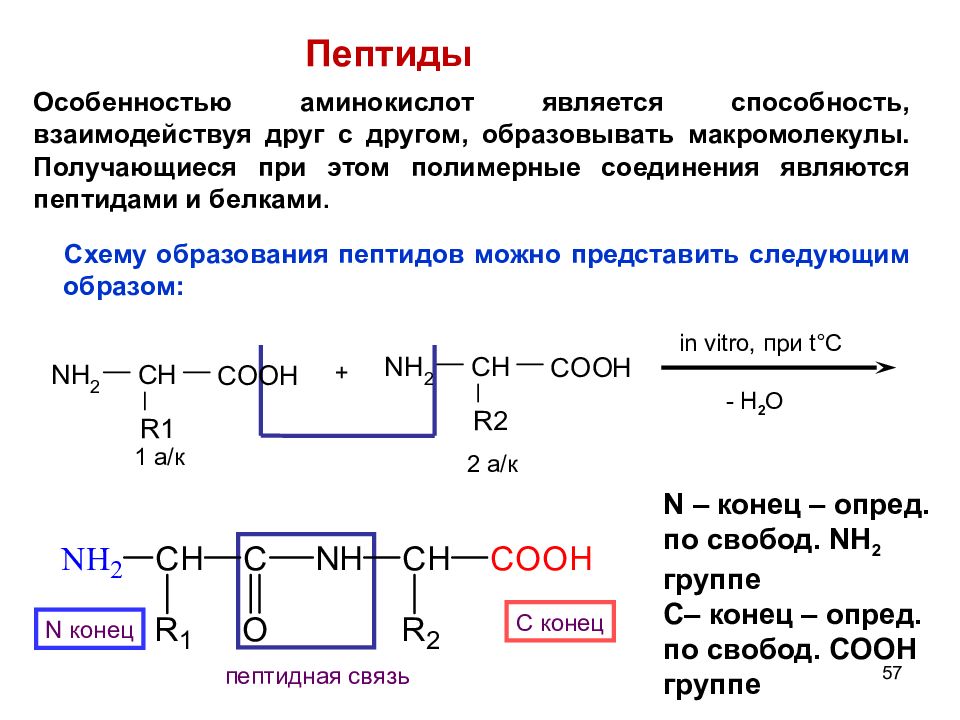
49 + in vitro, при t °C - H 2 O 1 ак 2 ак N конец С конец пептидная связь N – конец – опред. по свобод. NH 2 группе С – конец – опред. по свобод. COOH группе Биологически важные химические реакции 4. Пептиды. О собенностью аминокислот является способность, взаимодействуя друг с другом, образовывать макромолекулы. Получающиеся при этом полимерные соединения являются пептидами и белками Схему образования пептидов можно представить следующим образом:
Слайд 50: Аналитические реакции аминокислот
50 Аналитические реакции аминокислот лейцин (лей) 2-гидрокси, 4-метилпентановая кислота Если две аминогруппы, то азота выделяется в 2раза больше! Продукт всегда α – гидроксикислота! Метод Ван-Слайка При взаимодействии α -аминокислоты с азотистой кислотой образуется α –гидроксикислота и выделяется N 2,. По объёму выделившегося азота определяют либо количество NH 2 – групп, либо количество вступившей в реакцию аминокислоты
Слайд 51
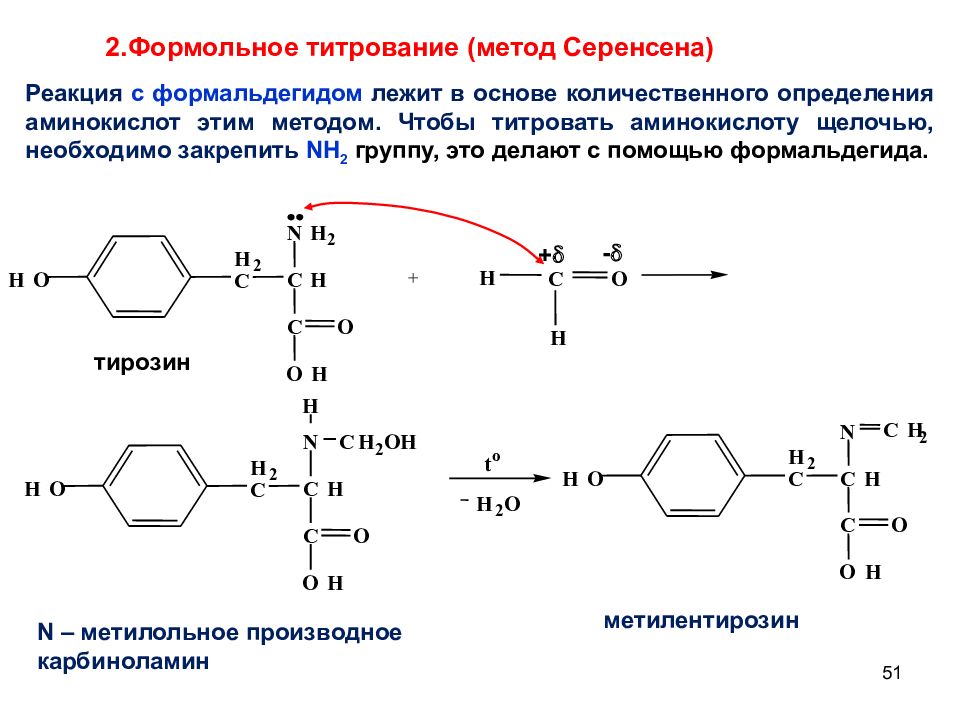
51 + N H 2 C H C H 2 C O H O H O тирозин H N C H C H 2 C O H O H O H C H 2 O N – метилольное производное карбиноламин t o H 2 O N C H C H 2 C O H O H O C H 2 метилентирозин O H C H + - 2.Формольное титрование (метод Серенсена) Реакция с формальдегидом лежит в основе количественного определения аминокислот этим методом. Чтобы титровать аминокислоту щелочью, необходимо закрепить NH 2 группу, это делают с помощью формальдегида.
Слайд 52: Качественные реакции
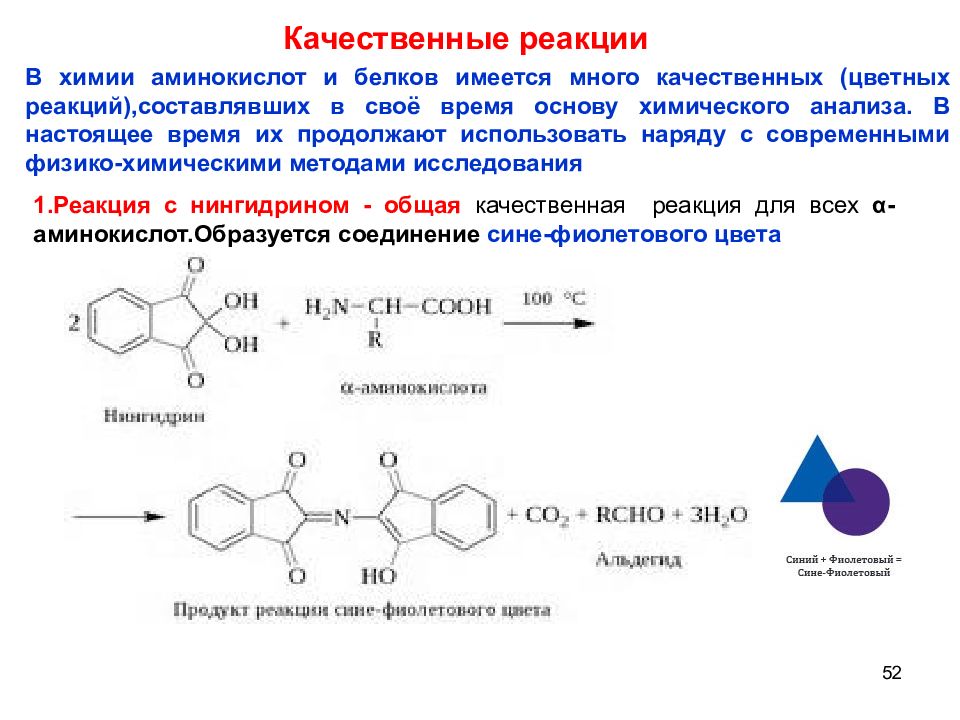
52 Качественные реакции В химии аминокислот и белков имеется много качественных (цветных реакций),составлявших в своё время основу химического анализа. В настоящее время их продолжают использовать наряду с современными физико-химическими методами исследования 1.Реакция с нингидрином - общая качественная реакция для всех α -аминокислот.Образуется соединение сине-фиолетового цвета
Слайд 53
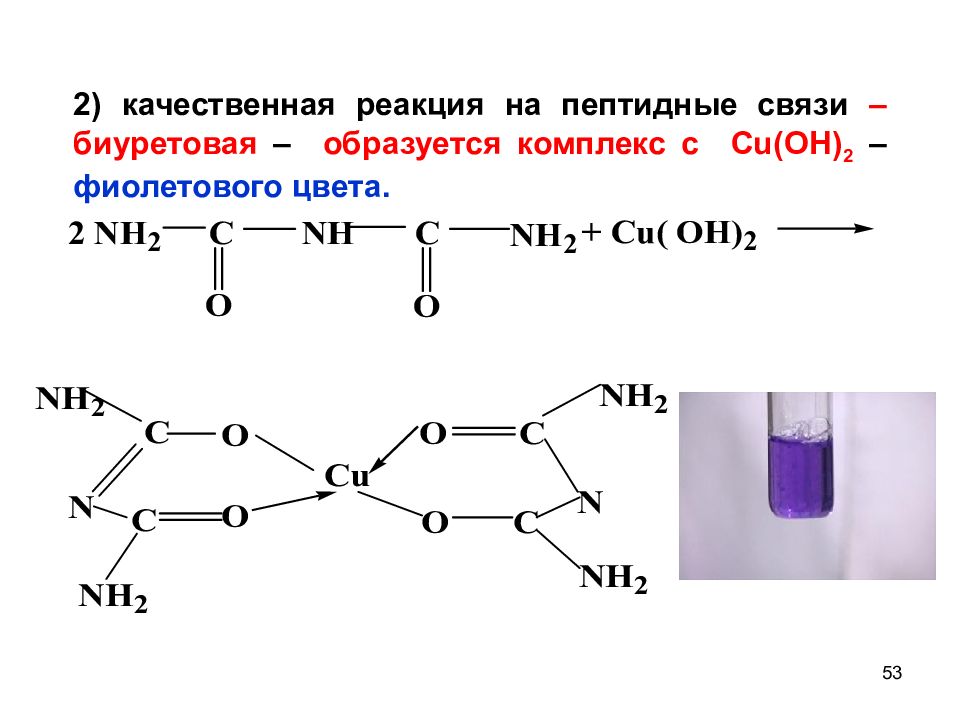
53 2) качественная реакция на пептидные связи – биуретовая – образуется комплекс с С u(OH) 2 – фиолетового цвета.
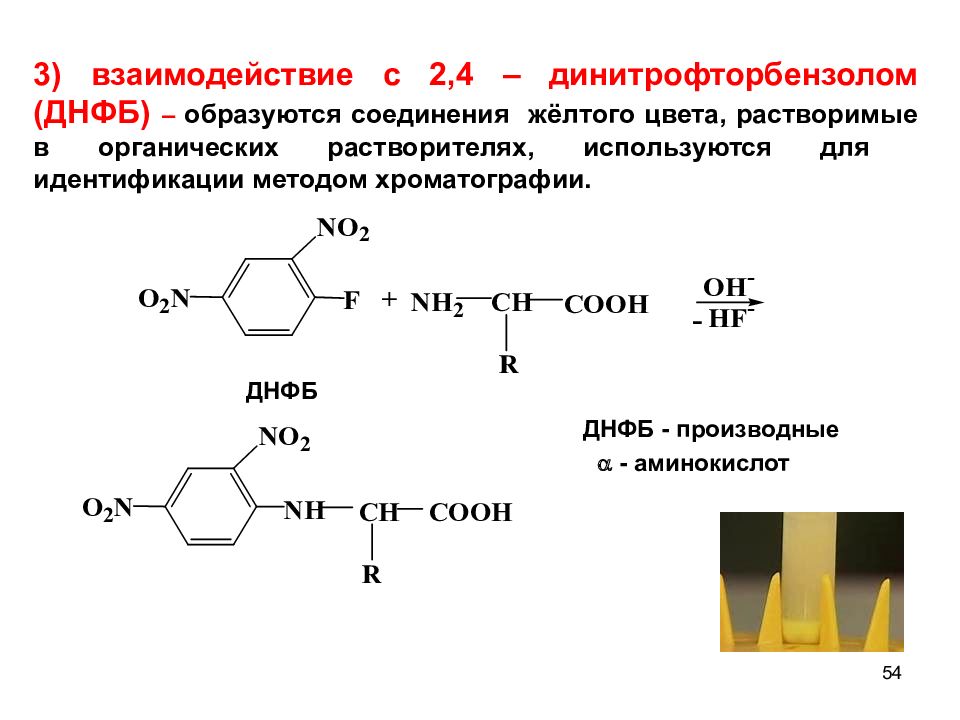
Слайд 54
54 ДНФБ ДНФБ - производные - аминокислот - 3) взаимодействие с 2,4 – динитрофторбензолом (ДНФБ) – образуются соединения жёлтого цвета, растворимые в органических растворителях, используются для идентификации методом хроматографии.
Слайд 55
55 чёрн цвет 4.Реакция обнаружения цистеина При нагревании раствора белка с ацетатом свинца в щелочной среде образуется осадок чёрного цвета PbS
Слайд 56
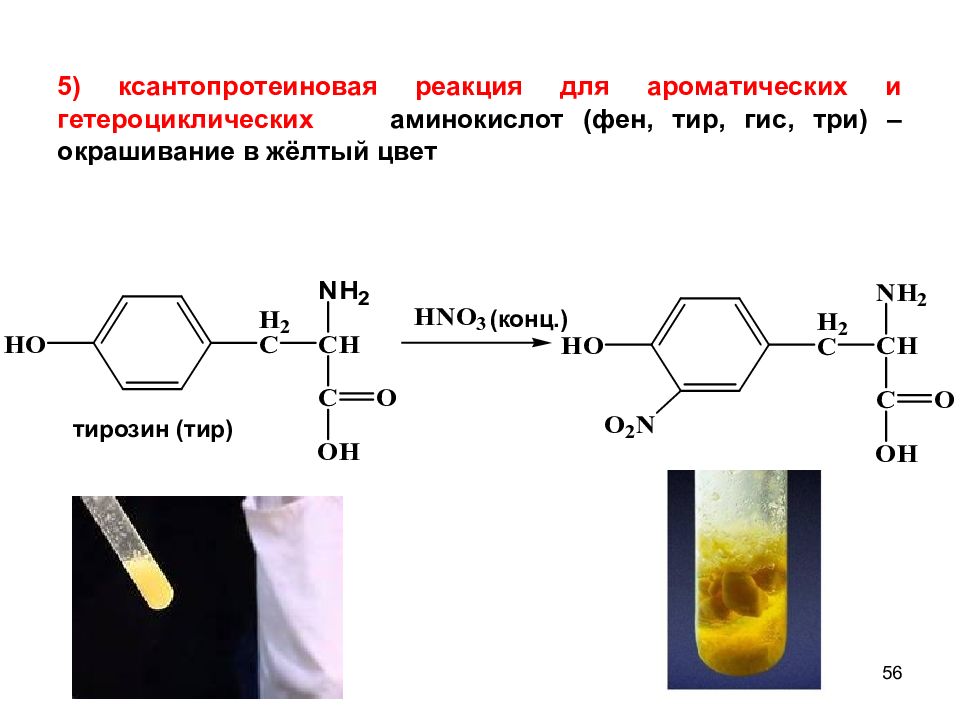
56 тирозин (тир) (конц.) 5 ) ксантопротеиновая реакция для ароматических и гетероциклических аминокислот (фен, тир, гис, три) – окрашивание в жёлтый цвет
Слайд 57
57 + in vitro, при t °C - H 2 O 1 а/к 2 а/к N конец С конец пептидная связь N – конец – опред. по свобод. NH 2 группе С – конец – опред. по свобод. COOH группе Пептиды Схему образования пептидов можно представить следующим образом: Особенностью аминокислот является способность, взаимодействуя друг с другом, образовывать макромолекулы. Получающиеся при этом полимерные соединения являются пептидами и белками.
Слайд 58
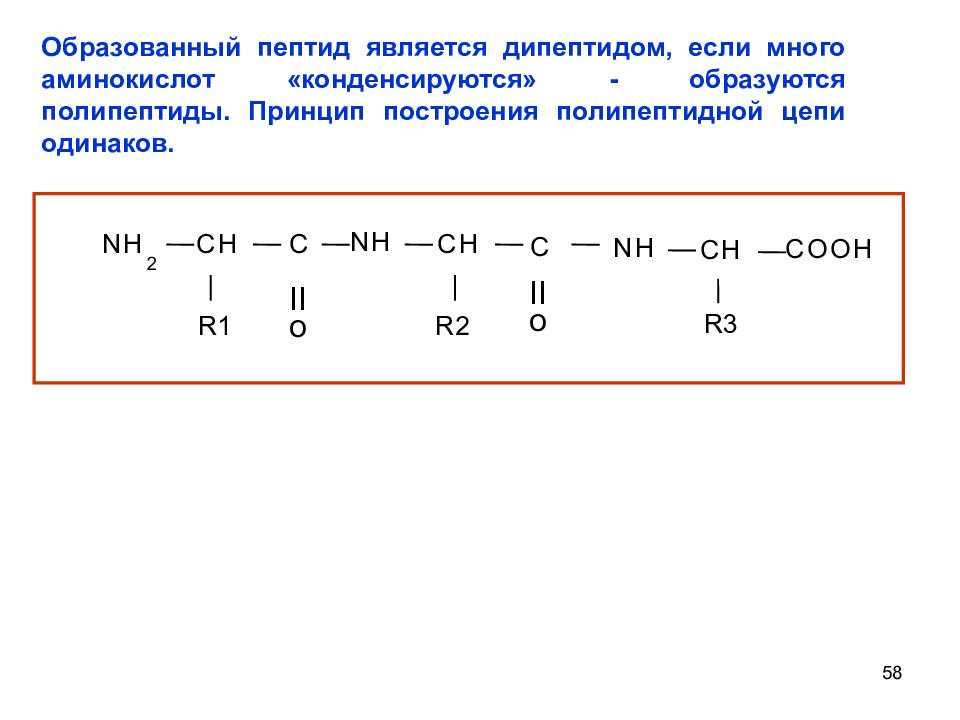
58 N H 2 C H C R1 N H C H R2 C N H C H R3 C O O H II o II o Образованный пептид является дипептидом, если много аминокислот «конденсируются» - образуются полипептиды. Принцип построения полипептидной цепи одинаков.
Слайд 59
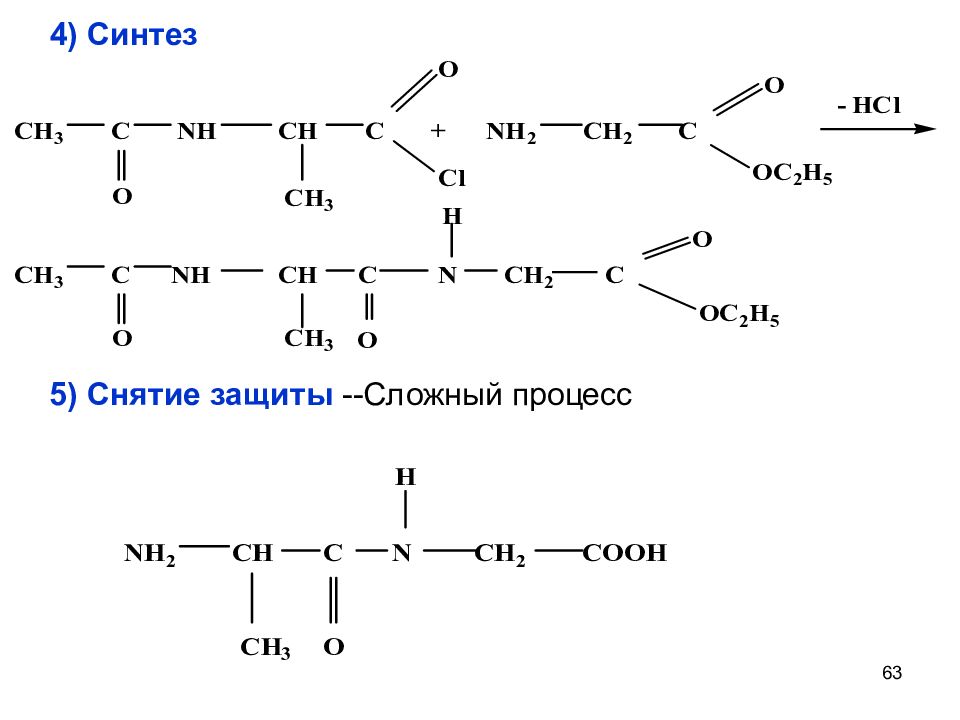
59 Каскадный синтез пептидов. ( ала-гли ) Все операции - в определенной, запрограммированной последовательности. Защита NH 2 группы I ак (ала) Защита СООН-группы II ак ( гли ) Активация СООН-группы I ак (ала) Синтез ( SN ) 5) Снятие защиты
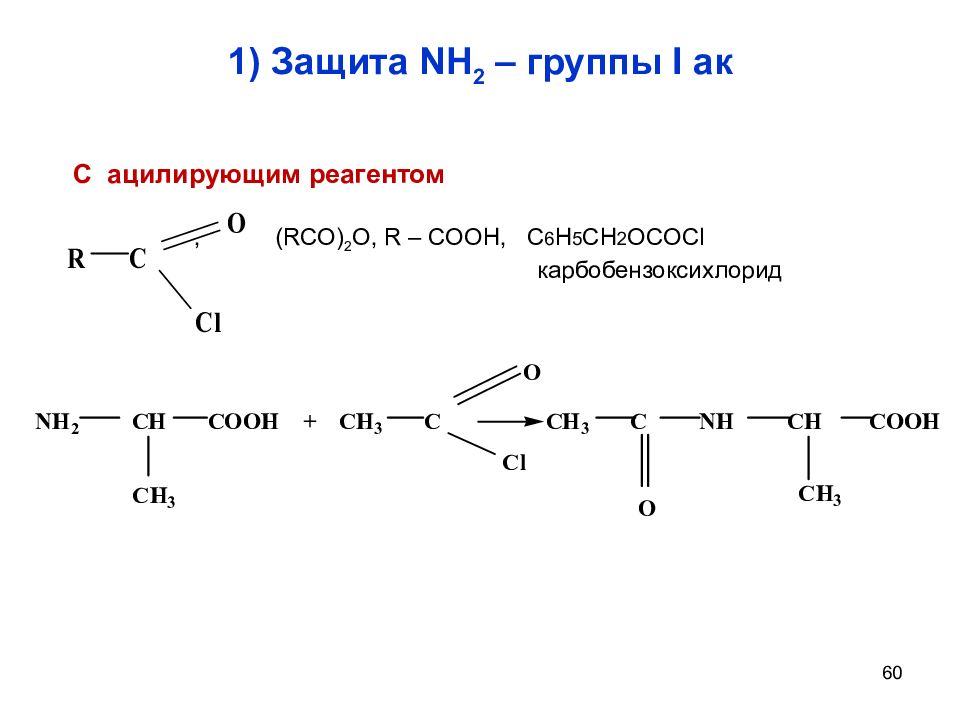
Слайд 60: 1) Защита NH 2 – группы I ак
60 1) Защита NH 2 – группы I ак С ацилирующим реагентом , ( RCO ) 2 O, R – COOH, C 6 H 5 CH 2 OCOCl карбобензоксихлорид
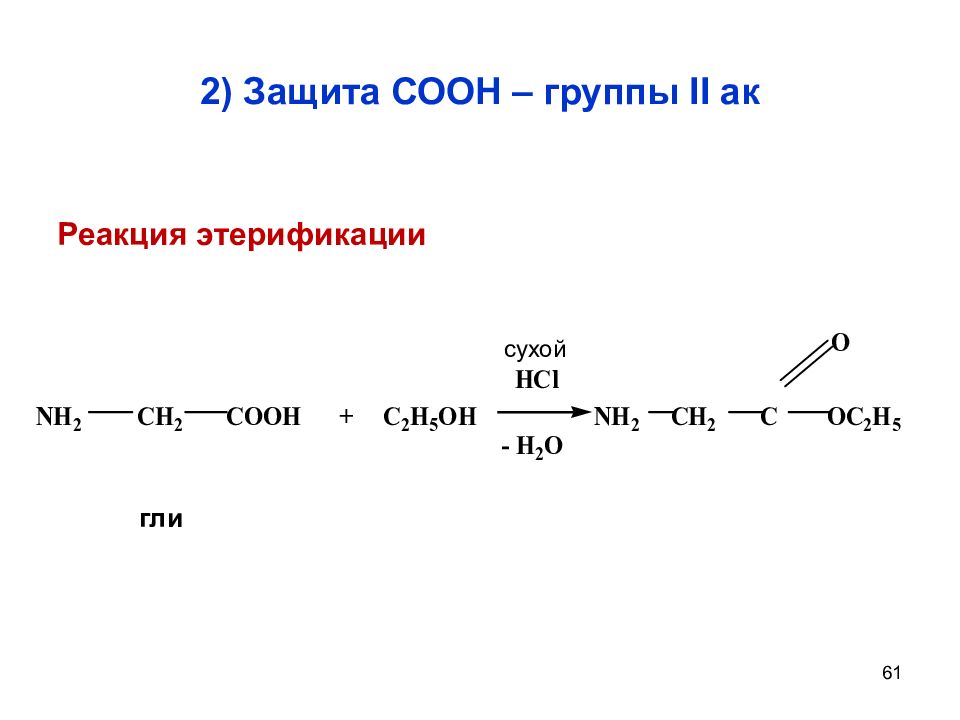
Слайд 61: 2) Защита СООН – группы II ак
61 2) Защита СООН – группы II ак сухой гли Реакция этерификации
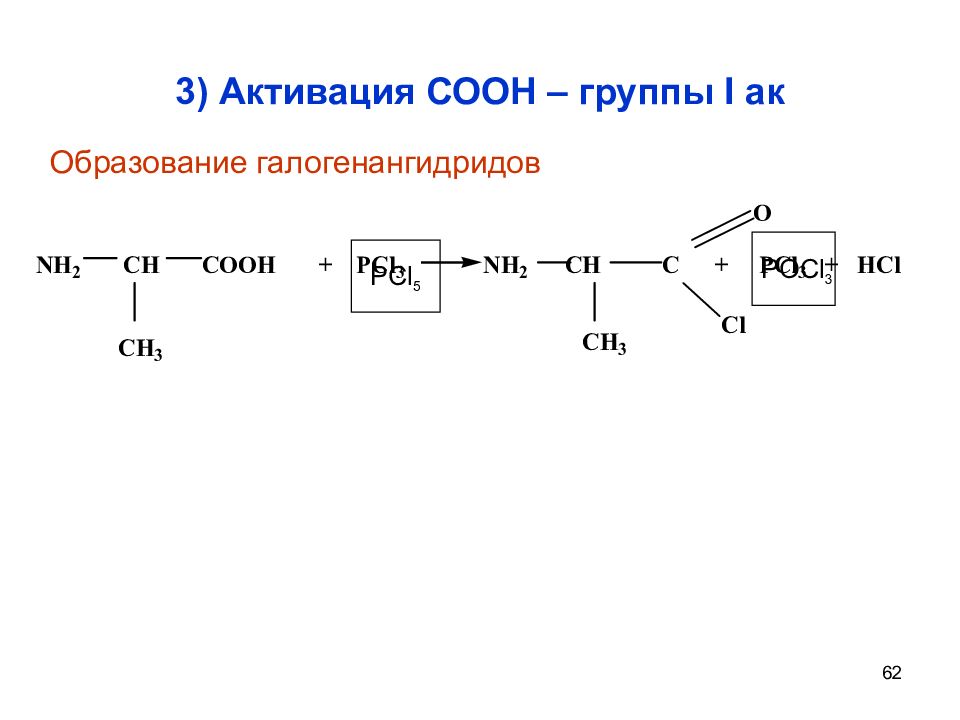
Слайд 62: 3) Активация СООН – группы I ак
62 3) Активация СООН – группы I ак PCl 5 POCl 3 Образование галогенангидридов
Слайд 64
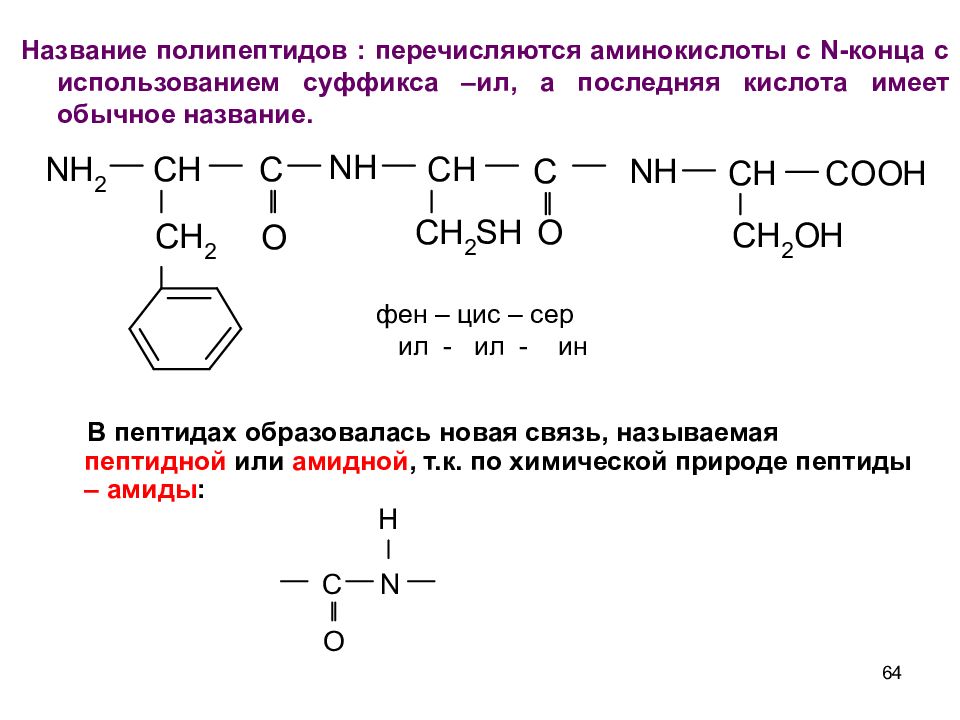
64 Название полипептидов : перечисляются аминокислоты с N- конца с использованием суффикса –ил, а последняя кислота имеет обычное название. фен – цис – сер ил - ил - ин В пептидах образовалась новая связь, называемая пептидной или амидной, т.к. по химической природе пептиды – амиды :
Слайд 65
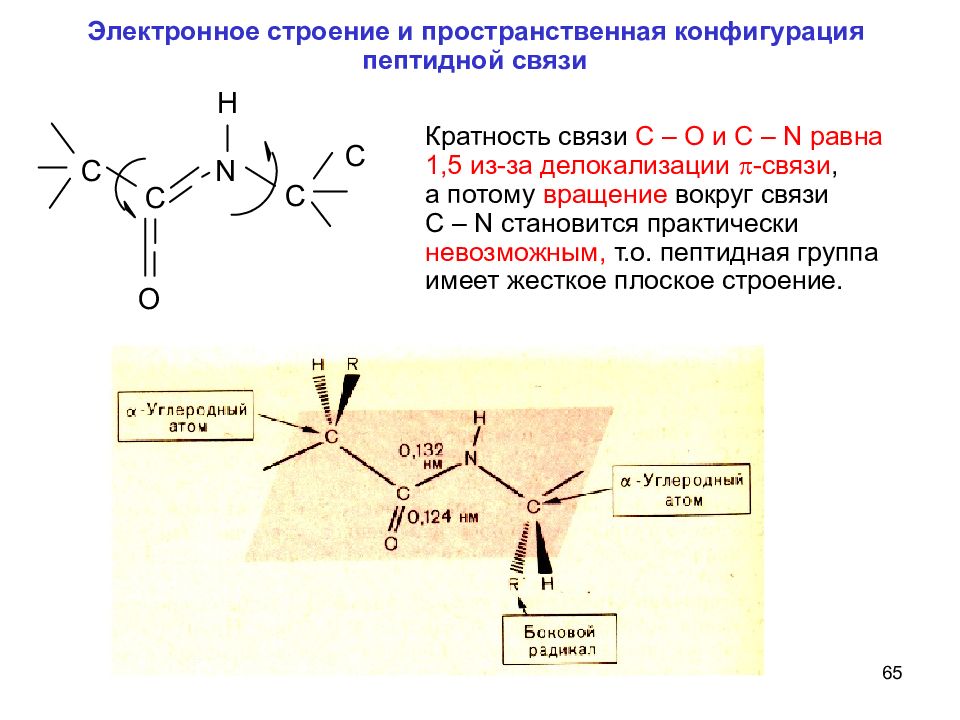
65 Электронное строение и пространственная конфигурация пептидной связи Кратность связи C – O и C – N равна 1,5 из-за делокализации -связи, а потому вращение вокруг связи C – N становится практически невозможным, т.о. пептидная группа имеет жесткое плоское строение.
Слайд 66
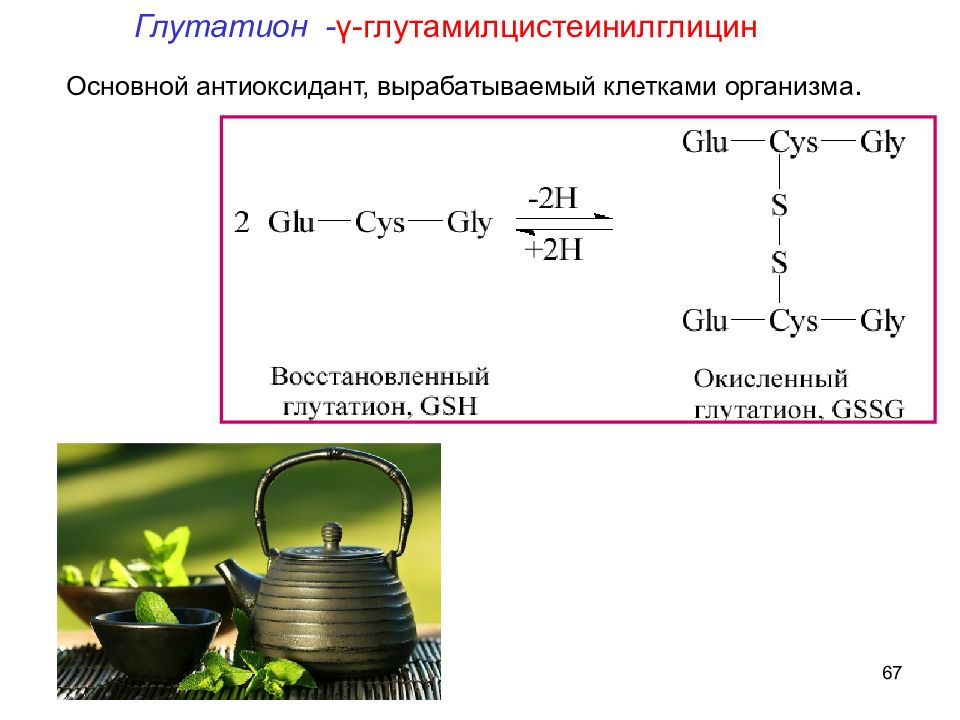
66 Эритроциты в норме Клетки в отсутствии глутатиона Защищает гемоглобин и его белки, мембрану эритроцитов от окислителей. Глутатион - γ-глутамилцистеинилглицин
Слайд 67
67 Основной антиоксидант, вырабатываемый клетками организма. Глутатион - γ-глутамилцистеинилглицин
Слайд 68
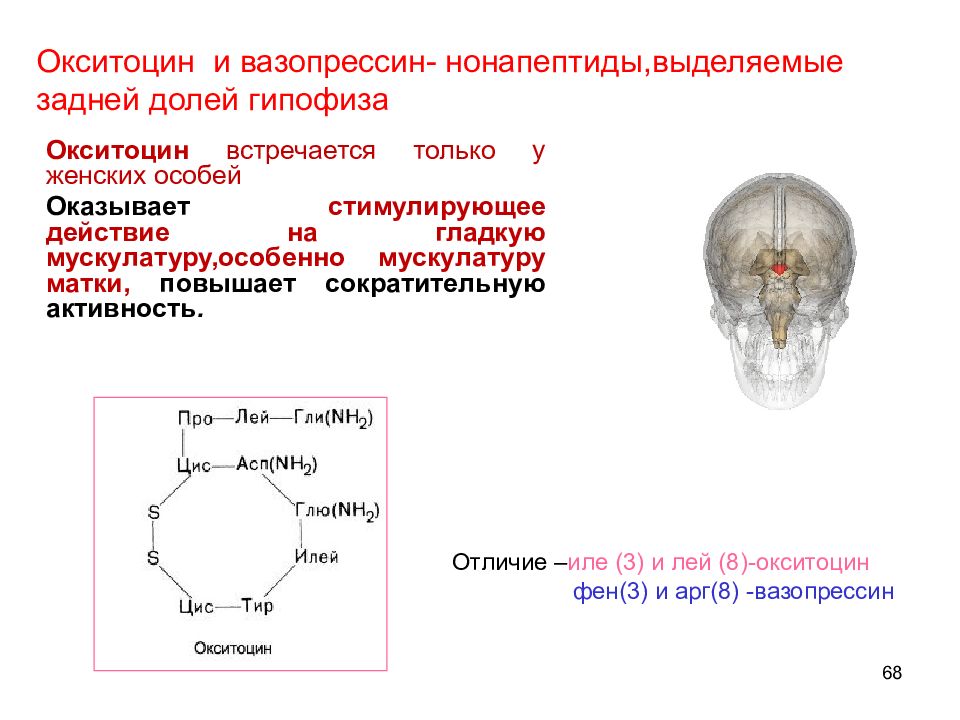
68 Окситоцин встречается только у женских особей Оказывает стимулирующее действие на гладкую мускулатуру,особенно мускулатуру матки, повышает сократительную активность. Окситоцин и вазопрессин- нонапептиды,выделяемые задней долей гипофиза Отличие – иле (3) и лей (8)-окситоцин фен(3) и арг(8) -вазопрессин
Слайд 69
69 Гормон доверчивости. Участвует сразу же после родов в формировании отношения мать-ребенок. Окситоцин
Слайд 70
70 Таблетки верности Вазопрессин управляет родительским поведением, а также узнаванием "своих" и формированием привязанности, нежности и ласки. Мощный стимулятор запоминания Вазопрессин
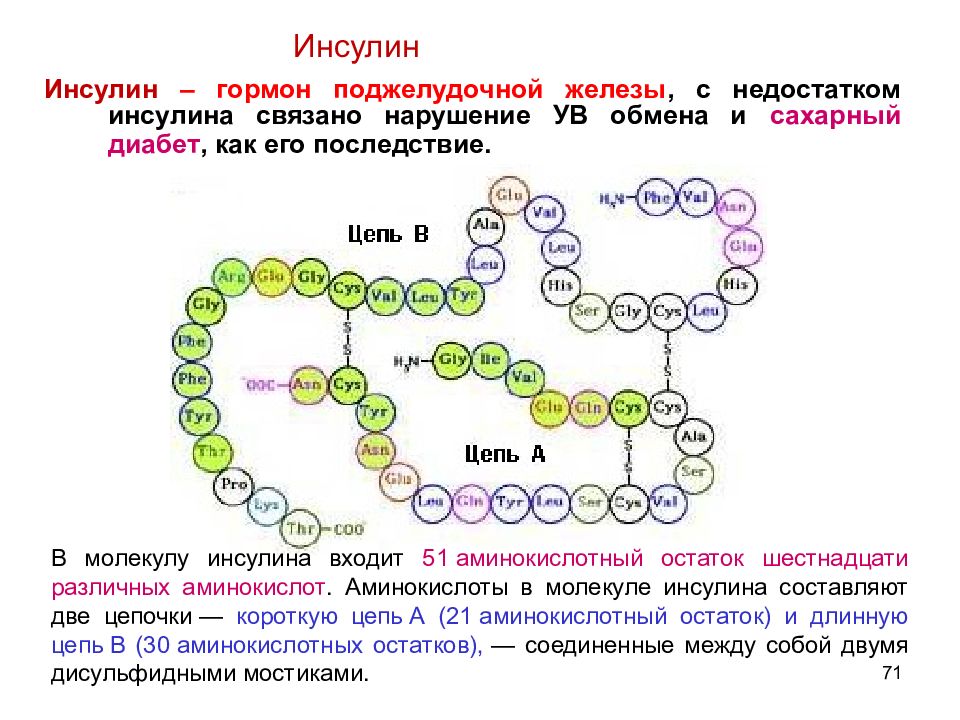
Слайд 71
71 Инсулин – гормон поджелудочной железы, с недостатком инсулина связано нарушение УВ обмена и сахарный диабет, как его последствие. Инсулин В молекулу инсулина входит 51 аминокислотный остаток шестнадцати различных аминокислот. Аминокислоты в молекуле инсулина составляют две цепочки — короткую цепь А (21 аминокислотный остаток) и длинную цепь В (30 аминокислотных остатков), — соединенные между собой двумя дисульфидными мостиками.