Первый слайд презентации: Электролитт ік диссоциация
Слайд 2: Фарадея терминдері
Майкл Фарадей (1791 -1867) Ион- Катион- Анион- Электролит- Катод- Анод- Электролиз- Диэлектрдік өткізгіштік - 1833-1834 гг.
Слайд 3: Менделеевтің ерітінділер теориясы
Д.И. Менделеев (1834-1907) 18 65-1887 ж. Ерітіндінің гидраттану теориясы 1865 г. Докторлық диссертация «спирттердің сумен қосылысы» 233 затты құрамындағы тығыздықтары арқылы анықтады H 2 SO 4 H 2 SO 4 H 2 O H 2 SO 4 6 H 2 O H 2 SO 4 150 H 2 O 1889 ж.РФХО отырысында «судағы ерітінділердің ерігіштік диссосиациясы», 1887 г. «салмақтары арқылы сулы ерітінділерді зерттеу.»
Слайд 4: ЭДТ-сының ашылуы
Рудольф Клаузиус 1857 ж. Р. Клаузиус электрөткізгіштік теориясын жасады. Тоқ күшінің әсерінен ерітінде иондар пайда болады..
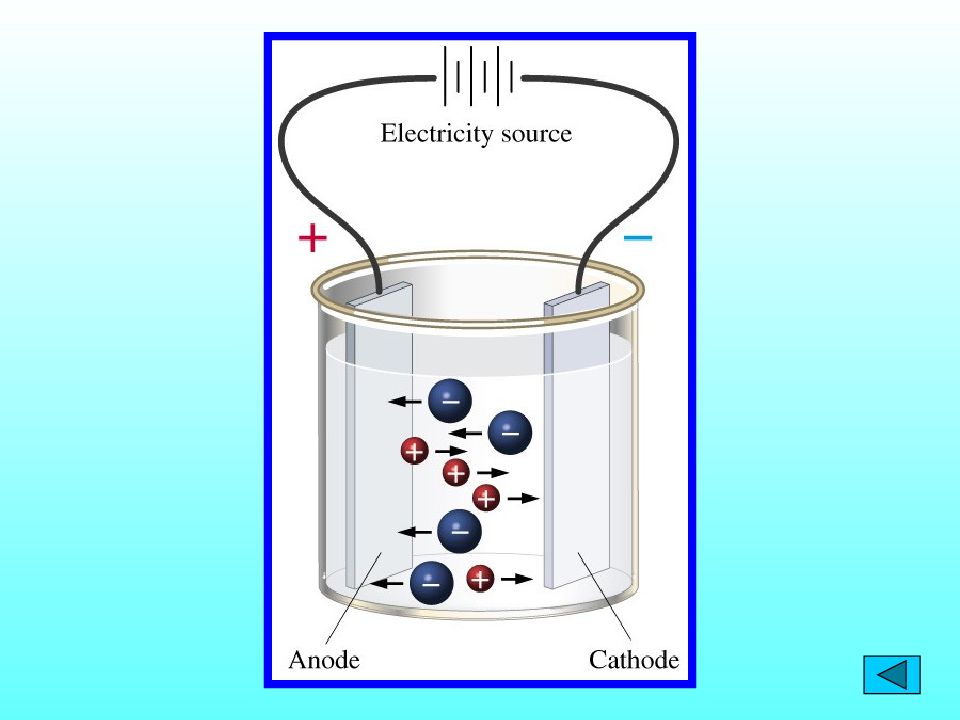
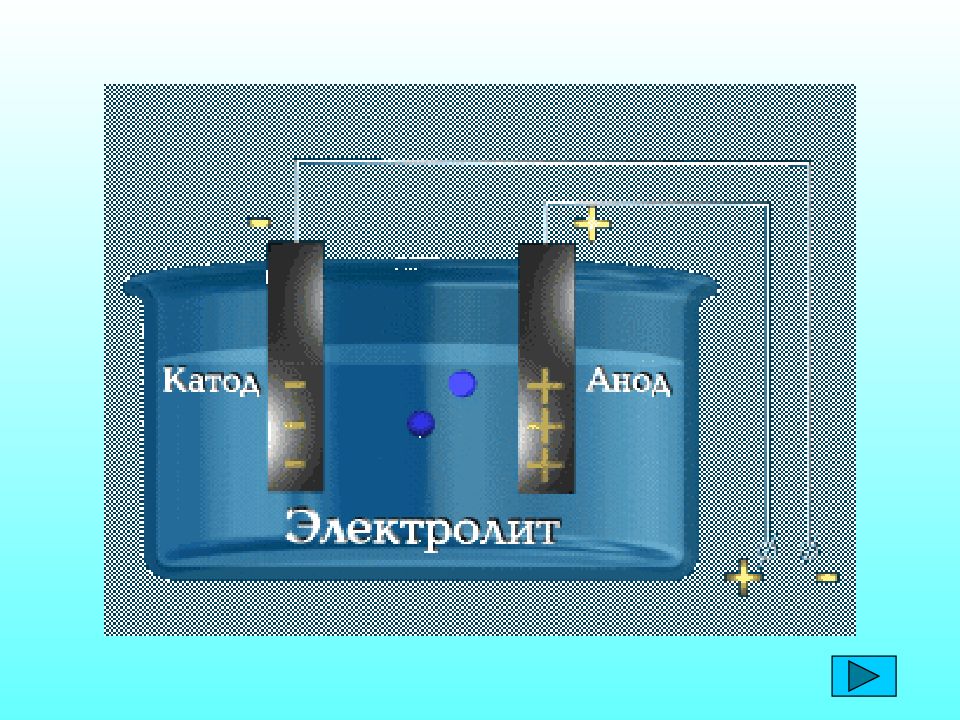
Сванте Аррениус (1859-1927) 1883 г. – диссертацияны қорғау « Химическая теория электролитов » Полюсті еріткіштің әсерінен электролиттер ерітіндіде иондарға ыдырайды. Электролититік диссоциация Ионы существенно отличаются от атомов. В растворе ионы движутся хаотично. При пропускании через раствор электролита постоянного электрического тока ионы перемещаются направленно: катионы к катоду, анионы к аноду.
Слайд 6
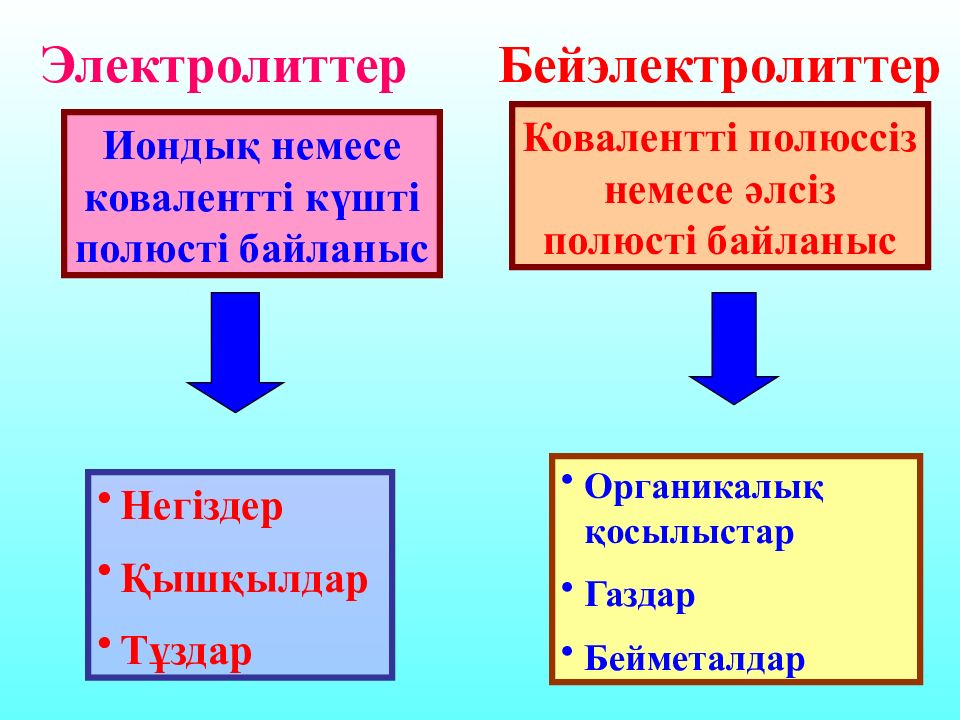
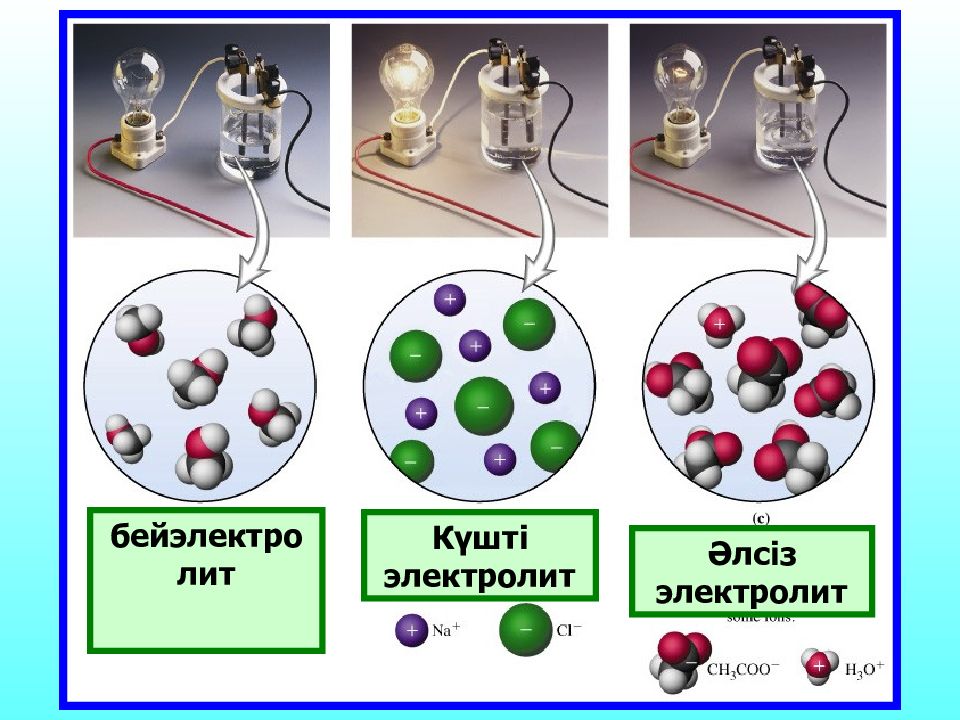
Ерітінділері мен балқымалары электр тоғын өткізеді Заттар Электрөткізгіштік Электролиттер Бейэлектролиттер Ерітінділері мен балқымалары электр тоғын өткізбейді
Слайд 7
Иондық немесе ковалентті күшті полюсті байланыс Негіздер Қышқылдар Тұздар Ковалентті полюссіз немесе әлсіз полюсті байланыс Органикалық қосылыстар Газдар Бейметалдар Электролиттер Бейэлектролиттер
Слайд 8: Электролиттік диссоциация теориясы
С. А. Аррениус (1859-1927) процесс растворения электролитов сопровождается образованием заряженных частиц, способных проводить электрический ток Электролиттердің еру немесе балқу процессі электр тогын өткізе алатын зарядталған бөлшектер түзе жүретін процесс
Слайд 9
1. Электролиттік диссоциация-электролиттерд ің суда ерігенде оң және теріс зарядталған иондарға ыдырауы. 2. Электр тоғының әсерінен теріс полюсқа оң зарядталған иондар жылжиды( катиондар ), ал оң полюсқа теріс зарядталған иондар жылжиды( аниондар ). 3. Диссоциация – қайтымды процесс. Молекулалардың иондарға ыдырау процесімен қатар иондардың молекулалар процесі жүреді.( ассоциация )
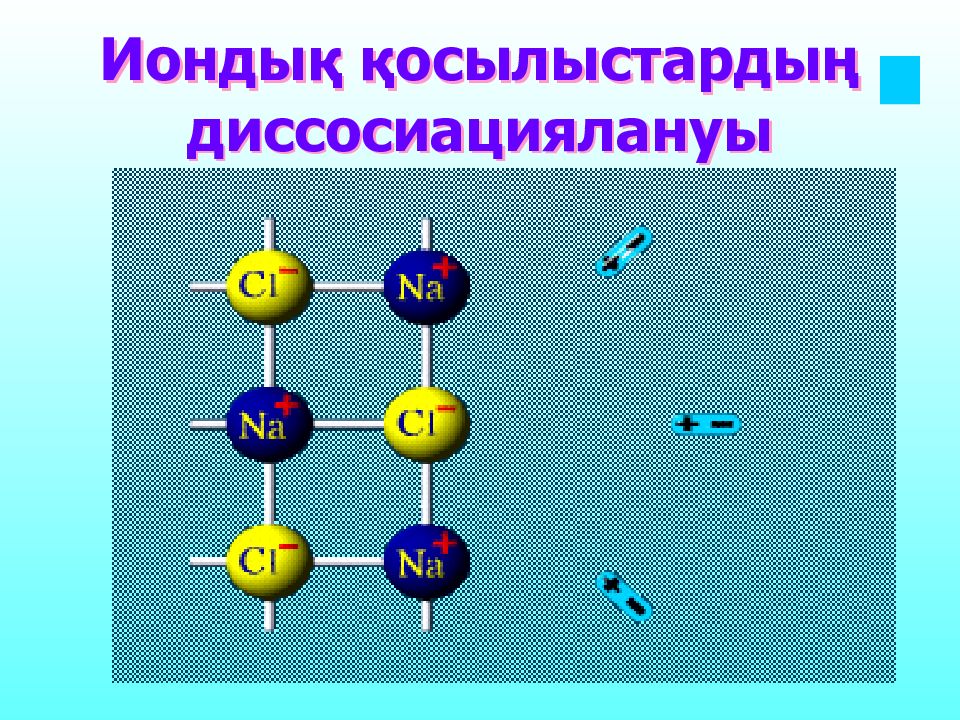
Слайд 13: Натрий хлориді кристалдарының құрылысы қант кристалдары құрылысынан мүлде өзгеше
Ас тұзы суда ерігенде заряды бар бөлшектер – иондар түзіліп,электр тоғын тасымалдайды ал, Қант ерігенде зарядсыз бөлшектер – молекулаларға дейін ғана ыдырайтындықтан,электр тоғын тасымалдай алмайды.
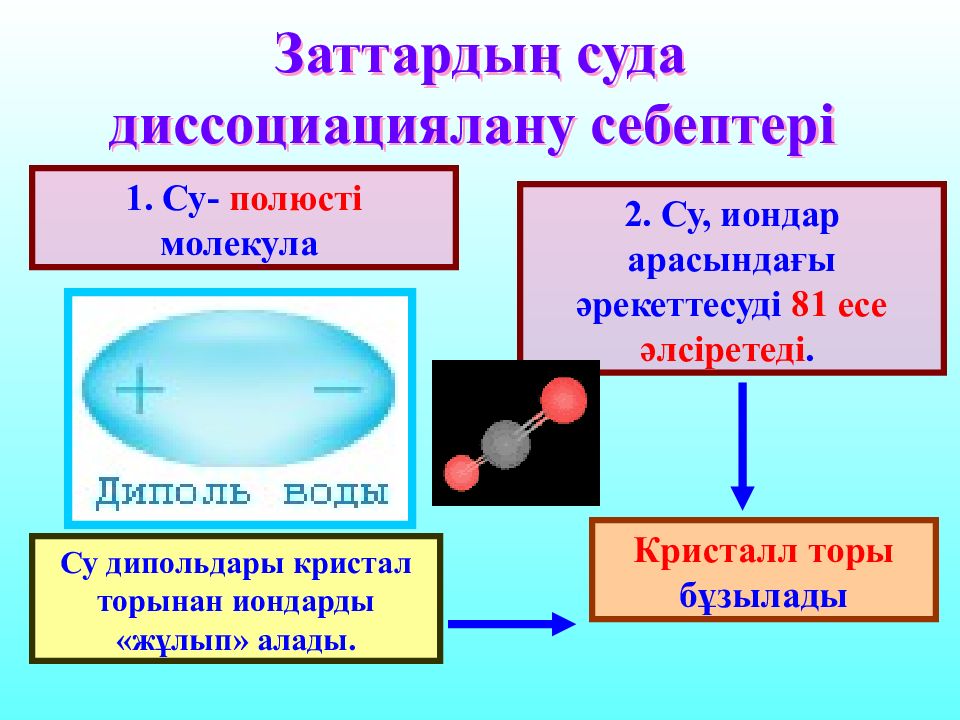
Слайд 14: Заттардың суда диссоциациялану себептері
1. Су- полюсті молекула 2. Су, иондар арасындағы әрекеттесуді 81 есе әлсіретеді. Су дипольдары кристал торынан иондарды «жұлып» алады. Кристалл торы бұзылады
Слайд 15: Балқымаларда заттардың иондарға ыдырау себептері
Қыздырғанда кристал торларының түйіндерінде орналасқан иондар тербелісі күше й еді – кристалл торы бұзылады.
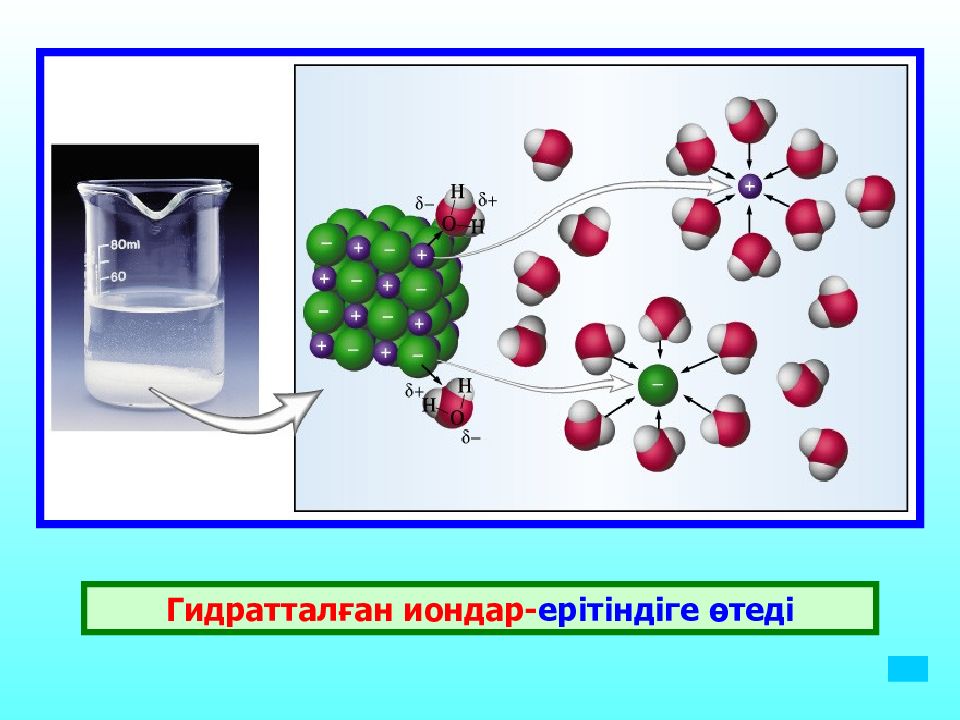
Слайд 18: Гидраттанған иондар
Гидраттану реакциясының мәнін алғаш ашқан орыс ғалымы И.А Каблуков Гидраттану нәтижесінде кристаллогидраттар түзіледі. Кристалл торында өз молекулаларымен және иондарымен қоса су молекулалары да болады ондай су кристалдық су деп аталады. Мысалы : MgSO 4 *10H 2 O
Слайд 20
Электролиттік ыдырау нәтижесінде түзілген гидратталған иондардыңдың қысқашадиссоциация теңдеуі.
Слайд 21
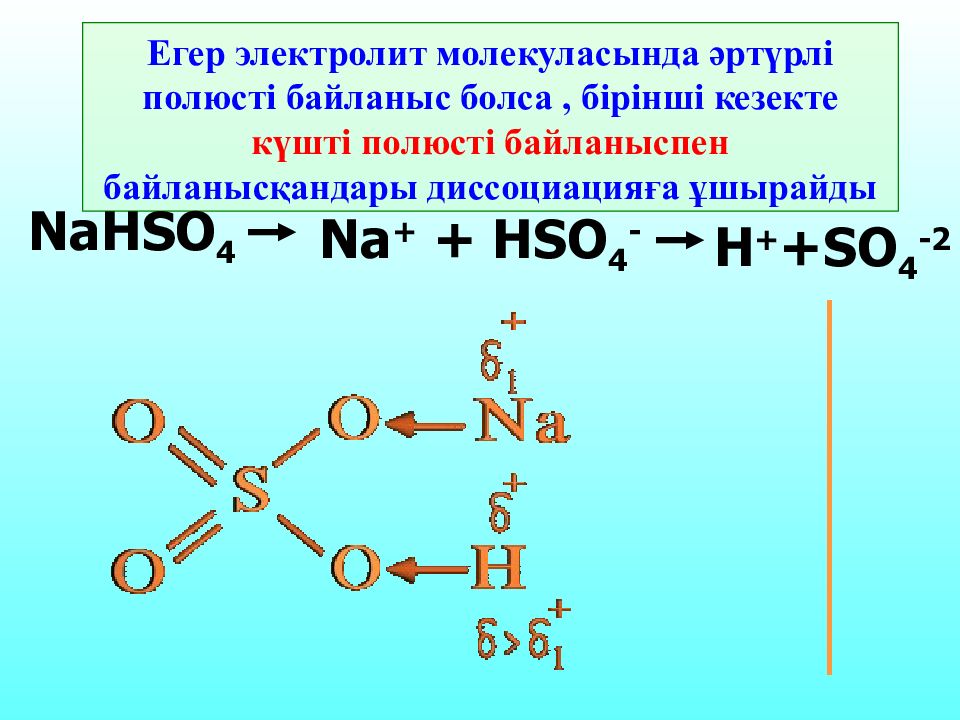
Егер электролит молекуласында әртүрлі полюсті байланыс болса, бірінші кезекте күшті полюсті байланыспен байланысқандары диссоциацияға ұшырайды NaHSO 4 Na + + HSO 4 - H + +SO 4 -2
Слайд 22
Диссоциацияға ұшыраған молекулалар санының жалпы молекулаларға қатынасы Электролиттердің күші
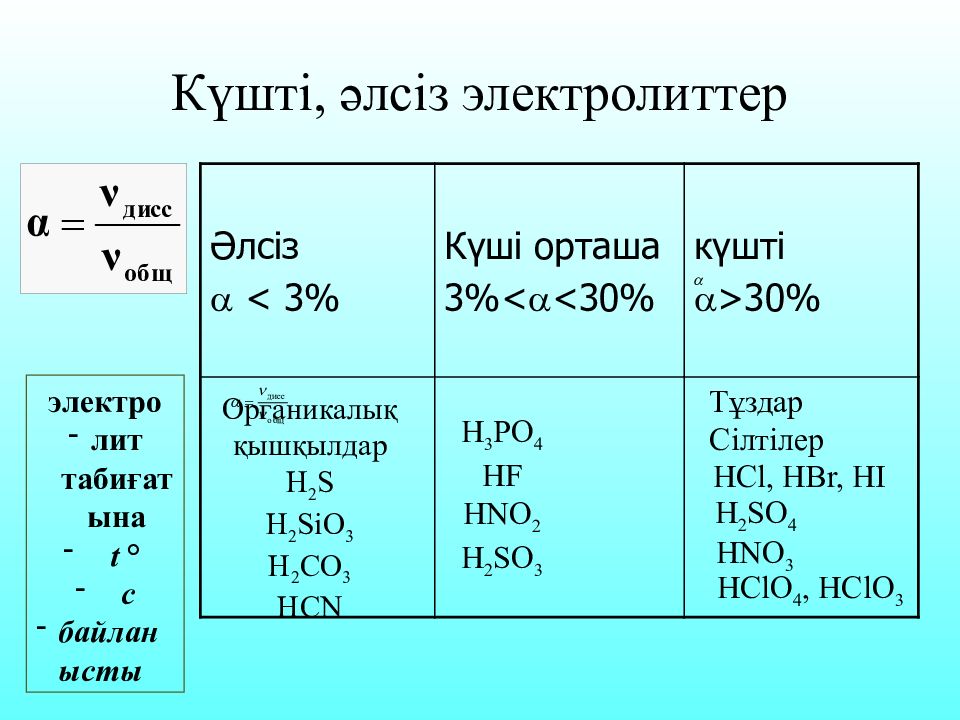
Слайд 23: Күшті, әлсіз электролиттер
Әлсіз < 3% Күші орташа 3%< <30% күшті >30% электро лит табиғатына t ° с байланысты Тұздар Сілтілер HCl, HBr, HI H 2 SO 4 HNO 3 HClO 4, HClO 3 H 3 PO 4 HF HNO 2 H 2 SO 3 Органикалық қышқылдар Н 2 S H 2 SiO 3 H 2 CO 3 HCN
Слайд 25: Электролиттік диссоциация теориясы
Сванте Аррениус (1859-1927) 1883 г. – « Электролиттердің химиялық теориясы » диссертациясын қорғау Электролиттік диссоциация - ерітіндідегі электролиттер полярлы еріткіштердің әсерінен иондарға ыдырауы. Иондар атомдардан ерекшеленеді. Ерітіндіде иондар ретсіз қозғалады. Тұрақты электр тогы әсерінен электролит ерітіндісіндегі иондар бағытталып қозғалады: Катиондар катодка, аниондар анодқа тартылады.
Слайд 26
Күшті электролиттер Суда еритін орта тұздар Сілтілік және сілтілік жер металдарының гидроксидтері LIOH- CsOH Ca(OH) 2- -- Ba (OH) 2 Минералды қышқылдар H 2 SO 4, HNO 3, HCIO 3, HCIO 4 HBrO 3, HJO 3, HCI, HBr, HJ
Слайд 27
Күші орташа электролиттер H 3 PO 4 HPO 3, HCIO 2, H 4 P 2 O 7, H 2 SO 3, HF, Fe(OH) 2
Слайд 28
Әлсіз электролиттер Органикалық қышқылдар HCOOH CH 3 COOH, C 2 H 5 COOH, Минералды қышқылдар HNO 2, HCIO,, H 2 SiO 3, H 2 CO 3 H 3 BO 3, H 3 PO 3, H 2 S Белсенділігі аз металдардың гидроксидтері Cu(OH) 2, Fe(OH) 3, Ae (OH) 3, Cr(OH) 3, NH 4 OH
Слайд 29
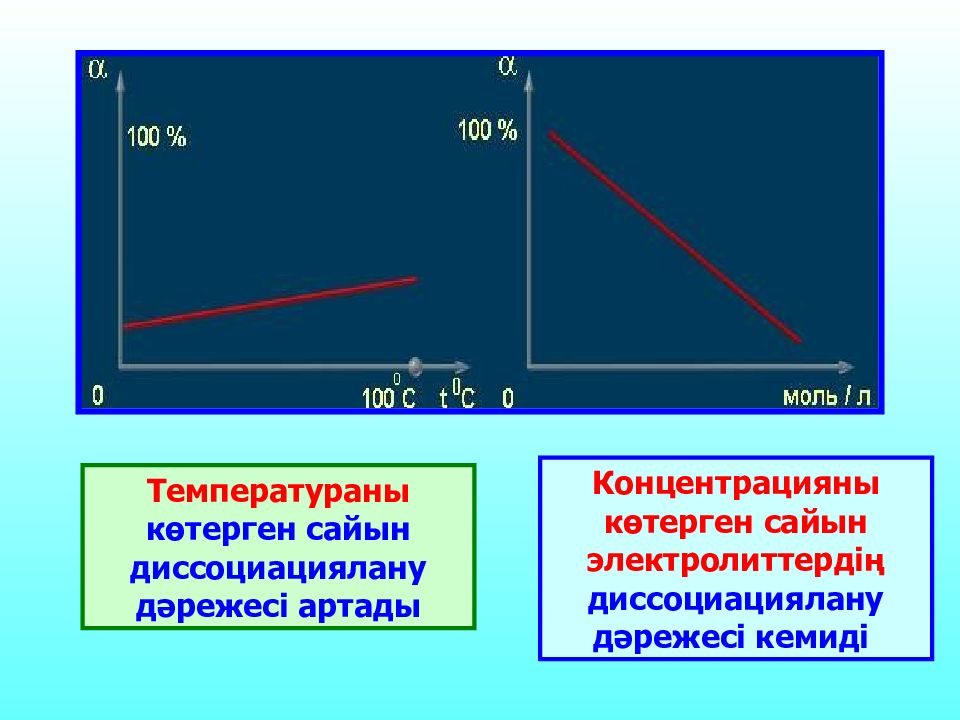
Температураны көтерген сайын диссоциациялану дәрежесі артады Концентрацияны көтерген сайын электролиттердің диссоциациялану дәрежесі кемиді
Слайд 30: Диссоциациялану Константасы
Әлсіз электролиттің иондарға ыдырау қабілеттілігін көрсетеді
Слайд 31
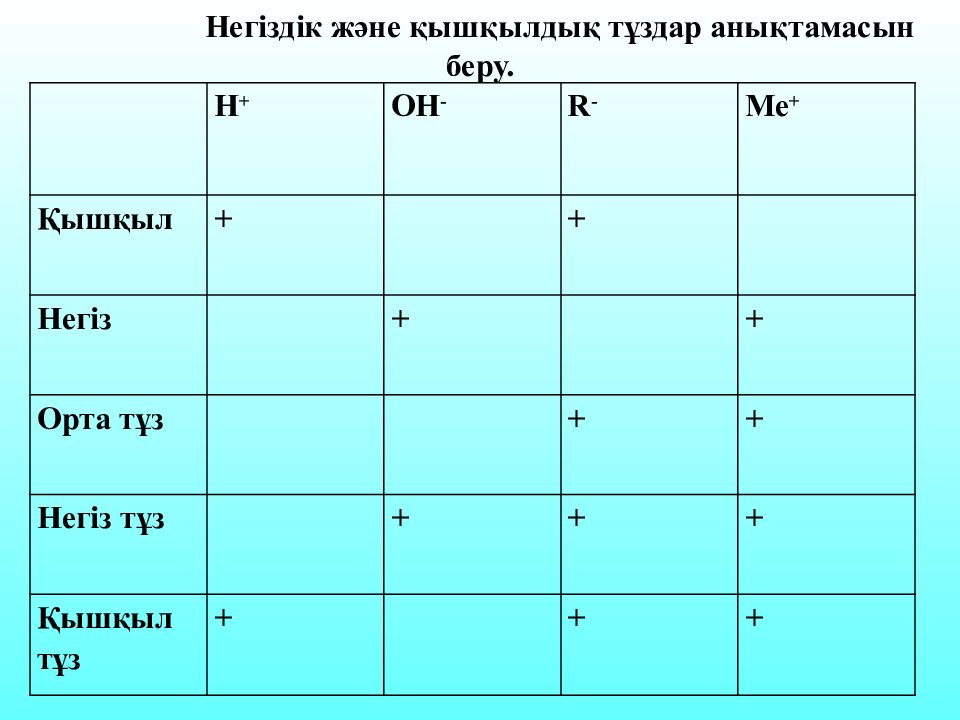
Н + ОН - R - Me + Қышқыл + + Негіз + + Орта тұз + + Негіз тұз + + + Қышқыл тұз + + + Негіздік және қышқылдық тұздар анықтамасын беру.
Слайд 32
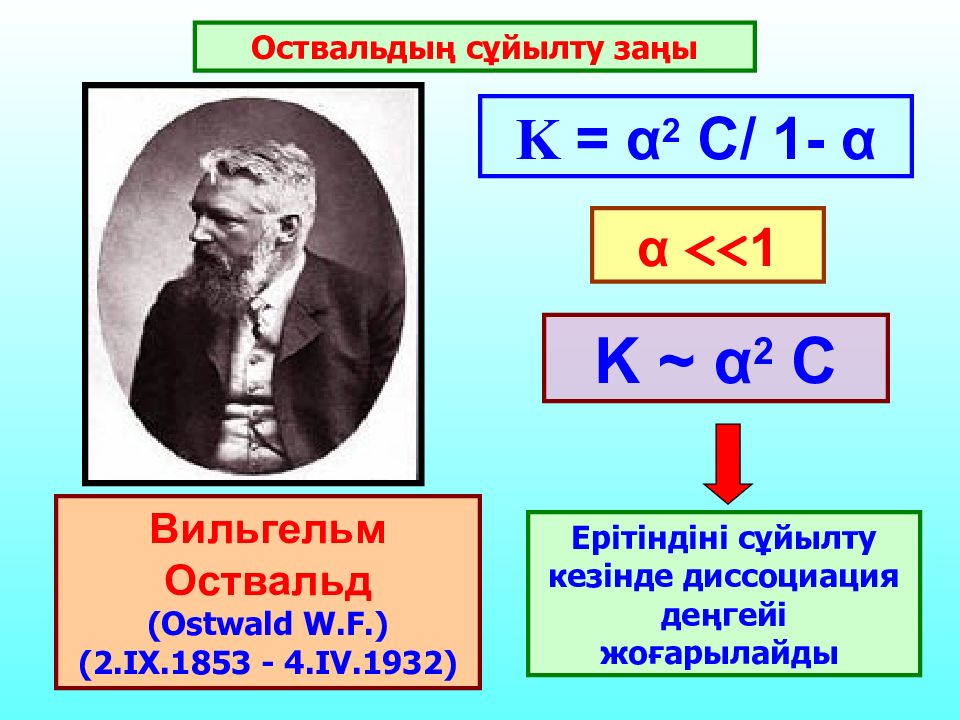
Вильгельм Оствальд (Ostwald W.F.) (2.IX.1853 - 4.IV.1932) Оствальдың сұйылту заңы K ~ α 2 C Ерітіндіні сұйылту кезінде диссоциация деңгейі жоғарылайды K = α 2 C/ 1- α α << 1