Первый слайд презентации: Элементы V группы главной подгруппы
Слайд 3
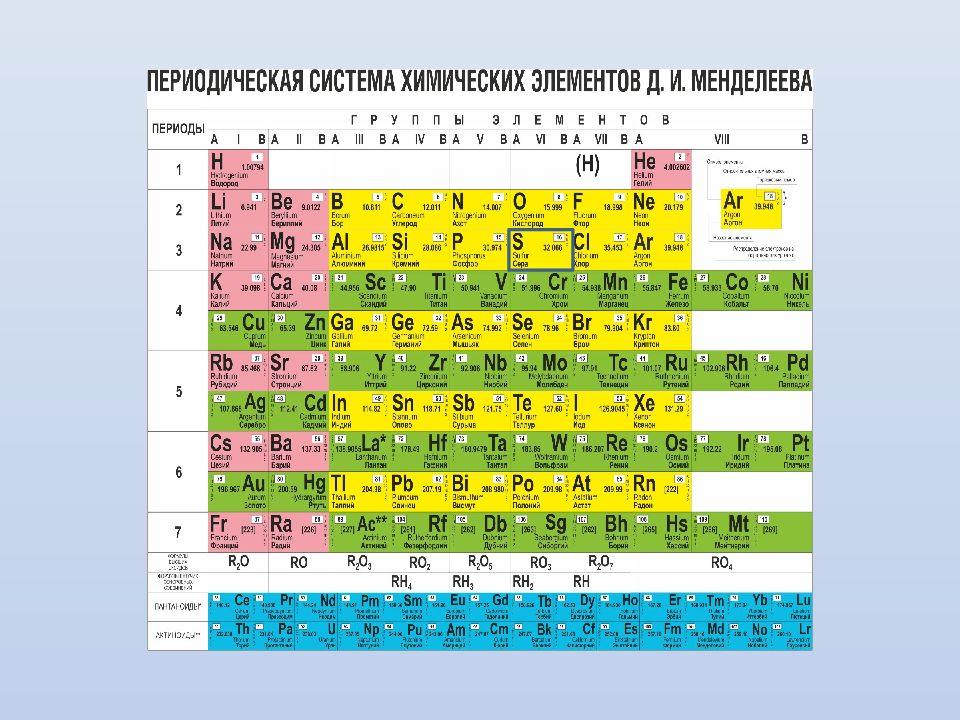
Группы элементов I III II VIII IV V VI VII II I III VII VI V IV 2 1 3 4 5 6 7 10 Li Литий 3 6,9 39 Периоды Ряды K Калий 19 39.102 Na Натрий 11 22,9898 Cu Медь 29 63.54 6 В Бор 5 10.811 Ne Неон 1 0 20,18 Be Вериллий 4 9,012 Ca Кальций 20 40,08 Ag Серебро 47 107.868 Ra Радий 88 [ 226 ] La Лантан 57 138.81 Al Алюминий 13 26,9815 O Кислород 8 15.996 N Азот 7 14.0 067 Ge Германий 32 72.59 C Углерод 6 12,011 F фтор 9 18.9984 Br Бром 35 79.904 H Водород 1 1.00797 Se Селен 34 78.96 I Иод 53 126.904 Cl Хло р 1 7 35,453 As Мышьяк 33 74.9216 He Гелий 2 4,003 Ar Аргон 1 8 39,948 Xe Ксенон 54 131,3 Kr Криптон 36 83,8 Te Теллур 52 127.60 Fe Железо 26 55.847 Mg Магний 1 2 24,312 S Сера 1 6 32,064 P Фосфор 1 5 30,9738 Si Кремний 1 4 28,086 Ti Титан 22 47.90 Mo Молибден 42 95.94 T с Технеций 4 3 99 V Ванадий 2 3 50.942 Cr Хром 24 51.996 Mn Марганец 25 54.938 S с Скандий 21 44.956 Ga Галлий 31 69.72 Re Рений 75 186.2 Rh Родий 45 102.905 Ir Иридий 77 192.2 Ru Рутений 44 101.07 Os Осмий 76 190.2 Pt Платина 78 195.09 Pd Палладий 46 106.4 At Астат 85 210 Rn Радон 8 6 [22 2 ] Mt Мейтнерий 109 [ 266 ] Hs Хассий 108 [ 265 ] Ba Барий 56 137.34 Sr Стронций 38 87.62 Rb Рубидий 37 85.47 In Индий 49 114.82 Cs Цезий 55 132.905 Fr Франций 87 [ 223 ] 9 8 Zn Цинк 30 65. 37 W Вольфрам 74 183.85 Po Полоний 84 208.982 Zr Цирконий 40 91.224 Nb Ниобий 41 92.906 Ta Тантал 73 180.9479 Cd Кадмий 48 112.41 Sb Сурьма 51 121.75 Hf Гафний 72 178.49 Sn Олово 50 118.71 Pb Свинец 82 207.2 Bi Висмут 83 208.98 Co Кобальт 27 58.933 Ni Никель 28 58.71 Y Иттрий 39 88.9059 Au Золото 79 196.966 Tl Таллий 81 204.383 Hg Ртуть 80 200.59 Ac Актиний 89 227.028 Bh Борий 107 [ 262 ] Sg Сиборгий 106 [ 263 ] Db Дубний 105 [ 262 ] Rf Резерфордий 104 [ 261 ] Галогены
Слайд 4: Общая характеристика
К элементам V группы, главной подгруппы относятся азот N, фосфор P, мышьяк As, сурьма Sb, висмут Bi Общее название - пниктогены (греческий корень " пникт " - "удушливый", "плохо пахнущий"), Так охарактеризованы запахи водородных соединений этих элементов N, P - типичные неметаллы As, Sb - проявляют неметаллические и металлические свойства Bi - типичный металл
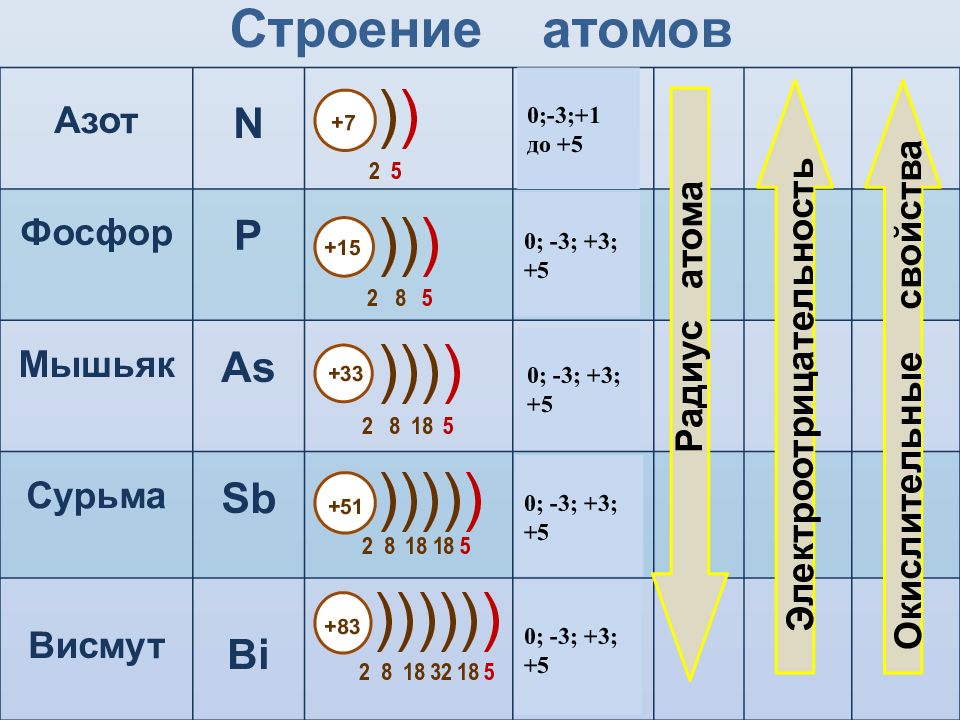
Слайд 5: Строение атомов
Азот N 2 s 2 2р 3 Фосфор P 3 s 2 3 p 3 Мышьяк As 4 s 2 4 p 3 Сурьма Sb 5 s 2 5 p 3 Висмут Bi 6 s 2 6 p 3 Строение атомов +7 2 5 ) ) +83 2 8 18 32 18 5 ))))) ) +15 2 8 5 )) ) +33 2 8 18 5 ))) ) +51 2 8 18 18 5 )))) ) Радиус атома Электроотрицательность Окислительные свойства 0 ;-3;+1 до +5 0; -3; +3; +5 0; -3; +3; +5 0; -3; +3; +5 0; -3; +3; +5
Слайд 6: Общая характеристика
nS 2 nP 3 – строение внешнего энергетического уровня На внешнем уровне 5 электронов Увеличивается количество энергетических уровней в атоме Увеличивается радиус атома ослабляется притяжение валентных электронов к ядру ослабляются неметаллические и окислительные сойства возрастают металлические и восстановительные свойства ЭО уменьшается Низшая степень окисления в соединениях -3 Высшая степень окисления в соединениях +5
Слайд 7
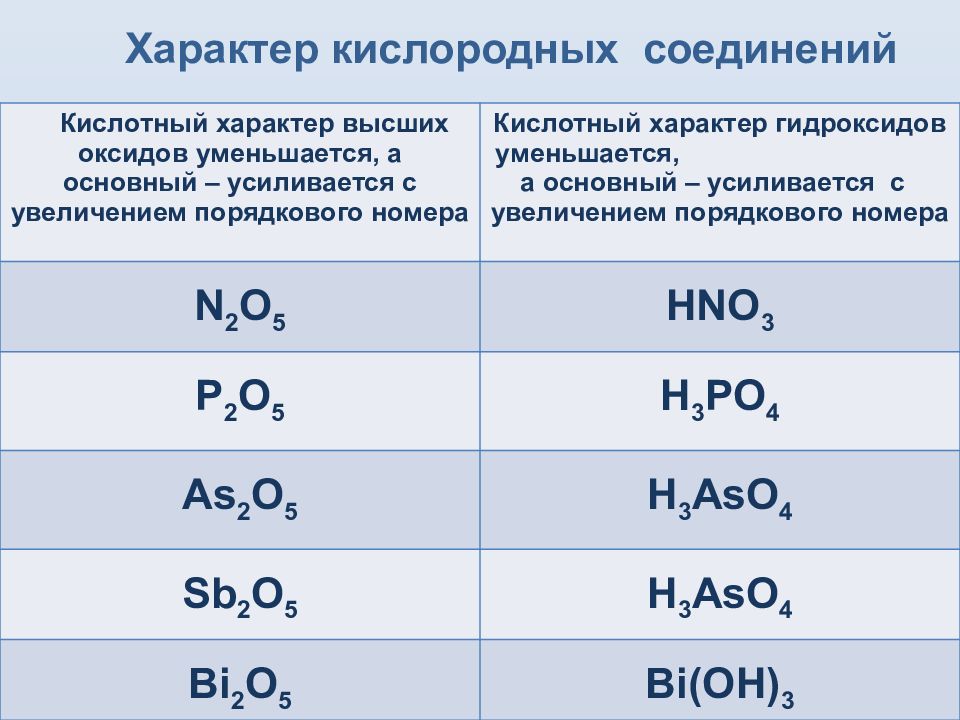
Высшая степень окисления в соединениях равна +5; низшая степень окисления равна —3 (кроме Sb и Bi ). В связи с этим высшие оксиды имеют общую формулу R 2 0 5, а водородные соединения — RH 3. Из промежуточных степеней окисления +3 является общей для всех элементов. Изменение свойств элементов по мере увеличения атомного радиуса (сверху вниз по подгруппе) происходит гораздо более резко, чем в главных подгруппах VII и VI групп.
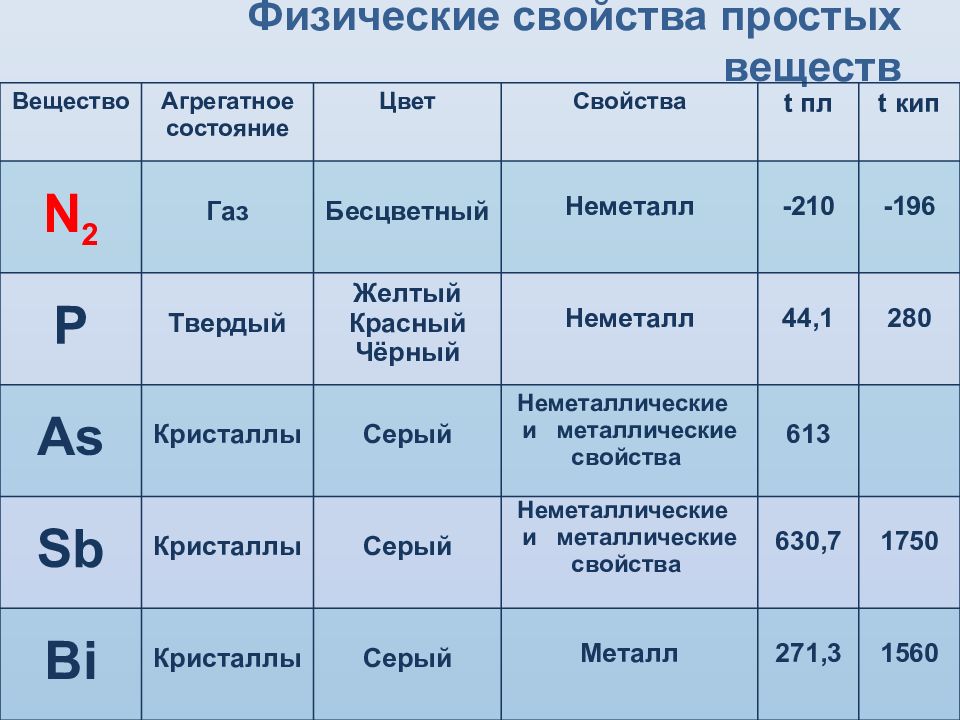
Слайд 8: Физические свойства простых веществ
Вещество Агрегатное состояние Цвет Свойства t пл t кип N 2 Газ Бесцветный Неметалл - 210 - 196 P Твердый Желтый Красный Чёрный Неметалл 44,1 280 As Кристаллы Серый Неметаллические и металлические свойства 613 Sb Кристаллы Серый Неметаллические и металлические свойства 630,7 1750 Bi Кристаллы Серый Металл 271,3 1560
Слайд 9
Первые два элемента (азот и фосфор) являются типичными неметаллами, мышьяк уже проявляет признаки металличности, значительно усиливающиеся у сурьмы и висмута, которые принадлежат к металлам. Эти различия проявляются как в свойствах простых веществ, образуемых элементами, так и в свойствах сложных веществ, прежде всего оксидов и гидроксидов :
Слайд 10: Характер кислородных соединений
Кислотный характер высших оксидов уменьшается, а основный – усиливается с увеличением порядкового номера Кислотный характер гидроксидов уменьшается, а основный – усиливается с увеличением порядкового номера N 2 O 5 HNO 3 P 2 O 5 H 3 PO 4 As 2 O 5 H 3 AsO 4 Sb 2 O 5 H 3 AsO 4 Bi 2 O 5 Bi ( OH) 3
Слайд 11: Из истории открытия азота
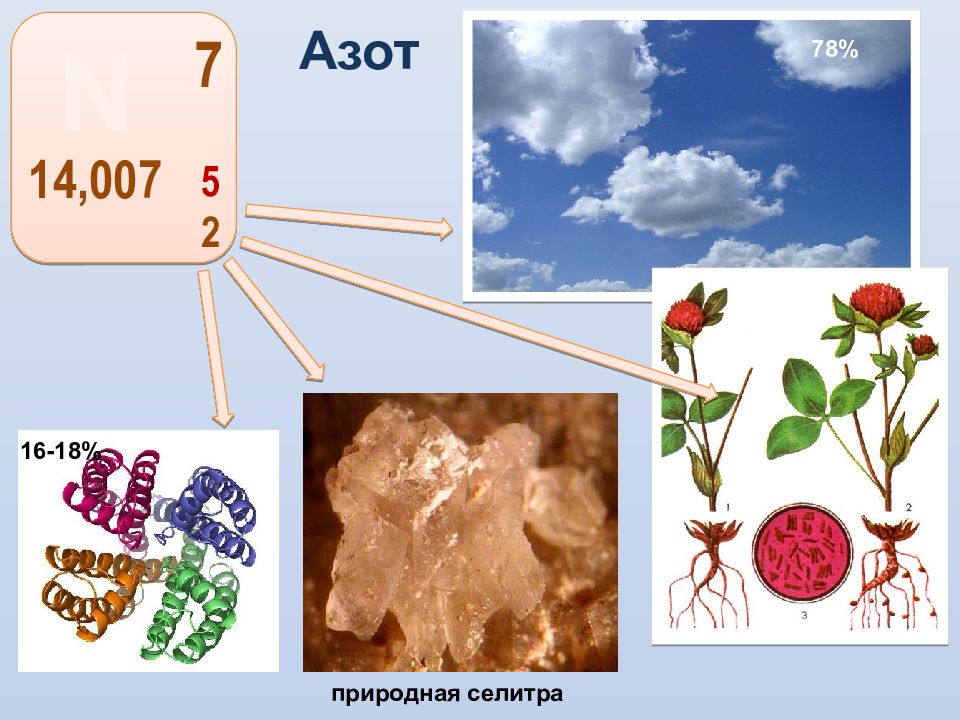
Впервые азот был открыт английским ученым Д.Резерфордом в 1772 г. Его свойства исследовали ученые К. Шееле, Г. Кавендиш, Дж. Пристли, А. Лавуазье. Знаменитый ученый А. Лавуазье совместно с другими учеными предложил термин «азот», что в переводе с греческого означает «безжизненный». Но не прошло и полувека, как выяснилось, что «безжизненный» азот – это один из элементов жизни – входит в состав белков.
Слайд 13: Значение азота
Азот- жизненно важный элемент. Все основные части клеток организма построены из белковых молекул, в состав которых входят атомы азота. Без белка нет жизни, а без азота нет белка. Азот входит в состав растительных белков, а животные получают готовые белковые вещества от растений, в животном организме содержится от 1 – 10 % азота по массе. Большое значение имеют особые бактерии, которые живут в клубеньках на корнях бобовых растений ( клубеньковые бактерии ). Эти бактерии превращают атмосферный азот в соединения, которые могут усваивать растения.
Слайд 14
В природе основная часть азота находится в свободном состоянии ( N 2 ). Из неорганических соединений азота только натриевая селитра (нитрат натрия NaN 0 3 ) в виде пластов имеется на побережье Тихого океана в Чили. В составе сложных органических соединений (белков, нуклеиновых кислот) азот присутствует во всех живых организмах.
Слайд 16: Мышьяк
Мышьяк — редкий элемент. содержание в земной коре 1,7·10-4% по массе может встречаться в самородном состоянии известно около 200 мышьяксодержащих минералов As 74,9 33 5 18 8 2 As Арсенопирит FeAsS Аурипигмент As 2 S 3
Слайд 17: Сурьма
Природная сурьма является смесью двух изотопов: 121 Sb (57,36 %) и 123 Sb (42,64 %) Напоминая внешним видом металл, кристаллическая сурьма обладает большей хрупкостью и меньшей тепло- и электропроводностью Sb 121,7 51 5 1818 8 2 Применяется в полупроводниковой промышленности Является компонентом свинцовых сплавов, увеличивающим их твёрдость и механическую прочность
Последний слайд презентации: Элементы V группы главной подгруппы: Висмут
Природный висмут состоит из одного изотопа 209 Bi Висмут в твёрдом состоянии имеет меньшую плотность, чем в жидком Bi 121,7 83 5 18 32 18 8 2 Сплавы висмута с другими легкоплавкими веществами (оловом, свинцом, ртутью, цинком) обладают очень низкой температурой плавления (некоторые — ниже температуры кипения воды, а наиболее легкоплавкий состав с висмутом имеет температуру плавления около +41 °C)