Первый слайд презентации: Элементы 15 группы ( пниктогены )
Слайд 2: Элементы 15 группы
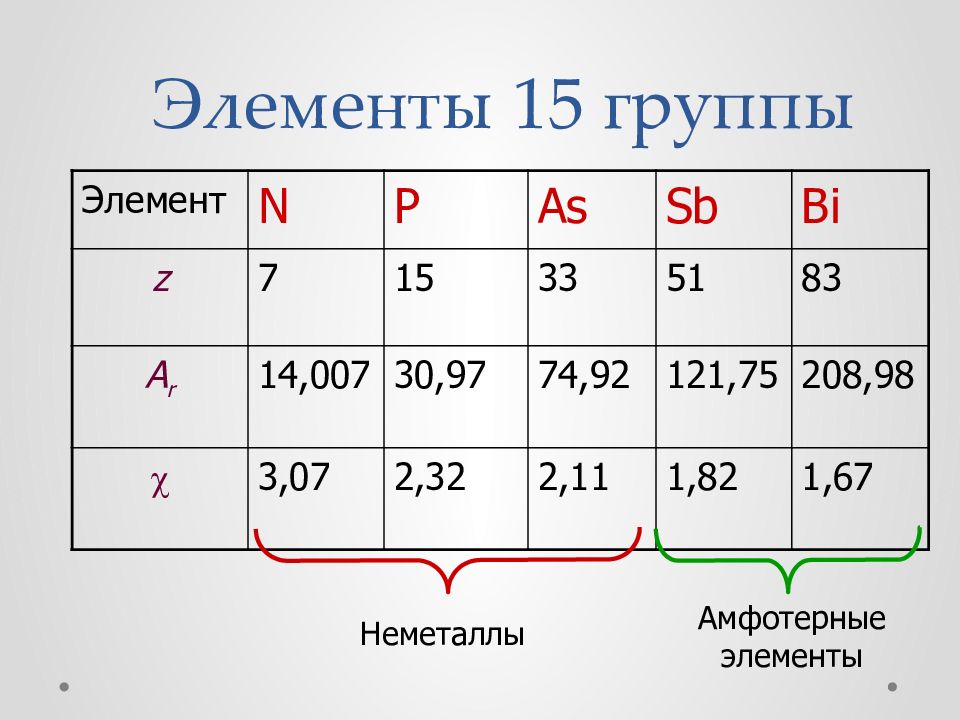
Элемент N P As Sb Bi z 7 15 33 51 83 A r 14,007 30,97 74,92 121,75 208,98 3,07 2,32 2,11 1,82 1,67 Неметаллы Амфотерные элементы
Слайд 3
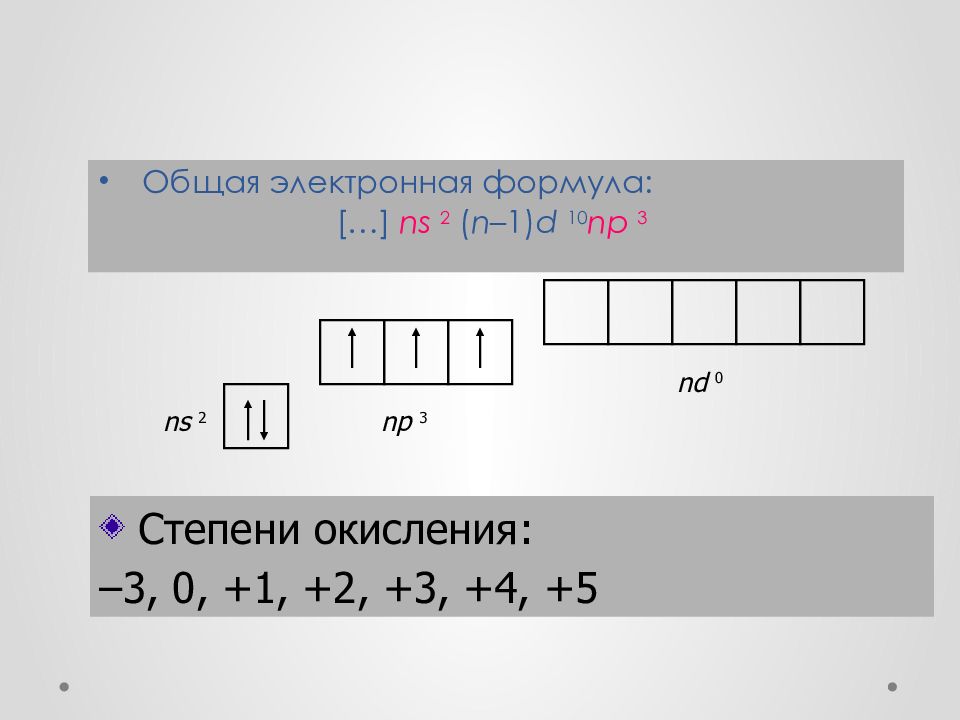
Общая электронная формула: […] ns 2 ( n– 1) d 10 np 3 Степени окисления: –3, 0, +1, +2, +3, +4, +5 ns 2 np 3 nd 0
Слайд 4: История открытия элементов
Азот: 1772 г., Д. Резерфорд, Г.Кавендиш, 1769-1771 гг., К.Шееле, А.Л. Лавуазье Фосфор: 1669 г., Хённиг Бранд Мышьяк: XIII в., Альберт Великий, XVI в., Парацельс, 1735 г., Г. Брандт Сурьма: 3000 лет до н.э.; XVI в., Парацельс, Василий Валентин, 1735 г., Г. Брандт Висмут: XV-XVI вв., Агрикола, Василий Валентин, 1739 г., И.Потт Фосфор. Джозеф Райт («Райт из Дерби») (1734-1797)
Слайд 5: Распространение в природе
12. P – 0, 09 масс.% 16. N – 0,03 масс.% 47. As – 5 ·10 –4 масс.% 62. Sb – 5 ·10 –5 масс.% 66. Bi – 1 ·10 –5 масс.% Азот атмосферы N 2 (самородный)
Слайд 6: Азот, фосфор
Нитратин (чилийская селитра) NaNO 3 Нитрокалит (индийская селитра) KNO 3 Нашатырь NH 4 Cl Нашатырь Нитратин Апатит 3Ca 3 (PO 4 ) 2 ·Ca(Cl,OH,F) 2 Фосфорит Ca 3 ( PO 4 ) 2 Фторапатит 3 Ca 3 ( PO 4 ) 2 · CaF 2 Апатит Фосфорит Фторапатит
Слайд 7: Мышьяк, сурьма, висмут
Реальгар As 4 S 4 Аурипигмент As 2 S 3 Арсенопирит FeAsS Тетраэдрит Cu l2 As 4 S 13 Антимонит (сурьмяный блеск) Sb 2 S 3 Висмутин (висмутовый блеск) Bi 2 S 3 Арсенопирит Аурипигмент Реальгар Редкие минералы Анимикит ( Ag, Sb ) Арсенопалладинит Pd 3 As Геверсит PtSb 2 Стибиопалладинит Pd 3 Sb Антимонит (стибин)
Слайд 8: АЗОТ
В 1772 году азот, (под названием «испорченного воздуха») как простое вещество, описал Даниэль Резерфорд. Азо́т (от греч. ázōos — безжизненный, лат. n itrogenium )предложил в 1787 году Антуан Лавуазье.
Слайд 9: Свойства азота
N 2 – бесцветный газ, без запаха и вкуса, т.пл. –210,0 С, т.кип. –195,8 С малорастворим в воде и орг. р- рителях э нерги я связи в молекуле N 2 равна 945 кДж/моль, длин а связи 110 пм. N 2 + F 2 N 2 + 6Li = 2 Li 3 N нитрид лития (катализатор – вода) Баллоны с азотом N N
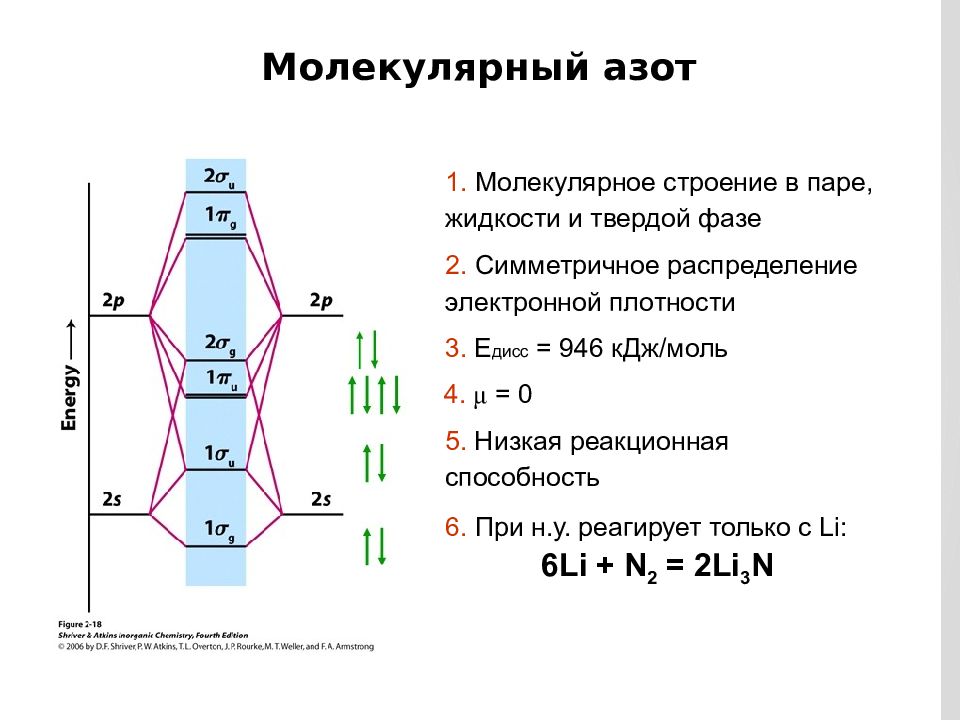
Слайд 10
Молекулярный азот 1. Молекулярное строение в паре, жидкости и твердой фазе 2. Симметричное распределение электронной плотности 3. Е дисс = 946 кДж/моль 4. μ = 0 5. Низкая реакционная способность 6. При н.у. реагирует только с Li: 6Li + N 2 = 2Li 3 N
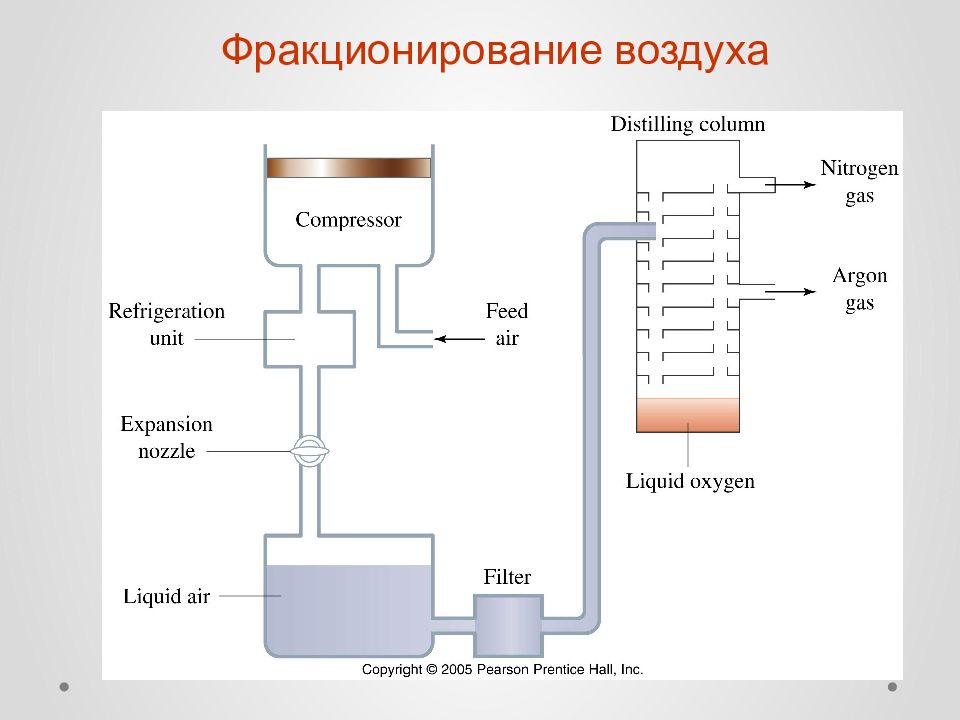
Слайд 11
Получение и применение азота 1. Азот составляет 78% воздуха (по объему) или 76% (по массе) 2. Промышленное получение азота: фракционирование воздуха или разделение воздуха на мембранах 3. Получение азота в лаборатории: 2NaN 3 = 2Na + 3N 2 (t o ) NH 4 NO 2 = N 2 + 2H 2 O (t o ) 4. Основное применение: - создание инертной атмосферы - синтез аммиака - охлаждение
Слайд 13: Азот. Шкала степеней окисления
+ V + III + II + I 0 – I – II – III + IV N 2 O 5, NO 3 , HNO 3, NaNO 3, AgNO 3 NO 2, N 2 O 4 N 2 O 3, NO 2 , HNO 2, NaNO 2, NF 3 NO, N 2 O 2 H 2 N 2 O 2 N 2 NH 2 OH, NH 3 OH + N 2 H 4, N 2 H 5 +, N 2 H 6 2+ NH 3, NH 4 +, NH 3 ·H 2 O, NH 4 Cl, Li 3 N, Cl 3 N
Слайд 14
Реакции молекулярного азота 1. С металлами при нагревании 3Mg +N 2 = Mg 3 N 2 2Ti + N 2 = 2TiN 2Al + N 2 = 2AlN 2. С Н 2 на катализаторе N 2 + 3H 2 = 2NH 3 450 o C 800 o C 900 o C (процесс Боша-Габера) 3. С О 2 в электрическом разряде N 2 + O 2 = 2NO 4. С комплексами переходных металлов [Ru(NH 3 ) 5 ]Cl 3 + N 2 + Zn/Hg = [Ru(NH 3 ) 5 (N 2 )]Cl 2 + ZnCl 2 + Hg + H 2 O
Слайд 15: Получение аммиака
В промышленности N 2 + 3 H 2 2NH 3 + Q ( 300-500 С, 300 атм, катализатор: Fe, Pt ) В лаборатории ( при нагревании ) NH 4 Cl + NaOH = = NaCl + H 2 O + NH 3 NH 3 · H 2 O = H 2 O + NH 3 Получение аммиака в лаборатории
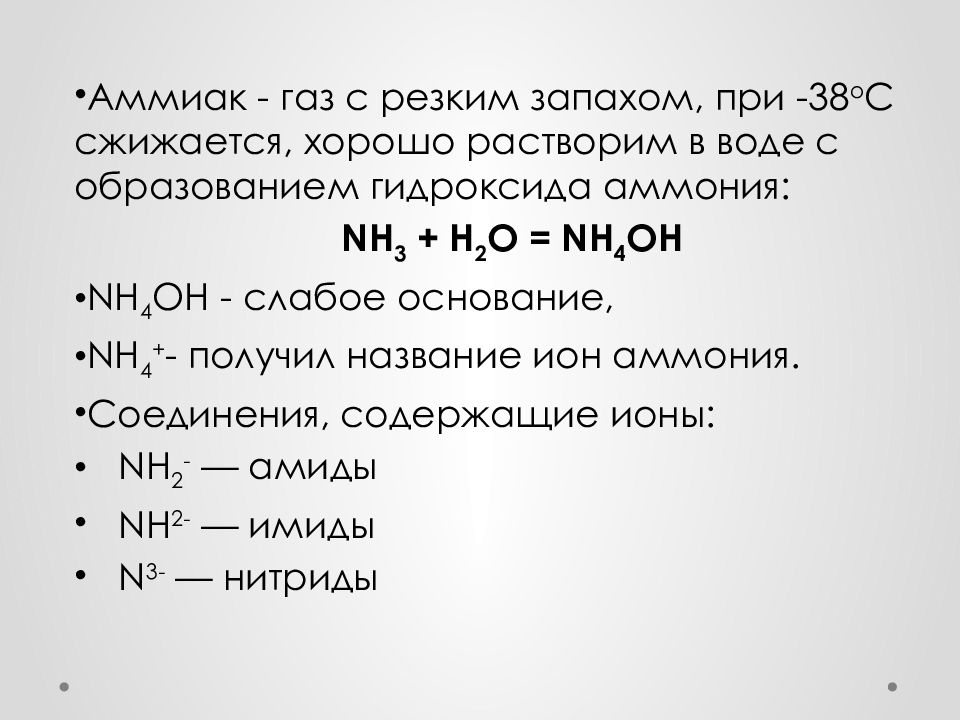
Слайд 17
Аммиак - газ с резким запахом, при -38 о С сжижается, хорошо растворим в воде с образованием гидроксида аммония: NH 3 + H 2 O = NH 4 OH NH 4 OH - слабое основание, NH 4 + - получил название ион аммония. Соединения, содержащие ионы: NH 2 - — амиды NH 2- — имиды N 3- — нитриды
Слайд 18
Для аммиака характерны реакции присоединения, окислительно -восстановительные и замещения. Реакции присоединения: NH 3 + HCl = NH 4 Cl NH 3 + CuSO 4 = [ Cu ( NH 3 ) 4 ] SO 4 эти реакции основаны на том, что в аммиаке азот имеет неподеленную пару электронов и может выступать в качестве донора, образуя донорно-акцепторную связь в комплексных соединениях.
Слайд 20
Окислительно -восстановительные реакции В аммиаке у азота низшая степень окисления -3 и он может выступать лишь в качестве восстановителя: 3 CuO + 2 NH 3 = 3 Cu + N 2 + 3 H 2 O 2 NH 3 + 2 KMnO 4 = 2 MnO 2 + N 2 + 2 KOH + 2 H 2 O Во всех реакциях без катализатора аммиак окисляется до свободного азота, в присутствии катализатора до NO.
Слайд 21
Реакции замещения. Они идут за счет замещения водорода аммиака металлом или неметаллом: 2NH 3 + 2Na = 2NH 2 Na + H 2 NH 3 + 2Na = NHNa 2 + H 2 2 NH 3 + 6 Na = 2 NNa 3 + 3 H 2
Слайд 22
Важным продуктом частичного окисления аммиака является гидразин (N 2 H 4 ): 2 NH 3 + NaOCl = N 2 H 4 + NaCl + H 2 O Это бесцветная жидкость, дымящая на воздухе и смешивающаяся с водой в любых соотношениях.
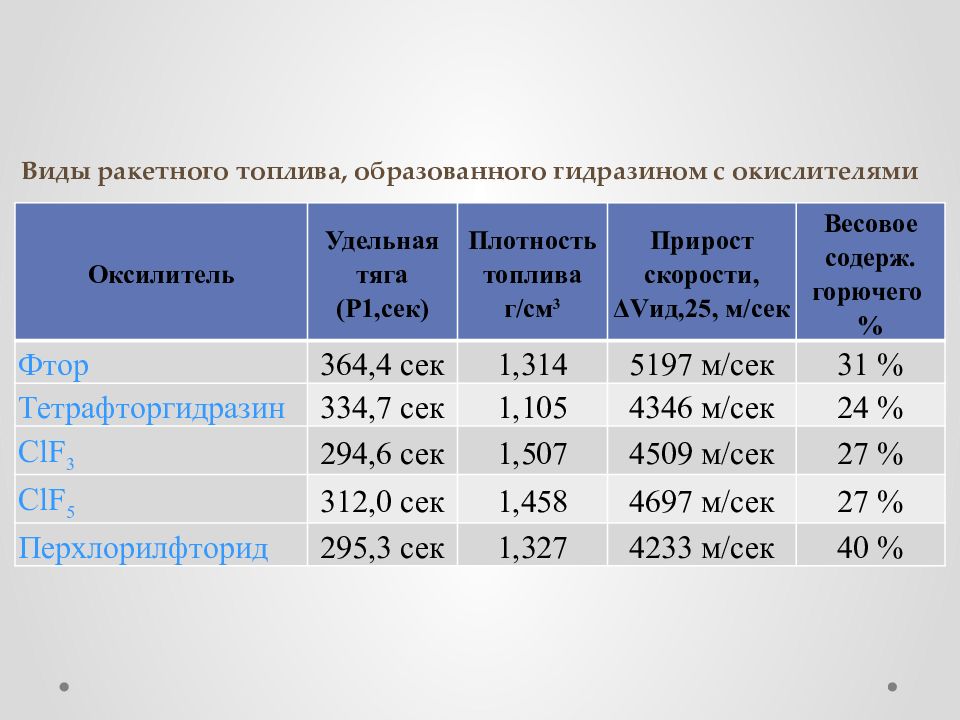
Слайд 24: Виды ракетного топлива, образованного гидразином с окислителями
Оксилитель Удельная тяга (Р1,сек) Плотность топлива г/см 3 Прирост скорости, ΔVид,25, м/сек Весовое содерж. горючего % Фтор 364,4 сек 1,314 5197 м/сек 31 % Тетрафторгидразин 334,7 сек 1,105 4346 м/сек 24 % ClF 3 294,6 сек 1,507 4509 м/сек 27 % ClF 5 312,0 сек 1,458 4697 м/сек 27 % Перхлорилфторид 295,3 сек 1,327 4233 м/сек 40 %
Слайд 26: Свойства оксидов азота
N 2 O NO N 2 O 3 NO 2 N 2 O 5 G обр., кДж/моль +104 (г) +87 (г) +139 (г) +51 (г) +115 (г) т. пл., С –90,9 –163,6 –101 –11,2 ( N 2 O 4 ) +41 ( при повышенном давлении ) т. кип., С –88,6 –151,7 разл. +21 ( N 2 O 4 ) разл.
Слайд 27: Оксид диазота N 2 O
N 2 O – бесцв. газ со слабым приятным запахом и слабонаркотическим действием, т.пл. –91 °С, т.кип. –89 °С. N 2 O – несолеобр. оксид, сильный окислитель. Разложение: 2N 2 O = 2N 2 + O 2 N N O 0 +II – II , , N N O – I +III – II , ,
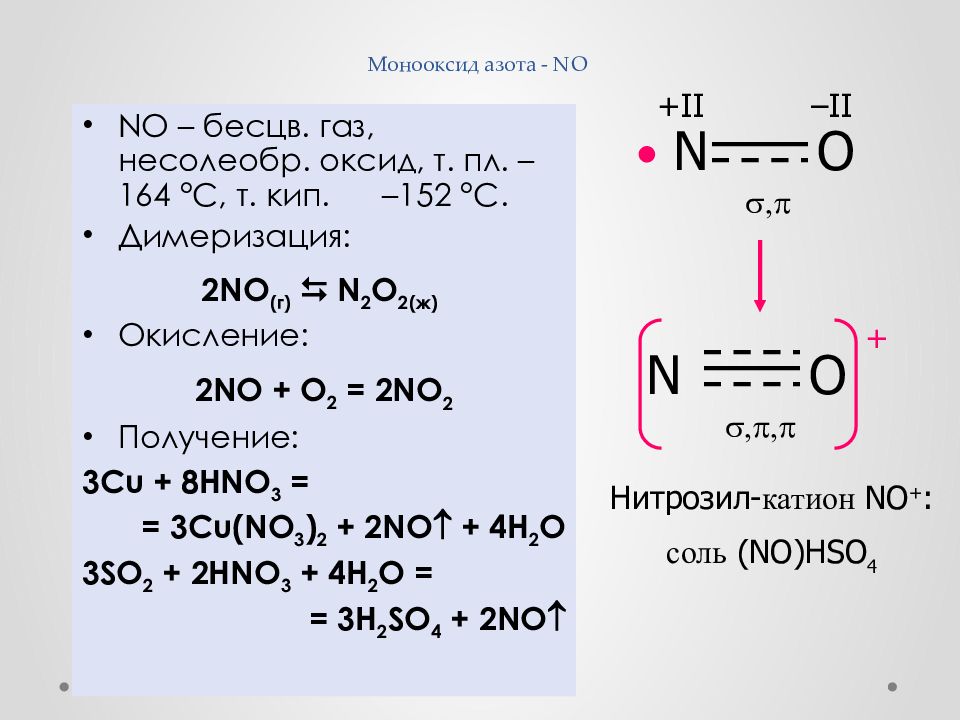
Слайд 28: Монооксид азота - NO
NO – бесцв. газ, несолеобр. оксид, т. пл. – 164 ° С, т. кип. – 152 ° С. Димеризация : 2 NO (г) N 2 O 2(ж) Окисление: 2 NO + O 2 = 2NO 2 Получение: 3 Cu + 8HNO 3 = = 3Cu(NO 3 ) 2 + 2NO + 4H 2 O 3 SO 2 + 2HNO 3 + 4H 2 O = = 3H 2 SO 4 + 2NO • N O +II – II , N O , , + Нитрозил - катион NO + : соль (NO)HSO 4
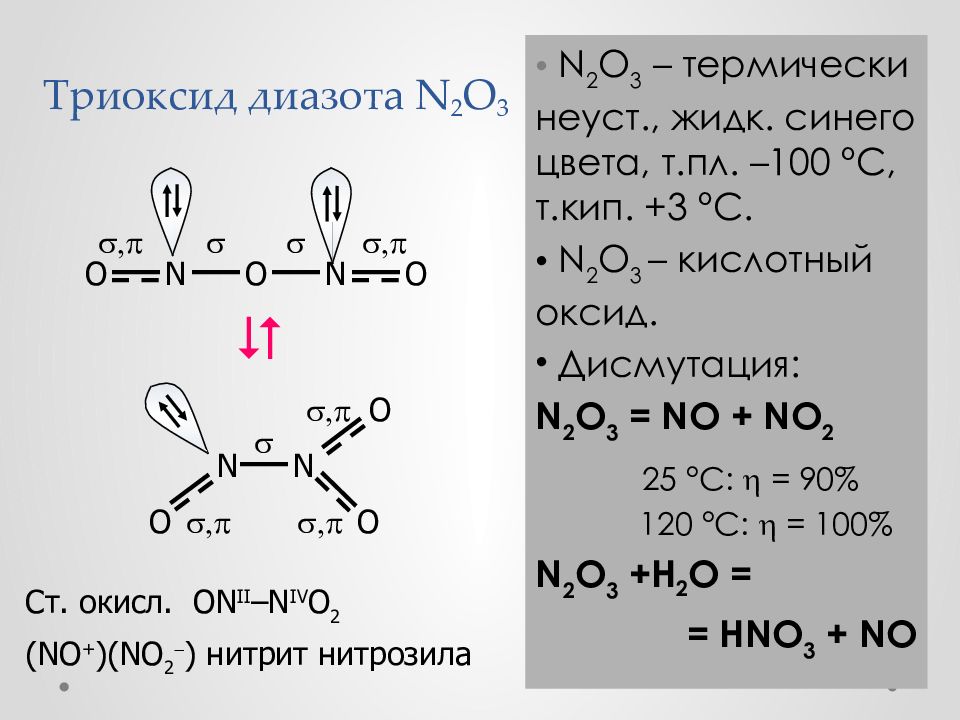
Слайд 29: Триоксид диазота N 2 O 3
N 2 O 3 – термич ески неуст., жидк. синего цвета, т.пл. – 100 ° С, т.кип. +3 ° С. N 2 O 3 – кислотный оксид. Дисмутация : N 2 O 3 = NO + NO 2 25 °С: = 90% 120 °С: = 100% N 2 O 3 + H 2 O = = HNO 3 + NO O O N O N , , O O N N O , , , Ст. окисл. ON II –N IV O 2 (NO + )(NO 2 ) нитрит нитрозила
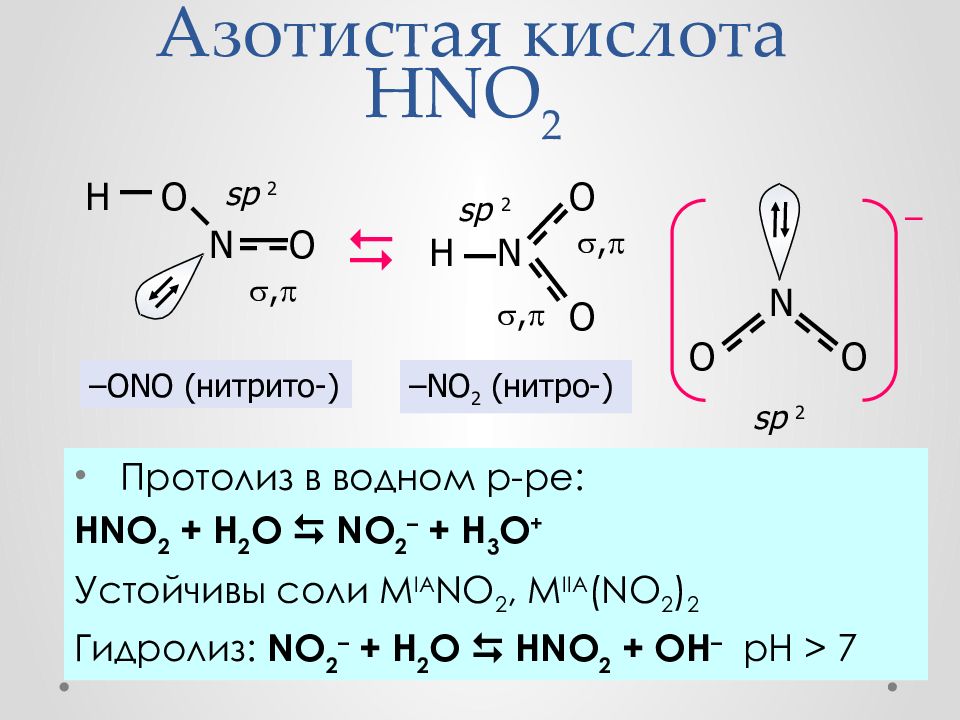
Слайд 30: Азотистая кислота HNO 2
Протолиз в водном р-ре : HNO 2 + H 2 O NO 2 – + H 3 O + Устойчивы соли M IA NO 2, M IIA (NO 2 ) 2 Гидролиз: NO 2 – + H 2 O HNO 2 + OH – рН > 7 N O H O sp 2 , N O H O sp 2 , , – ONO (нитрито-) – NO 2 (нитро-) sp 2 N O O –
Слайд 31: Окислительно-восстановительные свойства
Окислительные свойства рН > 7 : NO 2 – + H 2 O + 2 e = NO + 2 OH рН < 7 : HNO 2 + H + + 2 e = NO + H 2 O Восстановительные свойства рН > 7 : NO 2 – + 2 OH – 2 e = NO 3 – + H 2 O рН < 7 : HNO 2 + H 2 O – 2 e = NO 3 – +3 H +
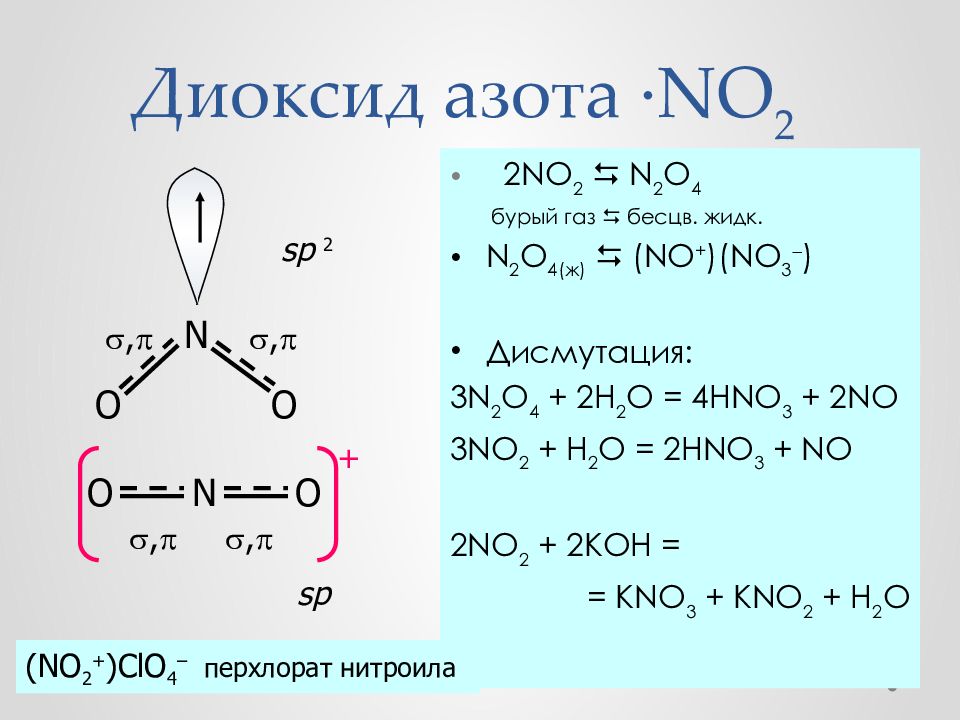
Слайд 32: Диоксид азота · NO 2
2 NO 2 N 2 O 4 бурый газ бесцв. жидк. N 2 O 4 (ж) (NO + )(NO 3 ) Дисмутация : 3N 2 O 4 + 2H 2 O = 4HNO 3 + 2NO 3NO 2 + H 2 O = 2HNO 3 + NO 2NO 2 + 2KOH = = KNO 3 + KNO 2 + H 2 O O O N + , , N O O , , sp 2 sp (NO 2 + )ClO 4 – перхлорат нитроила
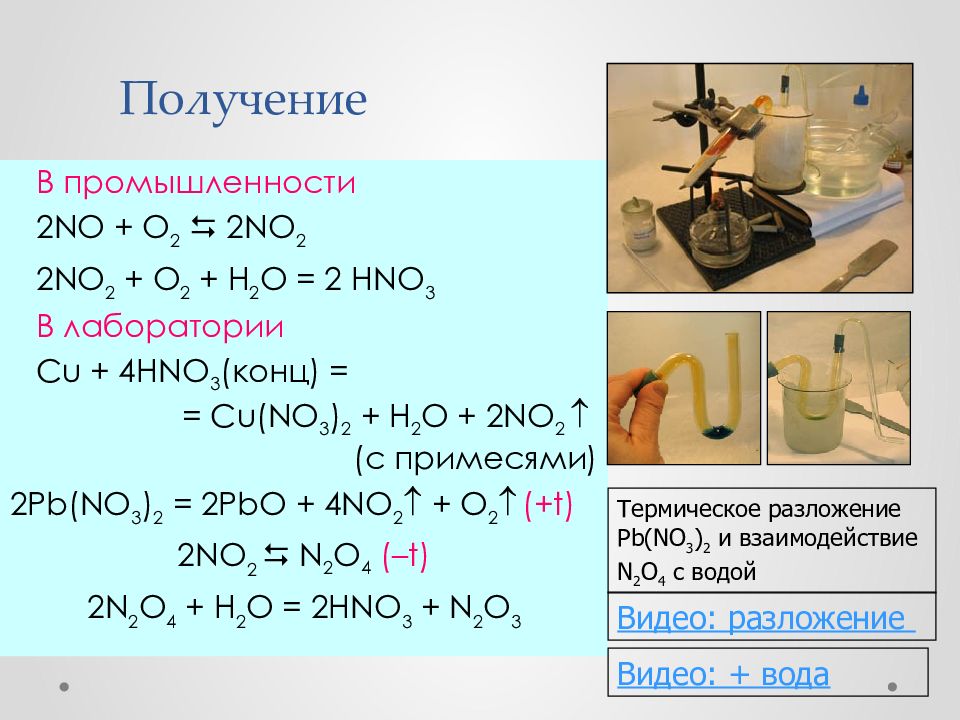
Слайд 33: Получение
В промышленности 2NO + O 2 2NO 2 2NO 2 + O 2 + H 2 O = 2 HNO 3 В лаборатории Cu + 4HNO 3 ( конц ) = = Cu(NO 3 ) 2 + H 2 O + 2 NO 2 (c примесями) 2Pb(NO 3 ) 2 = 2PbO + 4NO 2 + O 2 ( +t ) 2 NO 2 N 2 O 4 ( – t ) 2N 2 O 4 + H 2 O = 2HNO 3 + N 2 O 3 Термическое разложение Pb(NO 3 ) 2 и взаимодействие N 2 O 4 с водой Видео: разложение Видео: + вода
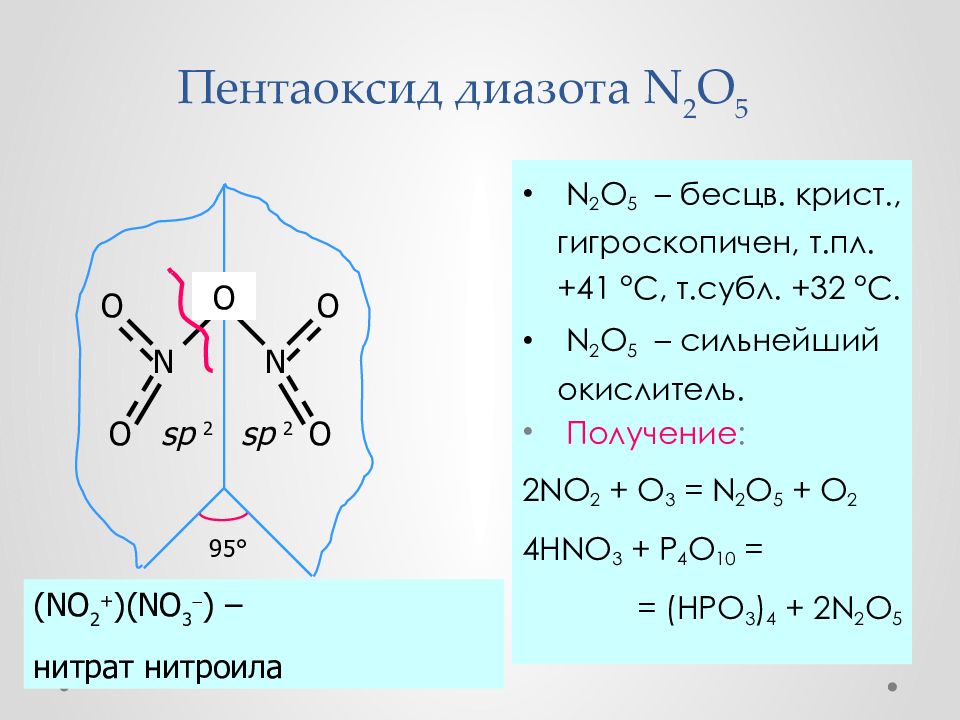
Слайд 34: Пентаоксид диазота N 2 O 5
N 2 O 5 – бесцв. крист., гигроскопич ен, т.пл. +41 ° С, т.субл. +32 ° С. N 2 O 5 – сильн ейший окисл итель. Получение : 2NO 2 + O 3 = N 2 O 5 + O 2 4HNO 3 + P 4 O 10 = = (HPO 3 ) 4 + 2N 2 O 5 N O O N O O 95 ° sp 2 sp 2 O (NO 2 + )(NO 3 ) – нитрат нитроила
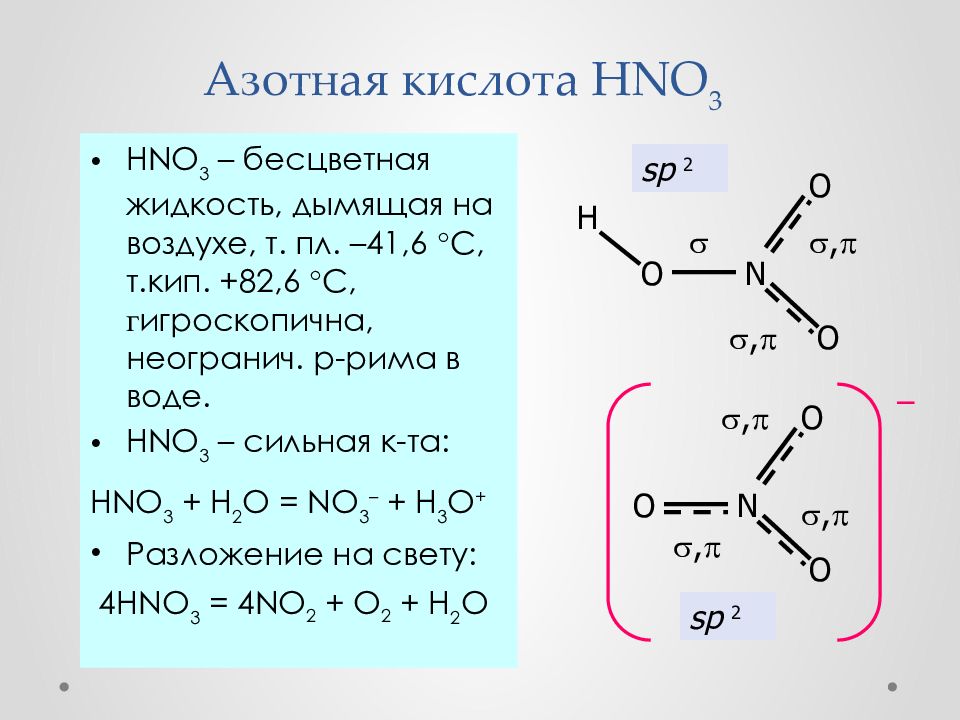
Слайд 35: Азотная кислота HNO 3
HNO 3 – бесцветная жидкость, дымящая на воздухе, т. пл. –41,6 С, т.кип. +82,6 С, г игроскопична, неогранич. р - рима в воде. HNO 3 – сильн ая к-та: HNO 3 + H 2 O = NO 3 – + H 3 O + Разложение на свету : 4 HNO 3 = 4 NO 2 + O 2 + H 2 O sp 2 N O O O – sp 2 , , , N O O O H , ,
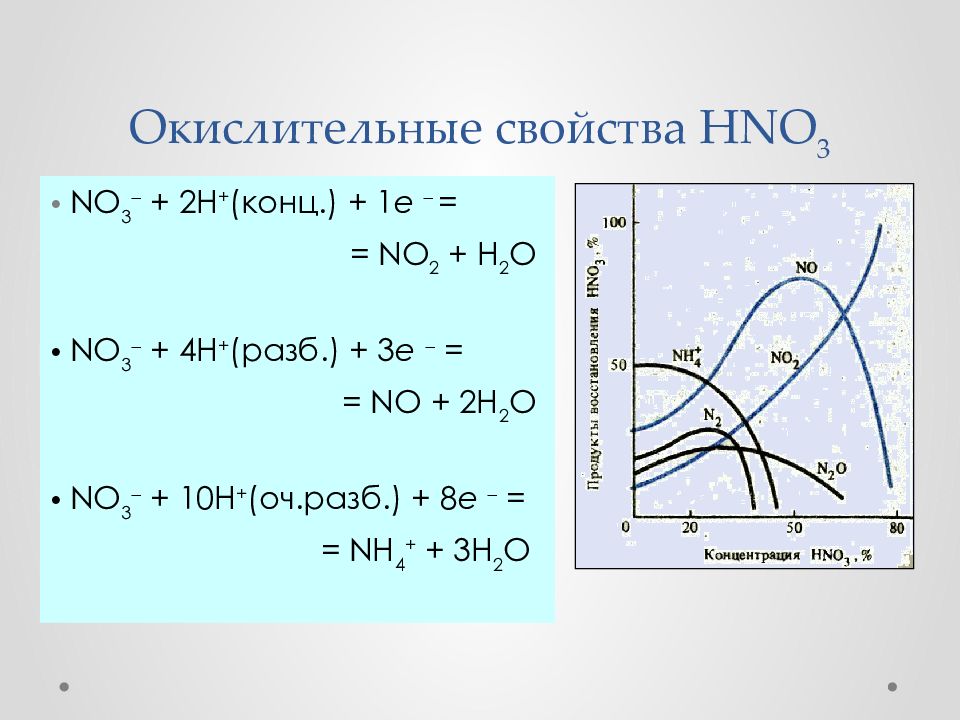
Слайд 36: Окислительные свойства HNO 3
NO 3 + 2H + ( конц.) + 1 e = = NO 2 + H 2 O NO 3 + 4H + ( разб.) + 3 e = = NO + 2H 2 O NO 3 + 10H + ( оч. разб.) + 8 e = = NH 4 + + 3 H 2 O
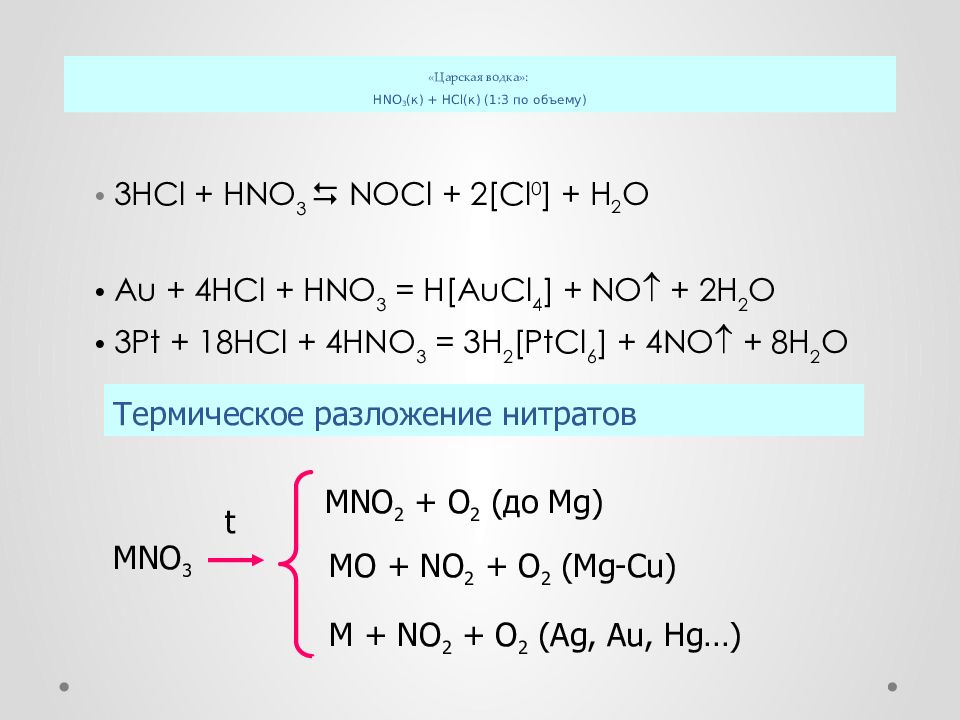
Слайд 37: Царская водка» : HNO 3 (к) + HCl (к) ( 1:3 по объему)
3 HCl + HNO 3 NOCl + 2[Cl 0 ] + H 2 O Au + 4HCl + HNO 3 = H[AuCl 4 ] + NO + 2H 2 O 3Pt + 18HCl + 4HNO 3 = 3H 2 [PtCl 6 ] + 4NO + 8H 2 O Термическое разложение нитратов MNO 3 t MNO 2 + O 2 ( до Mg) MO + NO 2 + O 2 (Mg-Cu) M + NO 2 + O 2 (Ag, Au, Hg…)
Слайд 38: Азотная кислота
В промышленности азотную кислоту получают окислением аммиака в присутствии катализатора: 4NH 3 + 5O 2 = 4NO + 6H 2 O 2NO + O 2 = 2NO 2 4 NO 2 + O 2 + 2 H 2 O = 4 HNO 3
Слайд 40: Шкала степеней окисления фосфора
+ V + III + I 0 – III P 4 O 10, (HPO 3 ) x, H 3 PO 4, PO 4 3 , H 4 P 2 O 7 P 4 O 6, H 2 (PHO 3 ), PHO 3 2–, PF 3 H(PH 2 O 2 ), PH 2 O 2 – P (P 4, P x ), P 2 PH 3, PH 4 +, Na 3 P, Mg 3 P 2, AlP
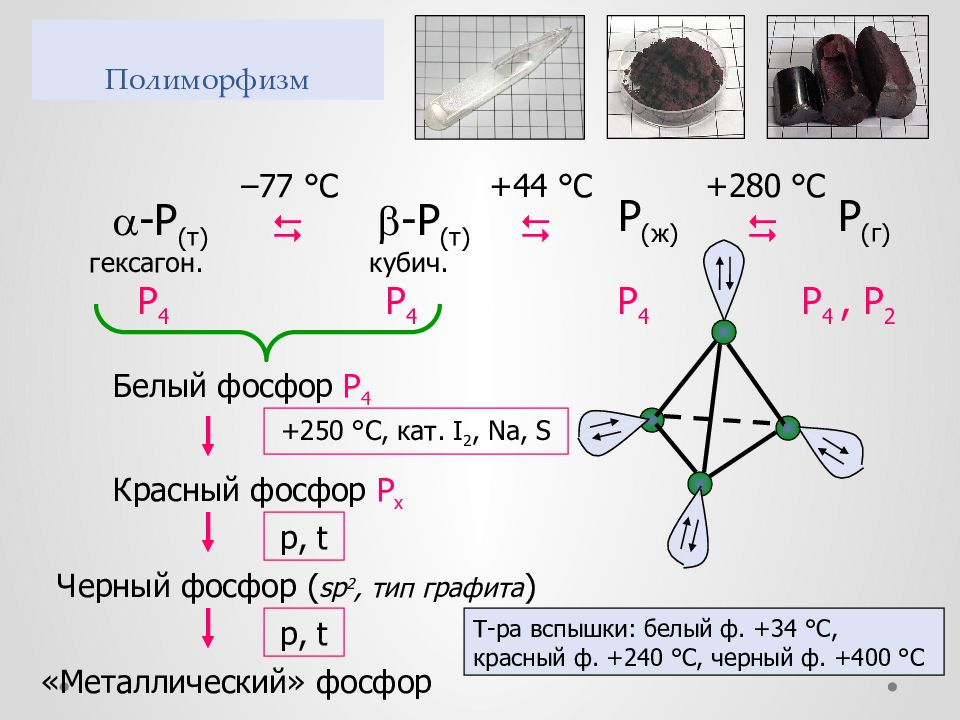
Слайд 41: Полиморфизм
– 77 ° С +44 ° С P ( ж ) +280 °С P ( г ) - P ( т ) гексагон. - P ( т ) кубич. P 4 P 4 P 4 P 4, P 2 Белый фосфор P 4 +250 ° С, кат. I 2, Na, S Красный фосфор P х p, t Черный фосфор ( sp 2, тип графита ) «Металлический» фосфор p, t Т-ра вспышки: белый ф. + 34 ° С, красный ф. +2 4 0 ° С, черный ф. +400 ° С
Слайд 42: Дисмутация фосфора в щелочной среде
на холоду: 4P + 3NaOH ( разб ) + 3H 2 O = 3Na(P +I H 2 O 2 ) + P –III H 3 P + 3H 2 O + 3 e = PH 3 + 3OH – P + 2OH – – 1 e = (PH 2 O 2 ) – ( гипофосфит -ион ) при нагревании: 2P + 2NaOH ( конц ) + H 2 O = Na 2 (P +III HO 3 ) + P –III H 3 P + 3H 2 O + 3 e = PH 3 + 3OH – P + 5 OH – – 3 e = (PHO 3 ) 3 – + 3H 2 O ( фосфит-ион ) Получение прокаливание фосфорита с углем и песком 2Ca 3 (PO 4 ) 2 + 10C + 6SiO 2 = 2 P 2 + 10CO + 6CaSiO 3
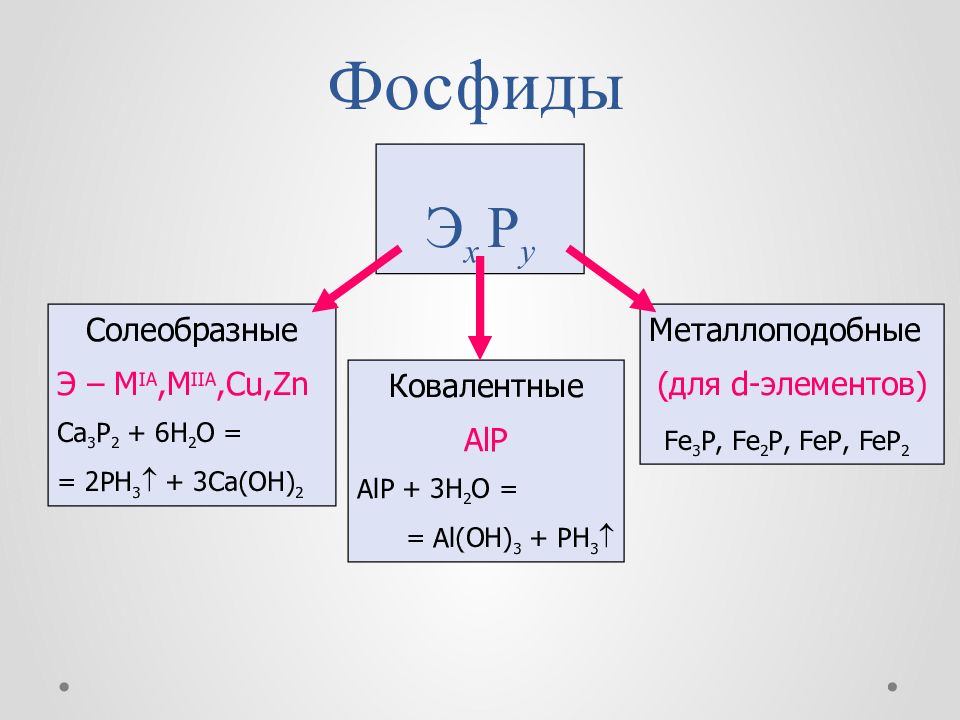
Слайд 43: Фосфиды
Э х Р y Солеобразные Э – M IA,M IIA,Cu,Zn Ca 3 P 2 + 6H 2 O = = 2PH 3 + 3Ca(OH) 2 Ковалентные AlP AlP + 3H 2 O = = Al(OH) 3 + PH 3 Металлоподобные (для d -элементов) Fe 3 P, Fe 2 P, FeP, FeP 2
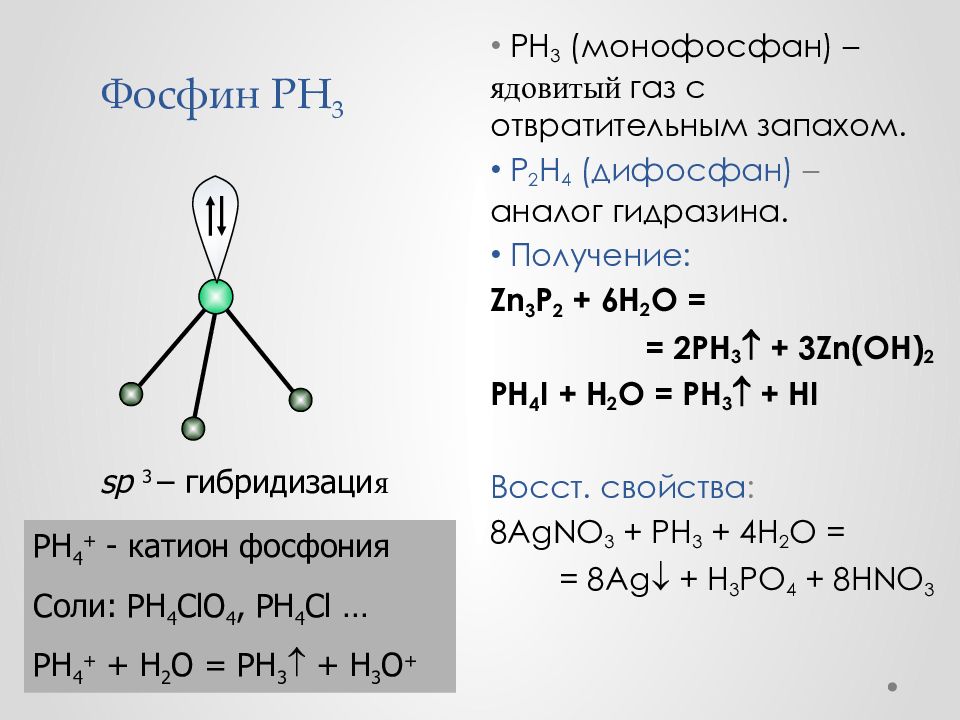
Слайд 44: Фосфин PH 3
PH 3 ( монофосфан ) – ядовит ый газ с отвратительным запахом. P 2 H 4 ( дифосфан ) – аналог гидразина. Получение: Zn 3 P 2 + 6 H 2 O = = 2PH 3 + 3 Zn(OH) 2 PH 4 I + H 2 O = PH 3 + HI Восст. свойства : 8AgNO 3 + PH 3 + 4H 2 O = = 8Ag + H 3 PO 4 + 8HNO 3 sp 3 – гибридизаци я PH 4 + - катион фосфония Соли: PH 4 ClO 4, PH 4 Cl … PH 4 + + H 2 O = PH 3 + H 3 O +
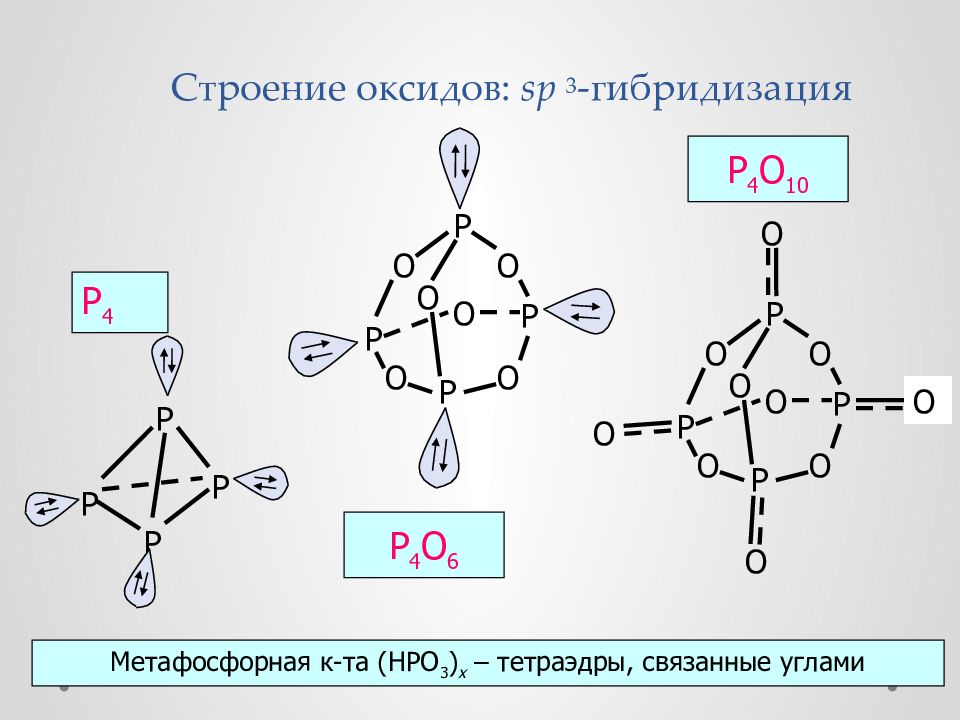
Слайд 45: Строение оксидов : sp 3 -гибридизация
P P P P O O O O O O O O O O P P P P O O O O O O P P P P P 4 P 4 O 6 P 4 O 10 Метафосфорная к-та (HPO 3 ) x – тетраэдры, связанные углами
Слайд 46
1. С кислородом. При горении фосфора образуется белый густой дым. Белый фосфор самовоспламеняется на воздухе, а красный горит при поджигании. Фосфор сгорает в кислород е ослепительно ярким пламенем. 4P + 3O 2( недостат ) → 2P 2 O 3 (P 4 O 6 ) 4P + 5O 2 (избыток) → 2P 2 O 5 (P 4 O 10 )
Слайд 47
2. С галогенами. С элементами, обладающими большей, чем у фосфора, электроотрицательностью, фосфор реагирует очень энергично. Если в сосуд с хлором внести красный фосфор, то через несколько секунд он самовоспламеняется в хлоре. При этом обычно получается хлорид фосфора ( III ). 4P + 6 Cl 2( недостат ) → 4PCl 3 4P + 10Cl 2 (избыток) → 4PCl 5
Слайд 48
3. С серой при нагревании. 4P + 6S → 2P 2 S 3 4P + 10 S → 2P 2 S 5 4. Фосфор окисляет при нагревании почти все металлы, образуя фосфиды: 2 P + 3 Ca → Ca 3 P 2 Фосфиды металлов легко гидролизуются водой. Ca 3 P 2 + 6 H 2 O → 2PH 3 ↑+ 3Ca(OH) 2
Слайд 49
5. Красный фосфор окисляется водой при температуре около 800 º С в присутствии катализатора – порошка меди: 2P + 8H 2 O → 2H 3 PO 4 + 5H 2 ↑ 6. Концентрированная серная кислота окисляет при нагревании фосфор: t 2P + 5H 2 SO 4 (к) → 5 SO 2 ↑ + 2H 3 PO 4 + 2H 2 O 7. Азотная кислота при нагревании окисляет фосфор t P + 5HNO 3 (к) → 5 NO 2 ↑ + H 3 PO 4 + H 2 O 3 P + 5HNO 3 ( разб ) + 2 H 2 O → 5 NO↑ + 3 H 3 PO 4
Слайд 50: Оксид фосфора ( V )
Оксид фосфора(V) P 2 O 5 (или P 4 O 10 ) образуется при горении фосфора на воздухе. 4Р + 5О 2 2Р 2 О 5 Твердое кристаллическое вещество Р 2 О 5 гигроскопично и используется как водоотнимающее средство. 1. При взаимодействии с водой оксид фосфора(V) образует на холоду метафосфорную кислоту НРО 3, имеющую полимерное строение: P 2 O 5 + H 2 O 2HPO 3
Слайд 51
или при нагревании ортофосфорную кислоту Н 3 РО 4. P 2 O 5 + 3H 2 O 2H 3 PO 4 2. Как кислотный оксид, вступает в реакции с основными оксидами: P 2 O 5 + 3CaO → Ca 3 (PO 4 ) 2 3. С щелочами: P 2 O 5 + 3Ca(OH) 2 → Ca 3 (PO 4 ) 2 + 3H 2 O
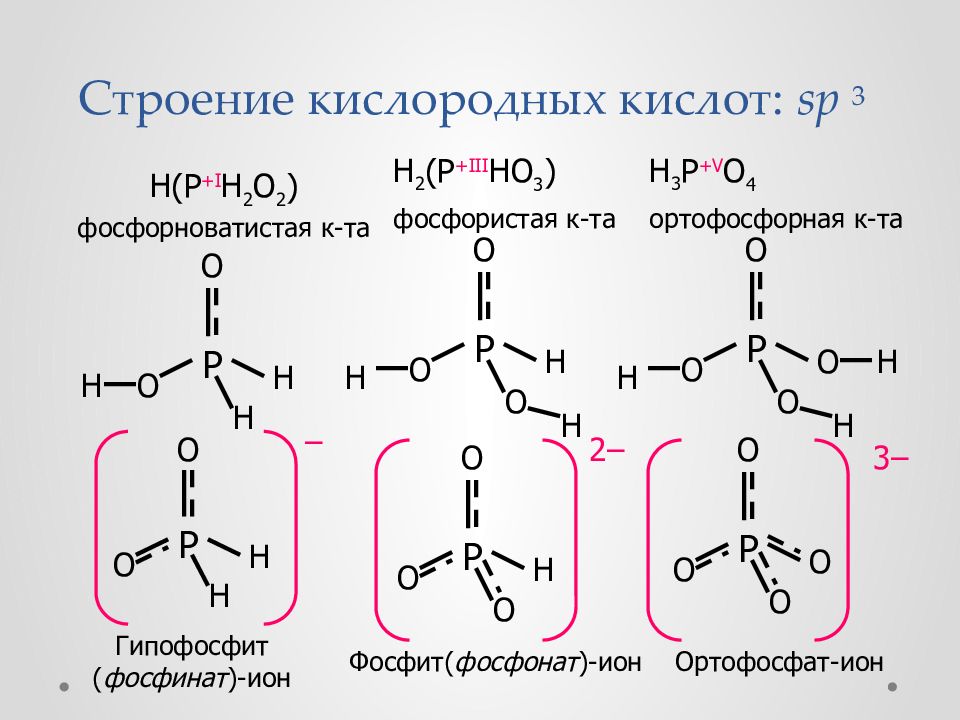
Слайд 52: Кислородные кислоты
Фосфорноватистая ( фосфоновая ) к-та, одноосновная H(PH 2 O 2 ) + H 2 O (PH 2 O 2 ) + H 3 O + Фосфористая ( фосфиновая ) к-та, двухосновная H 2 (PHO 3 ) + H 2 O H(PHO 3 ) + H 3 O + H(PHO 3 ) – + H 2 O (PHO 3 ) 2 + H 3 O + Ортофосфорн ая к-та, трехосновная H 3 PO 4 + H 2 O H 2 PO 4 + H 3 O + H 2 PO 4 + H 2 O HPO 4 2 + H 3 O + HPO 4 2 + H 2 O PO 4 3 + H 3 O + Дифосфорная к-та - H 4 P 2 O 7 Полиметафосфорная к-та - HPO 3 ) x
Слайд 53: Строение кислородных кислот : sp 3
H (P +I H 2 O 2 ) фосфорноватистая к-та H 2 (P +III HO 3 ) фосфористая к-та H 3 P +V O 4 ортофосфорная к-та O H P O H H O O P O H H H O O P O O H H H O H P O H – O O P O H 2 – O O P O O 3 – Гипофосфит ( фосфинат )-ион Ортофосфат-ион Фосфит( фосфонат )-ион
Слайд 54: Ортофосфорная кислота
В промышленности фосфорную кислоту получают действием серной кислоты на фосфорит: Ca 3 (PO 4 ) 2 + 3H 2 SO 4 3CaSO 4 + 2H 3 PO 4
Слайд 55: Химические свойства фосфорной кислоты
1.С металлами, стоящими в ряду напряжения металлов до водорода: 3Mg + 2H 3 PO 4 Mg 3 (PO 4 ) 2 + 3 H 2 ↑ 2.С основными оксидами: 3CaO + 2H 3 PO 4 С a 3 (PO 4 ) 2 + 3H 2 O 3.С основаниями и аммиаком: H 3 PO 4 + NaOH → Na H 2 PO 4 + H 2 O H 3 PO 4 + 2NaOH → Na 2 H PO 4 + 2 H 2 O H 3 PO 4 + 3NaOH → Na 3 PO 4 + 3 H 2 O H 3 PO 4 + NH 3 → (NH 4 ) 2 HP O 4
Слайд 56
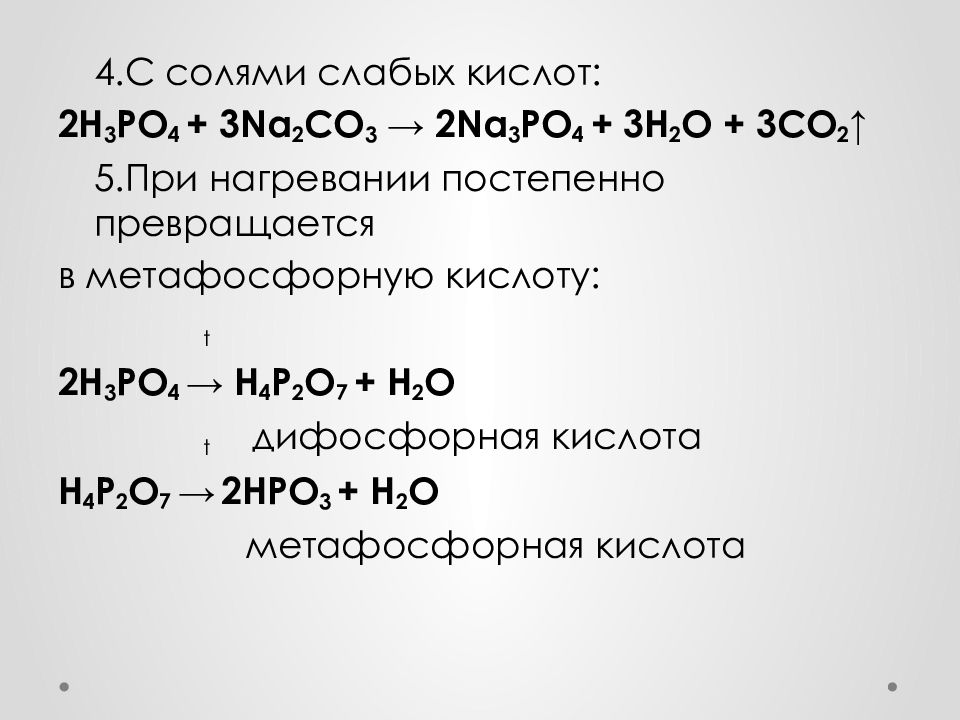
4.С солями слабых кислот: 2 H 3 PO 4 + 3Na 2 CO 3 → 2Na 3 PO 4 + 3 H 2 O + 3CO 2 ↑ 5.При нагревании постепенно превращается в метафосфорную кислоту: t 2H 3 PO 4 → H 4 P 2 O 7 + H 2 O t дифосфорная кислота H 4 P 2 O 7 → 2HPO 3 + H 2 O метафосфорная кислота
Слайд 57
6.При действии раствора нитрата серебра появляется желтый осадок: H 3 PO 4 + 3AgNO 3 → Ag 3 PO 4 ↓ + 3 H N O 3 желтый осадок Это качественная реакция на фосфорную кислоты и её соли – фосфаты.
Слайд 58: Соли фосфорной кислоты
Различают средние соли - фосфаты (Na 3 PO 4 ) и кислые соли - гидрофосфаты (Na 2 HPO 4 ) и дигидрофосфаты (NaH 2 PO 4 ). Растворимы в воде фосфаты и гидрофосфаты щелочных металлов и аммония. Все дигидрофосфаты растворимы в воде. Фосфорная кислота вытесняется более сильными кислотами из её солей: С a 3 (PO 4 ) 2 + 3H 2 SO 4 3CaSO 4 + 2H 3 PO 4 конц.
Слайд 60
Cодержание элементов в земной коре сравнительно невелико 1. 10 -4 % - As, 5. 10 -6 % - Sb, 2. 10 -6 % - Bi. Получают эти элементы прокаливанием на воздухе сульфидных руд, сернистые соединения переходят в оксиды, которые восстанавливают углем: 2Sb 2 S 3 + 9O 2 = 2Sb 2 O 3 + 6SO 2 Sb 2 O 3 + 3C = 2Sb + 3CO В свободном состоянии элементы имеют металлический блеск, довольно хорошо проводят электрический ток и тепло, очень хрупкие.
Слайд 61: Химические свойства
Мышьяк и сурьма имеют две модификации: желтый, серый и серый, черный соответственно. Молекула мышьяка состоит из четырех атомов. Характерные степени окисления в соединениях +5, +3, -3. В ряду As → Sb → Bi наиболее устойчивая степень окисления +5 у мышьяка, +3 у висмута. Все три элемента хорошо реагируют с кислородом, серой, галогенами, металлами: 4As + 3O 2 = As 2 O 3 2Sb + 3Cl 2 = 2SbCl 3 2Bi + 3S = Bi 2 S 3 2As + 3Mg = Mg 3 As 2
Слайд 62
С разбавленными кислотами не взаимодействуют, концентрированные кислоты - окислители растворяют мышьяк и сурьму: Sb + 5 HNO 3 = H 3 SbO 4 + 5 NO 2 + H 2 O ( As) Висмут концентрированной азотной кислотой пассивируется, в разбавленной растворяется: Bi + 4HNO 3 = Bi(NO 3 ) 3 + NO + 2H 2 O В щелочах висмут не растворим, мышьяк и сурьма: 2As + 2NaOH + 5KNO 3 = 5KNO 2 + 2NaAsO 3 + H 2 O (Sb)
Слайд 63
Оксиды в низшей степени окисления As 2 O 3, Sb 2 O 3, Bi 2 O 3 - порошки, плохо растворимые в воде, получаются при сгорании в кислороде. Оксиды мышьяка и сурьмы проявляют амфотерные свойства: As 2 O 3 + 6 NaOH = 2 Na 3 AsO 3 + 3 H 2 O ( Sb) Sb 2 O 3 + 3 H 2 SO 4 = Sb 2 ( SO 4 ) 3 + 3 H 2 O (As) Оксид висмута - основного характера: Bi 2 O 3 + 3 H 2 SO 4 = Bi 2 ( SO 4 ) 3 + 3 H 2 O Гидроксид мышьяка амфотерен, в свободном состоянии H 3 AsO 3 не получена, существует только в растворах.
Слайд 64
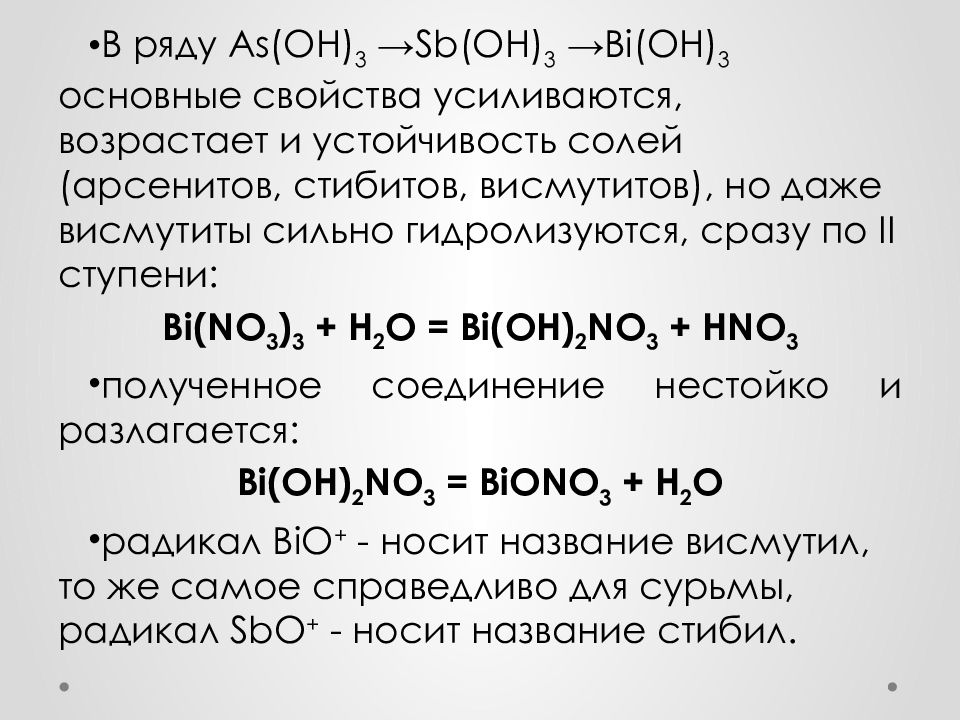
В ряду As (OH) 3 → Sb (OH) 3 → Bi (OH) 3 основные свойства усиливаются, возрастает и устойчивость солей (арсенитов, стибитов, висмутитов ), но даже висмутиты сильно гидролизуются, сразу по II cтупени : Bi (NO 3 ) 3 + H 2 O = Bi (OH) 2 NO 3 + HNO 3 полученное соединение нестойко и разлагается: Bi ( OH ) 2 NO 3 = BiONO 3 + H 2 O радикал BiO + - носит название висмутил, то же самое справедливо для сурьмы, радикал SbO + - носит название стибил.
Слайд 65
В высшей степени окисления оксид мышьяка растворим в воде, оксиды сурьмы и висмута - нерастворимые стеклообразные вещества. Обладают кислотными свойствами. В ряду H 3 AsO 4 →H 3 SbO 4 →[HBiO 3 ] кислотные свойства убывают. Висмутовая кислота не получена. Соли ( висмутаты ) легко получаются при взаимодействии оксидов со щелочами: Bi 2 O 5 + 6 NaOH = 2 Na 3 BiO 4 + 3 H 2 O Bi 2 O 5 + 2 NaOH = 2 NaBiO 3 + H 2 O
Последний слайд презентации: Элементы 15 группы ( пниктогены )
Арсенаты по свойствам похожи на фосфаты, а мышьяковая кислота даже сильнее фосфорной, которую можно получить взаимодействием оксида с водой, а также окислением мышьяка в водной среде: 2 As + 5 Cl 2 + 8 H 2 O = 2 H 3 AsO 4 + 10 HCl Сурмяную кислоту можно получить из стибатов : NaSbO 3 + H 2 O = NaOH + HSbO 3 Все кислоты твердые вещества, хорошо растворимые в воде.













![Элементы 15 группы ( пниктогены ) Модель тетрааминодиаквамеди ( II ) [ Cu(NH 3 ) 4 (H 2 O) 2 ] 2 +](https://s0.showslide.ru/s_slide/ff585154aec0c628d8c4a9e4b2cb4453/285b870a-4d7c-4247-83c8-d5535d941015.jpeg)