Первый слайд презентации: Лекция № 6 «Лекарственные средства производные р -элементов V гр. ПСЭ» (продолжение)
18.10.2012 Кафедра фармацевтической и токсикологической химии доц. Богословская О.А.
Слайд 2: Висмута нитрат основный
2 Висмута нитрат основный Висмута субнитрат Bismuthi subnitras BiO ( NO 3 )•Н 2 О М r 305,0 Описание. Аморфный или микрокристаллический порошок белого цвета, без запаха. Практически не растворим в воде и спирте. Легко растворим в минеральных кислотах (азотная, соляная).
Слайд 3: Определение подлинности
3 Определение подлинности 1. При прокаливании препарата образуется желто-оранжевый оксид висмута Bi 2 O 3 и выделяются красно-бурые пары диоксида азота ( IV ): 4 BiONO 3 2 Bi 2 O 3 + 4 NO 2 + O 2
Слайд 4
4 Общие реакции подлинности на ион висмута Bi 3+ 2. Сульфиды щелочных металлов дают с растворами солей висмута темно-коричневый осадок сульфида висмута. Реакция идет в кислой среде – для перевода препарата в ионное состояние - висмутил 2 BiONO 3 + 3 Na 2 S + 4 HCI 2 Bi 2 S 3 + + 2 NaNO 3 + 4 NaCI + 2 H 2 O Сульфид висмута растворяется в концентрированной азотной кислоте. Эта реакция позволяет обнаружить висмут в количестве 10 мкг/л (1:100000).
Слайд 5
5 3. Реакция с йодидом калия. При добавлении к концентрированному подкисленному раствору препарата раствора йодида калия выделяется бурый осадок йодида висмута, который растворяется в избытке реактива с образованием калия тетрайодовисмутата( III ), окрашенного в темно-оранжевый цвет: Bi(NO 3 ) 3 + 3KI BiI 3 + 3KNO 3 BiI 3 + KI K[BiI 4 ] раствор йодида калия вначале добавляют по каплям
Слайд 6
6 Подлинность (ВР): А. с калия йодида. B. Даёт реакцию (б) на висмут (Общие реакции). С. Даёт реакцию на нитраты. D. рН раствора 5% раствора, содержащего 10% азотной кислоты и 22% аммиака, ≤ 2.0
Слайд 7
7 Оценка чистоты (ГФ) Недопустимые примеси : медь, свинец, соли аммония, сульфаты, мышьяк и теллур. Допустимые примеси хлориды, соли щелочных и щелочноземельных металлов, карбонаты, серебро.
Слайд 8: Оценка чистоты
8 Оценка чистоты Недопустимые примеси Для обнаружения меди, свинца и сульфатов препарат растворяют в азотной кислоте, осаждают основные соли висмута, образовавшиеся в результате гидролиза при разбавлении и нагревании раствора. Для обнаружения меди в фильтрат добавляют аммиак. В присутствии меди фильтрат должен окрашиваться в ультрамариновый цвет, в результате образования аммиаката меди. 2 Cu 2+ + 4 NH 3. H 2 O 2[С u ( N Н 3 ) 4 ] 2+ + 4 H 2 O комплекс ультрамаринового цвета
Слайд 9
9 Для обнаружения свинца в этот же фильтрат добавляют разведенной серной кислоты. Образуется сульфат свинца и появляется белый осадок или муть ( PbSO 4 ). Для обнаружения сульфатов в этот же фильтрат добавляют нитрат бария. Раствор должен оставаться прозрачным.
Слайд 10
10 Определение мышьяка и теллура проводят по методу Буго и Тиле. Мышьяк и теллур восстанавливают до элементных форм. В качестве восстановителя используют гипофосфит натрия: 2 Na ( H 2 P +1 O 2 ) + Na 2 TeO 3 Te + 2 Na 2 ( HP +3 O 3 ) + H 2 O При этом теллур дает черное окрашивание, а мышьяк – бурое, за счет выделения элементных форм. Соли аммония не должны обнаруживаться по запаху при кипячении 1 г препарата в 5 мл раствора натрия гидроксида.
Слайд 11
11 Соли щелочных и щелочно-земельных металлов : препарат растворяют в соляной кислоте, пропускают сероводород до полного осаждения висмута (сульфид висмута), фильтруют. Фильтрат выпаривают досуха и остаток прокаливают до постоянной массы. Остаток оксидов и неразлагаюшихся солей не должен превышать 0,5 %.
Слайд 12
12 Содержание карбонатов не должно превышать количества, которое можно обнаружить по выделению углекислого газа, если на 1 г препарата подействовать 3 мл азотной кислоты. Определение хлоридов –эталонный метод Определение серебра –эталонный метод. Приготовление эталона описано в ФС
Слайд 13
13 Оценка чистоты (ЕР) Допустимые примеси медь, свинец, Вещества, осаждаемые аммиаком, хлориды, серебро.
Слайд 14: Количественное определение
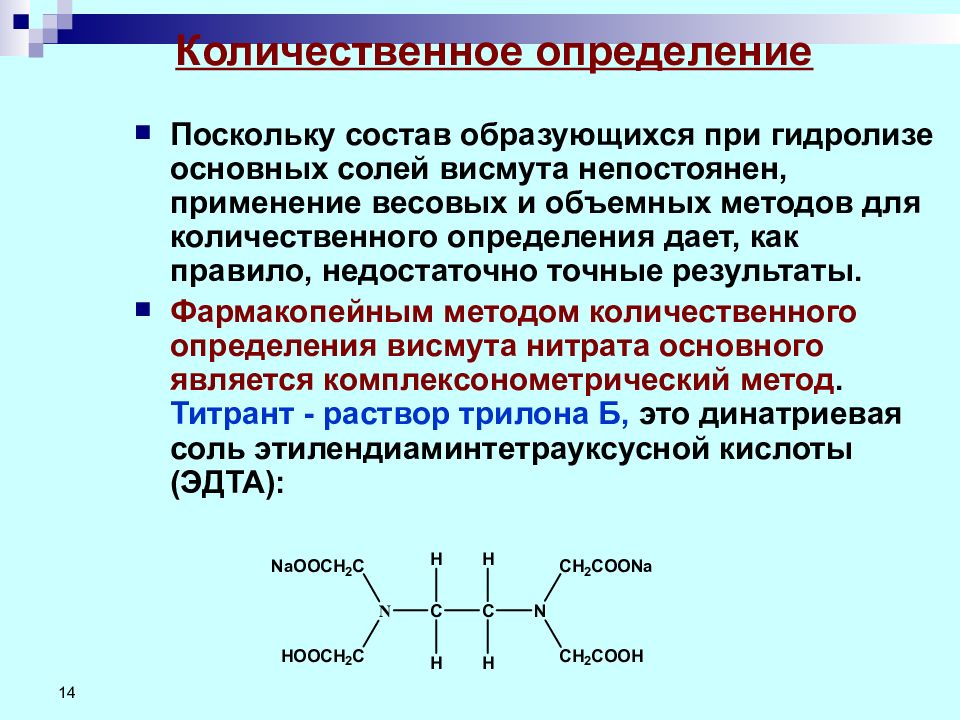
14 Количественное определение Поскольку состав образующихся при гидролизе основных солей висмута непостоянен, применение весовых и объемных методов для количественного определения дает, как правило, недостаточно точные результаты. Фармакопейным методом количественного определения висмута нитрата основного является комплексонометрический метод. Титрант - раствор трилона Б, это динатриевая соль этилендиаминтетрауксусной кислоты (ЭДТА):
Слайд 15
15 ЭДТА является шестидентатным лигандом, так как содержит 4 карбоксильные группы и два атома азота, имеющие каждый по неподеленной паре электронов. Хелаты ЭДТА с ионами металлов называют комплексонатами. ЭДТА- четырехосновная кислота и обозначается H 4 Y ЭДТА как титрант реагирует с ионами металла в соотношении 1:1 независимо от зарядов катиона, при этом происходит выделение двух ионов водорода: Bi 3+ + H 2 Y 2- → BiY - + 2H +. Для связывания ионов водорода в анализируемый раствор добавляют аммиачный буфер или щелочь. Если определение проводят в кислой среде, то ионы водорода не связываются. В качестве индикаторов используют металлоиндикаторы (органические красители, образующие с ионами титруемого металла интенсивно окрашенные комплексы, цвет которых отличается от окраски свободного индикатора).
Слайд 16: Принцип комплексонометрического титрования
16 Принцип комплексонометрического титрования К исследуемому раствору, содержащему определенный катион, при строго определенном значении рН прибавляют небольшое количество соответствующего индикатора (менее 1%). Если индикатор – шестиосновная кислота ( ксиленовый оранжевый): Н 6 Ind = 3 H + + Н 3 Ind 3 - (в свободном виде - желтого цвета) В результате образуется хорошо растворимое в воде окрашенное комплексное соединение индикатора с металлом. Bi 3+ + Н 3 Ind 3 - = Bi Н 3 Ind 3 - Комплекс индикатора с ионом металла достаточно устойчив, но в 10 раз менее устойчив, чем комплекс металла с ЭДТА (изменение окраски индикатора должно быть четким, контрастным и быстрым).
Слайд 17
17 Проводят титрование раствором трилона Б свободных ионов металла. Более 99% ионов металла находится в свободном виде и в ходе титрования связывается комплексоном ( Трилоном Б) в бесцветный растворимый комплекс ЭДТА с металлом. Bi 3+ + H 2 Y 2- → BiY - + 2H +. В процессе титрования титрант трилон Б ( Na 2 ЭДТА) связывает ионы висмута, образовавшиеся при растворении препарата в азотной кислоте, в комплексное соединение: Na 2 ЭДТА + Bi(NO 3 ) 3 Na[Bi ЭДТА ]+2HNO 3 +NaNO 3
Слайд 18
18 В точке эквивалентности: происходит разрушение комплекса металл-индикатор, образование более устойчивого комплекса металла – ЭДТА и свободного индикатора. Bi Н 3 Ind 3 - + H 2 Y 2- → BiY - + 3 H + + Ind 3 - При этом выделяется свободный индикатор, который окрашивает раствор в другой цвет, присущий свободному индикатору при данном значении рН.
Слайд 19
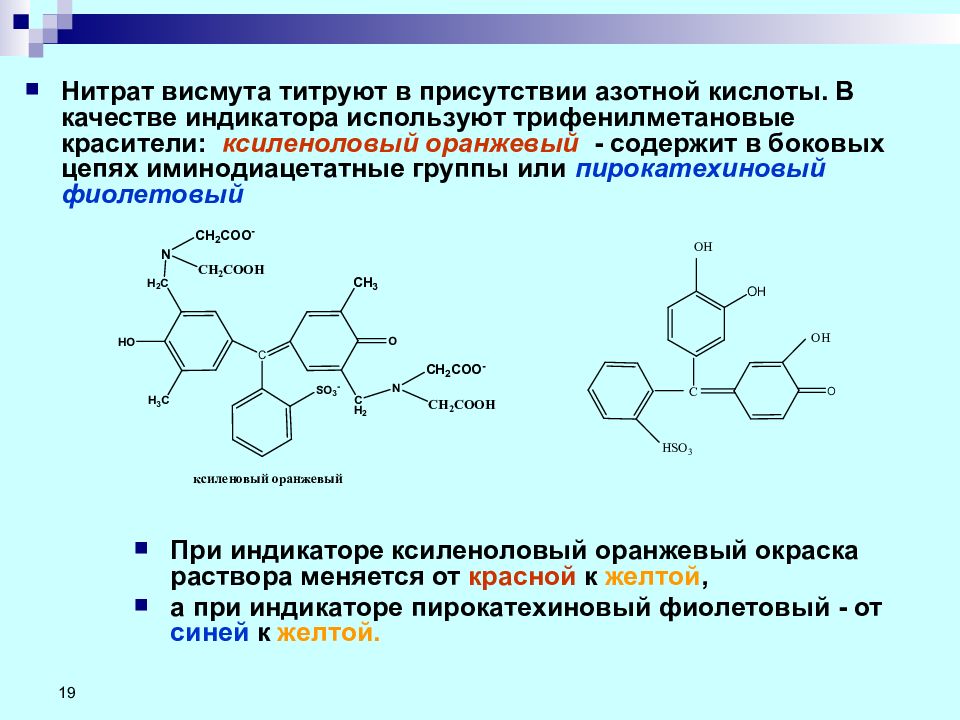
19 Нитрат висмута титруют в присутствии азотной кислоты. В качестве индикатора используют трифенилметановые красители: ксиленоловый оранжевый - c одержит в боковых цепях иминодиацетатные группы или пирокатехиновый фиолетовый При индикаторе ксиленоловый оранжевый окраска раствора меняется от красной к желтой, а при индикаторе пирокатехиновый фиолетовый - от синей к желтой.
Слайд 20
20 Применение Вяжущее, адсорбирующее, антацидное, противомикробное и противовоспалительное средство. Применяют при желудочно-кишечных заболеваниях. Выпускается в порошке и таблетках по 0,25 и 0,5 г. Входит в состав комбинированных антацидных препаратов (таблетки «Викалин», «Викаир» и др.). Применяют также наружно в виде мази и присыпки при воспалительных заболеваниях кожи и слизистых оболочек. В терапии вместо Bi ( NO 3 ) 3 следует применять ( BiO ) 2 CO 3, поскольку нитрат восстанавливается кишечными микробами до нитрита. Последний может вызывать отравления, ошибочно принимаемые за отравления висмутом.
Слайд 21
21 Хранение В хорошо закрытых банках в сухом, защищенном от света месте без доступа воздуха.
Слайд 22
«Лекарственные средства на основе p-элементов III группы » B, Al, Ga, In, Tl (бор, алюминий, галлий, индий, таллий)
Слайд 23: Атомы р-элементов III группы
На внешнем электронном слое содержат три валентных электрона. Поэтому бор, алюминий, галлий и индий в своих соединениях имеют степень окисления + III. С ростом порядкового номера внутри подгруппы металлические свойства элементов усиливаются: бор имеет ярко выраженный неметаллический характер, алюминий, галлий и индий – металлы с амфотерными свойствами, таллий - выраженые металлические свойства. Наиболее широко в качестве лекарственных средств используются соединения бора и алюминия. 23
Слайд 24: Лекарственные средства на основе р - элементов III группы: борная кислота (Н 3 ВО 3 ), тетраборат натрия (Na 2 B 4 O 7. 10Н 2 О ), гидроксид алюминия (Al(OH) 3 ), фосфат алюминия ( AlPO 4 )
24
Слайд 25: Биологическое значение р - элементов III группы
Галлий Поступает в организм с пищей и содержится в тканях в количестве 0,01-0,06 мкг/г. Галлиий присутствует в железах внутренней секреции, в частности, в гипофизе. «Депо» галлия в организме - костная ткань и печень.
Слайд 26
У животных, при отравлении галлием, наблюдается поражение нервной системы, сопровождающееся морфологическими изменениями в печени и почках. Наблюдаются значительные колебания в содержании калия и натрия в сыворотке крови, повреждения слизистых оболочек желудочно-кишечного тракта. В медицине нитрат галлия используется при лечении гиперкальциемии у онкологических больных. Радиоизотоп галлия применяют в диагностике и лечении опухолевых заболеваний. В USP -24 приведены фармакопейная статья на инъекционный раствор галлия цитрат 67 Ga. 26
Слайд 27
Индий - очень мягкий серебристо-белый металл. Индий не обнаружен в составе каких-либо жизненно важных соединений. Считают, что препараты индия могут стимулировать метаболизм. В USP -24 приведены фармакопейная статья на инъекционный раствор индия хлорида, на основе радиоактивного изотопа 111 In. 27
Слайд 28
Таллий — белый металл с голубоватым оттенком. Как сам таллий, так и его соединения высокотоксичны. Симптомы отравления — поражение нервной системы, почек, желудка, выпадение волос. ПДК в воде для таллия 0,0001 мг/м 3, в атмосферном воздухе 0,004 мг/м 3. Смертельная для человека доза таллия составляет 600 мг. В качестве антидота используется берлинская лазурь. Соединения таллия в медицине не применяются из-за своей токсичности. Предполагают, что ион таллия замещает в метаболических процессах ион К +, так как их ионные радиусы близки по величине. Ион таллия, может прочно связываться с тиоловыми группами, нарушая функционирование ряда ферментов. 28
Слайд 29
Бор относится к эссенциальным микроэлементам. Содержание в организме человека составляет 20 мг. Участвует в углеводном, жировом обменах, в окислительно-восстановительных процессах организма. Предполагают, что бор участвует в кальциевом обмене, т.к. содержание его в паращитовидной железе – основном органе регуляции кальциевого обмена в организме - высокое. Бор снижает токсичность мышьяка при их совместном применении. 29
Слайд 30
Верхний предел среднесуточной, безопасной дозы бора для человека - 13 мг. Токсическая доза для человека: 4 г. Летальная доза бора для человека не определена. При острой интоксикации соединениями бора (бурой, борной кислотой) наблюдается рвота и другие диспепсические расстройства, а также шок. При вдыхании газообразных соединений бора могут развиться судороги, мышечные боли, психические нарушения, диплопия. Описано такое эндемическое заболевание, как борный энтерит, которое встречается на Южном Урале и на севере Казахстана. Хроническое перенасыщение бором приводит к выпадению волос, полиморфной сухой эритеме и анемии, которые проходят при нормализации уровня бора в диете. 30
Слайд 31
Преимущественно бор накапливается в щитовидной и паращитовидной железах, костной ткани, а также почках, селезенке и сердце. Суточное поступление в организм колеблется от 0,35 мг до 41 мг в сутки. Для питьевых вод, которые применяются ежедневно, рекомендована предельно допустимая концентрация бора 0,5 мг/л (по санитарно-эпидемиологическим нормам). 31
Слайд 32
Бор имеет тенденцию к накоплению в растениях (особенно в овощах и фруктах): присутствует в яблоках (245 мкг%), грушах (135 мкг%), винограде (365 мкг%), моркови (200 мкг%), орехах (мкг% - это величина, показывающая содержание вещества в микрограммах в 100 граммах продукта). В природных водах бор находится в виде ионов борных кислот. В маломинерализованных подземных водах содержание бора составляет, как правило десятки-сотни мкг/дм 3, однако в минерализованных щелочных водах его концентрация может достигать единиц и даже десятков мг/л, что делает такую воду потенциально небезопасной для питьевого применения. 32
Слайд 33: БОР: растпространение в природе
Бор в природе встречается в виде кислородных соединений, входит в состав борной кислоты. В свободном виде известны две разновидности борной кислоты: метаборная - НВО 2 ортоборная - Н 3 ВО 3. Полиборные кислоты Н 3 m -2 n В m О 3 m - n в свободном виде не выделены, но известны их соли, например двузамещенный тетраборат натрия или бура - Na 2 B 4 O 7 ( m =4, n =5). В большинстве соединений бор трехвалентен. Но присутствие свободной р -орбитали у атома бора делает возможным образование химической связи по донорно-акцепторному типу, что приводит к увеличению валентности до четырех. БОР: растпространение в природе 33
Слайд 34: Кислота борная Acidum boricum Н 3 ВО 3 М.м. 61.8
Получение. Из буры ( Na 2 B 4 O 7.10 H 2 O - Natrii tetraboras ). Горячий раствор тетрабората натрия обрабатывают минеральной кислотой, затем раствор охлаждают, а выделившиеся кристаллы борной кислоты перекристаллизовывают из воды: Na 2 B 4 O 7 + Н 2 SО 4 + 5Н 2 О Na 2 SO 4 + 4Н 3 ВО 3 Описание. Бесцветные блестящие чешуйчатые кристаллы, жирные на ощупь (водородные связи образуют слоистую структуру) или мелкий белый кристаллический порошок без запаха (вид Н 3 ВО 3 зависит от технологии получения). В холодной воде раствор има (1:25), легко растворима в горячей воде (1:4). Растворима в спирте (1:25) (1:16 – BP ), легко растворима в глицерине (1:7) (1:4 – BP ). 34
Слайд 35
При длительном нагревании до 100°С борная кислота теряет часть воды и переходит в метаборную кислоту. При более сильном нагревании борная кислота превращается в тетраборную кислоту Н 2 B 4 О 7 и, наконец, пройдя стадию стекловидной сплавленной массы, теряет всю воду и превращается в борный ангидрид (оксид бора В 2 О 3 ). Н 3 ВО 3 → НВО 2 → Н 2 B 4 О 7 → 2 В 2 О 3 При растворении в воде все эти соединения снова переходят в борную кислоту 35 - Н 2 О - Н 2 О - Н 2 О
Слайд 36
Борная кислота – относится к очень слабым, трехосновным кислотам Константы ионизации равны: Ка 1 = 5,8 10 -10, Ка 2 = 2 10 –13, Ка 3 = 2 10 –14. Прочных солей борная кислота не образует ( Тетраборат натрия является солью тетраборной кислоты). Растворы борной кислоты имеют рН от 3.8 до 4.8 ( слабо-кислая ). В отличие от других кислот протолитические свойства борной кислоты связаны не с отщеплением протона, а присоединением гидроксид-ионов : Н 3 ВО 3 + Н 2 О [ B ( OH ) 4 ] - + H + 36
Слайд 37: Определение подлинности
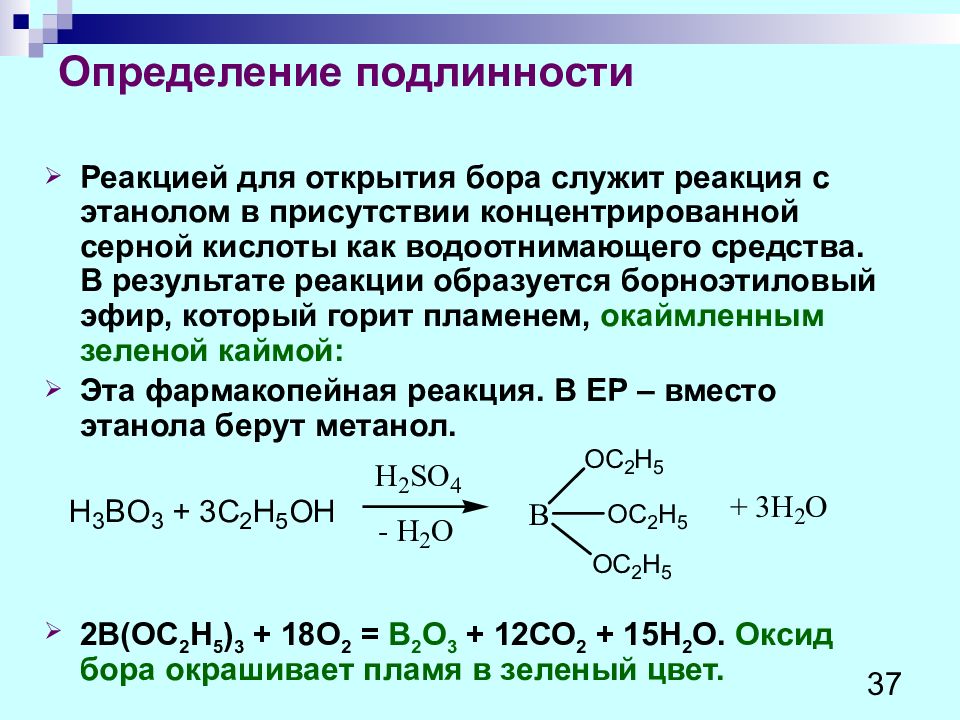
Реакцией для открытия бора служит реакция с этанолом в присутствии концентрированной серной кислоты как водоотнимающего средства. В результате реакции образуется борноэтиловый эфир, который горит пламенем, окаймленным зеленой каймой: Эта фармакопейная реакция. В Е P – вместо этанола берут метанол. 2В(ОС 2 Н 5 ) 3 + 18О 2 = В 2 О 3 + 12СО 2 + 15Н 2 О. Оксид бора окрашивает пламя в зеленый цвет. 37
Слайд 38
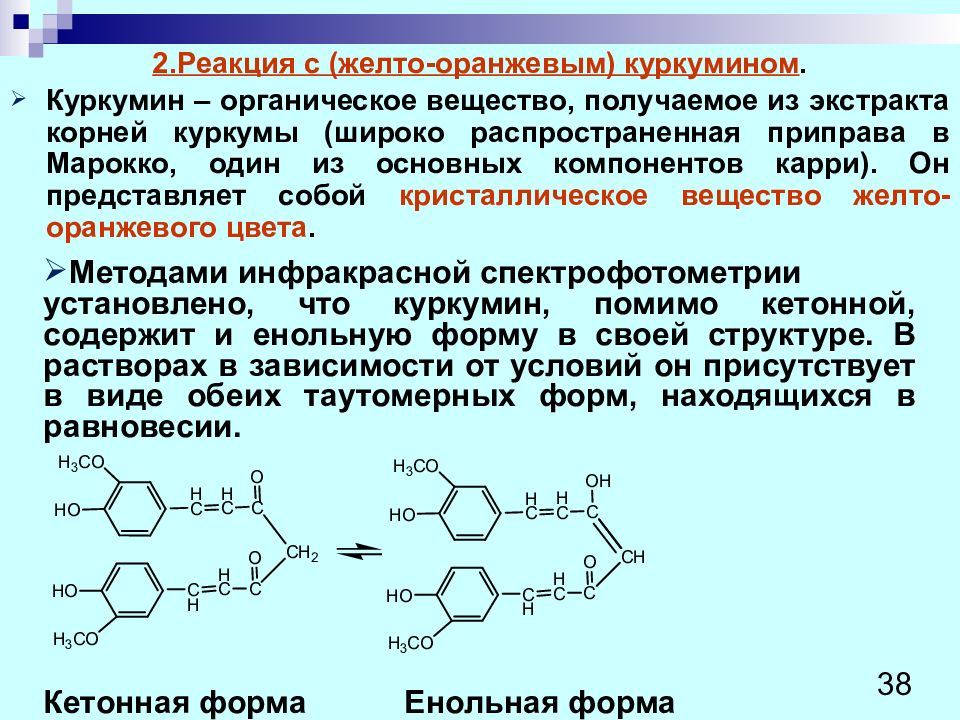
2.Реакция с (желто-оранжевым) куркумином. Куркумин – органическое вещество, получаемое из экстракта корней куркумы (широко распространенная приправа в Марокко, один из основных компонентов карри). Он представляет собой кристаллическое вещество желто-оранжевого цвета. 38 Методами инфракрасной спектрофотометрии установлено, что куркумин, помимо кетонной, содержит и енольную форму в своей структуре. В растворах в зависимости от условий он присутствует в виде обеих таутомерных форм, находящихся в равновесии. Кетонная форма Енольная форма
Слайд 39
Для реакции применяется куркумовая бумага: фильтровальная бумага, пропитанную спиртовой настойкой куркумина, а затем высушенная в помещении, не содержащем паров кислот и аммиака. Исследуемый раствор борной кислоты (1:50) наносят на куркумовую бумагу, одновременно добавляют несколько капель хлороводородной кислоты. При высушивании, в зависимости от концентрации борной кислоты, появляется розовый или буровато-красный цвет. Это образуется розоцианин. Если бумагу смочить раствором аммиака, окраска переходит в зеленовато-черную, а при очень разбавленных растворах – фиолетовую
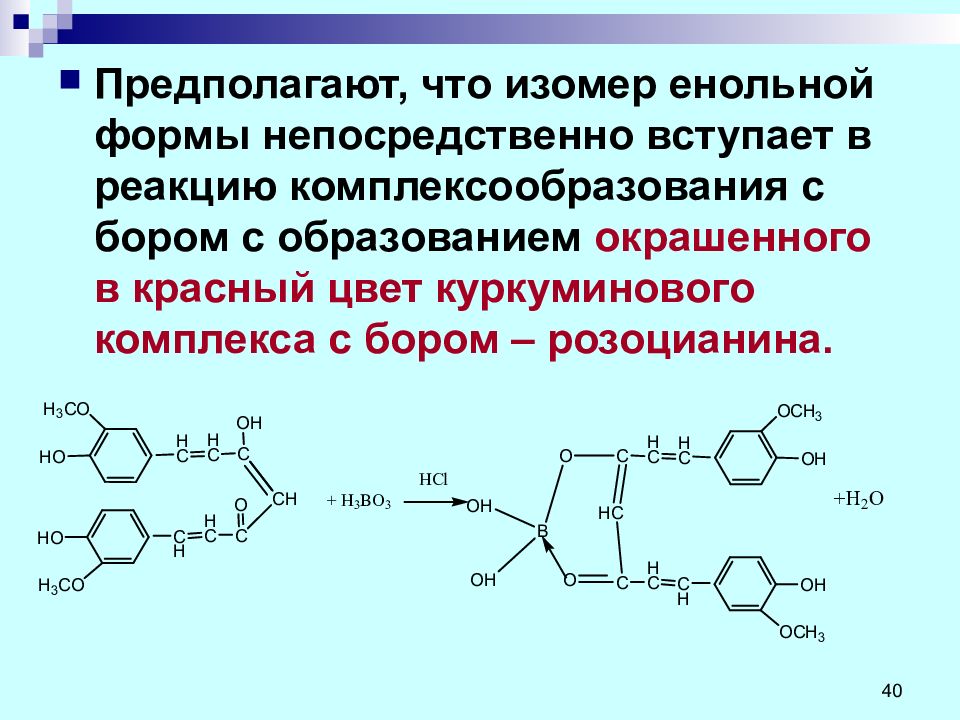
Слайд 40
Предполагают, что изомер енольной формы непосредственно вступает в реакцию комплексообразования с бором с образованием окрашенного в красный цвет куркуминового комплекса с бором – розоцианина. 40
Слайд 41
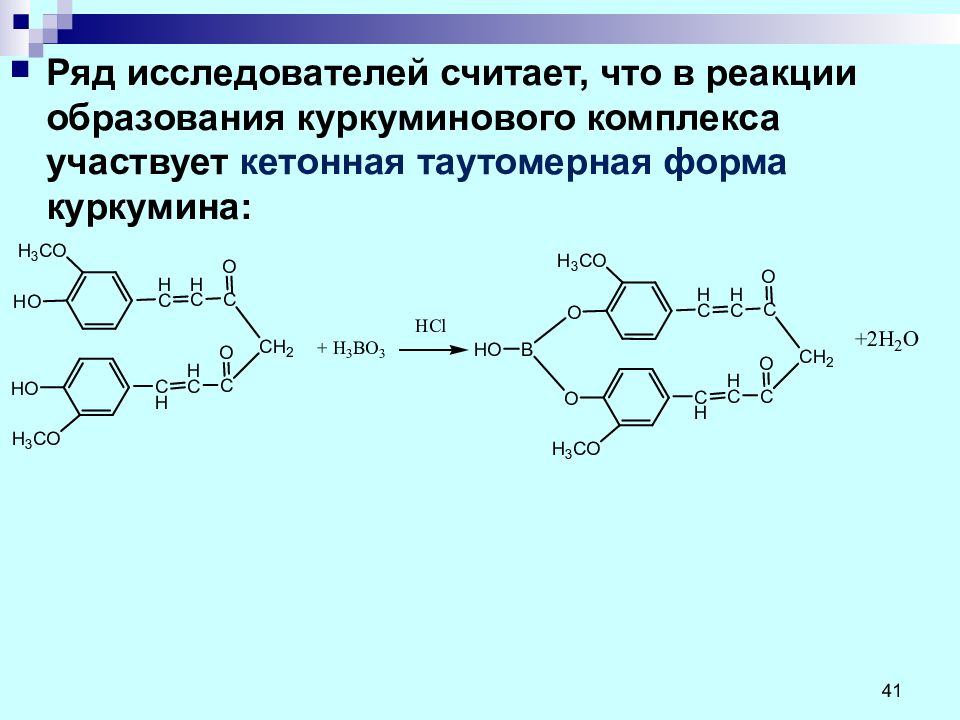
Ряд исследователей считает, что в реакции образования куркуминового комплекса участвует кетонная таутомерная форма куркумина: 41
Слайд 42
Определению бора с куркумином мешают: железо, молибден, вольфрам, берилий, висмут, мышьяк и ряд других элементов, которые в тех же условиях реагируют с куркумином с образованием окрашенных комплексов. Кроме того, этой реакции мешают и окислители, окисляющие куркумин. 42
Слайд 43
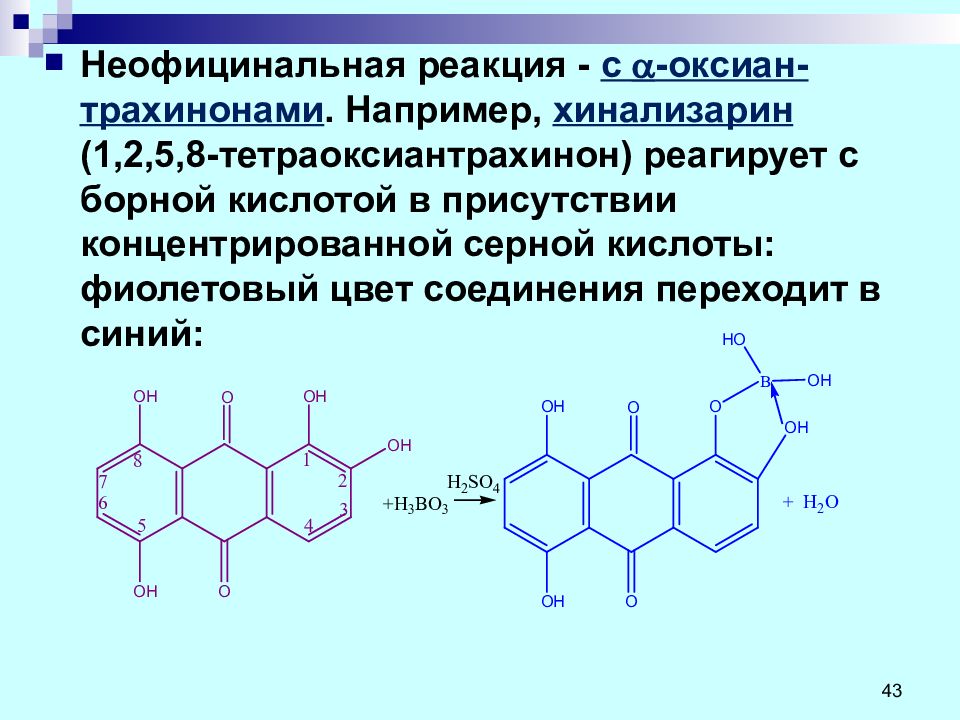
Неофицинальная реакция - с -оксиан - трахинонами. Например, хинализарин ( 1,2,5,8-тетраоксиантрахинон) реагирует с борной кислотой в присутствии концентрированной серной кислоты: фиолетовый цвет соединения переходит в синий: 43
Слайд 44
Е P помимо реакции с метанолом, включает тест на кислоту с индикаторами метиловым красным (оранжевая или красная окраска) или бромтимоловым голубым (желтая окраска). Методика определения: 3,3% раствор борной кислоты, объемом 100 мл, должен иметь кислую реакцию. Эта процедура необходима для отличия борной кислоты от другого препарата бора – буры: водный раствор буры имеет щелочную реакцию. 44
Слайд 45: Оценка чистоты
ГФ: Недопустимыми примесями в препарате являются минеральные кислоты. К 10 г препарата добавляют 50 мл воды, отфильтровывают выделившуюся борную кислоту, 1мл фильтрата разводят в 10 мл воды, прибавлют к раствору препарата 1 капли метилового оранжевого. Раствор не должен окрашиваться в розовый или оранжевый цвет (интервал перехода окраски индикатора – рН 3,1-4,0). ЕР : рН = 3.8 - 4.8 ЕР : Борная кислота должна полностью растворяться в горячей воде: 3,3 г растворяют в 80 мл кипящей воды, охлаждают и доводят до 100 мл – раствор прозрачный и бесцветный ЕР : В спирте: раствор, 1 г чистой борной кислоты в 10 мл кипящего спирта, должен быть бесцветным и его опалесценция не должна превышать опалесценцию эталонного раствора II. 45
Слайд 46
ЕР: Недопустимые примеси: Органические вещества обнаруживают при постепенном нагревании: не должно происходить потемнения препарата до слабого покраснения. ЕР: Сульфаты. 450 мкг/мл ( рр m ). ЕР: Тяжелые металлы. 15 мкг/мл ( рр m ). 46
Слайд 47: Количественное определение
Метод нейтрализации. Титрование щелочью комплексных соединений борной кислоты с многоатомными спиртами или сахарами. (борная кислота - очень слабая (рКа 1 = 9,24), поэтому прямое титрование ее щелочью невозможно). точка эквивалентности при титровании щелочью находится в области значений рН, где трудно подобрать индикатор с заметным переходом окраски. при действии щелочей на борную кислоту образуются соли не ортоборной кислоты Н 3 ВО 3, а тетрабораты и метаборной НВО 2 кислоты. При титровании борной кислоты щелочью, образующаяся соль метаборной кислоты гидролизуется : 2 NaBO 2 + 4Н 2 О 2Н 3 ВО 3 + 2 NaOH В результате гидролиза щелочная реакция раствора достигается значительно ранее достижения эквивалентной точки. 47
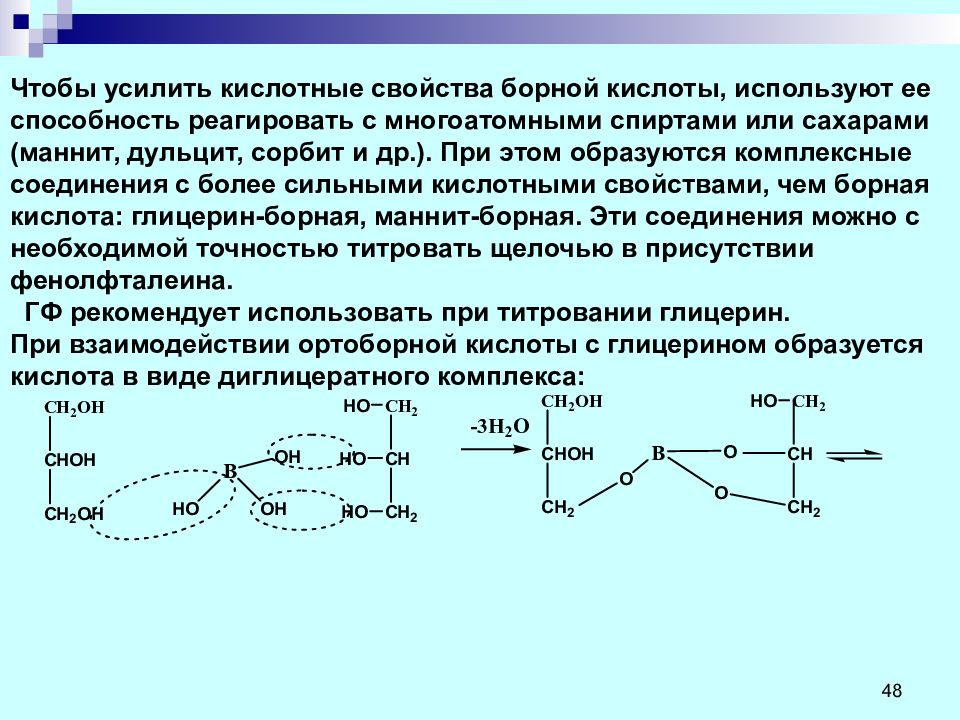
Слайд 48: Чтобы усилить кислотные свойства борной кислоты, используют ее способность реагировать с многоатомными спиртами или сахарами ( маннит, дульцит, сорбит и др.). При этом образуются комплексные соединения с более сильными кислотными свойствами, чем борная кислота: глицерин-борная, маннит-борная. Эти соединения можно с необходимой точностью титровать щелочью в присутствии фенолфталеина. ГФ рекомендует использовать при титровании глицерин. При взаимодействии ортоборной кислоты с глицерином образуется кислота в виде диглицератного комплекса:
48
Слайд 50: Условия
Глицерин предварительно необходимо нейтрализовать щелочью по фенолфталеину, так как он имеет слабокислую реакцию среды, поскольку является многоатомным спиртом. Чтобы избежать распада образующейся комплексной кислоты и сместить равновесие вправо, в конце титрования в реакционную смесь добавляют порцию глицерина. В конце титрования, при добавлении в реакционную смесь порции глицерина, розовая окраска фенолфталеина не должна исчезнуть. Исчезновение окраски свидетельствует о смещении равновесия влево (гидролиз диглицерата бора). В этом случае необходимо добавить новую порцию глицерина и продолжить титрование. Вода для растворения навески борной кислоты и раствор гидроксида натрия не должны содержать СО 2 (прокипятить). Угольная кислота, как более сильная кислота может вытеснять борную кислоту из ее солей. Борную кислоту следует титровать при комнатной температуре, так как при температуре выше 50°С комплекс борной кислоты с глицерином начинает разрушаться. Точку эквивалентности можно определить потенциометрически. 50
Слайд 51
ПРИМЕНЕНИЕ: Антисептическое средство. При местном применении (в виде 5 % мази) оказывает антипедикулезное действие. Ранее использовалась в качестве антисептического средства у взрослых и детей. В связи с выявленными побочными явлениями, внесены ограничения к ее применению. Применяют в виде 2 % водного раствора для промывания конъюнктивального мешка при конъюнктивитах; 3 % растворы - для примочек при мокнущей экземе, дерматитах. Спиртовыми растворы 0,5 %, 1 %, 2 % и 3 % - в виде капель с при остром и хроническом отите 10 % раствор в глицерине применяют для смазывания пораженных участков кожи при опрелостях, кольпитах. 51
Слайд 52
Борная кислота входит в состав ЛС: Линимент борно-цинковый (Linimentum Boro-zincatum). Паста борно-цинко-нафталанная Паста Теймурова (Pasta Teimurovi). Мазь борная (Unguentum Acidi borici 5%) Мазь солидоловая (по прописи Н.Ф. Рыбакова) (Unguentum Solidoli). Обладает кератолитическим эффектом. Применяют для лечения псориаза. Хранение: в прохладном, защищенном от света месте. 52
Слайд 53: Натрия тетраборат Natrii tetraboras
Бура Borax Na 2 B 4 O 7. 10Н 2 О М.м. 381,4 В свободном состоянии тетраборат натрия в природе встречается в виде минерала тинкала (в кристаллах которого атомы бора и кислорода чередуются, образуя цепь, содержащую 4 атома бора). Получение Для медицинских целей буру чаще всего получают из борокальцитов или борной кислоты при действии водного горячего раствора карбоната натрия: СаВ 4 О 7 + Na 2 CO 3 CaCO 3 + Na 2 B 4 O 7 4 Н 3 ВО 3 + Na 2 CO 3 Na 2 B 4 O 7 + CO 2 + 6 Н 2 О Образующийся кристаллогидрат Na 2 B 4 O 7. 10Н 2 О при прокаливании теряет всю воду и превращается в безводную соль. . 53
Слайд 54
Описание. Бесцветные, прозрачные, легко выветривающиеся кристаллы или белый кристаллический порошок. Бура растворима в воде (1:20), Очень легко растворима в горячей воде (1:0,6). Легко растворяется в глицерине (1:1), Очень мало растворима в спирте (1:2000) 54
Слайд 55: Определение подлинности
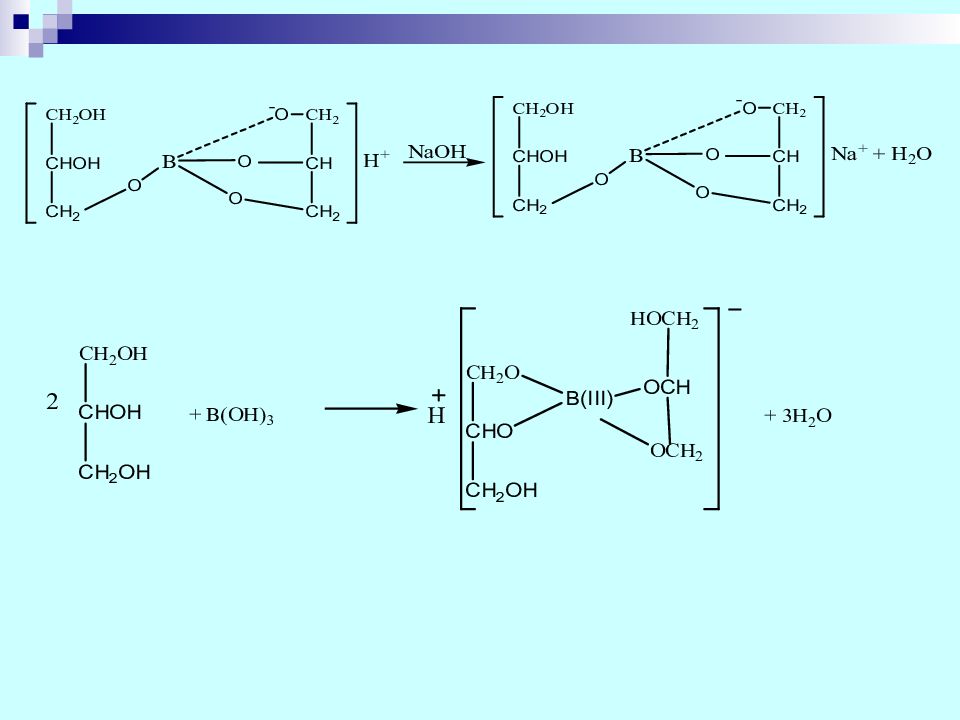
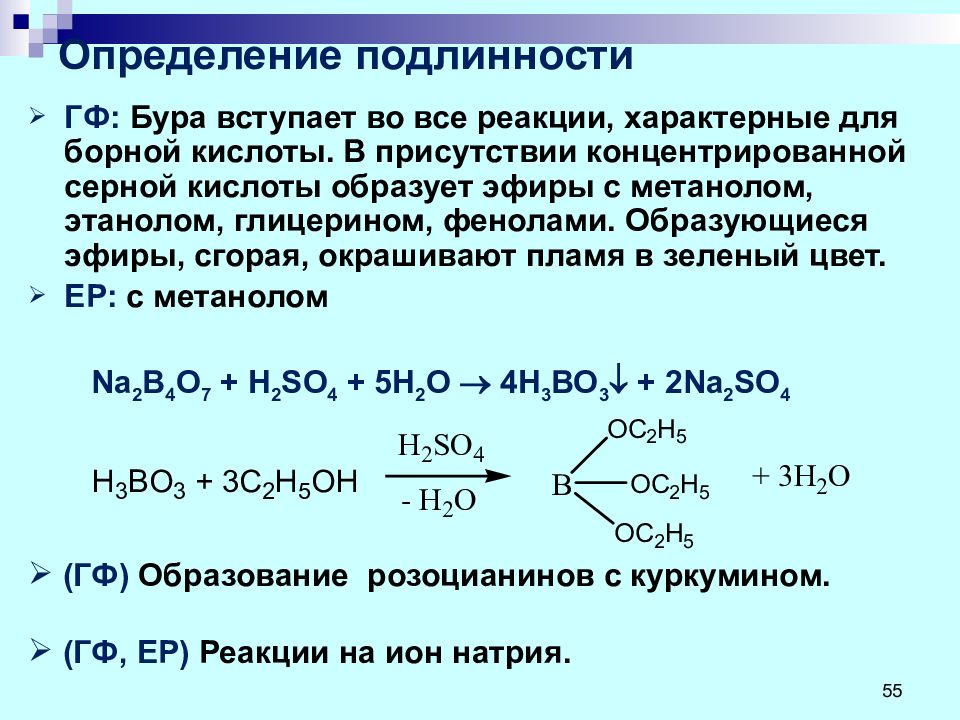
ГФ: Бура вступает во все реакции, характерные для борной кислоты. В присутствии концентрированной серной кислоты образует эфиры с метанолом, этанолом, глицерином, фенолами. Образующиеся эфиры, сгорая, окрашивают пламя в зеленый цвет. ЕР: с метанолом Na 2 B 4 О 7 + H 2 SO 4 + 5 H 2 O 4Н 3 ВО 3 + 2 Na 2 SO 4 (ГФ) Образование розоцианинов с куркумином. (ГФ, ЕР) Реакции на ион натрия. 55
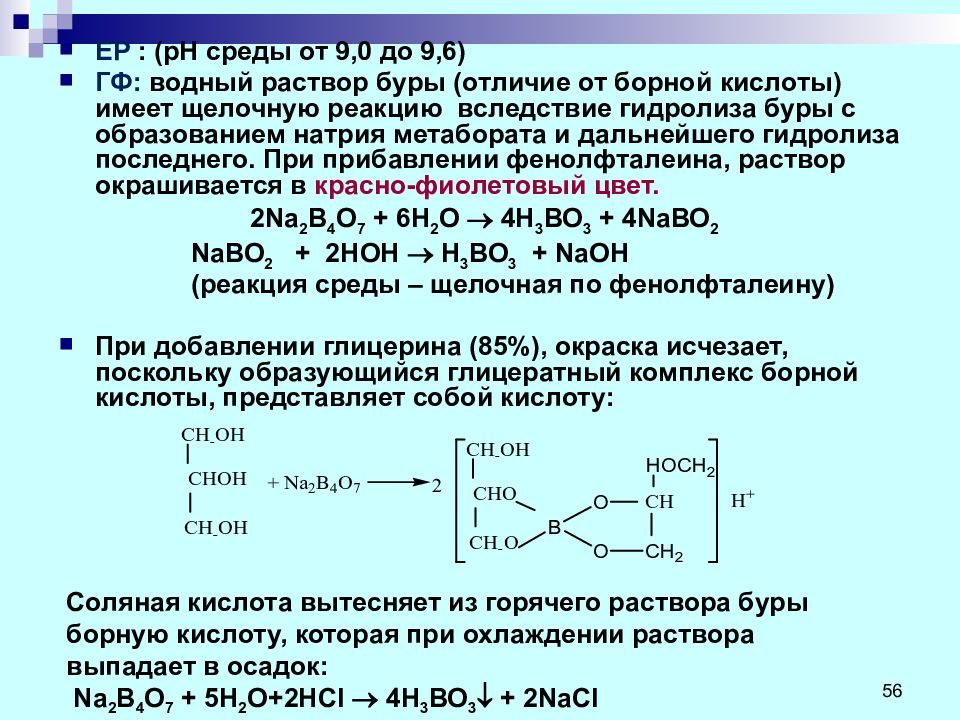
Слайд 56
ЕР : ( рН среды от 9,0 до 9,6) ГФ: водный раствор буры (отличие от борной кислоты) имеет щелочную реакцию вследствие гидролиза буры с образованием натрия метабората и дальнейшего гидролиза последнего. При прибавлении фенолфталеина, раствор окрашивается в красно-фиолетовый цвет. 2Na 2 В 4 О 7 + 6 Н 2 О 4 Н 3 ВО 3 + 4Na ВО 2 Na ВО 2 + 2 НОН Н 3 ВО 3 + Na ОН (реакция среды – щелочная по фенолфталеину) При добавлении глицерина (85%), окраска исчезает, поскольку образующийся глицератный комплекс борной кислоты, представляет собой кислоту: Соляная кислота вытесняет из горячего раствора буры борную кислоту, которая при охлаждении раствора выпадает в осадок: Na 2 B 4 О 7 + 5 H 2 O +2 HCl 4Н 3 ВО 3 + 2 NaCl 56
Слайд 57
Оценка чистоты Недопустимой примесью по ГФ являются карбонаты. Определяются по выделению диоксида углерода при прибавлении к раствору препарата (1:50) хлороводородной кислоты. Количественное определение Проводят методом нейтрализации. ГФ: Титрант - хлороводородная кислота. Индикатор - метиловый оранжевый (титруют до розовато-оранжевого окрашивания). Na 2 B 4 O 7 + 2HCI + 5H 2 O 4B(OH) 3 + 2NaCI (М 1/ z = ½ ) Индикатор изменяет окраску от избыточной капли хлороводородной кислоты. ЕР при количественном определении буры, как и в случае борной кислоты, использует образование комплексной кислоты с маннитолом и последующее ее титрование раствором щелочи в присутствии фенолфталеина. 57
Слайд 58
ГФ регламентирует содержание буры в препарате не менее 99,5 % (ВР - 99.0 %) и не более 103,0 %. Допустимое увеличение содержания основного вещества выше 100% связано с возможной потерей кристаллизационной воды. Применение. Бура применяется как антисептик в виде 1-2% растворов для полосканий, промываний, ингаляций при воспалительных процессах верхних дыхательных путей. Хранить препарат следует в хорошо закупоренных банках в прохладном месте, чтобы исключить потерю (выветривание) воды. 58
Слайд 59
Алюминий – Мягкий лёгкий металл серебристо-белого цвета. Микроэлемент, содержание в организме не превышает 50 мг. Суточное потребление алюминия человеком составляет 5-50 мг. В желудочно-кишечном тракте человека всасывается 2-4% поступившего алюминия, причем лучше усваиваются растворимые соли, такие как AlCl 3. Растительные продукты содержат в 50-100 раз больше алюминия, чем продукты животного происхождения. При горячей обработке пищевых продуктов или выпечке хлеба, за счет использования алюминиевой посуды, происходит загрязнение пищи алюминием. Питьевая вода: содержание алюминия составляет 2-4 мг/л. 59
Слайд 60
Источники, которые могут содержать излишки алюминия: чай, морковь, некоторые травы плавленые сыры, лекарственные вещества, антациды, дезодоранты, бумажные полотенца, продукты, контактирующие с алюминиевой фольгой.
Слайд 61
Алюминий влияет на ферментативные процессы. Предполагают, что он замещает ионы магния и кальция в активных центрах, так как ионные радиусы и энергии ионизации этих атомов близки по значениям. Отличается незначительным токсическим действием, но многие растворимые в воде неорганические соединения алюминия сохраняются в растворённом состоянии длительное время и могут оказывать вредное воздействие на человека и теплокровных животных через питьевую воду. Действует на нервную систему (накапливается в нервной ткани, приводя к тяжёлым расстройствам функции ЦНС). 61
Слайд 62: Алюминий и его соединения
Алюминия гидроксид Alumini hydroxydum Al ( OH ) 3. Получение Осаждение из горячего раствора сульфата алюминия 10% раствором аммиака. Al 2 (SO 4 ) 3 + 6NH 3. Н 2 O 2Al(OH) 3 + 3(NH 4 ) 2 SO 4 После отделения раствора, осадок промывают горячей водой до полного удаления сульфат-ионов и высушивают, вначале при температуре 400, а затем - при 100 0 С. Описание Аморфный рыхлый белый порошок, в воде практически нерастворим, в воде образует гель. Растворим при нагревании в разбавленных кислотах и растворах едких щелочей, т.е. гидроксид алюминия является амфотерным соединением: Al(OH) 3 + 3HCI AICI 3 + 3H 2 O Al(OH) 3 + NaOH Na[AI(OH) 4 ] 62
Слайд 63
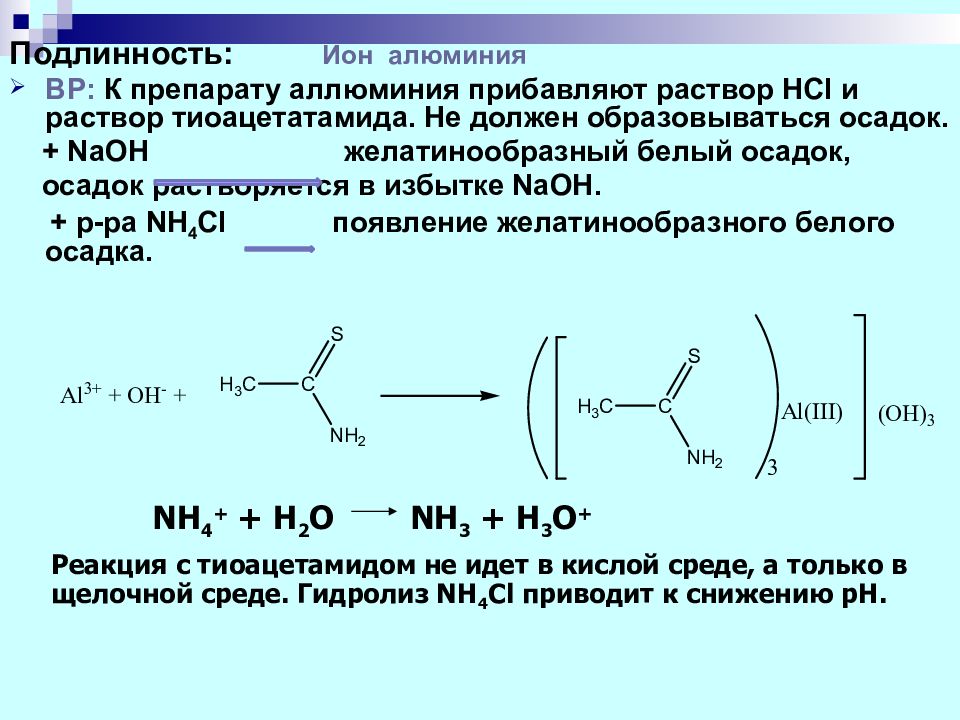
Подлинность : Ион алюминия ВР: К препарату аллюминия прибавляют раствор HCl и раствор тиоацетатамида. Не должен образовываться осадок. + NaOH желатинообразный белый осадок, осадок растворяется в избытке NaOH. + р-ра NH 4 Cl появление желатинообразного белого осадка. NH 4 + + H 2 O NH 3 + H 3 O + Реакция с тиоацетамидом не идет в кислой среде, а только в щелочной среде. Гидролиз NH 4 Cl приводит к снижению pH.
Слайд 64
ГФ: При прокаливании препарата, предварительно смоченного раствором нитрата кобальта, образуется плав, окрашенный в синий цвет, вследствие образования алюмината кобальта С o ( AlO 2 ) 2 - тенарова синь: 2Al(OH) 3 Al 2 O 3 + 3H 2 O 2Co(NO 3 ) 2 2CoO + 4NO 2 + O 2 Al 2 O 3 + CoO Co(AlO 2 ) 2 Неофицинальные реакции: 1. Гидроксид алюминия растворяют при нагревании в растворе NaOH. К прозрачному р-ру добавляют NH 4 Cl. Образуется белый студенистый осадок Al(OH) 3 (при добавлении к щелочному раствору гидроксида алюминия хлорида аммония, рН раствора понижается и гидроксид алюминия выпадет в осадок). Al(OH) 3 + NaOH Na[AI(OH) 4 ] 2[Al(OH) 4 ] - + NH 4 + Al 2 O 3. H 2 О + NH 3 комлпесообразования с ализарином образуется ализаринат алюминия красного цвета; с 8-оксихинолином образуется белое комплексное соединение, выпадающее в осадок с алюминоном образуется соединение в виде красного осадка.
Слайд 65: Оценка чистоты
ГФ: Допустимые примеси: карбонаты хлориды, железо, сульфаты, тяжелые металлы, мышьяк. Е P : Допустимые примеси: хлориды, сульфаты, тяжелые металлы, мышьяк. Е P : Микробиологическое загрязнение. Общее количество аэробных колоний не должно быть более чем 10 3 микроорганизмов на грамм. Оценка чистоты 65
Слайд 66
ЕР: Нейтрализующая способность. Диспергируйте 0,5 г препарата в 100 мл воды, нагрейте, добавьте 100 мл 0,1М хлороводородной кислоты, предварительно нагретой до 37 градусов; Измерить рН раствора через 10, 15, и 20 минут: должно быть не менее 1,8 ; 2,3 и 3,0 соответственно и далее во времени – не выше 4,5. Добавьте 10 мл 0,5М хлороводородной кислоты, предварительно нагретой, через 1 час титруйте 0,1 М раствором натрия гидроксида до рН 3,5. Должно потребоваться не более чем 35 мл 0,1 М раствора натрия гидроксида.
Слайд 67: Количественное определение
ГФ не приводит количественного определение данного препарата. 1.ЕР – комплексонометрическое определение (Метод обратного титрования ). Применяется, когда проведение прямого титрования затруднено из-за медленного протекания реакции образования комплексоната или невозможности подбора индикатора. Методика. К 20 мл раствора препарата добавляют 25 мл 0,1М ЭДТА и 10 мл смеси эквивалентный объемов растворов ацетата аммония и уксусной кислоты. Кипятят 2 мин., охлаждают и прибавляют 50 мл абсолютного этанола и 3 мл свежеприготовленного 0,025% раствора дитизона в абсолютном спирте. Титрант – цинка сульфат 1 мл 0,1М ЭДТА эквивалентен 5,098 мг алюминия. 67
Слайд 68
Прибавление избытка ЭДТА в раствор приводит к образованию комплексоната AlY - Al 3+ + H 2 Y 2- (изб) = AlY - + 2H + Индикатор – дитизон ( дифенилтиокарбазон ) – С 6 Н 5 -N=N-С(S)NНNН-С 6 Н 5 ( 2-фенилгидразид фенилазотиомуравьиной к-ты ). Присутствует в свободной форме HInd 2- ( зеленовато-голубая окраска) При титровании избыточных анионов H 2 Y 2- раствором цинка сульфата образуется комплексонат цинка H 2 Y 2- + Zn 2+ = ZnY 2- + 2H + В точке эквивалентности все анионы H 2 Y 2- оттитрованы, поэтому избыточная капля титранта приводит к образованию красновато-фиолетового комплекса дитизоната цинка ZnInd - HInd 2 - + Zn 2+ = ZnInd - + H +
Слайд 69
2. Гравиметрический метод: прокаливание, охлаждении и взвешивание образовавшегося оксида алюминия: t 2 Al ( OH ) 3 Al 2 О 3 + 3 H 2 O
Слайд 70: Применение
Антацидное средство. Антацидное действие основано на нейтрализации HCl (1 г препарата нейтрализует 250 мл 0,1 моль/л раствора HCl ): Al ( OH ) 3 + 3 HCl AlCl 3 + 3 H 2 O Значение рН желудочного сока постепенно повышается до 3,5-4,5 и остается на этом уровне в течение нескольких часов. Обладает также адсорбирующими и обволакивающими свойствами. В содержимом кишечника катион алюминия гидролизуется с образованием малорастворимых и невсасывающихся основных солей или гидроксида : AlCl 3 + 2H 2 O Al(OH) 2 Cl + 2HCl Кроме того в кишечнике возможно образование малорастворимого фосфата: Al 3+ + PO 4 3- AlPO 4 70
Слайд 71
В последнее время применяют ряд комбинированных готовых лекарственных препаратов: Альмагель ( Almagel ) – гель, 5 мл которого содержат 4,75 мл геля гидроокиси алюминия и 0,1 г магния окиси с добавлением D -сорбита. Альмагель А содержит дополительно 0.1 г анестезина. Применяют, если язвенная болезнь желудка или двенадцатиперстной кишки сопровождаются тошнотой, рвотой, болезненостью. Маалокс ( Maalox ) – комбинированный препарат в виде таблеток, содержащих по 0,4 г алюминия гидроокиси и гидроокиси магния, или суспензии, содержащей в 100 мл по 3,49 г алюминия гидроокиси и 3,99 г магния гидроокиси. Гастал ( Gastal ) – таблетки, содержащие 0,45 г алюминия гидроокиси в комбинации с магния карбонатом и магния окисью (0,3г). Хранение. Хранить в темном месте в хорошо закрытых банках.
Слайд 72: Алюминия фосфат Aluminii phosphatum Gel AlPO 4 122,0
Получение реакция взаимодействия сульфата алюминия с эквивалентным количеством фосфата натрия. При этом раствор должен иметь рН 4,0-4,5: Al 2 ( SO 4 ) 3 + 2 N а 3 РО 4 + n Н 2 O 2 AlPO 4. n Н 2 O + 3 N а 2 SO 4 Описание Белый рыхлый аморфный порошок. Практически не растворим в воде и в спирте. Растворим в разведенных минеральных кислотах. 72
Слайд 73
Подлинность (по ЕР) Препарат растворяют в хлороводородной кислоте, а далее – реакция на ион алюминия (c тиоацетатамидом ). Препарат растворяют в азотной кислоте, а далее – характерная реакция на фосфаты. Растворы фосфатов в разведенной азотной кислоте при взаимодействии с молибдатом аммония (NH 4 ) 3 MoO 4 при нагревании окрашиваются в желтый цвет, затем образуется желтый кристаллический осадок фосфомолибдата аммония: Осадок растворяется в азотной кислоте, растворах щелочей и аммиака, в присутствии большого количества фосфат-ионов ( с образованием желтого раствора) 73
Слайд 74
Оценка чистоты Допустимые примеси: хлориды (500 ррм ), сульфаты (0,2%), тяжелые металлы (10 ррм ), мышьяк (1 ррм ). растворимые фосфаты (не более 0,5% РО 4 3- )- с аммония молибдатом ). Измеряют абсорбцию испытуемого раствора и эталонного раствора при 400 нм. Растворимые соли алюминия (10 ррм ): к 16 г ЛС добавляем 50 мл воды, кипятим 5 мин., отмываем, центрифугируем. Титруем ЭДТА. Микробиологическое загрязнение. Общее количество аэробных колоний не должно быть более чем 10 3 микроорганизмов на грамм.
Слайд 75
рН = 6.0-8.0 Способность нейтрализовывать кислоты : 2 г Л C растворить в 30 мл 0,1 М HCl при 37 о С. Через 15 мин. рН= 2.0-2.5 Остаток при прокаливании при 500 о С 19-23% Микробиологическое загрязнение. Общее количество аэробных колоний не должно быть более чем 10 3 микроорганизмов на грамм. Перекиси (150 ррм ). Определения проводят с диванадием пентоксидом V 2 O 5, который в степени окисления +5 проявляют свойства окислителей ( по окраске не превосходит эталонный раствор)
Слайд 76
ЕР – комплексонометрическое определение (Метод обратного титрования ). Методика. К 50 мл раствора препарата (0.3 г ЛС) добавляют 10 мл 0,1М ЭДТА и 30 мл смеси эквивалентный объемов растворов ацетата аммония и уксусной кислоты. Кипятят 3 мин., охлаждают и прибавляют 25 мл абсолютного этанола и титруют. Титрант – цинка сульфат Точка эквивалентности – потенциометрически. 1 мл 0,1М цинка сульфата эквивалентен 12,2 мг алюминия фосфата. Содержание AlPO 4 19-21%
Последний слайд презентации: Лекция № 6 «Лекарственные средства производные р -элементов V гр. ПСЭ»
Применение. Как антацидное средство при язвенной болезни, гастритах, диспепсии. Хранение. В хорошо закрытых банках, в сухом прохлодном месте. Фосфалюгель ( Fosfalugel ). Препарат содержит около 23% алюминия фосфата, а также гель пектинов (растительных полисахаридов) и агара (полисахаридного препарата, содержащего 50-80% агарозы – линейного полисахарида). Гефал ( Gefal ) – содержит фосфат алюминия в виде суспезии (наполнители – сахар, нипагин, нипазол ) белого цвета, сладковатого вкуса, с запахом ароматических добавок. Выпускают в полиэтиленовых флаконах по 250 г. 77