Слайд 2
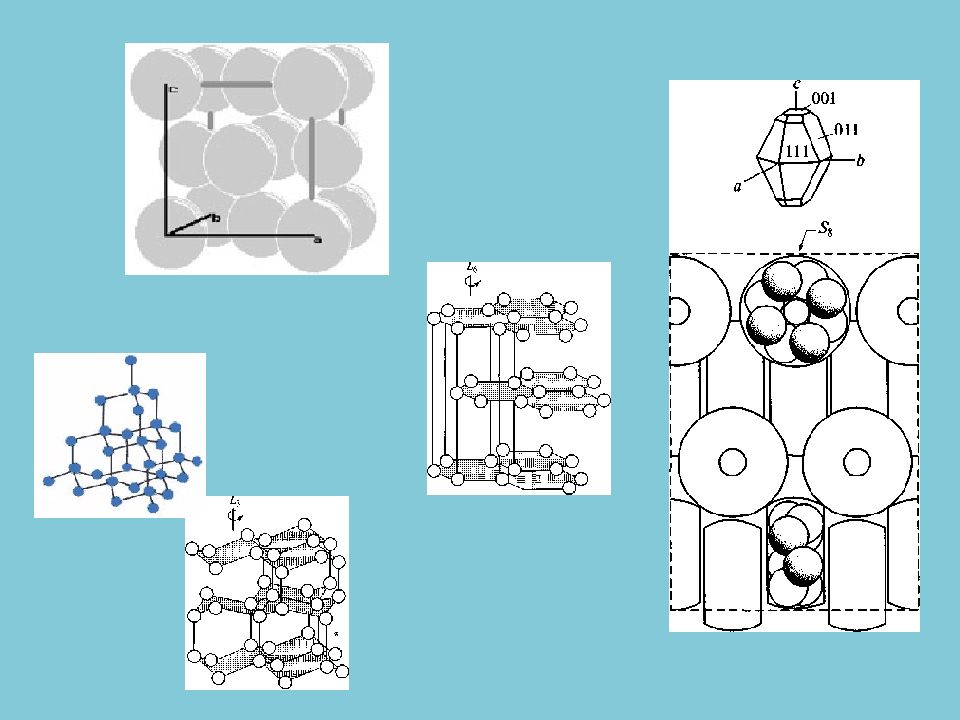
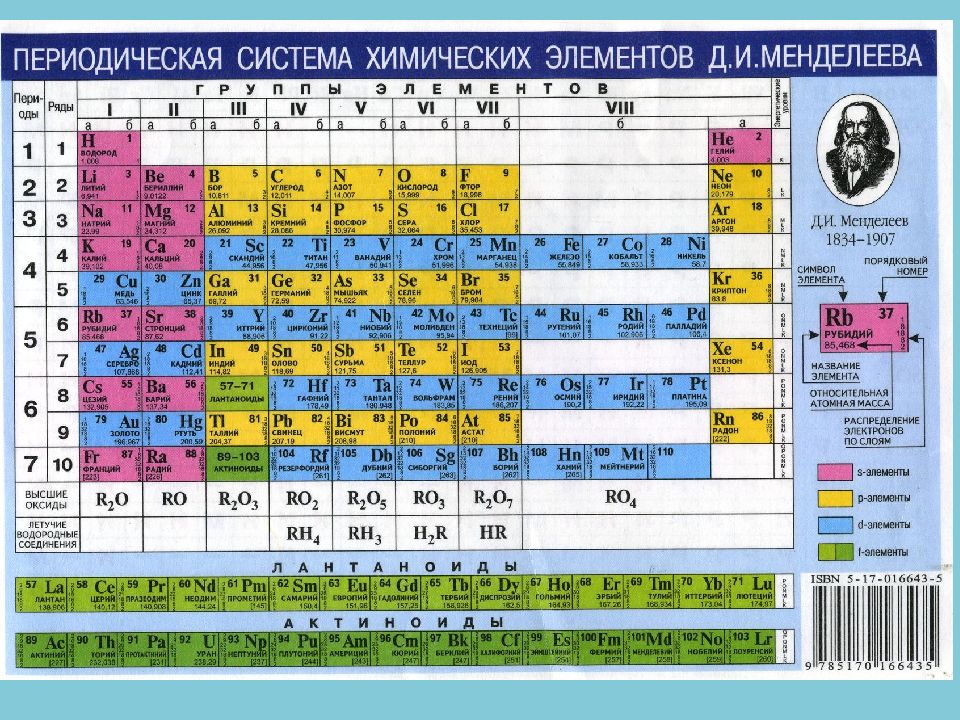
Все простые вещества — очень редкие минералы, суммарно они слагают не более 0,02 % массы земной коры. Известно около 100 самородных элементов (минералов).
Слайд 3: Самородные элементы
Газообразные (кислород, азот, водород, инертные газы); Жидкие (ртуть, амальгамы золота и серебра); Твердые самородные вещества (минералы).
Слайд 4: Твердые самородные минералы
элементарные вещества (как говорят, самородные элементы), например графит С, алмаз С, медь С u, висмут Bi делятся на: Самородные металлы (золото, серебро, медь, железо, платина, висмут, сурьма, мышьяк и др.); Самородные неметаллы (сера, алмаз, графит); твердые растворы (изоморфные смеси) металлов друг в друге, например, минералы состава ( Au, Ag ), ( Au, С u ), ( Pt, Fe ), ( Os, Ir ); особые химические соединения — интерметаллиды Pt 3 Sn, Pt 2 FeNi, Cu 3 Au 2, Cu 7 Hg 6 и др.
Слайд 5: Кристаллохимические особенности
Большинство самородных металлов и твердые растворы металлов друг в друге имеют структуру, отвечающую плотнейшим упаковкам — кубической или гексагональной. Чем сильнее химические свойства и характер связей в простом веществе отличаются от металлических, тем более структура минерала отходит от идеальной, плотнейшей упаковки.
Слайд 7
Формы выделений самородных элементов (минералов) разнообразны: каплевидные зёрна; идиоморфные или нитевидные кристаллы, проволочно-вытянутые формы; плоские дендриты; ксеноморфные угловатые или пластинчатые (плёночные) образования (по границам сопутствующих минеральных индивидов и по трещинам).
Слайд 8: Морфология и физические свойства
Габитус кристаллов : Металлы - куб, октаэдр, ромбододекаэдр; Неметаллы – Ромбические и гексагональные пирамиды, би- и дипирамиды, комбинации с участием пинакоидов и др. (только у алмаза кристаллы изометрического габитуса кубической и октаэдрической формы)
Слайд 9
Для металлических минералов характерно: - металлический блеск; - высокая теплопроводность; - высокая электропроводность; - ковкость; - высокий удельный вес; - у многих ( Au, Ag, Cu) низкая твердость; - часто крючковатый излом - несовершенная спайность.
Слайд 10
Для неметаллических минералов характерно: - относительно низкая плотность (до 3,5 – алмаз); - различная твердость (от 1 до 10); - различная спайность (от совершенной до несовершенной); - плохая тепло и электропроводность (исключение графит); - раковистый и неровный излом.
Слайд 11: Условия образования
Малая химическая активность элементов ( Au, Pt, Ir, Os) ; Малая химическая активность кислорода в среде минералообразования (Fe- теллурическое и Cu в основных породах ) ; Приповерхностное окисление некоторых руд (например, халькопирита ( CuFeS 2 )); биохимические реакции ( S) ; Падение метеоритов ( Fe - метеоритное ( камасит ), S, C (лонсдейлит)).
Слайд 12: Золото (Au)
Форма Кристаллы – октаэдры, реже – ромбододекаэдры и кубы. Чаще в виде зерен, ден-дритов, пленок, вкраплений. Сингония Кубическая Цвет Золотисто-желтый Цвет черты От золотисто-желтого до серебряно-белого Блеск Металлический Твёрдость 2-3 Спайность Весьма несовершенная Излом Неровный Особое свойство Тугоплавко, растворяется только в царской водке. Очень высокая плотность – от 15 до 19.
Слайд 13
Медь (Cu) Форма Кристаллы редки (куб,октаэдр,ромбододекаэдр). Чаще в виде дендритов, тонких пластинок, порошковатых скоплений и сплошных масс. Сингония Кубическая Цвет Медно-красный Цвет черты Медно-красный, блестящий Блеск Металлический Твёрдость 2,5-3 Спайность Весьма несовершенная Излом Крючковатый, неровный Особое свойство Иногда имеет побежалость
Слайд 14
Платина (поликсен) Pt Форма Кристаллы редки. Встречается в виде самородков, неправильных зерен, конкреций, сталактитовых форм Сингония Кубическая Цвет Разный: серовато-серебристый, свинцово-серый, желтоватый, черный Цвет черты Стально-серый Блеск Яркий или тусклый металлический Твёрдость от 4 до 7 Спайность Весьма несовершенная Излом Крючковатый, неровный Особое свойство Иногда магнитен. Очень высокая плотность (выше 19)
Слайд 15
Самородное железо (теллурическое) Fe Форма Кристаллы редки. Встречается в виде плотных зерен с неправильными извилистыми очертаниями, губчатых скоплений в базальтовых породах Сингония Кубическая Цвет Стально-серый в свежем изломе Цвет черты Блестящий серо-черный Блеск Металлический Твёрдость 4 -5 Спайность Весьма несовершенная Излом Крючковатый, неровный Особое свойство Сильно магнитен.
Слайд 16
Серебро (А g) Форма Кристаллы редки (куб, октаэдр). Встречается в виде дендритов, волосовидных образований (часто скрученных и изогнутых), неправильных зерен, самородков. Сингония Кубическая Цвет Серебряно-белый свежем изломе Цвет черты Белый, блестящий Блеск Металлический Твёрдость 4 -5 Спайность Весьма несовершенная Излом Крючковатый
Слайд 17
Алмаз (С) Форма Кристаллы обычны. Облик кристаллов окта-эдрический, реже кубический, ромбо- и тетраэдрический. Сингония Кубическая Цвет Бесцветный водяно-прозрачный, но может быть и окрашенным Блеск Алмазный до жирного Твёрдость 10 Спайность Средняя Излом Раковистый Особое свойство Самый твердый минерал на Земле
Слайд 18
Форма Тонкочешуйчатые, землистые агрегаты, пластинки и сферические радиально-лучистые агрегаты. Сингония Гексагональная Цвет Темно-серый, железо-черный Цвет черты Темно-свинцово-серая Блеск Полуметаллический, матовый Твёрдость 1 Спайность Совершенная Излом Зернистый, ровный Особое свойство Тепло- и электропроводен, жирен на ощупь Графит (С)
Слайд 19
C ера ( S ) Форма Сплошные массы, натечные, шаровидные, почковидные и сталактитовые образования. Кристаллы бипирамидального и толстотаблитчатого вида. Сингония Ромбическая и две моноклинные Цвет Желтый, зеленоватый Цвет черты Бесцветный Блеск Алмазный на гранях, жирный на изломе Твёрдость 1-2 Спайность Несовершенная Излом Неровный Особое свойство Хороший изолятор
Слайд 21: Сульфиды
природные соединения металлов и некоторых неметаллов с S. В химическом отношении - соли сероводородной кислоты H 2 S. Главнейшие элементы, образующие сульфиды: Fe, Zn, Cu, Mo, Ag, Hg, Pb, Bi, Ni, Co, Mn, V, As, Sb. К сульфидам относят и близкие к ним по свойствам антимониды, арсениды, селениды и теллуриды. Отмечается изоморфное замещение одних химических элементов другими и примесь редких элементов ( Cd,Ga,In,Re и др.) .
Слайд 22
Сульфиды составляют около 0,15 % массы земной коры. Выделяют около 600 минеральных видов сульфидов и их аналогов.
Слайд 23
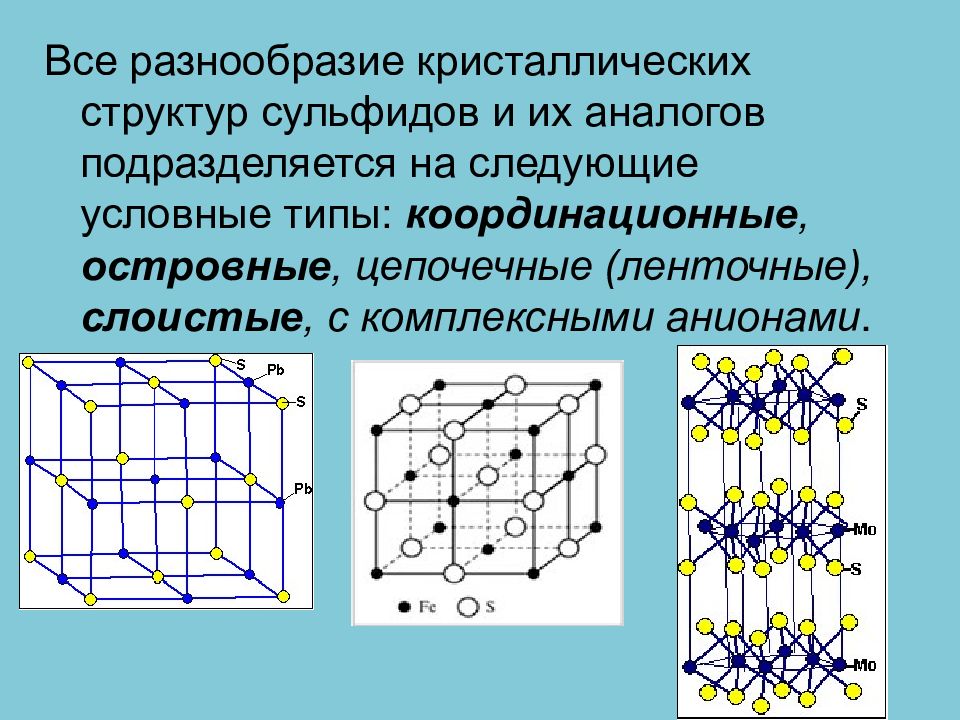
С позиций общей химии сернистые соединения можно разбить на четыре класса : 1. простые сульфиды - соли сероводородной кислоты (сфалерит ZnS, киноварь HgS, сульфид молибдена ( IV ) — молибденит MoS 2 и др.);
Слайд 24
2. сложные сульфиды, это двойные и многокомпонентные соли сероводородной кислоты ( халькопирит CuFeS 2, борнит Cu 5 FeS 4, станнин Cu 2 FeSnS и др. );
Слайд 25
3. Соли тиокислот (сульфокислот), т.е. бескислородных кислот, в которых роль кислорода играет сера. Например, прустит Ag 3 ( SbS 3 ) — это серебряная соль сурьмяной сульфокислоты H 3 SbS 3 ;
Слайд 26
4. полисернистые соединения (персульфиды), они формально трактуются как соли полисернистой кислоты H 2 S 2 со своеобразным комплексным двухзарядным анионом ( S 2 ) 2- в их кристаллических сруктурах (дисульфид железа ( II ) — пирит Fe ( S 2 ) и др.).
Слайд 27
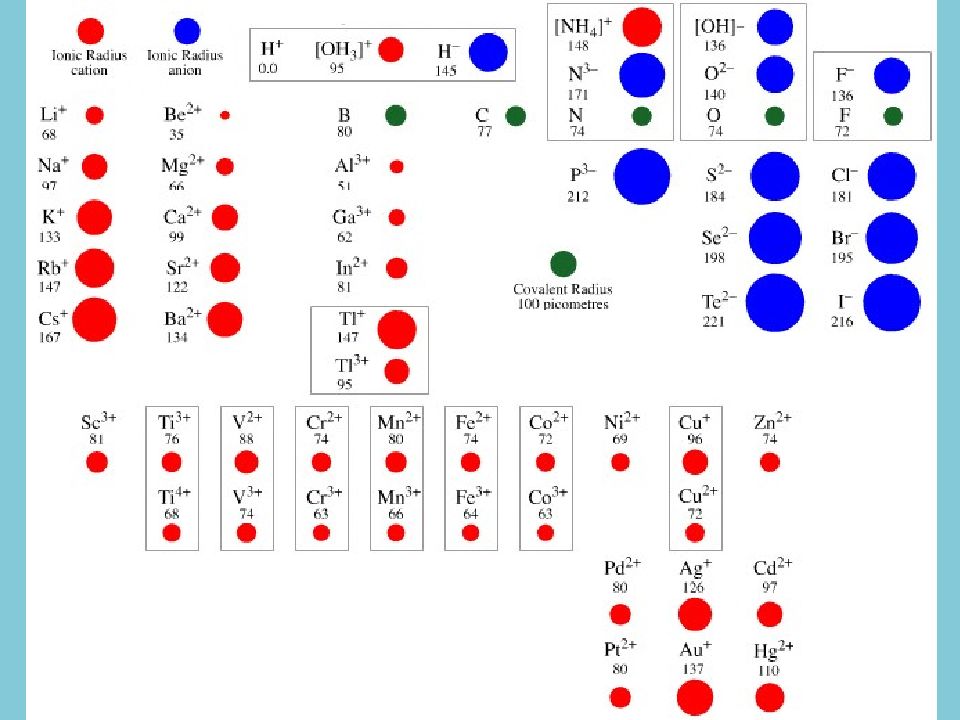
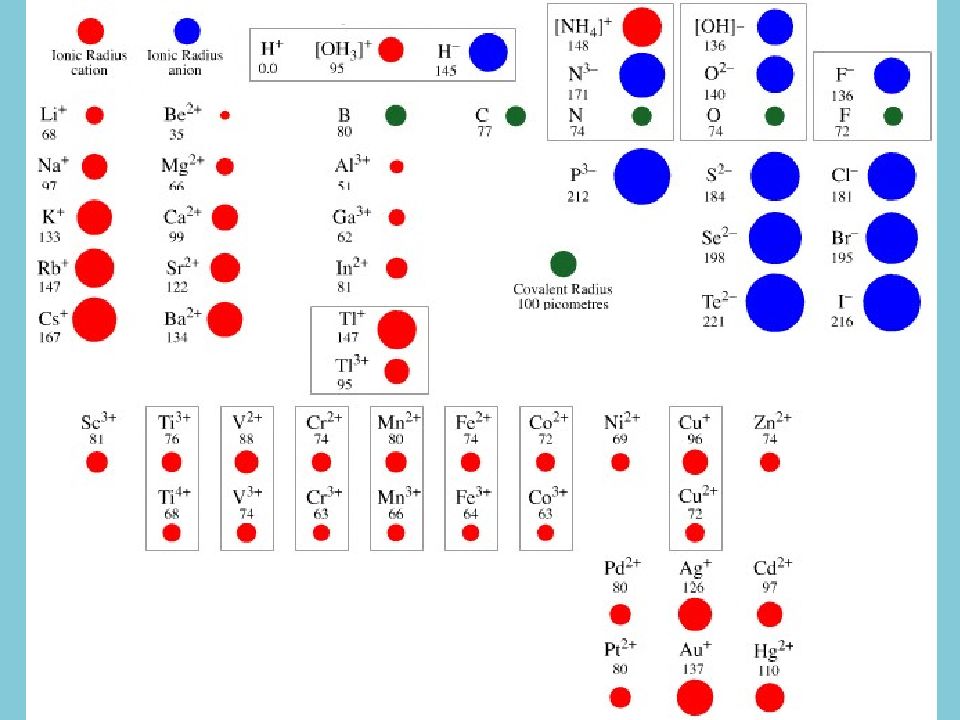
Для сульфидов характерно сочетание в кристаллических постройках этих минералов типичного ионообразователя (серы) и типичных металлов (железа, меди, свинца, цинка и др.). Важно и соотношение их размеров: радиус S 2- составляет 0,184 нм, радиусы Pb 2+, Fe 2+, Co 2+, Zn 2+, — соответственно 0,119, 0,078, 0,075, 0,074 нм
Слайд 28
Разница в ионных радиусах приводит к формированию неплотных упаковок атомов и ионов, что вызывает низкую химическую устойчивость атомов в кристаллических структурах. Атомы серы способны к легкой поляризации ионов, что вызывает возникновение ионно-ковалентно-металлических химических связей.
Слайд 29
Все разнообразие кристаллических структур сульфидов и их аналогов подразделяется на следующие условные типы: координационные, островные, цепочечные (ленточные), слоистые, с комплексными анионами.
Слайд 30
Физические свойства сульфидов очень специфичны. Внешне они подобны металлам - непрозрачны, имеют металлический или металловидный блеск, цвета, как и у металлов, в большинстве случаев серо-черные и желтые (реже — красные и синие) разной интенсивности и оттенков, электропроводны, высокая плотность. ( Все эти особенности физических свойств обусловлены смешанным, частично металлическим характером химических связей в сульфидах.)
Слайд 31
Все сульфиды, за исключением персульфидов, обладают относительно низкой твердостью — от 1 до 5 (т.е. мягче стекла). Твердость персульфидов ( пирита, кобальтина, марказита, арсенопирита ) равна или более 5, что предопределено проявлением в них преимущественно ковалентных, сильных связей внутри островных группировок
Слайд 32: Сульфиды железа
Пирит FeS 2 Марказит FeS 2 Пирротин FeS Пентландит [Fe,Ni] 9 S 8 Арсенопирит FeAsS
Слайд 34: Сульфиды остальных металлов
Галенит PbS C фалерит ZnS Киноварь HgS Молибденит MoS 2 Аурипигмент As 2 S 3
Слайд 36: Оксиды и гидроксиды - соединения металлов и металлоидов с кислородом и гидроксилом (ОН)
Слагают около 17% массы земной коры; Общее количество – около 300 минералов; Наиболее распространены оксиды и гидрооксиды Si ( 12,6% массы земной коры), Fe ( 4%), Al, Mn, Ti, Cr ; Преобладает ионный тип химической связи ; Кристаллохимические структуры обычно характеризуются тетраэдрической и октаэдрической группировкой кислорода и гидроксильных групп.
Слайд 37
Физические свойства оксидов связаны с кристаллохимической структурой. Оксиды, как правило, имеют большую твердость, высокую химическую стойкость, тугоплавкость, низкую растворимость. Удельный вес зависит от состава катионов.
Слайд 38
Гидроксиды за счет присутствия гидроксил-ионов имеют менее плотную упаковку частиц. Это приводит к меньшей твердости, более яркому цвету и лучшей спайности. Гидроксиды трехволентных металлов обычно более твердые, чем гидроксиды двухвалентных и металлов с переменной валентность ( Fe).
Слайд 39
Цвет – разнообразен. Оксиды Mg, Al, P в чистом виде бесцветны; Оксиды Mn, Fe, Cr – как правило окрашены в различные цвета (в т.ч. черный) и чеще всего непрозрачны. Плотность – повышенная (у оксидов значительно больше плотности гидрооксидов).
Слайд 40
Большинство оксидов имеет эндогенное происхождение (магматическое и метаморфическое), а также гидротермальное. Большинство гидроксидов образуется на поверхности ( в результате выветривания (гипергенеза)) и окисления эндогенных минералов.
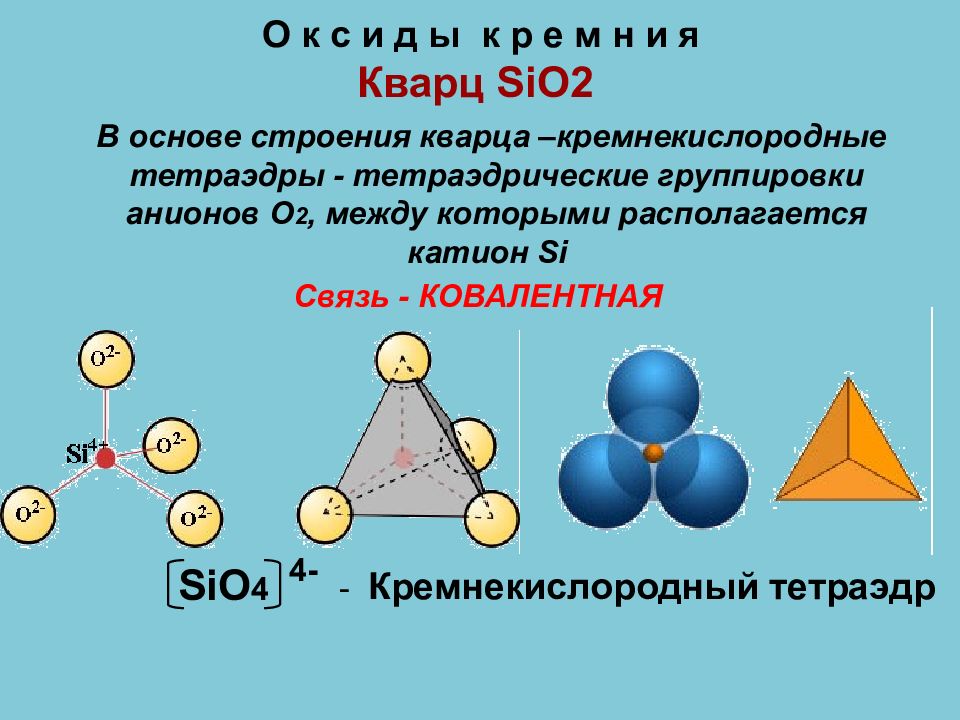
Слайд 41: О к с и д ы к р е м н и я Кварц SiO2
SiO 4 - Кремнекислородный тетраэдр 4- В основе строения кварца –кремнекислородные тетраэдры - тетраэдрические группировки анионов О 2, между которыми располагается катион Si Связь - КОВАЛЕНТНАЯ
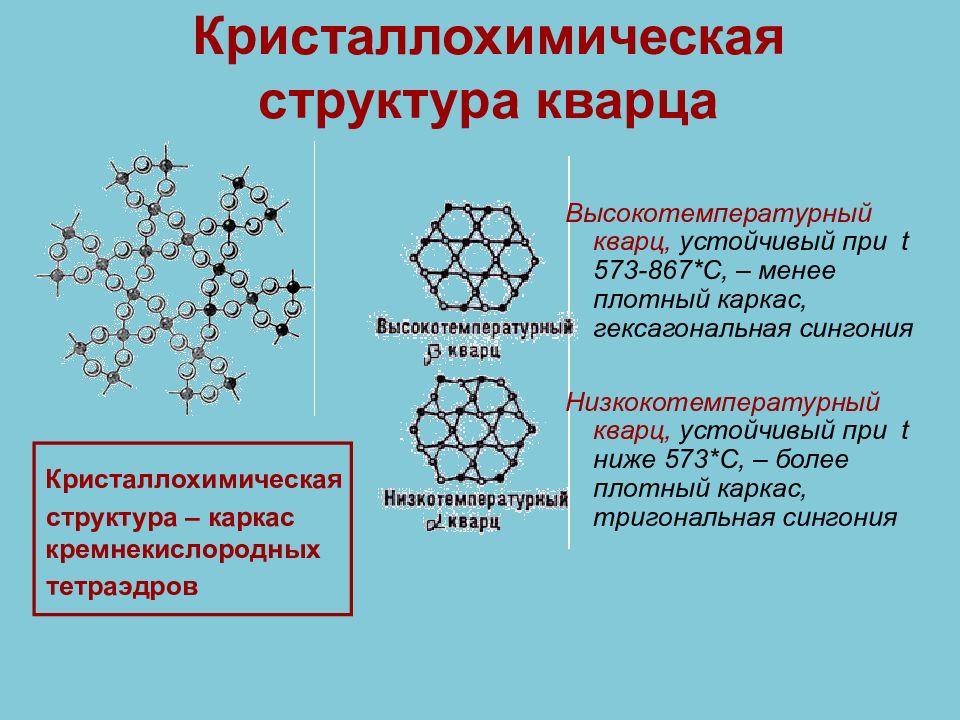
Слайд 42: Кристаллохимическая структура кварца
Кристаллохимическая структура – каркас кремнекислородных тетраэдров Высокотемпературный кварц, устойчивый при t 573-867*C, – менее плотный каркас, гексагональная сингония Низкокотемпературный кварц, устойчивый при t ниже 573*C, – более плотный каркас, тригональная сингония
Слайд 43: Свойства кварца
Форма Кристаллы гексагональные, трапецоэдрические, бипирамидальные. Характерны друзы, щетки, жеоды, кристаллические и зернистые агрегаты Сингония Тригональная у альфа-кварца, гексагональная у бета-кварца Цвет Бесцветен. Окраска обусловлена механическими включениями и дефектами в кристаллической решетке Блеск Стеклянный на гранях, жирный на изломе Твёрдость 7 Спайность Весьма несовершенная Излом Раковистый, неровный
Слайд 44: Разновидности кварца
Аметист Розовый кварц Морион Цитрин Белый кварц Раухтопаз Горный хрусталь Празем
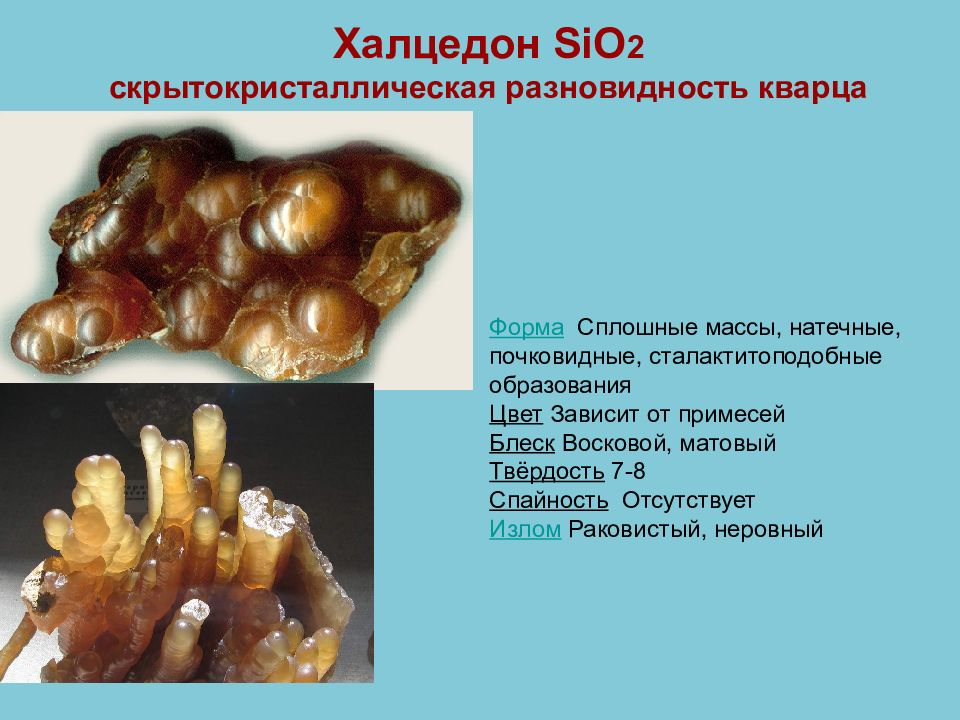
Слайд 45: Халцедон SiO 2 скрытокристаллическая разновидность кварца
Форма Сплошные массы, натечные, почковидные, сталактитоподобные образования Цвет Зависит от примесей Блеск Восковой, матовый Твёрдость 7-8 Спайность Отсутствует Излом Раковистый, неровный
Слайд 48: Опал SiO 2 nH 2 O (аморфный)
Молочный опал Форма Плотные стеклоподобные натечные массы, конкреции, корки, оолиты, псевдоморфозы Цвет Зависит от примесей Блеск Восковой, матовый Твёрдость от 1 до 6 Спайность Отсутствует Излом Раковистый Огненный опал
Слайд 50: О к с и д ы и г и д р оо к с и д ы ж е л е з а Гётит FeOOH и Гидрогётит FeOOH nH 2 O
Гётит Форма Кристаллы – волокнистые, игольчатые, столбчатые – редки. Сплошные, пористые, ноздреватые массы. Почковидные, сталактитовые, оолитовые образования Сингония Ромбическая Цвет Темно-бурый, черный, ржаво-бурый Цвет черты Желтовато-бурый Блеск Полуметаллический, матовый Твёрдость 5-5,5 Спайность Совершенная Гидрогётит
Слайд 51: Гематит Fe 2 O 3 и Гидрогематит Fe 2 O 3 nH 2 O
Гидрогематит тонкокристал- лический гематит, содержащий до 8% воды. Форма Кристаллы пластинчатые и ромбо-эдрические, реже призмати-ческие и скаленоэдрические. Натечные, почковидные массы. Землистые, чешуй-чатые, зернистые агрегаты Сингония Тригональная Цвет Стально-серый, у скрытокристаллических агрегатов – матово-красный Черта Вишнево-красная Блеск Полуметаллический, металлический, матовый Твёрдость 5-6 Спайность Отсутствует Гематит
Слайд 52: Формы выделений гематита
Скрытокристаллический агрегат Железная слюдка Натечные массы Почковидные массы Крупнокристаллический агрегат Гематитовая «роза»
Слайд 53: Магнетит FeFe 2 O 4 ( магнитный железняк)
Форма Кристаллы окта-эдрического, реже додека-эдрического облика. Крис-таллические и зернистые массы, вкрапления в изверженных породах Сингония Кубическая Цвет Железо-черный Черта Черная Блеск Полуметаллический, матовый Твёрдость 5,5-6 Спайность Отсутствует Излом Неровный Особое свойство Сильно магнитен Псевдомор- фоза гематита по магнетиту
Слайд 54: Хромит FeCr 2 O 4 ( хромистый железняк)
Форма Зернистые массы, вкрапленные округлые зерна, редко кристаллы окта-эдрического облика. Сингония Кубическая Цвет Черный Черта Коричневая, бурая Блеск Металлический Твёрдость 5,5-7,5 Спайность Отсутствует Излом Неровный
Слайд 55: Оксиды и гидроксиды алюминия
Боксит – сложная смесь минералов гидроксидов Al и Fe с глинистыми минералами. Представлен рыхлыми глинистыми массами, оолитами, реже – уплотненными породами.
Слайд 56: Гидраргиллит (гиббсит) Al(OH) 3
Г и д р о к с и д ы а л ю м и н и я Форма Кристаллы таблитчатого или столбчатого вида. Листоватые, чешуйчатые, волокнистые, натечные образования Сингония Ромбическая Цвет Белый, желтовато-бурый, серый, зеленоватый, розовый Черта Белая Блеск Стеклянный, перламутровый Твёрдость 2 - 3 Спайность Совершенная
Слайд 57
Диаспор AlOOH Гидроксиды алюминия Форма Кристаллы таблитчатого или столбчатого вида. Листоватые, чешуйчатые, волокнистые, натечные образования Сингония Ромбическая Цвет Белый, желтовато-бурый, серый, зеленоватый, розовый Черта Белая Блеск Стеклянный, перламутровый Твёрдость 6,5-7 Спайность Совершенная Полиморфная модификация – бёмит (менее твердый-3,5)
Слайд 58: Корунд Al 2 O 3
Форма Кристаллы призмати-ческие, дипирамидальные, бочонкообразные. Мелко-зернистые агрегаты. Сингония Тригональная Цвет Обычно синевато- или желтовато-серый Блеск Стеклянный, алмазный Твёрдость 9 Спайность Отсутствует Излом Неровный, раковистый
Слайд 59: Драгоценные разновидности корунда
Ограненный кристалл сапфира Рубин Сапфир
Слайд 60: Пиролюзит MnO 2
Форма Кристаллы призмати-ческие, но встречается, как правило, в землистых, сажис-тых, сплошных кристалличес-ких и скрытокристаллических массах. Иногда лучистые агрегаты. Корки. Конкреции. Сингония Тетрагональная Цвет Черный, на кристаллах стально-серый Черта Черная Блеск Металлический, матовый Твёрдость 6-6,5 для кристал-лов, 1-2 для землистых разностей Спайность Совершенная Излом Неровный, раковистый
Слайд 61: Касситерит SnO 2
Форма Кристаллы дипирами-дальные, призматические – хорошо выражены. Встречается в кристалличес-ких агрегатах и вкрапленниках в горные породы. Сингония Тетрагональная Цвет Разный, от бесцветного до черного Блеск От алмазного до смоля-ного, полуметаллического и матового Твёрдость 6-7 Спайность Несовершенная Излом Неровный, полурако-вистый
Слайд 62
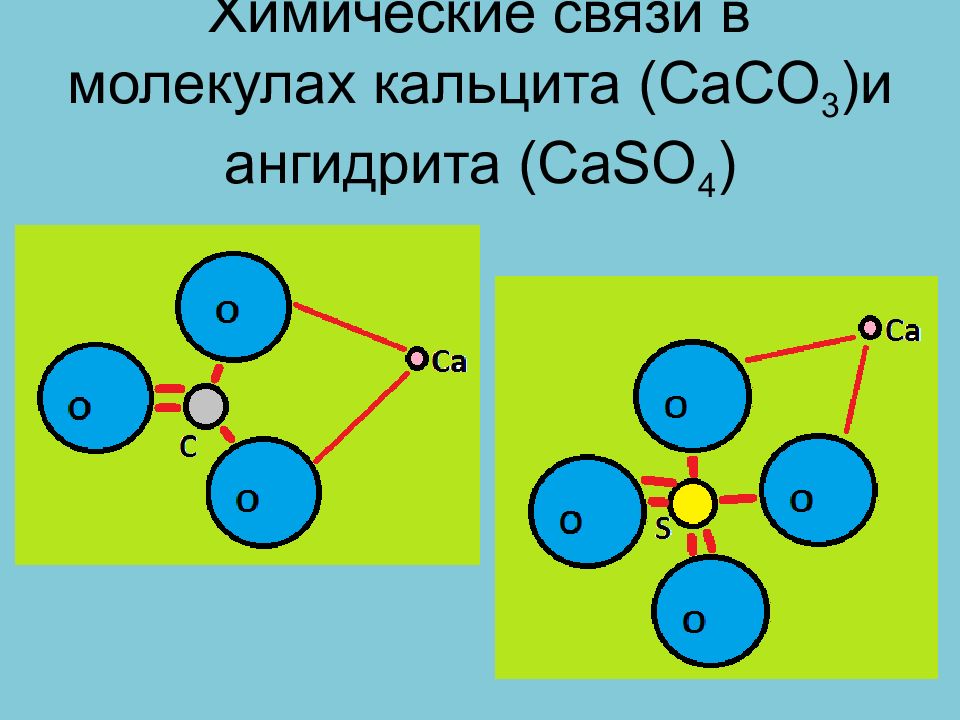
Соли кислородных кислот Для всех этих минералов характерно наличие в их структуре комплексных анионов с ковалентной связью внутри аниона по донорно-акцепторному механизму. Между комплексным анионом и катионом связь, как правило, ионная.
Слайд 67: Соли кислородных кислот
Карбонаты – соли угольной кислоты, анион (CO 3 ) 2- ; Сульфаты – соли серной кислоты, анион ( SO 4 ) 2- ; Фосфаты –соли фосфорной кислоты, анион ( PO 4 ) 3-
Слайд 68
Минералы этих классов – соединения соответствующих анионов с двухвалентными щелочно-земельными металлами ( Ca, Mg, Ba, Sr, реже Fe, Cu, Pb, Zn). Общие свойства: светлые, низкая твердость, низкая плотность, часто средняя и совершенная спайность, стеклянный блеск.
Слайд 81: Галогенные соединения
Катионы – щелочные ( K,Na) и щелочно-земельные ( Ca, Mg) металлы, реже Fe, Pb ; Анионы – Cl, F, Br, I. Отличаются координационно-ионной структурой, кристаллизуются в кубической сингонии. Твердость – низкая, плотность – средняя, спайность – часто совершенная. Многие минералы хорошо растворимы в воде.