Первый слайд презентации
Төмен молекулалық биологиялық заттар Лектор: х.ғ.д., профессор Шоинбекова Сабина Алимжановна
Табиғи биологиялық белсенді қосылыстар. Органикалы қ қ осылыстардың классификациясы ; Функционалды топтар, түрлері ; Химиялық байланыстар; Индуктивті және мезомерлі эффекттер.
Слайд 3
« Төмен молекулалы биологиялық заттар » - ол тірі организмнің құрамындағы заттардың құрамын, құрылысын, қасиеттерін, атқаратын қызметтерін, құбылыстарын зерттейтін пән. «Төмен молекулалы биологиялық заттар » органикалық химияның теориялық негіздерімен, биологиямен (биохимия, физиология) және физикамен ( физикалық химия, биофизика) тығыз байланысты.
Слайд 4
Органикалық химия органикалық қосылыстардың алу әдістерін, құрамын, құрылысын, қасиеттерін, құбылыстары мен ыдырауын зерттейді. Бұл терминді швед химигі Й.Я. Берцелиус 1808 жылы енгізген, тарихи аты осы күнге дейін қолданылады ( карбидтер, карбонаттар, оксидтер, СО 2 -бейорг. қос-р ).
Слайд 5: Органикалық химияның дамуы
Органикалық қосылыстардың ерекшеліктері: Изомерия; Молекулалардың конформациясы; Органикалық қосылыстардың алуантүрлілігі және күрделі құрылысы; Молекулалардың төмен реакциялық қабілеттілігі; Атомдардың өзара әсері және орынбасушылардың электронды эффекттері; С С, СН байланыстарындағы химиялық реакциялардың қайтымсыздығы; Стериалық (кеңістік) факторлар; Молекулаларда бос радикалды ыдырауы басымды келеді; С С, СН байланыстар д ын төмен полярлығы. 5
Слайд 6
6 «Төмен молекулалық биологиялық қосылыстар» органикалық химия пәнімен тікелей байланысты. «Органикалық химия адамды ақыл есінен айыра алады. Ол жұмбақ, ғажайыпқа толы, қызықтыратын тропикалық орман секілді. Бұл сұмдық қорқынышты шексіз орманнан шығу мүмкін емес, оған кіру қорқынышты….». Фридрих Велер (1835) Фридрих Велер (1800-1882)
7 Органикалық қосылыстардың құрылымдық теориясы. Радикалдар теориясы (Л. Гей-Люссак (1815), Ф. Велер (1832). Типтер теориясы (Ш. Жерар, 1840-1854); Фридрих Кекуле (1857) – көміртек – төрт атомды. Фридрих Август Кекуле 7. IX. 1829 – 13. VII. 1896 ЖЕРАР Шарль Фредерик (21.VIII.1816 - 19.VIII.1856)
Слайд 8
8 О рганикалық қосылыстардың құрылымдық теориясының негізгі қағидалары: (1861) БУТЛЕРОВ Александр Михайлович 3(15) қыркүйек 1828 ж. – 5(17) тамыз 1886 ж.
1) Атомдар молекулада өздерінің валенттілігіне сәйкес химиялық байланыстармен байланысқан ; 2) Атомдар органикалық қосылыстардың молекулаларында өзара белгілі ретпен орналасады ; 3) Органикалық қосылыстардың қасиеттері молекуланың құрамына кіретін тек атомдардың санына, табиғатына ғана емес, химиялық құрылысына тәуелді ; 4) Молекулада тікелей байланысқан және байланыспаған атомдар бір біріне әсер етеді ; 5) Заттың химиялық құрылысы оның қасиеттерін сиппаттайды, керісінше заттың химиялық алмасуларын зерттеп, заттың химиялық құрылысын анықтауға болады.
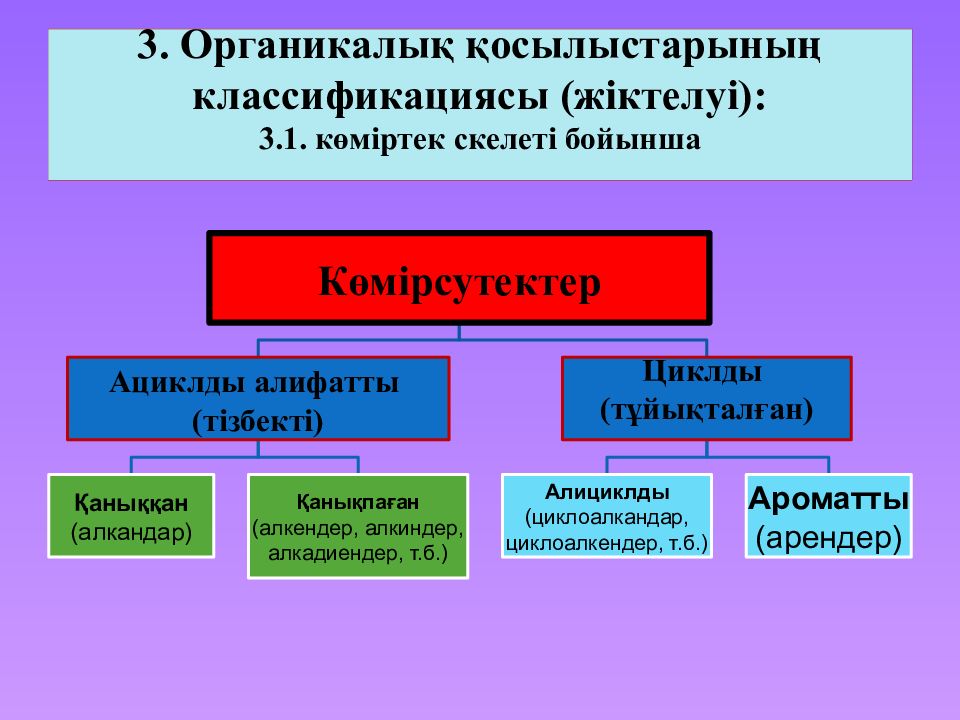
Слайд 10: 3. Органикалық қосылыстарының классификациясы ( жіктелуі ): 3.1. көміртек скелеті бойынша
Слайд 11: Функционалды топтар
Функционалды топтар – ол – қосылыстың химиялық қасиеттерін анықтайтын және белгілі бір класқа жіктейтін атомдар немесе атом топтары. Функционалды топтардың құрамына: Н, О, N, Р, S элементтері және галогендер – олар - органогендер деп аталады.
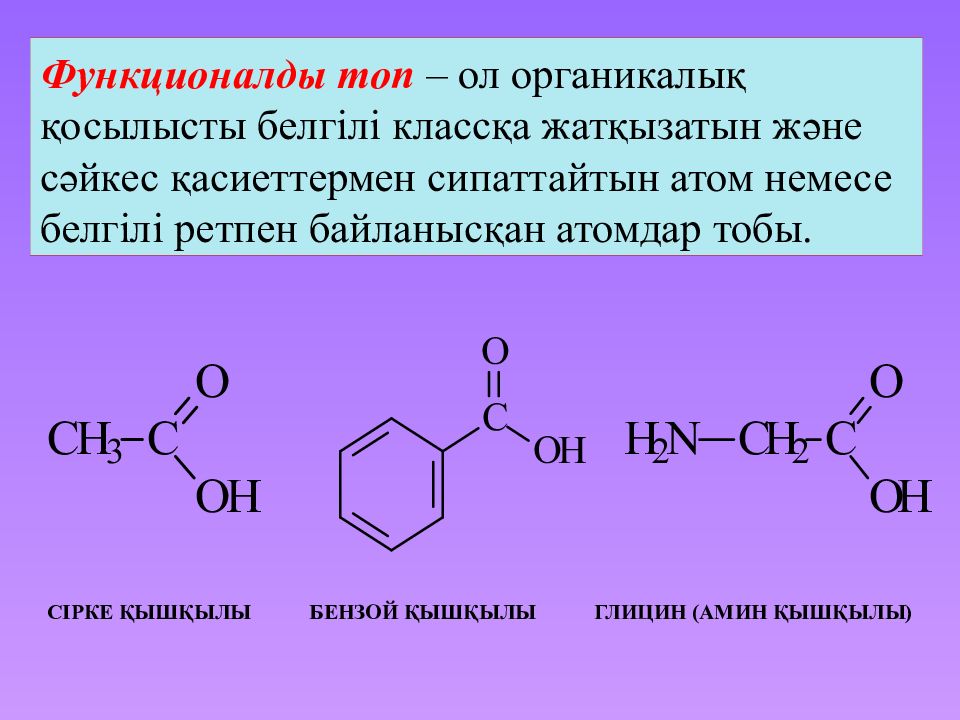
Слайд 12: Сірке қышқылы бензой қышқылы глицин (амин қышқылы )
Функционалды топ – ол органикалық қосылысты белгілі классқа жатқызатын және сәйкес қасиеттермен сипаттайтын атом немесе белгілі ретпен байланысқан атомдар тобы. Сірке қышқылы бензой қышқылы глицин (амин қышқылы )
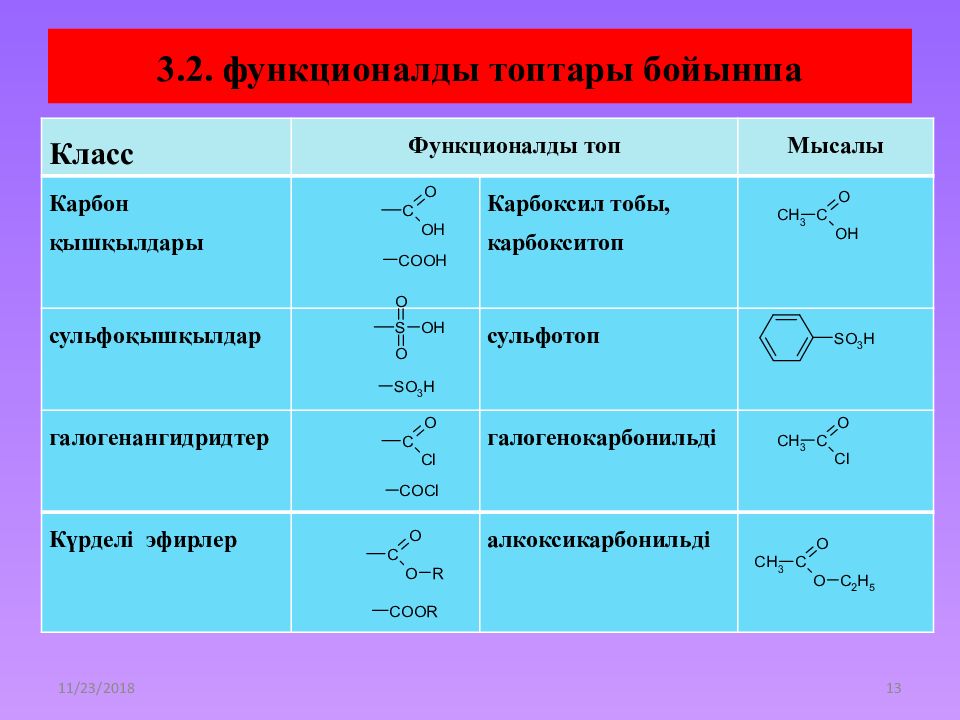
Слайд 13: 3.2. функционалды топтары бойынша
21.12.2014 13 3.2. функционалды топтары бойынша Таблица 1. Классы органических соединений Класс Функционалды топ Мысалы Карбон қышқылдары Карбоксил тобы, карбокситоп сульфоқышқылдар сульфотоп галогенангидридтер галогенокарбонильді Күрделі эфирлер алкоксикарбонильді
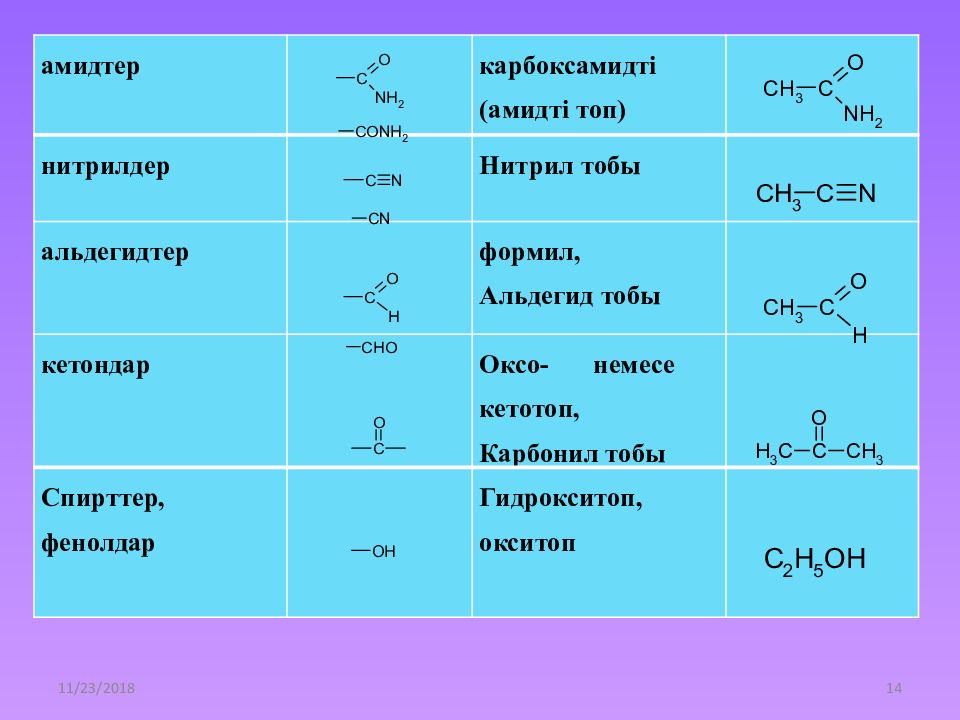
Слайд 14
21.12.2014 14 амидтер карбоксамидті ( амидті топ) нитрил дер Нитрил тобы альдегидтер формил, Альдегид тобы кетондар Оксо - немесе кетотоп, Карбонил тобы Спирттер, фенолдар Гидрокситоп, окситоп
Слайд 15
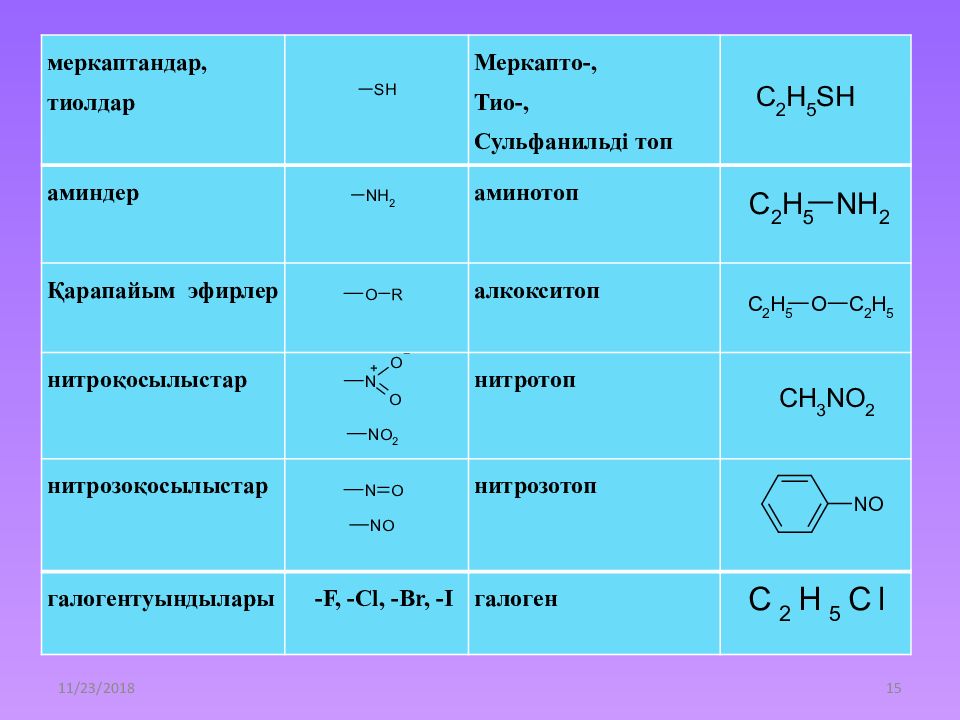
21.12.2014 15 меркаптандар, тиолдар Меркапто -, Тио-, Сульфанильді топ аминдер аминотоп Қарапайым эфирлер алкокситоп нитроқосылыстар нитротоп нитрозоқосылыстар нитрозотоп галогентуындылары - F, - Cl, -Br, -I галоген
Слайд 16
Органикалық қосылыстарда бірнеше функционалды топтар болуы мүмкін: Ф ункционалды топтар бірдей болса, олар полифункционалды деп аталады; Ф ункционалды топтар әртүрлі болса, олар гетерофункционалды қосылыстар деп аталады.
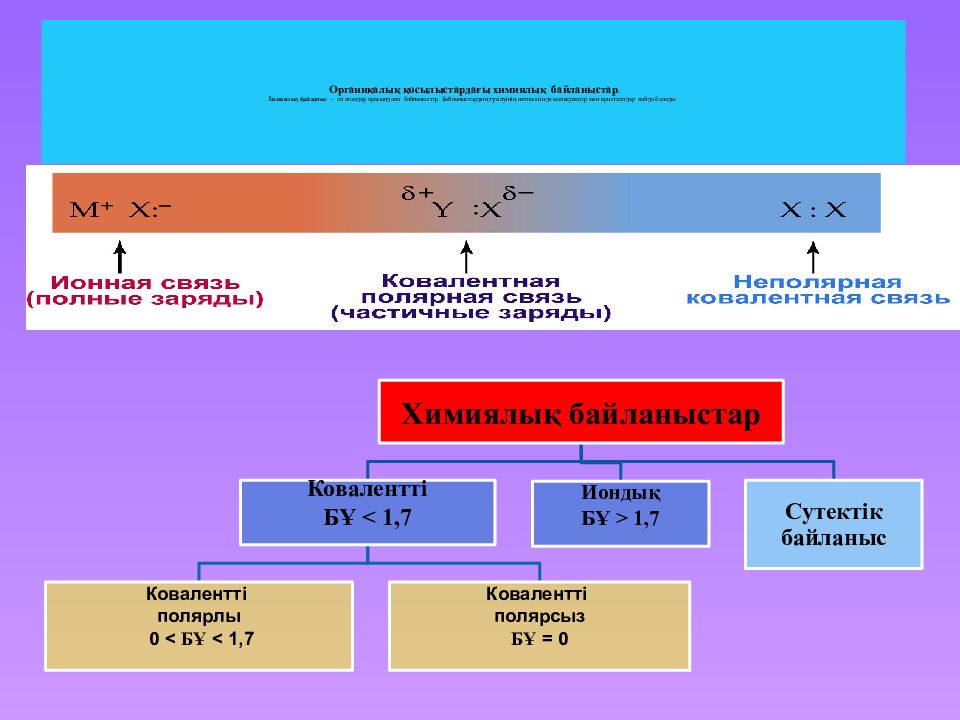
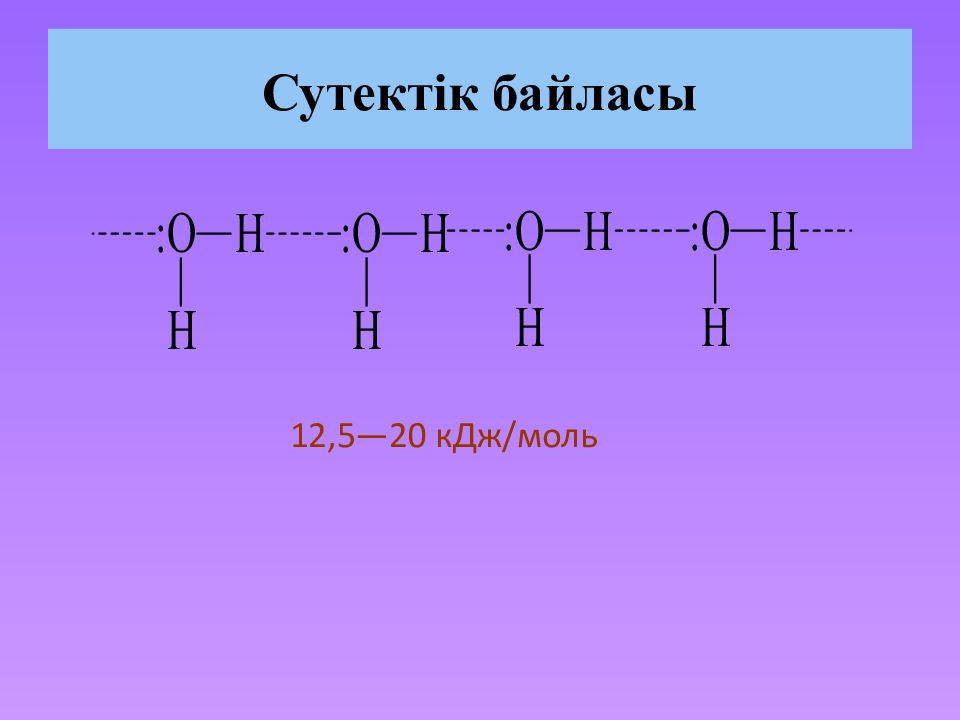
Слайд 17: Органикалық қосылыстардағы химиялық байланыстар. Химиялық байланыс – ол атомдар арасындағы байланыстар. Байланыстардың түзілуінің нәтижесінде молекулалар мен кристаллдар пайда болады
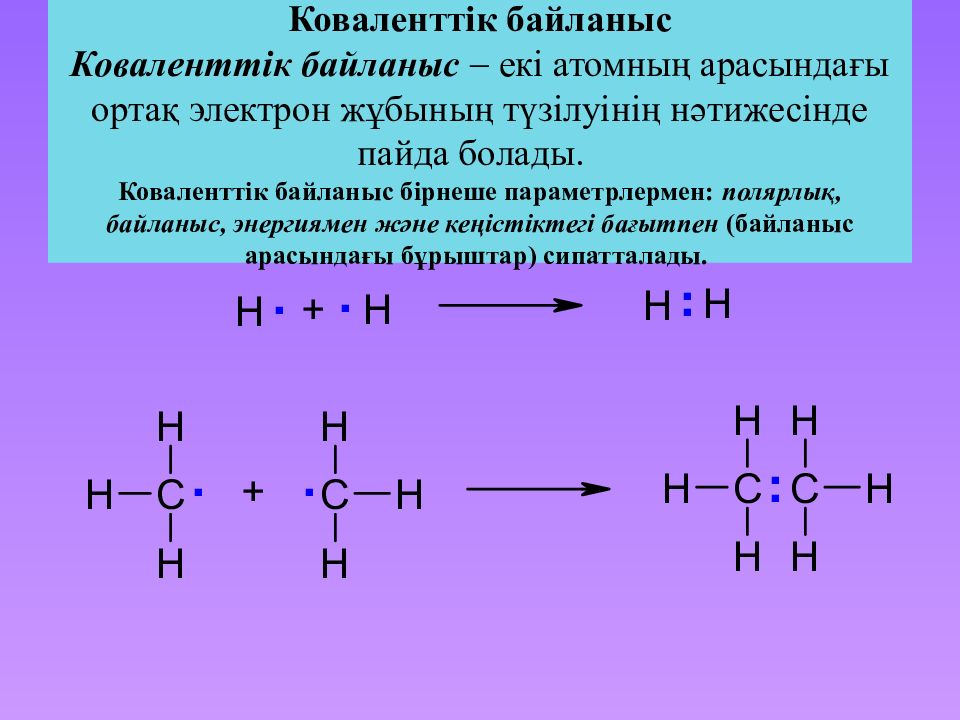
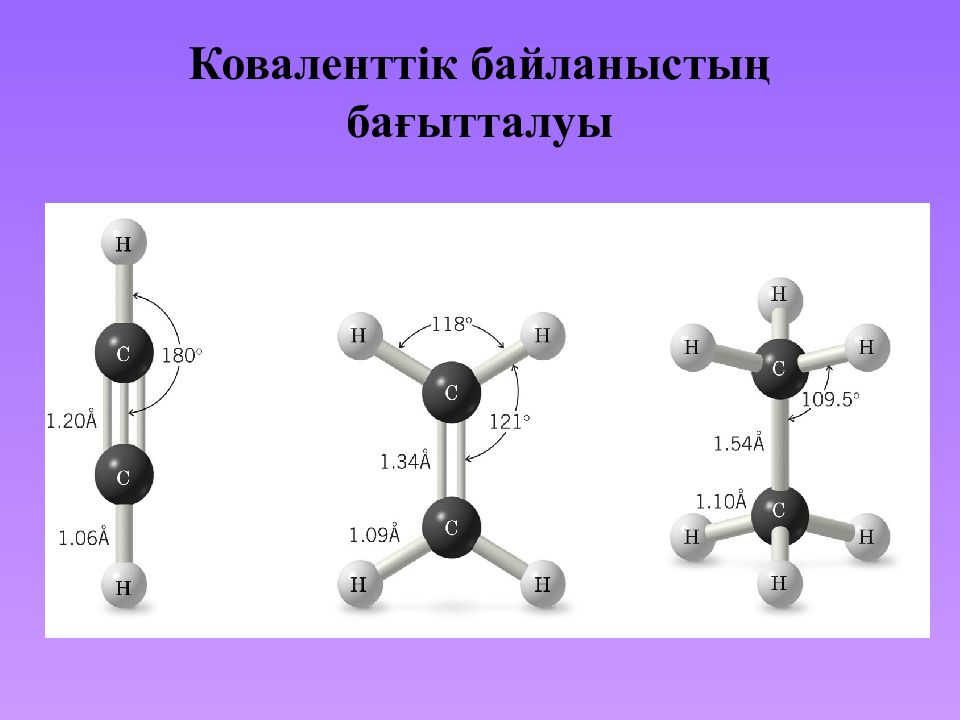
Слайд 19: Коваленттік байланыс Коваленттік байланыс екі атомның арасындағы ортақ электрон жұбының түзілуінің нәтижесінде пайда болады. Коваленттік байланыс бірнеше параметрлермен : полярлық, байланыс, энергиямен және кеңістіктегі бағытпен ( байланыс арасындағы бұрыштар ) сипатталады
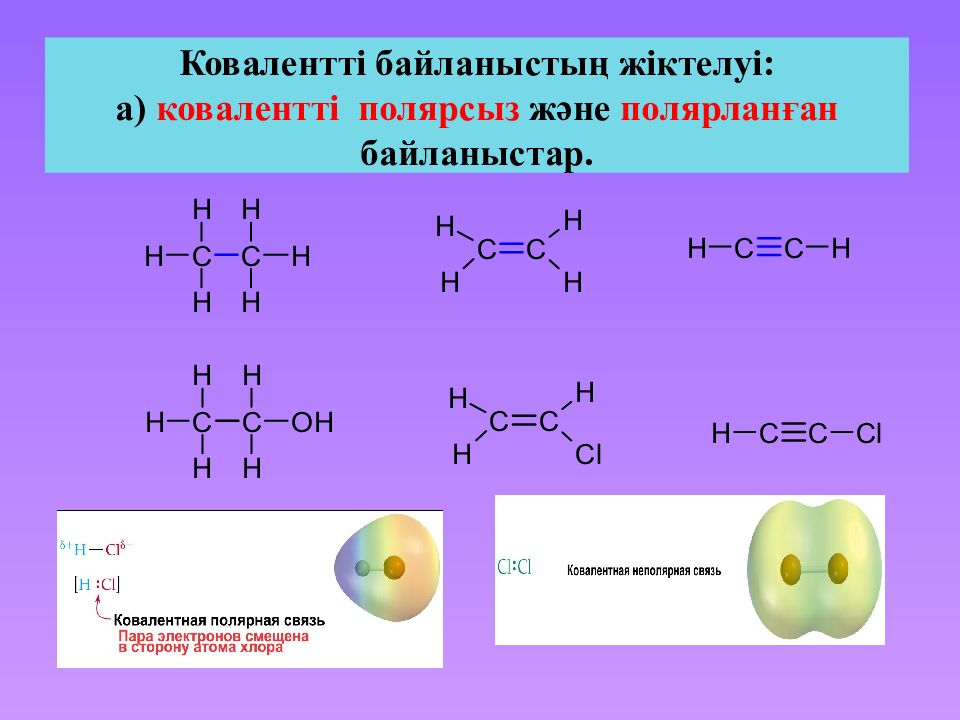
Слайд 20: Ковалентті байланыстың жіктелуі: а) ковалентті полярсыз және полярланған байланыстар
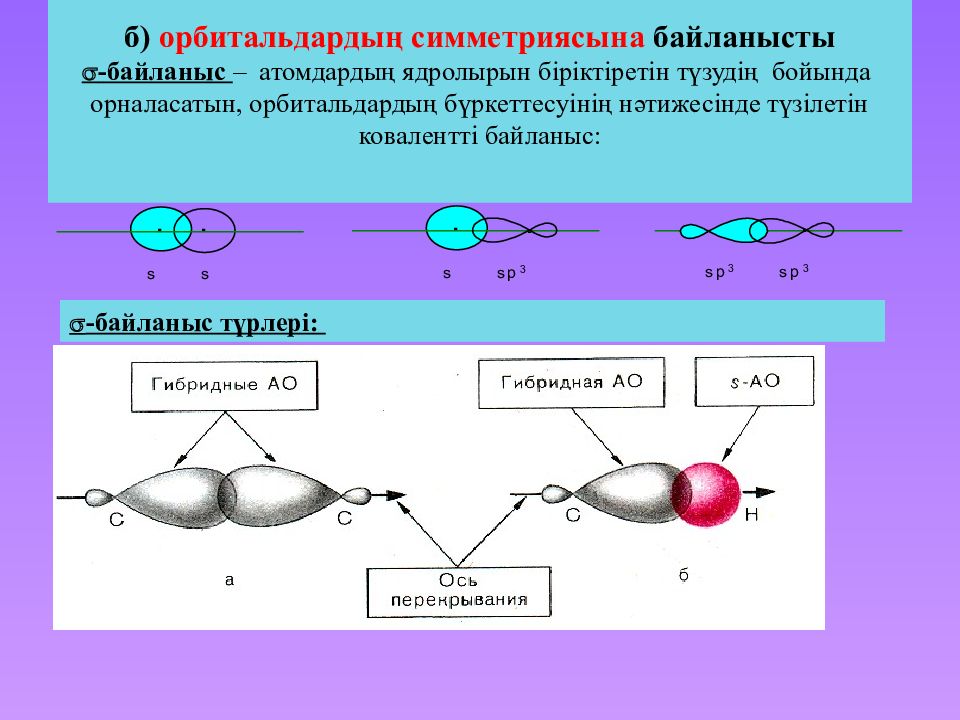
Слайд 21: б) орбитальдардың симметриясына байланысты - байланыс – атомдардың ядролырын біріктіретін түзудің бойында орналасатын, орбитальдардың бүркеттесуінің нәтижесінде түзілетін ковалентті байланыс :
- байланыс түрлері:
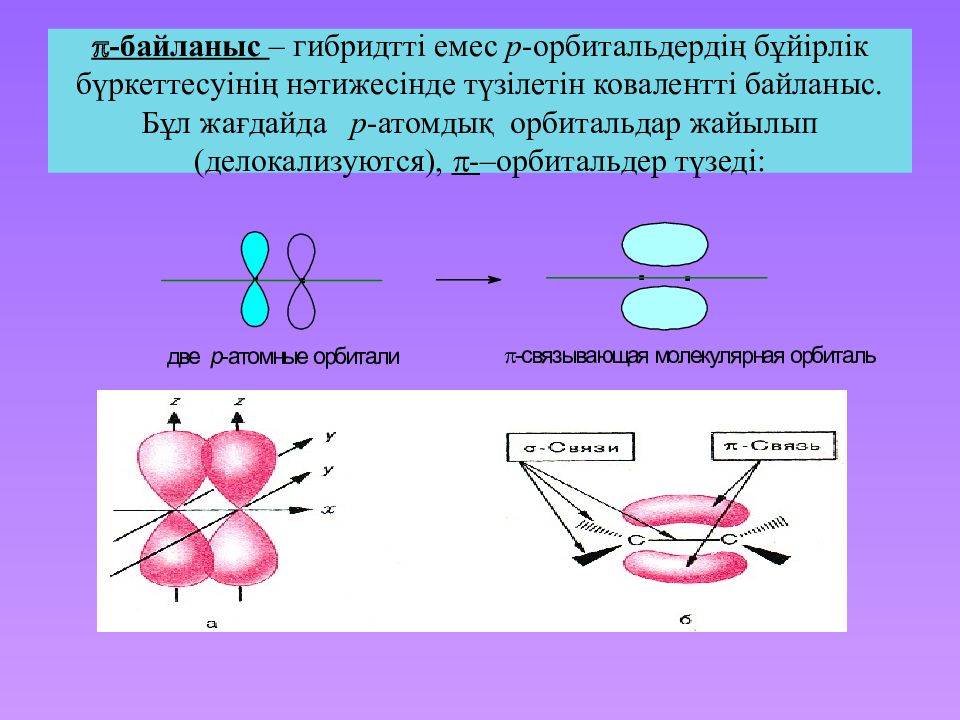
Слайд 22: байланыс – гибридтті емес p -орбитальдердің бұйірлік бүркеттесуінің нәтижесінде түзілетін ковалентті байланыс. Бұл жағдайда p -атомдық орбитальдар жайылып ( делокализуются ), - – орбитальдер түзеді :
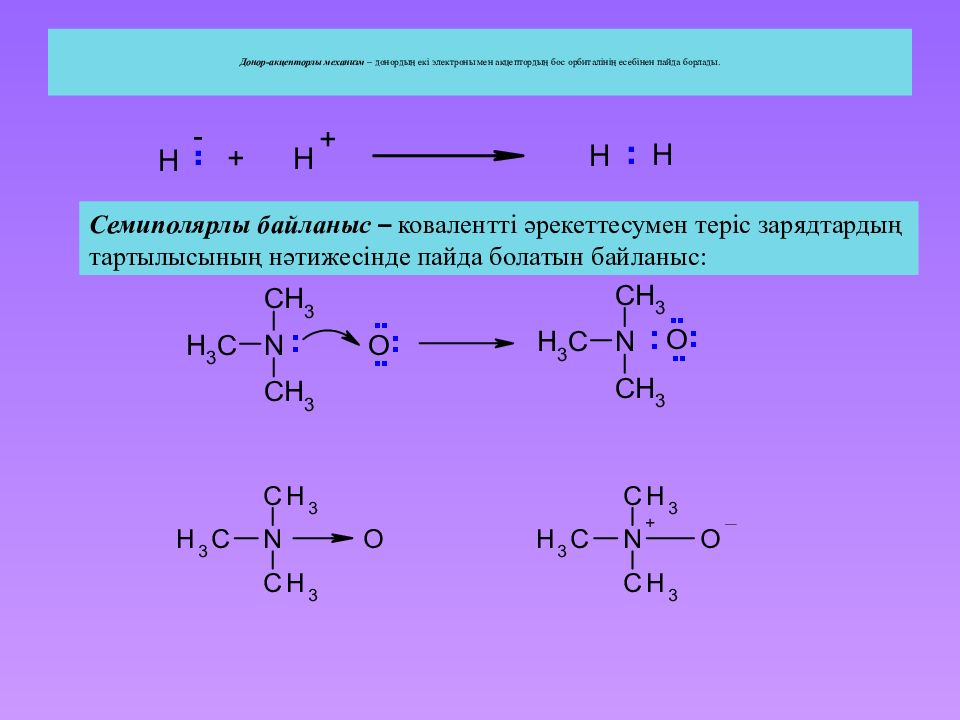
Слайд 23: Донор-акцепторлы механизм – донордың екі электроны мен акцептордың бос орбиталінің есебінен пайда борлады
Семиполярлы байланыс – ковалентті әрекеттесумен теріс зарядтардың тартылысының нәтижесінде пайда болатын байланыс :
Слайд 24
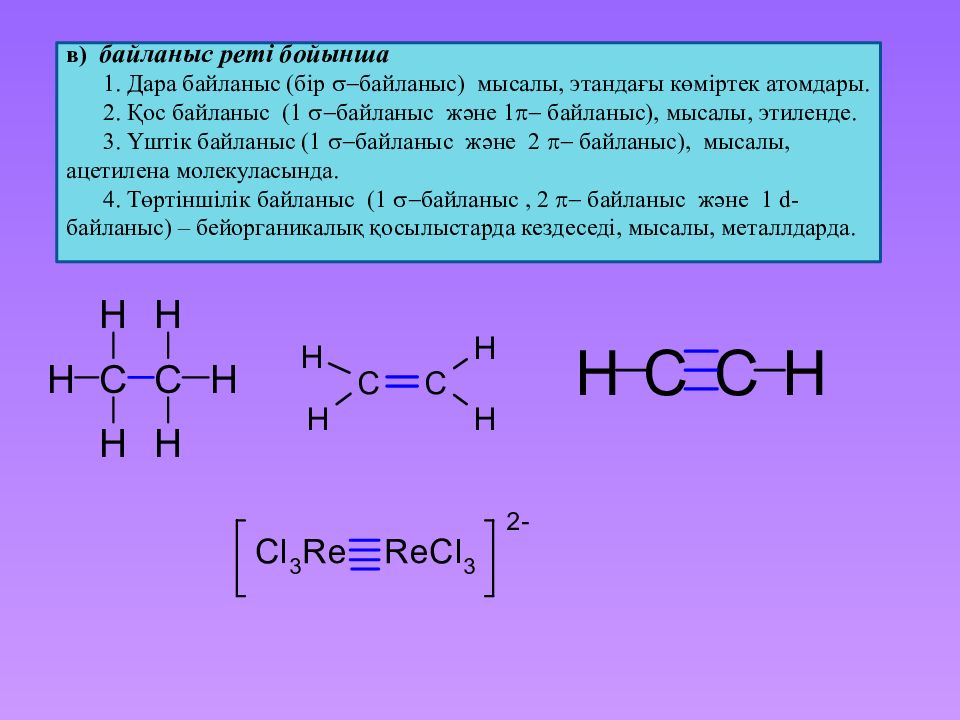
в) байланыс реті бойынша 1. Дара байланыс ( бір байланыс ) мысалы, этандағы көміртек атомдары. 2. Қос байланыс (1 байланыс және 1 байланыс ), мысалы, этиленде. 3. Үштік байланыс (1 байланыс және 2 байланыс ), мысалы, ацетилена молекуласында. 4. Төртіншілік байланыс (1 байланыс, 2 байланыс және 1 d - байланыс ) – бейорганикалық қосылыстарда кездеседі, мысалы, металлдарда.
Слайд 25: Ковалентті байланыстың сипаттамалары: Ι. Байланыс энергиясы. ΙΙ. Байланыстың ұзындығы. ΙΙΙ. Полярлығы. IV. Поляризациялануы
F > O > С l > N > Вг > С > Н Полярлығы: Коваленттік байланыс поляриацияланумен сипатталады — сыртқы факторладың әсерінен полярлікті өзгерту қабілеті. - байланыстар -байланыстарға қарағанда жылдам поляризацияланады.
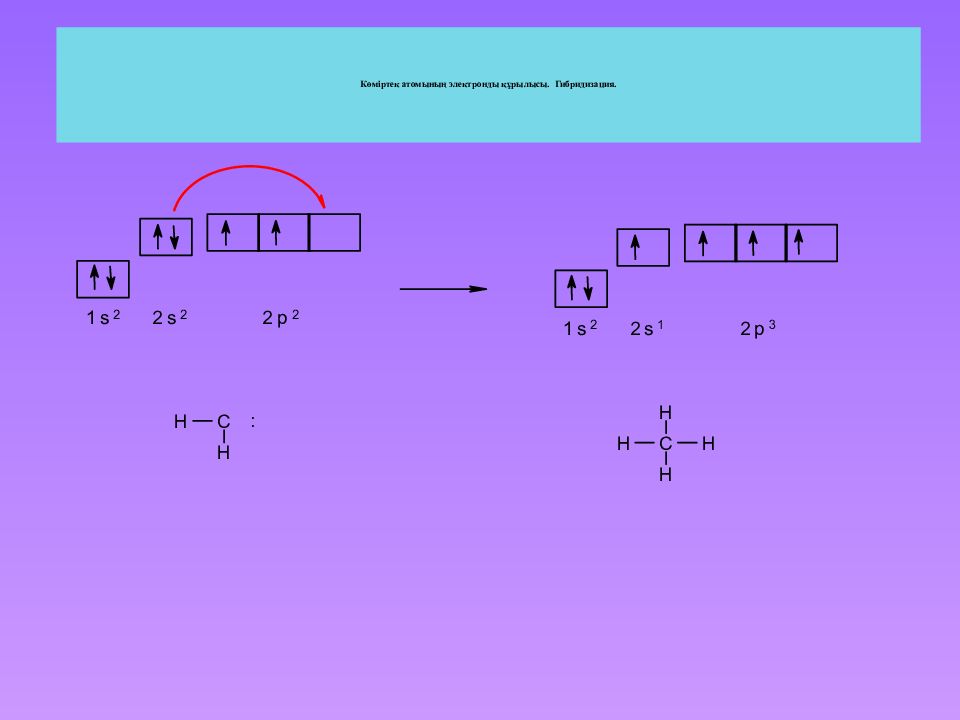
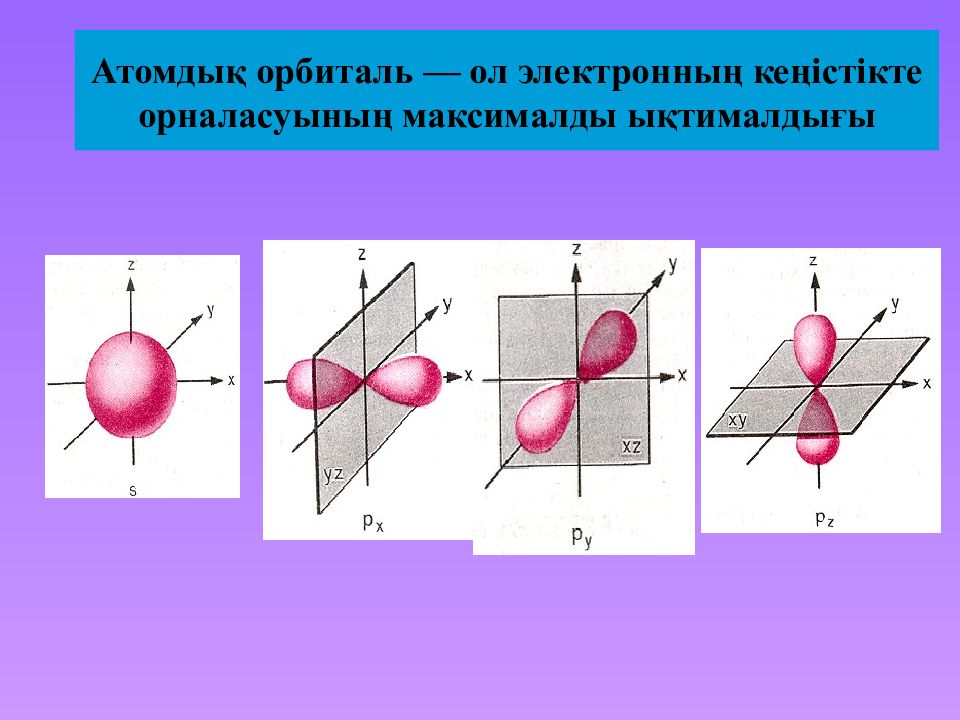
Слайд 27: Атомдық орбиталь — ол электронның кеңістікте орналасуының максималды ықтималдығы
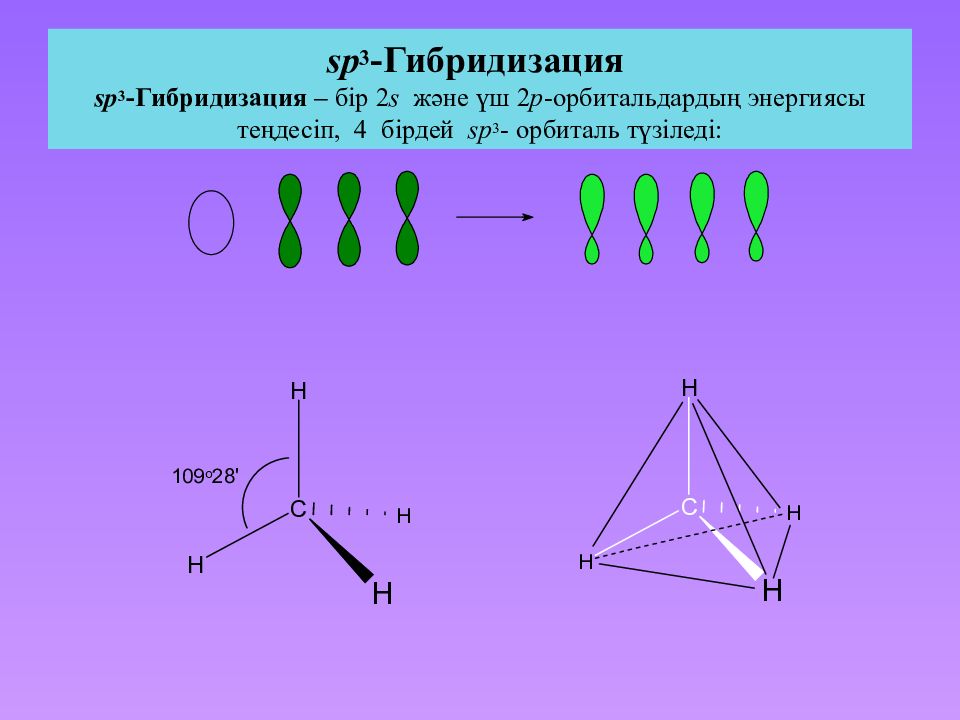
Слайд 28: sp 3 -Гибридизация sp 3 -Гибридизация – бір 2 s және үш 2 p -орбитальдардың энергиясы теңдесіп, 4 бірдей sp 3 - орбиталь түзіледі:
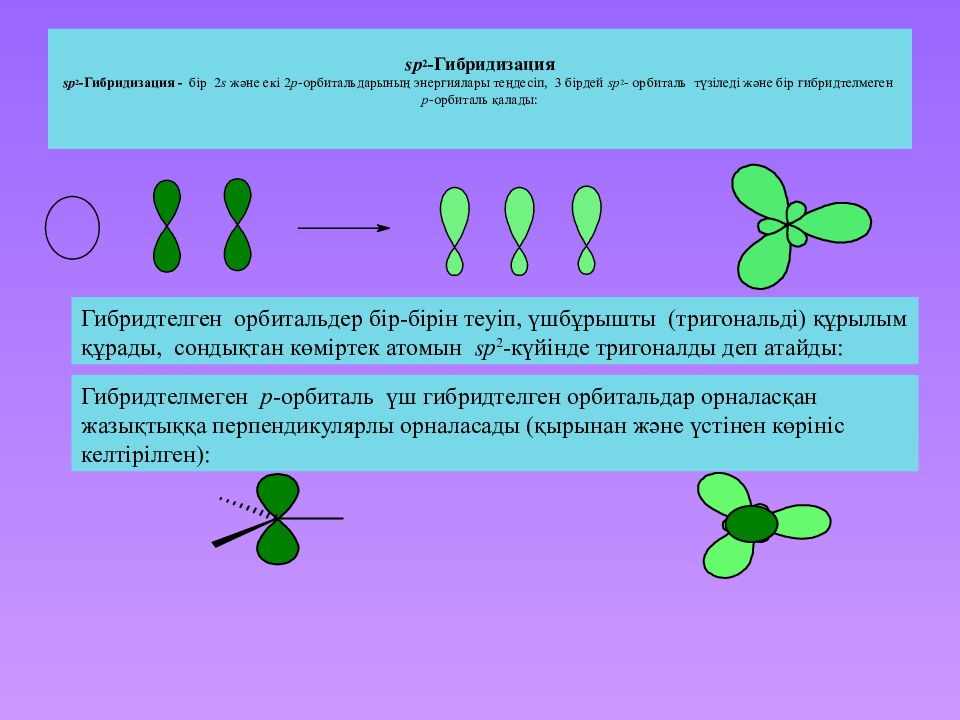
Слайд 29: s p 2 -Гибридизация s p 2 -Гибридизация - бір 2 s және екі 2 p -орбитальдарының энергиялары теңдесіп, 3 бірдей sp 2 - орбиталь түзіледі және бір гибридтелмеген p -орбиталь қалады:
Гибридтелген орбитальдер бір-бірін теуіп, үшбұрышты ( тригональді ) құрылым құрады, сондықтан көміртек атомын sp 2 -күйінде тригоналды деп атайды : Гибридтелмеген p -орбиталь үш гибридтелген орбитальдар орналасқан жазықтыққа перпендикулярлы орналасады (қырынан және үстінен көрініс келтірілген ):
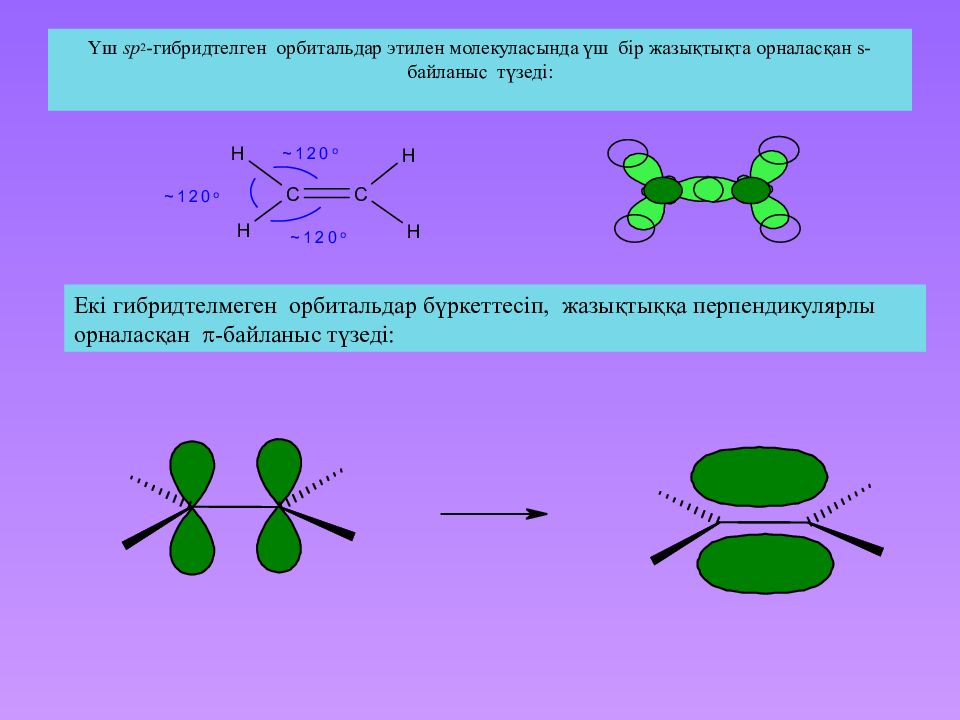
Слайд 30: Үш sp 2 -гибридтелген орбитальдар этилен молекуласында үш бір жазықтықта орналасқан s-байланыс түзеді :
Екі гибридтелмеген орбитальдар бүркеттесіп, жазықтыққа перпендикулярлы орналасқан - байланыс түзеді:
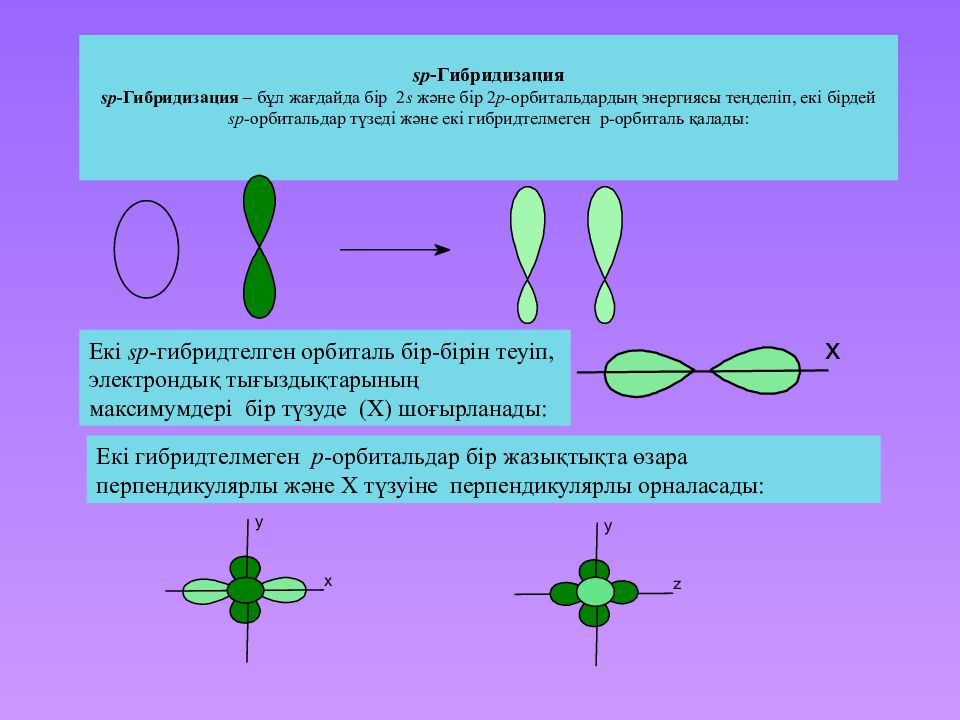
Слайд 31: sp -Гибридизация sp -Гибридизация – бұл жағдайда бір 2 s және бір 2 p -орбитальдардың энергиясы теңделіп, екі бірдей sp -орбитальдар түзеді және екі гибридтелмеген p-орбиталь қалады:
Екі sp -гибридтелген орбиталь бір-бірін теуіп, электрондық тығыздықтарының максимумдері бір түзуде (Х) шоғырланады : Екі гибридтелмеген p -орбитальдар бір жазықтықта өзара перпендикулярлы және Х түзуіне перпендикулярлы орналасады :
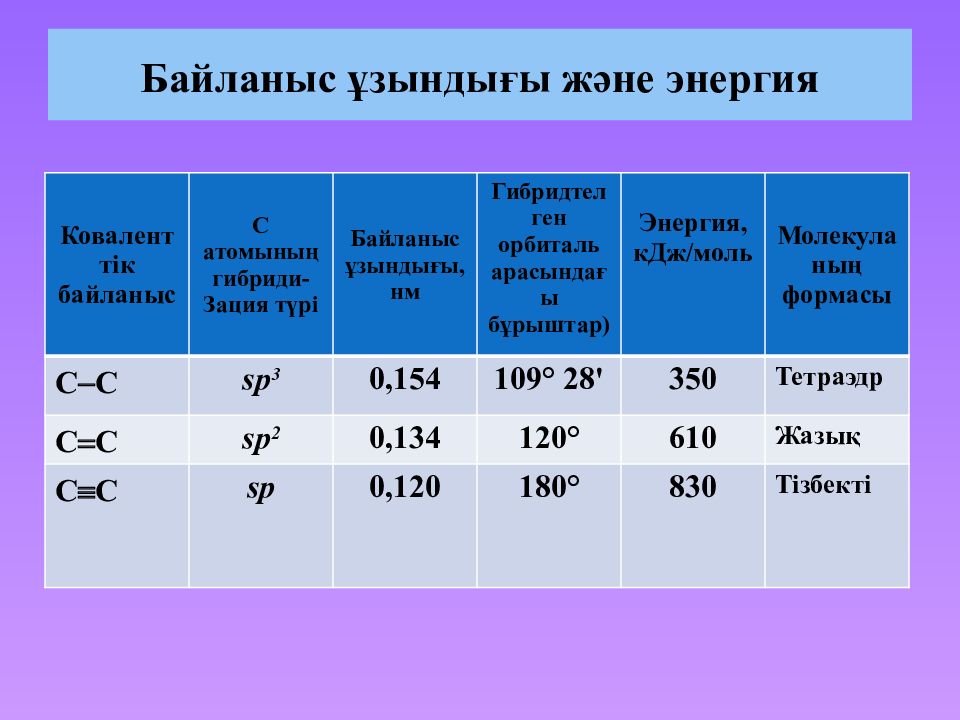
Слайд 32: Байланыс ұзындығы және энергия
Коваленттік байланыс С атомының гибриди - Зация түрі Байланыс ұзындығы, нм Гибридтелген орбиталь арасындағы бұрыштар ) Энергия, кДж/моль Молекуланың формасы С С sp 3 0,154 109° 28' 350 Тетраэдр С С sp 2 0,134 120° 610 Жазық С С sp 0,120 180° 830 Тізбекті
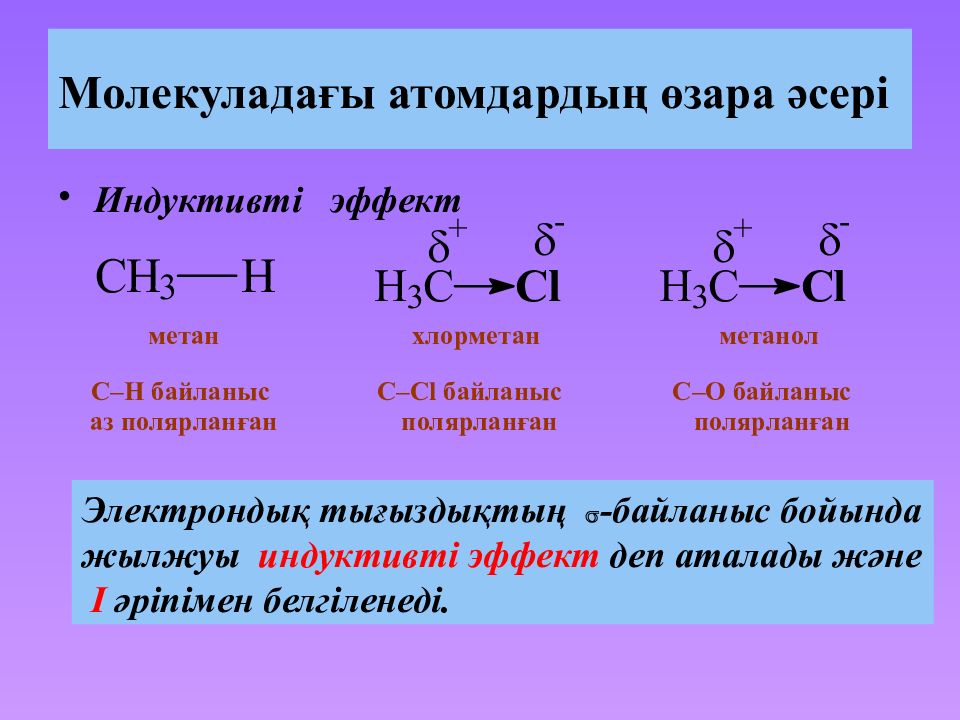
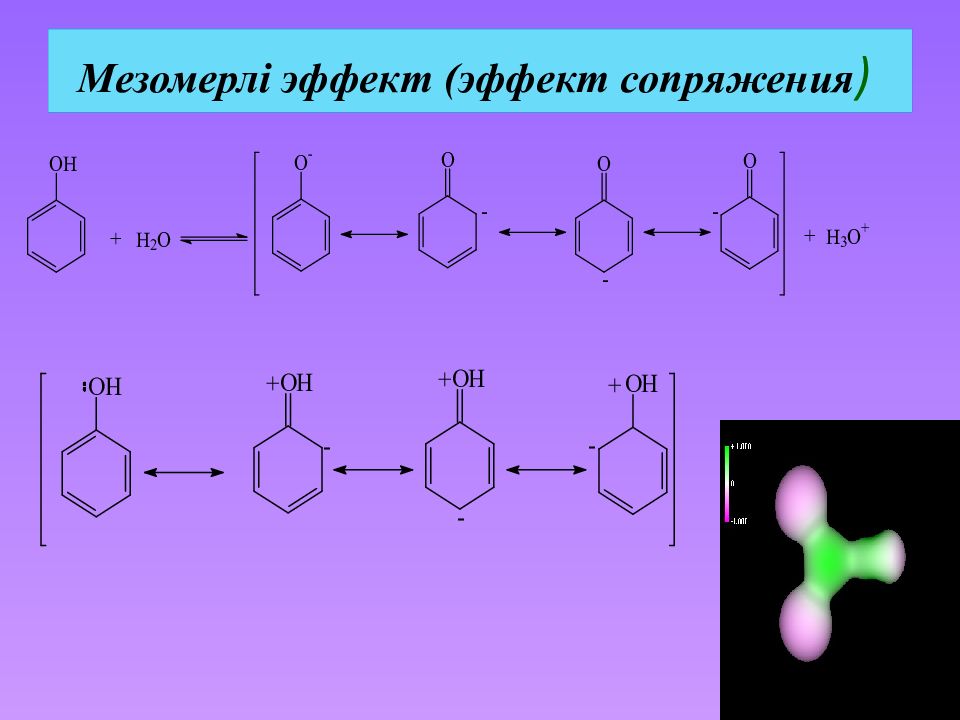
Слайд 35: Молекуладағы атомдардың өзара әсері
Индуктивті эффект метан хлорметан метанол C–H байланыс аз полярланған C– Cl байланыс полярланған C–O байланыс полярланған Электрондық тығыздықтың - байланыс бойында жылжуы индуктивті эффект деп аталады және I әріпімен белгіленеді.
Слайд 36: Индуктивный эффект
Электронакцепторлы орынбасушылар, яғни -байланыстың электрондық тығыздығын көміртек атомынан тартатын атом немесе атомдар тобы, теріс индуктивті эффектті көрсетеді ( -I-эффект ). Электрондонорлы орынбасушылар, яғни -байланыстың электрондық тығыздығын көміртек атомына тартатын атом немесе атомдар тобы, оң индуктивті эффект ( +I-эффект ).
Слайд 37: Индуктивті эффект
+ I -Эффект алифатты көмірсутекті немесе алкилды радикалдар (– CH 3, –C 2 H 5, т. б.) көрсетеді. Функционалды топтар : – Hal, – NH 2, – OH, > С= O, – COOH көбіне - I -эффект көрсетеді. пропен