Первый слайд презентации: Химияның негізгі түсініктері мен заңдары
Бисенғалиева Әсел
Слайд 2: Химия дегеніміз не ?
Химия – заттарды және олардың бір-біріне айналу заңдылықтарын зерттейтін жаратылыстану ғылымы. Химия элементтерді ( атомдарды ), жай және күрделі заттарды, олардың құрамын, құрылысын, қасиеттерін, химиялық өзгерістер мен оған әсер ететін жағдайлар мен өзгерістер кезінде байқалатын құбылыстарды зерттейді.
Слайд 3: Зерттелетін нысанына қарай химия негізгі екі топқа бөлінеді :
Бейорганикалық химия немесе анорганикалық химия барлық қалған химиялық элементтер түзетін қосылыстардың құрылысы мен қасиеттерін және олардың бір-бірімен әрекеттесу заңдылықтарын зерттейді. Органикалық химия негізінен көміртек атомдарынан тұратын заттардың құрылысын, химиялық қасиеттерін, құрамын, қолданылуын, табиғатта таралуын, тағы басқа зерттейді.
Слайд 4: Негізгі түсініктер
Қарапайым бөлшектер - өз құрылымы мен құрамы болмайтын бөлшекті элементар бөлшек дейміз. Заттың ең ұсақ және ішкі құрылымы ең қарапайым деп есептелетін бөлшектер. Атом - Химиялық элементтерді құрайтын, олардың өзіне тән ерекшеліктерін сақтайтын ең кішкене бөлшек. Молекула - жай немесе күрделі заттың негізгі химиялық қасиеттерін сақтайтын және өздігінен өмір сүретін ең кіші бөлшек.
Слайд 5: Басқа ғылымдармен байланысы
Химия физика және басқа да жаратылыстану ғылымдарымен тығыз байланысты. Кейбір химиялық мәліметтер ерте заманнан белгілі болған. Химия Биология Биохимия Геология Геохимия Космохимия Г идрохимия
Слайд 6: Бейорганикалық химия
Жай Күрделі Жай заттар бір ғана элементтерден тұрады. Күрделі заттардың құрамына екі немесе одан да көп элементтер кіреді. М еталдар және бейметалдар.
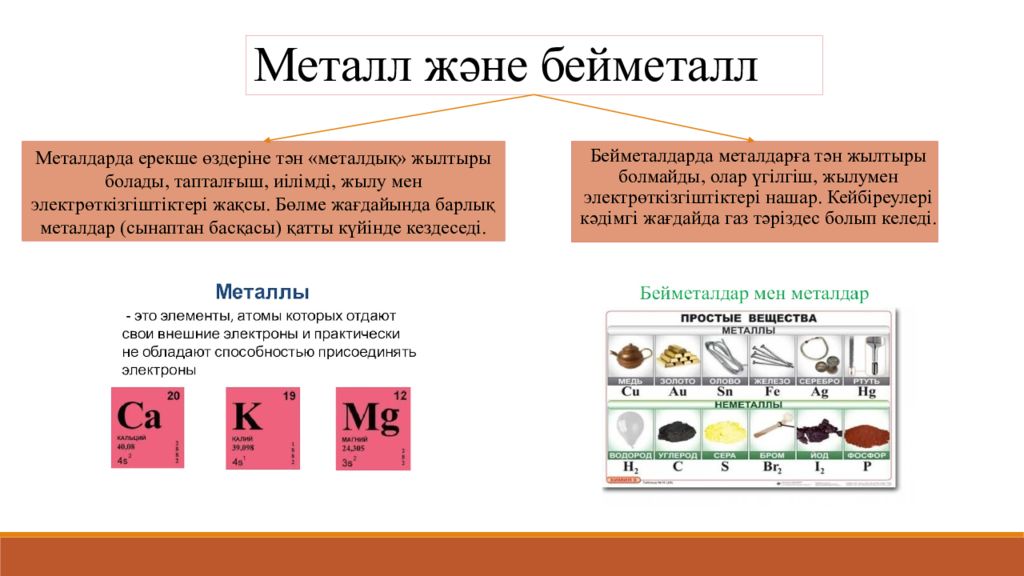
Слайд 7: Металл және бейметалл
Бейметалдарда металдарға тән жылтыры болмайды, олар үгілгіш, жылумен электрөткізгіштіктері нашар. Кейбіреулері кәдімгі жағдайда газ тәріздес болып келеді. Металдарда ерекше өздеріне тән « металдық » жылтыры болады, тапталғыш, иілімді, жылу мен электрөткізгіштіктері жақсы. Бөлме жағдайында барлық металдар ( сынаптан басқасы ) қатты күйінде кездеседі.
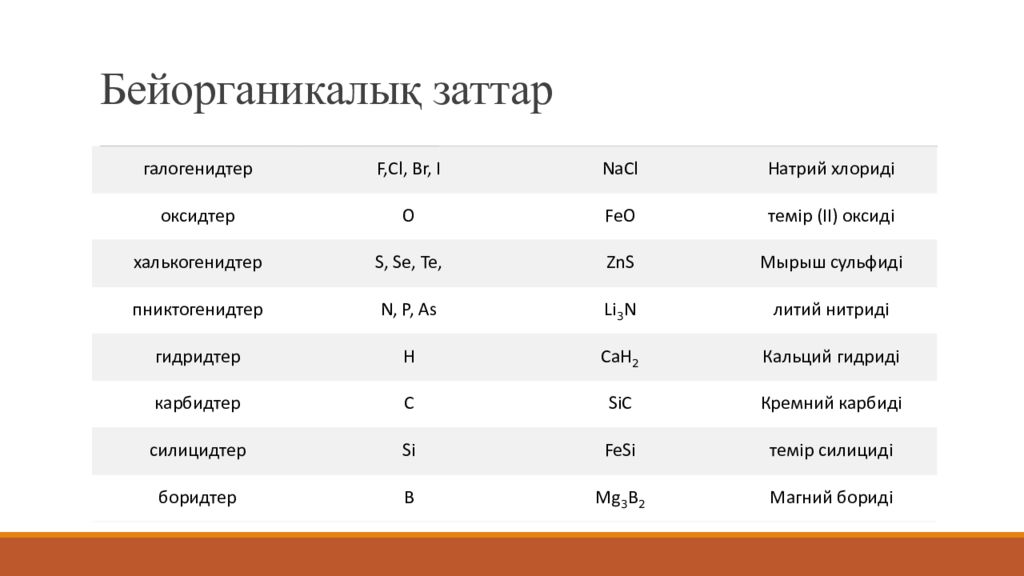
Слайд 8: Бейорганикалық заттар
галогенидтер F,Cl, Br, I NaCl Натрий хлориді оксидтер O FeO темір (ІІ) оксиді халькогенидтер S, Se, Te, ZnS Мырыш сульфиді пниктогенидтер N, P, As Li 3 N литий нитриді гидридтер H CaH 2 Кальций гидриді карбидтер C SiC Кремний карбиді силицидтер Si FeSi темір силициді боридтер B Mg 3 B 2 Магний бориді
Слайд 9: Таза заттар және қоспалар
Заттар – денелерді құраушылар. Таза заттарды қоспалардан бөліп алу және тазарту: Тұндыру – тығыздыққа байланысты болады. Сүзу – ерітіндідегі ерімеген бөлшектерді бөліп алу.Бөліп алынған заттар «сүзінді» деп аталады. Суалту – ерітіндідегі су буланып,ерітінді мөлшері азаяды. Дистильдеу – табиғи суды тазартып,оны қоспадан бөліп алу.
Слайд 10: Физикалық және химиялық құбылыстар
Физикалық құбылыс – судың булануы немесе қатуы. Бір күйден екінші күйге ауысуы. Химиялық құбылыс – құрамы өзгеріп,жаңа затқа айналуы. Мысалы: сүттің ашуы
Слайд 11
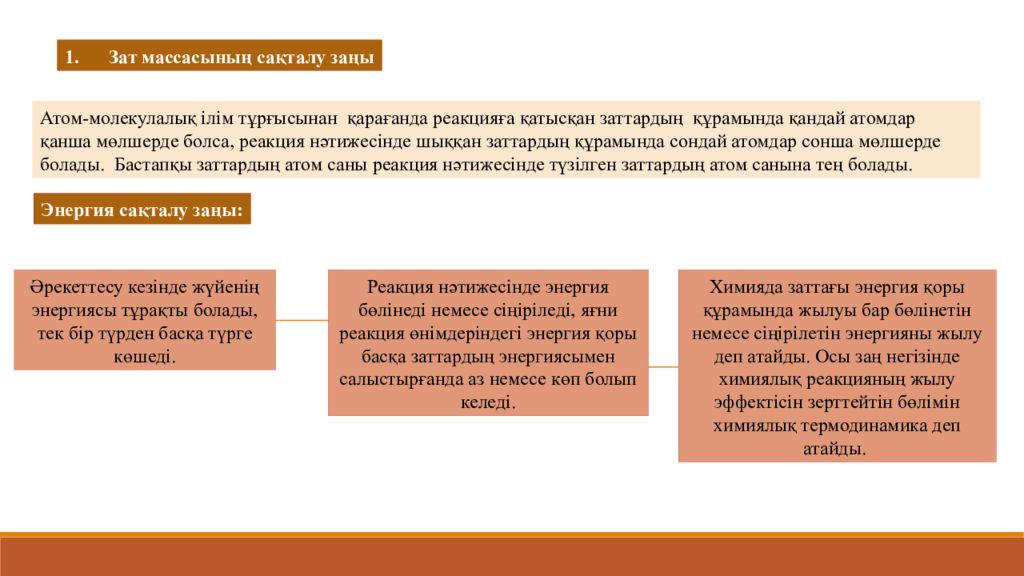
Атом- молекулалық ілім тұрғысынан қарағанда реакцияға қатысқан заттардың құрамында қандай атомдар қанша мөлшерде болса, реакция нәтижесінде шыққан заттардың құрамында сондай атомдар сонша мөлшерде болады. Бастапқы заттардың атом саны реакция нәтижесінде түзілген заттардың атом санына тең болады. 1. Зат массасының сақталу заңы Энергия сақталу заңы : Әрекеттесу кезінде жүйенің энергиясы тұрақты болады, тек бір түрден басқа түрге көшеді. Реакция нәтижесінде энергия бөлінеді немесе сіңіріледі, яғни реакция өнімдеріндегі энергия қоры басқа заттардың энергиясымен салыстырғанда аз немесе көп болып келеді. Химияда заттағы энергия қоры құрамында жылуы бар бөлінетін немесе сіңірілетін энергияны жылу деп атайды. Осы заң негізінде химиялық реакцияның жылу эффектісін зерттейтін бөлімін химиялық термодинамика деп атайды.
Слайд 12
2. Құрам тұрақтылық заңы Алыну жолына қарамастан кез – келген химиялық қосылыстың сандық құрамы бірдей болып келеді. Ж. Пруст, 1801 – 1808 ж.ж.). Қосылыс құрамына кіретін элементтер массаларының қатынасы тұрақты. Бұл заң тек газ және сұйық түрдегі заттарға қолданылады. Ал қатты күйдегі заттар қасиеттері бұл заңға негізделмеген. Себебі кез – келген қатты заттың кристалл құрылысында атоммен толтырылмаған бос қуыстар, басқа элементтердің атомдық қоспалары, идеалды құрылыстан ауытқуы байқалады. Кейбір элементтер әр түрлі пропорцияларда қосылып, әр түрлі қосылыстар түзеді. Мысалы : оттек азотпен әрекеттесіп 5 түрлі оксид түзеді, оның әрқайсысында азот пен оттектің массалық қатынастары әр түрлі болады. 2H2 + O2 = 2H2O NaOH + HCl = NaCl + H2O Cu(OH)2 = CuO + H2O CH4 + 2O2 = CO2 + 2H2O
Слайд 13
3. Эквиваленттер заңы Эквиваленттер заңы-химиялық заңдардың ең бір негізгісі. Олар химиялық элементтер бір-бірімен өздерінің химиялық эквиваленттеріне сай, белгілі сандық қатынаста әрекеттесетінін белгілейді.Эквивалент дегеніміз бағалары тең деген сөз. (И. Рихтер 1791 ж) Эквивалент деп берілген қышқылдық негіздік реакцияда сутектің 1 катионына, немесе берілген тотығу-тотықсыздану реакциясында 1 электронға сәйкес шартты немесе нақты бөлшекті айтады. “ Эквивалентті ” дегеніміз “ тең құнды ” “ тең бағалы ” дегенімі Элемент эквиваленті деп оның моль сутегі атомдарына тең құнды болған (эквивалент болған ) мөлшерін айтамыз.