Первый слайд презентации: Термохимия заңдары
Орындаған:Турсынбекова П.А Тексерген:Ниязбаева
Слайд 2: Термохимия
Термохимия – химиялық динамиканың бөлімі, ол химмиялық реакциялардың жылу эффектісін және реакцияның жүру барысындағы элементтердің физико-химиялық параметрлеріне тәуелділігін қарастырады. Сонымен қатар термохимия мақсатына жылудың фазалық өтулер, ерулер, қосылу, тағы басқа процестер, жылу сыйымдылықты меңгеру және заттардың энтальпиясы мен энтропиясы кіреді.
Слайд 3: Термохимия
Термохимияның негізгі тәсілі – калориметрия болып табылады. Кей жағдайларда калориметриялық емес те тәсілдер ( тепе-теңдік константасын өлшеу нәтижелерінен жылу эффектілерін санау ) қолданылады, алайда бұл жағдайларда нәтижелер онша дәл болмайды. 1-сурет 1 – термометр 2 – су 3 – үлгіні жағу үшін арналған спираль 4 – ауа кеңістігі 5 – араластырғыш 6 – үлгі салынған ыдыс 7 – қысымдағы оттегі 8 – бомба калориметр
Слайд 4
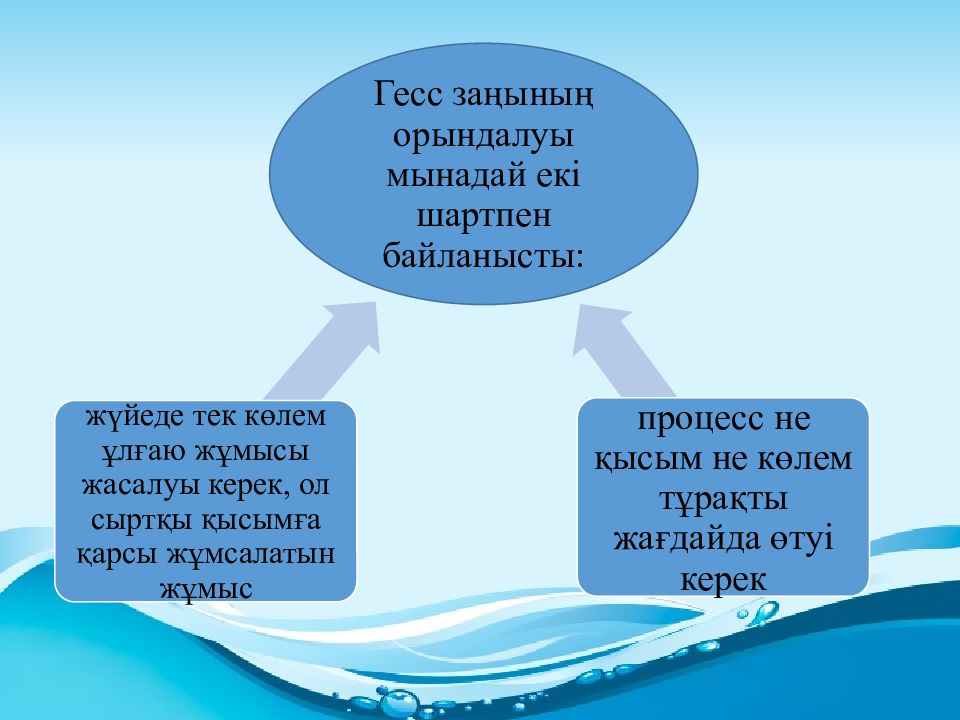
ХІХ ғасылдың ортасында Томсон және Бертло ой тұжырымдады, олардың айтуы бойынша, энергиясыз болып жатқын химиялық реакциялар максималды жылу бөлінген жаққа ағады. Олармен және олардың шәкірттерімен термохимияның негізгі эксперименталдық тәсілдері жасалды және көптеген реакциялардың жылу эффектілері өлшенді. Бертло-Томсеннің мәлімдемелері шындыққа сай болмады, бірақ термохимияда белгілі бір шартта химиялық реакциялардың ағу мүмкіндігін зерттеу маңызы сақталды. Сонымен, – термодинамиканың бірінші және екінші бастамасының жалпы теңдеуі болып табылып ( – энтальпия өзгеруі, – химиялық реакция кезіндегі энтропияның өзгеруі, Т – температура, R – газ тұрақтысы ), кез келген реакцияның тепе-теңдік констартасын Кр жылулық өлшемдер арқылы есептеуге мүмкіндік береді.
Слайд 5: Гесс заңы
1840 жылы Гесс атты химик тамаша заң ашты, кейіннен осы заңға оның аты беріліп, бұл заң реакцияның жылу эффектісін, заттардың түзілу жылулығын немесе олардың жануын есептеуге мүмкіндік береді.
Слайд 7
Гесс заңы химиялық реакцияның жылу эффектісін сипаттайды. Реакцияның жылу эффектісі – жүйенің онда болған химиялық өзгерістер нәтижесінде сіңірген н /е бөліп шығарған жылу энергиясының мөлшері. Жылу эффектісі Q н /е Δ H пен белгіленеді ( Q= — Δ H). Жылу бөлінетін реакциялар ( Q>0, Δ H<0) – экзотермиялық, ал сіңіретін реакциялар ( Q<0, Δ H>0) – эндотермиялық зеакцияларға жатады. Жылу эффектісі көрсетілген реакция теңдеуі термохимиялық болып табылады : CH 4 + 2O 2 = CO 2 +2H 2 O + Q (- Δ H)
Слайд 9
Энтальпия н /е жылу эффектісі — жүйенің онда болған химиялық өзгерістер нәтижесінде сіңірген н / е бөліп шығарған жылу энергиясының мөлшері. Энтальпия Q р н /е Δ H пен белгіленеді ( Q р = — Δ H). Жылу бөлінетін реакциялар ( Δ H<0) – экзотермиялық, ал сіңіретін реакциялар ( Δ H>0) – эндотермиялық зеакцияларға жатады. Жылу эффектісі көрсетілген реакция теңдеуі термохимиялық болып табылады : CH 4 + 2O 2 = CO 2 +2H 2 O + - Δ H.
Сурет 1 – Гесс заңын түсіндіретін сызба-нұсқа А 1, А 2, А 3, ал В 1, В 2, В і – бастапқы заттар; ∆Н 1 – бірінші жолдың жылу эффектісі; ∆Н 2, ∆Н 3 – екінші жолдың реакцияларының жылу эффектілері; ∆Н 4, ∆Н 5 және ∆Н 6 – үшінші жолдың жылу эффектілері. Суретте 1 реакция өнімдерін алудың жолдары көрсетілген. Осы жылу эффектілерінің Гесс заңы бойынша келесі қатынаста болады: ∆ Н 1 = ∆Н 2 + ∆Н 3 = ∆Н 4 + ∆Н 5 + ∆Н 6
Слайд 11: Гесс заңын көрнекті етіп түсіндіру үшін бастапқы заттар ретінде оттек пен көмірді (таза көміртектен тұратын болса), ал реакция өнімі ретінде көмірқышқыл газын қарастырайық. (Сурет 2 ) Сызба-нұсқада көрсетілгендей, көмірді тікелей СО 2 -ге дейін тотықтыруға болады.Осы процесті алдымен көмірді көміртек (II) оксидіне дейін, соңынан тікелей СО 2 -ге дейі соңынан көміртек (IV) оксидіне дейін тотықтыру арқылы сатылап жүргізуге де болады. Екі жағдайда да жүйенің бастапқы күйі (С, О 2 ) мен соңғы күйі (СО 2 )бірдей. Алғашқы процестің жылу эффектісі мынаған тең:
С + О 2 = СО 2 + 409,2 кДж (1 ) Ал екінші процесс үшін : С + 1/2О 2 = СО 2 + 124,3 кДж (2 ) СО + 1/2О 2 = СО 2 + 284,9 кДж (3 ) Ж алпы қосындысы: 409,2 кДж
Слайд 12
Гесс заңы іс жүзінде көп қолданылады. Ол кейбір химиялық реакцияларды жүргізбей-ақ, олардың жылу эффектілерін есептеуге мүмкіндік береді. Гесс заңдарынан бірнеше салдар шығады. Бірінші салдар. Кейбір химиялық қосылыстың айрылуының жылу эффектісі оның түзілу жылу эффектісіне тең, тек таңбасы қарама-қарсы. (Мұны Лавуазье-Лаплас (1780-1784) заңы деп атайды.). Мысалы, кальций оксидінің металдық кальций және оттектен түзілу жылуы мынаған тең: Са + 1/2О 2 = СаО + 636,4 кДж (4) 1 моль кальций оксидін кальций мен оттекке ыдырату үшін 636,4 кДж жұмсау керек: СаО = Са + 1/2 О 2 – 636,4 кДж (5)
Слайд 13
Екінші салдар. Егер әр түрлі бастапқы күйлерден бірдей соңғы күйге келетін екі реакция жүретін болса, онда олардың жылу эффектілерінің айырмасы бастапқы күйлердің Мысалы, өте таза көмір, графит және алмаз көміртек (IV) оксидіне дейін жанғанда 1 моль көміртек үшін мынадай жылу эффектілері пайда болады: С көмір + О 2 = СО 2 + 409,2 кДж (6) С графит + О 2 = СО 2 + 393,5 кДж (7) С алмаз + О 2 = СО 2 + 395,4 кДж (8) бір-біріне ауысқандағы жылу эффектісіне тең.
Слайд 14
Үшінші салдар. Бірдей бастапқы күй-жағдайда әр түрлі соңғы күйлерге келетін екі реакция жүретін болса, онда олардың жылу эффектілерінің айырмасы соңғы күй-жағдайлардың бір-біріне ауысқандағы жылу эффектісіне тең. С + О 2 = СО 2 + 409,2 кД (9) СО + 1/2О 2 = СО 2 = СО 2 + 284,9 кДж (10) Ал С + 1/2О 2 = СО + Q реакцияның жылу эффектісі тәжірибе арқылы анықталмайды, өйткені реакция нәтижесінде көміртек II оксидімен қатар көміртек IV оксиді де түзіледі. Алайда Гесс заңының үшінші салдарын пайдалана отырып, СО-ның түзілу жылуын анықтай аламыз.Ол үшін а) теңдеуінен б) теңдеуін алып тастасақ, мынаны аламыз. С + 1/2О 2 = СО + 124,3 кДж
Слайд 15: Гессзаңынан мынадай қорытындылар алуға болады :
Заттың түзілу жылуының мәні оның алғашқы заттардан алыну жолына тәуелді емес ; Заттың алғашқы заттарға ыдрайу жылуы оның осы заттардан түзілу жылуына тең, тек таңбалары қарама-қарсы. Екі түрлі жүйедегі өтетін процестердің нәтижесінде бірдей заттар түзілетін болса бұл процесстер жылуларының айырымдары біреуінің екінші күйге ауысу жылуына тің болады.
Слайд 16
Гесс заңының басты тәжірибелік мәні бар. Гесс заңының көмегімен жылу эффектілерін нақты өлшеу мүмкін емес немесе қиындық туғызатын процестердің жылу эффектілерінің шамасын есептеуге болады. Жүйенің ішкі энергиясының тұрақты көлемде өзгеруің температура бойынша дифференциалдағанда былай өрнектеледі : (d (∆U ) / d T) v = (d U 2 ) / d T) v – ( d U 1 ) / d T) v dU/ dT= ∆ C v Олай болса (d (∆U)/ dT) v = ∆C v2 –∆C v1 = ∆C v Мұндағы C v1 – жүйенің бастапқы қүйінің изохорлық жылусыйымдылығы, C v2 – жүйенің сонғы қүйінің изохорлық жылусыйымдылығы, ∆C v – изохорлық жылусыйымдылығының өзгеруі.
Слайд 17
Жалпы жағдайда изохорлық жылусыйымдылықтың өзгеруі үшін мынадай формуланы жазуға болады: ∆C v =∑ (n∙C v ) сонғы ─ ∑ (n ∙C v ) баст Тұрақты қысымдағы процестер үшін осыларға ұқсас былай өрнектей аламыз : (d (∆Н)/ dT) р = ∆C р2 –∆C р1 = ∆C р ( (33) және (34) теңдеулері – Кирхгоф заңының теңдеулері.
Слайд 18: Кирхгоф заңы
Ол заң былай айтылады: процестің жылу эффектісінің температуралық коэффициенті процесс нәтижесінде жүйенің жылусыйымдылығының өзгеруіне тең.
Слайд 19
Кирхгоф теңдеуін қолданып әртүрлі температуралардағы жылу эффектісін табу үшін кейде реакцияға қатысатын заттардың әрқайсысының жылу сыйымдылығының температураға тәуелділігін білу қажет болады. Жылу сыйымдылығының температураға тәуелділігі мыныдай эмпирикалық теңдеумен өрнектеледі Мұндағы – реакцияның жылусыйымдылығының өзгеруі. Сонда мұнда a, b, c, d, c 1 – берілген заттар үшін константалары.
Последний слайд презентации: Термохимия заңдары: Қорытынды
Химиялық термодинамика термохимия, химиялық тепе-теңдік және ерітінділер (олардың ішінде электролиттер ) туралы ілімдермен және электродты потенциалдар, беттік құбылыстар термодинамикаларымен тығыз байланысты. Гесс заңының практикадағы қолданбалы маңызы өте зор. Оның көмегімен әлі белгісіз, бірақ есептеу үшін не басқа мақсат-қа қажет болатын реакциялардың жылу эффектілерін есептеуге болады. Бұл жағдайда есептейтін реакцияларға жанама, қосым-ша, бірақ жылу зффектілері белгілі реакциялар пайдаланылады.