Слайд 2: Кислоты
Кислоты – это сложные вещества, молекулы которых состоят из атомов водорода и атомов или групп атомов, называемых кислотными остатками. H Cl H NO 3 H 2 SO 4 H 3 PO 4
Слайд 3: Кислоты
(по ТЭД) Кислоты – это соединения, при диссоциации которых в водном растворе образуются катионы водорода и анион кислотного остатка НС l H + + С l - H 2 SO 4 2 H + +SO 4 2 -
Слайд 4: Физические свойства
При обычных условиях кислоты могут быть жидкими (HNO 3, H 2 SO 4 ) и твердыми (Н 3 РО 4, Н 3 ВО 3 ), или растворами газов в воде (HCl, H 2 S).
Слайд 5: Физические свойства
Некоторые кислоты, например азотистая HNO 2, сернистая H 2 SO 3, угольная Н 2 СО 3, существуют только в разбавленных растворах. Не могут быть выделены в чистом виде: H 2 SO 3 → Н 2 О + SO 2 ; 2HNO 2 → Н 2 О + NO + NO 2. Физические свойства
Слайд 6: Названия кислот
Формула Название HCl Хлороводородная (соляная) H 2 S Сероводородная HBr Бромоводородная HNO 3 Азотная HNO 2 Азотистая H 2 SO 4 Серная H 2 SO 3 Сернистая H 2 CO 3 Угольная H 2 SiO 3 Кремниевая H 3 PO 4 Фосфорная HF Фтороводородная (плавиковая)
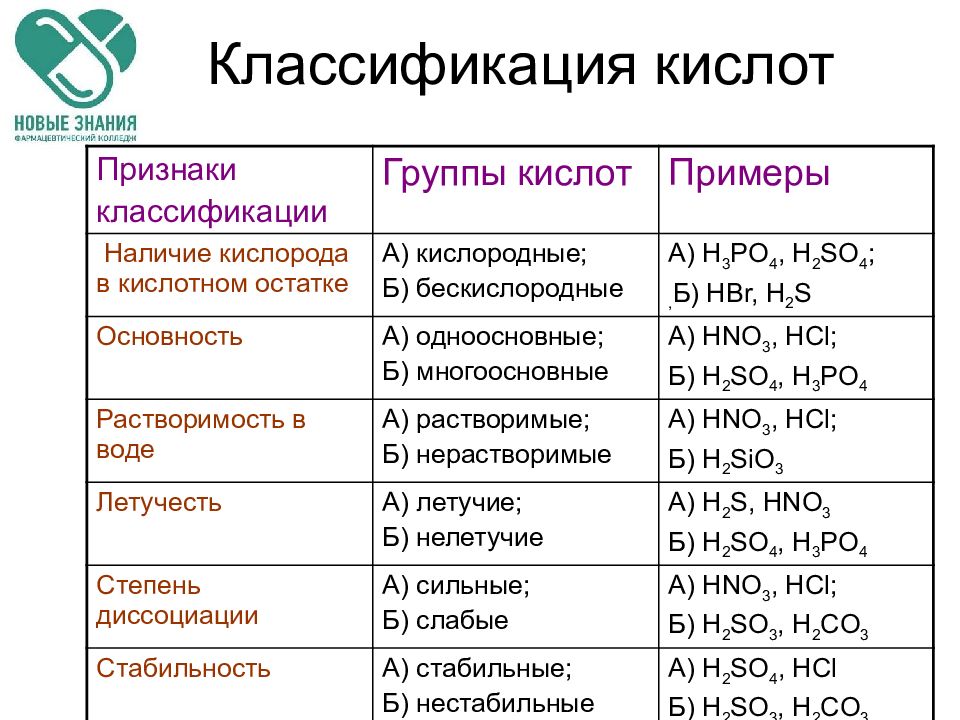
Слайд 7: Классификация кислот
Признаки классификации Группы кислот Примеры Наличие кислорода в кислотном остатке А) кислородные; Б) бескислородные А) H 3 PO 4, H 2 SO 4 ; , Б) HBr, H 2 S Основность А) одноосновные; Б) многоосновные А) HNO 3, HCl ; Б) H 2 SO 4, H 3 PO 4 Растворимость в воде А) растворимые; Б) нерастворимые А) HNO 3, HCl ; Б) H 2 SiO 3 Летучесть А) летучие; Б) нелетучие А) H 2 S, HNO 3 Б) H 2 SO 4, H 3 PO 4 Степень диссоциации А) сильные; Б) слабые А) HNO 3, HCl ; Б) H 2 SO 3, H 2 CO 3 Стабильность А) стабильные; Б) нестабильные А) H 2 SO 4, HCl Б) H 2 SO 3, H 2 CO 3
Слайд 8: Химические свойства кислот
Изменяют цвет индикаторов: Химические свойства кислот Растворы кислот имеют кислую среду ( pH< 7 ) Лакмус красный Фенолфталеин Бесцветный Метил-оранж малиновый
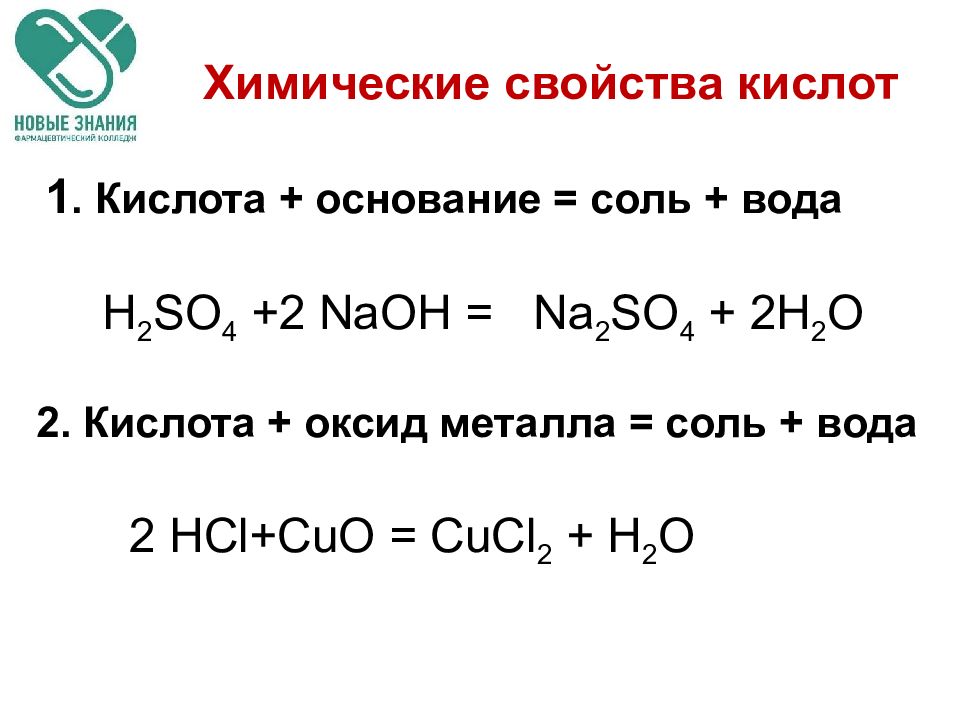
Слайд 9: Химические свойства кислот
1. Кислота + основание = соль + вода H 2 SO 4 +2 NaOH = Na 2 SO 4 + 2H 2 O 2. Кислота + оксид металла = соль + вода 2 HCl+CuO = CuCl 2 + H 2 O Химические свойства кислот
Слайд 10: Химические свойства кислот
3. Кислота + металл = водород + соль 2HCl +Zn = ZnCl 2 + H 2 Условия : - в ряду напряжений металл должен стоять до водорода в результате реакции должна получиться растворимая соль 4. Кислота + соль = новая кислота + новая соль Условия : - в результате реакции должны получиться газ, осадок или вода. BaCl 2 + H 2 SO 4 = BaSO 4 + 2HCl
Слайд 11: Способы получения кислот
1. Взаимодействие кислотных оксидов с водой SO 3 + H 2 O → H 2 SO 4 2. Вытеснение более летучей кислоты из её соли менее летучей кислотой NaCl + H 2 SO 4 ( конц.) → HCl + Na 2 SO 4 3. Гидролиз галогенидов или солей P Cl 5 + H 2 O → H 3 PO 4 + HCl 4. Из простых веществ (для бескислородных кислот) H 2 + Cl 2 → HCl H 2 + S → H 2 S