Первый слайд презентации: Оксиды (знакомство с оксидами)
Презентация для учащихся 8-ых классов с видеофрагментами.
Слайд 2: Что такое оксиды?
Оксиды – это сложные вещества, состоящие из двух элементов, один из которых кислород. Общая формула: Е m O n
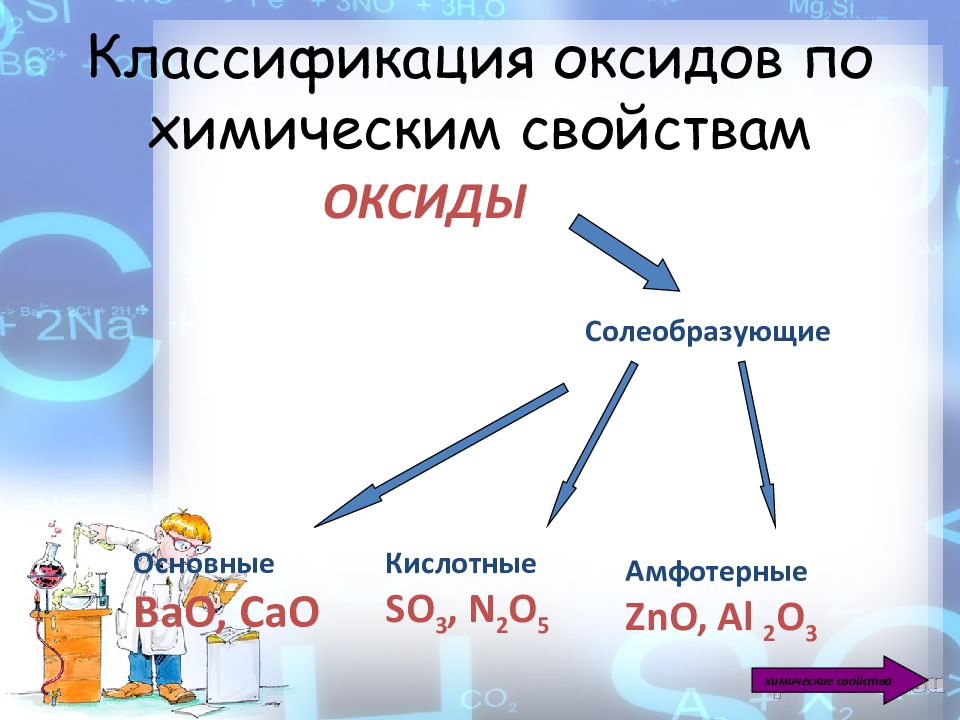
ОКСИДЫ Солеобразующие Основные ВаО, СаО Кислотные SO 3, N 2 O 5 Амфотерные ZnO, Al 2 O 3 химические свойства
Слайд 5: Названия оксидов
Оксид алюминия Al 2 O 3 Оксид калия K 2 O Оксид бария BaO В случае, если элемент обладает переменной валентностью, то обязательно в скобках указывают валентность этого элемента в оксиде. Оксид меди ( II ) С uO Оксид серы ( VI) SO 3 Оксид углерода ( IV) CO 2
Основные оксиды образуют металлы, которые проявляют валентность I, II, III. Примеры: Na 2 O, MgO, CaO, CuO, K 2 O, FeO. Кислотные оксиды образуют неметаллы и металлы, которые проявляют валентность VI, VII (например М n 2 O 7, С rO 3 ). SO 2, P 2 O 5, CO 2, SiO 2, N 2 O 5
Слайд 7: Получение основных оксидов
Взаимодействие металлов с кислородом (горение) 2Mg + O 2 = 2MgO
Слайд 8: Получение кислотных оксидов
Взаимодействие неметаллов с кислородом (горение) S + O 2 = SO 2
Слайд 9: Получение кислотных оксидов
Взаимодействие неметаллов с кислородом (горение) 4P + 5O 2 =2P 2 O 5
Слайд 10: Химические свойства основных оксидов
Взаимодействие с водой: Правило: при взаимодействии основных оксидов с водой образуются растворимые основания ( щелочи). Примеры: Li 2 O + H 2 O = 2LiOH Na 2 O + H 2 O = 2NaOH K 2 O + H 2 O = 2KOH BaO + H 2 O = Ba(OH) 2 CaO + H 2 O = Ca(OH) 2
Слайд 11: Химические свойства основных оксидов
Обратите внимание! С водой взаимодействуют только оксиды активных металлов (лития, натрия, калия, бария, кальция )!
Слайд 12: Химические свойства основных оксидов
Взаимодействие с кислотными оксидами: Правило: при взаимодействии основных оксидов с кислотными оксидами образуется соль. Примеры: Са О + N 2 O 5 = Ca (NO 3 ) 2 соль Na 2 O + SO 3 = Na 2 SO 4 соль
Слайд 13: Как правильно составить соль?
Соль Металл Кислотный остаток Металл мы переписываем из основного оксида, а кислотный остаток - из соответствующей кислоты. Для этого нужно знать, какому кислотному оксиду какая кислота соответствует. Давайте разберемся…
Слайд 14: Как правильно составить соль?
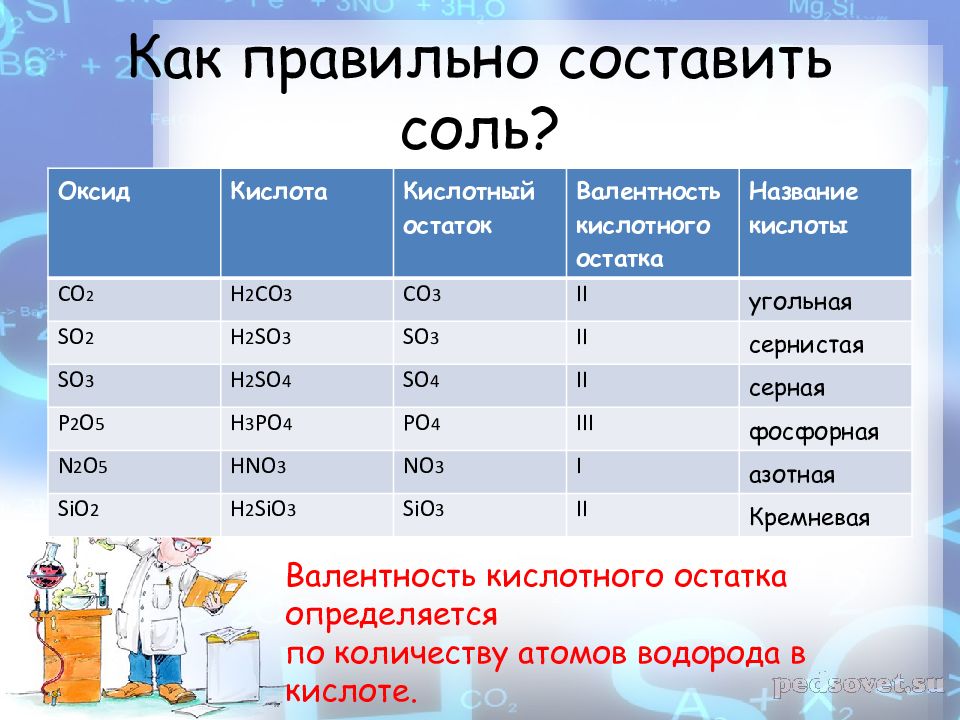
Оксид Кислота Кислотный остаток Валентность кислотного остатка Название кислоты СО 2 Н 2 СО 3 СО 3 II угольная SO 2 H 2 SO 3 SO 3 II сернистая SO 3 H 2 SO 4 SO 4 II серная Р 2 О 5 Н 3 РО 4 РО 4 III фосфорная N 2 O 5 HNO 3 NO 3 I азотная SiO 2 H 2 SiO 3 SiO 3 II Кремневая Валентность кислотного остатка определяется по количеству атомов водорода в кислоте.
Слайд 15: Как правильно составить соль?
Итак, рассмотрим алгоритм действий и составим соль в уравнении: Са О + Р 2 О 5 = Выписываем металл ( Са ) и рядом кислотный остаток, который соответствует вашему кислотному оксиду (РО4) Са РО 4 2. Подписываем валентности металла и кислотного остатка II III Ca PO 4 3. Находим НОК и уравновешиваем левую и правую часть формулы соли: Са 3 (РО 4 ) 2
Слайд 16: Химические свойства основных оксидов
Взаимодействие с кислотами Правило: При взаимодействии основных оксидов с кислотами образуются соль и вода. Примеры: Ва О + 2H NO 3 = Ва ( NO 3 ) 2 + H 2 O соль 3 K 2 O + 2H 3 PO 4 = 2 K 3 PO 4 + 3H 2 O соль
Слайд 17: Химические свойства кислотных оксидов
Взаимодействие с водой Правило: При взаимодействии кислотных оксидов с водой образуются кислоты (исключение составляет оксид кремния SiO 2 – речной песок не растворяется в воде) Примеры: SO 3 + H 2 O = H 2 SO 4 ( серная кислота) СО 2 + Н 2 О = Н 2 СО 3 (угольная кислота )
Слайд 18: Химические свойства кислотных оксидов
2. Взаимодействие кислотных оксидов с основными оксидами (см. выше) 3. Взаимодействие с растворимыми основаниями. Правило: При взаимодействии кислотных оксидов с растворимыми основаниями образуются соль и вода.
Слайд 19: Химические свойства кислотных оксидов
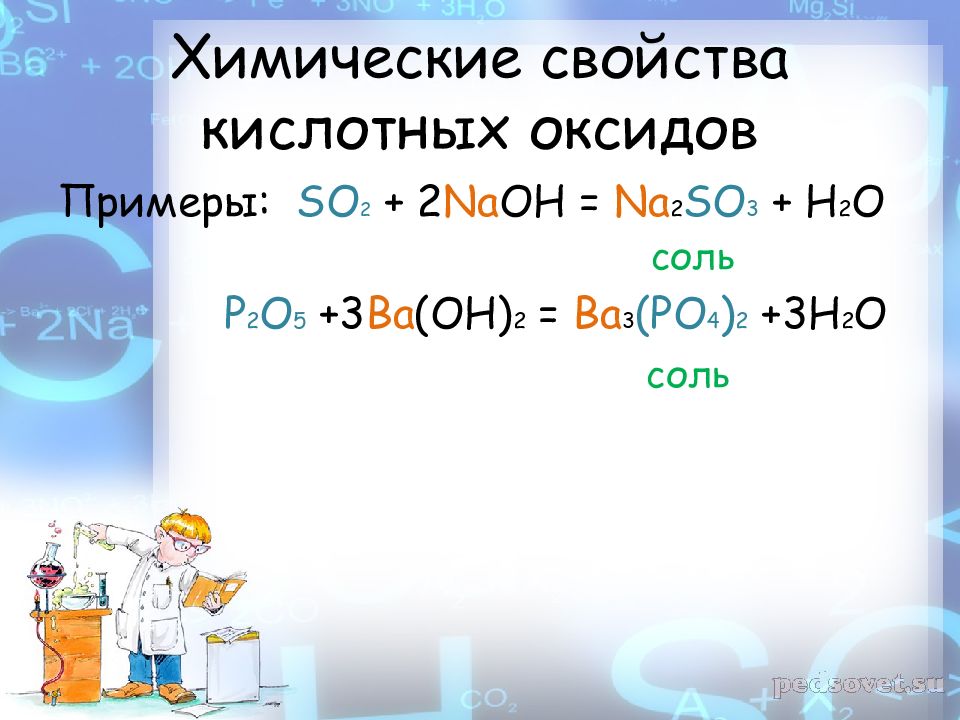
Примеры: SO 2 + 2 Na OH = Na 2 SO 3 + H 2 O соль P 2 O 5 +3 Ba (OH) 2 = Ba 3 (PO 4 ) 2 +3H 2 O соль
Слайд 22
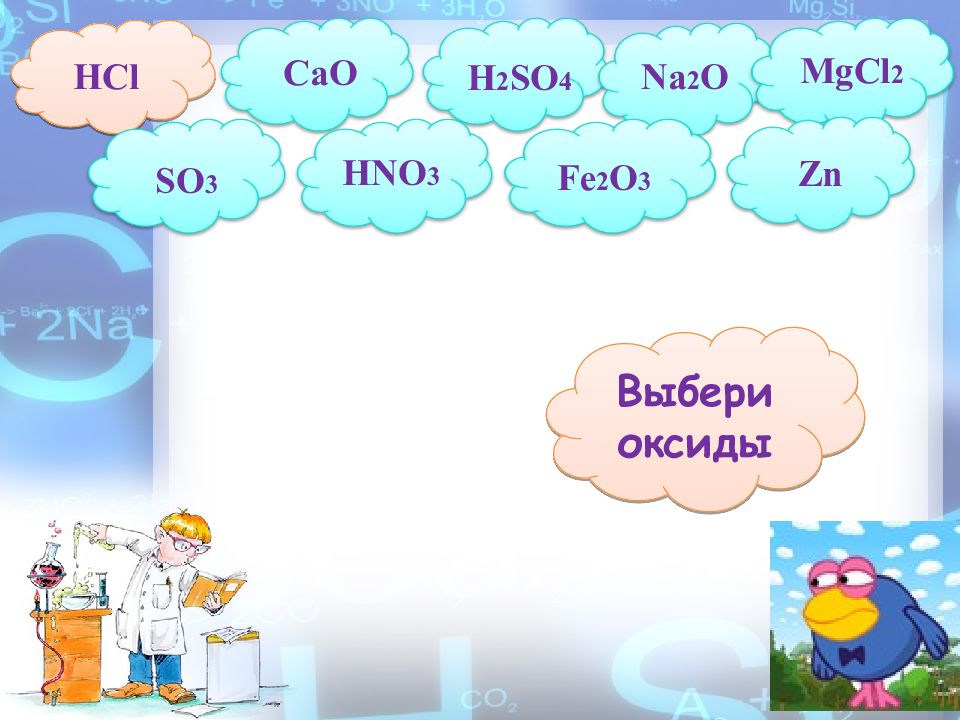
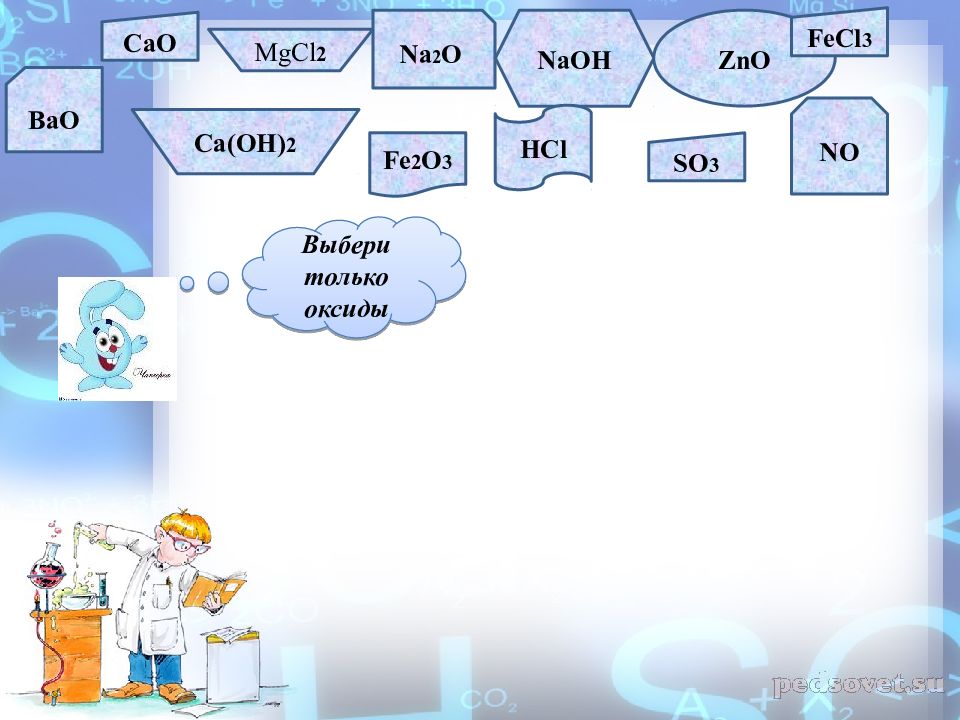
CaO MgCl 2 Na 2 O NaOH ZnO FeCl 3 BaO Ca (OH) 2 Fe 2 O 3 HCl SO 3 NO Выбери только оксиды
Слайд 23: 2. Составьте формулы оксидов элементов
Магния Калия Алюминия Фосфора ( V ) Хлора ( VII ) Железа ( III ) Углерода ( IV ) Серы ( VI ) Выпишите в два столбика оксиды металлов и неметаллов.
Слайд 24: 3. Напишите уравнения реакций получения оксидов:
Оксида кальция Оксида алюминия Оксида серы ( IV) Оксида фосфора ( V ) Оксида углерода ( IV)
Слайд 25: 4. Написать формулы оснований и кислот, которые соответствуют данным оксидам:
SO 3, N 2 O 5, Al 2 O 3, CO 2, BaO, CaO
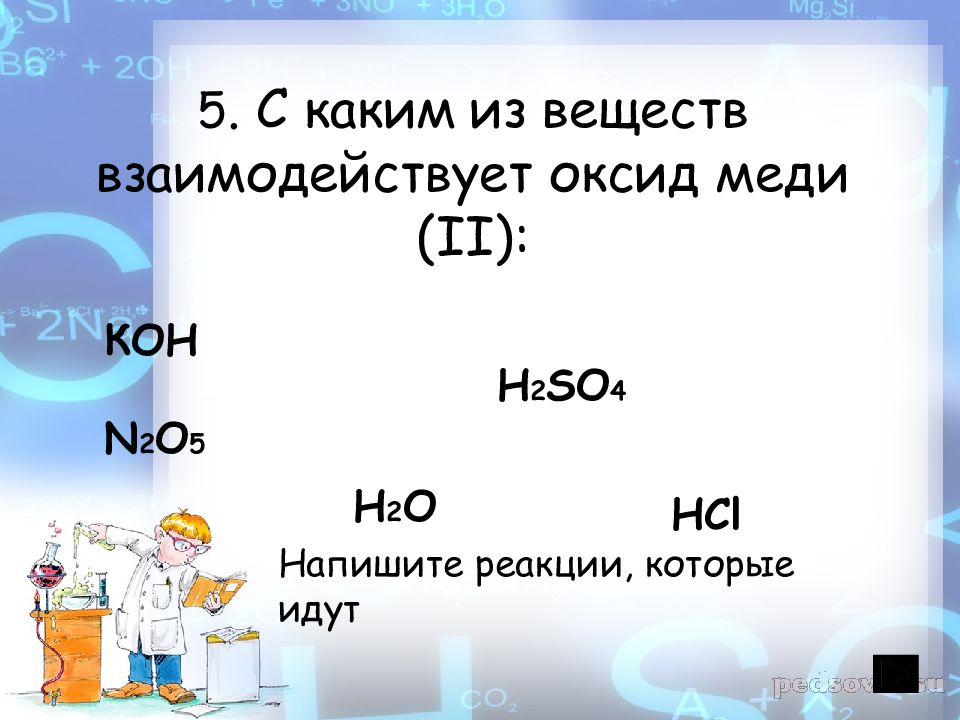
Слайд 26: 5. С каким из веществ взаимодействует оксид меди (II ):
КОН H 2 SO 4 N 2 O 5 H 2 O Напишите реакции, которые идут HCl