Первый слайд презентации: Основные классы неорганических соединений
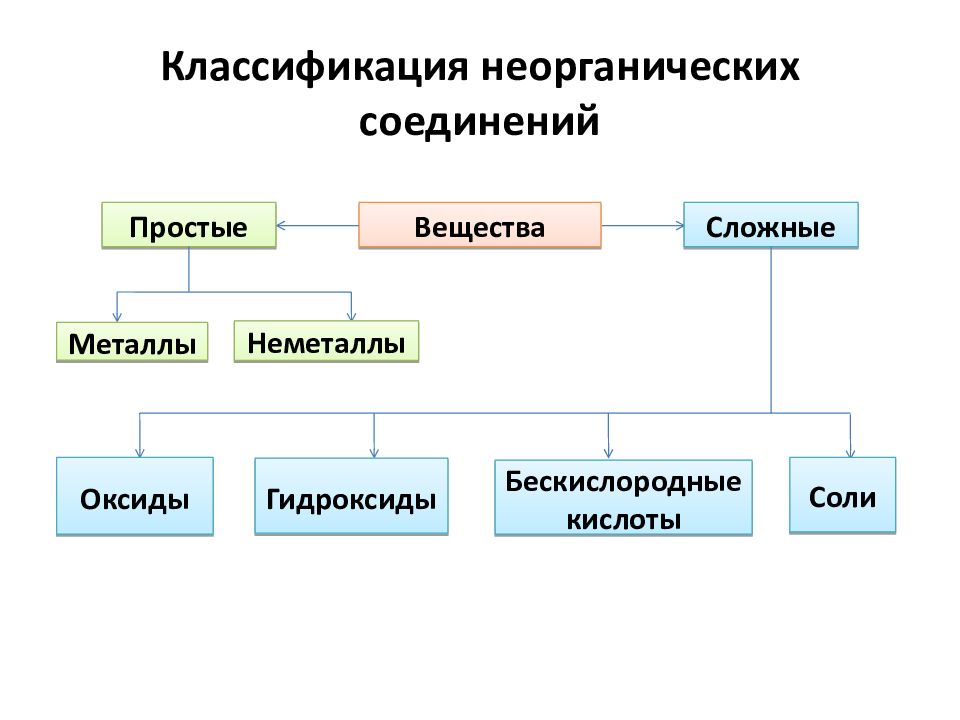
Вещества Сложные Простые Металлы Неметаллы Оксиды Гидроксиды Соли Бескислородные кислоты
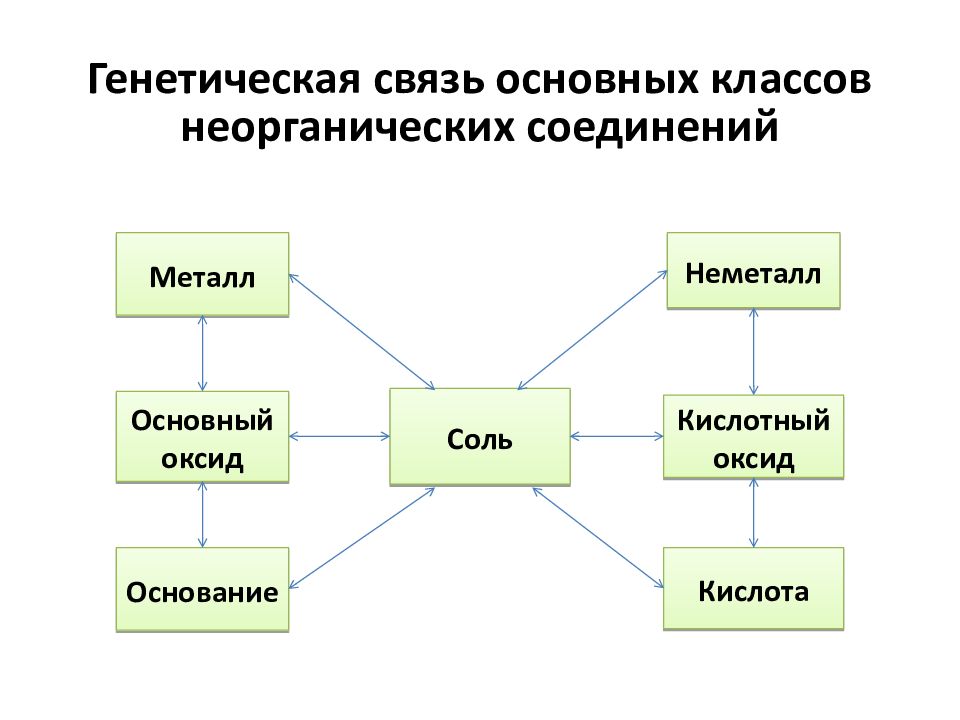
Слайд 3
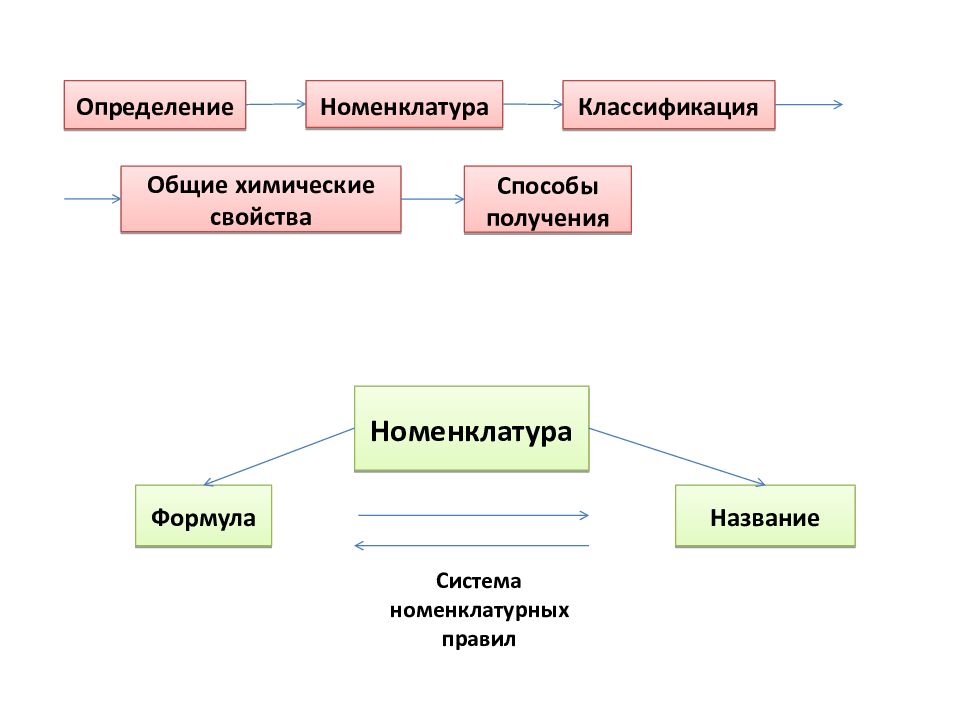
Определение Номенклатура Классификация Общие химические свойства Способы получения Номенклатура Формула Название Система номенклатурных правил
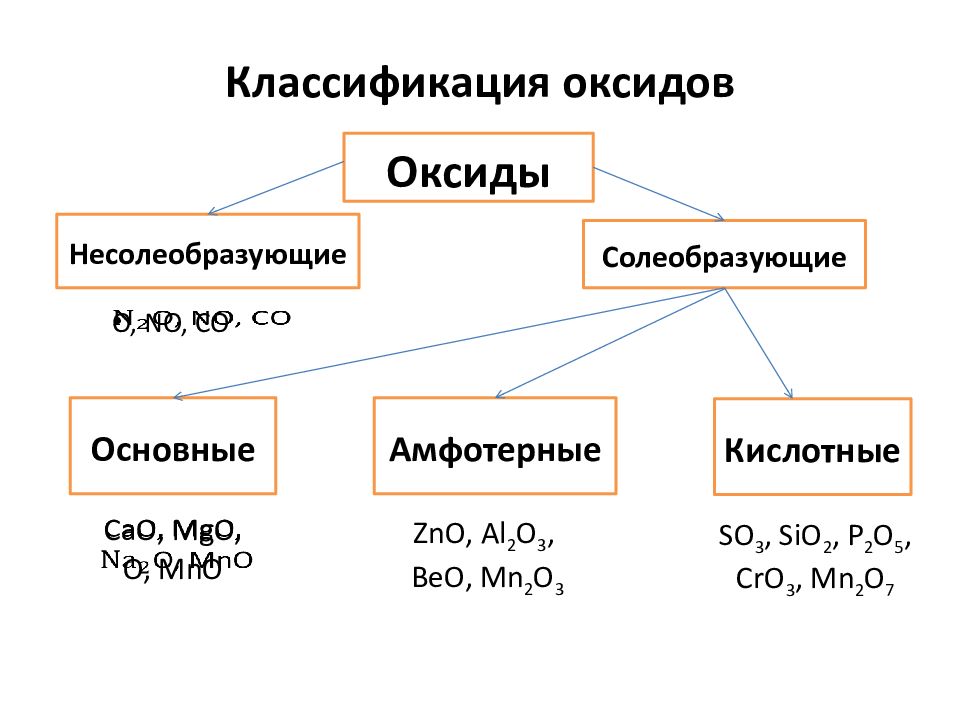
Слайд 4: Классификация оксидов
O, NO, CO Оксиды Несолеобразующие Солеобразующие Кислотные Амфотерные Основные CaO, MgO, O, MnO ZnO, Al 2 O 3, BeO, Mn 2 O 3 SO 3, SiO 2, P 2 O 5, CrO 3, Mn 2 O 7
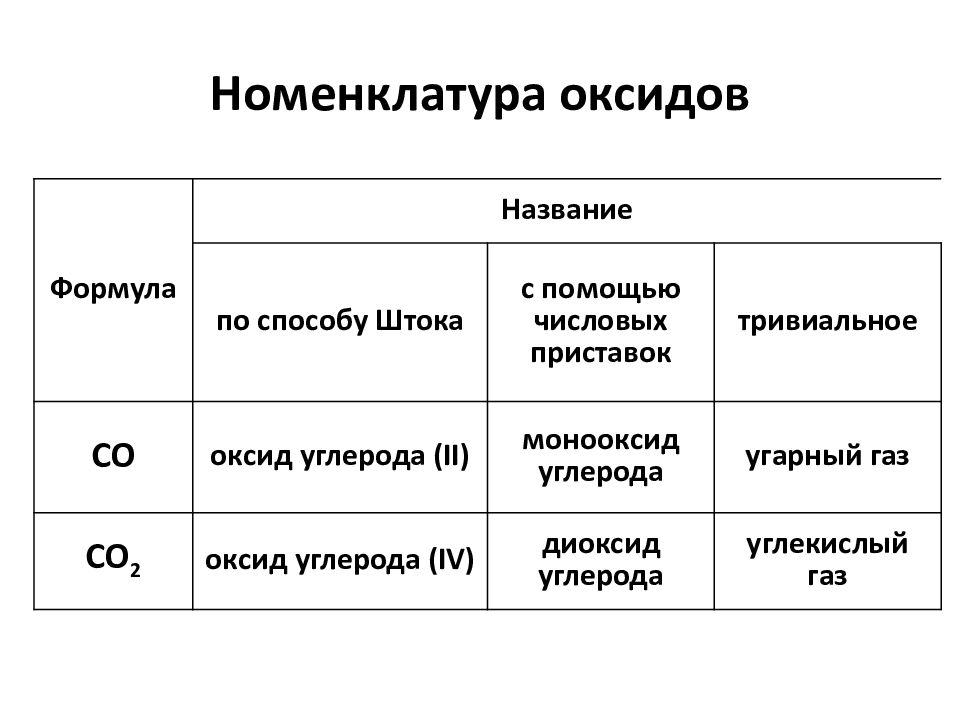
Слайд 5: Номенклатура оксидов
Формула Название по способу Штока с помощью числовых приставок тривиальное СО оксид углерода (II) монооксид углерода угарный газ СО 2 оксид углерода (IV) диоксид углерода углекислый газ
Слайд 6: Химические свойства основных оксидов
Взаимодействие с водой (только оксиды ЩМ и ЩЗМ) Na 2 O + H 2 O = 2NaOH Взаимодействие с кислотами CuO + H 2 SO 4 = CuSO 4 + H 2 O Взаимодействие с кислотными оксидами Li 2 O + SO 2 = Li 2 SO 3 MnO + SiO 2 = MnSiO 3
Взаимодействие с водой (большинство) SO 2 + H 2 O = H 2 SO 3 Взаимодействие со щелочами CrO 3 + 2NaOH = Na 2 CrO 4 + H 2 O Взаимодействие с основными оксидами CO 2 + CaO = CaCO 3
Слайд 8: Химические свойства амфотерных оксидов
Взаимодействие с кислотами ZnO + H 2 SO 4 = ZnSO 4 + H 2 O Взаимодействие со щ елочами а) в растворе ZnO + 2NaOH + H 2 O =Na 2 [Zn(OH) 4 ] б) при сплавлении ZnO + 2NaOH = Na 2 ZnO 2 + H 2 O
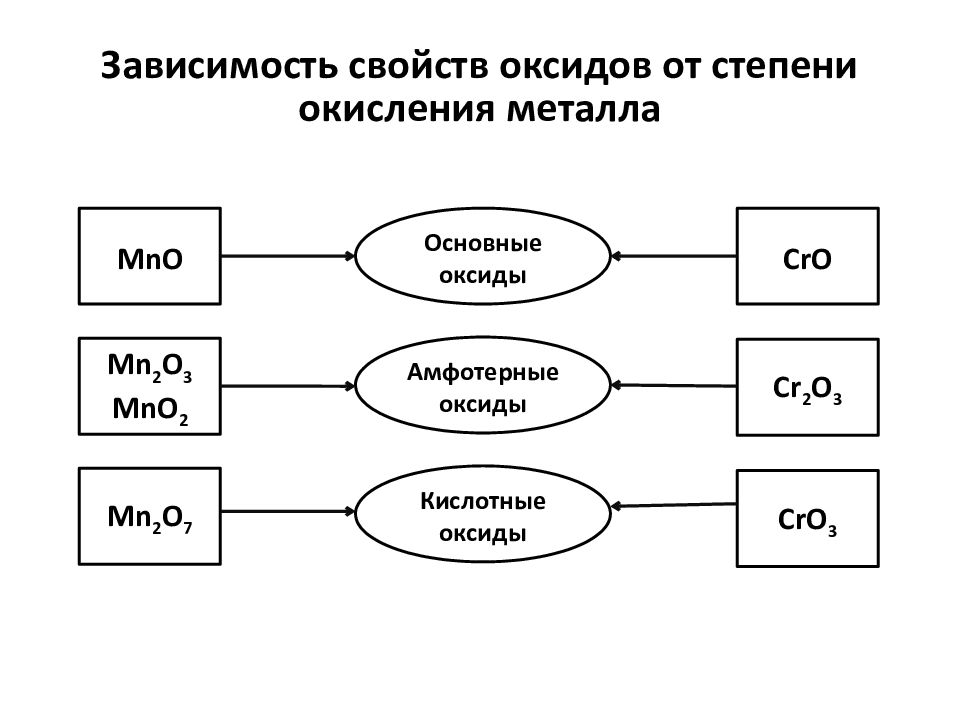
Слайд 9: Зависимость свойств оксидов от степени окисления металла
Mn 2 O 3 MnO 2 Амфотерные оксиды MnO Mn 2 O 7 CrO Cr 2 O 3 CrO 3 Основные оксиды Кислотные оксиды
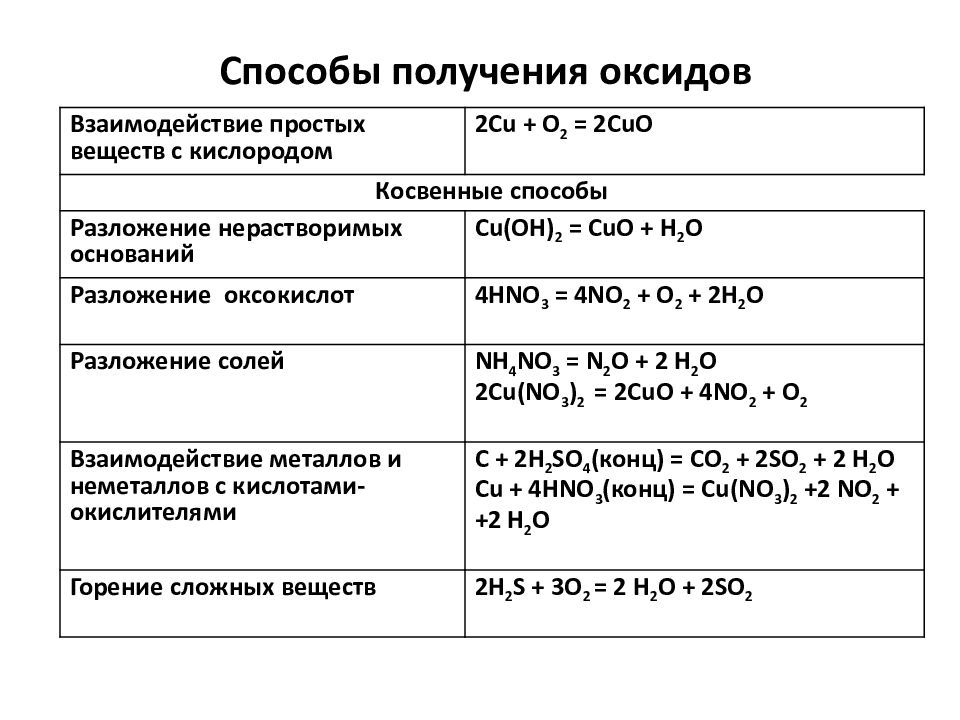
Слайд 10: Способы получения оксидов
Взаимодействие простых веществ с кислородом 2Cu + O 2 = 2CuO Косвенные способы Разложение нерастворимых оснований Cu(OH) 2 = CuO + H 2 O Разложение оксокислот 4HNO 3 = 4NO 2 + O 2 + 2H 2 O Разложение солей NH 4 NO 3 = N 2 O + 2 H 2 O 2Cu(NO 3 ) 2 = 2CuO + 4NO 2 + O 2 Взаимодействие металлов и неметаллов с кислотами-окислителями C + 2H 2 SO 4 ( конц ) = С O 2 + 2SO 2 + 2 H 2 O Cu + 4HNO 3 ( конц ) = С u(NO 3 ) 2 +2 NO 2 + + 2 H 2 O Горение сложных веществ 2H 2 S + 3O 2 = 2 H 2 O + 2SO 2
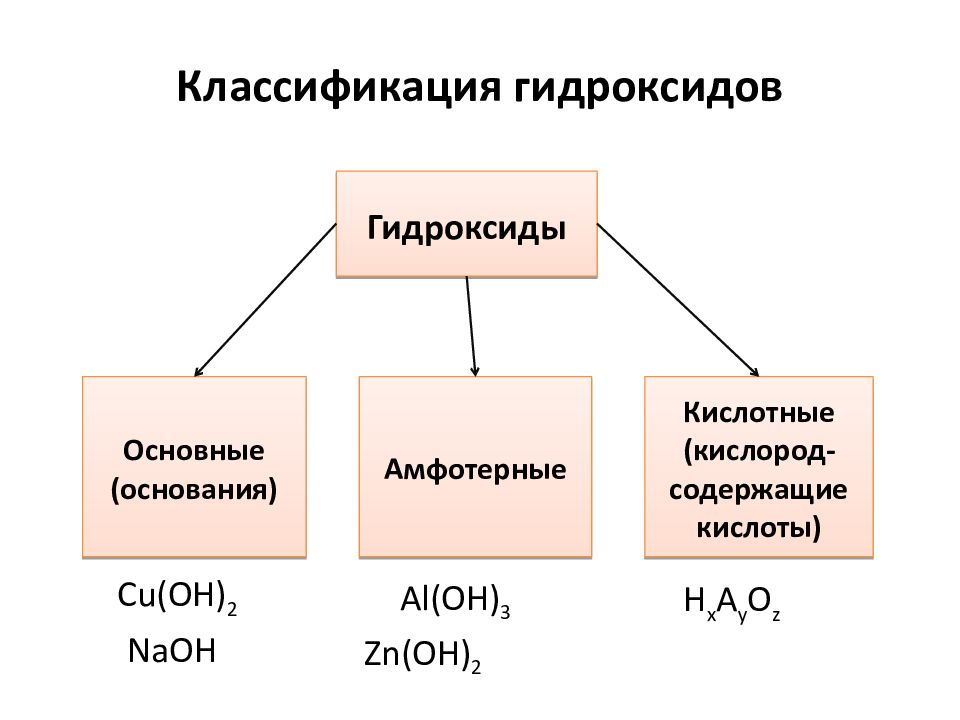
Слайд 11: Классификация гидроксидов
Кислотные ( кислород-содержащие кислоты) Основные (основания) Амфотерные Гидроксиды NaOH Cu(OH) 2 Zn(OH) 2 Al(OH) 3 H x A y O z
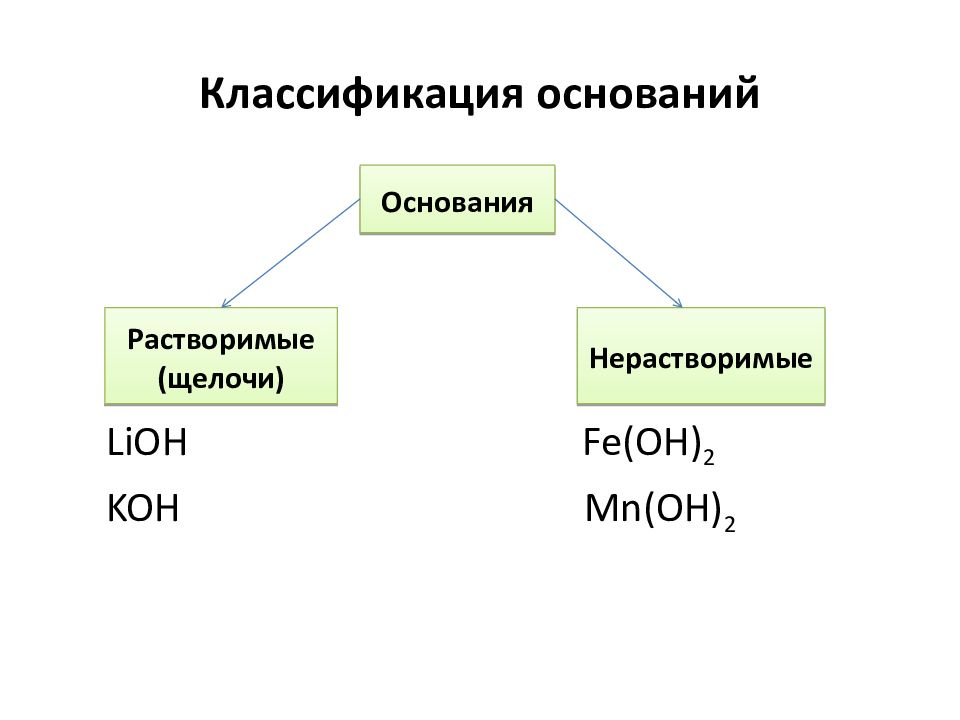
Слайд 12: Классификация оснований
LiOH Fe(OH) 2 KOH Mn (OH) 2 Основания Растворимые (щелочи) Нерастворимые
Слайд 13: Химические свойства оснований
Общие свойства оснований Взаимодействие с кислотами Cu(OH) 2 + 2HCl = CuCl 2 + 2 H 2 O Свойства щелочей Взаимодействие с кислотными оксидами 2NaOH + SO 3 = Na 2 SO 4 + H 2 O Взаимодействие с амфотерными оксидами и гидроксидами 2KOH + ZnO + H 2 O = K 2 [Zn(OH) 4 ] Взаимодействие с солями 2NaOH + CuCl 2 = Cu(OH) 2 !+2NaCl Свойства нерастворимых оснований Разложение при нагревании Cu(OH) 2 = CuO + H 2 O
Слайд 14: Получение оснований
Растворимые основания Взаимодействие ЩМ и ЩЗМ с водой 2Na + 2H 2 O = 2NaOH + H 2 Взаимодействие оксидов ЩМ и ЩЗМ с водой CaO + H 2 O = Ca(OH) 2 Электролиз концентрированных растворов солей 2NaCl +2H 2 O = 2NaOH + Cl 2 + H 2 Нерастворимые основания Реакции ионного обмена MnCl 2 + 2NaOH = Mn (OH) 2 ! + 2NaCl
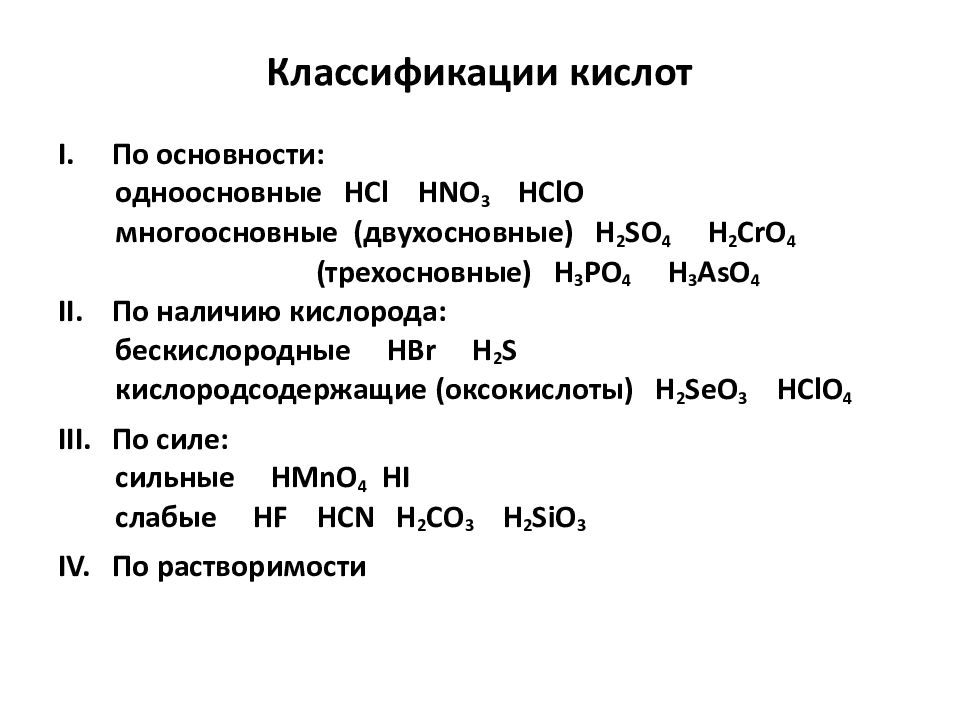
Слайд 15: Классификации кислот
По основности : одноосновные HCl HNO 3 HClO многоосновные (двухосновные) H 2 SO 4 H 2 CrO 4 ( трехосновные ) H 3 Р O 4 H 3 AsO 4 По наличию кислорода: бескислородные HBr H 2 S кислородсодержащие ( оксокислоты ) H 2 SeO 3 HClO 4 По силе: сильные HMnO 4 HI слабые HF HCN H 2 CO 3 H 2 SiO 3 IV. По растворимости
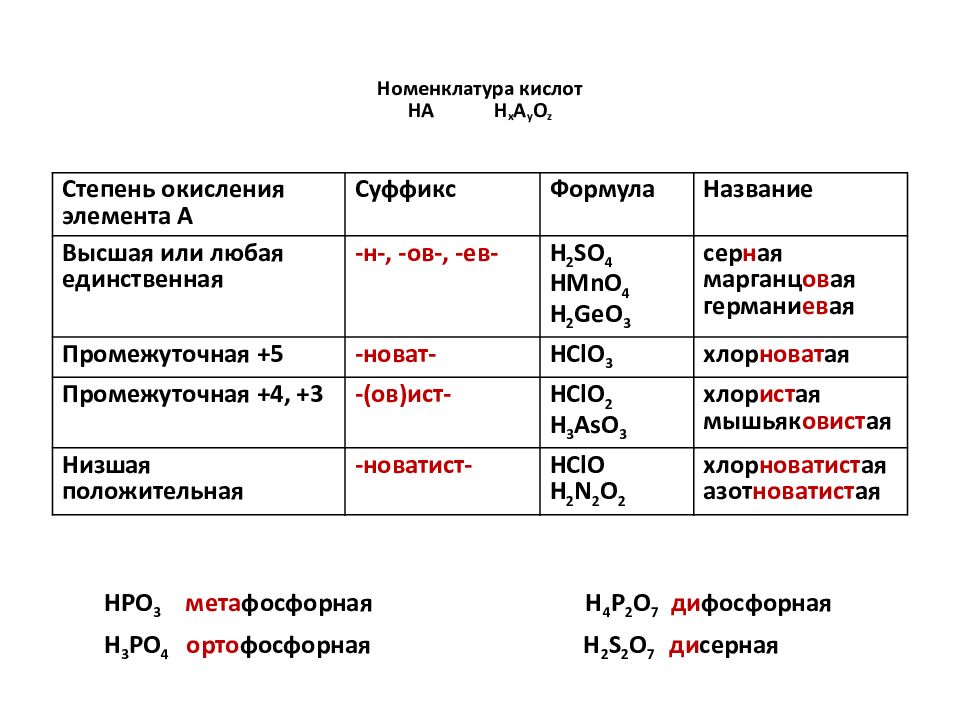
Слайд 16: Номенклатура кислот НА H x A y O z
C тепень окисления элемента А Суффикс Формула Название Высшая или любая единственная - н -, - ов -, -ев- H 2 SO 4 HMnO 4 H 2 GeO 3 сер н ая марганц ов ая германи ев ая Промежуточная +5 - новат - HClO 3 хлор новат ая Промежуточная +4, +3 -( ов ) ист - HClO 2 H 3 AsO 3 хлор ист ая мышьяк овист ая Низшая положительная - новатист - HClO H 2 N 2 O 2 хлор новатист ая азот новатист ая HPO 3 мета фосфорная H 4 P 2 O 7 ди фосфорная H 3 PO 4 орто фосфорная H 2 S 2 O 7 ди серная
Слайд 17: Химические свойства кислот
Взаимодействие с металлами, расположенными до Н в ряду напряжений (кислота проявляет окислительные свойства за счет иона Н + ) Zn + H 2 SO 4 (p-p) = ZnSO 4 + H 2 Взаимодействие с основаниями и амфотерными гидроксидами HCl + KOH = KCl + H 2 O Взаимодействие с основными и амфотерными оксидами H 2 SO 4 + MgO = MgSO 4 + H 2 O Взаимодействие с солями (если образуется более слабая или летучая кислота) 2HCl +Na 2 SiO 3 = H 2 SiO 3 +2 NaCl Взаимодействие с металлами, расположенными после Н в ряду напряжений (кислота проявляет окислительные свойства за счет аниона ) Cu + 2H 2 SO 4 ( конц ) = CuSO 4 + SO 2 + + 2H 2 O
Слайд 18: Способы получения кислот
Взаимодействие кислотных оксидов с водой SO 3 + H 2 O = H 2 SO 4 2NO 2 + H 2 O = HNO 2 + HNO 3 Взаимодействие солей с кислотами (используемая кислота должна быть более сильной и менее летучей, чем получаемая) NaNO 2 + H 2 SO 4 = Na 2 SO 4 + HNO 2 Окисление простых веществ сильными окислителями 3P + 5HNO 3 +2H 2 O = 3H 3 PO 4 +5NO Взаимодействие простых веществ (для бескислородных кислот) H 2 + Cl 2 = 2HCl
Слайд 19: Свойства амфотерных гидроксидов
Взаимодействие с кислотами Al(OH) 3 + 3HCl = AlCl 3 + 3H 2 O Взаимодействие со щелочами Al(OH) 3 + NaOH = Na[Al(OH) 4 ]
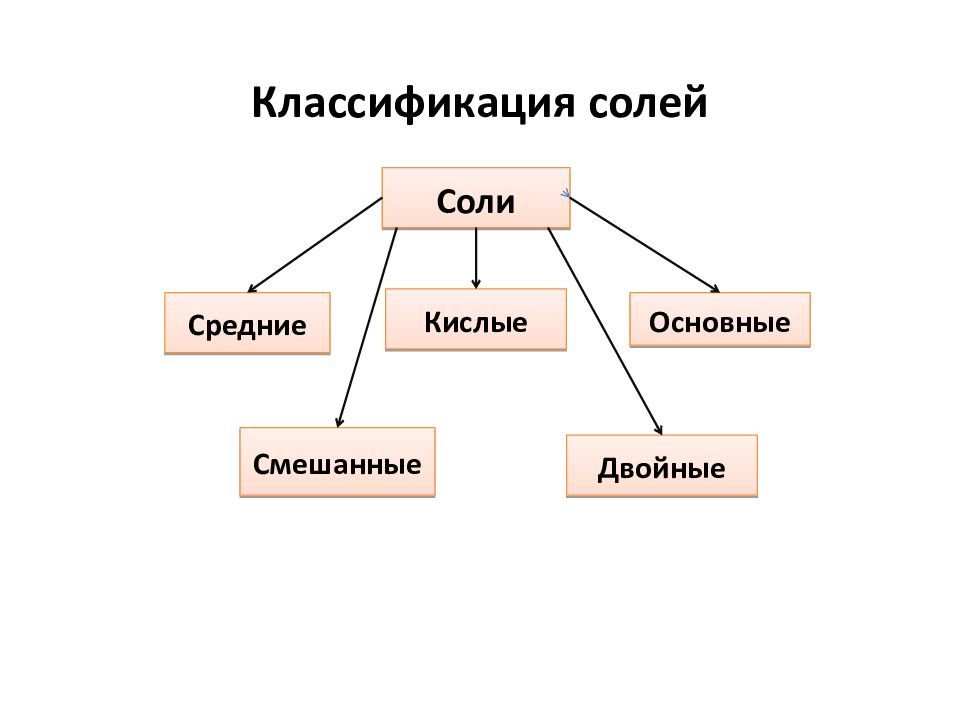
Слайд 21: Средние соли
H 2 SO 4 + 2NaOH = Na 2 SO 4 + 2H 2 O FeSO 4 – сульф ат железа ( II ) NH 4 NO 3 – нитр ат аммония UO 2 SO 4 – сульф ат уранила NONO 3 – нитр ат нитрозила Na 2 S – сульф ид натрия CrCl 3 – хлор ид хрома ( III )
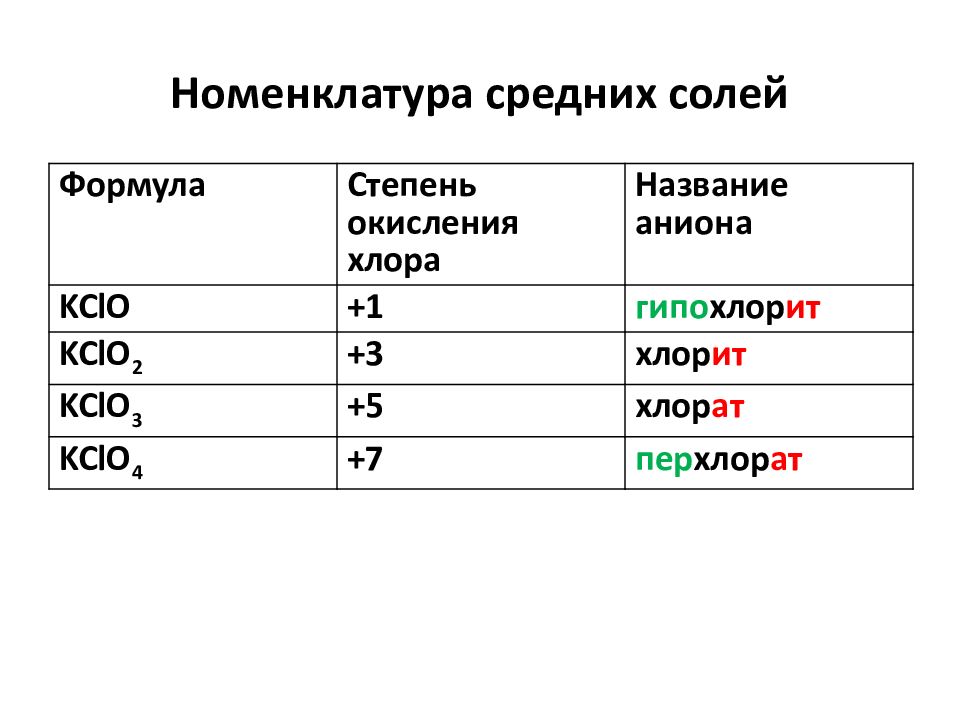
Слайд 22: Номенклатура средних солей
Формула Степень окисления хлора Название аниона KClO +1 гипо хлор ит KClO 2 +3 хлор ит KClO 3 +5 хлор ат KClO 4 +7 пер хлор ат
Слайд 23: Кислые соли
H 2 SO 4 + NaOH = NaHSO 4 + H 2 O Ba ( HSO 3 ) 2 – гидро сульфит бария Ca ( H 2 PO 4 ) 2 – дигидро ортофосфат кальция NaHS – гидро сульфид натрия Основные соли Fe(OH) 3 + 2HCl = ( FeOH )Cl 2 + 2H 2 O ( CuOH ) 2 CO 3 – гидроксо карбонат меди( II ) Al(OH)Cl 2 – гидроксо хлорид алюминия
Слайд 24: Двойные соли
KCr ( SO 4 ) 2 – сульфат хрома( III )-калия NaNH 4 Cl 2 – хлорид аммония-натрия Смешанные соли Ca 5 ( PO 4 ) 3 F – фторид-ортофосфат кальция
Слайд 25: Свойства солей
Взаимодействуют с металлами Zn + Hg(NO 3 ) 2 = Zn(NO 3 ) 2 = Hg Взаимодействуют с о щелочами FeCl 3 + 3KOH = Fe(OH) 3 + 3KCl Взаимодействуют с кислотами CaCO 3 + 2HCl = CaCl 2 + CO 2 + H 2 O Соли взаимодействуют друг с другом CaCl 2 + Na 2 CO 3 = CaCO 3 + 2NaCl Некоторые соли при нагревании разлагаются (NH 4 ) 2 Cr 2 O 7 = N 2 + Cr 2 O 3 + 4H 2 O Некоторые соли подвергаются гидролизу CuCl 2 + H 2 O = CuOHCl + HCl
Слайд 26: Способы получения солей
1. Взаимодействие оснований с кислотами KOH + HNO 3 = KNO 3 + H 2 O 2. Взаимодействие металлов с кислотами Hg + 4HNO 3(K) = Hg(NO 3 ) 2 + 2NO 2 + +2H 2 O 6Hg + 8HNO 3(p) = 3Hg 2 (NO 3 ) 2 + + 2NO + 4H 2 O 3. Взаимодействие основных или амфотерных оксидов с кислотами CaO + 2HCl = CaCl 2 + H 2 O 4. Взаимодействие кислотных оксидов с основаниями 6NaOH + P 2 O 5 = 2Na 3 PO 4 + 3H 2 O
Слайд 27
5. Взаимодействие основных и кислотных оксидов CaO +SiO 2 = CaSiO 3 6. Взаимодействие солей с кислотами MgCO 3 + 2HCl = MgCl 2 + CO 2 + H 2 O 7. Взаимодействие солей со щелочами Fe(NO 3 ) 2 + 3NaOH = 3NaNO 3 + + Fe(OH) 3 8. Взаимодействие двух солей BaCl 2 + Na 2 SO 4 = BaSO 4 + 2NaCl 9. Взаимодействие соли с металлом CuSO 4 + Fe = FeSO 4 + Cu 10. Взаимодействие неметаллов со щелочами Cl 2 + 2KOH = KCl + KClO + H 2 O
Слайд 28
11. Взаимодействие металлов и неметаллов 2Fe + 3Cl 2 =2FeCl 3 12.Термическое разложение некоторых солей 2KNO 3 = 2KNO 2 + O 2