Первый слайд презентации: Лекция № 1 ТЕМА: ОСНОВНЫЕ ПОНЯТИЯ И ЗАКОНЫ ХИМИИ
Преподаватель: к.т.н., доцент Ткаченко Элла Владимировна
Слайд 3: Литература:
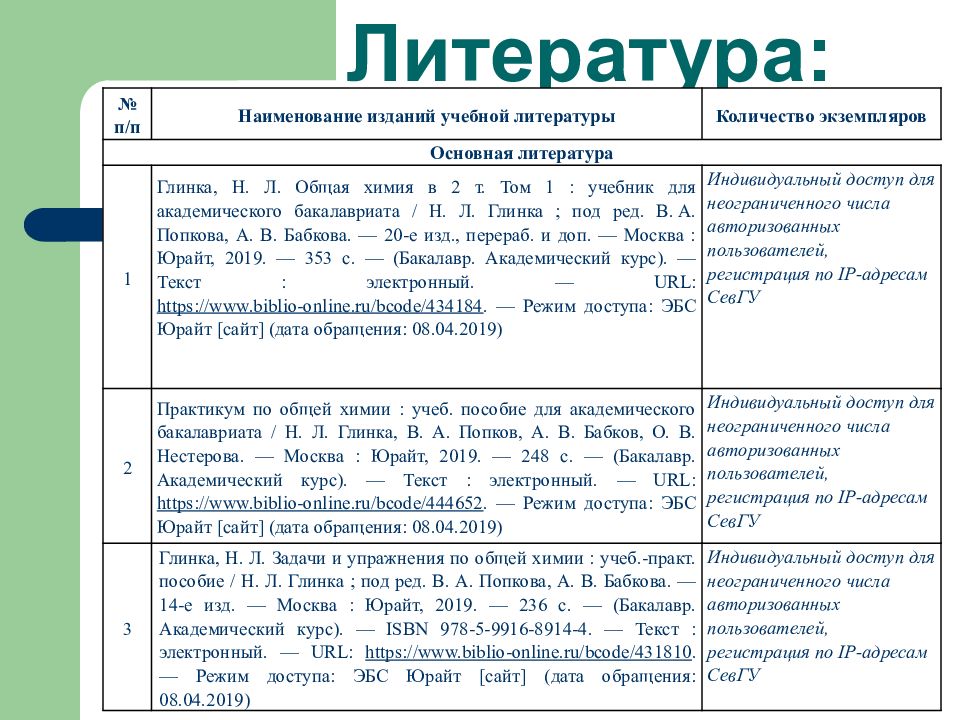
№ п/п Наименование изданий учебной литературы Количество экземпляров Основная литература 1 Глинка, Н. Л. Общая химия в 2 т. Том 1 : учебник для академического бакалавриата / Н. Л. Глинка ; под ред. В. А. Попкова, А. В. Бабкова. — 20-е изд., перераб. и доп. — Москва : Юрайт, 2019. — 353 с. — (Бакалавр. Академический курс). — Текст : электронный. — URL: https://www.biblio-online.ru/bcode/434184. — Режим доступа: ЭБС Юрайт [сайт] (дата обращения: 08.04.2019) Индивидуальный доступ для неограниченного числа авторизованных пользователей, регистрация по IP-адресам СевГУ 2 Практикум по общей химии : учеб. пособие для академического бакалавриата / Н. Л. Глинка, В. А. Попков, А. В. Бабков, О. В. Нестерова. — Москва : Юрайт, 2019. — 248 с. — (Бакалавр. Академический курс). — Текст : электронный. — URL: https://www.biblio-online.ru/bcode/444652. — Режим доступа: ЭБС Юрайт [сайт] (дата обращения: 08.04.2019) Индивидуальный доступ для неограниченного числа авторизованных пользователей, регистрация по IP-адресам СевГУ 3 Глинка, Н. Л. Задачи и упражнения по общей химии : учеб.- практ. пособие / Н. Л. Глинка ; под ред. В. А. Попкова, А. В. Бабкова. — 14-е изд. — Москва : Юрайт, 2019. — 236 с. — (Бакалавр. Академический курс). — ISBN 978-5-9916-8914-4. — Текст : электронный. — URL: https://www.biblio-online.ru/bcode/431810. — Режим доступа: ЭБС Юрайт [сайт] (дата обращения: 08.04.2019) Индивидуальный доступ для неограниченного числа авторизованных пользователей, регистрация по IP-адресам СевГУ
Слайд 4: СТРУКТУРА ДИСЦИПЛИНЫ ХИМИЯ
Всего 3 6 аудиторных часов Л-18, Лз-18, экзамен
Слайд 5: 1. Введение
Химия это наука о веществах и их превращениях. 1. Введение
Слайд 7: Основные понятия
Молекула - наименьшая частица вещества, способная к самостоятельному существованию, обладающая его основными химическими свойствами.
Слайд 8: Основные понятия
A том -это наименьшая частица химического элемента, сохраняющая все его химические свойства. Химический элемент –это вид атомов с одинаковым зарядом ядер, Основные понятия
Слайд 9: Количество вещества ( n)
Количество вещества ( n ) – это величина, содержащая столько структурных единиц (молекул, атомов, ионов и т.д. ), сколько атомов содержит в 0,012 кг углерода –12. n=m / M n=V / Vm n=N / N A
Слайд 12: Относительная атомная масса (Ar)
Относительной атомной массой элемента (А r ) называют отношение абсолютной массы атома к 1/12 части абсолютной массы атома изотопа углерода 12 С.
Слайд 13: Относительная атомная масса (Ar)
А r показывает, во сколько раз масса атома данного элемента больше 1/12 массы атома 12 С.
Слайд 14: Относительная молекулярная масса (М r )
Относительной молекулярной массой (М r ) вещества называется масса его молекулы, выраженная в а.е.м. М r численно равна сумме произведений относительных атомных масс атомов на их число.
Слайд 15: ПРИМЕР:
Относительная молекулярная масса воды будет слагаться из атомных масс двух атомов водорода атомной массы одного атома кислорода Тогда: Mr ( H 2 O )=2 × 1+16=18, выраженная в а.е.м.
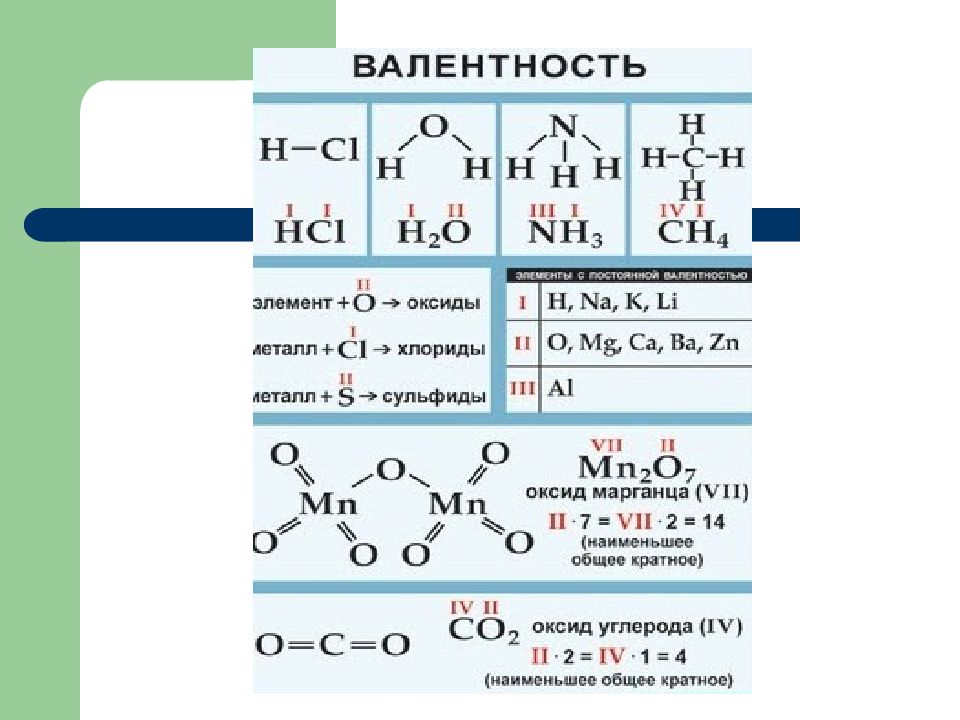
Слайд 16: Валентность
Валентность- способность атомов элемента присоединять определенное количество атомов другого элемента. Валентность обозначается римскими цифрами.
Слайд 18: Эквивалент (Э)
Эквивалент (Э) – это реальная или условная частица вещества, которая в кислотно-основной реакции соединяется или замещается с одним атомом или ионом водорода или в окислительно-восстанови-тельной реакции равноценна одному электрону
Слайд 19: Фактор эквивалентности ( f э)
показывает какая часть молекулы вступает во взаимодействие f э =эквиваленту
Слайд 20: ПРИМЕР:
HBr H 2 O NH 3 1 моль Н 2 моль Н 3 моль Н 1 моль Br 1 моль О 1 моль N Э (Br)=1 Э (O)=1/2 Э (N)=1/3 f э=1 f э= 1/2 f э= 1/3
Слайд 21: ВАЖНО!
Следует различать эквивалентные массы элементов и эквивалентные массы соединений!
Слайд 23
Молярная масса эквивалента ( Мэ) –это масса одного моля эквивалентов. Мэ,г/моль
Слайд 24: Эквивалентные массы
Эквивалентная масса элемента = А× f (атомная масса × фактор эквивалентности) Эквивалентная масса вещества = М× f (молярная масса × фактор эквивалентности)
Слайд 26
Эквивалентная масса сложного бинарного соединения равна сумме эквивалентных масс образующих его элементов
Слайд 28: ПРИМЕР:
0,304г магния вытеснили 0,0252 г водорода. Вычислите эквивалентную массу магния.
Слайд 30: ПРИМЕР
Мышьяк образует два оксида, один содержит 65,2% As, а дру-гой - 75,7% As. Вычислить Мэ мышьяка, его валентность и составить формулы оксидов.
Слайд 32: Решение
A s x О y –100%, тогда ω(О)=100% – ω( As )=100% – 65,2%=34,8% Т.к. дано бинарное соединение, то в формулу закона эквивалентов можно подставлять %, получим:
Слайд 34: Решение
Находим формулу второго оксида: A s x О y –100%, тогда ω(О)=100% – ω( As )=100% – 75,7 %= 2 4, 3 %
Слайд 36: 2.Основные законы химии
1. Закон сохранения массы (Ломоносов М.В. 1756-1759): Масса веществ, вступающих в реакцию, равна массе веществ, образующихся в результате реакции.
Слайд 37: 2. Закон постоянства состава (Пруст 1801-1808):
Каждое химически чистое соединение, независимо от метода его получения, обладает определенным весовым составом
Слайд 39: Закон эквивалентов ( И. В. Рихтера ( 1792-1800 гг.)
Массы реагирующих веществ прямопропорциональны их эквивалентам или их эквивалентным массам
Слайд 40: ГАЗОВЫЕ ЗАКОНЫ
Закон Авогадро (1811) В равных объемах различных газов при одинаковых условиях содержится равное число молекул
Слайд 41
1. Один моль газа при нормальных условиях (н.у.) занимает объем 22,4 л Пример: 1 моль Н 2 имеет объем 22,4л 1 моль O 2 имеет объем 22,4л Нормальные условия: T o =273 K и Р=101,3 кПа или 0 ° С и Р=760 мм. рт. ст. Следствия
Слайд 42: Следствия
2. В одном моле газа содержится 6,02 × 10 23 структурных единиц (атомов, молекул, ионов и т.д.) Пример: 1 моль Н 2 - 2 г - 6,02 × 10 23 молекул - 22,4л 1 моль Cl 2 - 70 г - 6,02 × 10 23 молекул -22,4 л Следствия
Слайд 43
Следует отметить, что состояние газа определяется температурой, давлением, объемом. Принято обозначать при н.у. P 0, V 0, T 0.
Слайд 44
Измерения объемов газов обычно проводят при условиях, отличающихся от нормальных. Для приведения объема газа к нормальным условиям можно пользоваться уравнением Клапейрона.
Слайд 46: Уравнение Менделеева - Клапейрона
Если условия отличаются от нормальных, мольный объём имеет другое значение, для расчетов которого можно воспользоваться уравнением Менделеева Клапейрона :
Слайд 47: Уравнение Менделеева - Клапейрона
Р давление газа, V объем, m масса газа, М молярная масса, Т температура (К), R универсальная газовая постоянная Уравнение Менделеева - Клапейрона
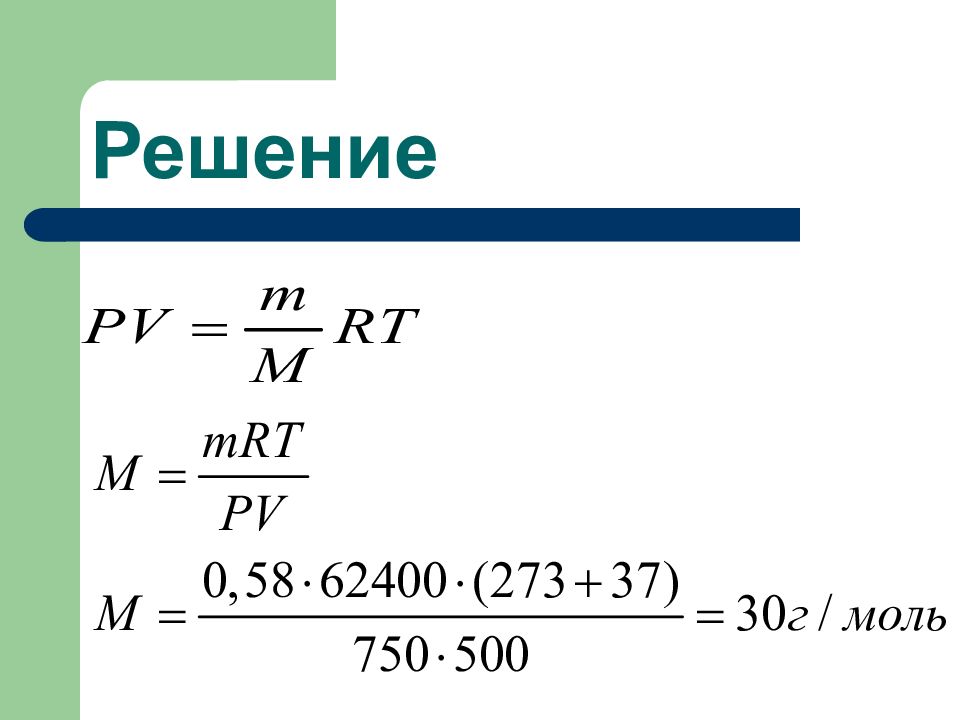
Слайд 48: ПРИМЕР:
Вычислить молярную массу газа если 500мл его при температуре 37 ° С и давлении 750 мм.рт.ст. весят 0,58 г. Решение: Запишем уравнение Менделеева - Клапейрона:
Слайд 50
Массы равных объемов двух газов должны относится друг к другу как их молярные массы
Слайд 51
Отношение массы данного газа к массе того же объема другого газа, взятого при той же температуре и том же давлении, называется относительной плотностью первого газа по второму :
Слайд 52: ПРИМЕР:
масса 1 л СО 2 равна 1,98 г, а масса 1л водорода при тех же условиях 0,09 г. П лотность углекислого газа по водороду составляет :
Слайд 53
Молярная масса газа равна его плотности по отношению к другому газу умноженной на молярную массу второго газа: