Слайд 5: Атом
– химически неделимая электронейтральная микросистема элементарных взаимодействующих частиц, состоящая из положительно заряженного ядра и отрицательно заряженных электронов, движущихся в около ядерном пространстве. Система может быть устойчивой и неустойчивой (радиоактивной) .
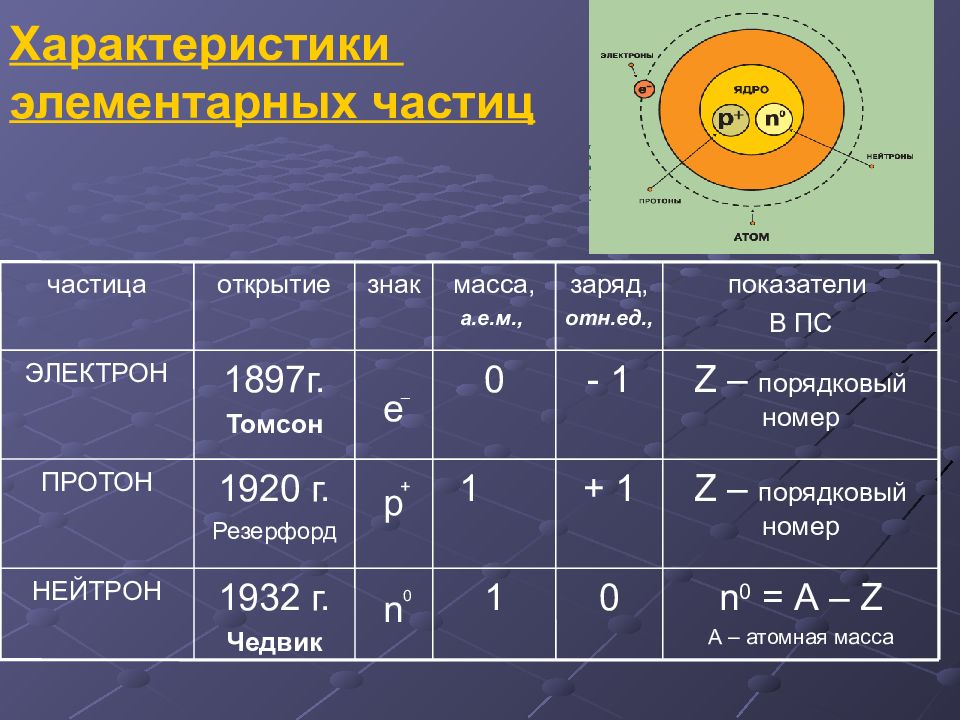
Слайд 6: Характеристики элементарных частиц
n 0 = А – Z А – атомная масса 0 1 0 n 1932 г. Чедвик НЕЙТРОН Z – порядковый номер + 1 1 + р 1920 г. Резерфорд ПРОТОН Z – порядковый номер - 1 0 _ е 1897г. Томсон ЭЛЕКТРОН показатели В ПС заряд, отн.ед., масса, а.е.м., знак открытие частица
Слайд 7
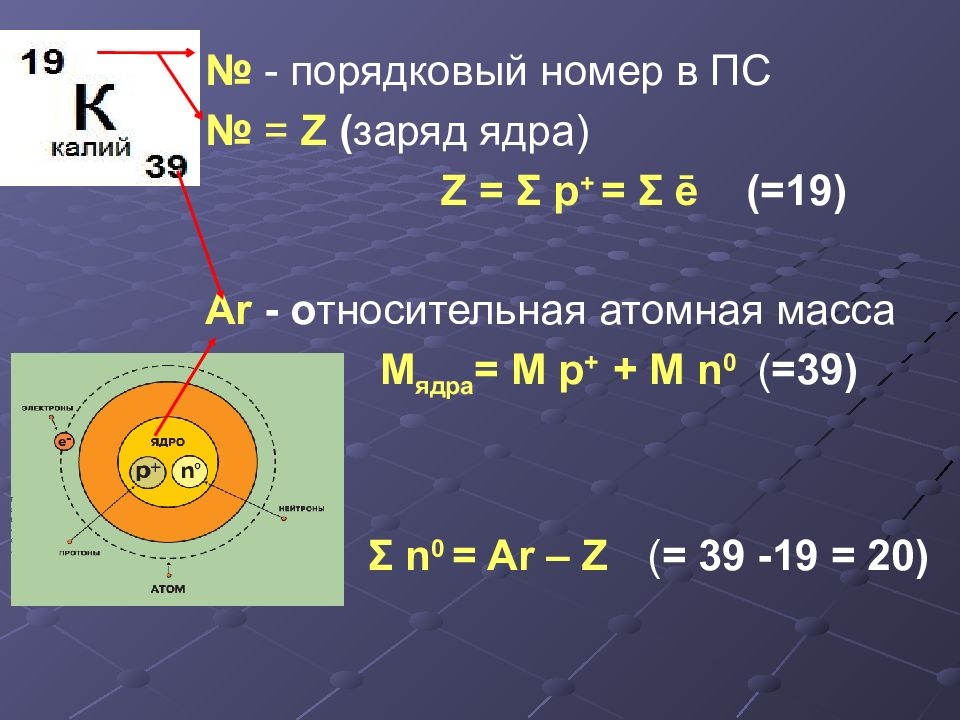
№ - порядковый номер в ПС № = Z ( заряд ядра) Z = Σ р + = Σ ē (=19) Ar - о тносительная атомная масса M ядра = M р + + M n 0 ( =39 ) Σ n 0 = Ar – Z ( = 39 -19 = 20)
Слайд 8
Химический элемент – вид атомов с одинаковым зарядом ядра. Изотопы – атомы одного химического элемента, ядра которых содержат разное число нейтронов.
Слайд 9
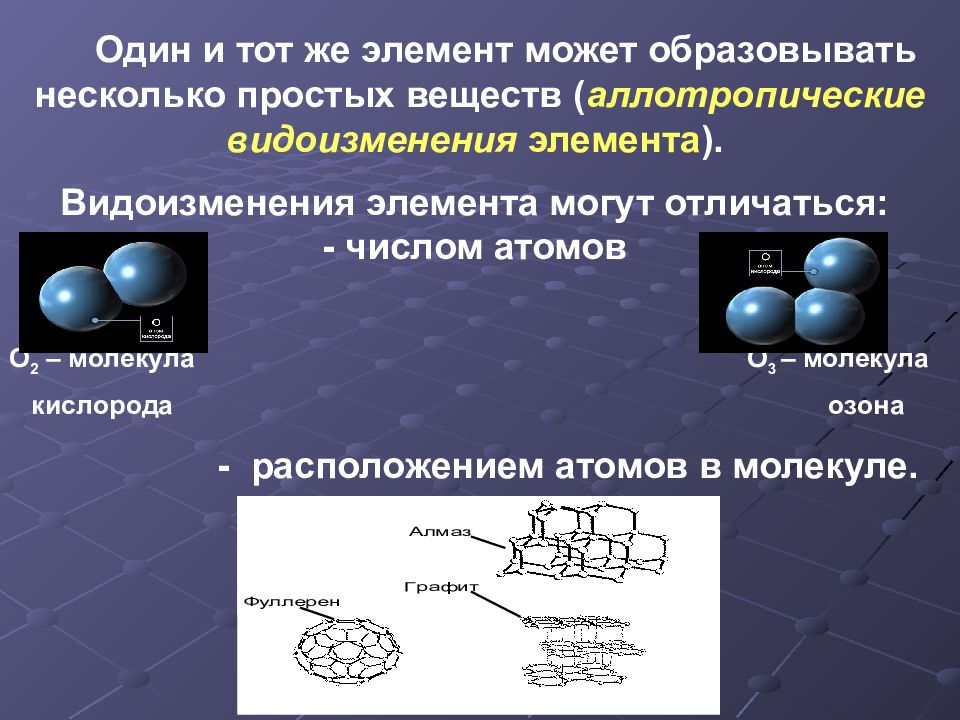
Один и тот же элемент может образовывать несколько простых веществ ( аллотропические видоизменения элемента ). Видоизменения элемента могут отличаться : - числом атомов O 2 – молекула О 3 – молекула кислорода озона - расположением атомов в молекуле. С-углерод
Слайд 10: Количественные характеристики атомов и молекул
1.Относительные атомные и молекулярные массы ( A r, M r ). а)- абсолютные массы атомов очень малы m а (Н)=1,67 ∙10 -27 кг, m а (С)=19,93 ∙10 -27 кг б)- введена условная атомная единица массы 1 а.е.м. = в) А r (элемента) = m а / 1 а.е.м - относитель. атомная масса А r (Н) = 1,67∙ 10 -27 1,667∙ 10 -27 = 1,008
Слайд 12: 2. Количество вещества моль [n] - это число структурных единиц (атомов, ионов, радикалов, молекул) в системе
1. Авогадро рассчитал, что в 12 г 12 С содержится 6,02 · 10 ²³ атомов. Количество вещества, которое содержит столько же структурных единиц, сколько и 12 г изотопа 12 С, (1811 г.) обозначается как 1 моль 1 моль = 6,02 ∙ 10 23 частиц ( N A – число Авогадро ) 2. Масса одного моля вещества, выраженная в граммах называется молярная масса вещества 1 моль = М (г/моль)
Слайд 13
3. При нормальных условиях (Т=0 0 C; Р=101325 Па) один моль любого газа занимает один и тот же молярный объем V m = 22, 4 л / моль 1моль = 22,4 л 4. При иных условиях используется уравнение Клапейрона-Менделеева PV = nRT P -давление газа, Па, V- объем газа, м 3 T- температура, К R – молярная газ. постоянная (8,314 Па ∙м 3 / моль∙К ) Таким образом, моль вещества можно найти разными способами : n = m / M = N / N A = V / V m = PV / RT
Слайд 15: Объединённый газовый закон Бойля – Мариотта и Гей-Люссака
где р 0 = 101,3 кПа, V 0 - объём газа при н.у. T 0 = 273 К (0 0 С) 0 0 0 T V p T рV =
Слайд 16
Задачи 1. Определить количество вещества (моль), содержащегося в 34 граммах, 44,8 л и 12,04∙10 23 молекулах аммиака ( NH 3 – газ) при н.у. 3. Вычислить массу 2 л водорода при Т=15 0 С и Р=100,7 кПа. 2. Вычислить массу 2 л водорода при н.у.
Слайд 17: Задача. Масса ортофосфорной кислоты равна 49 г. Определить : – количество кислоты (моль) – массу атомов водорода в ней (г)
Слайд 19
М. В. Ломоносов (1748 г.) - масса веществ, вступивших в реакцию, равна массе веществ, получившихся в результате реакции. 2Н 2 + O 2 = 2Н 2 O Фундаментальный закон сохранения массы (материальный баланс по атомам элементов, стехиометрические коэффициенты) Атомы элементов при химических реакциях сохраняются, не возникают из ничего, так же как и не исчезают в никуда.
Слайд 20: Фундаментальный закон сохранения энергии
1841, Г.И.Гесс Энергия изолированной системы есть величина постоянная, возможнен лишь переход одного вида энергии в другой Н 2 + ½ О 2 = Н 2 О + 241 кДж энергетический баланс (термохимическое уравнение реакции).
Слайд 21: Фундаментальный закон сохранения заряда
Сумма зарядов реагентов равна сумме зарядов продуктов электронный баланс (окислительно – восстановительные реакции).
Слайд 22
Свойства химических элементов, а также формы и свойства их соединений находятся в периодической зависимости от величины заряда ядер их атомов. Фундаментальный периодический закон 1869 г
Слайд 23
Валентность- число связей, которое может образовать атом данного элемента с атомами других элементов : принято, что валентность H (I), О( II) максим. валентность элементов = № группы -миним. валентность элементов = 8 - № группы 1803 г. Стехиометрические законы Атомы элементов соединяются в химические соединения только в определенных массовых отношениях (как простые целые числа), которые задаются их валентностью.
Слайд 24
- всякое чистое вещество имеет постоянный и неизменный качественный и количественный состав, независимо от способа получения и места нахождения : Cu(OH) 2 = H 2 O + CuO 2Н 2 + O 2 = 2 Н 2 O Са(ОН) 2 + H 2 SO 4 = 2 Н 2 O + CaSO 4 Закон постоянства состава Молекула воды всегда состоит из двух атомов водорода и одного атома кислорода. Пруст (1806 г)
Слайд 25: 3. Закон объемных отношений для газов
(Гей-Люссак, 1808 г.) - о бъемы газов, нацело реагирующих друг с другом, относятся между собой и к объемам образующихся газов, как небольшие целые числа 2Н 2 + О 2 = 2Н 2 О Объясняется законом Авогадро : в равных объемах различных газов при одинаковых условиях (Т и Р) содержится одно и то же число молекул.
Слайд 26
Из законов Гей-Люссака и Авогадро следует : масса одного газа во столько раз больше другого, во сколько раз больше его молярная масса М в-ва =М газа ∙ D по газу М в-ва = ρ ∙ V m ρ г / л – плотность в-ва в газообразном состоянии
Слайд 27: 4. Закон эквивалентов
А +В = С + D m A : m B = M эк.А : M эк.В Эквивалентная масса (молярная масса эквивалента) – это масса 1 моль эквивалентов (г/моль-экв) Рихтер, Волластон 1804 М эк. = М · f
Слайд 28
Эквивалент – это реальная или условная частица (часть частицы), которая взаимодействует с 1 атомом водорода или 1 электроном. Фактор эквивалентности ( f) - доля частицы, составляющая эквивалент f = 1/ ω ·n. ω – степень окисления частицы n – число таких частиц М эк. = М ·f
Слайд 29: Расчет эквивалентных масс элемента
Задача. Определить, в каком из веществ фактор эквивалентности элемента марганца ( Mn ) равен 1 / 4 KMnO 4 K 2 MnO 4 MnO 2 MnSO 4
Слайд 30: Расчет эквивалентных масс вещества
Задача. Рассчитать молярные эквивалентные массы для веществ H 2 H 2 O 2 NH 3 CH 4
Слайд 33: Расчет эквивалентных масс вещества в окислительно-восстановительных реакциях
Определить эквивалентную массу перманганата калия в следующих реакциях : KMnO 4 MnSO 4 Mn + 7 + 5e = Mn +2 М эк (KMnO 4 ) = 158/5 = 31,6 г / моль-экв KMnO 4 K 2 MnO 4 Mn +7 + 1e = Mn +6 М эк (KMnO 4 ) = 158/1 = 158 г / моль-экв





![Лекция 3
Атомно-молекулярное учение 2. Количество вещества моль [n] - это число структурных единиц (атомов, ионов, радикалов, молекул) в системе.](https://s1.showslide.ru/s_slide/eada8e6179c9aa2f08da71284a3709de/f4484536-c4cd-4cd6-b8cc-d2711db37e8c.jpeg)